亚麻(Linum usitatissimum L.)属于亚麻科亚麻属,一年生或多年生草本植物,一般分为油用亚麻和纤维亚麻2种。亚麻籽中含有35%~45%的油脂,主要含油酸、亚油酸、亚麻酸的不饱和脂肪酸和硬脂酸、棕榈酸的饱和脂肪酸,其中不饱和脂肪酸含量占85%以上[1]。亚麻除了较高的不饱和脂肪酸以外含有木酚素、亚麻胶、膳食纤维等多种有效营养成分,具有止痛、消肿、抗癌症、解热毒等药用价值[2]。木酚素(Lignan)是植物代谢合成的一种雌激素,具有抗肿瘤、预防心血管疾病、糖尿病等功效,王荣等[3]研究表明,亚麻籽木酚素抑制大鼠高血脂症状。党学良等[4]用亚麻籽木酚素喂糖尿病小鼠,结果表明能提高小鼠的学习记忆。Pan等[5]发现亚麻木酚素对前列腺患者康复有作用。目前,亚麻、谷类、水果、蔬菜中均发现了木酚素,其中亚麻籽木酚素含量最高,约为其他植物含量的75~800倍[6]。因此,亚麻木酚素含量的遗传改良研究对亚麻籽功能性食品开发和药用研究具有重要意义。
亚麻木酚素含量与亚麻品种、种植方式、气候等因素有关,同类型亚麻不同环境下木酚素含量有显著差异。因此,亚麻木酚素含量与许多重要农艺性状一样属于多基因控制的数量性状,传统育种很难短期选育出高木酚素含量的亚麻新品种。基于分子标记的基因QTL(Quantitative trait loci)定位的标记辅助选择(MAS),实现了直接对目标性状基因型的选择,大幅度提高了育种的选择效率,缩短了育种年限[7]。因此,表型和分子标记关联分析研究对亚麻木酚素含量的遗传改良具有重要意义。本研究以220份亚麻种质材料为研究对象,采用高效液相色谱法检测亚麻籽木酚素含量,与SSR标记基因型数据进行关联分析,获得亚麻木酚素含量显著关联位点,为亚麻木酚素含量遗传改良和开发利用提供科学依据。
1 材料和方法
1.1 供试材料
来自11个国家的220份亚麻核心资源材料,包括国外资源材料105份(加拿大13份、美国17份、法国9份、阿根廷8份、荷兰15份、俄罗斯5份、匈牙利17份、伊朗6份、巴基斯坦10份、波兰5份),国内资源材料116份(宁夏12个、新疆8个、内蒙古33个、河北15个、甘肃34个、山西14个)。
1.2 田间试验及采样
2018年种植于呼和浩特市和乌兰察布市集宁区。物候条件、播种和收获时间见表1。田间播种采用随机区组设计,重复3次,3行种植,每行种400粒种子,行长2.0 m,行距20.0 cm。常规的田间管理方法进行管理。同时,在生育期内对2个地区的气温、降水量和日照时数等气象因子做记录。出苗后,取0.10 g新鲜嫩叶子-80 ℃冰箱保存备用。种子成熟后用样品研磨机磨碎,称取1.00 g,密封备用。
表1 2个种植区的地理位置、气候条件
Tab.1 Geographical location and climatic conditions of the two growing areas
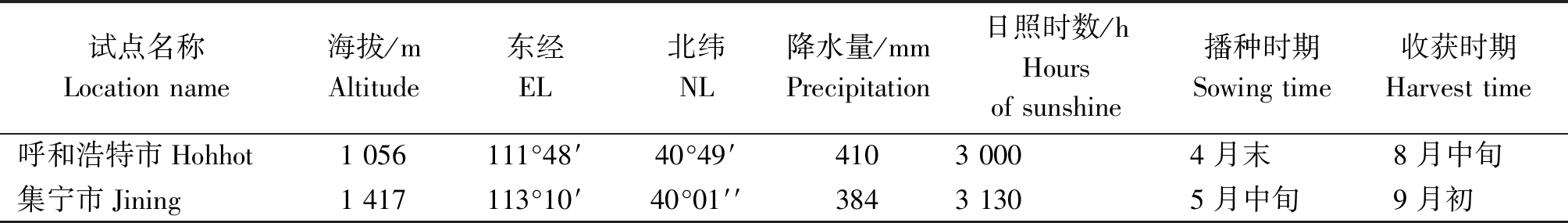
试点名称Locationname海拔/mAltitude东经EL北纬NL降水量/mmPrecipitation日照时数/hHoursofsunshine播种时期Sowingtime收获时期Harvesttime呼和浩特市Hohhot1056111°48′40°49′41030004月末8月中旬集宁市Jining1417113°10′40°01′′38431305月中旬9月初
1.3 亚麻木酚素含量测定
取出1.00 g的亚麻粉,用无水乙醚浸泡16 h,室温放置6 h,烘干1 h,冷却至室温,倒入50 mL的离心管,加入30 mL的60%的乙醇,在50 ℃条件振荡裂解40 min,以8 000 r/min离心5 min,取上清液加入5 mL 3.6 mol/L氢氧化钠溶液,在40 ℃条件振荡裂解20 min,用6 mol/L盐酸溶液调pH值为5,移入茄形瓶中,49 ℃真空浓缩至干,用40%的甲醇溶液溶解定容至100 mL,取出20 mL,过滤上机分析。色谱柱:C18柱,250.0 mm×4.6 mm,柱填料粒径5 μm。检测波长为290 nm,柱箱温度为35 ℃,进样量为20 μL。亚麻木酚素标准品购自上海源叶生物科技有限公司。用SPSS 19.0软件统计分析木酚素含量表型数据[8]。
1.4 亚麻基因组DNA提取及SSR基因型检测
取出-80 ℃保存的样品,用已备冷冻玻璃棒破碎,参照Stewart等[9]提出的CTAB法提取基因组DNA,用琼脂糖凝胶和核酸测定仪检测DNA的纯度和浓度。NCBI下载亚麻全基因组序列信息(https://www.ncbi.nlm.nih.gov/assembly/GCA_000224295.2)和亚麻EST-SSR信息,利用MISA软件和SSR IT软件[10]检测亚麻SSR引物信息。共得到81 369对SSR引物,利用Primer Primier 5.0软件默认参数(长度120~300 bp,Tm值57~65 ℃,引物长度20~25 bp)进行引物设计,在设计结果中选择150对SSR引物(金斯瑞生物科技有限公司合成),其中筛选出30对条带清晰,重复性好的引物(表2),对供试材料进行基因型检测。PCR反应体系为25.0 μL(Taq Master Mix:12.5 μL、10 μmol/L引物共1.0 μL、40 ng DNA模板3.0 μL、超纯水8.5 μL),扩增程序为:94 ℃ 5 min;94 ℃ 1 min,56 ℃ 1 min,72 ℃ 1 min,35个循环;72 ℃ 10 min,4 ℃保存[11]。产物用6%非变性聚丙烯酰胺凝胶电泳分离,恒功率70 W电泳1.5 h,采用银染法显色[12]。通过DNA Marker1500,统计DNA差异条带,标记为“0”或“1”。
1.5 关联分析
用TASSEL软件[13]的广义线性模型(GLM)混合线性模型(MLM)对表型数据和基因型数据进行关联分析。将30对引物所获得的203个多态性位点与220份亚麻种质的木酚素含量数据合并,得到各位点的显著性水平及其对表型变异的解释率。本研究选择显著性水平为P<0.01。
表2 SSR引物名称与序列信息
Tab.2 SSR primer name and sequence information

引物名称Primername序列(5′-3′)Sequence引物名称Primername序列(5′-3′)SequenceLu_b4TGGAAGTCAACGAGATCGAALu_400TCTTGTACATTGCGGCACTCACAGCAGCCTCCGTGTTTATGCACCAGATGAGGAAGAGGALu_b13CGAGGATGACAATGATGACGLu_422GAATGGCTCCTCGAAAGATGCAGCAGCAGCATCAGGTAAAATTAGACGGGGAGCTTGAGGLu_a37CACAGCACAGACACAGACCALu_462GTTAATCGCCCCTGAACTGAGCTTCCGTAATCCTCTACCTTTGCAGTTACAACAGCAGCALu_a69CTAAACCACACCCCCATCACLu_465AATGAGCACAACAACAGCAAGAAAGTGGGGAAATTGGGCTAAGCAGCTCTGGACTTGAGGALu_83bCCCTCATTTTTCTCCTTCCALu_511CAAGACTTGTAGGGCGGAACCAGGCGTTACAGTTTCCCATACGTCGGCCTATGAGAAGAACLu_125aGCCTTTGGAGGGCTTAACTTLu_554CATTGACCTCCCATTTCACCACAATCCCAACATTCCCAAATCAAGGAAGGCTCGTTGTTCLu_146AACCTGAACCAGACGAGCATLu_598GGCCAAGGATATAGCACGAAAGGTGGATCCAGCAAGCTAATTGGACCTTAAGCCCAGATGLu_176TCCATCCTCTGCATTTGTGALu_661TAGAGGCCAGCTAGCAGCAAAGACGAGTGCCCATTCCTAAAAAGCTTCCCTTTGGTGGTLu_203CCTTTTCACGCAGAGCTACCLu_747AAGACAACAACCTGGGGAAAGCTTCCGTAATCCTCTTCCAGATTCAGCAGCCGAGAGTGLu_263GCCGAAAGTTGAAGCATAGGLu_765bCGGCTGAGGATTACTTGTCGTGTTGCTTGTTGGCAAACTGTAAACTCCACTTCCCCCAACLu_266ACGACACCGGATTTATCTGCLu_771CCTCATTCCGCTCAGCAAACGTGTCCTCCACATGCTCTCGAAAATGGGGAAGATGATGLu_273CGATGATCACTGGACGGATALu_785ATACTCCTCCGACGCTGATGCATAGCTTCAAAGGCAGCACAACCTCGAAACGAATGATGCLu_291GGAAATTCCAAGTTCCCAGTLu_787CGAGGCATCATATTTTCTCTTGAGTTTCGCTATTCCGTCTGCATCAGCAATCAATCGCATCALu_316TCCTCGGAAGAAGAAGACGALu_840AAGACCACCACAAGGGACAGGAGAGGAATCATGGCGGATATGAACCATAGCGATCATCACALu_330TCTTGTACATTGCGGCACTCLu_849ATTCCTTTTTGAGGGCGAGTGCACCAGATGAGGAAGAGGAACAGCTGGAACTGGAGAGGA
2 结果与分析
2.1 亚麻木酚素含量的统计分析
用高效液相色谱法对亚麻种质木酚素含量进行2 a 2点的重复检测,获得了精准亚麻木酚素含量的表型数据(表3)。统计结果表明,220份亚麻种质木酚素含量均值7.37 mg/g,变幅为3.24~11.76 mg/g,变异系数为20.34%,广义遗传率61.03%。2017年,呼和浩特地区木酚素含量较高的品种分别为PAKISTAN161(12.15 mg/g)和RuSSIA5(13.25 mg/g),2018年,集宁地区木酚素含量较高的品种分别为CFRESBR94(11.81 mg/g)和RuSSIA5(13.33 mg/g),其中RuSSIA5品种在集宁地区2 a的木酚素含量均最高,表明此品种木酚素含量较高且稳定。以上3个品种均是国外引进品种。国内品种(系)中木酚素含量较高的品种是坝亚11号(11.79 mg/g)、坝亚6号(11.11 mg/g)、同亚9号(11.41 mg/g)、乌41号(9.63 mg/g)等4个品种。对2 a 2个环境条件下检测的亚麻籽木酚素含量进行正态分布检验,结果表明,均有正态分布趋势(图1),表明亚麻木酚素含量是受环境影响的数量性状。
表3 亚麻木酚素含量的统计分析
Tab.3 Statistical analysis of linseed lignans content
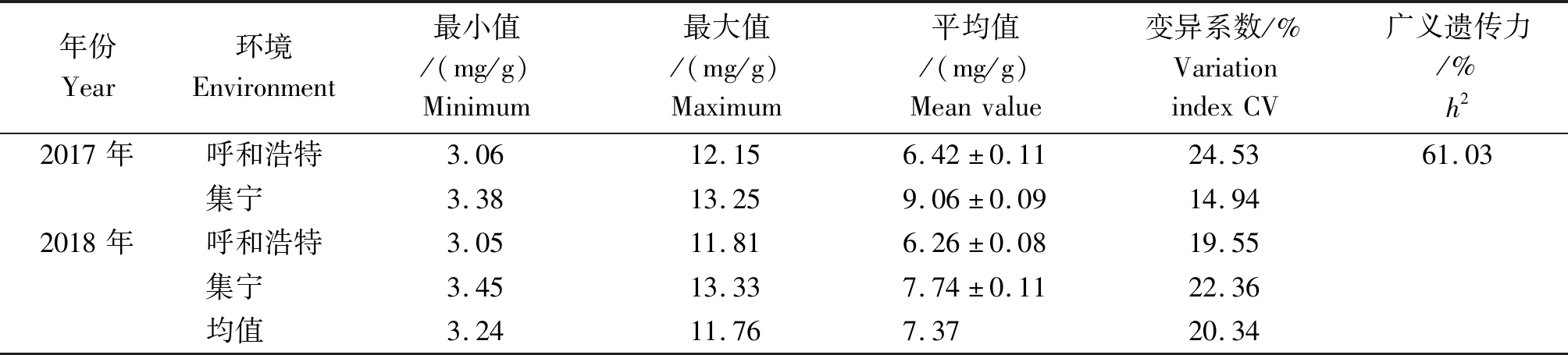
年份Year环境Environment最小值/(mg/g)Minimum最大值/(mg/g)Maximum平均值/(mg/g)Meanvalue变异系数/%VariationindexCV广义遗传力/%h22017年呼和浩特3.0612.156.42±0.1124.5361.03集宁3.3813.259.06±0.0914.942018年呼和浩特3.0511.816.26±0.0819.55集宁3.4513.337.74±0.1122.36均值3.2411.767.3720.34
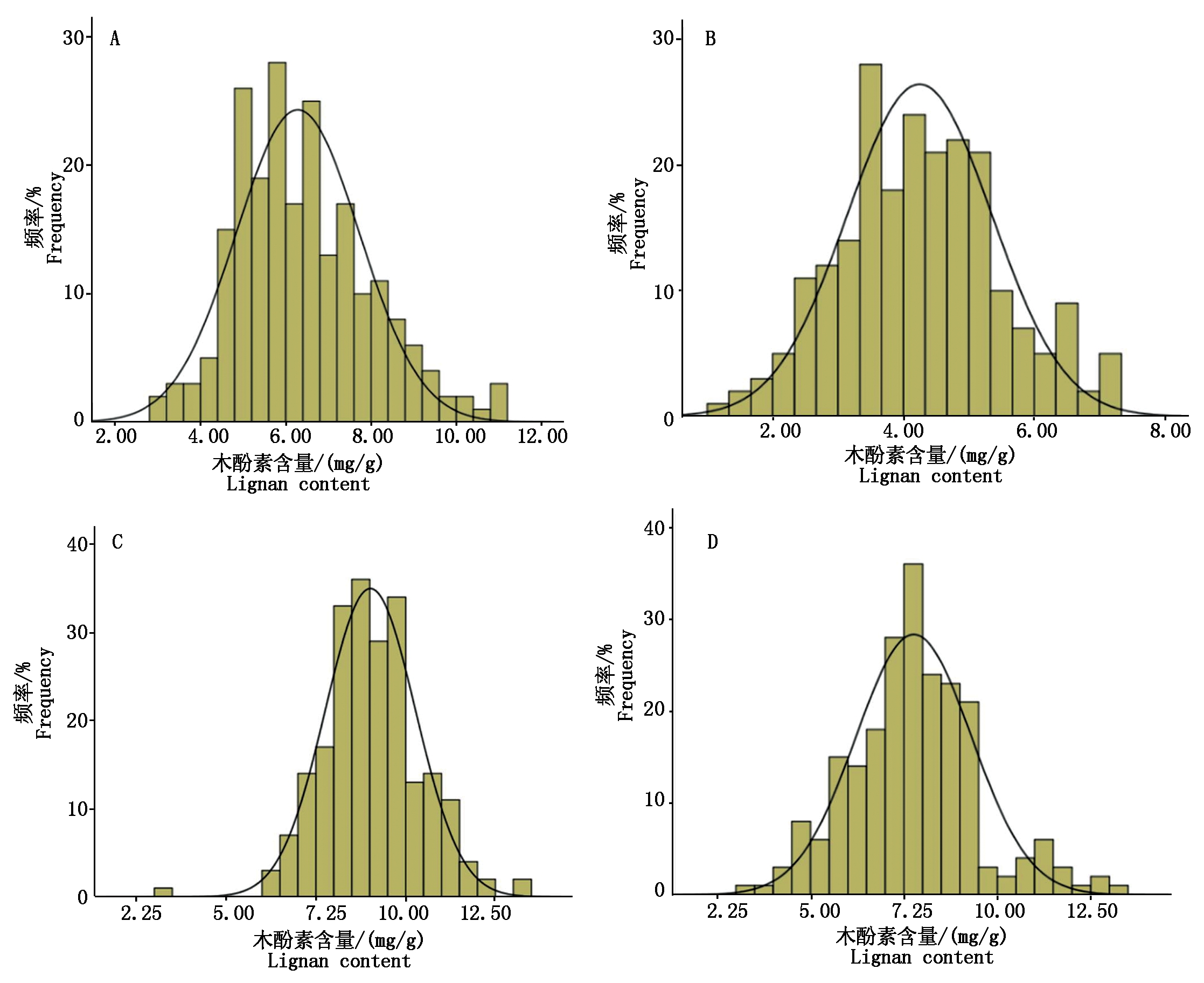
A.2017年呼和浩特地区木酚素含量正态分布;B.2018年呼和浩特地区木酚素含量正态分布;C. 2017年集宁地区木酚素含量正态分布;D.2018年集宁地区木酚素含量正态分布。
A.Distribution map of lignan content in Hohhot in 2017;B.Distribution map of lignan content in Hohhot in 2018;C.Distribution map of lignan content in Jining in 2017;D.Distribution map of lignan content in Jining in 2018.
图1 亚麻木酚素含量正态分布
Fig.1 Normal distribution of linseed lignans content
2.2 SSR引物多态性分析
由表4可知,对150对SSR引物进行PCR扩增,筛选出了30对多态性好、稳定的引物,共扩增出371个位点,其中203个多态性位点,平均扩增率为56.28%,Lu_291和Lu_83b引物扩增的多态性位点最多(10个),Lu_511引物的多态性位点百分率最高(80.00%)。有效等位基因数1.19~1.82,平均为1.41。引物多态性含量为0.27~0.63,平均值0.43,Lu_a37引物PIC值最大(0.63)。Lu_661引物的29份亚麻种质上扩增结果见图2。
表4 30对SSR引物组合对220份亚麻品种的扩增结果
Tab.4 Amplification of 220 flax cultivars using 30 pairs of SSR primer
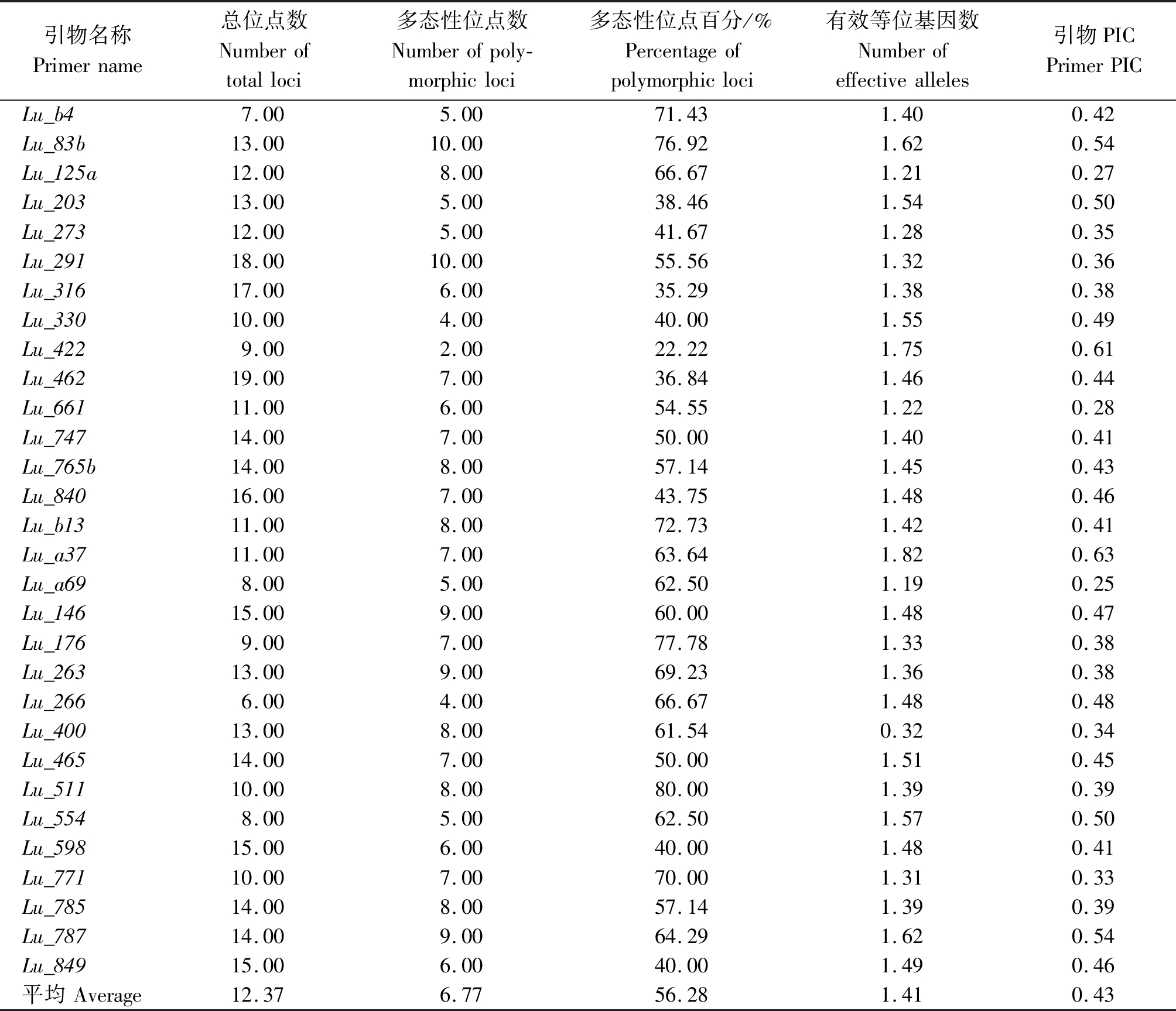
引物名称Primername总位点数Numberoftotalloci多态性位点数Numberofpoly-morphicloci多态性位点百分/%Percentageofpolymorphicloci有效等位基因数Numberofeffectivealleles引物PICPrimerPICLu_b47.005.0071.431.400.42Lu_83b13.0010.0076.921.620.54Lu_125a12.008.0066.671.210.27Lu_20313.005.0038.461.540.50Lu_27312.005.0041.671.280.35Lu_29118.0010.0055.561.320.36Lu_31617.006.0035.291.380.38Lu_33010.004.0040.001.550.49Lu_4229.002.0022.221.750.61Lu_46219.007.0036.841.460.44Lu_66111.006.0054.551.220.28Lu_74714.007.0050.001.400.41Lu_765b14.008.0057.141.450.43Lu_84016.007.0043.751.480.46Lu_b1311.008.0072.731.420.41Lu_a3711.007.0063.641.820.63Lu_a698.005.0062.501.190.25Lu_14615.009.0060.001.480.47Lu_1769.007.0077.781.330.38Lu_26313.009.0069.231.360.38Lu_2666.004.0066.671.480.48Lu_40013.008.0061.540.320.34Lu_46514.007.0050.001.510.45Lu_51110.008.0080.001.390.39Lu_5548.005.0062.501.570.50Lu_59815.006.0040.001.480.41Lu_77110.007.0070.001.310.33Lu_78514.008.0057.141.390.39Lu_78714.009.0064.291.620.54Lu_84915.006.0040.001.490.46平均Average12.376.7756.281.410.43
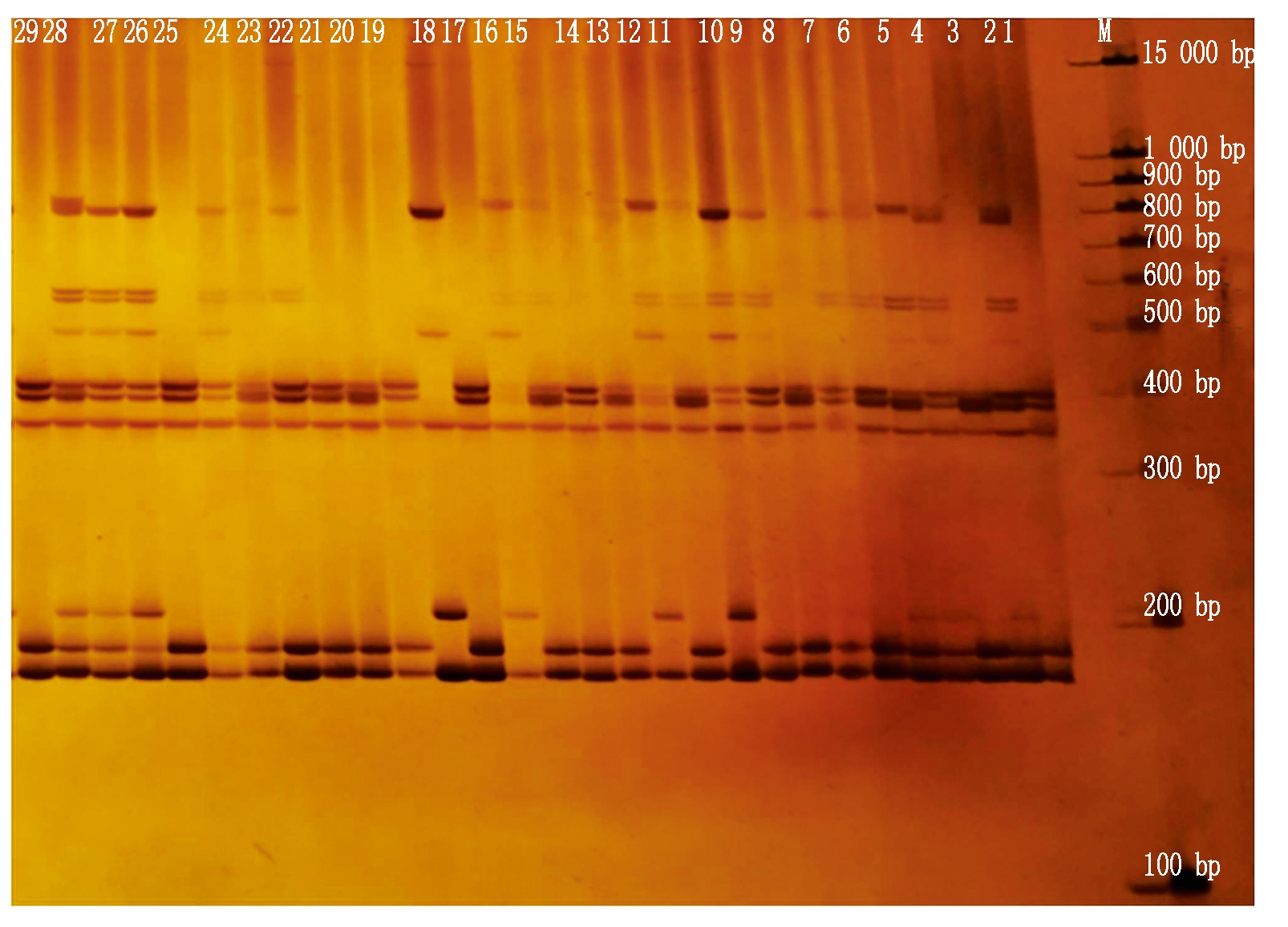
M.DL1500;1-29.29份亚麻样品。
M.DL1500;1-29.29 flax samples in turn.
图2 引物Lu_661在亚麻中的扩增结果
Fig.2 PCR product with SRAP primer Lu_661
2.3 群体结构分析
采用Admixture软件[14]构建群体遗传结构和群体世系信息。将220份品种的群体结构的分群数K值设置为2~10,进行Structure分析。根据种质之间的交叉验证错误率CV最小时K=4,表明最佳分群K值为4,即220份品种(系)分为4个群(图3)。第1个群共有49个种质,其中32个种质材料的遗传背景较纯,其他17份材料含有多种遗传成分,属于混合型;第2个群共有61个品种(系),其中28份材料遗传背景较纯,其他33份品种均为混合型。第4个群体有53个品种,其中遗传背景较纯的品种40份,其余的均为混合型;第4个群共57个品种(系),其中34个种质材料的遗传背景较纯,其他23份材料含有多种遗传成分。220份亚麻资源材料中134份种质的遗传背景比较纯,占关联群体材料的60.90%,86份种质材料含有不同程度的其他遗传成分,占关联群体材料的39.10%。按地理来源看,第1个和第2个群中主要分布国外种质(共64份),占第1和第2群种质的58.18%;第3个和第4个群中主要分布国内品种(82份),占第3和第4群种质的74.54%(图4)。表明国内外品种基本能分开,遗传差异较大。
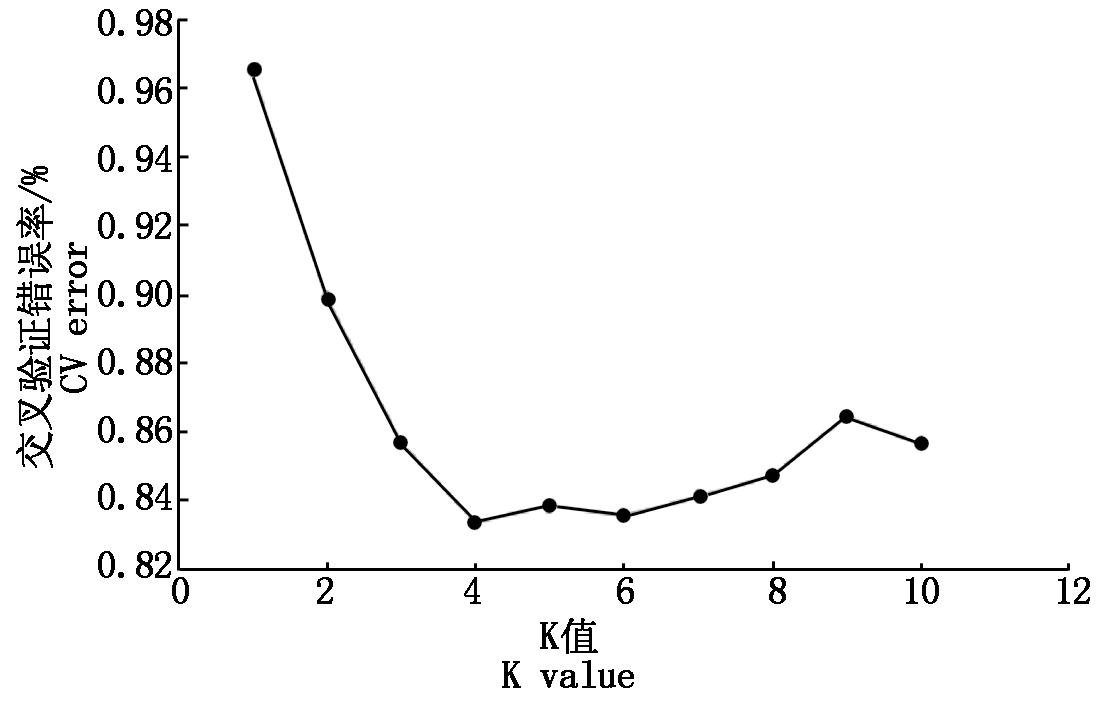
图3 K值的变化曲线
Fig.3 The change of K values
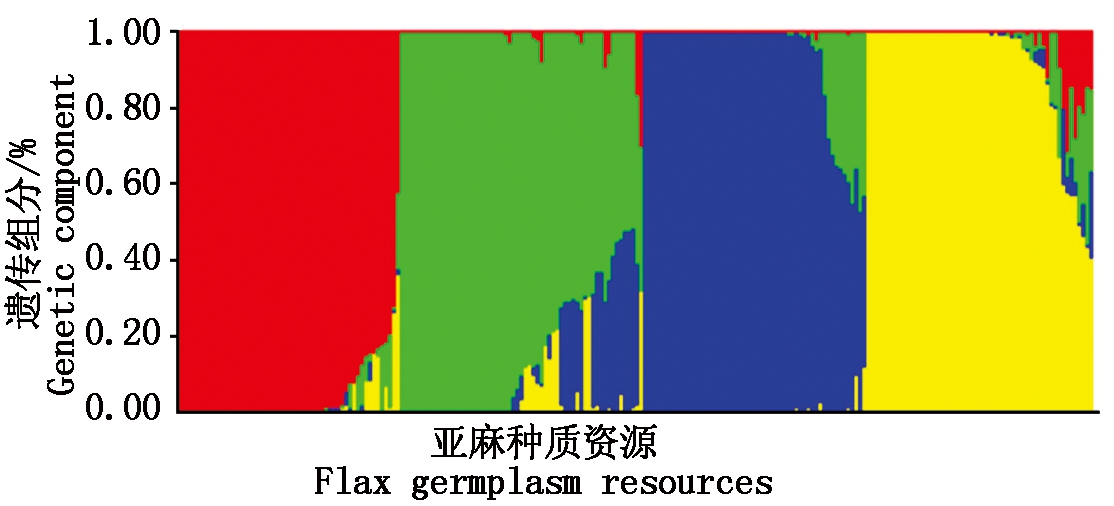
图4 群体结构图
Fig.4 Population structure
2.4 基于SSR标记的关联分析
30对SSR引物对220份亚麻材料扩增出343个多态性位点,与2 a 2个环境条件下检测的亚麻木酚素含量进行广义线性模型(GLM)和混合线性模型(MLM)的关联分析,GLM模型分析共检测到18个SSR位点,其中2017年检测到9个位点(呼和浩特4个位点、集宁5个位点),2018年检测到9个位点(呼和浩特6个位点、集宁3个位点),表型解释率为2.07%~13.18%。MLM模型分析共检测到16个位点,表型解释率为3.06%~15.03%,LU_83b位点在GLM(13.18%)和MLM(15.03%)下表型解释率均较高。LU_203标记在2017年2个环境下共同检测到,表型解释率呼和浩特地区3.61%(GLM)和3.06(MLM),集宁地区12.51%(GLM)和11.29%(MLM)。LU_661标记在呼和浩特(2017年)和集宁(2018年)地区共同检测到,表型解释率呼和浩特地区4.84%(GLM)和4.58%(MLM),集宁地区6.95%(GLM)和5.11%(MLM)。LU_330标记在集宁地区2 a均检测到,2017,2018年表型解释率分别为4.92%(GLM),3.18%(MLM)和10.84%(GLM),11.87%(MLM)。表明LU_203、LU_661和LU_330标记在不同的环境条件下均检测到,稳定性好(表5),进一步验证可以开发实用性分子标记。
表5 亚麻木酚素含量与SSR标记的关联分析
Tab.5 Correlation analysis between linseed lignans content and SSR Markers
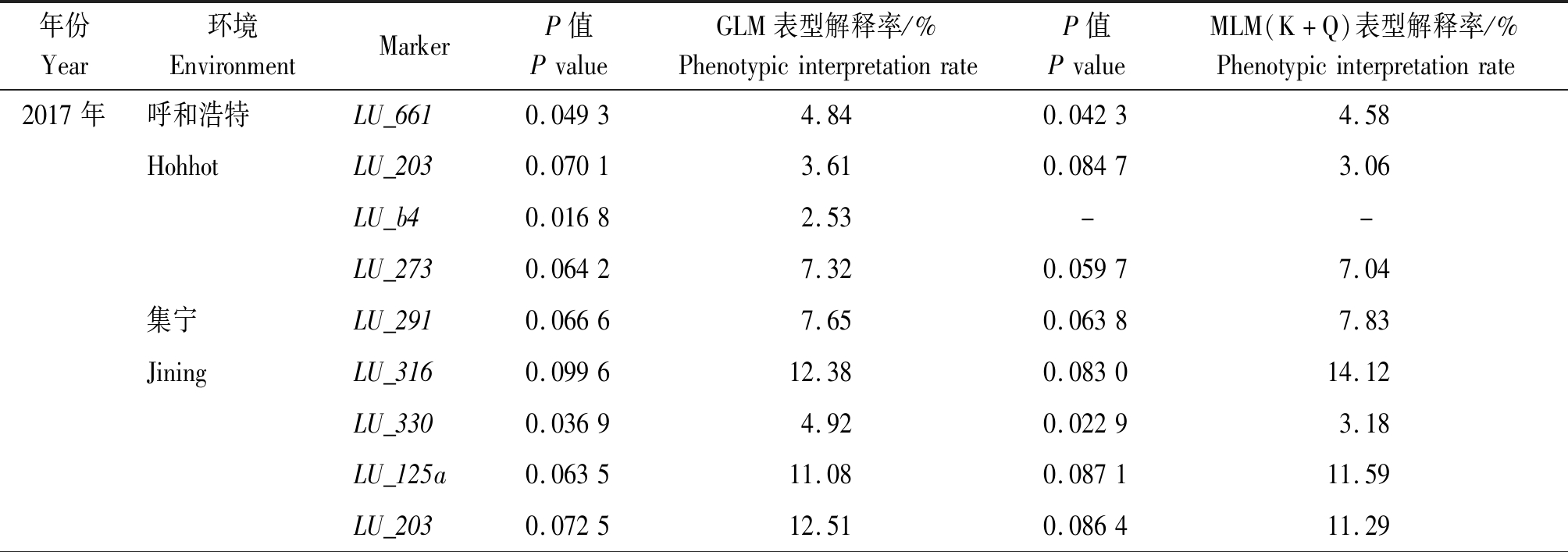
年份Year环境EnvironmentMarkerP值PvalueGLM表型解释率/%PhenotypicinterpretationrateP值PvalueMLM(K+Q)表型解释率/%Phenotypicinterpretationrate2017年呼和浩特LU_6610.04934.840.04234.58HohhotLU_2030.07013.610.08473.06LU_b40.01682.53--LU_2730.06427.320.05977.04集宁LU_2910.06667.650.06387.83JiningLU_3160.099612.380.083014.12LU_3300.03694.920.02293.18LU_125a0.063511.080.087111.59LU_2030.072512.510.086411.29
表5(续)

年份Year环境EnvironmentMarkerP值PvalueGLM表型解释率/%PhenotypicinterpretationrateP值PvalueMLM(K+Q)表型解释率/%Phenotypicinterpretationrate2018年呼和浩特LU_83b0.097213.180.087115.03HohhotLU_4220.04455.500.04815.39LU_4620.01348.920.02465.28LU_7470.02842.07--LU_3160.01912.750.01524.35LU_8400.092312.560.08708.89集宁LU_765b0.06229.640.082411.77JiningLU_6610.03626.950.03415.11LU_3300.080110.840.076311.87
3 讨论
亚麻木酚素是对人类健康效益诸多的有效成分,具有较高的保健功能。近几年随着色谱检测技术的发展,植物有效成分含量的鉴定评价研究越来越多。国内外学者对亚麻木酚素的理化性质进行了大量研究,建立了提取方法和检测体系。前人采用高效液相色谱法检测亚麻籽木酚素含量,优化构建了亚麻木酚素检测体系[15]。本研究在前人构建的检测体系的基础上,对提取步骤略有改变。220份亚麻种质木酚素含量变幅为3.24~11.76 mg/g,与冯小慧等[8]对7份亚麻品种的检测数据(木酚素含量变幅为4.80~8.50 mg/g)基本吻合。因此,使用高效液相色谱法检测亚麻木酚素含量可以获得精准的表型数据,能满足分子标记与表型性状的关联分析。
植物种质资源表型分析对于提供多样化育种亲本、扩大品种遗传基础、挖掘有效等位基因等方面都是非常重要的。表型性状能直接反映作物的生长发育情况,它是基因和环境的互作的表现形式。植物基因比较稳定,因此,作物在不同自然环境中产生表型差异是主要环境差异导致的[16]。本研究中筛选出了7个高木酚素含量的亚麻品种,其中PAKISTAN161(12.15 mg/g)、CFRESBR94(11.81 mg/g)和RuSSIA5(13.25 mg/g)是国外引进品种,坝亚11号(11.79 mg/g)、坝亚6号(11.11 mg/g)、同亚9号(11.41 mg/g)和乌41号(9.63 mg/g)等4个品种是国内品种。以上品种对高木酚素含量亚麻新品种选育提供遗传资源。
亚麻籽是植物木酚素的主要来源,在人体内可以转变成植物雌激素化合物,可以抑制激素敏感型癌症的发生和扩散,科学家们推荐每天食用2~4勺亚麻籽,能防止癌症和肿瘤的发生。因此,市场上迫切需要高木酚素含量的亚麻品种,但常规育种选育新品种周期长,效率低。关联分析是应用基因组中分子遗传标记,进行基因水平上的对照分析或相关性分析,通过比对发现影响目标性状基因变异的一种新策略。近年,随着亚麻参考基因组数据公布[17],亚麻品质和产量相关性状关联分析在国内外已有报道[18]。但亚麻木酚素含量的SSR关联分析未见报道。王蕾[19]对86份芝麻种质的木酚素含量进行全基因组关联分析获得了172个SNP位点。亚麻课题组对269份亚麻种质进行全基因组关联分析获得了13个显著SNP位点和21个候选基因[20]。本研究通过亚麻木酚素含量与SSR标记的关联分析,获得了木酚素含量显著关联的18个SSR位点,其中LU_203、LU_661和LU_330标记不同环境条件下均检测到,可以通过验证开发实用性标记,为高木酚素含量亚麻新品种选育提供基础。以上研究对植物木酚素含量相关基因的挖掘以及高木酚素含量新品种选育提供依据。
[1] 王玉富,贾婉琪,薛召东,邱财生,郝冬梅,于文静,胡小荣. 国外引进亚麻种质资源的聚类分析及评价[J]. 植物遗传资源学报,2010,11(5):548-554. doi:10.13430/j.cnki.jpgr.2010.05.003.
Wang Y F,Jia W Q,Xue Z H D,Qiu C S,Hao D M,Yu W J,Hu X R. The cluster analysis and evaluation of introduced flax germplasm resources[J]. Journal of Plant Genetic Resources,2010,11(5):548-554.
[2] 赵利,王斌,苗红梅,马琴.胡麻种质资源籽粒表型与品质性状评价及其相关性研究[J].植物遗传资源学报,2020,21(1):243-251. doi:10.13430/j.cnki.jpgr.20191107001.
Zhao L,Wang B,Miao H M,Ma Q. Evaluation and correlation analysis on seed morphology and quality traits of oil flax germplasm resources[J]. Journal of Plant Genetic Resources,2020,21(1):243-251.
[3] 王荣,杨宽,罗倩,魏彩霞.亚麻籽木酚素对高血脂症大鼠血脂和抗氧化作用研究[J]. 中国粮油学报,2020,35(3):133-138.
Wang R,Yang K,Luo Q,Wei C X.Research on blood lipid and antioxidation of rat with hyperlipidemia from flaxseed lignan[J].Journal of the Chinese Cereals and Oils Association,2020,35(3):133-138.
[4] 党学良,刘继洋,李文湖,杨乐.亚麻木酚素对2型糖尿病小鼠学习记忆的影响及其机制初探[J].现代生物医学进展,2020,20(2):259-263. doi:10.13241/j.cnki.pmb.2020.02.011.
Dang X L,Liu J Y,Li W H,Yang L. Effects of flax lignans on spatial learning and memory in diabetic encephalopathy mice and its mechanism[J]. Progress in Modern Biomedicine,2020,20(2):259-263.
[5] Pan A,Demark-Wahnefried W,Ye X W,Yu Z J,Li H X,Qi Q B,Sun J Q,Chen Y Q,Chen X F,Liu Y,Lin X. Effects of a flaxseed-derived lignan supplement on C-reactive protein,IL-6 and retinol-binding protein 4 in type 2 diabetic patients[J]. Br J Nutr,2009,101(8):1145-1149. doi:10.1017/S0007114508061527.
[6] 孙爱景,刘玮.亚麻籽功能成分提取及其应用[J].粮食科技与经济,2010,35(1):44-45,50. doi:10.16465/j.gste.2010.01.004.
Sun A J,Liu W. The extraction and utilization of the functional components in flaxseed[J].Food Science and Technology,2010,35(1):44-45,50.
[7] 罗冉,吴委林,张旸,李玉花. SSR 分子标记在作物遗传育种中的应用[J].基因组学与应用微生物学,2010,29(1):137-143.doi:10.3969/gab.029.000137.
Luo R,Wu W L,Zhang Y,Li Y H. SSR marker and its application to crop genetics and breeding[J]. Genomics and Applied Biology,2010,29(1):137-143.
[8] 冯小慧,李国银,宋洁,邵海.高效液相色谱法测定亚麻籽中木酚素的含量[J]. 畜牧与饲料科学,2017,37(12):17-18. doi:10.16003/j.cnki.issn1672-5190.2016.12.005.
Feng X H,Li G Y,Song J,Shao H. Determination of lignan in flaxseed by HPLC[J]. Animal Husbandry and Feed Scienc,2017,37(12):17-18.
[9] Stewart C N J,Via L E. A rapid CTAB DNA isolation technique useful for RAPD fingerprinting and other PCR applications[J]. Biotechniques,1993,14(5):748-750.
[10] 王希,陈丽,赵春雷. 利用MISA工具对不同类型序列进行SSR标记位点挖掘的探讨[J]. 中国农学通报,2016,32(10):150-156.
Wang X,Chen L,Zhao C L.Mining SSR molecular marker sites with MISA tool for different types of sequences[J]. Chinese Agricultural Science Bulletin,2016,32(10):150-156.
[11] 李光光,张华,郑岩松,李荣华.利用SSR标记研究菜心资源的遗传多样性分析[J].基因组学与应用生物学,2018,37(3):1257-1264. doi:10.13417/j.gab.037.001257.
Li G G,Zhang H,Zheng Y S,Li R H.The genetic diversity analysis of Chinese flowering cabbage resources based on SSR Marker[J].Genomics and Applied Biology,2018,37(3):1257-1264.
[12] 张照远,黄妹平,徐建民,项东云,陈风帆,常明山. 基于SSR标记的桉树枝瘿姬小蜂的关联分析[J]. 基因组学与应用生物学,2017,36(4):1660-1666. doi:10.13417/j.gab.036.001660.
Zhang Z H,Huang M P,Xu J M,Xiang D Y,Chen F F,Chang M S. Correlation analysis of Leptocybe invasa based on SSR Markers[J].Genomics and Applied Biology,2017,36(4):1660-1666.
[13] 向妮艳,湛蔚,陈贤军,黄稳,覃尔岱,李刚,严兴初,覃瑞. 红花油脂相关性状与 SSR 分子标记的关联分析[J]. 植物遗传资源学报,2019,20(6):1506-1516. doi:10.13430/j.cnki.jpgr.20190329001.
Xiang N Y,Zhan W,Chen X J,Hang W,Qin E D,Li G,Yan X C,Qin R. Association analysis of oil-related traits with SSR molecular markers in safflower[J]. Journal of Plant Genetic Resources,2019,20(6):1506-1516.
[14] Chand rawati, Singh N,Kumar R, Kumar S, Singh P K,Yadav V K, Ranade S A,Yadav H K. Genetic diversity,population structure and association analysis in linseed(Linum usitatissimum L.)[J]. Physiology and Molecular Biology of Plants,2017,23(1):207-219. doi:10.1007/s12298-016-0408-5.
[15] 许光映,胡晓军,李群,高忠东,王振. 亚麻木酚素检测精密度的影响因素分析及改进措施[J].山西农业科学,2016,44(7):938-940,950.doi:10.3969/j.issn.1002-2481.2016.07.11.
Xu G Y,Hu X J,Li Q,Gao Z D,Wang Z.Analysis of influencing factors of flaxseed lignans detection precision and improvements[J].Journal of Shanxi Agricultural Sciences,2016,44(7):938-940,950.
[16] Soto-Cerda B J ,Duguid S, Booker H, Rowland G, Diederichsen A,Cloutier S. Association mapping of seed quality traits using the Canadian flax(Linum usitatissimum L.)core collection[J]. Theoretical and Applied Genetics,2014,127(4):881-896. doi:10.1007/s00122-014-2264-4.
[17] Wang Z W, Hobson N, Galindo L, Zhu S L, Shi D H, McDill J,Yang L F, Hawkins S, Neutelings G, Datla R, Lambert G, Galbraith D W, Grassa C J,Geraldes A, Cronk Q C, Cullis C, Dash P K, Kumar P A, Cloutier S, Sharpe A G, Wong G K S, Wang J, Deyhoios M K. The genome of flax(Linum usitatissimum)assembled de novo from short shotgun sequence reads[J]. The Plant Journal,2012,72(3):461-473. doi:10.1111/j.1365-313X.2012.05093.x.
[18] Xie D W,Dai Z G,Yang Z M,Tang Q,Sun J,Yang X,Song X X,Lu Y,Zhao D B,Zhang L G,Su J G. Genomic variations and association study of agronomic traits in flax[J]. BMC Genomics, 2018,19(1):512-519. doi:10.1186/s12864-018-4899-z.
[19] 王蕾. 芝麻木酚素含量与相关候选基因的关联分析[D]. 北京:中国农业科学院,2014.
Wang L. Lignan content and candidate-gene association analysis in sesame(Sesamum indicum L.)[D].Beijing:Chinese Academy of Agricultural Sciences,2014.
[20] 伊六喜,斯钦巴特尔,冯小慧,贾霄云,高凤云,周宇,张辉.胡麻木酚素含量的全基因组关联分析[J]. 分子植物育种,2020,18(3):765-771. doi:10.13271/j.mpb.018.000765.
Yi L X,Siqin B,Feng X H,Jia X Y,Gao F Y,Zhou Y,Zhang H.Genome-wide association analysis of lignan content in flax[J].Molecular Plant Breeding,2020,18(3):765-771.
