重金属作为地壳中存在的天然成分,一般被分为两部分,一部分为植物生长发育必需元素,如铁(Fe)、锌(Zn)、铜(Cu)等;另一部分为植物生长发育非必需元素,如镉(Cd)、铅(Pb)、汞(Hg)等[1]。Cu作为植物生长所需的微量元素,参与光合作用、呼吸以及清除超氧化物等重要过程,但是Cu含量一旦超过植物体所能承受的范围便会产生自由基,对脂质、蛋白质造成损伤[2]。当拟南芥中铜含量过高时,硝酸盐高亲和力转运蛋白(NTRs)表达降低,导致其对氮和其他养分的吸收和积累减少[3]。过量的铜还会破坏大豆体内氮代谢及固定,造成大豆减产[4]。Hg是植物生长非必需的元素,越来越多的证据表明,Hg2+很容易在高等植物中积累[5-6]。Cargnelutti等[7]研究发现,Hg胁迫下,脂质过氧化,蛋白质氧化水平升高,导致黄瓜幼苗的叶绿素含量减少、光合速率降低,膜损伤增加。Cd含量过高不仅会抑制植物生长,甚至会导致其死亡。草莓在Cd胁迫下,叶绿素含量降低,生长量下降,并且在整个胁迫过程中根中的Cd含量始终低于叶片[8]。当土壤中Cd和Hg的浓度达到一定程度时,番茄叶片、芽和根的细胞内会产生大量H2O2和MDA,导致膜脂过氧化,从而对番茄幼苗产生毒害作用[9-10]。
WRKY基因家族是植物特异性的大型转录调节因子家族,可以通过识别大量植物防御相关基因序列中的W-box(TTGAC/T)元件来发挥它的调节功能,并通过调控防御反应相关基因的表达来提高植物对不良环境的适应性和耐受性[11]。拟南芥AtWRKY6基因通过在ABA信号转导通路中直接下调RAV1的表达介导种子萌发和早期幼苗发育[12]。并且在低磷条件下,AtWRKY6缺失突变会导致拟南芥根毛密度的增加[13]。WRKY转录因子不仅参与植物的生长发育,在植物抵抗非生物逆境胁迫的过程中也起到了很重要的作用。在烟草中,GhWRKY17通过降低ABA的水平调节植物细胞中ROS的水平来应对干旱和盐胁迫[14]。拟南芥中WRKY39也被证明在耐热性中具有正调节作用[15]。Huang等[16]分析微阵列数据时发现有些WRKY转录因子响应重金属胁迫,例如OsWRKY53响应Hg胁迫,OsWRKY12响应砷(As)胁迫。在Cd胁迫下,东南景天根、茎、叶中SaWRKY7基因的表达量显著上调[17]。AtWRKY47[18]和ThWRKY7[19]基因的过表达会增强拟南芥对Cd的耐受性,相反AtWRKY12[20]基因的过表达会增强拟南芥对Cd的敏感性。但是近年来关于WRKY转录因子在重金属胁迫方面的研究都集中在模式植物上,关于园艺作物番茄的研究却较少。
番茄(Solanum lycopersicum L.)作为重要的经济作物,现已被广泛应用于植物防御生物和非生物胁迫的研究上[21]。Huang等[22]在番茄中确定了81个SlWRKY基因,并根据其结构特点将其分成了3个组。现已经有学者确定WRKY6转录因子在抵抗非生物胁迫中的功能,例如在拟南芥中AtWRKY6负调控磷酸盐运输[23],还可以通过直接下调RAV1的表达,在ABA转导信号中发挥重要作用[24],水稻中OsWRKY6异源表达使水稻的抗病能力增强[25]。然而WRKY6转录因子在重金属胁迫方面的研究鲜有报道。本研究以番茄为试验材料,克隆出番茄SlWRKY6基因并对其核酸序列进行生物信息学分析,利用实时荧光定量PCR技术研究在不同组织中和经过重金属胁迫处理后该基因的表达情况,进一步分析SlWRKY6基因在番茄抵抗重金属胁迫过程中的功能,旨在为深入研究SlWRKY6基因在番茄抵抗重金属胁迫过程中的分子机制提供理论依据。
1 材料和方法
1.1 试验材料及重金属胁迫处理
本研究所用材料为黑龙江地方常规番茄品种红罗成。使用草炭土将番茄培育至五叶期后,取其幼根、老根、幼茎、老茎、幼叶、老叶组织,迅速转入液氮中冷冻处理,随后保存至-80 ℃中用于后续基因克隆。将生长状况良好的五叶期的番茄幼苗,先用1% Hoagland营养液培养1 d,随后进行重金属胁迫处理,处理组分别为:50,100 μmol/L CdCl2;200,400 μmol/L CuCl2;600,800 μmol/L HgSO4,均以1% Hoagland营养液的水溶液作为对照,每个处理设置3次生物学重复,在0,3,6,12 h时取材,各处理均混合收取10株番茄幼苗的根和第3,4片真叶,用滤纸吸干水分后转入液氮中,-80 ℃保存备用。
1.2 SlWRKY6基因克隆
根据从NCBI中GenBank在线网站下载的番茄WRKY6基因序列,使用Primer 5.0软件设计引物,送上海生工公司合成。提取番茄叶片RNA(康为世纪公司,植物总RNA提取试剂盒),反转录为cDNA(TaKaRa,ReverTra Ace qPCR RT Kit)。以番茄cDNA为模板,通过PCR扩增获得WRKY6基因PCR产物。PCR反应体系(50 μL):10×PCR Buffer for KOD-Plus-Neo 5 μL,dNTPs 5 μL,MgSO4 3 μL,KOD-Plus-Neo 1 μL,上下游引物1 μL,cDNA 1 μL,ddH2O 33 μL。反应程序:94 ℃ 2 min;98 ℃ 10 s,60 ℃ 30 s,68 ℃ 1 min 30 s 35个循环;72 ℃ 2 min,-20 ℃保存。通过1%琼脂糖凝胶电泳将其分离,纯化PCR产物(康为世纪公司,OMEGA Gel Extraction kit)后用Kpn Ⅰ 和BamH Ⅰ 酶切,使用T4连接酶将其与pCAMBIA2300载体连接,转入大肠杆菌DHα5感受态,37 ℃培养12 h,菌落PCR鉴定后,挑阳性菌落摇菌,提取质粒(康为世纪公司,PurePlasmid Mini Kit),双酶切进一步验证后送往上海生工公司测序。
1.3 SlWRKY6基因生物信息学分析
从NCBI网站中获得SlWRKY6基因的碱基序列和氨基酸序列信息,使用在线分析工具ORFinder(https://www.ncbi.nlm.nih.gov/orffinder/)对SlWRKY6基因进行开放阅读框(ORF)预测,使用DNAMAN软件进行氨基酸序列预测;使用Expasy(https://web.expasy.org/)在线网站分析SlWRKY6蛋白的理化性质和亲/疏水性;使用Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)在线分析工具查找同源序列,使用ClustalX对其氨基酸同源序列进行多重比对分析,并使用MEGA 7软件构建系统发育进化树;使用Phytozome(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)查找SlWRKY6启动子序列,导入PlantCARE(https://phytozome.jgi.doe.gov/)中,分析与非生物胁迫相关的顺式作用元件。
1.4 SlWRKY6基因表达模式分析
使用实时荧光定量PCR仪(ABI7500),以番茄β-Actin基因为内参,检测番茄的各组织以及重金属胁迫处理下SlWRKY6基因的相对表达量。反应体系(25 μL):2×UltraSYBR Mixture(Low ROX)12.5 μL,上下游引物1 μL,cDNA 1 μL,ddH2O 9.5 μL。所用特异性引物及内参引物见表1。反应程序:94 ℃ 10 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,40个循环;72 ℃ 10 min,94 ℃ 2 min。每个处理设置3次生物学重复,3次技术重复,以0 h表达量为对照,相对表达量采用2-ΔΔCt法计算。使用Excel 2010作图,IBM SPSS Statistics V25.0软件中配对样本T检验方法对数据进行统计学分析。
表1 PCR 特异性引物
Tab.1 PCR specific primer

引物名称Nameofprimers引物序列(5′-3′)Sequencesofprimers引物类型PrimertypeSlWRKY6-FGGGGTACCGTCTTCAATTTATCATATTTCTATCTCTACC目的片段特异性扩增引物SlWRKY6-RCGGGATCCATACAAAGGCTGCCCCAAAACQ-SlWRKY6-FCAACCACCCATTACCACCAG实时荧光定量PCR引物Q-SlWRKY6-RGTTTGGATTTTGGGCTGTGβ-Actin-FGGAACTTGAGAAGGAGCCTAAG内参基因引物β-Actin-RCAACACCAACAGCAACAGTCT
注:下划线部分为Kpn Ⅰ酶切位点和BamH Ⅰ酶切位点。
Note:The underlined part is Kpn Ⅰ restriction site and BamH Ⅰ restriction site.
2 结果与分析
2.1 SlWRKY6基因克隆及生物信息学分析
2.1.1 SlWRKY6基因克隆及序列分析 以番茄的cDNA为模板,PCR扩增后连接到pCAMBIA2300载体上,转化至大肠杆菌DH5α感受态细胞后,选取PCR鉴定出的阳性菌提取质粒,进行双酶切鉴定。经测序后结果显示,基因编码区片段大小为1 342 bp,编码447个氨基酸(图1)。使用NCBI网站的ORF finder查找分析,SlWRKY6基因序列的编码区最大的开放阅读框为1 185 bp,编码394个氨基酸。保守结构域预测(图2)结果显示,SlWRKY6蛋白在296-352位碱基处具有WRKY转录因子家族所具备的典型的WRKY结构,锌指结构模式为C2H2,因此,判断SlWRKY6属于番茄WRKY家族的Group Ⅱ亚家族的成员。

图1 SlWRKY6蛋白氨基酸序列
Fig.1 Amino acid sequence of SlWRKY6 protein
2.1.2 SlWRKY6蛋白的理化性质及亲疏水性分析 ProtParam分析显示,SlWRKY6蛋白分子式为C2071H3330N614O676S27,相对分子质量为48.512 55 ku,等电点为8.13;理论推导其不稳定参数为44.50,属于不稳定蛋白,该蛋白中的氨基种类含量最多的为丝氨酸(Ser),带负电荷的残基总和(Asp+Glu)为47,带正电荷的残基总和(Arg+Lys)为49,蛋白的脂肪系数为63.39,亲水平均数为-0.616,预测该蛋白为亲水性蛋白。
2.1.3 SlWRKY6蛋白二级结构预测 使用SPOMA对转录因子的氨基酸序列的二维结构进行预测,发现该蛋白的二级结构主要包括α-螺旋(Alpha helix)、β-转角(Beta turn)、延伸链(Extended strand)和无规卷曲(Random coil),其中无规则卷曲是该蛋白二级结构中最多的结构元件,α-螺旋和延伸链则分散地分布在蛋白质中;根据PredictProtein网站得到的结果可知无规则卷曲占48.14%,α-螺旋占16.13%,延伸链占26.05%,β-转角占9.68%,可见无规则卷曲是SlWRKY6最主要的二级结构(图3)。

图2 SlWRKY6蛋白保守结构域
Fig.2 Conserved domain of SlWRKY6 protein
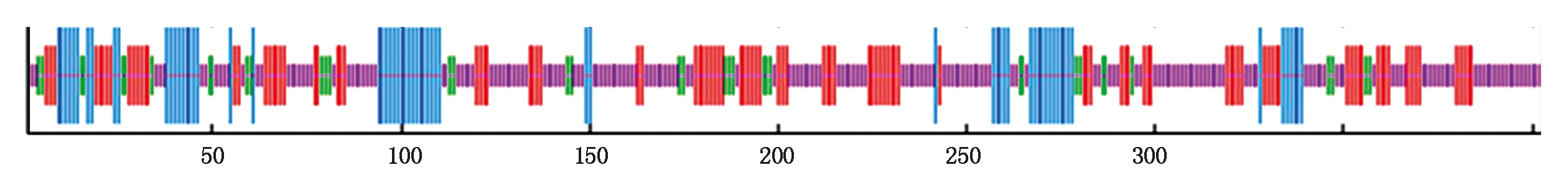
蓝色.α-螺旋;紫色.无规则卷曲;红色.延伸链;绿色.β-转角;数字.氨基酸位置。
Blue.α-helix;Purple.Random curl;Red.Extended chain;Green.β-turn;Numbers.Amino acid positions.
图3 SlWRKY6蛋白二级结构预测
Fig.3 Secondary structure prediction of SlWRKY6 protein
2.1.4 SlWRKY6基因进化分析 通过Blast查找SlWRKY6的同源氨基酸序列,ClustaX进行序列比对分析并使用MEGA构建进化树(图4),结果表明,番茄SlWRKY6与辣椒(Capsicum annuum)、烟草(Nicotiana tomentosiformis)、马铃薯(Solanum tuberosum)等物种中的WRKY转录因子序列相似性在78.53%~99.37%,并与番茄SpWRKY31聚成一类,可信度达到99%,说明SlWRKY6与SpWRKY31在进化上亲缘关系最近。番茄SlWRKY6的氨基酸序列与以上物种氨基酸序列多重比对分析表明(图5),它们具有共同的WRKYGQK结构域和C2H2型的锌指结构,说明SlWRKY6氨基酸序列具有高度保守性。
2.1.5 SlWRKY6启动子顺式作用元件分析 为了研究SlWRKY6基因表达及调控机制,使用PlantCARE分析该基因起始密码子ATG上游2 000 bp序列的非生物胁迫相关顺式作用元件。结果显示(表2),SlWRKY6启动子中存在着许多与逆境胁迫有关的顺式作用元件,如AT1-motif、Box 4、G-box等光响应元件;响应脱落酸的元件ABRE;响应茉莉酸甲酯的调控元件CGTCA-motif等。还有厌氧调节元件和低温响应元件,如ARE和GC-motif是调节厌氧感应的顺势作用元件;LTR是低温响应元件。此外,还包括TC-rich repeats(逆境胁迫响应元件)、RY-element(种子特异性调控元件)等。预测SlWRKY6基因在植物抵抗逆境胁迫过程中起到一定的作用。
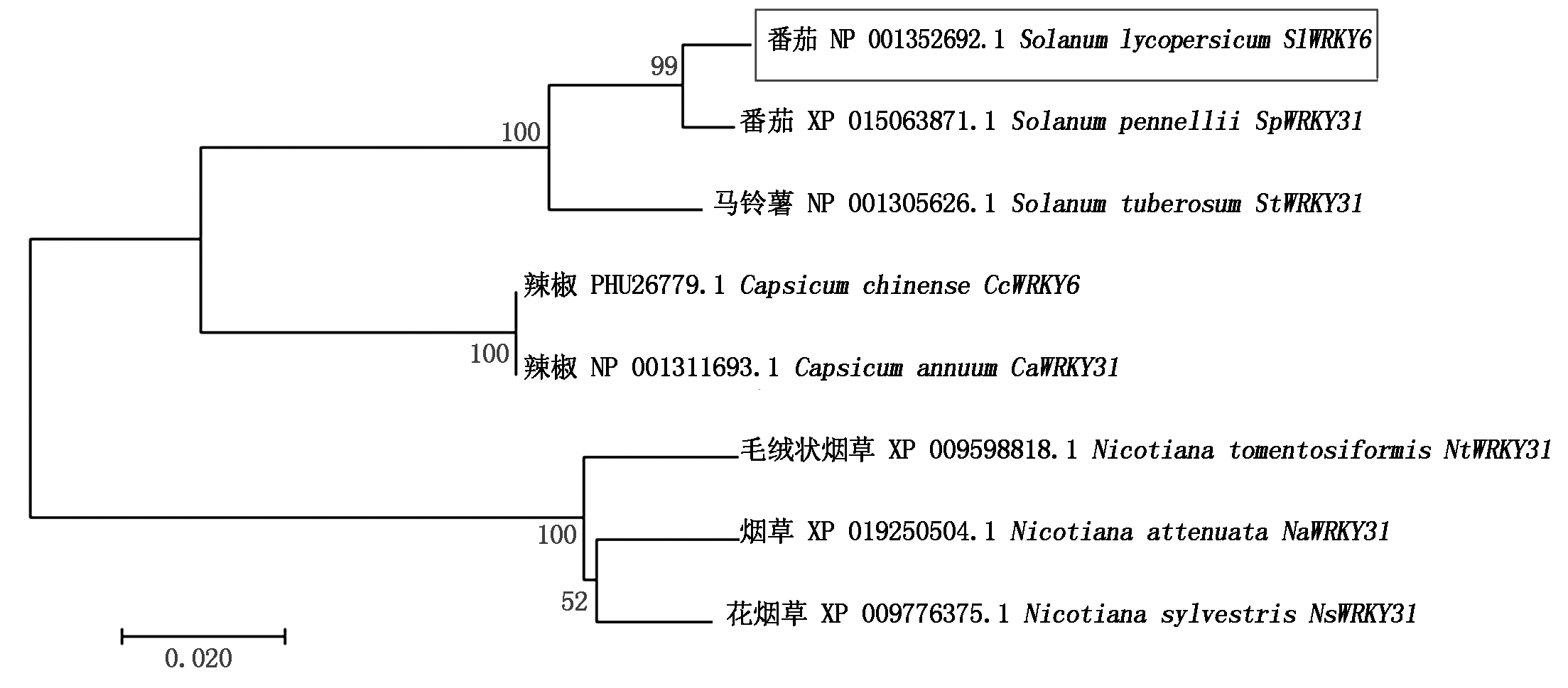
图4 SlWRKY6与其他物种WRKY家族成员系统进化树
Fig.4 SlWRKY6 phylogenetic tree with other species WRKY family members

黑色框内分别为WRKYGQK结构域和C2H2锌指结构。
The black boxes are the WRKYGQK domain and C2H2 zinc finger structure.
图5 不同物种间WRKY蛋白序列比对
Fig.5 WRKY protein sequence alignment between different species
表2 SlWRKY6启动子顺式作用元件
Tab.2 Cis-acting elements of SlWRKY6 promoter
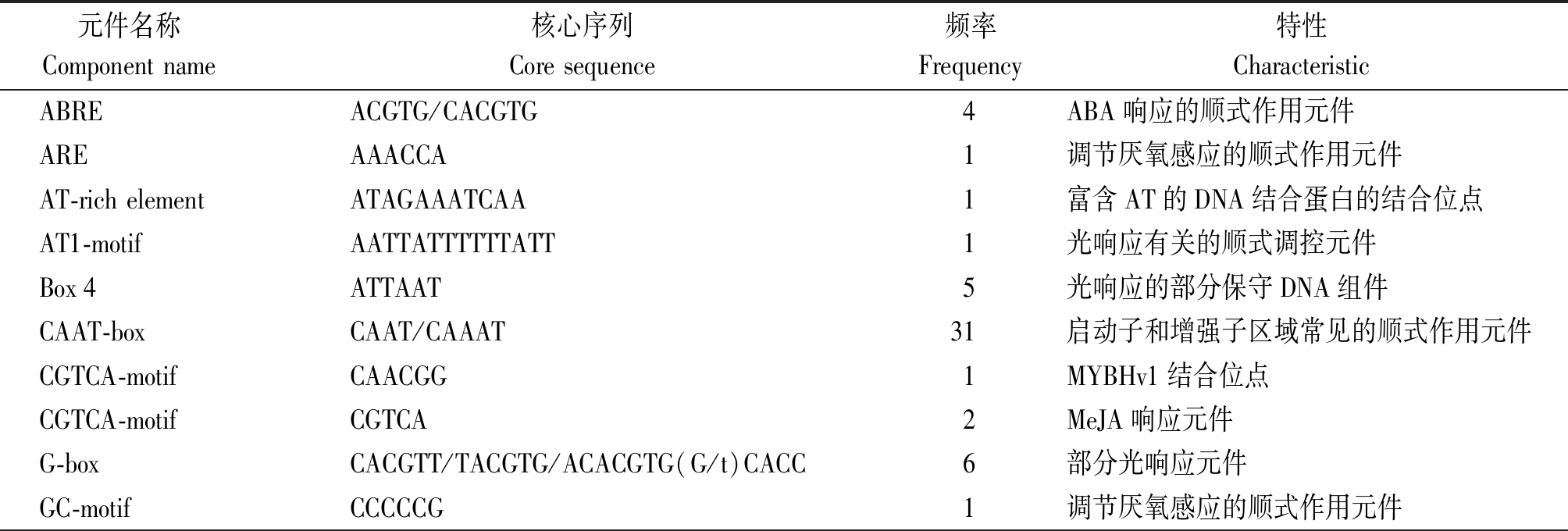
元件名称Componentname核心序列Coresequence频率Frequency特性CharacteristicABREACGTG/CACGTG4ABA响应的顺式作用元件AREAAACCA1调节厌氧感应的顺式作用元件AT-richelementATAGAAATCAA1富含AT的DNA结合蛋白的结合位点AT1-motifAATTATTTTTTATT1光响应有关的顺式调控元件Box4ATTAAT5光响应的部分保守DNA组件CAAT-boxCAAT/CAAAT31启动子和增强子区域常见的顺式作用元件CGTCA-motifCAACGG1MYBHv1结合位点CGTCA-motifCGTCA2MeJA响应元件G-boxCACGTT/TACGTG/ACACGTG(G/t)CACC6部分光响应元件GC-motifCCCCCG1调节厌氧感应的顺式作用元件
表2(续)

元件名称Componentname核心序列Coresequence频率Frequency特性CharacteristicGT1-motifGGTTAA1光响应元件LTRCCGAAA1低温响应元件MBSITTTTTACGGTTA/aaaAaaC(G/C)GTAA2MYB结合位点参与类黄酮生物合成基因的调控RY-elementCATGCATG1参与种子特异性调控的顺式调控元件SP1GGGCGG1光响应元件TATA-boxTATA/TATATA/TATAAAA/TATTTAAA/ATATAA/ATATAT90转录启动子周围-30个核心启动子TC-richrepeatsGTTTTCTTAC1参与防御和应激反应的顺式作用元件TGACG-motifTGACG2MeJA反应性中涉及的顺式作用调节元件Chs-CMA1aTTACTTAA1光响应元件
2.2 SlWRKY6基因表达模式分析
2.2.1 SlWRKY6基因在不同组织中的表达 SlWRKY6基因在番茄不同组织中的表达结果显示(图6),SlWRKY6基因在番茄不同组织中的表达量依次为:老叶>老根>幼根>老茎>幼茎>幼叶,在幼叶、幼茎、老茎中的表达量没有显著差异,说明SlWRKY6基因在番茄中的表达具有空间特异性。
2.2.2 SlWRKY6基因在重金属胁迫下的表达 不同种类的重金属处理下,SlWRKY6基因在番茄的根和叶中均有不同程度的响应(图7)。CdCl2胁迫,50,100 μmol/L处理番茄根中SlWRKY6基因相对表达量在3,6,12 h时均显著上调,且均于6 h时达到最大值,约是0 h的88,130倍,且在6~12 h SlWRKY6基因表达均表现为剂量效应;叶中SlWRKY6基因相对表达量在50 μmol/L处理仅在12 h时较0 h显著上调,而在100 μmol/L处理各时间的表达差异均未达显著水平。
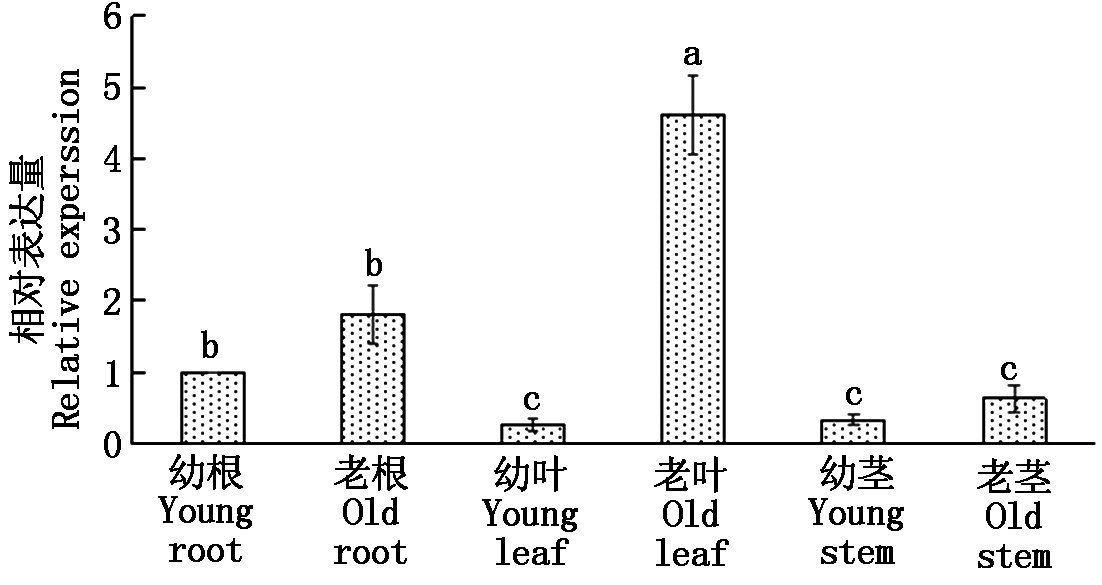
不同小写字母表示差异显著(P<0.05)。
Lowercase letters indicate significant difference(P<0.05).
图6 SlWRKY6在番茄不同组织中的表达量
Fig.6 Expression of SlWRKY6 in different tissues of tomato
CuCl2胁迫下,番茄叶和根中SlWRKY6基因表达量显著上调,叶中SlWRKY6基因表达量随时间呈先升高后降低的趋势,在3 h时相对表达量达到最大值,且SlWRKY6基因表达量在200 μmol/L CuCl2处理是400 μmol/L CuCl2处理的1.6倍;番茄根中SlWRKY6基因相对表达量在200 μmol/L CuCl2处理随时间呈升-降-升的趋势,而在400 μmol/L CuCl2处理则呈先升后将的趋势,分别于12,6 h达到最大值,约是0 h的134,34倍,且SlWRKY6基因相对表达量在3,6,12 h时均表现为200 μmol/L CuCl2处理高于400 μmol/L CuCl2处理,前者分别是后者的2.5,1.8,9.6倍。HgSO4胁迫,叶中SlWRKY6基因相对表达量均显著上调,其中在600 μmol/L处理随时间呈先升后降的趋势且在3 h时达到最大值,约是0 h的7.6倍,而在800 μmol/L处理则随时间呈上升趋势于12 h时达到最大值,约是0 h的6.8倍;根中SlWRKY6基因相对表达量在600 μmol/L HgSO4处理随时间呈上升趋势且在6,12 h时显著上调表达,于12 h时达到最大值,约是0 h的9倍,800 μmol/L HgSO4处理SlWRKY6基因相对表达量显著上调且随时间呈先升后降的趋势,于3 h时达到最大值,约是0 h的7.7倍;番茄叶中SlWRKY6基因表达水平在3,6 h时表现为600 μmol/L高于800 μmol/L处理,而在12 h时表现为600 μmol/L低于800 μmol/L处理,而在根中则相反。
3 讨论
在重金属胁迫下,植物体对所需离子的吸收、运输、渗透和调节等过程会受到影响,从而导致离子稳态被破坏,造成植物体内代谢紊乱[26]。而WRKY基因家族作为转录调节因子,通过调节特定基因的表达来发挥作用,从而确保细胞对内外部的刺激做出适当的反应。本研究从番茄中克隆了SlWRKY6基因的cDNA序列,并对其cDNA序列和启动子序列进行了生物信息学分析和表达特性研究。通过在NCBI数据库中进行氨基酸序列比对及构建进化树发现,番茄SlWRKY6与番茄SpWRKY31亲缘关系最近。并且发现SlWRKY6蛋白含有1个WRKYGQK保守基序,锌指结构为C2H2型,判定该基因是WRKY转录家族的Group Ⅱ亚家族成员,与Huang等[22]、Eulgem等[27]分析结果一致。Huang等[28]通过系统进化分析发现番茄中的WRKY转录家族Group Ⅱ共包括52个WRKY转录因子,其中大部分转录因子在植物应对非生物胁迫中起作用。陈青奇等[29]研究发现,SlWRKY50下调表达后会导致植物耐低温的能力下降。SlWRKY23的过表达会提高番茄的耐盐能力[30]。SlWRKY39基因通过激活发病相关基因和胁迫相关基因的表达来增强番茄抵抗生物和非生物胁迫的能力[31]。通过对SlWRKY6基因启动子顺势作用元件分析可以看出,该基因启动子中包括光、激素、低温等逆境响应元件。除此之外还存在参与防御和应激反应元件,推测在重金属胁迫下,该元件会发挥防御和应激作用。
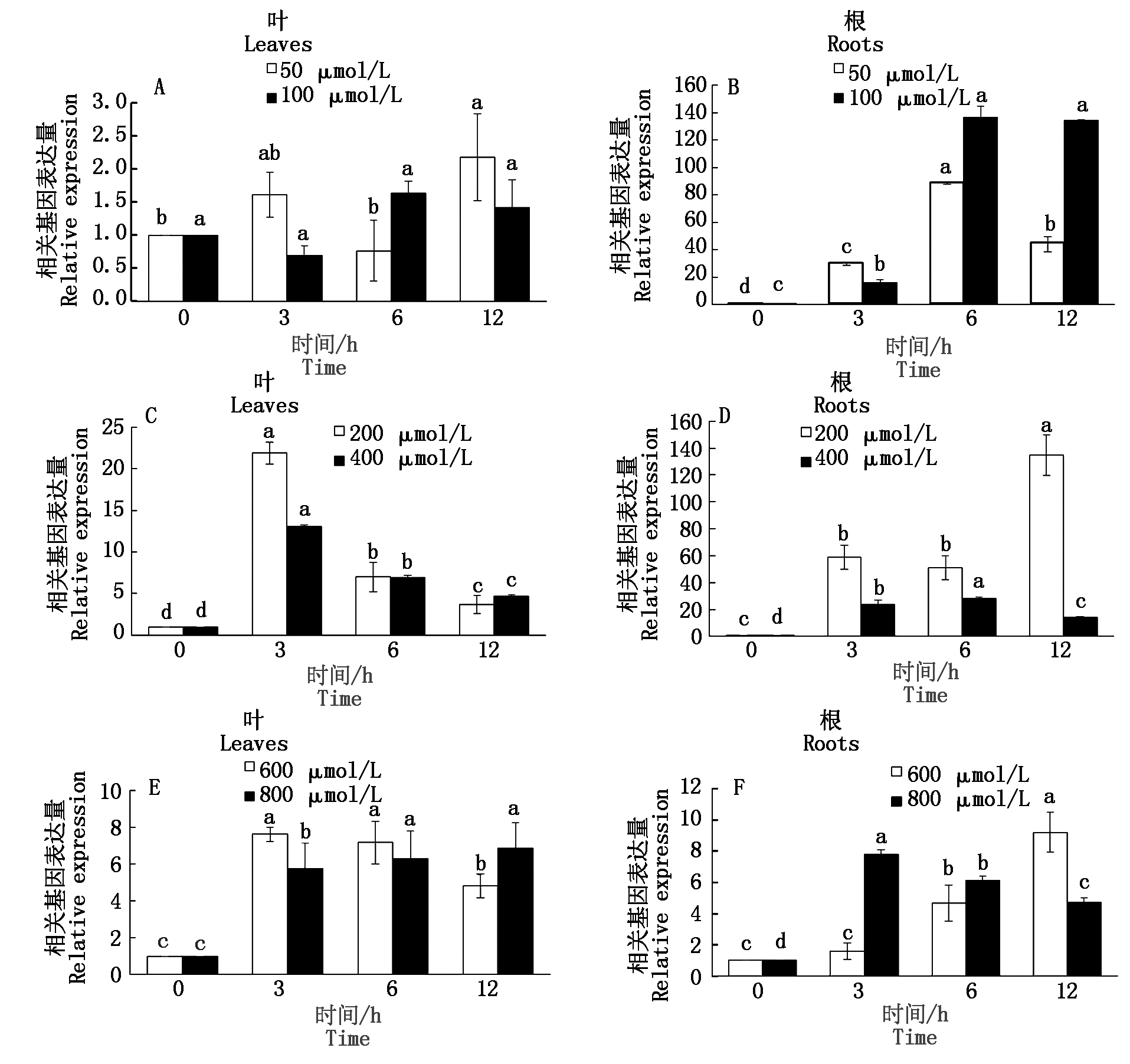
A、B.CdCl2;C、D.CuCl2;E、F.HgSO4。均与同一胁迫处理0 h比对结果,不同小写字母表示显著差异(P<0.05)。
A,B.CdCl2;C,D.CuCl2;E,F.HgSO4.Compared with the results of the same stress treatment for 0 h,lowercase letters indicate significant difference(P<0.05).
图7 3种重金属胁迫下SlWRKY6在番茄根和叶中表达量
Fig.7 Expression of SlWRKY6 in tomato roots and leaves under three heavy metal stresses
本研究表明,SlWRKY6基因在番茄的根茎叶中均有不同程度的表达,老叶中SlWRKY6基因的相对表达量最高,老根次之,与杨明泽[32]、Robatzek等[33]、刘震[34]的研究结果一致,WRKY6基因在植物衰老器官中的表达量会显著上调,推测SlWRKY6基因可能主要在衰老叶中发挥作用。近年来有许多研究发现WRKY转录因子受重金属胁迫诱导表达,AtWRKY13[35]在Cd胁迫下上调表达,AtWRKY12[20]在Cd胁迫下转录水平受到抑制。本研究通过测定SlWRKY6基因在不同浓度重金属处理下的表达水平可知,在CdCl2胁迫下,SlWRKY6基因上调表达,并且根中SlWRKY6基因受CdCl2诱导程度远高于叶,与彭喜旭等[36]、王影等[17]研究结果一致,Cd胁迫下水稻OsWRKY15和东南景天SaWRKY7在根部的受诱导程度都明显高于叶片。研究还发现,当CuCl2胁迫浓度升高时,番茄根和叶中SlWRKY6基因表达水平出现下降的趋势,并且该基因在根中的相对表达量要高于叶片。Liu等[37]研究发现,水稻根中OSLAC基因的表达水平也随着Cu2+浓度的增加而降低。过量的Cu会加速植物体内活性氧的积累,破坏氧化还原平衡导致植物体内氧化应激反应[38]。所以在200 μmol/L CuCl2胁迫下,该基因响应CuCl2胁迫诱导程度最高,并推测SlWRKY6基因可能在番茄根系响应铜胁迫中起重要作用。刘震[34]在研究番茄SpWRKY6基因的功能时也发现该基因响应HgCl2胁迫。HgSO4胁迫下番茄根中SlWRKY6基因相对表达量没有CdCl2和CuCl2胁迫下高,推测与重金属胁迫种类有关。在600 μmol/L HgSO4胁迫下,叶中SlWRKY6基因相对表达量随时间增加显著下调表达,根中该基因表达水平随着时间延长显著上调。而在800 μmol/L HgSO4胁迫下SlWRKY6基因表达水平与600 μmol/L HgSO4胁迫下呈现相反的趋势,Ding等[39]研究发现,根系比叶片更容易吸收Hg2+,并且Hg胁迫会改变植物根系中的抗性蛋白发生变化。推测在HgSO4胁迫激发了番茄根系中抗性蛋白的活性,导致番茄根和叶中SlWRKY6相对表达量出现差异,并且Hg胁迫下根中该基因相对基因表达量低于另外2种重金属。
本试验结果表明,SlWRKY6基因在番茄体内的表达具有组织表达特异性,并且能够响应CdCl2、CuCl2、HgSO4的诱导,推测该基因在番茄抵抗重金属胁迫中扮演重要的角色。本研究为番茄抵抗重金属胁迫提供了新的候选基因。
[1] 王若男,乜兰春,张双双,崔强,贾明飞. 植物抗重金属胁迫研究进展[J]. 园艺学报,2019,46(1):157-170. doi:10.16420/j.issn.0513-353x.2018-0585.
Wang R N,Nie L C,Zhang S S,Cui Q,Jia M F. Research progress on plant resistance to heavy metal stress[J]. Acta Horticulturae Sinica,2019,46(1):157-170.
[2] Lequeux H,Hermans C,Lutts S,Verbruggen N. Response to copper excess in Arabidopsis thaliana:Impact on the root system architecture,hormone distribution,lignin accumulation and mineral profile[J]. Plant Physiology and Biochemistry,2010,48(8):673-682. doi:10.1016/j.plaphy.2010.05.005.
[3] Hippler F W R,Mattos-Jr D,Boaretto R M,Williams L E. Copper excess reduces nitrate uptake by Arabidopsis roots with specific effects on gene expression[J]. Journal of Plant Physiology,2018,228:158-165. doi:10.1016/j.jplph.2018.06.005.
[4] Llorens N,Arola L,Bladé C,Mas A. Effects of copper exposure upon nitrogen metabolism in tissue cultured Vitis vinifera[J]. Plant Science,2000,160(1):159-163. doi:10.1016/s0168-9452(00)00379-4.
[5] Kamal M,Ghaly A E,Mahmoud N,C té R. Phytoaccumulation of heavy metals by aquatic plants[J]. Environment International,2004,29(8):1029-1039. doi:10.1016/S0160-4120(03)00091-6.
té R. Phytoaccumulation of heavy metals by aquatic plants[J]. Environment International,2004,29(8):1029-1039. doi:10.1016/S0160-4120(03)00091-6.
[6] Israr M,Sahi S V. Antioxidative responses to mercury in the cell cultures of Sesbania drummondii[J]. Plant Physiology and Biochemistry,2006,44(10):590-595. doi:10.1016/j.plaphy.2006.09.021.
[7] Cargnelutti D,Tabaldi L A,Spanevello R M,Jucoski G O,Battisti V,Redin M,Linares C E B,Dressler V L,Flores E M M,Nicoloso F T,Morsch V M,Schetinger M R C. Mercury toxicity induces oxidative stress in growing cucumber seedlings[J]. Chemosphere,2006,65(6):999-1006. doi:10.1016/j.chemosphere.2006.03.037.
[8] Muradoglu F,Gundogdu M,Ercisli S,Encu T,Balta F,Jaafar H,Muhammad Z,Zia-UI-Haq M. Cadmium toxicity affects chlorophyll a and b content,antioxidant enzyme activities and mineral nutrient accumulation in strawberry[J]. Biological Research,2015,48(1):11-18. doi:10.1186/s40659-015-0001-3.
[9] 张义凯,崔秀敏,杨守祥,陈秀灵. 外源NO对镉胁迫下番茄活性氧代谢及光合特性的影响[J]. 应用生态学报,2010,21(6):1432-1438.
Zhang Y K,Cui X M,Yang S X,Chen X L. Effects of exogenous nitric oxide on active oxygen metabolism and photosynthetic characteristics of tomato seedlings under cadmium stress[J]. Chinese Journal of Applied Ecology,2010,21(6):1432-1438.
[10] Sethy S K,Ghosh S. Effect of heavy metals on germination of seeds[J]. Journal of Natural Science,Biology and Medicine,2013,4(2):272-275. doi:10.4103/0976-9668.116964.
[11] Chen F,Hu Y,Vannozzi A,Wu K C,Cai H Y,Qin Y,Mullis A,Lin Z G,Zhang L S. The WRKY transcription factor family in model plants and crops[J]. Critical Reviews in Plant Sciences,2017,36(5-6):311-335. doi:10.1080/07352689.2018.1441103.
[12] Huang Y,Feng C Z,Ye Q,Wu W H,Chen Y F. Arabidopsis WRKY6 transcription factor acts as a positive regulator of abscisic acid signaling during seed germination and early seedling development[J]. PLoS Genetics,2016,12(2):751-773. doi:10.1371/journal.pgen.1005833.
[13] Stetter M G,Benz M,Ludewig U. Increased root hair density by loss of WRKY6 in Arabidopsis thaliana[J]. PeerJ,2017,5(5):e2891. doi:10.7717/peerj.2891.
[14] Yan H R,Jia H H,Chen X B,Hao L L,An H L,Guo X Q. The cotton WRKY transcription factor GhWRKY17 functions in drought and salt stress in transgenic Nicotiana benthamiana through ABA signaling and the modulation of reactive oxygen species production[J]. Plant and Cell Physiology,2014,55(12):2060-2076. doi:10.1093/pcp/pcu133.
[15] Li S J,Zhou X,Chen L G,Huang W D,Yu D Q. Functional characterization of Arabidopsis thaliana WRKY39 in heat stress[J]. Molecules and Cells,2010,29(5):475-483. doi:10.1007/s10059-010-0059-2.
[16] Huang L Y,Lin C W,Lee R H,Chiang C Y,Wang Y C,Chang C H,Huang H J. Integrating early transcriptomic responses to rhizotoxins in rice(Oryza sativa L.)reveals key regulators and a potential early biomarker of cadmium toxicity[J]. Frontiers in Plant Science,2017,8:1432-1448. doi:10.3389/fpls.2017.01432.
[17] 王影,邱文敏,李鹤,贺雪莲,刘明英,韩小娇,曲同宝,卓仁英. 东南景天SaWRKY7基因对镉胁迫的响应研究[J]. 南京林业大学学报(自然科学版),2019,43(3):59-66. doi:10.3969/j.issn.1000-2006.201810007.
Wang Y,Qiu W M,Li H,He X L,Liu M Y,Han X J,Qu T B,Zhuo R Y.Research on the response of SaWRKY7 gene to cadmium stress in Sedum alfredii Hance[J]. Journal of Nanjing Forestry University(Natural Sciences Edition),2019,43(3):59-66.
[18] 孟云. 拟南芥WRKY47基因在镉胁迫应答中的作用机理研究[D].合肥:合肥工业大学,2019.
Meng Y. Mechanism by which WRKY47 gene regulating the cadmium stress response in Arabidopsis thaliana[D]. Hefei:Hefei University of Technology,2019.
[19] Yang G Y,Wang C,Wang Y C,Guo Y C,Zhao Y L,Yang C P,Gao C Q. Overexpression of ThVHAc1 and its potential upstream regulator,ThWRKY7,improved plant tolerance of cadmium stress[J]. Scientific Reports,2016,6(1):18752. doi:10.1038/srep18752.
[20] Han Y Y,Fan T T,Zhu X Y,Wu X,Ouyang J,Jiang L,Cao S Q. WRKY12 represses GSH1 expression to negatively regulate cadmium tolerance in Arabidopsis[J]. Plant Molecular Biology,2019,99(1):149-159. doi:10.1007/s11103-018-0809-7.
[21] Kimura S,Sinha N. Tomato(Solanum lycopersicum):a model fruit-bearing crop[J]. Cold Spring Harbor Protocols,2008,2008(12):105-106. doi:10.1101/pdb.emo105.
[22] Huang S X,Gao Y F,Liu J K,Peng X L,Niu X L,Fei Z J,Cao S Q,Liu Y S. Genome-wide analysis of WRKY transcription factors in Solanum lycopersicum[J]. Molecular Genetics and Genomics,2012,287(6):495-513. doi:10.1007/s00438-012-0696-6.
[23] Chen Y F,Li L Q,Xu Q,Kong Y H,Wang H,Wu W H. The WRKY6 transcription factor modulates PHOSPHATE1 expression in response to low Pi stress in Arabidopsis[J]. The Plant Cell,2009,21(11):3554-3566. doi:10.1105/tpc.108.064980.
[24] Huang Y,Feng C Z,Ye Q,Wu W H,Chen Y F. Arabidopsis WRKY6 transcription factor acts as a positive regulator of abscisic acid signaling during seed germination and early seedling development[J]. PLoS Genetics,2016,12(2):e1005833. doi:10.1371/journal.pgen.1005833.
[25] Hwang S H, Yie S W, Hwang D J.Heterologous expression of OsWRKY6 gene in Arabidopsis activates the expression of defense related genes and enhances resistance to pathogens[J]. Plant Science,2011,181(3):316-323. doi:10.1016/j.plantsci.2011.06.007.
[26] 李栋,孙午阳,谷庆宝,彭昌盛. 植物修复及重金属在植物体内形态分析综述[J]. 环境污染与防治,2017,39(11):1256-1263. doi:10.15985/j.cnki.1001-3865.2017.11.020.
Li D,Sun W Y,Gu Q B,Peng C S. Review on the research progress in phytoremediation and speciation analysis of heavy metals in plants[J]. Environmental Pollution & Control,2019,39(11):1256-1263.
[27] Eulgem T,Rushton P J,Robatzek S,Somssich I E. The WRKY superfamily of plant transcription factors[J]. Trends in Plant Science,2000,5(5):199-206. doi:10.1016/s1360-1385(00)01600-9.
[28] Huang Y,Li M Y,Wu P,Xu Z S,Que F,Wang F,Xiong A S. Members of WRKY Group Ⅲ transcription factors are important in TYLCV defense signaling pathway in tomato(Solanum lycopersicum)[J]. BMC Genomics,2016,17(1):788-806. doi:10.1186/s12864-016-3123-2.
[29] 陈青奇,张红,姜景彬,李景富. 番茄部分WRKY基因非生物胁迫表达和SlWRKY50基因沉默分析[J]. 东北农业大学学报,2018,49(7):8-18. doi:10.3969/j.issn.1005-9369.2018.07.002.
Chen Q Q,Zhang H,Jiang J B,Li J F. Partial WRKY genes expression under non-biological stress and analysis of SlWRKY50 gene silencing in tomato[J]. Journal of Northeast Agricultural University,2018,49(7):8-18.
[30] 孙晓春,高永峰,李会容,杨述章,刘永胜. 番茄SlWRKY23基因的克隆及其抗病性和耐盐性分析[J]. 中国农业科技导报,2014,16(5):39-46. doi:10.13304/j.nykjdb.2014.459.
Sun X C,Gao Y F,Li H R,Yang S Z,Liu Y S. Cloning,disease resistance and salt tolerance analysis of SlWRKY23 in tomato[J]. Journal of Agricultural Science and Technology,2014,16(5):39-46.
[31] Sun X C,Gao Y F,Li H R,Yang S Z,Liu Y S. Over-expression of SlWRKY39 leads to enhanced resistance to multiple stress factors in tomato[J]. Journal of Plant Biology,2015,58(1):52-60. doi:10.1007/s12374-014-0407-4.
[32] 杨明泽. 番茄ShWRKY6基因的抗逆功能研究[D]. 武汉:华中农业大学,2015.doi:10.7666/d.Y2803392.
Yang M Z.Analysis of resistant function of ShWRKY6 in tomato[D]. Wuhan:Huazhong Agricultural University,2015.
[33] Robatzek S,Somssich I E. Targets of AtWRKY6 regulation during plant senescence and pathogen defense[J]. Genes & Development,2002,16(9):1139-1149. doi:10.1101/gad.222702.
[34] 刘震. 番茄SpWRKY6转录因子的抗病功能研究[D]. 大连:大连理工大学,2016.
Liu Z. Functional analysis of tomato SpWRKY6 transcription factor in disease resistance[D].Dalian:Dalian University of Technology,2016.
[35] Sheng Y B,Yan X X,Huang Y,Han Y Y,Cheng Z,Ren Y B,Fan T T,Xiao F M,Liu Y S,Cao S Q. The WRKY transcription factor,WRKY13,activates PDR8 expression to positively regulate cadmium tolerance in Arabidopsis[J]. Plant,Cell & Environment,2018,42(3):891-903. doi:10.1111/pce.13457.
[36] 彭喜旭,白宁宁,王海华. 响应镉胁迫的水稻WRKY15转录因子基因的分离与表达特征[J]. 中国水稻科学,2018,32(2):103-110. doi:10.16819/j.1001-7216.2018.7056.
Peng X X,Bai N N,Wang H H. Isolation and expression profiles of cadmium stress-responsive rice WRKY15 transcription factor gene[J]. Chinese Journal of Rice Science,2018,32(2):103-110.
[37] Liu Q Q,Luo L,Wang X X,Shen Z G,Zheng L Q. Comprehensive analysis of rice laccase gene(OsLAC)family and ectopic expression of OsLAC10 enhances tolerance to copper stress in Arabidopsis[J]. International Journal of Molecular Sciences,2017,18(2):209-215. doi:10.3390/ijms18020209.
[38] Li M J,Xu G Y,Xia X J,Wang M L,Yin X M,Zhang B,Zhang X,Cui Y C. Deciphering the physiological and molecular mechanisms for copper tolerance in autotetraploid Arabidopsis[J]. Plant Cell Report,2017,36(10):1585-1597. doi:10.1007/s00299-017-2176-2.
[39] Ding W,Zhang J,Wu S C,Zhang S,Christie P,Liang P. Responses of the grass Paspalum distichum L. to Hg stress:aproteomic study[J]. Ecotoxicology and Environmental Safety,2019,183:109549. doi:10.1016/j.ecoenv.2019.109549.
