随着人们生活质量的提高和对食品营养保健功能认识的加强,我国食用植物油的需求不断增加[1],油菜是我国重要的油料和经济作物之一,菜籽油不仅富含人体所必需的氨基酸和脂肪酸,而且能较长时间地储存[2],为了更好地满足广大人民对优质食用植物油的需求,菜籽油品质改良已成为当前油菜育种领域的热点。
菜籽油的主要成分是脂肪酸,油脂的优劣由脂肪酸决定,而油脂脂肪酸的好坏则主要取决于其碳氢链饱和程度。脂肪酸根据碳氢链饱和与不饱和分为3类:饱和脂肪酸(主要有棕榈酸、硬脂酸等)、单不饱和脂肪酸(油酸、芥酸等)和多不饱和脂肪酸(亚油酸、亚麻酸等)[1],有研究表明,预防冠心病的指导方针集中在将饮食中的饱和脂肪和反式脂肪转变为不饱和脂肪[3],饱和脂肪酸熔点较高,易凝固在血管壁上,从而导致高血压和动脉粥样硬化,且饱和脂肪酸还导致血胆固醇浓度上升[4],不饱和脂肪酸熔点较低,容易被人体吸收。
本研究以湖南省水稻油菜抗病重点实验室前期对高亚麻酸甘蓝型油菜(Brassica napus)近等基因系进行的miRNA测序结果为基础,筛选到的与脂肪酸代谢相关的bna-miR396及其靶基因乙酰转移酶基因(Acetyltransferase gene,AT)[5]。研究表明,AT通过催化乙酰基团从乙酰辅酶A(乙酰CoA,Acetyl-CoA)转移到其作用底物芳香胺及杂环胺类物质上,参与脂肪酸转化与降解,AT缺失会推迟植物开花时间并降低育性[6-7]。利用同源基因克隆,得到AT基因的2个拷贝,分别构建过表达载体与干扰载体,转化拟南芥,分析转基因拟南芥后代种子脂肪酸组成,探究该基因在脂肪酸合成过程的功能,以期促进甘蓝型油菜脂肪酸合成分子机理研究。
1 材料和方法
1.1 试验材料
高亚麻酸甘蓝型油菜近等基因系(低亚麻酸株系575,亚麻酸含量为5.1%;高亚麻酸株系574,亚麻酸含量9.8%),野生型拟南芥(WT)由湖南农业大学国家油料改良中心提供。大肠杆菌感受态DH5α,限制性内切酶、dNTP、T4 DNA Ligation Kit购自北京擎科生物科技有限公司;pMD18-T载体由本实验室保存;pCambia1300-35s-N1、pCambia1300-RNAi载体购于上海康颜生物科技有限公司;本试验中所用到的引物均由北京擎科合成。
1.2 AT基因克隆
利用TAIR(https://www.arabidopsis.org)和Brassica Database(http://brassicadb.org/brad/)数据库进行检索,发现AT基因有2个拷贝,分别在A基因组和C基因组,并以此序列(GSBRNA2T00114025001、GSBRNA2T00148464001)进行后续引物设计(表1),其中5′端酶切位点前的序列用于重组连接。
采用TransZol UP植物总RNA提取试剂盒(北京全式金)提取低亚麻酸甘蓝型油菜株系575自交授粉后20~35 d混合种子总RNA,并用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒(北京全式金)合成cDNA第一链,以此为模板,进行PCR扩增,扩增体系包含KOD-FX聚合酶 1 μL,2×PCR Buffer 25 μL,dNTP(2.5 μmol/L) 10 μL,正反向引物各0.2 μmol/L,cDNA小于500 ng,用ddH2O补足至50 μL。反应条件为98 ℃ 2 min预变性;98 ℃ 10 s,60 ℃ 30 s,68 ℃ 2 min,35个循环;68 ℃ 7 min延伸。
经PCR纯化回收后,与pMD18-T载体相连,转化到大肠杆菌中,由北京擎科公司进行测序。
表1 与脂肪酸代谢相关的miRNA及其靶基因
Tab.1 miRNA and its target genes related to fatty acid metabolism

名称Name靶标ID(简写)TargetID(Shorthand)靶标名称Targetname引物名称Primername引物序列(5′-3′)Primersequence(5′-3′)bna-miR396GSBRNA2T00114025001(114)乙酰转移酶(AT)114BamHⅠ-FTCTGATCAAGAGACAGGATCCATGAATTCTTCACCATCAGTG114SalⅠ-RCATCGGTGCACTAGTGTCGACTCAAAAATAAACAAGAGACATGGSBRNA2T00148464001(148)148BamHⅠ-FTCTGATCAAGAGACAGGATCCATGAATTCTTCTTCATCAGTA148SalⅠ-RCATCGGTGCACTAGTGTCGACTCAAATAGAAACAAGAGACA
注:下划线表示酶切位点。表2同。
Note:The underline indicates the restriction site. The same as Tab.2.
1.3 生物信息学分析
用SnapGene 3.2.1将克隆到的靶基因序列翻译成氨基酸,经NCBI数据库BlastP进行鉴定后,登录ExPASy-ProtParam tool网站,预测对应蛋白的一级结构,包括氨基酸组成、理化性质等;分别登录PredictProtein、SOPMA、TMHMM网站进行蛋白亚细胞定位预测、结构预测、跨膜螺旋区分析;通过SWISS-MODEL构建蛋白三级结构模型。
1.4 AT基因干扰片段的扩增
根据甘蓝型油菜数据库获得AT基因全长序列,选择长度为300 bp特异序列设计引物(表2),以合成的cDNA为模板进行高保真扩增,反应体系与1.2克隆体系相同,反应条件为98 ℃ 2 min预变性;98 ℃ 10 s,60 ℃ 30 s,68 ℃ 30 s,35个循环;68 ℃ 7 min延伸。经PCR纯化回收后,与pMD18-T载体相连,转化到大肠杆菌中,由北京擎科公司进行测序。
表2 RNAi干扰引物
Tab.2 RNAi interference primers

基因名称Genename引物名称Primername引物序列(5′-3′)Primersequence(5′-3′)148148Ri-PBFAGTCTCTCTGCAGGGATCCAAGGTATCTCAGATGATTG148Ri-SXRTTTCCAGGTCGACTCTAGAAATAGAAACAAGAGACATG114114Ri-PBFAGTCTCTCTGCAGGGATCCAAGGTAACTCAAATGATTG114Ri-SXRTTTCCAGGTCGACTCTAGAAAAATAAACAAGAGACATG
1.5 过表达载体与RNAi干扰载体构建
用BamHⅠ和SalⅠ双酶切pCambia1300-35s-N1载体,胶回收,产物进行体外同源重组反应,获得重组质粒。
用XbaⅠ及BamHⅠ双酶切pCambia1300-RNAi载体以及各个基因的RNAi片段的PCR产物,具体方法参考刘芳等[8],并进行改进,胶回收后进行连接,获得重组质粒。测序检验正确后,用PstⅠ和SalⅠ双酶切重组质粒及各个基因的RNAi片段的PCR产物,再次进行连接,转化,获得最终的RNAi载体。
将构建好的过表达载体与RNAi干扰载体转入农杆菌中,以野生型拟南芥为受体,进行基因转化,获得T0种子;用潮霉素筛选T0拟南芥阳性苗并种植,之后,用PCR鉴定转基因苗,收取得到T1种子。
1.6 脂肪酸成分测定
采用SP-6890型气相色谱仪、FID检测器、N3000色谱工作站、毛细管色谱柱DB-23对转基因拟南芥T1种子进行脂肪酸成分测定[9],对7个主要的脂肪酸成分进行分析,测定时取5个转基因后代株系,每个材料检测约30粒种子。
2 结果与分析
2.1 靶基因与特异干扰片段克隆及检测结果
以低亚麻酸甘蓝型油菜20~35 d自交种cDNA为模板,高保真扩增了乙酰转移酶基因的2个拷贝,大小均为1 350 bp。分别对2个靶基因特异片段进行PCR高保真扩增,得到了目的片段长度大小的DNA片段。
2.2 生物信息学分析
2.2.1 蛋白质一级结构预测与分析 以SnapGene 3.2.1分别对AT基因翻译出来的氨基酸序列,通过ExPASy-ProtParam tool进行理化性质分析表明(表3),AT基因的2个拷贝114与148氨基酸均为449个,分子量约50.5 ku,114编码的氨基酸偏中性而148编码的蛋白偏碱性。不稳定系数显示114与148均为稳定蛋白,且亲水性较差,属于脂溶性蛋白。
表3 AT基因编码蛋白一级结构理化性质分析
Tab.3 Analysis of the physical and chemical properties of the primary structure of the protein encoded by the AT gene

一级结构理化性质Physicalandchemicalpropertiesofprimarystructures114148氨基酸数目/个Numberofaminoacids449449分子量/kuMolecularweight50.5950.55等电点TheoreticalpI6.868.19正电荷残基(Arg+Lys)Totalnumberofpositivelychargedresidues4647负电荷残基(Asp+Glu)Totalnumberofnegativelychargedresidues4744不稳定系数Instabilityindex37.2942.17脂肪系数Aliphaticindex85.5779.71平均亲水性Grandaverageofhydropathicity(GRAVY)-0.089-0.202
2.2.2 蛋白质二级结构预测与分析 通过在线PredictProtein软件对AT基因不同拷贝编码的蛋白质进行亚细胞定位发现2个蛋白均定位在细胞质;TMHMM跨膜螺旋区分析表明,2个蛋白均为膜外蛋白,无跨膜结构。SOPMA结构预测表明,AT蛋白中,无规则卷曲占比最高,均在43%左右,其次为α-螺旋,约占35%,延伸链约占18%,β-转角约占4%,两蛋白有一定差异(表4)。
2.2.3 蛋白质三级结构预测与分析 经SWISS-MODEL同源建模发现,114、148均适应酰基转移酶模型,但其构象略不同(图1,2)。
表4 AT蛋白二级结构预测
Tab.4 Prediction of secondary structure of AT proteins
%
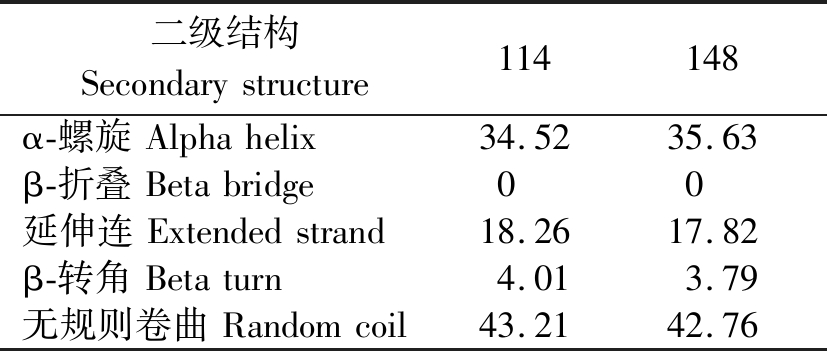
二级结构Secondarystructure114148α-螺旋Alphahelix34.5235.63β-折叠Betabridge00延伸连Extendedstrand18.2617.82β-转角Betaturn4.013.79无规则卷曲Randomcoil43.2142.76
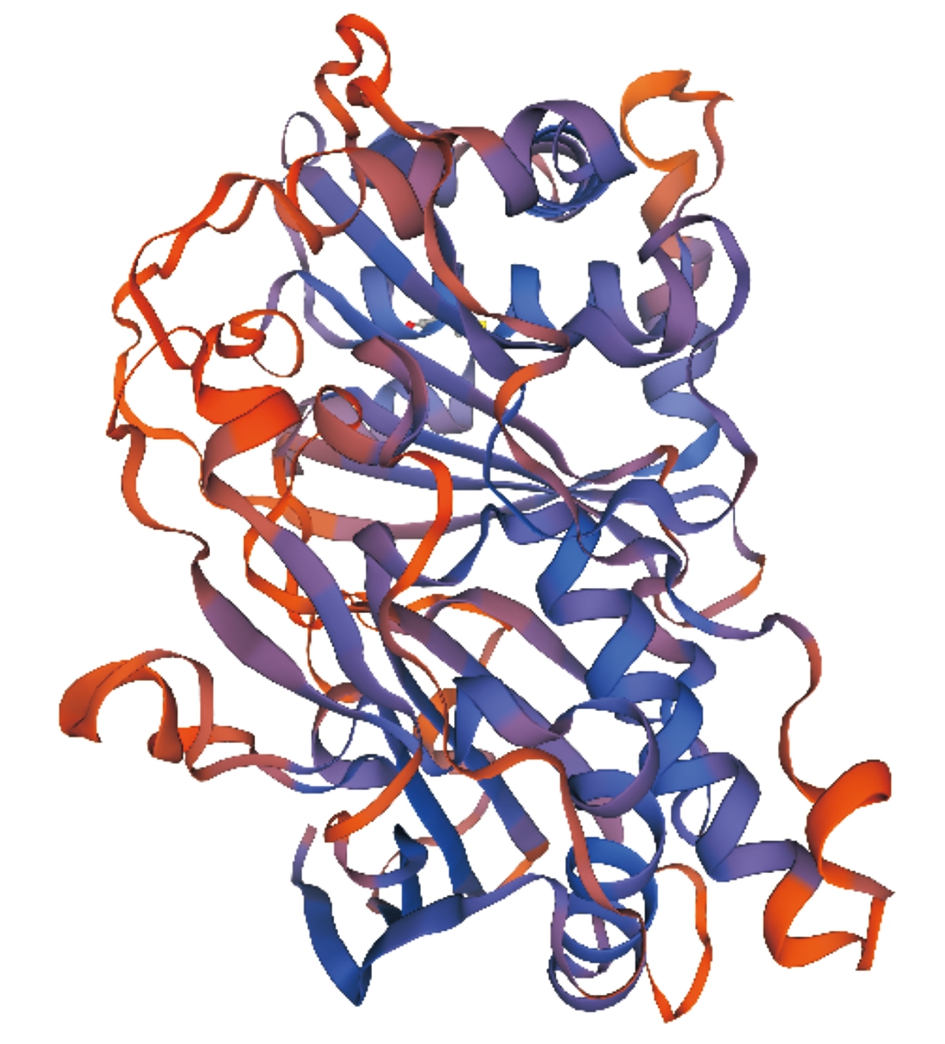
图1 114蛋白三级结构
Fig.1 114 protein tertiary structure
2.3 过表达与RNAi干扰重组质粒图谱
AT基因的2个拷贝114与148过表达重组质粒见图3-A。AT基因的2个拷贝114与148 RNAi重组质粒见图3-B。
2.4 转基因拟南芥检测
经潮霉素筛选T0转基因拟南芥种子后(图4),对T1进行pCambia1300-35s-114、pCambia1300-RNAi-114、pCambia1300-35s-148及pCambia1300-RNAi-148载体潮霉素鉴定,结果表明(图5),目的质粒T-DNA均已插入拟南芥基因组,表明拟南芥转基因成功。
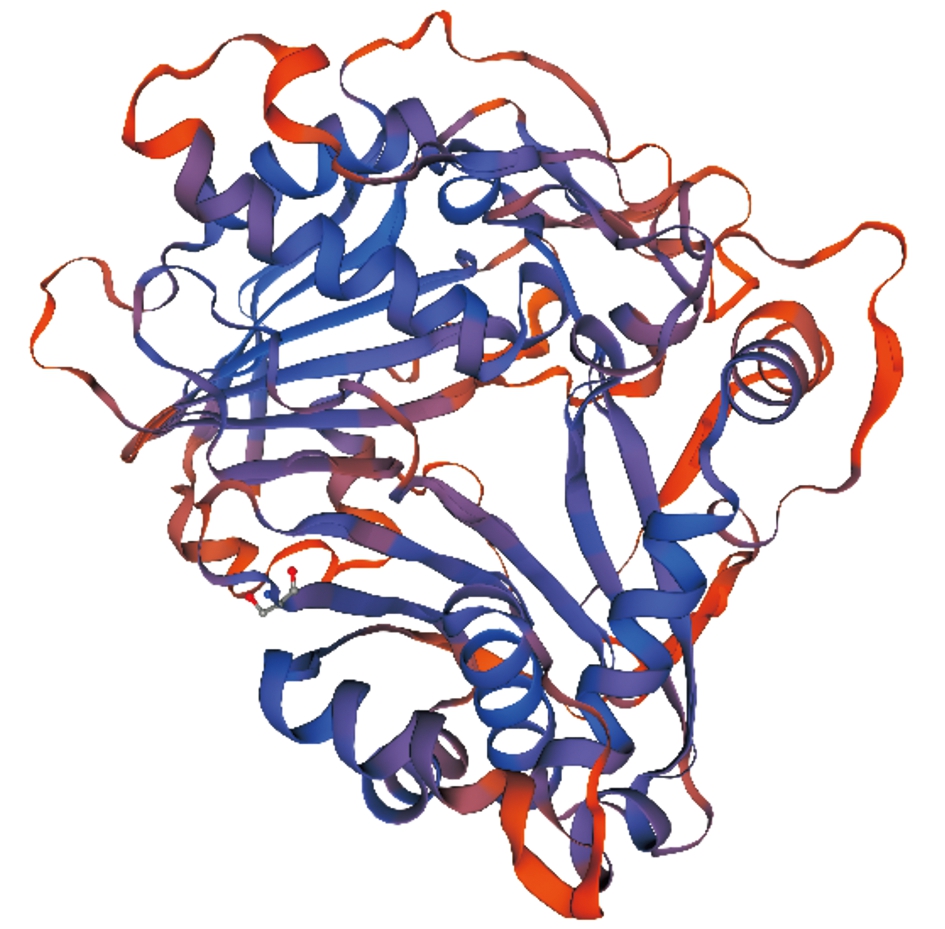
图2 148蛋白三级结构
Fig.2 148 protein tertiary structure
2.5 转基因株系种子中脂肪酸成分分析
2.5.1 转114基因T1种子脂肪酸成分分析 分别收集野生型拟南芥(对照)、114基因过表达(35s-114)与RNAi干扰(114R)转基因T1种子,烘干后用气相色谱仪测定各脂肪酸含量,用Excel 2019单因素方差分析法分析各个脂肪酸成分,结果见表5。

A.114与148过表达载体;B.114与148 RNAi载体。
A.Overexpression vectors of 114 and 148;B.RNAi vector of 114 and 148.
图3 重组质粒图谱
Fig.3 Recombinant plasmid map
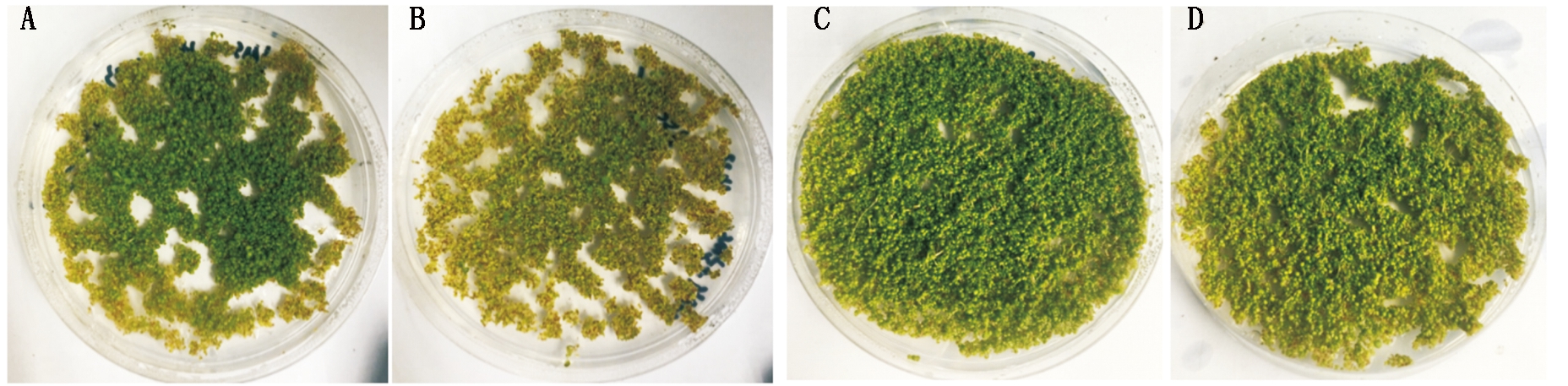
A.35s-114;B.114R;C.35s-148;D.148R。
图4 转基因拟南芥潮霉素筛选
Fig.4 Screening of transgenic Arabidopsis thaliana hygromycin

M.DL2000;P.pCambia1300-35s;A.L1-L10∶114过表达转基因植株;B.R1-R11∶114 RNAi转基因株系;C.L1-L11∶148过表达转基因植株;D.R1-R11∶148 RNAi转基因株系。
M.DL2000;P. pCambia1300-35s;A.L1-L10∶114 overexpressed transgenic plants;B.R1-R11∶114 RNAi transgenic strain;C.L1-L10∶148 overexpressed transgenic plants;D.R1-R11∶148 RNAi transgenic strain.
图5 转基因拟南芥潮霉素鉴定
Fig.5 Identification of hygromycin in transgenic Arabidopsis thaliana
表5 转114基因T1种子脂肪酸成分分析
Tab.5 Fatty acid composition analysis of T1 seeds of trans 114 genes
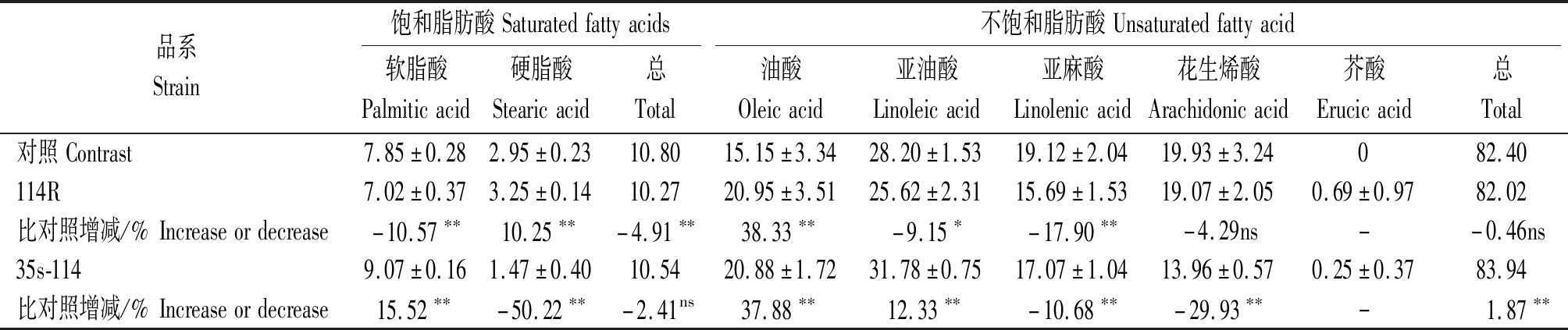
品系Strain饱和脂肪酸Saturatedfattyacids不饱和脂肪酸Unsaturatedfattyacid软脂酸Palmiticacid硬脂酸Stearicacid总Total油酸Oleicacid亚油酸Linoleicacid亚麻酸Linolenicacid花生烯酸Arachidonicacid芥酸Erucicacid总Total对照Contrast7.85±0.282.95±0.2310.8015.15±3.3428.20±1.5319.12±2.0419.93±3.24082.40114R7.02±0.373.25±0.1410.2720.95±3.5125.62±2.3115.69±1.5319.07±2.050.69±0.9782.02比对照增减/%Increaseordecrease-10.57∗∗10.25∗∗-4.91∗∗38.33∗∗-9.15∗-17.90∗∗-4.29ns--0.46ns35s-1149.07±0.161.47±0.4010.5420.88±1.7231.78±0.7517.07±1.0413.96±0.570.25±0.3783.94比对照增减/%Increaseordecrease15.52∗∗-50.22∗∗-2.41ns37.88∗∗12.33∗∗-10.68∗∗-29.93∗∗-1.87∗∗
注:*.P< 0.05;**.0.01<P<0.05;ns.P>0.05。表6-7同。
Note:*.P< 0.05;** .0.01<P<0.05;ns. P>0.05.The same as Tab.6-7.
由表5可知,与野生型拟南芥种子脂肪酸各成分相比,干扰114基因(114R)表达会导致硬脂酸和油酸含量极显著的增加,增加幅度分别为10.25%,38.33%,而软脂酸和亚麻酸是极显著的减少,减少幅度分别为10.57%,17.90%,显著减少亚油酸的含量,花生烯酸的含量也有减少,但是差异不显著;过表达114基因(35s-114)会导致软脂酸、油酸和亚油酸含量的显著增加,增加幅度分别达到15.52%,37.88%,12.33%,而硬脂酸、亚麻酸和花生烯酸含量达到极显著的减少,幅度分别为50.22%,10.86%,29.93%。
在对饱和脂肪酸与不饱和脂肪酸分析中,干扰114基因会使饱和脂肪酸含量下降,对不饱和脂肪酸无显著影响;过表达114基因会增加不饱和脂肪酸的含量,而对饱和脂肪酸无显著影响。
2.5.2 转148基因T1种子脂肪酸成分分析 分别收集野生型拟南芥(对照)、148基因过表达(35s-148)与RNAi干扰(148R)转基因T1种子,烘干后用气相色谱仪测定各脂肪酸含量,用Excel 2019单因素方差分析法分析各个脂肪酸成分,结果见表6。
表6 转148基因T1种子脂肪酸成分分析
Tab.6 Fatty acid composition analysis of T1 seeds of trans 148 genes
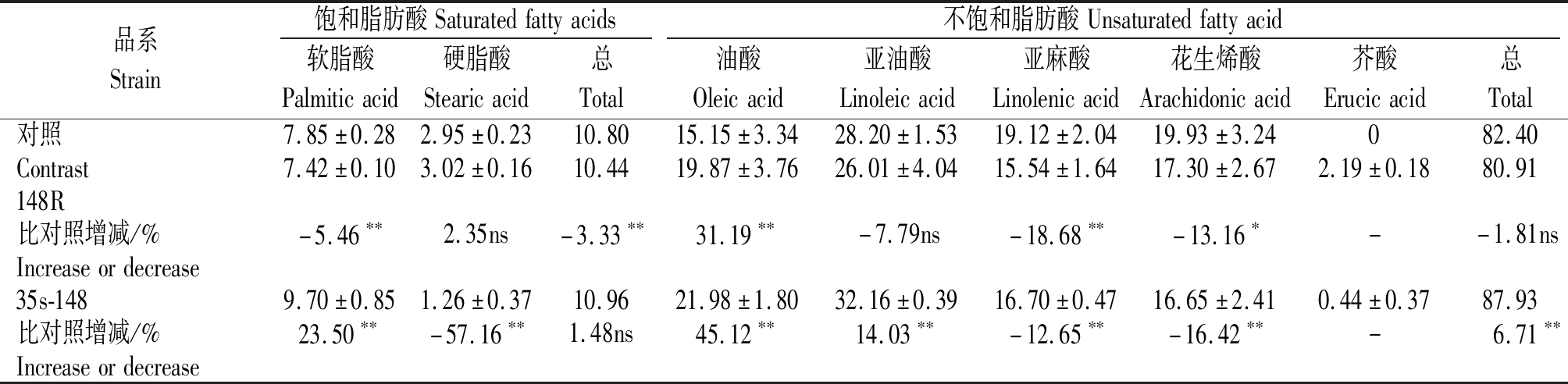
品系Strain饱和脂肪酸Saturatedfattyacids不饱和脂肪酸Unsaturatedfattyacid软脂酸Palmiticacid硬脂酸Stearicacid总Total油酸Oleicacid亚油酸Linoleicacid亚麻酸Linolenicacid花生烯酸Arachidonicacid芥酸Erucicacid总Total对照7.85±0.282.95±0.2310.8015.15±3.3428.20±1.5319.12±2.0419.93±3.24082.40Contrast7.42±0.103.02±0.1610.4419.87±3.7626.01±4.0415.54±1.6417.30±2.672.19±0.1880.91148R比对照增减/%-5.46∗∗2.35ns-3.33∗∗31.19∗∗-7.79ns-18.68∗∗-13.16∗--1.81nsIncreaseordecrease35s-1489.70±0.851.26±0.3710.9621.98±1.8032.16±0.3916.70±0.4716.65±2.410.44±0.3787.93比对照增减/%23.50∗∗-57.16∗∗1.48ns45.12∗∗14.03∗∗-12.65∗∗-16.42∗∗-6.71∗∗Increaseordecrease
由表6可知,与野生型拟南芥种子脂肪酸各成分相比,干扰148基因(148R)会导致油酸含量增加,幅度为31.19%,而软脂酸、亚麻酸会极显著减少,而花生烯酸含量显著减少,减少幅度分别为5.46%,18.68%,13.16%,并使硬脂酸增加,亚油酸和芥酸减少,但是增减幅度没有达到显著水平,干扰148基因还会导致芥酸含量增加;过表达148基因(35s-148)会导致软脂酸、油酸、亚油酸含量的极显著增加,其增加幅度分别为23.50%,45.12%,14.03%,而硬脂酸、亚麻酸和花生烯酸的含量与野生型拟南芥相比,都有极显著的下降。
在对饱和脂肪酸与不饱和脂肪酸分析中,干扰148基因会使饱和脂肪酸含量下降,对不饱和脂肪酸无显著影响;过表达148基因会显著增加不饱和脂肪酸的含量,而对饱和脂肪酸无显著影响。
2.5.3 对具有相同变化趋势的脂肪酸成分进行分析 结合表5,6,选取在2个拷贝基因的过表达与干扰体系中,脂肪酸成分具有相同变化趋势的油酸、亚麻酸、花生烯酸和芥酸,并进行方差分析,结果见表7。
表7 过表达与干扰体系间方差分析
Tab.7 Analysis of variance between overexpression and interference systems
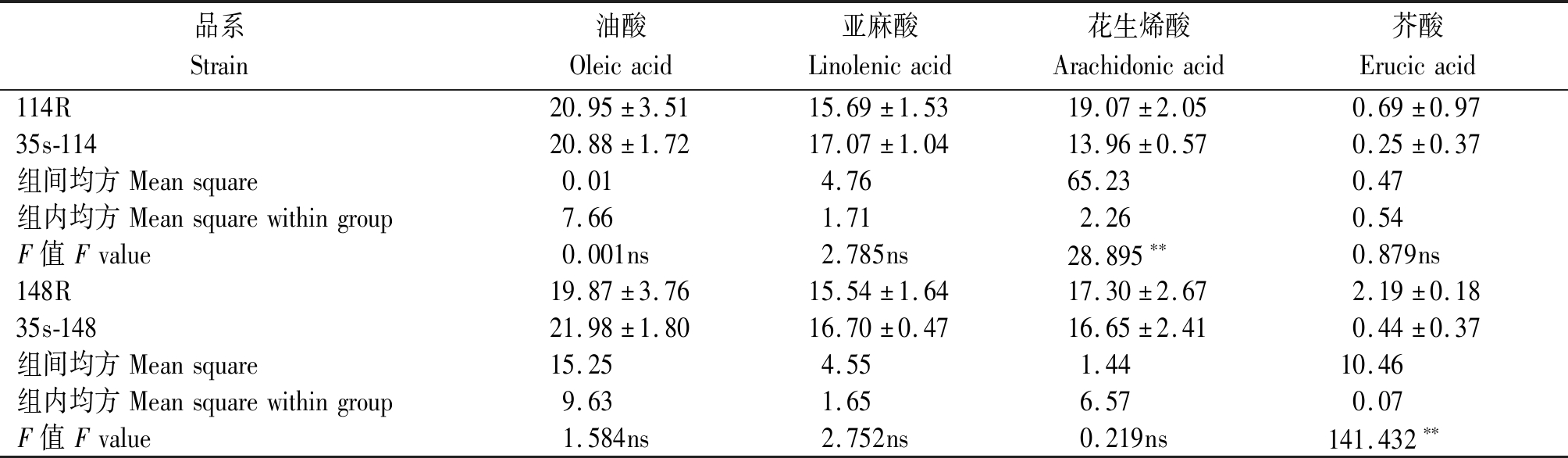
品系 Strain 油酸Oleicacid亚麻酸Linolenicacid花生烯酸Arachidonicacid芥酸Erucicacid114R20.95±3.5115.69±1.5319.07±2.050.69±0.9735s-11420.88±1.7217.07±1.0413.96±0.570.25±0.37组间均方Meansquare0.014.7665.230.47组内均方Meansquarewithingroup7.661.712.260.54F值Fvalue0.001ns2.785ns28.895∗∗0.879ns148R19.87±3.7615.54±1.6417.30±2.672.19±0.1835s-14821.98±1.8016.70±0.4716.65±2.410.44±0.37组间均方Meansquare15.254.551.4410.46组内均方Meansquarewithingroup9.631.656.570.07F值Fvalue1.584ns2.752ns0.219ns141.432∗∗
结果显示,过表达114基因会导致花生烯酸极显著的下降,而对其他脂肪酸含量无显著影响;干扰148基因会导致芥酸含量的极显著增加,而对其他脂肪酸成分无显著影响。
3 讨论与结论
棕榈酸是游离脂肪酸中最主要的饱和脂肪酸,能够诱导肝细胞、骨骼肌和心肌细胞等发生胰岛素抵抗[10-12],硬脂酸是自然界广泛存在的一种脂肪酸,在动物脂肪中的含量较高,植物油中含量较少,主要应用于橡胶和化妆品工业,人若长期微量摄入可能会刺激眼睛、呼吸系统。油酸是人体最易消化吸收的脂肪酸,高油酸具有降低人体血液中有害的低密度脂,同时可减少血浆中脂蛋白胆固醇含量[13],有效的预防及治疗动脉的硬化[14]。亚油酸是一种人体必需脂肪酸,在机体内含量极为丰富,具有降血脂、降血压、防止动脉硬化,还参与了人体物质循环和免疫调节[15]。α-亚麻酸是二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)的前体物质,EPA和DHA在视网膜和大脑的结构膜中也起重要作用[16-17],亚麻酸还具有抗动脉粥样硬化、预防心脑血管疾病及减肥、降血脂等生理功能[16,18]。花生四烯酸具有增加血管弹性、酯化胆固醇,调节血细胞功能等一系列生理活性,对预防心血管疾病、糖尿病和肿瘤等具有重要功效[19]。花生四烯酸及其代谢产物还参与了人体造血和免疫调节[20],花生四烯酸降低血液中胆固醇的效果是亚油酸和亚麻酸的4倍,其降低血液中血脂和血压的能力也要强于亚油酸和亚麻酸[21-22]。芥酸在人体内不易被消化吸收,而且芥酸凝固点高,不适于食品加工[23]。高芥酸的油菜籽饼粕需经过脱毒处理才能用作动物饲料,因此,降低芥酸含量是油菜食用目的脂肪酸改良的首要任务[24]。
在西方饮食中,棕榈酸(C16∶0)和硬脂酸(C18∶0)是最常食用得饱和脂肪酸[25]。一般认为棕榈酸比硬脂酸更能提高胆固醇[26-28],世界卫生组织(WHO)与联合国粮农组织(FAO)曾建议食用油中饱和脂肪酸∶单不饱和脂肪酸∶多不饱和脂肪酸=1∶1∶1[29]。熊秋芳等[1]分析认为,在亚麻酸质量分数不低于5%的前提下,饱和脂肪酸含量越低、油酸含量越高、且ω-6与ω-3比例为1~4∶1的天然食用植物油品最具营养价值。
拟南芥作为模式植物,并与甘蓝型油菜同属于芸薹属十字花科且有着共同的原始祖先,开展拟南芥研究可为甘蓝型油菜研究提供重要参考与借鉴[30-31]。
本研究对克隆得到的AT基因的2个拷贝进行生物信息学分析,发现114与148同属于酰基转移酶模型,但其构象略有不同,推测其在甘蓝型油菜中发生了序列变异,将进一步研究;脂肪酸组成分析表明,乙酰转移酶基因的这2个拷贝在饱和脂肪酸的代谢过程中具有相同的功能,过表达114基因与148基因均会导致软脂酸含量的增加,硬脂酸含量的减少,干扰114基因与148基因均会导致软脂酸含量的减少,硬脂酸含量增加,表明在软脂酸向硬脂酸合成过程中发挥抑制作用,抑制这2个拷贝表达,可以促进软脂酸向硬脂酸转化;这2个拷贝在不饱和脂肪酸代谢过程中存在差异,过表达114基因和148基因均会引起亚油酸含量的增加,而通过分析其他几个具有相同变化趋势的脂肪酸成分后,发现可以通过过表达114基因,可以使花生烯酸含量显著下降,干扰148基因的表达会导致芥酸含量的增加。这2个拷贝可以促进菜籽油品质改良。
本研究以前期对高亚麻酸油菜近等基因系材料miRNA测序结果为基础,同源克隆获得了AT基因的2个拷贝114与148(均为1 350 bp),分别构建了这2个基因的过表达载体和RNAi干扰载体并成功转化拟南芥。生物信息学分析表明,114编码的蛋白偏中性而148编码的蛋白偏碱性,114与148均为稳定蛋白,亲水性差,属于脂溶性蛋白,且定位在细胞质,无跨膜结构。114基因与148基因在脂肪酸代谢途径中,抑制软脂酸向硬脂酸转化。过表达114基因和与148基因可以提高不饱和脂肪酸含量,抑制这2个拷贝基因会导致饱和脂肪酸含量的增加;过表达114基因可以显著增加软脂酸、油酸和亚油酸的含量,并减少硬脂酸、亚麻酸和花生烯酸的含量,干扰114基因的表达可以增加硬脂酸和油酸的含量,减少软脂酸、亚油酸和亚麻酸的含量;过表达148基因可以增加软脂酸、油酸和亚油酸的含量,减少硬脂酸、亚麻酸和花生烯酸的含量,而干扰148基因会导致油酸、花生烯酸以及芥酸含量的增加,软脂酸、亚油酸和亚麻酸含量的减少;可以通过过表达114基因,促使花生烯酸含量的下降,干扰148基因的表达会导致芥酸含量的增加。因此,乙酰转移酶基因这2个拷贝对改良甘蓝型油菜脂肪酸成分作用明显。
[1] 熊秋芳,张效明,文静,李兴华,傅廷栋,沈金雄. 菜籽油与不同食用植物油营养品质的比较——兼论油菜品质的遗传改良[J]. 中国粮油学报,2014,29(6):122-128.
Xiong Q F,Zhang X M,Wen J,Li X H,Fu T D,Shen J X. Comparation of nutritional values between rapeseed oil and several other edible vegetable oils-Discussion of rapeseed quality genetic improvement[J]. Journal of the Chinese Cereals and Oils Association,2014,29(6):122-128.
[2] 刘睿洋,刘芳,张振乾,官春云. 甘蓝型油菜BnFAD2-C5基因启动子及内含子在表达水平的功能分析[J].作物学报,2016,42(10):1471-1478.doi:10.3724/SP.J.1006.2016.01471.
Liu R Y,Liu F,Zhang Z Q,Guan C Y. Functional analysis of BnFAD2-C5 promoter and intron at expression level in Brassica napus[J]. Acta Agronomica Sinica,2016,42(10):1471-1478.
[3] Listed N. Fats and fatty acids in human nutrition. Report of an expert consultation[J]. FAO Food and Nutrition Paper,2010,91:1.
[4] 刘丽莉,杨协立,张仲欣. 低胆固醇发酵肉制品的研究与开发[J]. 食品科学,2005,26(9):632-636.doi:10.3321/j.issn:1002-6630.2005.09.171 .
Liu L L,Yang X L,Zhang Z X. Research and development on the low cholesterol of fermented meat products[J]. Food Science,2005,26(9):632-636.
[5] 王晓丹,肖钢,张振乾,官春云. 高油酸油菜脂肪酸代谢相关微效基因筛选及验证[J]. 农业生物技术学报,2019,27(7):1171-1178.doi:10.3969/j.issn.1674-7968.2019.07.004.
Wang X D,Xiao G,Zhang Z Q,Guan C Y. Screening and verification of minor genes related to fatty acid metabolism in high oleic acid rapeseed(Brassica napus)[J]. Journal of Agricultural Biotechnology,2019,27(7):1171-1178.
[6] 夏德安,刘春娟,吕世博,张彦妮,刘奕佳,马旭俊. 植物组蛋白乙酰基转移酶的研究进展[J]. 生物技术通报,2015,31(7):18-25. doi:10.13560/j.cnki.biotech.bull.1985.2015.07.003.
Xia D A,Liu C J,Lü S B,Zhang Y N,Liu Y J,Ma X J. Research progress of plant histone acetyltransferases[J]. Biotechnology Bulletin,2015,31(7):18-25.
[7] 何路军,姜玲玲. N-乙酰基转移酶的研究进展[J]. 国外医学(输血及血液学分册),2003,26(6):529-531.doi:10.3760/cma.j.issn.1673-419X.2003.06.016.
He L J,Jiang L L. Re-search of N-acetyltransferase[J]. Foreign Medical Sciences(Blood Transfusion and Heanatology),2003,26(6):529-531.
[8] 刘芳,刘睿洋,官春云. BnFAD2、BnFAD3和BnFATB基因的共干扰对油菜种子脂肪酸组分的影响[J]. 植物遗传资源学报,2017,18(2):290-297.doi:10.13430/j.cnki.jpgr.2017.02.015.
Liu F,Liu R Y,Guan C Y. Effect of silencing of BnFAD2,BnFAD3,BnFATB genes on fatty acid component in rapeseed(Brassica napus)[J]. Journal of Plant Genetic Resources,2017,18(2):290-297.
[9] 张振乾,肖钢,官春云. 气相色谱内标法测定生物柴油产率[J]. 中国粮油学报,2009,24(5):139-142.
Zhang Z Q,Xiao G,Guan C Y. Determining biodiesel yield by gas chromatography inner standard method[J]. Journal of the Chinese Cereals and Oils Association,2009,24(5):139-142.
[10] Pardo V,González-Rodtíguez  ,Muntané J,Kozma S C,Valverde
,Muntané J,Kozma S C,Valverde  M. Role of hepatocyte S6K1 in palmitic acid-induced endoplasmic reticulum stress,lipotoxicity,insulin resistance and in oleicacid-induced protection[J]. Food Chem Toxicol,2015,80:298-309. doi:10.1016/j.fct.2015.03.029.
M. Role of hepatocyte S6K1 in palmitic acid-induced endoplasmic reticulum stress,lipotoxicity,insulin resistance and in oleicacid-induced protection[J]. Food Chem Toxicol,2015,80:298-309. doi:10.1016/j.fct.2015.03.029.
[11] Kwak H J,Choi H E,Cheon H G. 5-LO inhibition ameliorates palmitic acid-induced ER stress,oxidative stress and insulin resistance via AMPK activation in murine myot ubes[J]. Scientific Reports,2017,7(1):5025.doi:10.1038/s41598-017-05346-5.
[12] Talukder M A H,Preda M,Ryzhova L,Prudoovsky I,Pinz I M. Heterozygous caveolin-3 mice show increased susceptibility to palmitate-induced in sulin resistance[J].The Physiological Reports,2016,4(6):e12736.doi:10.14814/phy2.12736.
[13] Grundy S M. Composition of monounsaturated fatty acids and carbohydrates for lowering plasma cholesterol[J].The New England Journal of Medicine,1986,314:745-748. doi:10.1056/NEJM198603203141204.
[14] Nicolosi R J,Woolfrey B,Wilson T A,Scollin P,Handelman G,Fisher R. Decreased aortic early atherosclerosis and associated risk factors in hyper cholesteromemic hamsters fed a high-or mid-oleic acid oil compared to a high-linoleic acid oil[J].The Journal of Nutritional Biochemistry,2004,15(9):540-547.doi:10.1016/j.jnutbio.2004.04.001.
[15] 胥莉. 亚油酸氧化产物的体外活性和促炎作用[D]. 杨凌:西北农林科技大学,2013.
Xu L. The study on in vitro bioactivity of linoleic acid and its proinflammatory effect[D]. Yangling:Northwest A&F University,2013.
[16] 李加兴,李忠海,刘飞,李敏利,陈双平,周殷. α-亚麻酸的生理功能及其富集纯化[J]. 食品与机械,2009,25(5):172-177.
Li J X,Li Z H,Liu F,Li M L,Chen S P,Zhou Y. Alpha-linolenic acid physiological functions and its enrichment purification technologies[J]. Food & Machinery,2009,25(5):172-177.
[17] 刘峰,王正武,王仲妮. α-亚麻酸的分离技术及功能[J]. 食品与药品,2007,9(8):60-63.doi:10.3969/j.issn.1672-979x.2007.08.020.
Liu F,Wang Z W,Wang Z N. Isolation technique and pharmacological function of α-linolenic acid[J]. Food and Drug,2007,9(8):60-63.
[18] Kim K B,Nam Y A,Kim H S,Hayes A W,Lee B M. α-Linolenic acid:nutraceutical,pharmacological and toxicological evaluation[J]. Food and Chemical Toxicology,2014(70):163-178.doi:10.1016/j.fct.2014.05.009.
[19] 丛珊. 细胞色素酶介导的花生四烯酸代谢机制研究[D]. 上海:上海交通大学,2015.
Cong S. Cytochrome p450 mediated metabolic mechanism of arachidonic acid[D]. Shanghai:Shanghai Jiao Tong University,2015.
[20] 李春梅. 花生四烯酸衍生物与造血和免疫调节[J]. 军事医学科学院院刊,1989,13(4):259-265.
Li C M. Arachidonic acid derivatives and hematopoietic and immune regulation[J]. Bulletin of the Academy of Military Medical Sciences, 1989,13(4):259-265.
[21] Yamashima T. Dual effects of the non-esterified fatty acid receptor ′GPR40′ for human health[J]. Progress in Lipid Research,2015,58:40-50.doi:10.1016/j.plipres.2015.01.002.
[22] Kanter J E,Bornfeldt K E. Inflammation and diabetes-accelerated atherosclerosis:myeloid cell mediators[J]. Trends in Endocrinology & Metabolism,2013,24(3):137-144.doi:10.1016/j.tem.2012.10.002.
[23] Martínez-Rivas J M,Sperling P,Lühs W,Heinz E. Spatial and temporal regulation of three different microsomal oleate desaturase genes(FAD2)from normal-type and high-oleic varieties of sunflower(Helianthus annuus L.)[J]. Molecular Breeding,2001,8(2):159-168. doi:10.1023/a:1013324329322.
[24] Damude H G,Kinney A J. Enhancing plant seed oils for human nutrition[J]. Plant Physiology,2008,147(3):962-968.doi:10.1104/pp.108.121681.
[25] Ervin R B,Wright J D,Wang C Y,Kennedy-Stephenson J. Dietary intake of fats and fatty acids for the United States population:1999-2000[J]. Advance Data,2004,8(348):1-6.
[26] Fattore E,Bosetti C,Brighenti F,Agostoni C,Fattore G. Palm oil and blood lipid-related markers of cardiovascular disease:a systematic review and meta-analysis of dietary intervention trials[J]. The American Journal of Clinical Nutrition,2014,99(6):1331-1350.doi:10.3945/ajcn.113.081190.
[27] Li Y P,Hruby A,Bernstein A M,Ley S H,Wang D D,Chiuve S E,Sampson L,Rexrode K M,Rimm E B,Willett W C,Hu F B. Saturated fats compared with unsaturated fats and sources of carbohydrates in relation to risk of coronary heart disease:a prospective cohort study[J]. Journal of the American College of Cardiology,2015,66(14):1538-1548.doi:10.1016/j.jacc.2015.07.055.
[28] Van Rooijen M A,Mensink R P. Palmitic acid versus stearic acid:effects of interesterification and intakes on cardiometabolic risk markers-a systematic review[J]. Nutrients,2020,12(3):615. doi:10.3390/nu12030615.
[29] 吴谋成. 正确认识食用植物油[N]. 中国食品质量报,2004-08-03,(4).
Wu M C. Correct understanding of edible vegetable oil[N]. China Food Quality News,2004-08-03,(4).
[30] 张园园. 油菜和拟南芥中几个硫代葡萄糖苷合成及调控基因的功能分析[D]. 武汉:华中农业大学,2015.
Zhang Y Y. Function analyses of several genes involved in biosynthesis and regulation of glucosinolate in Brassica napus and Arabidopsis thaliana[D]. Wuhan:Huazhong Agricultural University,2015.
[31] 李志兰. 拟南芥与油菜GDSL类脂肪酶基因的in silico分析及其对种子油脂积累影响的研究[D]. 杭州:浙江大学,2014.
Li Z L. In Silico analysis of GDSL genes in arabidopsis and brassica and the investigation on their function in seeds[D]. Hangzhou:Zhejiang University,2014.
