哺乳动物的妊娠过程需要母体与胎儿间建立联系、进行物质交换并协同发展。子宫是孕育胎儿的重要场所,在哺乳动物生殖过程中,子宫内膜与胚胎附植间有着密切联系。子宫内膜位于哺乳动物的子宫腔面,正常的子宫内膜由内侧的上皮层(具有分泌功能的子宫内膜上皮细胞)和其下方的固有层(基质细胞)构成。在生殖过程中,子宫内膜与胚胎附植间有着密切联系[1];同时,子宫内膜作为卵巢激素的作用靶点,其多种生物功能受卵巢激素调节,如雌激素和孕激素[2]。哺乳动物的卵巢、黄体、胎盘和睾丸均可分泌雌激素。雌二醇(Estradiol,E2)作为功能性最强的雌激素,参与了调节子宫内细胞增殖、腔上皮腺体分泌以及增加子宫内血管通透性和子宫肌收缩等功能[3]。
环氧合酶2(Cyclooxygenase-2,COX-2)是合成前列腺素类化合物(Prostaglandins,PGs)的关键限速酶,COX-2催化合成的PGs在排卵、胚胎植入和胚胎发育等方面发挥了重要作用。PGs是由环氧合酶催化不饱和脂肪酸形成的一类脂类介质[4],属于膜磷脂的衍生物,其可被催化为5种前列腺素,分别为PGE2、PGF2α、PGI2、PGD2及血栓烷TXA2[5]。妊娠早期,PGF2α能促进排卵及配子结合,妊娠过程中PGF2α参与调控胚胎附着和发育[6]。研究显示,子宫来源的PGF2α对啮齿类和反刍类动物的黄体溶解发挥着重要的调节作用[7],PGF2α还可促进子宫颈成熟和促进分娩等。PGF2α通过诱导猪子宫平滑肌收缩从而参与调节分娩过程[8]。E2能诱导牛输卵管上皮细胞[9]和子宫内膜上皮细胞COX-2的表达,从而促进PGF2α的分泌[10]。哺乳动物妊娠过程中的激素调控十分复杂,关于E2调控妊娠早期奶牛子宫内膜上皮细胞中COX-2的表达及PGF2α合成的具体调控机制,目前研究尚不充分。
因此,试验以奶牛为模式动物,通过体外培养妊娠早期奶牛子宫内膜上皮细胞,利用qRT-PCR、Western Blot、ELISA等技术,探究E2对奶牛子宫内膜上皮细胞中COX-2的表达及PGF2α分泌的影响,并深入研究相关的作用途径及分子机制,为进一步探究奶牛的生殖生理和繁殖机理奠定理论基础。
1 材料和方法
1.1 奶牛子宫样品收集
奶牛子宫收集自河北省大厂县屠宰场。根据子宫中胎儿大小,选取外观健康,妊娠45~90 d的奶牛子宫。将收集的子宫组织用37 ℃预温含0.01 mol/L双抗的DPBS(磷酸盐缓冲液)清洗后,2 h内带回实验室用于后续的细胞培养。
1.2 奶牛子宫内膜上皮细胞的体外培养
无菌条件下,用眼科镊和眼科剪将子宫内侧脂肪组织去除干净。剥离子宫内膜并用含0.01 mol/L双抗的DPBS清洗3次后,剪成1 mm2大小的组织块。将组织块接种于75 cm2细胞培养瓶中,静置2 h后,加入5 mL含10% FBS的完全培养基(DMEM/F12,HYClone)并放入37 ℃、5% CO2细胞培养箱中进行培养。每隔48 h进行换液,当细胞铺满至80%时,根据子宫基质细胞和子宫内膜上皮细胞消化时间不同,用0.25%胰蛋白酶进行细胞纯化和传代。
1.3 子宫内膜上皮细胞的鉴定
将纯化后的F2子宫内膜上皮细胞均匀传至6孔板中进行细胞爬片。培养3 d后选取细胞量为50%~60%的细胞去除细胞培养液,用4 ℃预冷的DPBS清洗3次;加入1 mL 4%的多聚甲醛固定30 min。4 ℃预冷的DPBS清洗3次后,加入1 mL 0.01% Triton X-100通透15 min。用4 ℃预冷的DPBS清洗3次后,加入1 mL 5%的BSA封闭30 min。加入200 μL稀释好的兔抗多克隆角蛋白-18抗体(北京博奥森生物技术有限公司,bs-2043R,1∶100)4 ℃过夜,之后加入100 μL PE标记的山羊抗兔荧光二抗(北京全式金生物技术有限公司,HS121,1∶150),37 ℃避光孵育1 h。4 ℃预冷的DPBS清洗后,加入200 μL的1 μg/mL DAPI避光孵育1 min。预冷的DPBS清洗并用倒置荧光显微镜拍照观察。
1.4 细胞处理
将纯化后子宫内膜上皮细胞按106 /mL细胞密度接种于6孔板中,放入37 ℃、5% CO2细胞培养箱中进行培养。待细胞量为80%~90% 时弃去培养板中的培养基,加入基础培养基对细胞饥饿12 h。为了检测E2对奶牛子宫内膜上皮细胞COX-2表达及PGF2α分泌的影响,加入E2(Sigma公司,美国)使其终浓度分别为0,10-9,10-8,10-7 mol/L,分批处理细胞,处理1 h后收集的细胞检测Akt及p38 MAPK磷酸化水平;处理24 h后收集的细胞和细胞培养基检测COX-2基因和蛋白的表达及PGF2α分泌水平的变化。为了验证E2是否通过p38 MAPK和PI3K/Akt信号通路调控子宫内膜上皮细胞COX-2表达及PGF2α的分泌,添加10-7 mol/L的E2单独或联合p38 MAPK通路抑制剂SB203580和PI3K通路抑制剂LY294002处理奶牛子宫内膜上皮细胞24 h,检测COX-2基因和蛋白的表达及PGF2α分泌水平的变化。
1.5 总RNA提取及qRT-PCR
将收集的细胞按照TriQuick Resgent总RNA提取试剂(北京索莱宝科技有限公司)说明书提取RNA,保存于-80 ℃冰箱。按照Promega反转录试剂盒说明书进行反转录,将得到的cDNA保存于-20 ℃冰箱。
引物序列交由北京生物工程有限公司合成,具体信息见表1。按照SYBR® Premix Ex TaqTM(TaKaRa))试剂盒说明书进行操作,以GAPDH为参照基因,每个样品重复3次,具体反应条件:95 ℃ 10 min;95 ℃ 10 s,60 ℃30 s,40个循环。采用2-ΔΔCt定量分析法分析基因的表达变化。
表1 实时荧光定量PCR引物
Tab.1 Primers used in Real-time PCR

基因Genes引物序列(5′-3′)Primersequences产物长度/bpProductlength登录号AccessionnumberCOX-2F:CTGGAAGCCTAGCACTTTCGR:CGTTTTGGTGAGGTGCGTAT139NM_174445.2GAPDHF:GGCGTGAACCACGAGAAGTAR:GGCGTGGACAGTGGTCATAA141NM_001034034.2
1.6 总蛋白提取及Western Blot
向收集到的细胞中加入150 μL添加了1% PMSF和蛋白酶抑制剂的 RIPA裂解液(北京索莱宝科技有限公司),反复冻融3次裂解细胞,12 000 r/min离心5 min,用BCA试剂盒测定蛋白浓度;取总蛋白40 μg加入4×Loading Buffer(北京索莱宝科技有限公司),98 ℃变性10 min后置于冰盒上。上样进行SDS-PAGE电泳,转膜,5%脱脂奶粉封闭2 h后,分别用Akt多克隆抗体(北京博奥森生物技术有限公司,bs-6951R,1∶500),p-Akt多克隆抗体(北京博奥森生物技术有限公司,bs-0876R,1∶500),p38 MAPK多克隆抗体(北京博奥森生物技术有限公司,bs-0637R,1∶500),p-p38 MAPK多克隆抗体(北京博奥森生物技术有限公司,bs-2210R,1∶500),COX-2多克隆抗体(Abcam,美国,ab169782,1∶500)和GAPDH多克隆抗体(北京博奥森生物技术有限公司,bs-10900R,1∶3 000)4 ℃孵育过夜。二抗为HRP标记的羊抗兔IgG抗体(北京博奥森生物技术有限公司,bs-0295G-HRP,1∶3 000)37 ℃孵育1 h。ECL化学发光(南京诺唯赞生物科技有限公司)检测蛋白条带。
1.7 细胞上清液PGF2α检测
将收集的细胞培养基3 000 r/min离心20 min,按照Bovine PGF2α ELISA试剂盒(上海江莱生物科技有限公司)进行操作,测定不同浓度E2处理细胞24 h和E2联合ICI182780处理24 h后的细胞培养基中PGF2α的浓度,每个样品3个重复。
1.8 数据分析
所有定量数据均以均数±标准误(s)表示。通过使用SPSS 19.0(IBM Corporation,NY,USA)进行单因素方差分析来评估统计学差异。P<0.05表示差异显著,P>0.05表示无差异。
2 结果与分析
2.1 上皮细胞鉴定
通过体外培养妊娠早期奶牛子宫内膜上皮细胞,研究E2对妊娠早期奶牛子宫内膜上皮细胞COX-2表达的调节作用,结果如图1所示:纯化后的奶牛子宫内膜上皮细胞之间紧密衔接,连接成片,呈蜂窝状贴壁生长;通过细胞免疫荧光染色鉴定奶牛子宫内膜上皮细胞中角蛋白-18含量,结果显示,超过95%的细胞及细胞质呈阳性表达,表明获得的细胞可用于后续试验。

A.细胞明场;B.细胞核染色(DAPI,蓝色);C.角蛋白-18蛋白染色(PE,红色);D.合成图。
A.Cell localization;B.Nuclear staining (DAPI,blue);C.Keratin-18 staining (PE,red);D. Merge.
图1 纯化后奶牛子宫内膜上皮细胞的鉴定
Fig.1 Identification of purified cow endometrial epithelial cells
2.2 不同浓度E2对奶牛子宫内膜上皮细胞COX-2及PGF2α的影响
由图2可知,不同浓度E2处理子宫内膜上皮细胞24 h后,10-8,10-7 mol/L的E2显著促进奶牛子宫内膜上皮细胞中PGF2α的分泌 (P<0.05);COX-2 mRNA的表达呈浓度依赖性升高(P<0.05),COX-2蛋白表达趋势与基因水平变化一致,均随着E2水平上升而蛋白表达水平上调(P<0.05)。
2.3 不同浓度E2对Akt和p38 MAPK磷酸化的影响
结果如图3所示,不同浓度E2处理1 h后,10-8,10-7 mol/L浓度的E2显著促进了子宫内膜上皮细胞中Akt蛋白的磷酸化水平(P<0.05),而10-9 mol/L 的E2则对子宫内膜上皮细胞中Akt磷酸化水平无显著影响(P>0.05)。p38 MAPK蛋白的磷酸化与Akt相似,10-9 mol/L的E2处理1 h后,p38 MAPK蛋白的磷酸化水平并无显著变化,而10-8,10-7 mol/L E2显著提高了子宫内膜上皮细胞中p38 MAPK蛋白的磷酸化水平(P<0.05)。

A. PGF2α的水平变化;B.不同浓度E2处理后COX-2 mRNA的表达变化;C.Western Blot检测不同浓度E2处理后COX-2蛋白的表达;D.不同浓度E2对COX-2蛋白的相对表达变化。不同字母表示差异显著(P<0.05);相同字母表示差异不显著(P>0.05)。图3-5同。
A.Changes in the level of PGF2α; B.Changes of COX-2 mRNA expression after treatment with different concentrations of E2; C.Western Blot detection of COX-2 protein expression after treatment with different concentrations of E2; D.Changes in the relative expression of COX-2 protein in different concentrations of E2. Different letters (a, b, c) indicate significant differences (P<0.05), and the same letters indicate no significant differences (P>0.05).The same as Fig.3-5.
图2 不同浓度E2对奶牛子宫内膜上皮细胞COX-2表达及PGF2α分泌的影响
Fig.2 Effects of E2 on the expression of COX-2 and PGF2α secretion in bovine endometrial epithelial cells
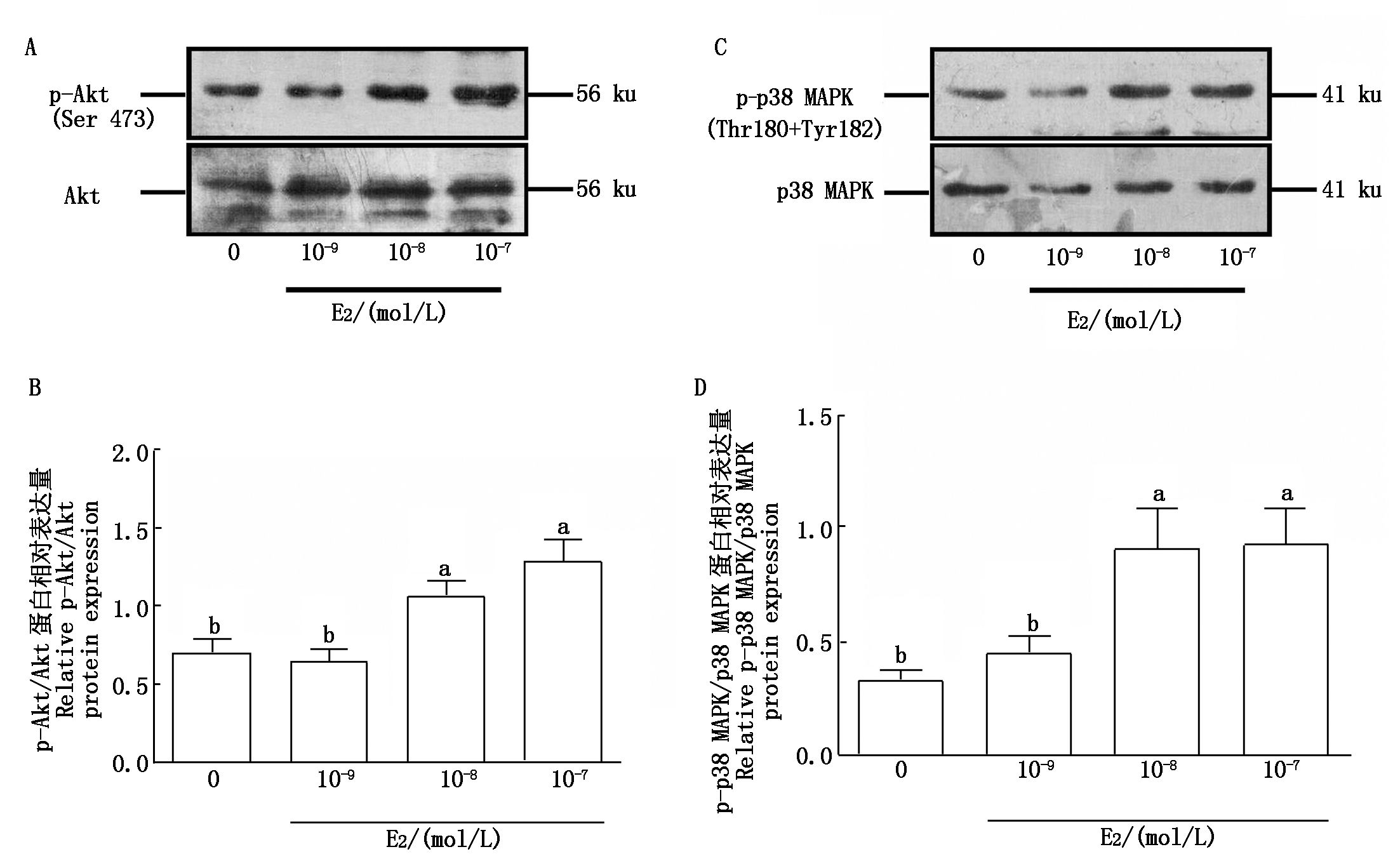
A. p-Akt/Akt蛋白的表达;B. p-Akt/Akt相对表达变化;C. p-p38 MAPK/p38 MAPK蛋白的表达;D. p-p38 MAPK/p38 MAPK相对表达变化。
A.Expression of p-Akt/Akt protein; B. Relative expression changes of p-Akt/Akt;C.Expression of p-p38 MAPK/p38 MAPK protein;D.Relative expression changes of p-p38 MAPK/p38 MAPK.
图3 不同浓度E2对Akt和p38 MAPK磷酸化的影响
Fig.3 Phosphorylation of Akt and p38 MAPK in bovine endometrial epithelial cells treated with different concentrations of E2
2.4 E2和LY294002对奶牛子宫内膜上皮细胞COX-2表达和PGF2α分泌的影响
由图4可知,E2对奶牛子宫内膜上皮细胞中COX-2 mRNA和蛋白的表达以及PGF2α的分泌有显著促进作用(P<0.05),虽然单独使用PI3K通路抑制剂LY294002对COX-2 mRNA和蛋白的表达以及PGF2α的分泌没有显著影响(P>0.05),但LY294002与10-7 mol/L的E2共同处理时,COX-2 mRNA和蛋白的表达以及PGF2α的分泌水平则显著低于10-7 mol/L的E2处理组(P<0.05)。
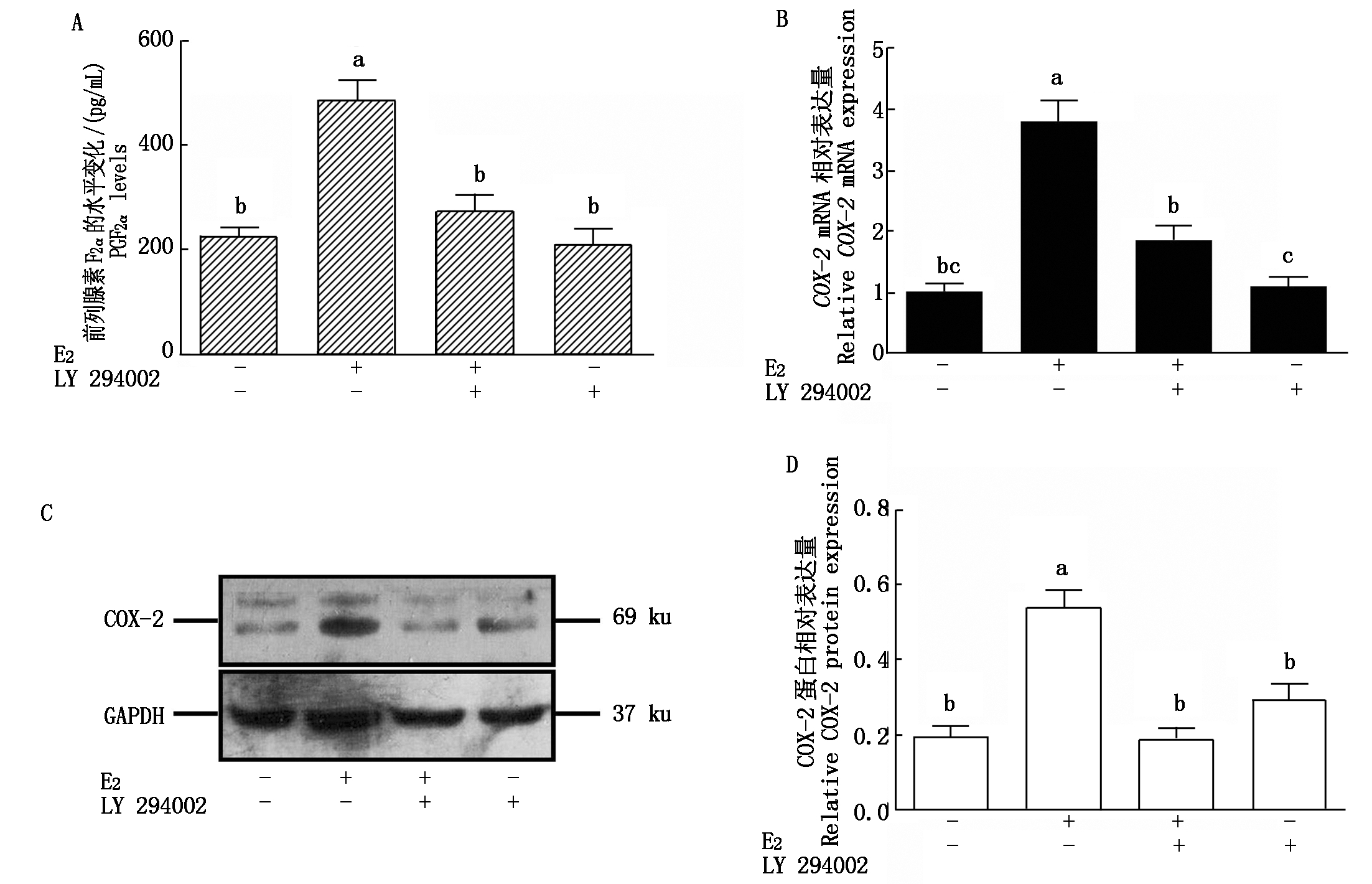
A.PGF2α的水平变化;B.E2和LY294002对COX-2 mRNA的表达变化;C.Western Blot检测E2和LY294002处理后COX-2蛋白的表达;D.E2和LY294002对COX-2 蛋白的相对表达变化。
A.Changes in the level of PGF2α; B.Changes in the expression of COX-2 mRNA by E2 and LY294002; C.Western Blot detection of COX-2 protein expression after E2 and LY294002 treatment; D.The relative expression changes of E2 and LY294002 on COX-2 protein.
图4 E2和LY294002对奶牛子宫内膜上皮细胞COX-2表达和PGF2α分泌的影响
Fig.4 Effects of E2 and LY294002 on COX-2 mRNA and protein expression and PGF2α secretion in cow endometrial epithelial cells
2.5 E2和SB203580对奶牛子宫内膜上皮细胞COX-2表达和PGF2α分泌的影响
由图5可知,E2对奶牛子宫内膜上皮细胞中COX-2 mRNA和蛋白的表达以及PGF2α的分泌有显著促进作用(P<0.05),虽然单独使用p38 MAPK通路抑制剂SB203580对COX-2 mRNA和蛋白的表达以及PGF2α的分泌没有显著影响(P>0.05),但SB203580与10-7 mol/L的E2共同处理时,COX-2 mRNA和蛋白的表达以及PGF2α的分泌水平则显著低于10-7 mol/L的E2处理组(P<0.05)。
3 讨论与结论
E2是一种重要的生殖激素,主要由卵巢中的颗粒细胞合成,胎盘亦可合成E2。哺乳动物的各个器官和组织中都分布着雌激素,子宫和卵巢是雌激素的重要靶器官,雌激素广泛的参与了调节子宫的生殖和生理功能。PGF2α来源于子宫内膜,由COX-2催化不饱和脂肪酸形成,具有调节胚胎植入、子宫肌收缩和溶解黄体等功能[11]。先前的研究表明,类固醇激素具有调节各类细胞中COX-2的表达及PGF2α分泌的功能。在本试验中,发现10-8,10-7 mol/L的E2能促进妊娠早期奶牛子宫内膜上皮细胞中COX-2 mRNA和蛋白的表达,这与Membrive等[12]研究一致,然而Sobrino等[13]表明10-11~10-7 mol/L的E2对HUVEC细胞中的COX-2 mRNA表达无显著影响。此外,Xiao等[14]研究发现在牛发情晚期子宫内膜细胞中,E2则抑制了COX-2的表达及PGF2α的分泌。这提示E2对不同时期的奶牛子宫中COX-2的表达可能存在差异。
p38 MAPK信号通路是丝裂原活化蛋白激酶(Mitogen-activated proteinkinases,MAPKs)家族的重要成员。E2可通过激活细胞中的p38 MAPK信号通路,参与细胞增殖、分化和迁移的调节[15]。Akt称为蛋白激酶B,最初发现为小鼠自发性胸腺的转化逆转录病毒中v-akt致癌基因的同源物,该酶是PI3K的直接下游效应因子,Akt还能调节细胞增殖、凋亡、影响葡萄糖的使用和血管生成[16]。郭瑞霞等[17]研究发现E2能激活PI3K/Akt信号通路来促进人子宫内膜癌细胞的生长。E2可激活PI3K/Akt或p38 MAPK信号通路已在多种细胞中得到证实。本试验发现E2处理后激活了奶牛子宫内膜上皮细胞中PI3K/Akt及p38 MAPK信号通路,与在其他细胞上的发现一致。
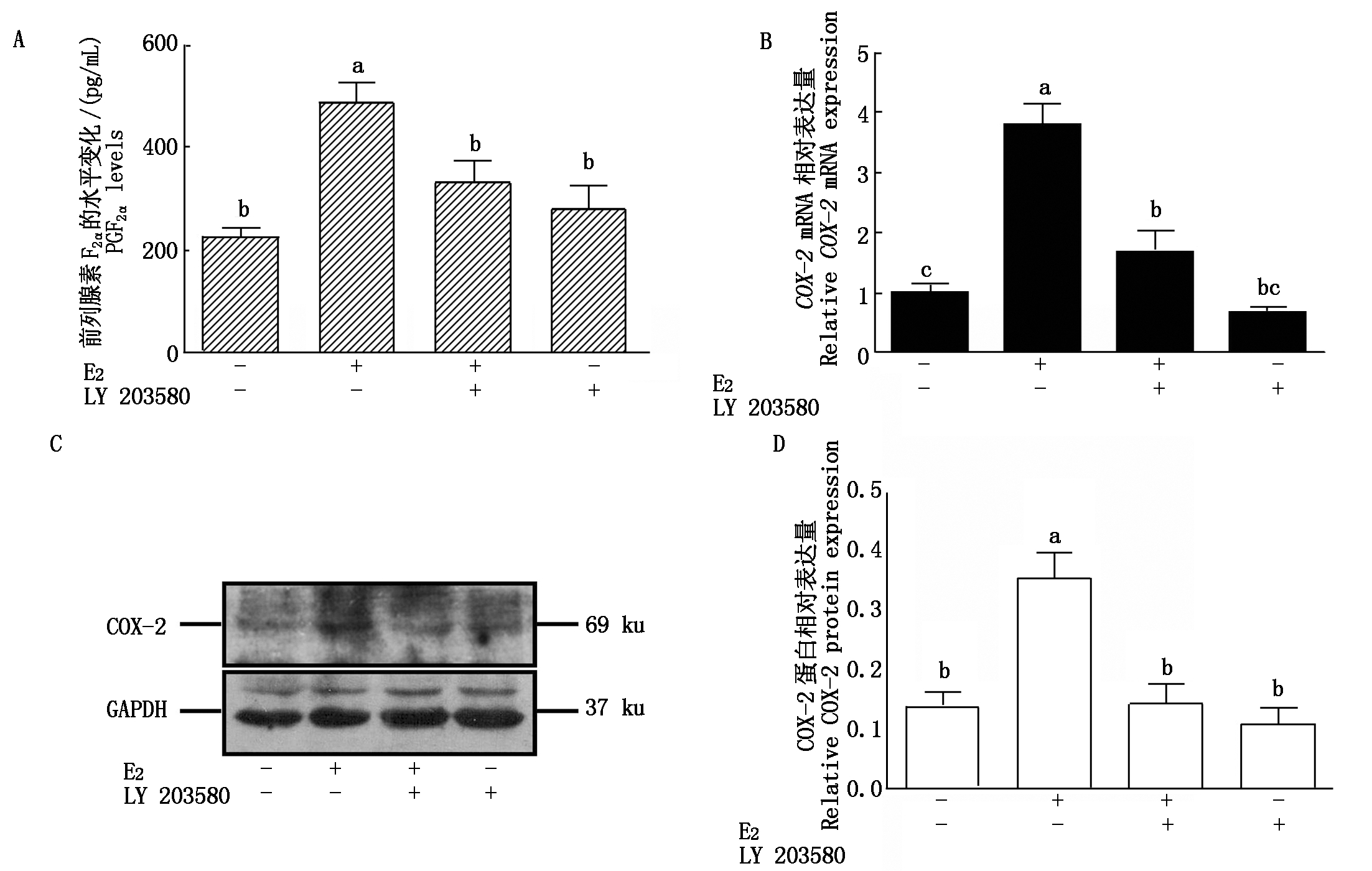
A.PGF2α的水平变化;B. E2和SB203580对COX-2 mRNA的表达变化;C.Western Blot检测E2和SB203580处理后COX-2蛋白的表达;D.E2和SB203580对COX-2 蛋白的相对表达变化。
A.Changes in the level of PGF2α; B.Changes in the expression of COX-2 mRNA by E2 and SB203580;C.Western Blot detection of COX-2 protein expression after E2 and SB203580 treatment; D.Changes in the relative expression of COX-2 protein by E2 and SB203580.
图5 E2和SB203580对奶牛子宫内膜上皮细胞COX-2表达和PGF2α分泌的影响
Fig.5 Effects of E2 and SB203580 on COX-2 mRNA and protein expression and PGF2α secretion in cow endometrial epithelial cells
研究显示,p38 MAPK参与介导人气道肌细胞中COX-2的表达[18];同时,p38 MAPK还参与介导皮质酮对大鼠心肌细胞中COX-2 mRNA的调控作用。Patterson等[19]研究发现,E2通过GPER非基因组效应反式激活EGFR,促进下游的PI3K/Akt磷酸化,进而调控大鼠输卵管上皮中COX-2的表达及PGF2α的分泌。PI3K/Akt[20]和p38 MAPK[21]信号通路是包括COX-2在内的多种炎性细胞因子的信号转导靶标。在本研究中,用E2与LY294002、SB203580单独或联合处理奶牛子宫内膜上皮细胞后发现,E2对COX-2的表达及PGF2α分泌的促进作用被抑制,PI3K/Akt及p38 MAPK信号通路可通过多种途径调控炎症或癌症的发生。而生理浓度的E2对调控发情周期、配子植入、胚胎发育和分娩方面具有重要意义。
综上所述,通过体外培养妊娠早期奶牛子宫内膜上皮细胞,发现E2可通过激活p38 MAPK及PI3K/Akt信号通路,从而促进COX-2的表达及PGF2α的分泌。本试验深入研究E2调控奶牛子宫内膜上皮细胞中COX-2的表达及PGF2α分泌的作用机制,为探究子宫源性不孕、异位妊娠、早产和其他子宫内膜疾病的原因提供了新思路。
[1] Akbar R,Ullah K,Rahman T U,Cheng Y,Pang H Y,Jin L Y,Wang Q J,Huang H F,Sheng J Z. miR-183-5p regulates uterine receptivity and enhances embryo implantation[J]. Journal of Molecular Endocrinology,2020,64(1):43-52.doi:10.1530/JME-19-0184.
[2] Marquardt R M,Kim T H,Shin J H,Jeong J W. Progesterone and estrogen signaling in the endometrium:What goes wrong in endometriosis?[J]. International Journal of Molecular Sciences,2019,20(15):3822.doi:10.3390/ijms20153822.
[3] Weems C W,Weems Y S,Randel R D. Prostaglandins and reproduction in female farm animals[J].The Veterinary Journal,2006,171(2):206-228.doi:10.1016/j.tvjl.2004.11.014.
[4] Zhang Q,Collins V,Chakrabarty K,Wolf R F,Unno N,Howe D,Rose J C,Wu W X. Regulation of membrane-associated prostaglandin E2 synthase 1 in pregnant sheep intrauterine tissues by glucocorticoid and estradiol[J]. Endocrinology,2006,147(8):3719-3726. doi:10.1210/en.2006-0293.
[5] Smith W L,Song I. The enzymology of prostaglandin endoperoxide H synthases-1 and-2[J]. Prostaglandins Other Lipid Mediat,2002,68-69:115-128.doi:10.1016/s0090-6980(02)00025-4.
[6] 张楠. 前列腺素E_2和F_(2α)对奶牛输卵管上皮细胞输卵管蛋白表达的调控作用研究[D].呼和浩特:内蒙古农业大学,2016:95.
Zhang N.Studies on effects of PGE2 and PGF2α on oviductin expression in bovine oviduct epithelial cells[D].Hohhot:Inner Mongolia Agricultural University,2016:95.
[7] Stocco C,Telleria C,Gibori G. The molecular control of corpus luteum formation,function,and regression[J]. Endocrine Reviews,2007,28(1):117-149.doi:10.1210/er.2006-0022.
[8] Cao J S,Yosida M,Kitazawa T,Taneike T. Uterine region-dependent differences in responsiveness to prostaglandins in the non-pregnant porcine myometrium[J]. Prostaglandins Other Lipid Mediat,2005,75(1-4):105-122.doi:10.1016/j.prostaglandins.2004.11.002.
[9] 武岳,苏日娜,付改玲,曹金山,曹贵方. 17β-雌二醇对体外培养牛输卵上皮细胞中环氧合酶-2的表达影响[J].内蒙古农业大学学报(自然科学版),2010,31(3):20-23.
Wu Y,Su R N,Fu G L,Cao J S,Cao G F. Effects of 17β-estradiol on the expression of cyclooxygenase-2 in bovine oviduct epithelial cells[J].Journal of Inner Mongolia Agricultural University(Natural Science Edition),2010,31(3):20-23.
[10] 李茜如. 17β-雌二醇对奶牛子宫内膜组织中PGE2和PGF2α合成分泌及其受体表达的影响[D]. 呼和浩特:内蒙古农业大学, 2018.
Li Q R. The effects of 17β-estradiol on prostaglandin E2 and F2alpha secretion and expression of its receptors in endometrial explants of dairy cows in vitro[D]. Hohhot:Inner Mongolia Agricultural University,2018.
[11] Ziecik A J,Przygrodzka E,Jalali B M,Kaczmarek M M. Regulation of the porcine corpus luteum during pregnancy[J]. Reproduction,2018,156(3):R57-R67.doi:10.1530/REP-17-0662.
[12] Membrive C M B,Cunha P M D,Meirelles F V,Binelli M. Calcium potentiates the effect of estradiol on PGF2α production in the bovine endometrium[J]. Journal of Animal Science and Biotechnology,2014,5(1):25.doi:10.1186/2049-1891-5-25.
[13] Sobrino A,Mata M,Laguna-Fernandez A,Novella S,Oviedo P J,Garcia-Pérez M A,Taín J J,Cano A,Hermenegildo C. Estradiol stimulates vasodilatory and metabolic pathways in cultured human endothelial cells[J]. PLoS One,2009,4(12):e8242.doi:10.1371/journal.pone.0008242.
[14] Xiao C W,Liu J M,Sirois J,Goff A K. Regulation of cyclooxygenase-2 and prostaglandin F synthase gene expression by steroid hormones and interferon-tau in bovine endometrial cells[J]. Endocrinology,1998,139(5):2293-2299.doi:10.1210/endo.139.5.5961.
[15] 梁克山. P38MAPK抑制剂、雌二醇和TPX2对痴呆鼠模型海马神经细胞损害的保护作用及认知功能的影响[D].济南:山东大学,2019:220.doi:10.27272/d.cnki.gshdu.2019.000091.
Liang K S. Protective effects of P38 MAPK,estradiol and TPX2 in the hippocampal apoptosis and their effect on cognition in mouse models of dementi[D]. Jinan:Shandong University,2019:220.
[16] Chan J,Bayliss P E,Wood J M,Roberts T M. Dissection of angiogenic signaling in zebrafish using a chemical genetic approach[J].Cancer Cell,2002,1(3):257-267.doi:10.1016/s1535-6108(02)00042-9.
[17] 郭瑞霞,魏丽惠,王建六,孙蓬明,孙秀丽. 17β-雌二醇对子宫内膜癌细胞磷脂酰肌醇3激酶/蛋白激酶B信号传导通路的激活作用[J].中华妇产科杂志,2004,39(7):469-473.doi:10.3760/j.issn:0529-5467X.2004.07.11.
Guo R X,Wei L H,Wang J L,Sun P M,Sun X L.Activation of phosphatidylinositol 3-kinase-protein kinase B(PI3K-PKB)induced by 17β-estradiol in endometrial carcinoma cell(Ishikawa)[J].Chin J Obstet Gynecol,2004,39(7):469-473.
[18] Singer C A,Baker K J,McCaffrey A,AuCoin D P,Dechert M A,Gerthoffer W T. p38 MAPK and NF-kappaB mediate COX-2 expression in human airway myocytes[J].American Journal of Physiology-lung Cellular and Molecular Physiology,2003,285(5):L1087-L1098.doi:10.1152/ajplung.00409.2002.
[19] Patterson H,Nibbs R,McInnes I,Siebert S. Protein kinase inhibitors in the treatment of inflammatory and autoimmune diseases[J]. Clin Exp Immunol,2014,176(1):1-10.doi:10.1111/cei.12248.
[20] Wang L,Zuo M Y,Chen H,Liu S Y,Wu X Y,Cui Z L,Yang H,Liu H P,Ge B X. Mycobacterium tuberculosis lipoprotein MPT83 induces apoptosis of infected macrophages by activating the TLR2/p38/COX-2 signaling pathway[J]. Journal of Immunol,2017,198(12):4772-4780.doi:10.4049/jimmunol.1700030.
[21] Chen L Y,Liu P,Feng X,Ma C H. Salidroside suppressing LPS-induced myocardial injury by inhibiting ROS-mediated PI3K/Akt/mTOR pathway in vitro and in vivo[J]. Journal of Cellular and Molecular Medicine,2017,21(12):3178-3189.doi:10.1111/jcmm.12871.
