水通道蛋白(Aquaporins,AQPs)参与细胞水液平衡的调节,在跨细胞膜转运过程中起着重要的作用[1]。目前已发现13个AQP家族成员AQP0~12[2],其对水都有通透性,由于基因结构、蛋白结构和组织分布等不同导致家族成员在机体中起着不同的作用[3]。AQP8对水分子具有高度的选择性[4],可作为B细胞活化过程的信号调节剂,在几种类型的B细胞相关疾病中表达[5-6],还参与了宫颈癌、直肠癌和急性肝损伤等多类疾病的发生 [7-9]。此外,AQP8在肝脏细胞内对水通透,还对过氧化氢、氨也有通透性[10-11],其存在于运输囊泡和管状质膜结构域和线粒体内膜中,是胆汁的合成、分泌和调节[12-13]以及参与糖原代谢过程中对细胞渗透压的保持和对线粒体体积的维持等功能的基础[14]。目前,关于AQP8基因表达仅在人、鼠、水牛等哺乳动物中有报道[15-17],在高原动物中未见报道。牦牛作为以我国青藏高原为中心的高原特有珍稀牛种之一,对其生态环境具有极强适应性[18],对AQP8基因的研究为探讨牦牛极端环境适应性具有重要意义。本研究旨在克隆牦牛AQP8,并对不同年龄段肝脏中该基因的差异表达进行分析,为深入研究牦牛AQP8基因功能提供参考资料。
1 材料和方法
1.1 试验动物及样品采集
试验动物源于四川省阿坝州红原县,随机选取健康胎儿(1 d)、幼年(15月)、成年(5岁)雌性麦洼牦牛各3头,屠宰后采集其心脏、肝脏、脾脏、肺脏、肾脏、小肠、肌肉、瘤胃组织样品,部分液氮保存,部分4%多聚甲醛进行固定。
1.2 主要试剂
4%多聚甲醛固定液购自国药集团化学试剂有限公司;AQP8兔多克隆抗体购自北京博奥森生物技术有限公司;组化二抗试剂盒购自北京中杉金桥生物技术有限公司;PrimeScriptTM RT Reagent Kit、TB GreenTM Premix Ex TaqTMⅡ酶、pMDTM19-T Vector Cloning Kit、DL2000 Marker和DH5α感受态细胞均购于宝生物工程 (大连)有限公司;1.1×T3 Super PCR购自成都擎科梓熙生物技术有限公司。
1.3 RNA提取及cDNA合成
用TRIzol法对牦牛心脏、肝脏、脾脏、肺脏、肾脏、小肠、肌肉、瘤胃8种组织进行RNA提取,通过1%琼脂糖凝胶电泳及NanoDrop 2000分光光度计检测RNA质量及完整性。按照反转录试剂盒说明书合成cDNA,置于-20 ℃保存备用。
1.4 牦牛AQP8基因克隆及测序
根据GenBank上公布的牛AQP8基因序列(登录号:NM_001206607.3),利用Primer 5.0软件设计CDS区扩增引物,引物序列上游:5′-ATGTTTACAGA
GGCAGCTGTATCCA-3′;下游:5′-TCACCGTCCCTTTA
GGATTAGACGA-3′。PCR扩增反应体系为:cDNA模板2 μL,上下游引物各2 μL,1.1×T3 Super PCR Mix 44 μL。反应程序:98 ℃预变性2 min;98 ℃变性10 s,54 ℃退火10 s,72 ℃延伸15 s,共35个循环。PCR产物经1%的琼脂糖电泳检测后按胶回收试剂盒说明书对其进行胶回收,并按pMDTM19-T克隆载体试剂盒说明书将目的基因与载体16 ℃连接过夜,转化到DH5α感受态细胞中,37 ℃进行培养40 min进行复苏,均匀的涂布到含有Amp+的LB固体培养基上,37 ℃培养12 h,挑取单菌落进行PCR鉴定,阳性菌液送上海生物工程有限公司进行测序。
1.5 牦牛AQP8基因生物信息学分析
用NCBI中的Blast对获得的核酸序列进行比对,并用ORF Finder获得其氨基酸序列,用在线软件ExPASy中的ProtParam进行蛋白质的基本理化性质分析;ProtScal进行疏水性分析;用在线软件TMHMM对蛋白进行跨膜分析;SignalP对信号肽进行分析;用在线软件SMART对蛋白的结构功能域进行分析;用在线软件SOPMA、SWISS-MODEL对蛋白的二级结构、三级结构进行预测;用MEGA 6.0软件进行比对并构建系统进化树。
1.6 牦牛AQP8基因组织表达谱及不同生长阶段肝脏中的表达检测
以β-actin为内参基因,采取qRT-PCR方法检测AQP8基因在成年麦洼牦牛心脏、肝脏、脾脏、肺脏、肾脏、小肠、肌肉和瘤胃共8种组织中的表达量。并且检测1 d、15月、5岁麦洼牦牛肝脏中的AQP8基因表达量。β-actin引物为上游:5′-CTTCGAGCAG
GAGATGGC-3′;下游:5′-CCGTGTTGGCGTAGAGGT-3′。AQP8引物为上游:5′-CAGCGTCAAGGTGAAGGAG-3′;下游:5′-GAAGATGAACAGAGCAGAGCC-3′。反应体系:上下游引物均为0.8 μL,cDNA模板1 μL,TB GreenTMPremix Ex TaqTM 5.2 μL,灭菌ddH2O 2.2 μL。反应程序:95 ℃预变性3 min;95 ℃变性10 s,59.4 ℃退火10 s,共40个循环。以牦牛β-actin为内参基因对组织进行定量结果分析,得到每个样品的 Ct 值,每个样品3个生物学重复,3个技术重复。采用2-ΔΔCt 法分析试验结果,数据用平均值±标准误差,SPSS 24.0 单因素方差分析其显著性,P<0.05表示差异性显著,P>0.05差异性不显著。
1.7 牦牛AQP8蛋白免疫组织化学检测
对4%多聚甲醛固定的1 d、15月、5岁牦牛段肝脏组织进行包埋、切片和染色,用枸橼酸缓冲液(pH值6.0)进行抗原修复,加入阻断剂后PBS清洗,滴加100 μL或适量的封闭用正常山羊血清工作液孵育后,滴加一抗(1∶100),4 ℃过夜孵育后滴加二抗,DAB进行显色,苏木素复染,脱水,透明,中性树胶封片。显微镜下观察阳性表达情况,显微成像系统拍照记录,每个样品选择3个阳性区域进行拍照,用Image Pro Plus 6.0 软件对数据结果进行光密度分析,SPSS 24.0分析其显著性。
2 结果与分析
2.1 牦牛AQP8基因的克隆
以牦牛肝脏cDNA为模板,PCR扩增牦牛AQP8基因,1%琼脂糖凝胶电泳检测获得单一的目的条带,如图1所示。经测序获得一条长为792 bp的序列,ORF为792 bp,编码263个氨基酸,序列提交到GenBank数据库,获得登录号为MT062952。
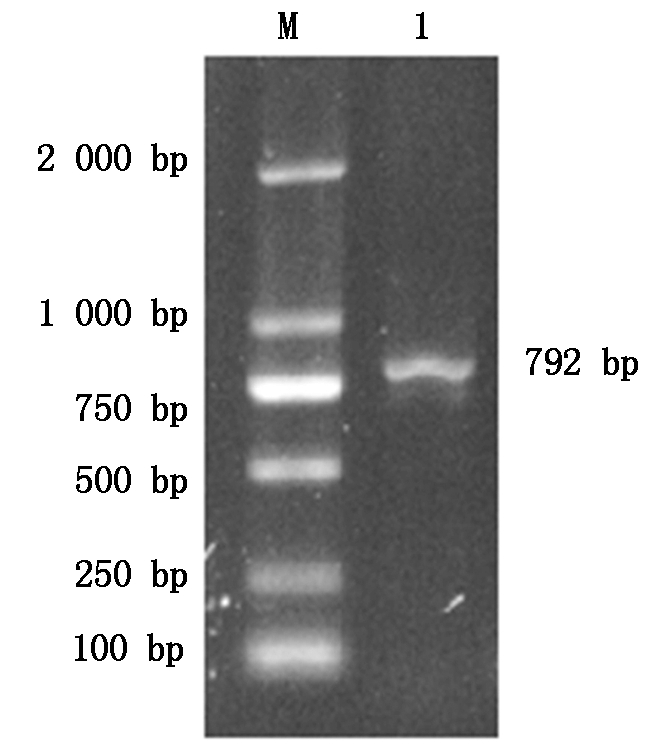
M.DL2000 DNA Marker;1.AQP8基因。
M.DL2000 DNA Marker;1.AQP8 gene.
图1 牦牛AQP8基因PCR扩增结果
Fig.1 The PCR amplification for AQP8 gene of yak
2.2 牦牛AQP8基因生物信息学分析
将获得的麦洼牦牛AQP8基因核酸序列与其他物种进行同源性比对,发现其与野牦牛的核苷酸序列同源性最高为99.6%,其次与水牛、山羊和绵羊的同源性分别为98.6%,98.2%,98.1%。同时构建了系统进化树,发现其与野牦牛的亲缘关系最近,与小斑熊虫的亲缘关系最远,并且该基因在物种进化过程中有较高的保守性(图2)。
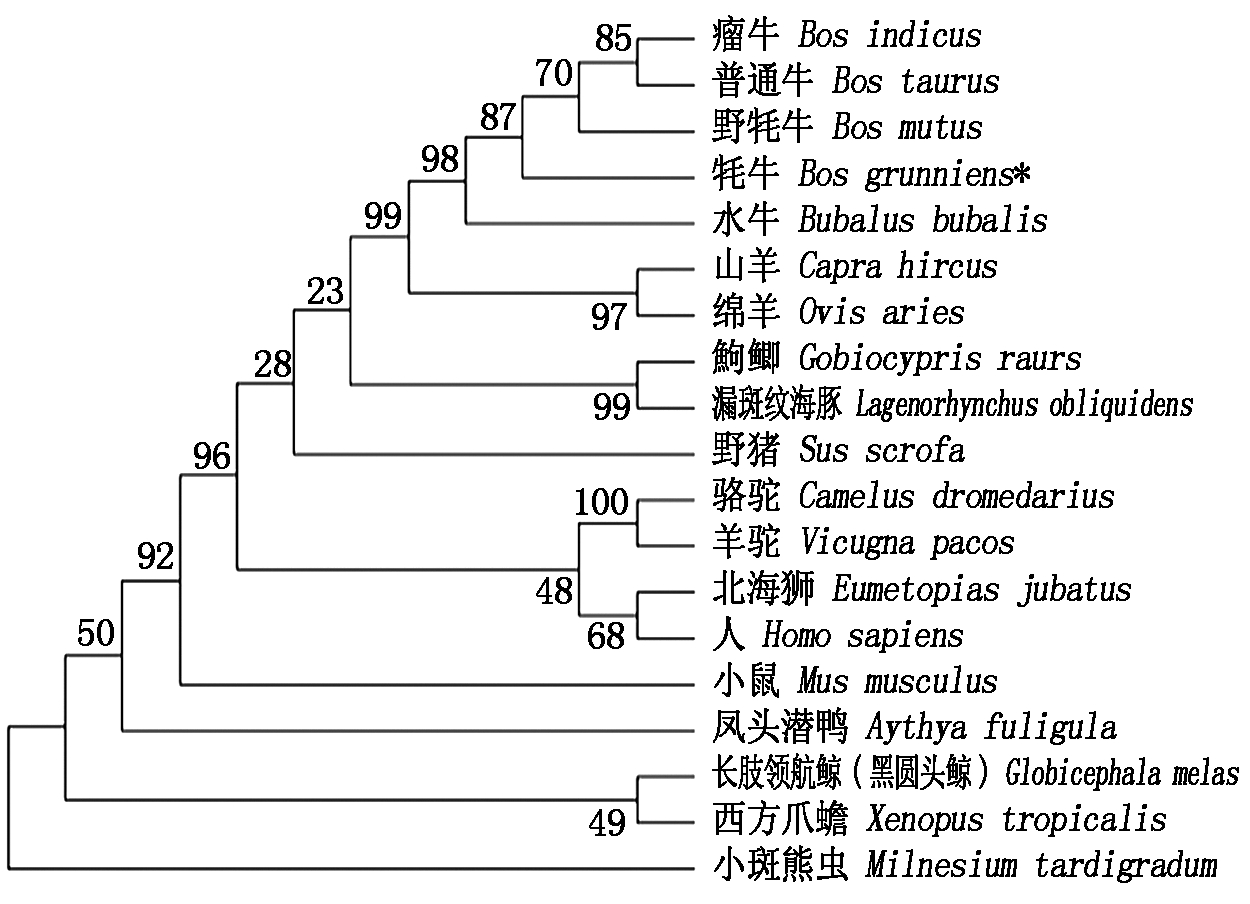
图2 AQP8基因系统进化树
Fig.2 Phylogenetic tree of AQP8 gene
通过对AQP8蛋白进行理化性质分析所知,该蛋白的分子式为C1271H2001N327O340S15,分子质量为27.78 ku,理论等电点为6.50,带负电残基数(Asp+Glu)17,带正电残基数(Arg+Lys)16,脂肪系数114.64,半衰期30 h,不稳定系数为34.04,推测该蛋白为酸性稳定蛋白。该蛋白中,亮氨酸的含量最高为13.7%,酪氨酸的含量最低为1.5%。功能预测发现,该蛋白是典型的疏水蛋白,有6个跨膜螺旋区,在33-247有1个高度保守的MIP结构功能域。该蛋白二级结构有α螺旋、β折叠、无规卷曲,分别占比为41.8%,6.08%,18.87%,34.22%,其三级结构由26-252位氨基酸构成。
2.3 牦牛AQP8基因的组织表达谱
不同组织提取的RNA经过1%琼脂糖凝胶电泳检测,条带清晰完整无降解,利用Nanodrop检测RNA的纯度和浓度,其A260/280nm比值均在1.8~2.2,表明RNA质量符合试验要求,可以进行后续试验。采用qRT-PCR检测AQP8基因在成年麦洼牦牛8种组织中的表达量,以心脏为参照,AQP8基因在成年麦洼牦牛心脏、肝脏、脾脏、肺脏、肾脏、小肠、肌肉和瘤胃共8种组织中均有表达,其中在肝脏中的表达最高,且显著高于心脏、脾脏和肾脏等其他组织(P<0.05),其他组织之间表达不显著(P>0.05)(图3)。
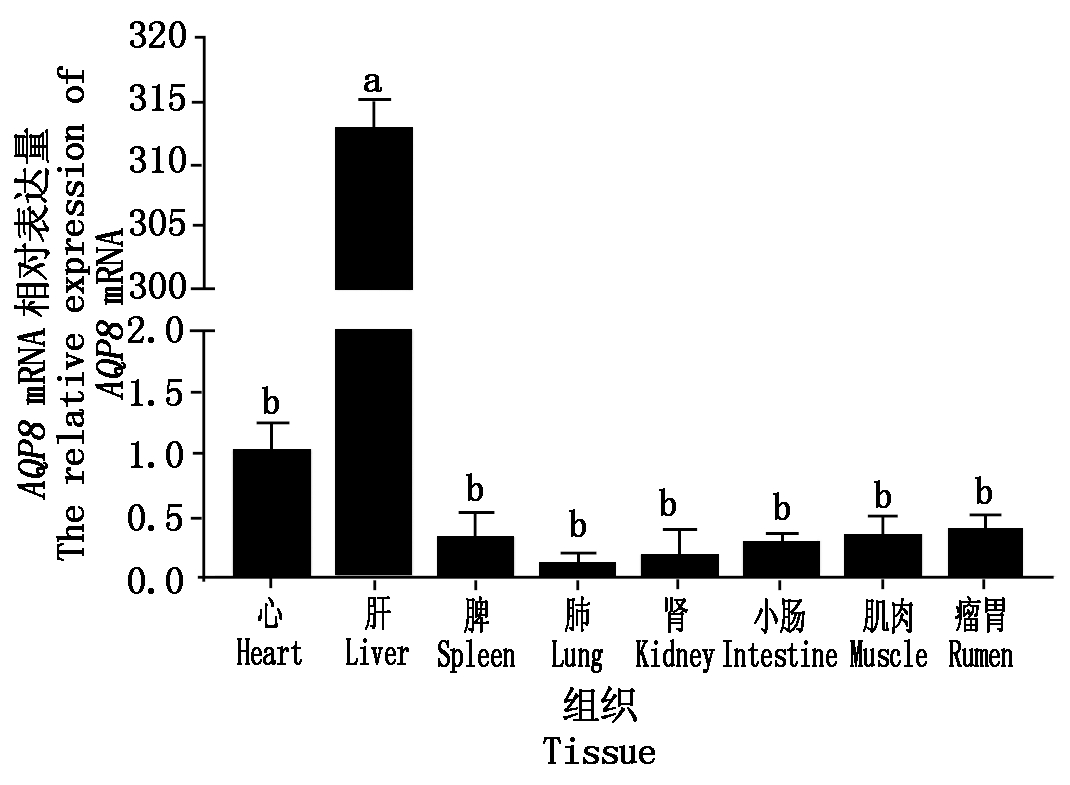
相同字母代表差异不显著(P>0.05);不同字母代表差异显著(P<0.05)。图4,6同。
The same letter suggests that the difference is not significant(P>0.05);The difference letters suggests that the difference is significant(P<0.05). The same as Fig.4,6.
图3 牦牛AQP8基因组织表达谱
Fig.3 The tissue expression profiles of yak AQP8
2.4 AQP8基因在牦牛不同生长阶段肝脏中mRNA表达
对牦牛胎儿时期(1 d)、幼年时期(15月)和成年时期(5岁)肝脏中AQP8的表达量进行分析,结果显示,幼年时期的牦牛肝脏中AQP8的表达量最高,显著高于胎儿时期和成年时期(P<0.05),其次为成年时期和胎儿时期,AQP8在胎儿时期和成年时期中表达差异不显著(P>0.05)(图4)。
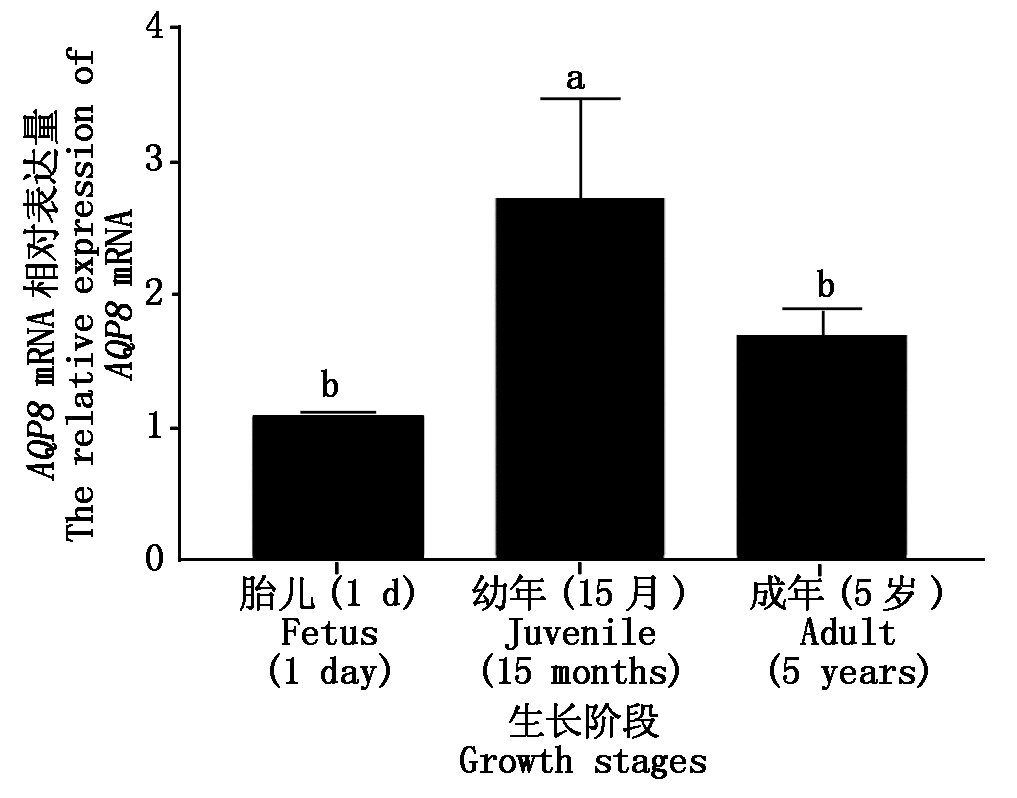
图4 AQP8基因在不同生长阶段肝脏中的差异表达
Fig.4 Differential expression of AQP8 in livers at different growth stages
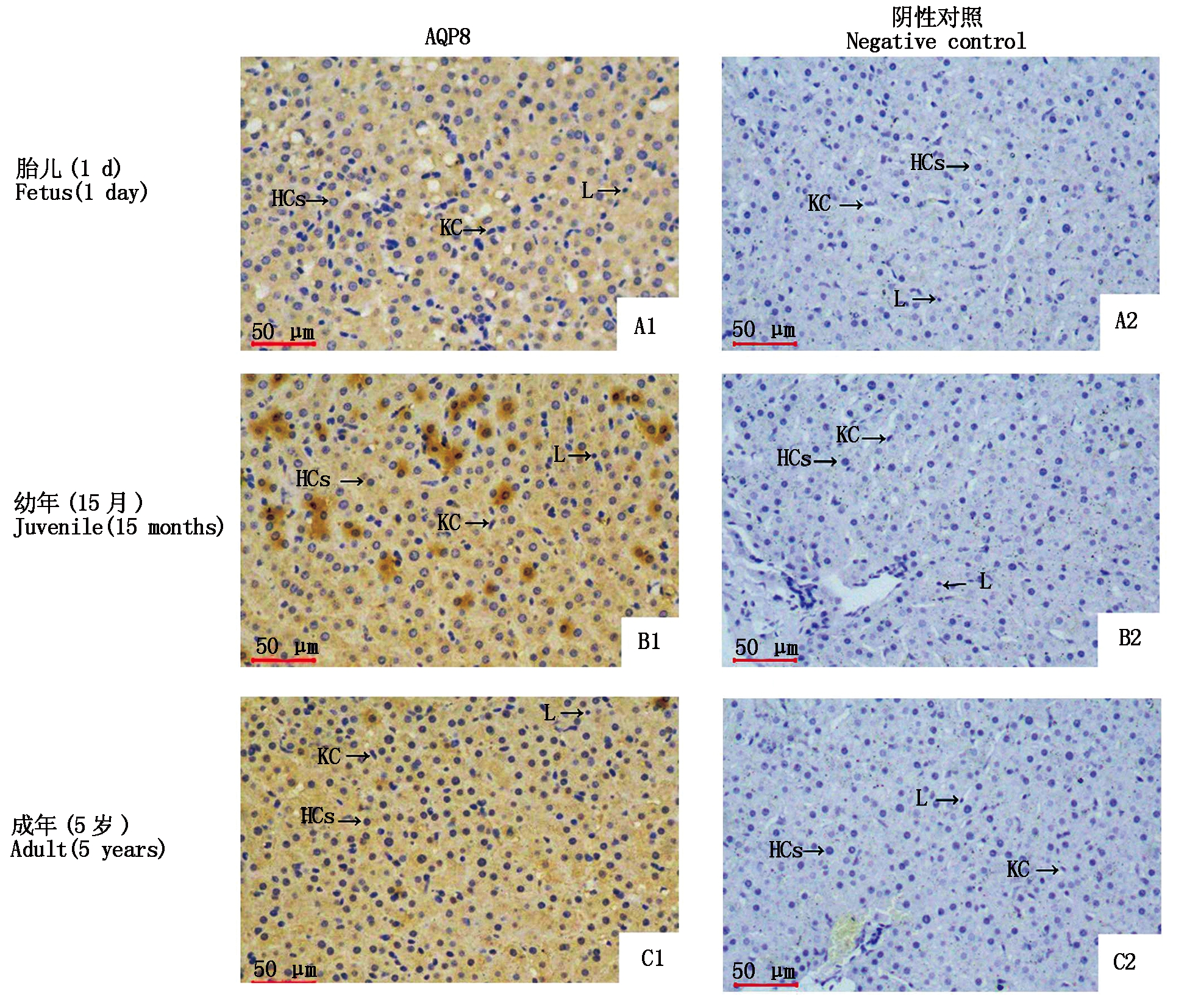
用PBS代替一抗作阴性对照;KC.枯否细胞;HCs肝细胞;L.淋巴细胞。
Negative control was conducted by replacing first antibody of PBS;KC.Kupffer cell;HCs.Hepato-cytes;L.Lymphocyte.
图5 AQP8蛋白在牦牛肝脏组织的分布(400×)
Fig.5 Distribution of AQP8 protein in liver of yak(400 ×)
2.5 AQP8蛋白在牦牛肝脏组织的定位和表达
对牦牛不同生长阶段的肝脏进行免疫组织化学检测发现,在胎儿时期、幼年时期和成年时期牦牛肝脏组织中,均有AQP8蛋白表达,AQP8蛋白主要表达于肝细胞的细胞质中,细胞上呈黄色或棕黄色(图5)。对其平均光密度值分析发现,AQP8蛋白在幼年(15月)牦牛肝脏中的表达量最高,成年(5岁)次之,胎儿(1 d)时期最低,且幼年(15月)和成年(5岁)时期的表达显著高于胎儿时期(P<0.05),幼年和成年时期的表达没有显著差异(P>0.05)(图6)。
3 讨论与结论
水通道蛋白位于细胞膜上调节水液的平衡,水液平衡的失调会导致相关疾病的发生[19-20],其研究有利于目前对疾病的研究和治疗。牦牛作为高原最大哺乳动物,对高原低氧环境具有适应性,对AQP8基因的探究有利于进一步了解水通道蛋白家族与牦牛低氧适应性之间的关系。目前已有AQP1[21]、AQP4[22-23]、AQP9[24-25]与低氧环境相关的报道。为探讨AQPs基因在低氧环境中的功能,本试验克隆了牦牛AQP8基因,发现该基因在进化过程中相对保守,其与李胜等[17]克隆到的水牛AQP8基因相差60 bp,这可能是由于物种之间的差异导致的。对AQP8蛋白结构域进行预测发现该蛋白具有一个AQPs特有的稳定MIP结构域,是形成膜通道的重要结构,与水牛相比少一个MIP结构域,这可能是由于牦牛生活在高原环境所导致的。牦牛AQP8蛋白结构预测为进一步探讨该蛋白在牦牛上的功能作用提供了参考资料。
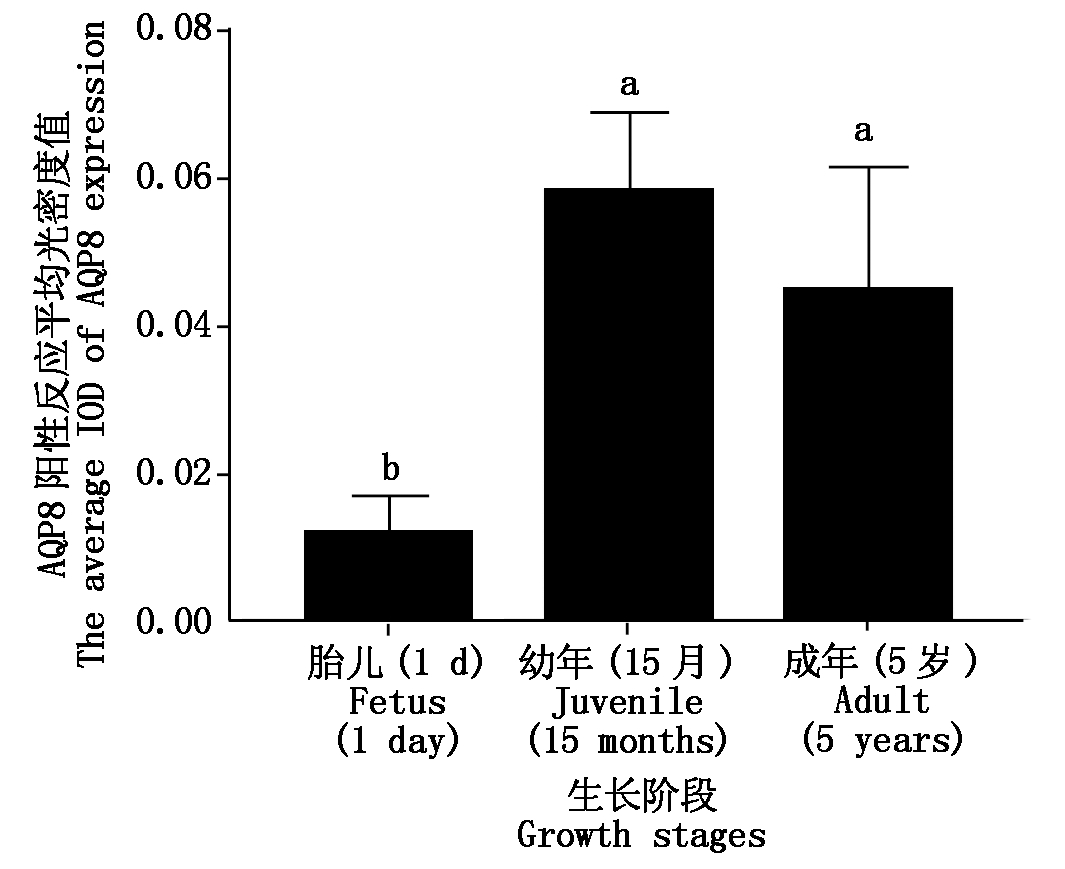
图6 AQP8阳性反应平均光密度值分析
Fig.6 Analysis of average integral optical density of AQP8 expressions
本试验采用qRT-PCR方法检测到AQP8基因在牦牛肝脏中特异性高表达,说明AQP8主要存在于肝细胞中。张霖等[9]报道AQP8是在人肝细胞中大量表达且起重要作用的水通道蛋白,人AQP8在肝脏中高表达与其参与肝脏中的代谢活动相关,且AQP8的表达异常会导致肝细胞通透性改变和水液代谢的失衡[4]。肝脏中水液代谢影响着线粒体的能量代谢[26],AQP8在肝脏线粒体中高表达,可促进氧化磷酸化和细胞凋亡的信号转导以及线粒体体积调控[10,27]。肝脏作为牦牛体内的一个重要能量代谢器官,维持和稳定机体氧化功能[28],对适应高原极端环境有重要作用。组织定位发现,AQP8蛋白主要于肝细胞的细胞质中表达,由此推测AQP8在牦牛肝脏中特异性高表达可能与其在低氧环境下参与机体的能量代谢相关。AQP8蛋白与AQP8基因表达有一定的差异,可能是由于mRNA降解、蛋白折叠与修饰等因素导致的。在生长发育的胎儿时期、幼年时期和成年时期,肝脏的代谢功能有一定的差异。赖树云等[29]报道的不同年龄组小鼠肝细胞线粒体的差异分析表明幼年组的肝细胞线粒体密度极显著高于成年组。幼年时期麦洼牦牛肝脏中AQP8的表达显著高于胎儿时期和成年时期,不同年龄段的差异表达可能与肝细胞线粒体密度相关。通过免疫组化检测到牦牛AQP8蛋白定位在肝细胞的细胞质中,从而可以推测牦牛AQP8可能通过调控细胞质中的线粒体参与机体的能量代谢。
本试验成功克隆了牦牛AQP8基因,发现该基因在牦牛肝脏中高表达,幼年时期肝脏中AQP8基因表达显著高于胎儿时期和成年时期,且AQP8蛋白主要定位在肝细胞的细胞质中,在幼年牦牛肝脏中的表达量最高,这表明牦牛AQP8在肝脏能量代谢过程中发挥着一定作用,为深入探讨牦牛AQP8功能以及牦牛低氧适应性机制积累了科学资料。
[1] Magdeldin S,Nameta M,Yamamoto T. Aquaporin 8 Regulates mitochondrial glycogen phosphorylase expression in C57BL6 mice[J]. Suez Canal Veterinary Medicine Journal,2018,23(1):27-39. doi:10.21608/scvmj.2018.60750.
[2] 黄诗雅,温麒丹,李娟,马红霞. 水通道蛋白与多囊卵巢综合征发病机制的研究进展[J].国际生殖健康/计划生育杂志,2018,37(5):409-413. doi:10.3969/j.issn.1674-1889.2018.05.015.
Huang S Y,Wen Q D,Li J,Ma H X. Aquaporins and polycystic ovary syndrome:a review[J].Journal of International Reproductive Health/Family Planning,2018,37(5):409-413.
[3] 齐迎春,谢晓华.水通道蛋白1,5与肺部疾病关系的研究进展[J].国际老年医学杂志,2014,35(2):69-74.doi:10.3969/j.issn.1674-7593.2014.02.008.
Qi Y C,Xie X H. Research progress in the relationship between aquaporin1,aquaporin5 and pulmonary diseases[J].International Journal of Geriatrics,2014,35(2):69-74.
[4] 张睦清,韩雪,段思明,张一昕,王亚芬,张纳博,王彦蕊. 泽泻汤加味方对高脂血症模型大鼠肝组织中水通道蛋白8的影响[J].中国药房,2018,29(5):651-655. doi:10.6039/j.issn.1001-0408.2018.05.19.
Zhang M Q,Han X,Duan S M,Zhang Y X,Wang Y F,Zhang N B,Wang Y R. Effects of modified Rhizoma alismatis decoction on the expression of AQP8 in liver-tissue of hyperlipidemia model rats[J].China Pharmacy,2018,29(5):651-655.
[5] Matsuzaki T,Tajika Y,Ablimit A,Aoki T,Hagiwara H,Takata K. Aquaporins in the digestive system[J].Medical Electron Microscopy,2004,37(2):71-80.doi:10.1007/s00795-004-0246-3.
[6] Bertolotti M,Farinelli G,Galli M,Aiuti A,Sitia R.AQP8 transports NOX2-generated H2O2 across the plasma membrane to promote signaling in B cells[J]. Journal of Leukocyte Biology,2016,100(5):1071-1079.doi:10.1189/jlb.2AB0116-045R.
[7] 吴利荣. AQP1、AQP8在病变宫颈上皮组织中的表达及临床意义[J]. 海南医学院学报,2014,20(2):180-183. doi:10.13210/j.cnki.jhmu.2014.02.024.
Wu L R.Expression of aquaporin 1 and aquaporin 8 in cervical intraepithelial neoclassic patients[J].Journal of Hainan Medical College,2014,20(2):180-183.
[8] Zhang H,Du W B,Guo X M,Wang L K,Cheng J M,Wei L J. Identification of the AQP8-miR-92a network associated with the aggressive traits of colorectal cancer[J]. Biochem Biophys Res Commun,2020,527(1):218-225. doi:10.1016/j.bbrc.2020.04.055.
[9] 张霖,王锦权.水通道蛋白在急性肝损伤中的作用的研究进展[J].中华医学杂志,2012,92(16):1148-1150.doi:10.3760/cma.j.issn.0376-2491.2012.16.021.
Zhang L,Wang J Q. Research progress on the role of aquaporins in acute liver injury[J].National Medical Journal of China,2012,92(16):1148-1150.
[10] Danielli M,Marrone J,Capiglioni A M,Marinelli R A. Mitochondrial aquaporin-8 is involved in SREBP-controlled hepatocyte cholesterol biosynthesis[J]. Free Radical Biology and Medicine,2019,131:370-375.doi:10.1016/j.freeradbiomed.2018.12.016.
[11] ![]() I,Bestetti S,Bertolotti M,Bienert G P,Bottino C,Laforenza U,Rubartelli A,Sitia R. Stress regulates aquaporin-8 permeability to impact cell growth and survival[J].Antioxidants & Redox Signaling,2016,24(18):1031-1044. doi:10.1089/ars.2016.6636.
I,Bestetti S,Bertolotti M,Bienert G P,Bottino C,Laforenza U,Rubartelli A,Sitia R. Stress regulates aquaporin-8 permeability to impact cell growth and survival[J].Antioxidants & Redox Signaling,2016,24(18):1031-1044. doi:10.1089/ars.2016.6636.
[12] 彭欣,卿笃信. 水通道蛋白8在肝病治疗中的潜在价值[J]. 临床肝胆病杂志,2019,35(5):1140-1142. doi:10.3969/j.issn.1001-5256.2019.05.047.
Peng X,Qing D X. Potential value of aquaporin-8 in treatment of liver diseases[J].Journal of Clinical Hepatology,2019,35(5):1140-1142.
[13] Calamita G,Ferri D,Bazzini C,Mazzone A,Bott G,Liquori G E,Paulmichl M,Portincasa P,Meyer G,Svelto M. Expression and subcellular localization of the AQP8 and AQP1 water channels in the mouse gall-bladder epithelium[J]. Biology of the Cell,2015,97(6):415-423. doi:10.1042/BC20040137.
G,Liquori G E,Paulmichl M,Portincasa P,Meyer G,Svelto M. Expression and subcellular localization of the AQP8 and AQP1 water channels in the mouse gall-bladder epithelium[J]. Biology of the Cell,2015,97(6):415-423. doi:10.1042/BC20040137.
[14] Ferri D,Mazzone A,Liquori G E,Cassano G,Svelto M,Calamita G. Ontogeny distribution and possible functional implications of an unusual aquaporin AQP8 in mouse liver[J].Hepatology,2003,38(4):947-957.doi:10.1053/jhep.2003.50397.
[15] 唐雅兵.复方丹参对人羊膜上皮细胞AQP8表达的影响[J].医学临床研究,2017,34(4):726-728. doi:10.3969/j.issn.1671-7171.2017.04.033.
Tang Y B. The effect of compound salvia miltiorrhiza on the expression of AQP8 in human amniotic epithelial cells[J].Journal of Clinical Research,2017,34(4):726-728.
[16] Sun X L,Zhang J,Fan Y,Ding J H,Sha J H,Hu G. Aquaporin-4 deficiency induces subfertility in female mice[J]. Fertility and Sterility,2009,92(5):1736-1743. doi:10.1016/j.fertnstert.2008.07.1785.
[17] 李胜,屈春凤,李润,何金娜,石德顺,李湘萍. 水牛水通道蛋白8基因克隆及表达分析[J]. 中国畜牧兽医,2014,41(3):44-48.
Li S,Qu C F,Li R,He J N,Shi D S,Li X P. Cloning and expression analysis of buffalo aquaporin 8 gene[J].Chinese Animal Husbandry and Veterinary Medicine,2014,41(3):44-48.
[18] 肖玉萍,魏云霞,张百炼,吴晓睿,师音,周磊,李维红.牦牛功能基因的研究进展[J]. 黑龙江畜牧兽医,2012(2):37-40.doi:10.13881/j.cnki.hljxmsy.2012.03.020.
Xiao Y P,Wei Y X,Zhang B L,Wu X R,Shi Y,Zhou L,Li W H. Research progress on yak functional genes[J].Heilongjiang Animal Science and Veterinary Medicine,2012(2):37-40.
[19] Tardelli M,Claudel T,Bruschi F V,Trauner M. Nuclear receptor regulation of aquaglyceroporins in metabolic organs [J]. International Journal of Molecular Sciences,2018,19(6):1777.doi:10.3390/ijms19061777.
[20] Tardelli M,Stulnig T M. Aquaporin regulation in metabolic organs[J].Vitam Horm,2020,112:71-93. doi:10.1016/bs.vh.2019.09.002.
[21] 尚俊依. 低氧诱导AQP1表达的分子机制[C].广州:中华医学会,2011:299-300.
Shang J Y. Molecular mechanism of hypoxia-induced AQP1 expression[C].Guangzhou:Chinese Medical Association,2011:299-300.
[22] 宋国强. 牦牛AQP4基因的克隆及其对高原脑水肿抗性的表达机理[D]. 兰州:兰州大学,2011.
Song G Q. AQP4 gene cloning and its expression mechanism of resistance to high altitude cerebral edema in the yak(Bos grunniens)[D]. Lanzhou:Lanzhou University,2011.
[23] 刘健锋,丁艳平,侯博儒,王建林,邵宝平. 牦牛AQP4基因CDS序列的克隆及其生物信息学特征分析[J]. 生物技术通报,2015,31(2):129-134.doi:10.13560/j.cnki.biotech.bull.1985.2015.02.019.
Liu J F,Ding Y P,Hou B R,Wang J L,Shao B P.Cloning and bioinformatics analysis of the CDS of yak AQP4 gene[J].Biotechnology Bulletin,2015,31(2):129-134.
[24] 刘健锋,丁艳平,伍志伟,王建林,邵宝平. 牦牛AQP9基因CDS全长序列克隆及其生物信息学特征分析[J]. 畜牧兽医学报,2015,46(7):1134-1140.doi:10.11843/j.issn.0366-6964.2015.07.008.
Liu J F,Ding Y P,Wu Z W,Wang J L,Shao B P. Cloning and bioinformatics analysis of the CDS of yak AQP4 Gene[J].Acta Veterinaria et Zootechnica Sinica,2015,46(7):1134-1140.
[25] 汪迁昊. 牦牛脑AQP9的功能特征[D]. 兰州:兰州大学,2017.
Wang Q H. Functional characteristics of AQP9 in the yak brain[D]. Lanzhou:Lanzhou University,2017.
[26] Karimi S,Khatami S R,Azarpira N,Galehdari H,Pakbaz S. Investigate of AQP gene expression in the liver of mice after ischemia-reperfusion[J]. Molecular Biology Reports,2018,45(6):1769-1774. doi:10.1007/s11033-018-4320-7.
[27] Laforenza U,Bottino C,Gastaldi G. Mammalian aquaglyceroporin function in metabolism[J]. Biochim Biophys Acta,2016,1858(1):1-11. doi:10.1016/j.bbamem.2015.10.004.
[28] 王江. 饥饿对牦牛肌肉及肝脏中脂肪分解代谢的影响研究[D].雅安:四川农业大学,2014.
Wang J. The study of effects of starvation on yak′ muscle and liver fat catabolism[D].Ya′an:Sichuan Agricultural University,2014.
[29] 赖树云,钱纬,刘美玉,刘爱武,孙君洁. 不同年龄组小白鼠肝细胞线粒体的立体学分析[J]. 昆明医学院学报,1987(1):16-21.
Lai S Y,Qian W,Liu M Y,Liu A W,Sun J J .Stereoanalysis of mitochondria in liver cells of mice of different age groups[J]. Academic Journal of Kunming Medical College,1987(1):16-21.
