目前,水资源短缺已成为世界性问题,其中我国的人均水资源占有量不足世界水平的1/4,资源性缺水十分严重[1]。全国用水量中,农业生产需水量最大,占到总量的一半以上[2]。作为我国三大粮食作物之一,小麦(Triticum aestivum L.)是生育期需水量较大的农作物,几乎占农业总用水量的1/3[2-3]。因此,如何保证水资源高效利用,提高水分生产率[4],实现小麦的稳产高产对保障粮食安全具有重大意义。近年来,随着科学技术的进步与发展,各种新型的水处理技术层出不穷[5]。20世纪中叶以来,一种无毒、无污染、简便、高效的物理水处理技术在国内外相继开展[4,6],经该技术处理后,水的理化性质(电导率、pH值、表面张力、渗透性、黏滞系数等)发生显著改变,水分子活性被提升,称之为活化水,该技术被称为活化水技术[7]。研究表明,常见的磁化(水分子垂直通过特定磁场)与去电子(水分子通过去电子器)等活化水技术能够加快土壤水分入渗速率,提高水肥利用效率,促进农田作物生长及增产[7-9]。近年来,活化水技术应用于作物灌溉、促进作物增效增产方面的研究成为农业水土资源高效利用领域新的热点[10]。有证据表明,活化水(多数为磁化水)不仅影响作物种子萌发、产量和品质,而且影响作物的生长过程、作物的根系及生理特性[11-14]。Savostin[12]首先提出了特定磁场有利于植物地上部的生长,用磁化水灌溉小麦,不仅可以增加其地上生物量,还能促进根系生长,根长较对照提高了40.4%[13]。朱练峰等[14]用磁化水灌溉2种杂交水稻(Oryza sativa subsp. Indica,Oryza sativa subsp. japonica),结果表明,磁化水灌溉处理对水稻产量及品质的提升有促进作用。去电子水处理技术由美国首次提出,广泛用于工业水油分离处理,其在农业生产过程中的应用近几年才开始被关注[15]。有学者研究表明,去电子微咸水灌溉可以促进棉花(Gossypium spp.)植株生长发育,提高水分利用效率和作物产量,并可以改善土壤水盐运移特性,缓解土壤盐分胁迫[15-17]。综上所述,目前,活化水在农业生产中的应用多以磁化水为主,去电子水的作用效果报道较少,且磁化与去电子2种活化方式叠加耦合的效果研究亦少;同时,活化水影响作物产量提升的机理还不清楚,比如水活化后如何影响作物根系的形态结构与活力水平,目前还鲜有报道。因此,本研究拟通过室内水培与大田试验相结合的方式研究地下水经活化处理后对小麦生长的影响,其中大田试验侧重于研究活化水灌溉对小麦产量的影响,室内水培试验主要研究活化水对小麦种子萌发、根系活力及根系构型的影响,且大田与室内水培试验均对小麦叶片叶绿素含量、株高、干物质量等指标进行了测定,同时探讨了活化水对小麦植株生长的潜在作用,以期为未来活化水作用功效与机制的研究提供借鉴,也为活化水在小麦生产中的应用提供理论依据。
1 材料和方法
1.1 大田试验
1.1.1 试验区概况 试验于2018年10月-2019年5月在陕西省杨凌示范区曹新庄试验农场(E 108°04′02″,N 34°17′38″,海拔520 m)进行。该区地处关中平原中部,属半湿润易旱区,年均气温12.9 ℃,无霜期210 d,年均降水量550~600 mm,土壤类型为土垫旱耕人为土(塿土)。试验期间降水量、大气温度如图1所示。
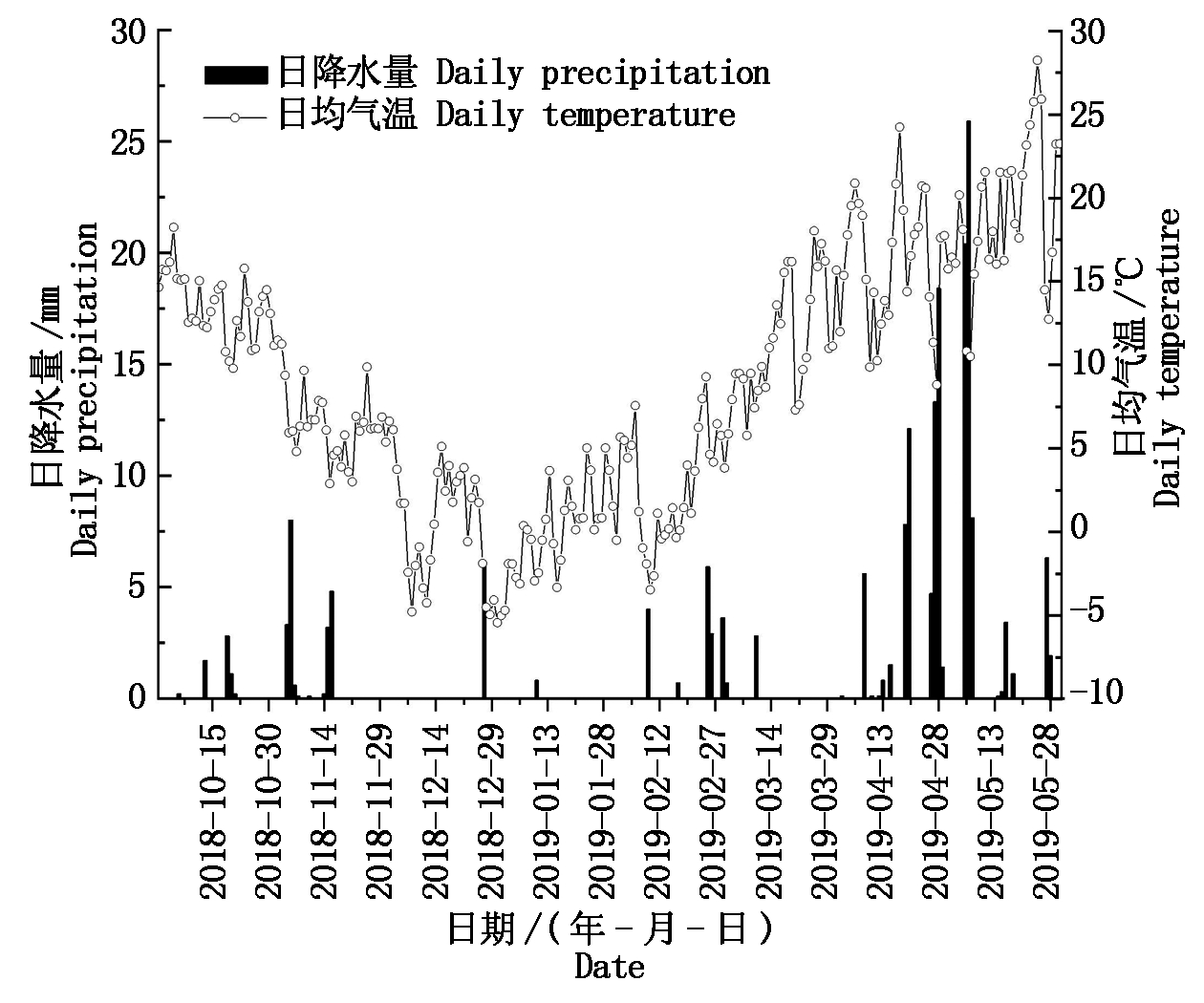
图1 小麦生育期内降水量与气温分布(2018-2019年)
Fig.1 Daily precipitation and temperature during growing period of wheat(2018-2019)
1.1.2 试验设计 供试小麦品种为小偃22号,播种量为187.5 kg/hm2,播种前施基肥,参照当地农作水平,施用242 kg/hm2的氮肥和172 kg/hm2的磷肥,肥料分别为尿素和磷酸二铵,同时施农药辛硫磷45 kg/hm2 (防止地下蛀虫)。试验期间采用滴灌系统,在小麦越冬期(1月15日)、拔节期(4月12日)、灌浆期(5月24日)分别进行灌溉,灌溉处理包括地下水灌溉(GI)、去电子水灌溉(GDI)、磁化水灌溉(GMI)、先去电子后磁化水灌溉(G(D+M)I)、先磁化后去电子水灌溉(G(M+D)I),单次灌溉量均为60 mm,总灌溉量180 mm,并且试验设零灌溉(I0)为空白对照,共计6个处理,每个处理重复3次,共18个小区,小区面积16 m2(4 m×4 m),小区间隔0.6 m。试验采用随机区组设计。
1.2 室内水培试验
1.2.1 试验设计 试验于2019年6-9月在西北农林科技大学科研温室中进行。供试小麦品种与大田试验一致。试验用水类型同大田试验,即:地下水(G)、去电子水(GD)、磁化水(GM)、先去电子后磁化水(G(D+M))、先磁化后去电子水(G(M+D)),用以配制营养液培养小麦,共计5个处理,每个处理重复10次,随机区组排列。
1.2.2 室内培养 精选饱满、大小均匀的小麦种子,使其浸泡在55 ℃的温水中15 min,然后放置于3% H2O2溶液中浸泡10 min(杀菌消毒),用蒸馏水冲洗残留在种子上的H2O2,随后再加入蒸馏水浸泡3 h,最后平铺在放有湿滤纸的培养皿中在室温(25±3) ℃下进行遮光催芽(催芽第3天温室中降温系统出现故障,温度高达35 ℃,可能使得小麦发芽率偏低)。每天更换活化水,5 d后选择长势一致、健壮的幼苗,去掉胚乳后将幼苗转入盛有Hoagland营养液的长方形聚乙烯塑料盆(规格为长40 cm,宽30 cm,高23 cm)中进行培养,用定植棉将幼苗固定于泡沫板的孔中,每盆6株。培养条件为温度25 ℃/20 ℃(昼/夜),湿度60%~70%,自然光照,每5 d更换一次营养液,营养液用增氧泵(森森有限公司,ACO-005)早晚各通气1 h[18-19]。营养液具体配制方法如表1[20]。
1.3 活化水制备
磁化水经磁化装置制成,该装置由储水桶(800 L塑料桶)、输水管道及磁铁组成。本研究选取磁场强度为3 000 Gs的永磁磁铁(包头鑫达磁性材料厂),将永磁磁铁安装在出水管外壁,当水流经过外置永磁体管道时,因垂直于磁场切割磁感线而受到磁化[21]。去电子水由去电子处理系统制成,该系统包括去电子处理器(韩国亚美华(北京)环境科技发展有限公司生产,W600DELF)、接地电极(电阻5 Ω)、导线、塑料水桶(800 L)。当水流经去电子处理器时,水中一定数量的电子在管道壁上富集,并由接地电极导入地下,水体中的盐分物质只剩正离子与正电荷,从而制成去电子水[15]。先去电子后磁化水是地下水先经过去电子装置然后再经过磁化装置制成的,先磁化后去电子水则是地下水先经过磁化装置然后再经过去电子装置制成的。大田试验中制备完成的活化水立即由自吸喷射泵(中国台州汇精机电有限公司,JET-1100)导入滴灌系统,滴灌带铺设在靠近小麦的部位,每小区铺设20条,滴头间距30 cm,滴头流量1.38 L/h;室内水培试验则用制备完成的活化水直接配制营养液以培养小麦。活化水的制备量均以用水量为依据。
表1 Hoagland营养液组成成分
Tab.1 The composition of Hoagland nutrient solution
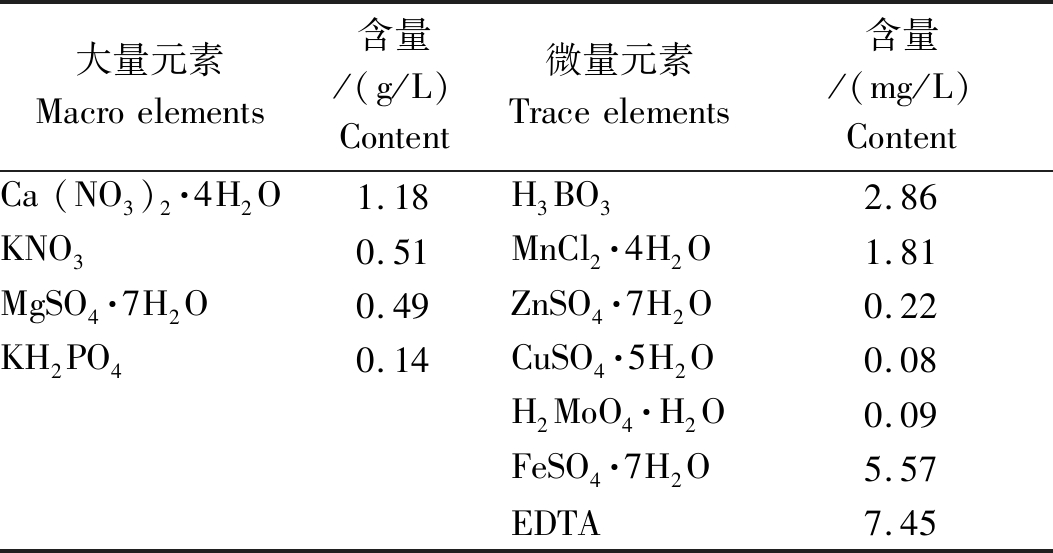
大量元素Macroelements含量/(g/L)Content微量元素Traceelements含量/(mg/L)ContentCa(NO3)2·4H2O1.18H3BO32.86KNO30.51MnCl2·4H2O1.81MgSO4·7H2O0.49ZnSO4·7H2O0.22KH2PO40.14CuSO4·5H2O0.08H2MoO4·H2O0.09FeSO4·7H2O5.57EDTA7.45
1.4 测定指标与方法
1.4.1 大田试验指标 旗叶SPAD值(相对叶绿素含量)、株高、干物质量:分别于拔节期(4月15日)与灌浆期(5月9日)进行测定。叶片叶绿素含量采用日本柯尼卡美能达公司产便携式SPAD-502型叶绿素仪测定,每重复随机取5片生长一致的旗叶测定。同时每个小区随机采集具有代表性的植株5株(只取地上部分),带回实验室用卷尺测定其高度,取平均值;然后放入烘箱,于105 ℃杀青0.5 h后调至70 ℃烘干,称质量。
产量及产量构成:成熟期,每个小区收获1 m2(1 m×1 m)样方内小麦,晒干后点算其单位面积内的麦穗总数,脱粒后进行实际籽粒产量的测定;同时从中随机取籽粒1 000粒进行称量。穗粒数的测定方法为每个小区随机取20穗,点算其穗粒数,取平均值。
1.4.2 室内水培试验指标 种子发芽率:每日观察并记录每个培养皿中发芽种子数,发芽5 d后所有处理均无新种子萌发,发芽种子数占供试种子数的百分比即为发芽率(%)。
叶绿素、株高、干物质量:水培90 d(小麦拔节期)时,每处理随机选取30片生长一致的旗叶进行叶绿素含量的测定;同时每处理随机选取30株小麦植株,每株分离为地上和地下部分,进行株高的测量;最后测定根干物质量与地上部干物质量。测定方法同大田试验。
根系活力:采用氯化三苯基四氮唑还原法(TTC法)进行测定,无色的TTC能被根系还原为红色的物质,产物的多少与根系的琥珀酸脱氢酶活性呈正比,因此,可用单位时间内单位质量的根系还原的TTC量(单位为mg/(g·h))来表示根系活力强弱[22]。根系活力与根系构型的测定取样时间亦为水培90 d。
根系构型:将用蒸馏水清洗干净的小麦根系放入装有少量水的有机玻璃盘上,用镊子小心将每条根展开,使根与根之间不交叉、不重叠,用EPSON扫描仪(V370)进行扫描,再用根系图像分析软件WinRHIZO Reg. 2012b(Regent Instrument Inc.)对扫描图进行定量测定,测定指标分别为总根长、总根表面积、总根体积、根直径、总根尖数[23]。
1.5 数据分析
试验数据采用Excel 2016和SPSS 22软件进行统计分析,以平均数加减标准差(X±s)表示。用单因素(One-way ANOVA)和Duncan新复极差法进行方差分析和多重比较,并用Origin 9.0软件进行绘图。
2 结果与分析
2.1 大田试验
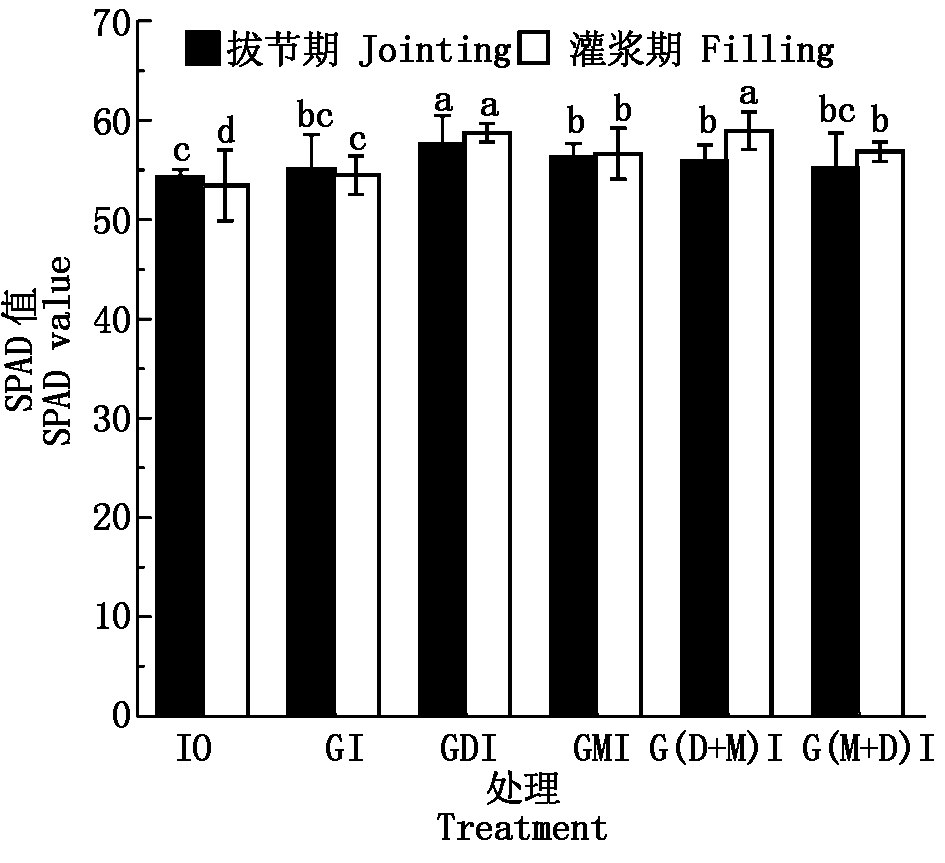
2.1.1 活化水灌溉对小麦叶片叶绿素含量(SPAD)值的影响 图2为不同类型灌溉水处理下小麦拔节期与灌浆期旗叶SPAD值。由图2可知,不同灌水处理拔节期与灌浆期小麦旗叶SPAD值均大于I0处理,分别提高了1.5%~6.1%与1.9%~10.3%。同一灌溉量水平(180 mm)下,拔节期小麦旗叶SPAD值由大到小为GDI>GMI>G(D+M)I>G(M+D)I>GI,其中GDI处理显著最高(P<0.05);灌浆期小麦旗叶SPAD值由大到小则为G(D+M)I>GDI>G(M+D)I>GMI>GI,各类活化水灌溉处理较地下水灌溉显著提高了4.0%~8.3%(P<0.05)。另外,零灌溉与地下水灌溉处理的小麦叶片SPAD值表现为灌浆期低于拔节期,分别低0.9,0.7;各类活化水灌溉处理则表现为灌浆期高于拔节期,高0.3~3.0。这可能是因为活化水灌溉处理下灌浆后期小麦叶片仍保持绿色,推测活化水灌溉可减慢生长后期叶片SPAD值的降低,延长小麦灌浆期,有利于光合产物的增加。
2.1.2 活化水灌溉对小麦株高与干物质量的影响 不同灌溉水处理下,小麦拔节期-灌浆期株高与干物质量的增量表现出一定差异(图3)。如图3-A,拔节期-灌浆期,GDI、GMI、G(D+M)I、G(M+D)I处理下小麦株高的增量分别为13.3,11.0,11.6,11.0 cm,10、GI处理下小麦株高的增量分别为3.2,8.2 cm,GDI、GMI、G(D+M)I、G(M+D)I处理小麦株高的增量显著高于I0与GI处理的增量(P<0.05),且较GI处理分别提高了62.1%,33.5%,40.6%,33.8%。如图3-B,拔节期-灌浆期小麦干物质量的增量亦表现为GDI、GMI、G(D+M)I、G(M+D)I处理显著高于I0与GI处理(P<0.05),较GI处理分别提高了157.9%,123.7%,139.5%,118.4%。由以上结果可知,相同的灌溉量,各类活化水灌溉处理下的小麦株高增长速率与地上部干物质量的累积效果均优于地下水灌溉,其中去电子水灌溉处理效果最佳。
不同小写字母表示处理间差异显著(P<0.05)。图3-5同。
The different small letters indicate significant differences among treatments(P<0.05).The same as Fig.3-5.
图2 小麦拔节期与灌浆期各处理旗叶SPAD值
Fig.2 The SPAD value of flag leaves in each treatment at the jointing and filling stages of wheat
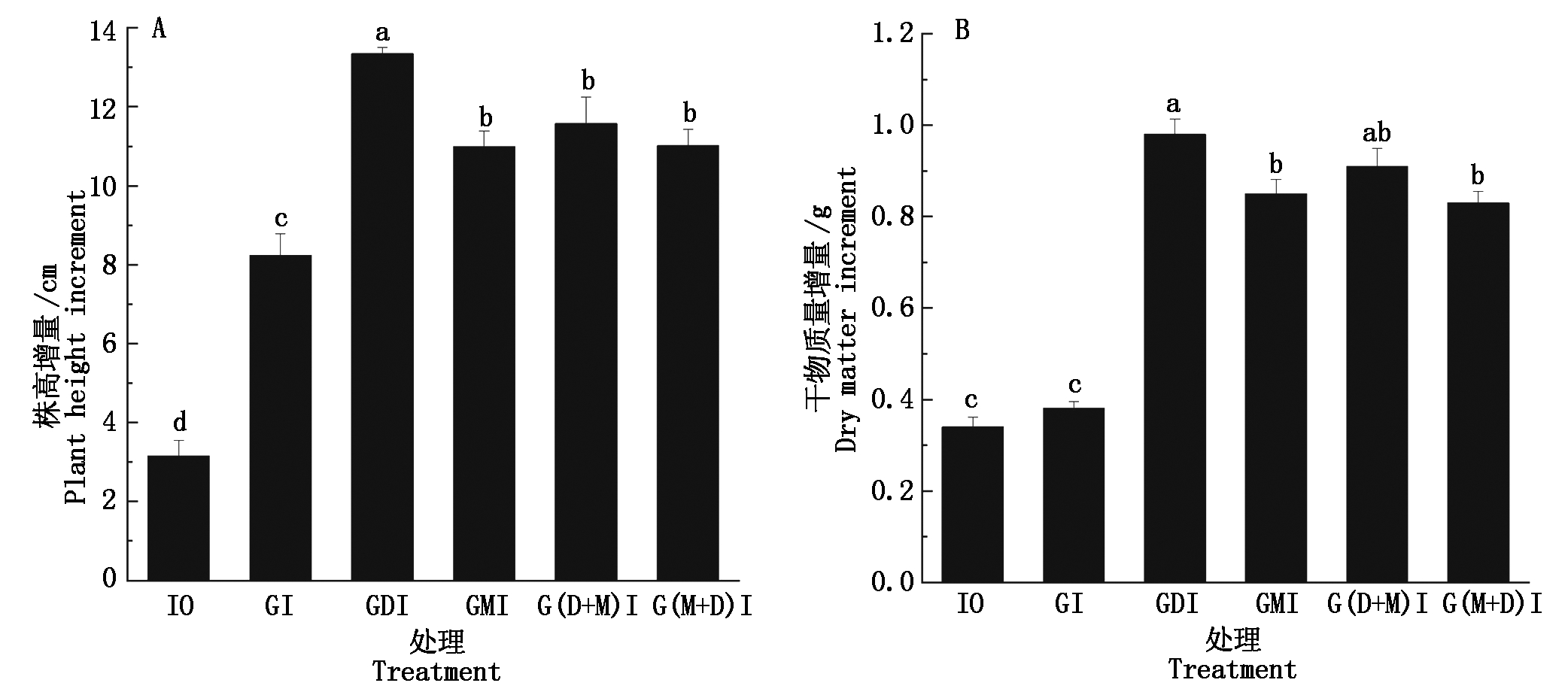
图3 小麦拔节期-灌浆期各处理株高与干物质量的增量
Fig.3 The increment of plant height and dry matter of wheat in each treatment from jointing to filling stage
2.1.3 活化水灌溉对小麦产量及产量构成的影响 不同灌溉水处理对小麦产量及产量构成的影响不同(表2)。由表2可知,I0处理的穗数与产量均显著低于各灌水处理,表明全生育期不灌水抑制了小麦产量的形成。同一灌溉量水平(180 mm)下,GDI、GMI、G(D+M)I、G(M+D)I处理的穗粒数显著高于GI处理,且GDI处理的小麦穗数(572/m2)较GI处理(525/m2)显著提高了9.0%(P<0.05),各灌溉处理间小麦千粒质量的差异均未达到显著水平。就小麦的产量而言,GDI、G(D+M)I、G(M+D)I处理的小麦产量较GI处理显著提高了17.8%,15.4%,2.8%(P<0.05);GMI处理的产量较GI处理提高了1.0%,二者之间差异不显著(P>0.05)。说明同一灌溉量处理下,活化水较地下水灌溉更有利于产量的提升,且去电子水、先去电子后磁化水灌溉处理时能够获得更高的产量。
表2 活化水灌溉处理下小麦的产量及产量构成
Tab.2 The yield and yield components of wheat under activated water irrigation
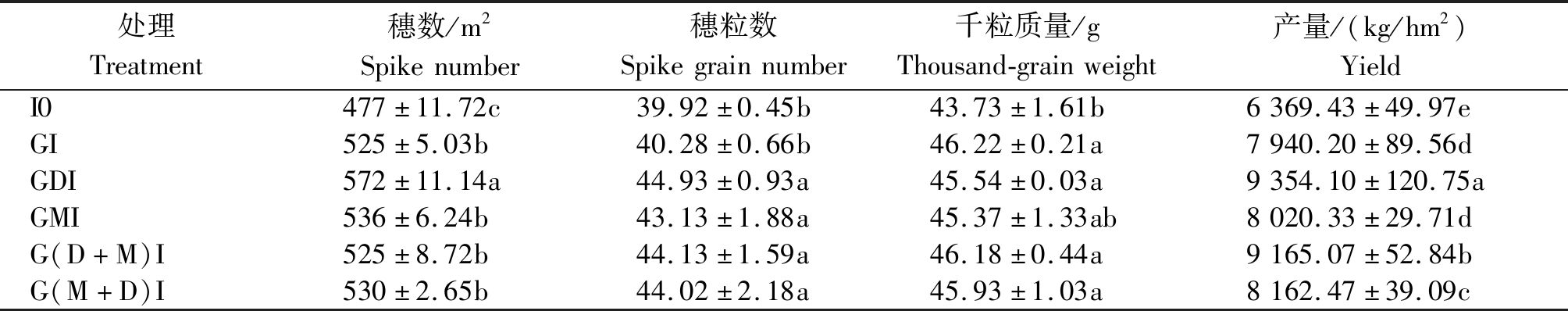
处理Treatment穗数/m2Spikenumber穗粒数Spikegrainnumber千粒质量/gThousand-grainweight产量/(kg/hm2)YieldI0477±11.72c39.92±0.45b43.73±1.61b6369.43±49.97eGI525±5.03b40.28±0.66b46.22±0.21a7940.20±89.56dGDI572±11.14a44.93±0.93a45.54±0.03a9354.10±120.75aGMI536±6.24b43.13±1.88a45.37±1.33ab8020.33±29.71dG(D+M)I525±8.72b44.13±1.59a46.18±0.44a9165.07±52.84bG(M+D)I530±2.65b44.02±2.18a45.93±1.03a8162.47±39.09c
注:同列不同小写字母表示处理间在0.05水平差异显著。表3-4同。
Note:Different small letters in the same column indicate significant differences among treatments at 0.05 level. The same as Tab.3-4.
2.2 室内水培试验
2.2.1 活化水对小麦种子发芽率的影响 不同水处理下的小麦种子发芽率有所差异,去电子水、磁化水、先去电子后磁化水、先磁化后去电子水处理的小麦种子发芽率均高于地下水处理(图4)。各处理小麦种子的发芽率由大到小为G(D+M)>GD>G(M+D)>GM>G,其中G(D+M)处理的发芽率(69.0%)显著高于其他处理(P<0.05),其他处理间差异不显著(P>0.05),G(D+M)、GD、G(M+D)和
GM处理分别较G处理提高了64.3%,19.8%,16.7%,4.0%。整体来看,相对于地下水,活化水处理可以促进小麦种子的萌发,其中去电子水处理的效果优于磁化水,同时去电子与磁化2种活化方式叠加耦合的效果为先去电子后磁化处理的影响较大。
2.2.2 活化水对小麦株高、干物质量与叶片叶绿素含量的影响 由表3可知,不同活化水处理的小麦干物质量与叶片叶绿素含量均显著大于地下水处理(P<0.05),株高则表现为各处理间无显著差异(P>0.05)。叶片叶绿素含量方面,GD、G(D+M)、GM与G(M+D)处理较G处理提高了8.9%~17.3%,GD处理增幅最大,G(M+D)处理增幅最小。地上部干物质量与根干物质量方面,GD、GM、G(D+M)、G(M+D)处理的地上部干物质量与根干物质量分别较G处理提高了101.3%,85.2%,102.4%,59.6%与90.9%,66.6%,75.5%,35.9%,可见活化水处理对小麦地上部干物质量的影响大于根部。综上所述,地下水经活化处理后培养小麦可增加其叶片叶绿素含量,同时促进干物质量的累积,这与大田试验的结果一致。但株高的提升幅度较小,可能是因为试验处于水培条件下,各处理小麦伸长所需水分的供给均较充足。
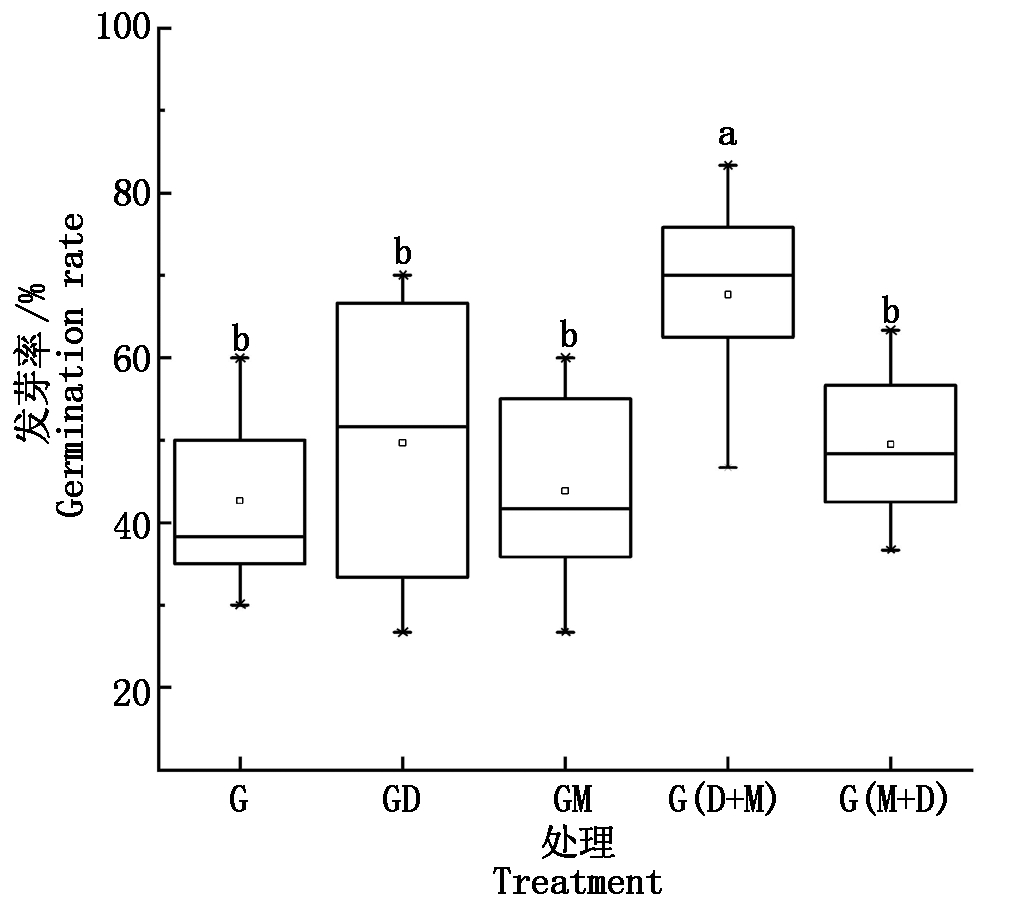
图4 活化水处理对小麦种子发芽率的影响
Fig.4 Effects of activated water treatments on germination rate of wheat seeds
表3 活化水处理对小麦株高、干物质量与叶片叶绿素含量的影响
Tab.3 Effects of activated water treatments on plant height,biomass and leaf chlorophyll content of wheat
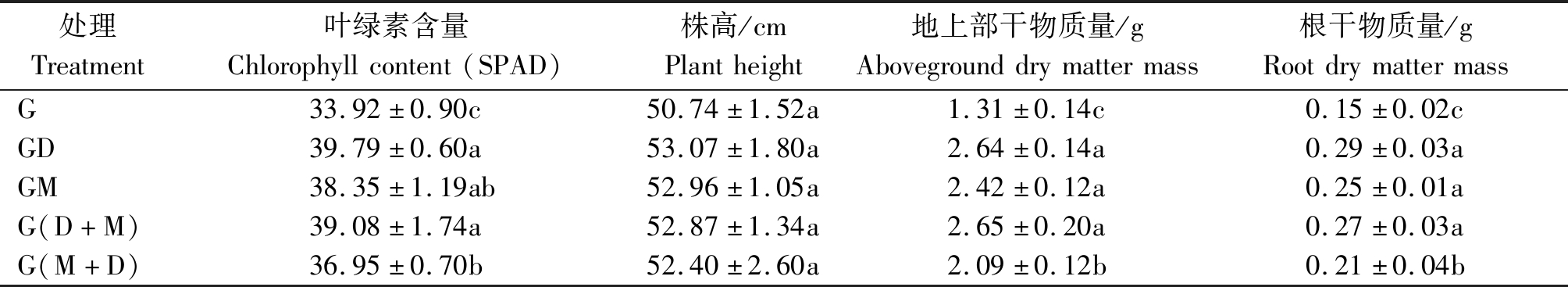
处理Treatment叶绿素含量Chlorophyllcontent(SPAD)株高/cmPlantheight地上部干物质量/gAbovegrounddrymattermass根干物质量/gRootdrymattermassG33.92±0.90c50.74±1.52a1.31±0.14c0.15±0.02cGD39.79±0.60a53.07±1.80a2.64±0.14a0.29±0.03aGM38.35±1.19ab52.96±1.05a2.42±0.12a0.25±0.01aG(D+M)39.08±1.74a52.87±1.34a2.65±0.20a0.27±0.03aG(M+D)36.95±0.70b52.40±2.60a2.09±0.12b0.21±0.04b
2.2.3 活化水对小麦根系构型的影响 各类活化水与地下水处理对小麦根系构型各参数的影响不同(表4),其中总根表面积、总根体积、根直径、总根尖数等根系构型指标在GD处理时最大,总根长则是G(D+M)处理最大。小麦的总根长表现为各活化水处理均显著大于地下水(G)处理(P<0.05),G(D+M)、GD处理的总根长较G处理分别增加了36.1%,32.7%,高于GM、G(M+D)处理的增幅(22.0%,17.6%)。各处理的总根表面积与总根体积的大小均为GD>G(D+M)>GM>G(M+D)>G,其中GD处理显著最大(P<0.05),其总根表面积与总根体积较G处理分别提高了42.0%,52.6%。总根尖数方面,与G处理相比,GD、GM、G(D+M)、G(M+D)处理的总根尖数分别增加了29.7%,17.6%,17.3%,10.7%。根直径则表现为GD处理较G处理显著提高了9.4%(P<0.05),其他各处理间差异不显著(P>0.05)。总体看来,各类活化水处理对小麦总根长、总根表面积、总根体积、总根尖数等根系构型各指标的提高具有明显的促进作用,且去电子水、先去电子后磁化水的效果较为显著。
表4 活化水处理对小麦根系构型的影响
Tab.4 Effects of activated water treatments on root configuration of wheat
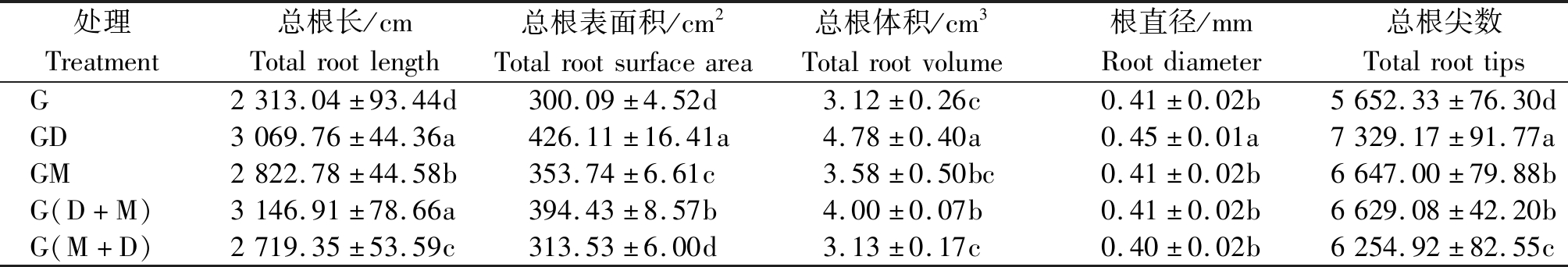
处理Treatment总根长/cmTotalrootlength总根表面积/cm2Totalrootsurfacearea总根体积/cm3Totalrootvolume根直径/mmRootdiameter总根尖数TotalroottipsG2313.04±93.44d300.09±4.52d3.12±0.26c0.41±0.02b5652.33±76.30dGD3069.76±44.36a426.11±16.41a4.78±0.40a0.45±0.01a7329.17±91.77aGM2822.78±44.58b353.74±6.61c3.58±0.50bc0.41±0.02b6647.00±79.88bG(D+M)3146.91±78.66a394.43±8.57b4.00±0.07b0.41±0.02b6629.08±42.20bG(M+D)2719.35±53.59c313.53±6.00d3.13±0.17c0.40±0.02b6254.92±82.55c
2.2.4 活化水对小麦根系活力的影响 图5为各类活化水与地下水处理下小麦根系活力的测定结果。根系活力的大小为GD>G(D+M)>G(M+D)>GM>G,其中不同活化水处理均显著高于地下水处理(P<0.05),GD、G(D+M)处理的根系活力较G处理分别提高了194.2%,162.7%,高于G(M+D)、GM处理的增幅(86.3%,75.8%),且GD与G(D+M)处理的根系活力分别显著高于GM与G(M+D)处理(P<0.05)。可见,活化水均有利于显著提高小麦的根系活力,其中去电子、先去电子后磁化处理的效果优于磁化、先磁化后去电子处理。
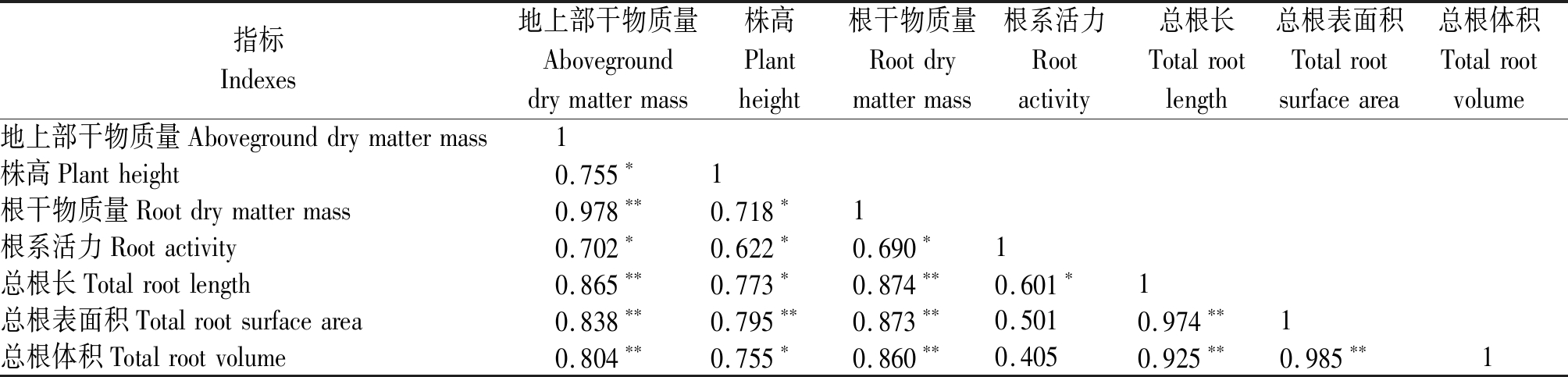
2.2.5 小麦生长指标的相关性 通过对不同水分条件下的小麦植株地上部干物质量、株高、根干物质量、根系活力及各根系构型指标之间的相关性分析(表5)可知,小麦的地上部干物质量与株高、根系活力呈显著正相关(P<0.05),与根干物质量、总根长、总根表面积、总根体积呈极显著正相关(P<0.01);株高与根干物质量、根系活力、总根长、总根体积呈显著正相关(P<0.05),与总根表面积呈极显著正相关(P<0.01);根干物质量与根系活力呈显著正相关(P<0.05),与总根长、总根表面积、总根体积呈极显著正相关(P<0.01);根系活力与地上部干物质量、株高、根干物质量、总根长呈显著正相关(P<0.05);各根系构型指标之间的相关性极显著(P<0.01)。
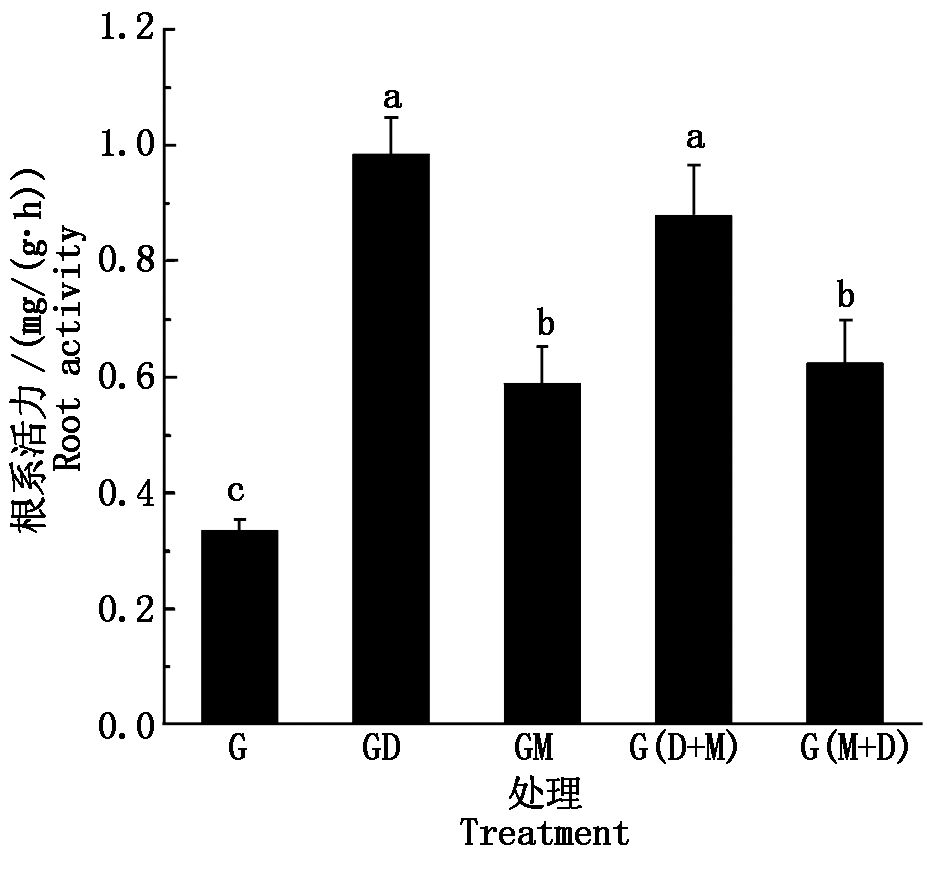
图5 活化水处理对小麦根系活力的影响
Fig.5 Effects of activated water treatments on root activity of wheat
表5 小麦生长指标的相关性分析结果
Tab.5 Correlation analysis result of wheat growth indexes
指标Indexes地上部干物质量Abovegrounddrymattermass株高Plantheight根干物质量Rootdrymattermass根系活力Rootactivity总根长Totalrootlength总根表面积Totalrootsurfacearea总根体积Totalrootvolume地上部干物质量Abovegrounddrymattermass1株高Plantheight0.755∗1根干物质量Rootdrymattermass0.978∗∗0.718∗1根系活力Rootactivity0.702∗0.622∗0.690∗1总根长Totalrootlength0.865∗∗0.773∗0.874∗∗0.601∗1总根表面积Totalrootsurfacearea0.838∗∗0.795∗∗0.873∗∗0.5010.974∗∗1总根体积Totalrootvolume0.804∗∗0.755∗0.860∗∗0.4050.925∗∗0.985∗∗1
注:*和**分别表示显著(P<0.05)和极显著(P<0.01)相关性。
Note:* and ** indicate significant(P<0.05)and very significant(P<0.01)correlation,respectively.
3 讨论与结论
水大量存在于作物细胞中,作为细胞的重要组成成分,其参与了植株整个生长过程中的新陈代谢。水经活化处理(磁化、去电子等)后,其理化特性发生了一定程度的改变,这些变化对维持植物正常新陈代谢具有促进作用[7]。相关研究表明,尽管磁化与去电子技术的作用途径和方式有所不同,但对水理化性质(接触角、黏度、电导率、表面张力等)的改变效果具有相似的作用[10]。在室温下,水一般以30~40个水分子依靠氢键缔合成分子团簇结构存在[24]。水被磁化与去电子后,水分子间平均距离增大,部分氢键变弱甚至断裂,缔合水分子簇变小,大分子团变为小分子团[25],这使得水的活力增加,水分子与其他物质作用的能力提高,从而直接影响物质传输与作物生长[10,26]。
3.1 活化水对小麦植株地上部生长的影响
小麦的株高、生物量等形态指标是影响其产量形成的重要因素[27]。研究表明,活化水能够促进植株生长,并为细胞提供大量的能量,有利于细胞的分裂、生长和发育[28],有增加作物产量与改善作物品质的功效。赵国林等[11]通过2 a的大田试验,证明磁化水浸种可促进小麦种子萌发,并提高小麦幼苗生长势,与对照相比,单位面积有效穗数与穗粒数增加,2 a平均增产14.7%。然而邱念伟等[29]通过水培试验研究表明,磁化水处理对小麦的发芽参数和幼苗生长无明显的生物学效应。本研究结果表明,活化水灌溉可以加快小麦地上部的生长且增产。具体表现为同一灌溉量水平(180 mm)下,拔节期-灌浆期,活化水灌溉的小麦株高增长速率与干物质累积量均显著高于地下水灌溉处理;且各类活化水灌溉处理收获时的小麦产量较地下水灌溉提高了1.0%~17.8%。同样室内水培试验也发现,各类活化水培养的小麦种子发芽率较地下水处理提高了4.0%~64.3%,地上部干物质量也显著提高了59.6%~102.4%。
作为叶绿体中最为重要的色素,叶绿素在光合作用过程中可以吸收和转化光能,叶绿素含量的多少决定了植物光合作用的强弱、生物量积累以及植物生长状况[30]。已有研究证明,活化水(磁化水与去电子水)灌溉能促进植株体内叶绿素含量的增加,且提高净光合速率,在棉花[16-17]、番茄(Lycopersicon esculentum)[8]、红鲜椒(Capsicum annuum)[31]、豇豆(Vigna unguiculata)[32]等作物上均有报道。本研究中,田间与室内水培试验均证实了经活化水处理的小麦叶片叶绿素含量高于地下水处理,提高了8.9%~17.3%,且大田试验发现活化水灌溉的小麦灌浆期叶片SPAD值较拔节期高0.3~3.0,地下水灌溉处理则较拔节期降低0.7,由此可知,活化水灌溉可减慢生长后期叶片SPAD值的降低,促进小麦叶片叶绿素的积累。
3.2 活化水对小麦根系生长的影响
小麦根系的生长、发育、分布和形态构建除了由本身的品种特性决定外,还受各种农艺措施的影响[33]。有国外学者发现,磁场处理对作物根系生长的促进作用较明显,且根系对活化水的响应大于地上部[34]。同样,我国学者也发现,与普通水灌溉相比,磁化水灌溉的农作物根系生长与发育情况较优[35]。赵黎明等[36]研究表明,水稻秧苗经磁化水处理一段时间后,其根数、根长分别增加了21.74%,20.62%。张新宇等[37]研究发现,磁化处理对扦插苗根系形态有显著影响,其根直径、根表面积、根体积显著高于对照处理。本研究的试验结果与上述结论相似,与地下水处理相比,各类活化水培养的小麦根干物质量与根系活力分别显著提高了35.9%~90.9%与75.8%~194.2%,同时各根系构型指标(总根长、总根表面积、总根体积、总根尖数等)也显著增大。
3.3 活化水影响小麦生长的潜在作用
大量研究表明,活化水灌溉可以增加作物产量,而产量的增加是在作物吸收更多水分和养分的基础上完成的[10-11,16,38]。根系作为直接与土壤或营养液接触的重要器官,影响作物吸收水分及养分的过程,作物的生长及产量形成由根系是否正常生长发育决定[39]。相关研究表明,植物的地下部分与地上部分是相互协调的关系,地上部分的生长和营养状况由根系的生长情况和活力水平直接影响[20]。总根长、总根表面积等形态学参数可以反映根系吸收水分与养分的强度和范围[40],适宜的根系形态与健壮的根系能为植株提供充足的水分与养分[41]。除此之外,根系活力是一种客观反映根系生命活动的生理指标,其泛指根系新陈代谢能力的强弱,包括吸收、合成、呼吸作用和氧化力等[42]。根系活力越高,吸收水分与养分的能力越强,且较强的根系活力有助于延缓地上部衰老,促进光合产物的合成与转运[43],因此与产量的形成密切相关,相关系数达0.9以上[44-45]。本研究的室内水培试验也发现小麦株高、地上部干物质量等指标与根干物质量、根系活力、总根长、总根表面积、总根体积均呈显著或极显著的正相关关系,说明经活化水培养的小麦根系活力增强,根系构型显著改善,根干物质量与根系活力较地下水分别显著提高了35.9%~90.9%与75.8%~194.2%,使其吸收营养物质的能力提高,维持植物旺盛代谢,进而促进地上部的生长和生物量的积累,其中地上部干物质量提高了59.6%~102.4%。综上所述,活化水促进小麦植株生长的潜在作用在于其对根系生长有明显的促进作用,而其提升根系活力与根系构型的机理尚不清楚,仍有待于进一步研究。
[1] Huang J,Ridoutt B G,Thorp K R,Wang X C,Lan K,Liao J,Tao X,Wu C Y,Huang J L,Chen F,Scherer L. Water-scarcity footprints and water productivities indicate unsustainable wheat production in China[J].Agricultural Water Management,2019,224:105744. doi:10.1016/j.agwat.2019.105744.
[2] 郝晓燕. 我国小麦生产区位集聚:特征、影响因素及增长效应[D]. 北京:中国农业大学,2019.
Hao X Y. Agglomeration of wheat production location in China:characteristics,influencing factors and growth effects[D]. Beijing:China Agricultural University,2019.
[3] 刘兆辉,吴小宾,谭德水,李彦,江丽华. 一次性施肥在我国主要粮食作物中的应用与环境效应[J]. 中国农业科学,2018,51(20):3827-3839.doi:10.3864/j.issn.0578-1752.2018.20.002.
Liu Z H,Wu X B,Tan D S,Li Y,Jiang L H. Application and environmental effects of one-off fertilization technique in major cereal crops in China[J]. Scientia Agricultura Sinica,2018,51(20):3827-3839.
[4] Maheshwari B L,Grewal H S. Magnetic treatment of irrigation water:Its effects on vegetable crop yield and water productivity[J]. Agricultural Water Management,2009,96(8):1229-1236.doi:10.1016/j.agwat.2009.03.016.
[5] 郑利兵,佟娟,魏源送,王军,岳增刚,王钢.磁分离技术在水处理中的研究与应用进展[J].环境科学学报,2016,36(9):3103-3117.doi:10.13671/j.hjkxxb.2015.0775.
Zheng L B,Tong J,Wei Y S,Wang J,Yue Z G,Wang G. The progress of magnetic separation technology in water treatment[J].Acta Scientiae Circumstantiae,2016,36(9):3103-3117.
[6] 王艳红,杨小刚. 磁化水处理技术及其在农业上的应用[J]. 农业工程,2014,4(5):74-77.doi:10.3969/j.issn.2095-1795.2014.05.023.
Wang Y H,Yang X G. Magnetized water treatment technology and its application in agriculture[J]. Agricultural Engineering,2014,4(5):74-77.
[7] 穆艳,赵国庆,赵巧巧,刘皓,王全九. 活化水灌溉在农业生产中的应用研究进展[J]. 农业资源与环境学报,2019,36(4):403-411.doi:10.13254/j.jare.2019.0106.
Mu Y,Zhao G Q,Zhao Q Q,Liu H,Wang Q J. Advance in the application of activated water irrigation[J].Journal of Agricultural Resources and Environment,2019,36(4):403-411.
[8] Diaz C E D,Riquenes J A,Sotolongo B,Portuondo M A,Quintana E O,Perez R. Effects of magnetic treatment of irrigation water on the tomato crop[J]. Horticulture Abstracts,1997,69:494.
[9] 张瑞喜,王卫兵,褚贵新. 磁化水在盐渍化土壤中的入渗和淋洗效应[J]. 中国农业科学,2014,47(8):1634-1641.doi:10.3864/j.issn.0578-1752.2014.08.019.
Zhang R X,Wang W B,Chu G X. Impacts of magnetized water irrigation on soil infiltration and soil salt leaching[J].Scientia Agricultura Sinica,2014,47(8):1634-1641.
[10] 王全九,孙燕,宁松瑞,张继红,周蓓蓓,苏李君,单鱼洋. 活化灌溉水对土壤理化性质和作物生长影响途径剖析[J]. 地球科学进展,2019,34(6):660-670. doi:10.11867/j.issn.1001-8166.2019.06.0660.
Wang Q J,Sun Y,Ning S R,Zhang J H,Zhou B B,Su L J,Shan Y Y.Effects of activated irrigation water on soil physicochemical properties and crop growth and analysis of the probable pathway[J]. Advances in Earth Science,2019,34(6):660-670.
[11] 赵国林,曹宏,张国柱,李高清. 磁化水浸种对小麦生理代谢及增产效应的研究[J]. 西北农业学报,1997,6(4):42-46.
Zhao G L,Cao H,Zhang G Z,Li G Q. Effect of soaking wheat seed in magnetized water on physiological metabolism and production increasement[J]. Acta Agriculturae Boreali-Occidentalis Sinica,1997,6(4):42-46.
[12] Savostin P V. Magnetic growth relations in plants[J]. Planta,1964,12:327.
[13] Massah J,Dousti A,Khazaei J,Vaezzadeh M.Effects of water magnetic treatment on seed germination and seedling growth of wheat[J]. Journal of Plant Nutrition,2019,42(11-12):1283-1289. doi:10.1080/01904167.2019.1617309.
[14] 朱练峰,张均华,禹盛苗,胡志华,金千瑜. 磁化水灌溉促进水稻生长发育提高产量和品质[J]. 农业工程学报,2014,30(19):107-114.doi:10.3969/j.issn.1002-6819.2014.19.013.
Zhu L F,Zhang J H,Yu S M,Hu Z H,Jin Q Y. Magnetized water irrigation enhanced rice growth and development,improved yield and quality[J]. Transactions of the Chinese Society of Agricultural Engineering,2014,30(19):107-114.
[15] 王全九,许紫月,单鱼洋,张继红. 去电子处理微咸水矿化度对土壤水盐运移特征的影响[J]. 农业工程学报,2018,34(4):125-132.doi:10.11975/j.issn.1002-6819.2018.04.015.
Wang Q J,Xu Z Y,Shan Y Y,Zhang J H. Effect of salinity of de-electronic brackish water on characteristics of water and salt movement in soil[J]. Transactions of the Chinese Society of Agricultural Engineering,2018,34(4):125-132.
[16] 韦开. 去电子微咸水膜下滴灌水盐运移及棉花生长特征研究[D].西安:西安理工大学,2018.
Wei K. Research on soil water-salt distribution and cotton growth characteristics using de-electronic brackish water drip irrigation with plastic mulh[D]. Xi′an:Xi′an University of Technology,2018.
[17] 唐湘伟. 去电子微咸水膜下滴灌土壤水氮对棉花生长耦合作用研究[D]. 西安:西安理工大学,2019.
Tang X W. Study on coupling effects of soil water and nitrogen on cotton growth under drip irrigation under de-electronic brackish water film[D]. Xi′an:Xi′an University of Technology,2019.
[18] 杨习文,田霄鸿,陆欣春,曹玉贤,买文选. 螯合-缓冲营养液中不同磷锌配比对小麦苗期磷-锌关系的影响[J]. 中国生态农业学报,2009,17(6):1055-1062.doi:10.3724/SP.J.1011.2009.01055.
Yang X W,Tian X H,Lu X C,Cao Y X,Mai W X. Effect of varying combination of P and Zn in chelater-buffered solution on P-Zn interaction in wheat seedling[J]. Chinese Journal of Eco-Agriculture,2009,17(6):1055-1062.
[19] 张洋,翟丙年. 水分胁迫条件下氮素营养对不同冬小麦基因型的生理效应[J]. 麦类作物学报,2010,30(3):492-495.doi:10.7606/j.issn.1009-1041.2010.03.020.
Zhang Y,Zhai B N. Physiological effects of nitrogen on different winter wheat genotypes under water stress[J]. Journal of Triticeae Crops,2010,30(3):492-495.
[20] 周丽平,袁亮,赵秉强,李燕婷,林治安. 不同用量风化煤腐殖酸对玉米根系的影响[J]. 中国农业科学,2019,52(2):285-292.doi:10.3864/j.issn.0578-1752.2019.02.008.
Zhou L P,Yuan L,Zhao B Q,Li Y T,Lin Z A. Response of maize roots to different additive amounts of weathered coal humic acids[J]. Scientia Agricultura Sinica,2019,52(2):285-292.
[21] 王全九,许紫月,单鱼洋,张继红. 磁化微咸水矿化度对土壤水盐运移的影响[J]. 农业机械学报,2017,48(7):198-206.doi:10.6041/j.issn.1000-1298.2017.07.025.
Wang Q J,Xu Z Y,Shan Y Y,Zhang J H. Effects of salinity of magnetized brackish water on salt and water movement[J]. Transactions of the Chinese Society for Agricultural Machinery,2017,48(7):198-206.
[22] Zhang X,Huang G,Bian X,Zhao Q. Effects of root interaction and nitrogen fertilization on the chlorophyll content,root activity,photosynthetic characteristics of intercropped soybean and microbial quantity in the rhizosphere[J]. Plant Soil Environment,2013,59(2):80-88.doi:10.17221/613/2012-PSE.
[23] 张向前,曹承富,乔玉强,李玮,陈欢. 砂姜黑土小麦根系性状与冠层光合对不同灌水方式的响应[J]. 中国农业科学,2015,48(8):1506-1517. doi:10.3864/j.issn.0578-1752.2015.08.05.
Zhang X Q,Cao C F,Qiao Y Q,Li W,Chen H. Response of wheat root characteristics and canopy photosynthesis to different irrigation methods in lime concretion black soil[J]. Scientia Agricultura Sinica,2015,48(8):1506-1517.
[24] 黎礼丽,朱伯和,黄静文,蒋超,张永洪,彭兴宇.水分子结构及其应用研究综述[J].农业与技术,2019,39(16):50-51.doi:10.19754/j.nyyjs.20190830017.
Li L L,Zhu B H,Huang J W,Jiang C,Zhang Y H,Peng X Y. Research review of water molecular structure and its application[J]. Agriculture and Technology,2019,39(16):50-51.
[25] 王全九,张继红,门旗,谭帅,周莉薇,刘湘岩. 磁化或电离化微咸水理化特性试验[J]. 农业工程学报,2016,32(10):60-66.doi:10.11975/j.issn.1002-6819.2016.10.009.
Wang Q J,Zhang J H,Men Q,Tan S,Zhou L W,Liu X Y. Experiment on physical and chemical characteristics of activated brackish water by magnetization or ionization[J]. Transactions of the Chinese Society of Agricultural Engineering,2016,32(10):60-66.
[26] Toledo E J L,Ramalho T C,Magriotis Z M. Influence of magnetic field on physical-chemical properties of the liquid water:insights from experimental and theoretical models[J]. Journal of Molecular Structure,2008,888(1-3):409-415.doi:10.1016/j.molstruc.2008.01.010.
[27] 王秀波,上官周平. 干旱胁迫下氮素对不同基因型小麦根系活力和生长的调控[J]. 麦类作物学报,2017,37(6):820-827. doi:10.7606/j.issn.1009-1041.2017.06.014.
Wang X B,Shangguan Z P. Effect of nitrogen on root vigor and growth in different genotypes of wheat under drought stress[J]. Journal of Triticeae Crops,2017,37(6):820-827.
[28] 徐卫辉,石歆莹,邓国础,钟如龙,杨明生. 核磁共振对水稻胚超微结构的影响[J]. 激光生物学,1994,3(1):400-403.
Xu W H,Shi X Y,Deng G C,Zhong R L,Yang M S. Effects of nuclear magnetic resonance on ultrastructure of embryo in rice seeds[J]. Laser Biology,1994,3(1):400-403.
[29] 邱念伟,谭廷鸿,戴华,沈璇,韩冉,林燕,马宗琪. 磁化水对小麦种子萌发、幼苗生长和生理特性的生物学效应[J]. 植物生理学报,2011,47(8):803-810.doi:10.13592/j.cnki.ppj.2011.08.005.
Qiu N W,Tan T H,Dai H,Shen X,Han R,Lin Y,Ma Z Q. Biological effects of magnetized water on seed germination,seedling growth and physiological characteristics of wheat[J]. Plant Physiology Journal,2011,47(8):803-810.
[30] 杜祥备,王家宝,刘小平,夏家平,韩杨. 减氮运筹对甘薯光合作用和叶绿素荧光特性的影响[J]. 应用生态学报,2019,30(4):1253-1260. doi:10.13287/j.1001-9332.201904.012.
Du X B,Wang J B,Liu X P,Xia J P,Han Y. Effects of nitrogen fertilizer reduction management on photosynthesis and chlorophyll fluorescence characteristics of sweetpotato[J]. Chinese Journal of Applied Ecology,2019,30(4):1253-1260.
[31] Marei A,Rdaydeh D,Karajeh D,Abu-khalaf N. Effect of using magnetic brackish water on irrigated bell pepper crop(Capsicum annuum L.)characteristics in lower Jordan Valley/West Bank[J]. Journal of Agricultural Science and Technology,2014,4(10):830-838. doi:10.17265/2161-6256/2014.10.005.
[32] Sadeghipour O,Aghaei P. Improving the growth of cowpea(Vigna unguiculata L. Walp.)by magnetized water[J].Journal of Biodiversity and Environmental Sciences,2013,3(1):37-43.
[33] 张向前,曹承富,陈欢,乔玉强,杜世州,李玮,赵竹,徐云姬. 长期定位施肥对砂姜黑土小麦根系性状和根冠比的影响[J]. 麦类作物学报,2017,37(3):382-389. doi:10.7606/j.issn.1009-1041.2017.03.15.
Zhang X Q,Cao C F,Chen H,Qiao Y Q,Du S Z,Li W,Zhao Z,Xu Y J. Effect of long-term fertilization on root traits and root-shoot ratio of wheat in lime concretion black soil[J]. Journal of Triticeae Crops,2017,37(3):382-389.
[34] Vashisth A,Nagarajan S. Exposure of seeds to static magnetic field enhances germination and early growth characteristics in chickpea(Cicer arietinum L.)[J]. Bio Electro Magnetics,2008,29(7):571-578. doi:10.1002/bem.20426.
[35] 毕思圣. 磁化水灌溉对桑树硬枝扦插生根的影响[D]. 泰安:山东农业大学,2018.
Bi S S. Effect of magnetized water on hardwood cuttings rooting of Morus alba[D]. Tai′an:Shandong Agricultural University,2018.
[36] 赵黎明,顾春梅,王士强,王丽萍,王贺,那永光,解保胜. 日光温室下磁化水对水稻秧苗生长发育的影响[J]. 灌溉排水学报,2016,35(12):34-38. doi:10.13522/j.cnki.ggps.2016.12.007.
Zhao L M,Gu C M,Wang S Q,Wang L P,Wang H,Na Y G,Xie B S. Effects of magnetized water on growth of rice seedlings in solar greenhouse[J]. Journal of Irrigation and Drainage,2016,35(12):34-38.
[37] 张新宇,李庆国,徐金光,王华田,董玉峰. 磁化处理对楸树嫩枝扦插生根及生长的影响[J]. 西北林学院学报,2018,33(6):78-82.doi:10.3969/j.issn.1001-7461.2018.06.13.
Zhang X Y,Li Q G,Xu J G,Wang H T,Dong Y F. Effects of magnetic treatment on rooting and growth of semi-lignified twigs of Catalpa bungei[J]. Journal of Northwest Forestry University,2018,33(6):78-82.
[38] 王艳会,赵国庆,王全九,王力. 去电子水灌溉对冬小麦生长及其水分利用的影响[J]. 农业环境科学学报,2020,39(5):953-963. doi:10.11654/jaes.2019-1339.
Wang Y H,Zhao G Q,Wang Q J,Wang L. Effects of irrigation with de-electronic water on growth and water use of winter wheat[J].Journal of Agro-Environment Science,2020,39(5):953-963.
[39] 张永清. 几种谷类作物根土系统的研究[D]. 晋中:山西农业大学,2005.
Zhang Y Q. Studies on root-soil systems of several grain crops[D].Jinzhong:Shanxi Agricultural University,2005.
[40] Hodge A,Berta G,Doussan C,Merchan F,Crespi M. Plant root growth,architecture and function[J]. Plant and Soil,2009,321(1-2):153-187.doi:10.1007/s11104-009-9929-9.
[41] Flavel R J,Guppy C N,Tighe M K,Watt M,Young I M. Quantifying the response of wheat(Triticum aestivum L.)root system architecture to phosphorus in an Oxisol[J]. Plant and Soil,2014,385(1-2):303-310. doi:10.1007/s11104-014-2191-9.
[42] 熊淑萍,吴克远,王小纯,张捷,杜盼,吴懿鑫,马新明. 不同氮效率基因型小麦根系吸收特性与氮素利用差异的分析[J].中国农业科学,2016,49(12):2267-2279.doi:10.3864/j.issn.0578-1752.2016.12.003.
Xiong S P,Wu K Y,Wang X C,Zhang J,Du P,Wu Y X,Ma X M. Analysis of root absorption characteristics and nitrogen utilization of wheat genotypes with different N efficiency[J]. Scientia Agricultura Sinica,2016,49(12):2267-2279.
[43] 王飞飞,张善平,邵立杰,李耕,陈晓璐,刘鹏,赵秉强,董树亭,张吉旺,赵斌. 夏玉米不同土层根系对花后植株生长及产量形成的影响[J]. 中国农业科学,2013,46(19):4007-4017.doi:10.3864/j.issn.0578-1752.2013.19.006.
Wang F F,Zhang S P,Shao L J,Li G,Chen X L,Liu P,Zhao B Q,Dong S T,Zhang J W,Zhao B. Effect of root in different soil layers on plant growth and yield formation after anthesis in summer maize[J]. Scientia Agricultura Sinica,2013,46(19):4007-4017.
[44] Huang J K,Huang Z R,Jia X P,Hu R F,Xiang C. Long-term reduction of nitrogen fertilizer use through knowledge training in rice production in China[J].Agricultural Systems,2015,135:105-111.doi:10.1016/j.agsy.2015.01.004.
[45] 黄国勤,黄小洋,张兆飞,刘隆旺,章秀福,高旺盛. 免耕对水稻根系活力和产量性状的影响[J]. 中国农学通报,2005,21(5):170-173.doi:10.3969/j.issn.1000-6850.2005.05.051.
Huang G Q,Huang X Y,Zhang Z F,Liu L W,Zhang X F,Gao W S. Effect of no-tillage on the root activity and yield characters in rice[J]. Chinese Agricultural Science Bulletin,2005,21(5):170-173.
