WRKY转录因子是植物中广泛分布的一类转录因子,在不同植物胁迫抗性、发育和生理过程中发挥重要作用[1-3]。该类转录因子具有1~2个60个氨基酸左右的保守WRKY结构域,其N端包括一段WRKYGQK核心序列,结构域的C端是一段类似锌指的结构CX4-5CX22-23HXH或CX7CX23HXC[4]。WRKY 转录因子通过和靶基因启动子上的顺式作用元件W-box(TTGAC(C/T))结合,行使激活或者抑制靶基因转录的功能[5-6]。
目前,已鉴定出的马铃薯(Solanum tuberosum L.)WRKY转录因子超过80个[7],但相对于拟南芥和水稻,马铃薯WRKY转录因子功能的系统研究甚少。Dellagi等[8]利用抑制性差减杂交技术构建了马铃薯cDNA文库,获得了编码172个氨基酸的StWRKY基因,该基因在软腐病菌侵染后表达上调,参与马铃薯对软腐病的抵御过程。2004年从野生马铃薯胚珠中克隆获得编码525个氨基酸的ScWRKY基因,在受精16 d的鱼雷期胚胎中瞬时高表达,在发育完全的根、茎、花粉、雄蕊、雌蕊中表达量偏低,表明ScWRKY可能参与胚胎形成过程[9]。有研究表明,StWRKY1参与抵抗马铃薯晚疫病和水分胁迫[10-11],StWRKY8通过调控生物碱的合成提高马铃薯对晚疫病病原菌的侵染防御[12]。国内学者克隆了WRKY2及WRKY6,发现它们分别对干旱和低钾胁迫积极响应[13-14]。马铃薯StWRKY57的克隆及功能未见报道。拟南芥同源转录因子AtWRKY57可作为激活因子,通过增加脱落酸(ABA)的积累,上调干旱胁迫响应基因RD29A、NCED3和ABA3的表达提高拟南芥的干旱抗性[15]。前期转录组测序结果表明,StWRKY57的表达显著受ABA诱导,相比野生型,过表达StWRKY57基因拟南芥植株表现出更高的干旱耐受性。因而,推测StWRKY57同样正调控马铃薯的干旱胁迫响应。
马铃薯是对水分亏缺非常敏感的作物,干旱胁迫是制约其产量及品质的重要因素[16]。2015年中央一号文件明确提出,将马铃薯定位在继水稻、小麦、玉米之外的第四大主粮作物。开展StWRKY57在干旱胁迫响应中的功能研究对启动马铃薯主粮化战略及在逆境条件下保持马铃薯产量具有重要意义。因而,本研究克隆了马铃薯耐旱品种PB06的转录因子基因WRKY57-PB,并对其编码蛋白进行了生物信息学和原核表达分析,以期为后续生物学功能和分子机制研究奠定基础。
1 材料和方法
1.1 试验材料
以马铃薯耐旱品种PB06为试验材料。表达菌株Tuner、Rosetta、BL21(DE3)、原核表达载体pGEX-KG均由植物激素与生长发育湖南省重点实验室种植或保存;感受态细胞DH5α、T克隆试剂盒pEASY®-Blunt Simple Cloning Kit、高保真DNA聚合酶TransStart®FastPfu DNA Polymerase和Trans2K Plus DNA Marker购于北京全式金生物技术有限公司;RNA提取、反转录试剂盒、限制性内切酶BamH Ⅰ和Sac Ⅰ购于TaKaRa(大连)公司;凝胶回收纯化试剂盒、质粒提取试剂盒购于天根生化科技(北京)有限公司;蛋白Marker(PageRuler Prestained Protein Ladder)、anti-GST抗体、HRP标记的鼠二抗购于引Thermo公司;引物合成及DNA测序由华大基因公司完成,其他试剂均为国产分析纯。
1.2 试验方法
1.2.1 序列的获得及基因克隆 通过在马铃薯基因组数据库(http://solanaceae.plantbiology.msu.edu/)查找开放阅读框ORF,确定CDS区序列。设计引物进行扩增,上游引物序列为:5′-GGATCCAT GGATGAGAACGATAAGCAGG-3′,引入酶切位点BamHⅠ;下游引物序列为:5′-GAATTCTTATCTGCT TCGCATCCCAGGA-3′,引入酶切位点SacⅠ。
取0.2 mg左右马铃薯脱毒苗的茎段在液氮中研磨,加入1 mL TRIzol试剂提取总RNA。用DNase Ⅰ去除gDNA污染后,采用反转录试剂盒将RNA反转录为cDNA。gDNA的去除和反转录的反应条件及程序均按照宝生物工程(大连)有限公司的试剂盒说明书进行。以cDNA为模板扩增StWRKY-PB基因,PCR反应条件为:95 ℃充分预变性2 min;95 ℃变性20 s,56 ℃退火30 s,72 ℃延伸50 s,34个循环后;72 ℃终延伸5 min。将PCR产物切胶回收后,按照说明书进行T克隆并测序获得正确的基因CDS全长。
1.2.2 StWRKY57-PB编码蛋白质生物信息学分析 采用在线工具Protparam(http://web.expasy.org/protparam/)对StWRKY57-PB基因编码蛋白的理化性质进行分析预测;蛋白二级结构与3D结构建模分别采用在线软件SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL(https://swissmodel.expasy.org/interactive)预测;亚细胞定位采用在线软件PSORT(http://www.genscript.com/tools/psort)预测。应用结构域在线分析软件SMART(http://smart.embl.de/)对保守结构域进行验证和功能注释。采用ClustalW软件对StWRKY57-PB与其他物种的同源WRKY蛋白进行氨基酸序列比对及作图,采用MEGA 5.05软件最大简约法构建进化树。
1.2.3 原核表达载体构建及转化 用BamHⅠ和SacⅠ双酶切StWRKY57的T克隆载体以及pGEX-KG,分别回收StWRKY57-PB和pGEX-KG后,按T4 DNA连接酶说明书进行连接反应,采用热激法转化DH5α感受态细胞并筛选到正确克隆。测序正确后,提取质粒pGEX-KG∶∶WRKY57,电击法分别转入到大肠杆菌表达菌株Tuner、Rosetta、BL21(DE3)感受态细胞,获得携带有目的基因的原核表达菌株。
1.2.4 GST融合蛋白质的表达及纯化 将上述表达菌株菌液涂板,挑取单菌落,在含有100 mg/mL氨苄青霉素的LB培养基中37 ℃过夜振荡培养;取重组菌按 1∶100 的体积比接入含氨苄青霉素的LB培养基中,200 r/min、37 ℃培养4 h至 OD600为0.4~0.6 时,取1 mL菌液作为诱导前总蛋白样,剩余菌液中加入终浓度为 0.5 mmol/L 的异丙基-β-D-硫代吡喃半乳糖苷(IPTG),25 ℃、180 r/min下诱导6 h,取1 mL菌液做全蛋白检测。
将剩余菌液收集在离心管中,4 ℃,8 800 r/min 离心10 min,弃上清,用TBS裂解液(50 mmol/L HCl-Tris,150 mmol/L NaCl,pH值7.4)重悬并加入终溶度分别为1 mg/mL的溶菌酶和1 mmol/L的PMSF。冰上放置30 min,超声波破碎30 min。8 800 r/min离心15 min,上清中加入500 μL GST SefiroseTM resin 树脂,使用蛋白旋转仪轻轻晃动吸附蛋白5~6 h,使GST-WRKY57与树脂充分结合。2 300 r/min,3 min离心弃上清,加入4倍体积TBS洗脱液(50 mmol/L HCl-Tris,300 mmol/L NaCl,pH值7.4),轻摇至beads悬浮于溶液中,2 300 r/min,3 min离心弃上清,重复2次。最后加入0.25 mL GST Elution Buffer(50 mmol/L HCl-Tris,300 mmol/L NaCl,40 mmol/L Reduced Glutathione pH值8.0),轻摇2~3 h,洗脱目的蛋白,SDS-PAGE电泳检测。
1.2.5 Western Blot检测 将SDS-PAGE电泳后胶浸于转移缓冲液中平衡15 min,依据胶的大小剪取NC膜1片和滤纸一起放入转膜缓冲液中平衡15 min。将转移槽置于冰浴中,100 mA,转膜1.5 h。转膜结束后,置膜于30 mL封闭缓冲液(含5%脱脂牛奶的TBS/T,Tween-20 的含量为0.05%)中室温摇动封闭1.5 h。按1∶5 000 的比例加入anti-GST一抗,室温孵育2.5 h或 4 ℃过夜,缓慢摇动。用20 mL TBS/T 洗3 次后按1∶6 000 的比例加入辣根过氧化酶标记的鼠二抗,室温孵育1 h后用TBS/T 洗3次,TBS洗1次,aZURE biosystems蛋白显影检测。
2 结果与分析
2.1 马铃薯StWRKY57-PB基因的克隆
通过同源比对拟南芥的WRKY57得到马铃薯同源蛋白的转录本序列,设计了一对CDS区特异引物,以马铃薯PB06的cDNA为模板进行PCR扩增,得到一条长约1 000 bp的特异条带(图1-A),T克隆后,用BamHⅠ、SacⅠ双酶切T载体鉴定(图1-B),切出2条符合预期大小的条带,一条为T载体大小约4 000 bp,另一条为目的基因CDS大小约1 000 bp,并将酶切鉴定后T载体送华大基因测序。测序结果表明,CDS区全长981 bp,A、T、G 和C 碱基含量分别为29.56%,25.59%,23.14%,21.71%。与NCBI公布的马铃薯预测WRKY57基因(XP_006348711.1,PGSC0003DMT400072958)CDS区序列碱基数目一致,均编码326个氨基酸,但是有6个碱基的差异,其中2个碱基为无义突变,另外4个碱基突变导致氨基酸突变。4个突变的氨基酸分别是第84个氨基酸S-N,第112个氨基酸V-N,第114个氨基酸E-G,第289个氨基酸E-D,NCBI数据库检索结果表明,该序列属于WRKY转录因子家族Ⅱc类成员,因与马铃薯数据库及NCBI公布的WRKY57蛋白序列有4个氨基酸不一样,将该蛋白基因命名为StWRKY57-PB。
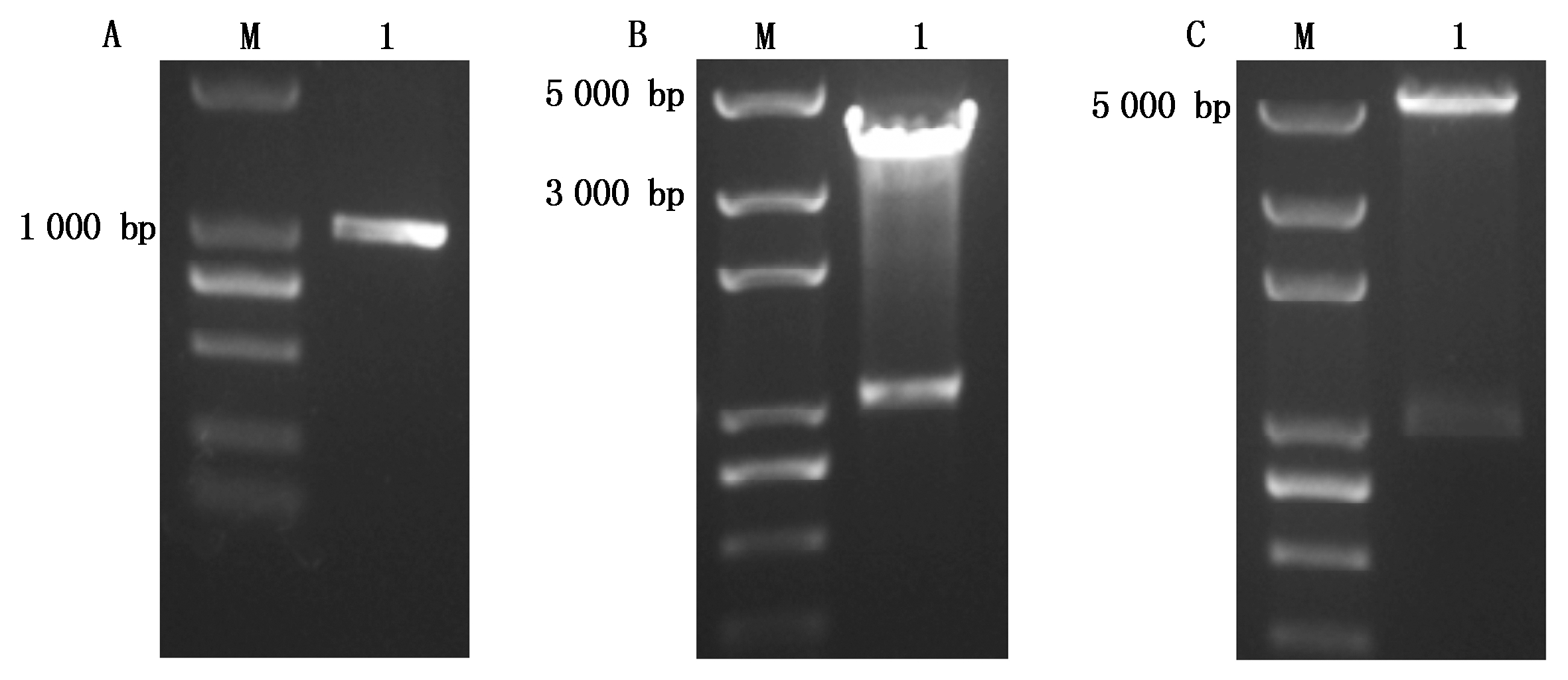
A.StWRKY57-PB特异扩增;B.T载体双酶切鉴定;C.原核表达重组载体pGEX-KG双酶切鉴定。
A. Amplification product of StWRKY57-PB specific fragment;B.Double digest T vector;C.Double digest recombinant pGEX-KG.
图1 StWRKY57-PB的特异扩增及载体的双酶切鉴定
Fig.1 Amplification product of StWRKY57-PB fragment and detection result of construction through double digestion
2.2 马铃薯StWRKY57-PB基因编码蛋白理化特性分析
在线软件Protparam预测结果显示,StWRKY57-PB编码一个含有326个氨基酸的蛋白,其分子式为C1512H2339N441O515S10,分子质量为35.3 ku,蛋白表现为偏酸,等电点pI为5.42,包含带正电残基(K、R)34个,带负电残基(D、E)44个。进一步分析得到,该蛋白的不稳定系数为54.20,说明WRKY57蛋白为不稳定蛋白;脂肪系数为45.49,说明其在不同环境中稳定性较差;平均亲水性系数为-0.865小于0,说明该蛋白属于亲水蛋白。WRKY57-PB二级结构预测结果表明(图2),不规则卷曲所占比例最大,为61.96%;α螺旋次之,比例为16.56%;延伸链的比率为13.50%;β转角最少,仅为7.98%。WRKY57-PB蛋白的保守结构域三维结构模型如图3所示。以拟南芥WRKY1(2ayd.1.A)三维结构为模板构建StWRKY57-PB蛋白的保守结构域三维结构模型,发现75个氨基酸残基(占整个蛋白的23%)与对照模型具有57.33%的相似度。亚细胞定位预测结果表明,细胞核定位系数69.6%,线粒体定位系数13.0%、细胞质定位系数13.0%,过氧化物酶定位系数为4.3%,定位在细胞核的可信为94.1%,所以该蛋白作为转录因子定位于细胞核。
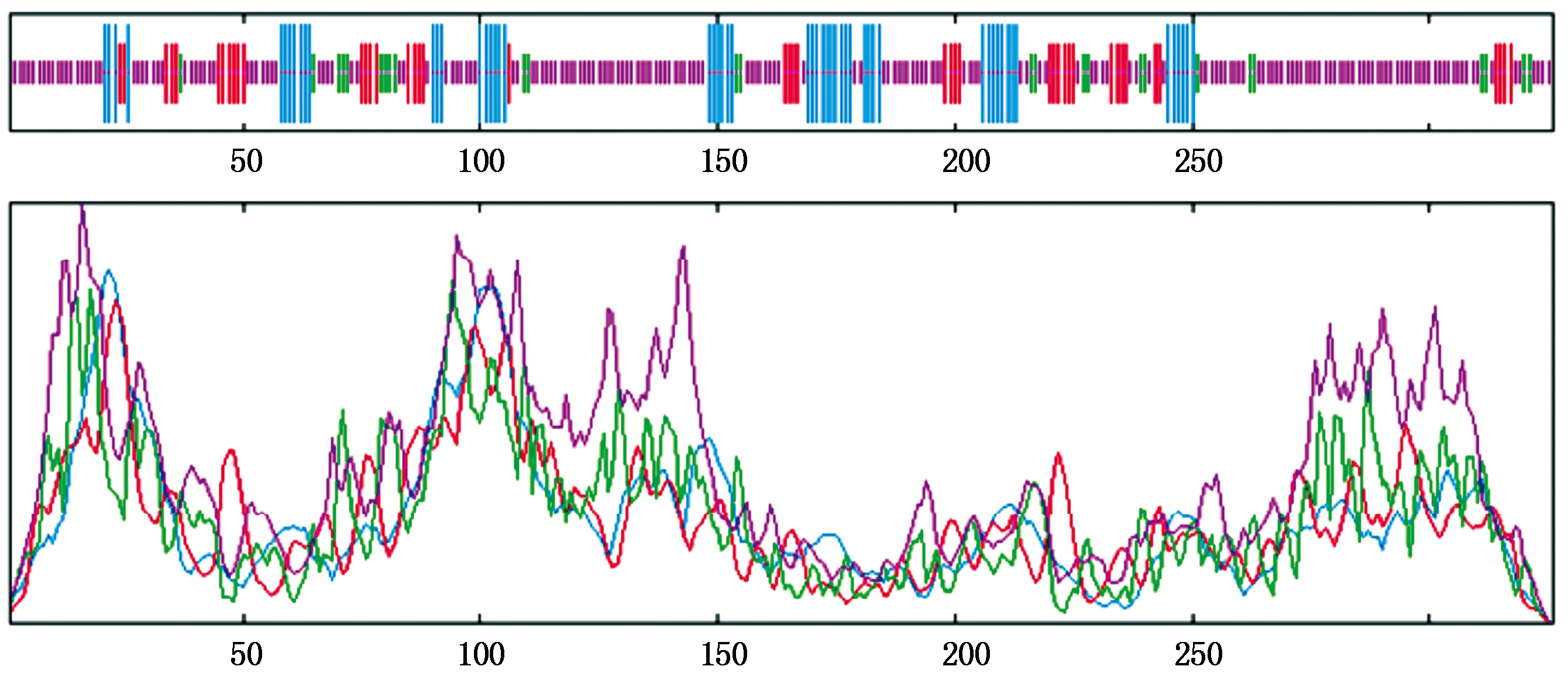
蓝色.α螺旋;绿色.β转角;红色.延伸链;黄色.不规则卷曲。
Blue.Alpha helix;Green.Beta burn;Red.Extended strand;Yellow.Random coil.
图2 WRKY57-PB蛋白的二级结构
Fig.2 The secondary structure of WRKY57-PB protein

图3 WRKY57-PB蛋白三维结构预测
Fig.3 Three-dimensional structure of deduced WRKY57-PB protein
2.3 马铃薯StWRKY57-PB蛋白序列比对及聚类分析
将WRKY57-PB蛋白序列提交至美国国立生物技术信息中心(NCBI)的蛋白序列数据库(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行相似性搜索。从非冗余蛋白数据库中下载与WRKY57-PB同源的12条序列,利用ClustalW软件,将WRKY57-PB蛋白序列与下载得到的蛋白序列进行氨基酸同源比对,发现相似度为马铃薯(Solanum tuberosum XP_006348711.1)99%,番茄(Solanum lycopersicum XP_004239067.1)93%,绒毛烟草(Nicotiana tomentosiformis XP_009610329.1)77%,辣椒(Capsicum annuum XP_016547995.1)70%,胡桃(Juglans regia XP_018808597.1)66%,中粒咖啡(Coffea canephora CDP00413.1)65%,牵牛花(Ipomoea nil XP_019166374.1)59%,葡萄(Vitis vinifera XP_002274549.1)58%,可可(Theobroma cacao EOY01748.1)58%,枣(Ziziphus jujuba XP_015894978.1)56%,中棉(Gossypium arboreum XP_017636878.1)56%,拟南芥(Arabidopsis thaliana OAP14911.1)57%。利用ClustalW软件,将WRKY57-PB蛋白序列与下载得到的12条蛋白序进行氨基酸同源比对,证实上述蛋白序列具有不同的序列相似度(图4)。为进一步分析WRKY蛋白在不同物种之间的进化关系,利用MEGA 5.05软件,采用最大简约法构建了不同植物物种间WRKY蛋白的系统进化树,发现马铃薯WRKY57-PB与番茄及马铃薯测序品种WRKY57聚在一起,分子距离最近,其次与辣椒、绒毛烟草的分子距离也相对较近,与拟南芥的分子距离最远(图5)。

图4 植物WRKY类蛋白氨基酸序列同源比对
Fig.4 Multiple alignment profile of WRKY proteins from different plant species
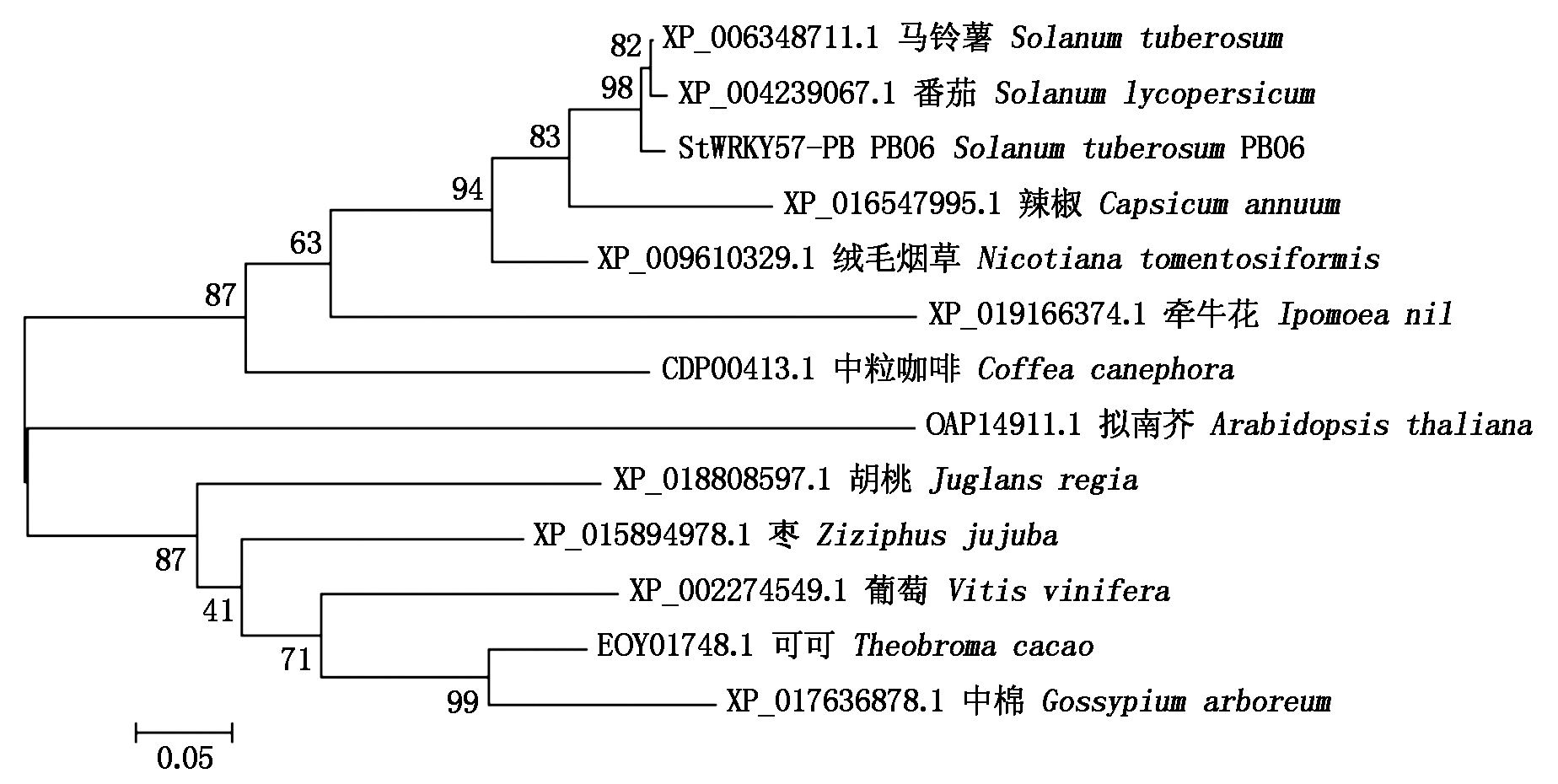
图5 StWRKY57-PB与其他物种WRKY蛋白的系统进化分析
Fig.5 Phylogenetic evolutionary analyses of WRKY proteins from different plant species
2.4 StWRKY57-PB原核表达载体的鉴定、蛋白表达与纯化
用限制性内切酶BamHⅠ和SacⅠ双酶切鉴定pGEX-KG∶∶WRKY57-PB重组质粒,酶切片段大小符合预期设想(图1-C)。将酶切阳性的重组质粒送华大基因公司测序,基因序列正确无误,可用做后续原核蛋白的表达。
鉴于温度越高蛋白活性越低,而温度低于16 ℃又会导致细菌生长缓慢,降低蛋白总产量,故选择25 ℃作为诱导温度。根据其他报道的原核蛋白表达条件[17-18],诱导剂IPTG的诱导浓度为0.5 mmol/L,结果显示,诱导前后全蛋白表达量差异非常明显,WRKY57-PB在3个不同菌株(BL21、Rosetta、Tuner)中都能高效表达,且不同菌株中表达量差异不大。融合蛋白在3个不同菌株中上清样的表达量均大于沉淀样蛋白的表达,SDS-PAGE显示,上清样纯化后融合蛋白约为70 ku(图6),条带特异性好,与未纯化蛋白条带大小也相一致。值得提出的是,GST相对质量约26 ku,WRKY57-PB相对质量预测约36 ku,因此,GST与WRKY57融合蛋白约为62 ku,但电泳检测蛋白GST-StWRKY57-PB融合蛋白电泳检测大小在70 ku左右,与预测大小略有差异。
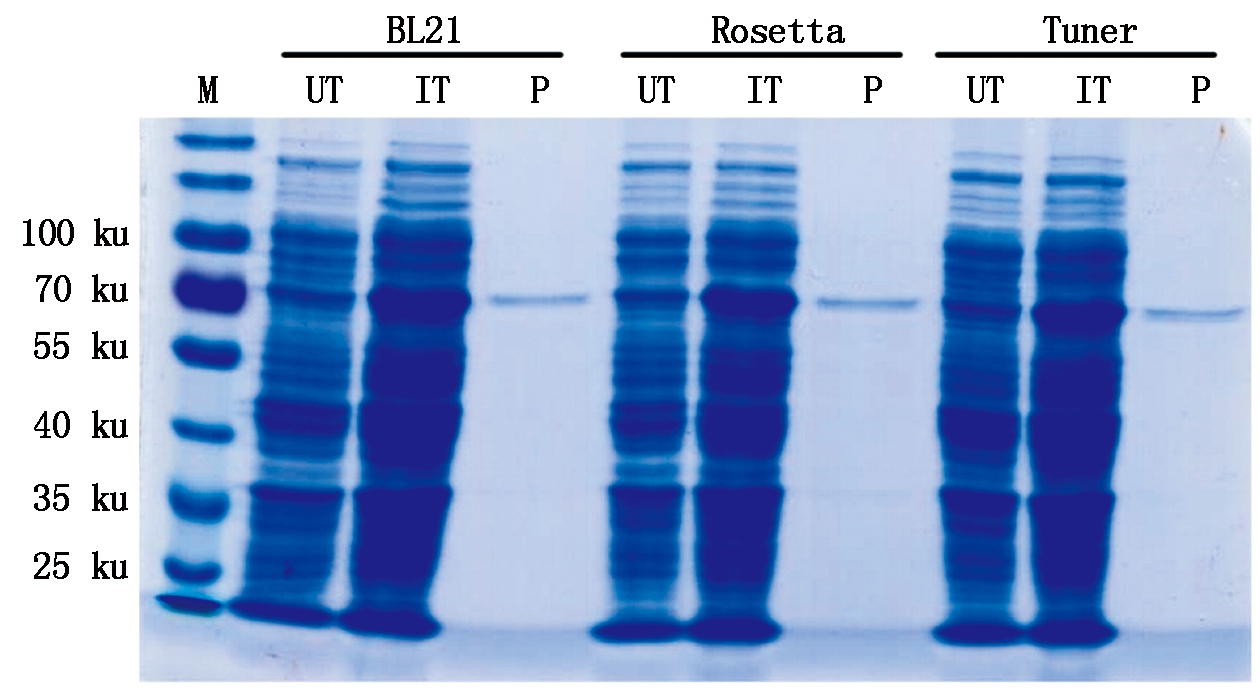
UT.未诱导全蛋白;IT.诱导后全蛋白;P.纯化蛋白。图7同。
UT.Un-induced total protein;IT.Induced total protein;P.Purified protein.The same as Fig.7.
图6 StWRKY57-PB蛋白的原核表达与纯化SDS-PAGE检测
Fig.6 SDS-PAGE analysis of prokaryotic expression and purification of StWRKY57-PB protein
2.5 Western Blot检测
为了进一步验证蛋白的表达和纯化融合蛋白的准确性,用抗GST标签的抗体进行了免疫印迹检测 (图7),结果显示,3个不同菌株BL21、Rosetta、Tuner中规律一致,未经诱导的对照中信号非常弱,而在诱导后的全蛋白和纯化蛋白质样品中均出现特异信号,尤其是在全蛋白中信号非常强。Western Blot检测结果与SDS-PAGE检测相一致,说明获得了表达纯化的StWRKY57-PB蛋白质。
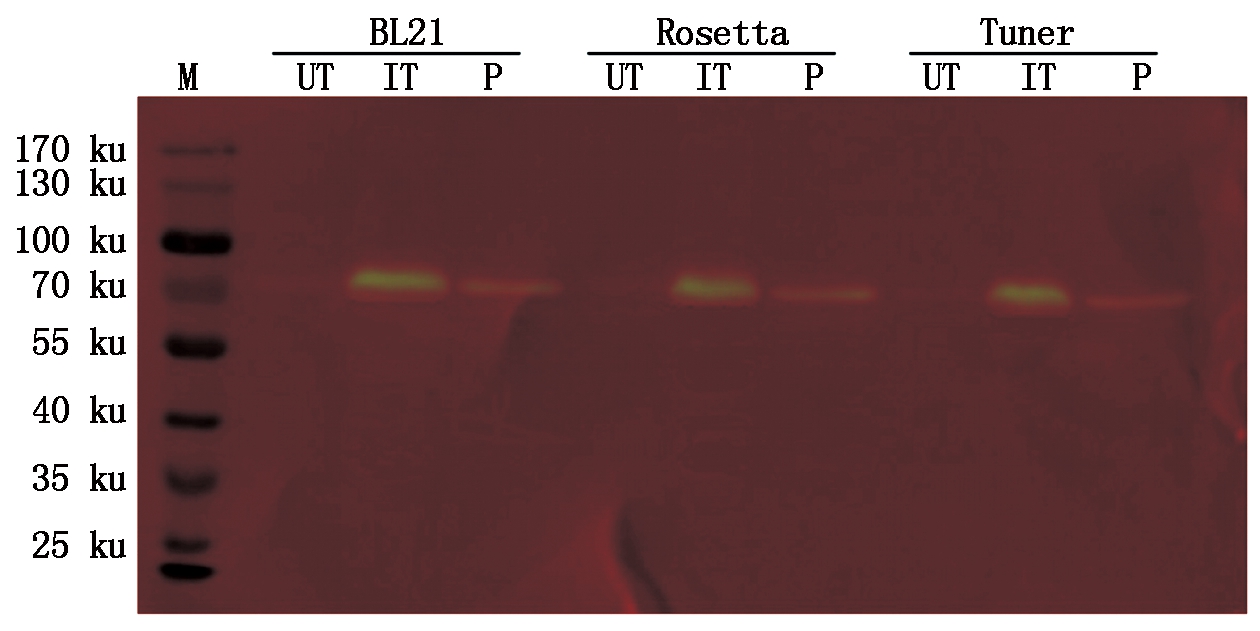
图7 StWRKY57-PB蛋白的原核表达与纯化Western Blot检测
Fig.7 Western Blot detection of prokaryotic expression and purification of StWRKY57-PB protein
3 讨论
WRKY转录因子广泛存在于各类群植物中,表明WRKY蛋白履行重要的生物功能。报道表明,它们的确参与植物的生物和非生物胁迫响应及多个生长发育过程的调节,比如糖代谢、逆境胁迫、种子的休眠和萌发、叶片的衰老、毛状体和胚的发育等[19-21]。相对于模式植物拟南芥WRKY转录因子的深入研究,马铃薯WRKY转录因子的功能报道较少。本研究采取同源克隆的方法克隆了马铃薯一个耐旱品种PB06的StWRKY57基因。根据序列分析,发现其与马铃薯基因组数据库中公布的序列有6个碱基的差异,并且有4个氨基酸的翻译发生了变化,暗示在不同的品种间WRKY57转录因子具有变异性,这种变异可能与其特殊的生理生化性状相关,如可能与抗旱特性相关。今后的研究中可克隆几个抗旱性不同马铃薯品种的WRKY57序列并比它们的差异。系统进化分析表明,该蛋白与同属植物番茄的同源性较高93%,而不同属间、不同科间的同源性较低,与拟南芥的相似性有57%,这与其他学者的研究一致[22]。为了进一步开展StWRKY57-PB基因功能研究,对其编码蛋白进行了原核表达,GST-WRKY57相对质量约为62 ku,但电泳检测显示大小为70 ku,这可能是因为蛋白修饰造成不同折叠构象导致,水稻WRKY42蛋白表达亦有类似的情况[23]。
根据WRKY结构域数目及锌指结构的特征,可将WRKY转录因子分为3组[4,24],第1组含有2个WRKY结构域,且其锌指结构为C2H2型(C-X4-5-C-X22-23-H-X1-H);第2组含有1个WRKY结构域,其锌指结构与第一组相同,依据WRKY结构域的氨基酸序列相似性,可进一步将其划分为5个亚组:IIa、IIb、IIc、IId和IIe;第3组含有一个WRKY结构域且锌指结构为C2HC类型(C-X7-C-X23-H-X1-C)。拟南芥的72个WRKY家族成员中有32个属于第1组,26个属于第2组,14个属于第3组[25]。马铃薯的81个WRKY转录因子成员,其中13个属于第1组,53个属于第2组(IIa 6个、IIb 5个、IIc 16个、IId 7个、IIe 19个),15个属于第3组[7]。本研究克隆得到的StWRKY57-PB属于IIc类,在马铃薯中是首次克隆,目前,未见茄科作物中有该同源基因功能的报道。
马铃薯作为一种重要的经济作物,它的产量和质量是关乎民生的重要问题。提高其产量和质量的重要措施是提高品种的抗逆能力,很可惜,目前关于马铃薯WRKY转录因子参与逆境胁迫的报道并不多见。AtWRKY57通过调控植物激素ABA的代谢及逆境胁迫响应基因表达发挥抗旱功能;前期试验结果表明,转StWRKY57-PB基因的拟南芥显著提高了干旱耐受性,因而笔者预测该同源转录因子StWRKY57在马铃薯抗逆中可能具有重要功能。本研究克隆了StWRKY57-PB的完整编码框,并成功在大肠杆菌中表达并纯化出特异性高的融合蛋白,下一步的工作可以验证其是否具有W 盒的结合能力,构建基因表达谱、运用遗传转化的方法鉴定其生物学功能以及采用染色质免疫共沉淀(ChIP)技术寻找转录因子靶基因揭示其响应干旱胁迫的作用机制。
[1] Li X Y,Guo W,Li J C,Yue P T,Bu H D,Jiang J,Liu W T,Xu Y X,Yuan H,Li T,Wang A D. Histone acetylation at the promoter for the transcription factor PuWRKY31 affects sucrose accumulation in pear fruit[J]. Plant Physiology,2020,182(4):2035-2046.doi:10.1104/pp.20.00002.
[2] Han Y Y,Fan T T,Zhu X Y,Wu X,Ouyang J,Jiang L,Cao S Q. WRKY12 represses GSH1 expression to negatively regulate cadmium tolerance in Arabidopsis[J]. Plant Molecular Biology,2019,99(1-2):149-159.doi:10.1007/s11103-018-0809-7.
[3] Zhang L P,Chen L G,Yu D Q. Transcription factor WRKY75 interacts with DELLA proteins to affect flowering[J]. Plant Physiology,2018,176(1):790-803.doi:10.1104/pp.17.00657.
[4] Rushton P J,Somssich I E,Ringler P,Shen Q J. WRKY transcription factors[J]. Trends in Plant Science,2010,15(5):247-258.doi:10.1016/j.tplants.2010.02.006.
[5] Brand L H,Fischer N M,Harter K,Kohlbacher O,Wanke D. Elucidating the evolutionary conserved DNA-binding specificities of WRKY transcription factors by molecular dynamics and in vitro binding assays[J]. Nucleic Acids Research,2013,41(21):9764-9778.doi:10.1093/nar/gkt732.
[6] Agarwal P,Reddy M P,Chikara J. WRKY:its structure,evolutionary relationship,DNA-binding selectivity,role in stress tolerance and development of plants[J]. Molecular Biology Reports,2011,38(6):3883-3896.doi:10.1007/s11033-010-0504-5.
[7] Liu Q N,Liu Y,Xin Z Z,Zhang D Z,Ge B M,Yang R P,Wang Z F,Yang L,Tang B P,Zhou C L. Genome-wide identification and characterization of the WRKY gene family in potato(Solanum tuberosum )[J]. Biochemical Systematics and Ecology,2017,71:212-218.doi:10.1016/j.bse.2017.02.010.
[8] Dellagi A,Helibronn J,Avrova A O,Montesano M,Palva E T,Stewart H E,Toth I K,Cooke D E,Lyon G D,Birch P R. A potato gene encoding a WRKY-like transcription factor is induced in interactions with Erwinia carotovora subsp. atroseptica and Phytophthora infestans and is coregulated with class I endochitinase expression[J]. Molecular Plant-Microbe Interactions,2000,13(10):1092-1101.doi:10.1094/mpmi.2000.13.10.1092.
[9] Lagacé M,Matton D P. Characterization of a WRKY transcription factor expressed in late torpedo-stage embryos of Solanum chacoense[J]. Planta,2004,219(1):185-189.doi:10.2307/23388419.
[10] Shahzad R,Harlina P W,Xie C H,Ewas M,Nishawy E,Pan Z Y,Foly M M.Overexpression of potato transcription factor(StWRKY1)conferred resistance to Phytophthorainfestans and improved tolerance to water stress[J]. Plant Omics Journal,2016,9(2):149-158.doi:10.21475/poj.160902.p7649x.
[11] Yogendra K N,Kumar A,Sarkar K,Li Y L,Pushpa D,Mosa K A,Duggavathi R,Kushalappa A C.Transcription factor StWRKY1 regulates phenylpropanoid metabolites conferring late blight resistance in potato[J]. Journal of Experimental Botany,2015,66(22):7377-7389.doi:10.1093/jxb/erv434.
[12] Yogendra K N,Dhokane D,Kushalappa A C,Sarmiento F,Rodriguez E,Mosquera T. StWRKY8 transcription factor regulates benzylisoquinoline alkaloid pathway in potato conferring resistance to late blight[J]. Plant Science,2017,256:208-216.doi:10.1016/j.plantsci.2016.12.014.
[13] 李立芹,王西瑶. 马铃薯WRKY2基因的克隆和非生物逆境下的表达模式[J]. 广西植物,2015,35(3):401-407.doi:10.11931/guihaia.gxzw201309003.
Li Y Q,Wang X Y. Cloning and expression pattern research under abiotic stress of the WRKY2 in potato[J].Guihaia,2015,35(3):401-407.
[14] 王伟.马铃薯WRKY6基因的功能分析[D]. 雅安:四川农业大学,2013.
Wang W. Functional analysis of potato WRKY6 gene[D].Yaan:Sichuan Agricultural University,2013.
[15] Jiang Y J,Liang G,Yu D Q. Activated expression of WRKY57 confers drought tolerance in Arabidopsis[J]. Molecular Plant,2012,5(6):1375-1388.doi:10.1093/mp/sss080.
[16] Hijmans R J.The effect of climate change on global potato production[J]. American Journal of Potato Research,2003,80(4):271-279.doi:10.1007/bf02855363.
[17] Tosarini T R,Ramos P Z,Profeta G S,Baroni R M,Massirer K B,Cou ago R M,Mondego J M C. Cloning,expression and purification of kinase domains of cacao PR-1 receptor-like kinases[J]. Protein Expression and Purification,2018,146:78-84.doi:10.1016/j.pep.2018.01.004.
ago R M,Mondego J M C. Cloning,expression and purification of kinase domains of cacao PR-1 receptor-like kinases[J]. Protein Expression and Purification,2018,146:78-84.doi:10.1016/j.pep.2018.01.004.
[18] Auslender E L,Donia S,Dumont S,Rivoal J. Expression,purification and characterization of Solanum tuberosum recombinant cytosolic pyruvate kinase[J]. Protein Expression and Purification,2015,110:7-13.doi:10.1016/j.pep.2014.12.015.
[19] Bakshi M,Oelmüller R.WRKY transcription factors. Jack of many trades in plants[J]. Plant Signaling and Behavior,2014,9(2):e27700.doi:10.4161/psb.27700.
[20] Zheng Y,Ge J Y,Bao C,Chang W W,Liu J J,Shao J J,Liu X Y,Su L F,Pan L,Zhou D X.Histone deacetylase HDA9 and transcription factor WRKY53 are mutual antagonists in regulation of plant stress response[J]. Molecular Plant,2020,13(4):598-611. doi:10.1016/j.molp.2019.12.011.
[21] Chen Q S,Xu X Y,Xu D,Zhang H S,Zhang C K,Li G.WRKY18 and WRKY53 coordinate with HISTONE ACETYLTRANSFERASE1 tor egulate rapid responses to sugar[J].Plant Physiology,2019,180(4):2212-2226.doi:10.1104/pp.19.00511.
[22] 胡向阳,屈新运,吴格格,秦苗苗,刘蕊,高天娥,李焘.菘蓝IiCYP79B2基因的克隆与表达分析[J].华北农学报,2019,34(5):23-29.doi:10.7668/hbnxb.201751719.
Hu X Y, Qu X Y, Wu G G, Qin M M, Liu R, Gao T E, Li T. Cloning and expression analysis of IiCYP79B2 from Isatis indigotica Fort[J].Acta Agriculturae Boreali-Sinica, 2019, 34(5):23-29.
[23] 缪刘杨,周亮,杨烁,李莉云,李雪姣,范伟,兰金苹,史佳楠,刘丽娟,刘国振.水稻转录因子WRKY42的转录、表达及其与W-box的结合特征分析[J]. 生物化学与生物物理进展,2014,41(7):682-692.doi:10.3724/SP.J.1206.2013.00510.
Miao L Y,Zhou L,Yang S,Li L Y,Li X J,Fan W,Lan J P,Shi J N,Liu L J,Liu G Z. Characterization of transcription,expression and bindingproperties with W-box of rice transcription gactor WRKY42 gene[J].Progress in Biochemistry and Biophysics,2014,41(7):682-692.
[24] Eulgem T,Rushton P J,Robatzek S,Somssich I E. The WRKY superfamily of plant transcription factor[J]. Trends in Plant Science,2000,5(5):199-206.doi:10.1016/S1360-1385(00)01600-9.
[25] Wu K L,Guo Z J,Wang H H,Li J. The WRKY family of transcription factors in rice and Arabidopsis and their origins[J]. DNA Research,2005,12(1):9-26. doi:10.1093/dnares/12.1.9.
