随着我国经济的不断发展,人民生活水平的逐渐提高,人们对稻米的品质及口感都有了更高的要求。经研究表明,米饭质地和食味品质取决于水稻品种的直链淀粉含量[1]。低直链淀粉含量的水稻,其米饭表面光泽透亮,既有糯米的柔软性,还具有粳米的弹性,适口性好,食味品质佳[2]。近年来,随着我国农业供给侧结构性改革的不断完善,土地流转不断加快,作物生产逐渐向规模化、轻简化方向发展[3-4]。直播稻田已经成为水稻轻简栽培的一种重要方式,随着水稻直播面积的逐年增加,杂草稻作为全球性草害,具有生长快、繁殖能力强、适应性强等特点,其危害程度仅次于稗草和千金子,对直播水稻生产带来重大的危害。长期以来,田间杂草、杂草稻与农作物争夺光照条件、生长空间及营养物质等,危害农作物的生命活动,在作物生长过程中传播病虫害,释放有毒物质造成粮食减产[5-6],影响水稻的产量及品质。农作物与杂草同时生长在农田中,极大制约了农作物的生长,喷施除草剂就成为现代农业中常用防治杂草的手段之一。由于杂草稻具有栽培稻的同源相似性,目前,生产上还没有防治杂草稻的专一除草剂,在使用化学除草剂消灭杂草和杂草稻的同时,也对农作物本身造成一定的伤害,在一定程度上极大限制了化学除草剂的应用,金粳818带有抗咪唑乙盐酸基因,咪唑乙盐酸[7]又称咪草烟,属于咪唑啉酮类除草剂,是一类广谱内吸性除草剂,可以有效防治稻田杂草和杂草稻的危害[8-9]。在高等植物体内,通过抑制乙酰乳酸合酶(Acetolactate synthase, ALS)的活性从而抑制侧链氨基酸如缬氨酸、亮氨酸、异亮氨酸的合成[10-11],进而影响蛋白质的合成,有丝分裂指数下降,最终使组织失绿、黄化,植株逐渐死亡达到除草目的。因咪唑啉酮类除草剂生物活性高、除草种类多,且乙酰乳酸合酶不存在于人体和动物中,对人畜无害,安全系数高,成本低廉,成为仅次于草甘膦的另一类除草剂。王芳权等[12]利用分子标记有效的区分水稻中咪唑啉酮类除草剂抗性的3种基因型,结果表明,基因型与表型一致,从而快速获得了具有除草剂抗性且稳定遗传的水稻材料。
目前,已经报道的能够决定低直链淀粉含量的突变基因有14个,它们大多以1对隐性基因控制[13],其中,Wx-mq[14-17]基因在蜡质基因编码区发生了2个碱基的替换进而影响Wx蛋白活性,造成其直链淀粉含量的降低[18]。培育食味品质优良的软米品种已经成为育种工作者的一个新的研究目标。陈涛等[1]研究结果表明,利用四引物扩增受阻突变体系PCR(Tetra-primer amplification refractory mutation system-PCR,Tetra-primer ARMS-PCR)技术进行等位基因特异扩增来检测低直链淀粉含量基因,其检测结果与成熟后对胚乳外观的检测结果完全一致。利用四引物ARSM-PCR技术可以对Wx-mq基因水稻的种质资源鉴定和分子标记辅助选择。如何提高稻米食味品质及控制杂草稻的发生,是水稻育种研究的一个重要课题,因此,培育含有低直链淀粉含量基因的抗除草剂水稻品种对提高稻米品质及解决杂草稻的危害具有重要意义。
本研究利用四引物ARSM-PCR技术选育低直链淀粉含量水稻品种,结合等位基因特异PCR(Allelic-specific PCR,AS-PCR)技术培育出带有低直链淀粉含量基因且具有咪唑乙盐酸除草剂抗性的水稻新品种。
1 材料和方法
1.1 试验材料
显性核不育群体最初由华中农业大学作物遗传改良国家重点实验室何予卿教授提供。是一个籼性核不育群体。该群体后代可育和不育为1∶1分离,分离出的不育株可以作为目的基因的受体,继续进行杂交,分离出的可育株根据农艺性状表现,进行新品种的培育。本研究首先利用该群体分离出的不育单株为母本,粳稻品种圣稻17为父本进行杂交,并以圣稻17为轮回亲本,回交3次,获得了具有粳稻背景的显性核不育群体。利用南粳9108(带有低直链淀粉含量的Wx-mq基因)作为供体与显性核不育群体不育单株进行杂交,并以南粳9108为轮回亲本,回交2次,获得BC2F1分离群体,利用分子标记对BC2F1分离群体单株进行Wx-mq鉴定,选育出带有Wx-mq基因的不育单株,然后利用金粳818(含抗除草剂ALS基因)为供体亲本,以含糯性基因的BC2F1不育单株为母本进行杂交,对后代分离群体单株进行低直链淀粉含量Wx-mq和抗咪唑乙盐酸除草剂ALS分子标记辅助选择。
1.2 材料种植
所有供试水稻材料均种植于山东省农业科学院饮马泉试验基地,5月4日播种,6月4日插秧,田间正常大田管理。
1.3 抗除草剂水稻植株的田间鉴定
对培育出的抗除草剂低直链淀粉含量的水稻新品系,在苗期进行除草剂咪唑乙盐酸抗性检测,人工喷洒咪唑乙盐酸除草剂在水稻植株叶片上,3~5 d后统计抗性及敏感植株株数。
1.4 引物合成与PCR检测
选取杂交及回交转育后经除草剂抗性筛选的阳性植株,摘取其幼嫩叶片,充分研磨,利用TPS法[19]提取DNA备用。参照王芳权等[12]的方法设计了2对特异性引物S1/S9、S1/S10(表1),S1/S9能特异检测感咪草烟基因型(ALS-G);S1/S10能特异检测抗咪草烟基因型(ALS-A)。
根据Wx-mq基因存在单核苷酸变异,在Wx位点第497位核苷酸发生G到A的等位变异,参照Ye等[20]的方法设计了2对特异性引物(表1),部分引物在3′端引入了错配。
表1 ALS、Wx-mq基因分子标记设计
Tab.1 Molecular marker design of ALS and Wx-mq genes
注:加粗的小写字母标识的碱基表示错配碱基。
Note:The base identified by a bold lowercase letter represents the mismatched base.
引物名称Primer name引物序列(5'-3')Primer sequencesS1GAGGCAATCATCGCTACTGGS9TGTCCTTGAATGCGCCCCtACS10TGTCCTTGAATGCGCCCCtATWx-O-FATGTTGTGTTCTTGTGTTCTTTGCAGGCWx-O-RGTAGATCTTCTCACCGGTCTTTCCCCAAWx-1-FGGGTGAGGTTTTTCCATTGCTACAATCGWx-1-RGTCGATGAACACACGGTCGACTCAAT
1.4.1 四引物ARMS-PCR分子检测 PCR体系:DNA模板2 μL;2×Power Taq PCR MasterMix 10 μL;引物2 μL;ddH2O 6 μL混合,共20 μL。PCR反应程序:95 ℃预热5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸7 min。PCR产物经1%的琼脂糖凝胶电泳分离和EB染色后在紫外透射仪下观察。
1.4.2 AS-PCR分子检测 PCR体系:DNA模板2 μL;2×Power Taq PCR MasterMix 10 μL;引物5 μL;ddH2O 3 μL混合,共20 μL。PCR反应程序:94 ℃预热5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min。PCR产物经1%的琼脂糖凝胶电泳分离和EB染色后在紫外透射仪下观察。
1.5 糯性基因外观鉴定
由于含Wx-mq纯合基因型水稻成熟籽粒在晾晒后,其胚乳会呈现云雾状、乳白色和透明度略差等特征。利用四引物ARMS-PCR可以在苗期对直链淀粉含量的水稻单株进行准确鉴定。
1.6 田间种植及农艺性状考察
在济南饮马泉试验农场种植培育出的抗除草剂低直链淀粉含量的水稻新品系,小区面积为66.7 m2,同时种植南粳9108、金粳818为对照。田间管理同大田,考察的农艺性状有抽穗期、株高、直链淀粉含量、穗实粒数、千粒质量、穗长、产量。获得数据通过SPSS 16.0进行统计分析。
2 结果与分析
2.1 杂交及回交转育
在8月中下旬,选取正处于开花期的稻穗,以显性核不育群体为母本,以南粳9108为父本进行杂交获得F1,再以显性核不育群体不育单株为父本,以南粳9108为轮回亲本,连续回交获得BC1F1和BC2F1,在开花前对每一个杂交或回交后代单株进行低直链淀粉含量PCR分子检测跟踪Wx-mq基因,从中选择含糯性基因的农艺性状优良的不育单株,再以金粳818抗除草剂基因(ALS)为供体亲本,与低直链淀粉含量的不育单株进行杂交,在F1分离群体中选育出农艺性状优良的可育单株,可育单株自交,在F5选育出了农艺性状优良的带有Wx-mq基因及ALS除草剂基因的水稻株系。
2.2 田间抗除草剂筛选
在喷施除草剂后,水稻生长缓慢,叶色加深(图1-A)。7 d后不含抗除草剂水稻材料开始出现凋萎和死亡,先从新叶枯死,老叶也逐渐枯死,15 d以后基本全部枯死,而抗除草剂材料开始恢复并正常生长(图1-B)。

A.不抗除草剂表型;B.抗除草剂表型。
A.Non-herbicide resistant phenotype;B.Herbicide resistant phenotype.
图1 田间除草剂抗性筛选
Fig.1 Field herbicide resistance screening
2.3 糯性基因与抗除草剂基因的PCR检测
利用四引物ARMS-PCR分子标记对Wx-mq基因型进行检测,在分蘖盛期对亲本显性核不育株、南粳9108以及回交转育获得的BC2F1世代农艺性状优良的800个不育单株进行Wx-mq基因型鉴定,其电泳结果显示具有3种带型:低直链淀粉含量亲本南粳9108条带为439 bp+292 bp;正常淀粉含量不育株条带为439 bp+200 bp;杂合基因型同时具有父母本的2种带型,条带为439 bp+292 bp+200 bp(图2)。经统计,BC2F1不育群体中检测得到172株单株带型与南粳9108一致,含有糯性基因,性状为糯性;160株单株不含糯性基因;468株单株带型为双亲的杂合基因型。
利用咪唑乙盐酸抗性基因ALS的特异性引物对以含有Wx-mq基因的不育株为母本,金粳818(含除草剂基因ALS)为供体亲本的杂交后代F1分离群体进行AS-PCR扩增,结果显示,携带的ALS-A纯合和杂合基因型的植株都表现为抗除草剂,而携带有ALS-G纯合基因型的植株表现为感除草剂。在F1群体1 200个单株中,检测得到868个抗除草剂单株和332个感除草剂单株,其中纯合基因型624个,杂合基因型576个(图3-B、C);经筛选,得到纯合抗咪唑乙盐酸除草剂可育单株188株,综合四引物ARMS-PCR分子标记对188株可育单株进行Wx-mq基因的PCR扩增结果(图3-A),筛选得到同时具有低直链淀粉含量和抗除草剂特性且农艺性状优良的可育单株112株,可育单株自交,在F5选育出了农艺性状优良的聚合有Wx-mq基因和ALS除草剂基因的水稻株系6个,暂命名为8X001、8X002、 8X003、 8X004、 8X005、 8X006。
2.4 糯性基因外观检测
对杂交及回交转育后代进行PCR检测的同时对其进行了胚乳外观特性的鉴定,确保分子检测的准确性。由于含有糯性基因的水稻籽粒胚乳呈现出云雾状、乳白色和不透明等特性,将不同的水稻材料分单株晾晒、脱粒和脱壳后,对籽粒胚乳淀粉基因型进行目测鉴定。结果表明,胚乳外观全部呈现出云雾状、乳白色和透明度差的个体可确认为纯合含糯性基因Wx-mq的单株(图4-A);胚乳外观全部为透明个体可确认为纯合不含糯性基因Wx-mq的单株(图4-B);胚乳外观既有透明个体又有非透明个体可确认为Wx-mq基因型杂合的单株。
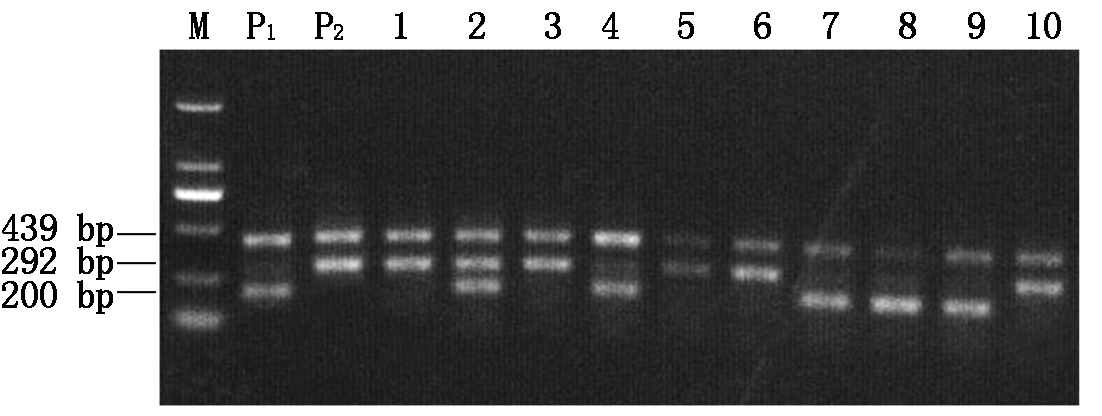
DL2000 DNA标记(由大到小分别为2 000,1 000,750,500,250,100 bp);P1.不育株;P2.南粳9108;1-10.不育系部分单株;P1为正常淀粉含量;P2为低直链淀粉含量。
DNA Marker of DL2000 (from large to small,2 000,1 000,750,500,250,100 bp,respectively); P1.The sterile plant; P2.The sterile plant of Nanjing 9108; 1-10.Part of the sterile line; P1 .Normal starch content; P2 .Low amylose content.
图2 四引物ARMS-PCR对BC2F1 Wx-mq基因型的检测
Fig.2 Detection of BC2F1 Wx-mq genotype by ARMS-PCR with four primers
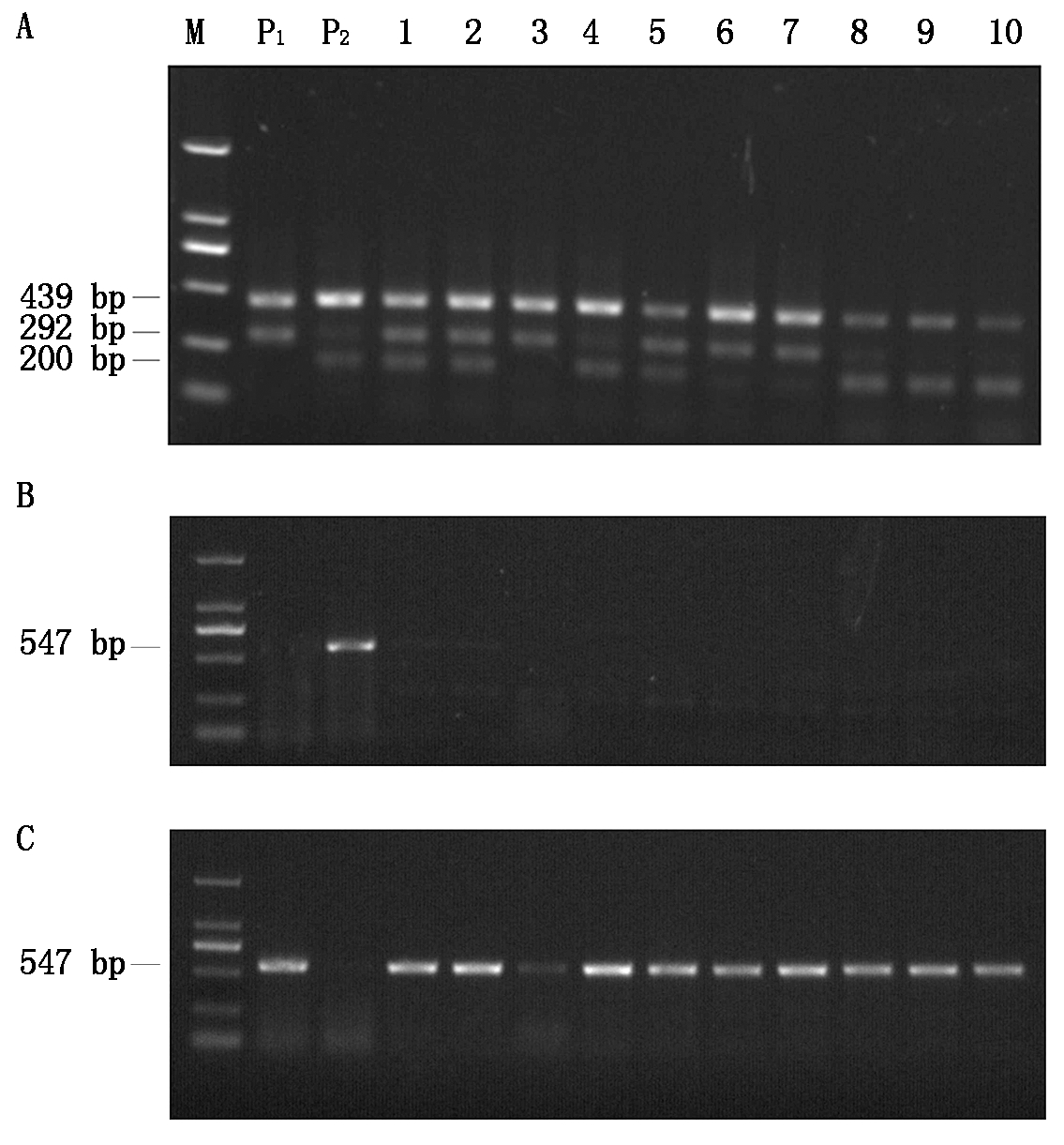
M.DL2000 DNA标记(由大到小分别为2 000,1 000,750,500,250,100 bp);P1.金粳818;P2.不育株;1-10.F1群体部分单株;A.四引物ARMS-PCR检测结果;B、C.AS-ALS分子标记检测结果;B.S1/S9引物对扩增;C.S1/S10引物对扩增。
M.DNA Marker of DL2000 (from large to small,2 000,1 000,750,500,250 and 100 bp,respectively); P1.Jinjing 818; P2 .The sterile plant; 1-10.Some individual plants of F1 population; A.Test results of ARMS-PCR with four primers; B,C.The results of AS-ALS molecular marker detection; B. Amplification of S1/S9 primer pair; C.Amplification of S1/S10 primer pairs.
图3 四引物ARMS-PCR和AS-ALS分子标记检测F1群体
Fig.3 Four primers ARMS-PCR and AS-ALS molecular markers were used to detect F1 population

A.含糯性基因;B.不含糯性基因。
A.Containing waxy gene; B. Containing no waxy gene.
图4 含与不含糯性基因Wx-mq水稻胚乳外观的比较
Fig.4 Comparison of appearance of endosperm of rice with and without waxy gene Wx-mq
2.5 田间农艺性状及产量表现
选育出的具有农艺性状优良的低直链淀粉含量的抗除草剂纯系,按小区种植,对其进行Wx-mq、ALS基因鉴定和抽穗期、株高、直链淀粉含量、穗粒数、千粒质量、穗长、产量等主要农艺性状的调查。结果表明,6个新品系的直链淀粉含量与金粳818相比有显著性差异;其主要农艺性状与南粳9108相比均无显著性差异(表2)。
表2 南粳9108、金粳818及6个新品系主要农艺性状分析
Tab.2 Agronomic character analysis of Nanjing 9108,Jinjing 818 and 6 new strains
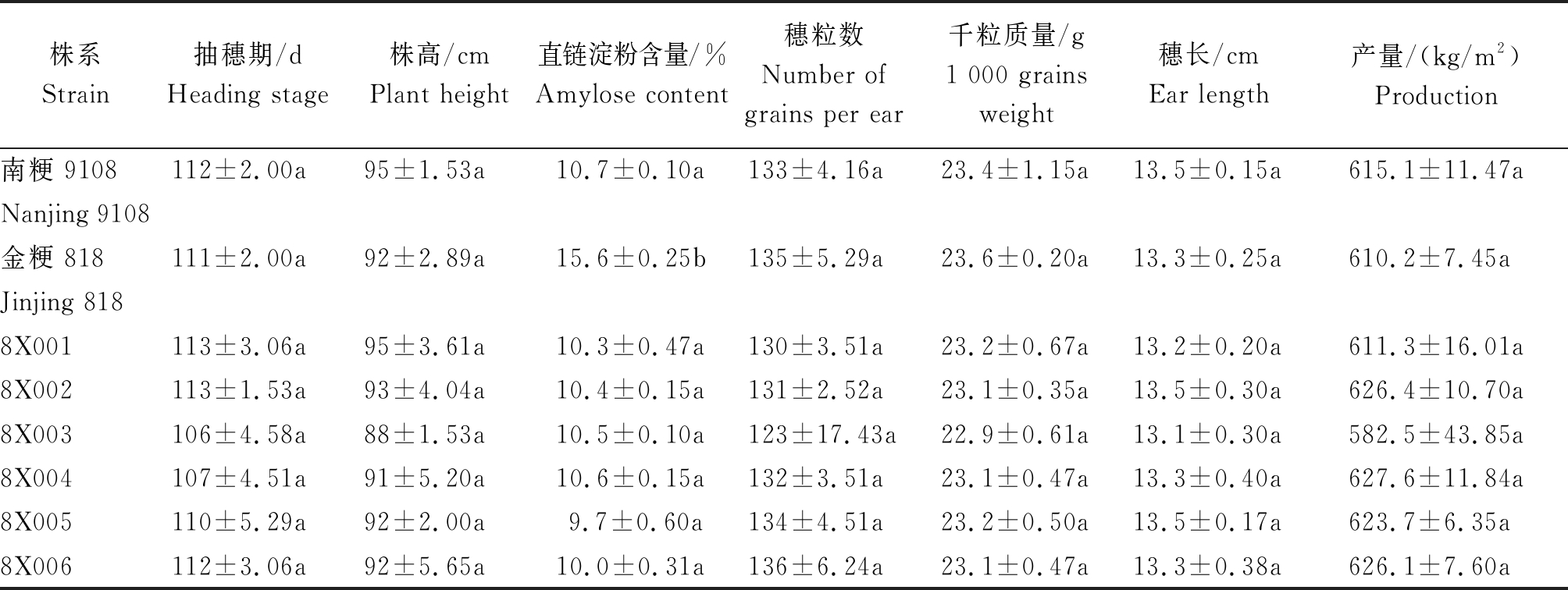
注:不同小写字母表示在0.05水平上差异显著(P<0.05)。
Note:Different lowercase letters indicate significant differences at the 0.05 level(P<0.05).
株系Strain抽穗期/dHeading stage株高/cmPlant height直链淀粉含量/%Amylose content穗粒数Number ofgrains per ear千粒质量/g1 000 grainsweight穗长/cmEar length产量/(kg/m2)Production南粳 9108112±2.00a95±1.53a10.7±0.10a133±4.16a23.4±1.15a13.5±0.15a615.1±11.47aNanjing 9108金粳 818111±2.00a92±2.89a15.6±0.25b135±5.29a23.6±0.20a13.3±0.25a610.2±7.45aJinjing 8188X001113±3.06a95±3.61a10.3±0.47a130±3.51a23.2±0.67a13.2±0.20a611.3±16.01a8X002113±1.53a93±4.04a10.4±0.15a131±2.52a23.1±0.35a13.5±0.30a626.4±10.70a8X003106±4.58a88±1.53a10.5±0.10a123±17.43a22.9±0.61a13.1±0.30a582.5±43.85a8X004107±4.51a91±5.20a10.6±0.15a132±3.51a23.1±0.47a13.3±0.40a627.6±11.84a8X005110±5.29a92±2.00a9.7±0.60a134±4.51a23.2±0.50a13.5±0.17a623.7±6.35a8X006112±3.06a92±5.65a10.0±0.31a136±6.24a23.1±0.47a13.3±0.38a626.1±7.60a
3 结论与讨论
主效基因Wx基因(蜡质基因)控制着稻米的糯性与非糯性状[21],Wx基因可以编码淀粉合成酶,淀粉合成酶通过与淀粉粒结合催化合成直链淀粉,从而控制胚乳中直链淀粉含量[22]。随着人民生活水平的日益提高,人们对稻米品质及适口性有了更高的要求,对稻米的追求正在从数量型向质量食味型转变[23],高品质的稻米也就具有了更高的生产价值。为了满足人们对稻米日益增长的品质需求,在育种过程中,培育了具有低直链淀粉含量的水稻品种。近年来,作物生产方式逐渐向轻简化发展,传统的播种方式已经不能满足田间种植的需要,因而直播稻田的面积逐渐增加,与此同时产生的田间杂草、杂草稻正严重威胁着水稻产量及品质。目前,以杂草稻为首的杂草已经成为水稻种植区的主要杂草,由于其与栽培稻具有相似的同源性,并具有与栽培稻伴生、生长速度快、生育期提前、落粒性高、耐逆境等特点[24],杂草稻的防治已成为生产难题,使用常规化学除草剂来防治田间杂草及杂草稻不仅防治效果不佳且对农作物本身具有一定的危害性,栽培稻的优质优产与除草剂抗性并存已成为水稻生产中亟须解决的问题。培育同时带有低直链淀粉含量基因Wx-mq和抗除草剂基因ALS的水稻品种对解决杂草危害,降低生产成本,提高水稻产量和品质具有重要意义。
基因功能标记的开发与应用能够加快育种进程。分子标记可以用于基因型选择,特别是对于显性基因,能够快速剔除杂合基因型,加快目的基因的早代稳定,可以省略表型鉴定过程,节省成本,加快育种进程[25-26]。本研究培育了携带有低直链淀粉含量和除草剂抗性的新品种,利用传统的育种手段,将具有除草剂抗性的粳稻与带有低直链淀粉含量基因的品种进行杂交及回交转育,育种过程繁琐且田间鉴定时间长,有必要采用分子标记辅助选择对低直链淀粉含量基因Wx-mq和抗除草剂基因ALS基因型进行鉴定,快速获得基因型纯合的水稻材料,为育种工作缩短时间。王金明等[27]研究表明在抗病基因聚合育种中,分子标记选择具有常规表型鉴定不可比拟的优越性,以PCR为基础的分子标记具有DNA用量少、操作简单、快速等优点,是分子标记辅助育种的首选。在实际品种选育过程中,抗除草剂基因ALS可以在苗期通过喷施除草剂的方法提前进行抗性筛选,具有除草剂抗性的单株能够正常生长,这样便于我们进行田间统计抗除草剂与不抗除草剂的单株,为后续分子标记检测提供有力的数据支持。本研究采用的四引物ARSM-PCR技术和AS-PCR技术可以在苗期对Wx-mq和ALS基因型进行鉴定,经田间抗性筛选及胚乳外观检测,培育出了6个农艺性状优良且具有除草剂抗性的低直链淀粉含量水稻新品系,在水稻优良性状(抗性、优质等)的辅助选育及多基因聚合育种中发挥了重要作用。
[1] 陈涛,骆名瑞,张亚东,朱镇,赵凌,赵庆勇,周丽慧,姚姝,于新,王才林. 利用四引物扩增受阻突变体系PCR技术检测水稻低直链淀粉含量基因Wx-mq[J]. 中国水稻科学,2013,27(5):529-534. doi:10.3969/j.issn.1001-7216.2013.05.010.
Chen T,Luo M R,Zhang Y D,Zhu Z,Zhao L,Zhao Q Y,Zhou L H,Yao S,Yu X,Wang C L. Detection of Wx-mq gene for Low-amylose content by Tetra-primer amplification refractory mutation system PCR in rice[J]. Chin J Rice Science,2013,27(5):529-534.
[2] 杨博文,向珣朝,许顺菊,许亮,王茜. Wx基因与SSⅢ-2基因互作对稻米蒸煮食味品质的影响[J].西北植物学报,2017,37(5):879-884. doi:10.7606/j.issn.1000-4025.2017.05.0879.
Yang B W,Xiang X C,Xu S J,Xu L,Wang Q. Effects for interaction of Wx and SSⅢ-2 on rice eating and cooking qualities[J]. Acta Botanica Boreali-Occidentalia Sinica,2017,37(5):879-884.
[3] 李顺国,夏雪岩,刘猛,赵宇,刘斐,程汝宏,王慧军. 我国谷子轻简高效生产技术研究进展[J]. 中国农业科技导报,2016,18(2):19-24. doi:10.13304/j.nykjdb.2015.356.
Li S G,Xia X Y,Liu M,Zhao Y,Liu F,Cheng R H,Wang H J. Research progress on light simple and efficient production technology of foxtail millet in China[J]. Journal of Agricultural Science and Technology,2016,18(2):19-24.
[4] 李顺国,刘斐,刘猛,赵宇,王慧军. 我国谷子产业现状、发展趋势及对策建议[J]. 农业现代化研究,2014,35(5):531-535. doi:10.13872/j.1000-0275.2014.000051.
Li S G,Liu F,Liu M,Zhao Y,Wang H J. The current industry situation,development trend,and suggestions for the future of foxtail millet in China[J]. Research of Agricultural Modernization,2014,35(5):531-535.
[5] Gianessi L P,Reigner N P. The value of herbicides in U.S. crop production[J]. Weed Technology,2007,21(2):559-566. doi:10.1614/WT-06-130.1.
[6] 李燕敏,祁显涛,刘昌林,刘方,谢传晓. 除草剂抗性农作物育种研究进展[J].作物杂志,2017(2):1-6. doi:10.16035/j.issn.1001-7283.2017.02.001.
Li Y M,Qi X T,Liu C L,Liu F,Xie C X. Progress of crops breeding on resistance to herbicides[J].Crops,2017(2):1-6.
[7] 宋慧,李海峰,付楠,魏萌涵,邢璐,刘金荣.咪唑啉酮类除草剂及其抗性作物的发展现状[J].河北农业科学,2018,22(3):38-41. doi:10.16318/j.cnki.hbnykx.2018.03.009.
Song H,Li H F,Fu N,Wei M H,Xing L,Liu J R. Development status of imidazolinone herbicides and their resistant crops[J]. Journal of Hebei Agricultural Sciences,2018,22(3):38-41.
[8] Nikolaos S K,Nieves C,Ana A,Eleftherohorinos I G. Red rice(Oryza sativa)cross-resistance to imidazolinone herbicides used in resistant rice cultivars grown in Northern Greece[J].Pesticide Biochemistry and Physiology,2013,105(3):177-183. doi:10.1016/j.pestbp.2013.01.008.
[9] Carlson T P,Webster E P,Salassi M E,Hensley J B,Blouin D C. Imazethapyr plus propanil programs in imidazolinone-resistant rice[J]. Weed Technology,2011,25(2):204-211. doi:10.1614/WT-D-10-00118.1.
[10] Gaston S,Zabalza A,Gonz lez E M,Arrese-Igor C,Aparicio-Tejo P M,Royuela M. Imazethapyr,an inhibitor of the branched-chain amino acid biosynthesis,induces aerobic fermentation in pea plants[J]. Physiol Plant,2002,114(4):524-532. doi:10.1034/j.1399-3054.2002.1140404.x.
lez E M,Arrese-Igor C,Aparicio-Tejo P M,Royuela M. Imazethapyr,an inhibitor of the branched-chain amino acid biosynthesis,induces aerobic fermentation in pea plants[J]. Physiol Plant,2002,114(4):524-532. doi:10.1034/j.1399-3054.2002.1140404.x.
[11] Rajguru S N,Burgos N R,Shivrain V K,Stewart J M. Mutations in the red rice ALS gene associated with resistance to imazethapyr[J]. Weed Science,2005,53(5):567-577. doi:10.1614/ws-04-111r1.1.
[12] 王芳权,杨杰,范方军,李文奇,王军,许扬,朱金燕,费云燕,仲维功. 水稻抗咪唑啉酮类除草剂基因ALS功能标记的开发与应用[J].作物学报,2018,44(3):324-331. doi:10.3724/SP.J.1006.2018.00324.
Wang Q F,Yang J,Fan F J,Li W Q,Wang J,Xu Y,Zhu J Y,Fei Y Y,Zhong W G. Development and application of the functional marker for imidazolinone herbicides resistant ALS gene in rice[J]. Acta Agronomic Sinica,2018,44(3):324-331.
[13] 王才林,陈涛,张亚东,朱镇,赵凌,林静. 通过分子标记辅助选择培育优良食味水稻新品种[J]. 中国水稻科学,2009,23(1):25-30.
Wang C L,Chen T,Zhang Y D,Zhu Z,Zhao L,Lin J. Breeding of a new rice variety with good eating quality by marker assisted selection[J]. Chin J Rice Sci,2009,23(1):25-30.
[14] Chen T,Wu H,Zhang Y D,Zhu Z,Zhao Q Y,Zhou L H,Yao S,Zhao L,Yu X,Zhao C F,Wang C L. Genetic improvement of Japonica rice variety Wuyujing 3 for stripe disease resistance and eating quality by pyramiding Stv-bi and Wx-mq[J]. Rice Science,2016,23(2):69-77. doi:10.1016/j.rsci.2016.02.002.
[15] 朱镇,赵庆勇,张亚东,陈涛,姚姝,周丽慧,赵凌,赵春芳,梁文化,路凯,王才林.不同地点南粳9108稻米直链淀粉含量及RVA谱特征值分析[J].江苏农业科学,2019,47(24):213-216. doi:10.15889/j.issn.1002-1302.2019.24.050.
Zhu Z,Zhao Q Y,Zhang Y D,Chen T,Yao S,Zhou L H,Zhao L,Zhao C F,Liang W H,Lu K,Wang C L.Analysis of amylose content and RVA characteristic value of Nanjing 9108 rice in different locations[J]. Jiangsu Agricultural Sciences,2019,47(24):213-216.
[16] 牛付安,周继华,曹黎明,程灿,涂荣剑,胡雪娇,杨佳,孙滨,罗忠永,赵志鹏,王新其,储黄伟.水稻低直链淀粉含量基因Wxmq的KASP标记开发与利用[J].分子植物育种,2019,17(24):8125-8131. doi:10.13271/j.mpb.017.008125.
Niu F A,Zhou J H,Cao L M,Cheng C,Tu R J,Hu X J,Yang J,Sun B,Luo Y Z,Zhao Z P,Wang X Q,Chu H W. Development and utilization of KASP marker for low amylose content gene,Wxmq,in rice(Oryza sativa L.)[J]. Molecular Plant Breeding,2019,17(24):8125-8131.
[17] 姚姝,陈涛,张亚东,朱镇,赵庆勇,周丽慧,赵凌,赵春芳,王才林. 利用分子标记辅助选择聚合水稻Pi-ta、Pi-b和Wx-mq基因[J].作物学报,2017,43(11):1622-1631. doi:10.3724/SP.J.1006.2017.01622.
Yao S,Chen T,Zhang Y D,Zhu Z,Zhao Q Y,Zhou L H,Zhao L,Wang C F,Wang C L.Pyramiding Pi-ta,Pi-b, and Wx-mq gene by marker-assisted selection in rice[J]. Acta Agronomica Sinica,2017,43(11):1622-1631.
[18] 杨柳,郭长婕,梁斌.基于直链淀粉含量的大米食味品质评价[J].现代食品,2019(19):171-174. doi:10.16736/j.cnki.cn41-1434/ts.2019.19.055.
Yang L,Guo C J,Liang B. The evaluation of the rice eating quality basing on amylose content[J]. Modern Food,2019(19):171-174.
[19] 朱常香,姚方印,温孚江,宋云枝. CryIA(b)基因及其介导的抗性在转基因水稻中的遗传[J]. 植物保护学报,2003,30(1):1-7. doi:10.13802/j.cnki.zwbhxb.2003.01.001.
Zhu C X,Yao F Y,Wen F J,Song Y Z. Genetics of CryIA(b) gene and its mediated resistance in transgenic rice[J].Acta Phytophylacica Sinica,2003,30(1):1-7.
[20] Ye S,Dhillon S,Ke X Y,Collins A R,Day I N M. An efficient procedure for genotyping single nucleotide polymorphisms[J].Nucleic Acids Res,2001,29(17):e88. doi:10.1093/nar/29.17.e88.
[21] 范美英,梅法庭,朱义旺,林雅容,赵丽丽,田光蕾,王锋.利用CRISPR/Cas9技术创制糯稻新材料[J].福建农业学报,2019,34(5):503-508. doi:10.19303/j.issn.1008-0384.2019.05.001.
Fan M Y,Mei F T,Zhu Y W,Lin Y R,Zhao L L,Tian G L,Wang F. Greating new glutinous rice by CRISPR/Cas9-targeted mutagenesis in rice[J]. Fujian Journal of Agricultural Sciences,2019,34(5):503-508.
[22] 王慧,方玉,黄艳玲,冯冲,杨力,周桂香,张从合.稻米主要食味品质基因型与环境互作分析及其相关性研究[J].中国稻米,2020,26(2):23-26. doi:10.3969/j.issn.1006-8082.2020.02.006.
Wang H,Fang Y,Huang Y L,Feng C,Yang L,Zhou G X,Zhang C H. Analysis of the genotype and environment interactions as well as the correlation research of main taste quality in rice[J]. China Rice,2020,26(2):23-26.
[23] Fitzgerald M A,Mc Couch S R,Hall R D. Not just a grain of rice:the quest for quality[J]. Trends Plant Science,2009,14(3):133-139. doi:10.1016/j.tplants.2008.12.004.
[24] 马静,王兴盛,段彩林,孙建昌. 宁夏杂草外观和碾磨品质分析[J]. 种子,2018,37(2):55-58. doi:10.16590/j.cnki.1001-4705.2018.02.055.
Ma J,Wang X S,Duan C L,Sun J C. Analysis on appearance and milling quality of weedy rice in Ningxia[J]. Seed,2018,37(2):55-58.
[25] 李静静,史娜溶,杨孟于,王金鹏,孙道杰,冯毅,张玲丽.抗赤霉病小麦优异新种质的分子标记辅助选择[J].麦类作物学报,2020,40(3):261-269.doi:10.7606/j.issn.1009-1041.2020.03.01.
Li J J,Shi N R,Yang M Y,Wang J P,Sun D J,Feng Y,Zhang L L. Marker-assisted selection for Fusuarium head blight resistance of wheat germplasms with excellent agronomy traits and seed quality[J]. Journal of Triticeae Crops,2020,40(3):261-269.
[26] 王芳权,杨杰,范方军,王军,朱金燕,李文奇,沈文飚,仲维功. 水稻紫色果皮的延迟遗传及Pb基因功能标记开发[J]. 中国水稻科学,2014,28(6):605-611. doi:10.3969/j.issn.1001-7216.2014.06.006.
Wang F Q,Yang J,Fan F J,Wang J,Zhu J Y,Li W Q,Shen W B,Zhong W G. Delayed inheritance of purple pericarp in rice and development of functional marker for Pb gene[J]. Chin J Rice Sci,2014,28(6):605-611.
[27] 王金明,林秀云,刘晓梅,孙强,李鹏志,张三元. 分子标记选择水稻抗稻瘟病基因Pi40和Pib聚合体[J]. 华北农学报,2012,27(2):218-221. doi:10.3969/j.issn.1000-7091.2012.02.041.
Wang J M,Lin X Y,Liu X M,Sun Q,Li P Z,Zhang S Y. Selecting the pyramids of blast resistance genes Pi40 and Pib in rice assisted by molecular marker[J].Acta Agriculturae Boreali-Sinica,2012,27(2):218-221.