芽孢杆菌是一类常见的益生菌,被广泛应用于家禽养殖业[1]。有大量研究表明,芽孢杆菌制剂能够作为免疫激活剂,促进机体免疫器官发育及激活免疫相关信号通路,从而刺激机体的特异性及非特异性免疫,改善动物免疫能力[2-4],对其免疫作用的机制尤其是分子机制的研究是当前的一项热点。
抑制性消减杂交(Suppression subtractive hybridization,SSH)技术是一种用于构建差异基因文库的技术,具有应用度广、灵敏度高、特异性强、能富集稀有转录本等诸多优点[5],因此,在动物差异表达基因的筛选上有大量应用。Yu等[6]利用SSH技术来研究梭子蟹卵巢发育相关基因,鉴定了51个差异表达序列(ESTs),发现肌球蛋白Ⅱ杆孔样蛋白、组蛋白H3及围食膜因子48等可能参与了卵巢的发育。Kang等[7]利用SSH文库技术对中国滩羊不同生长阶段的不同毛发表型(卷曲和非卷曲)进行了分析,发现67个差异表达的基因,再通过进一步研究,证实KRT71基因与滩羊的卷发表型高度相关。但SSH技术也存在程序繁琐和假阳性率高等缺点。同时,因为巢式PCR克隆会产生大量重复cDNA片段,最终会导致库容虚增。因此,有必要将SSH技术与其他技术结合以对其进行改良。
变性梯度凝胶电泳(Denatured gradient gel electrophoresis,PCR-DGGE)技术是一种用于分离差异基因的技术[8]。理论上可以分离开200~1 000 bp大小,差异一个碱基的DNA片段[9]。具有快速、稳定、高效、可重复性高等优势,在分析微生物群落结构组成及发现和筛选功能菌群等方面被大量应用[10-11]。Karina等[12]利用DGGE技术研究了哥伦比亚传统发酵牛奶Suero ![]() 主要菌群组成,为该产品的工业化生产提供了基础。Andrea等[13]采用DGGE技术并结合荧光定量PCR对6种食用昆虫的微生物区系进行了分析,发现大部分样品有假单胞菌存在,提示应当对其进行适当的加工,以减少对消费者的风险。
主要菌群组成,为该产品的工业化生产提供了基础。Andrea等[13]采用DGGE技术并结合荧光定量PCR对6种食用昆虫的微生物区系进行了分析,发现大部分样品有假单胞菌存在,提示应当对其进行适当的加工,以减少对消费者的风险。
有关对SSH技术进行改良,以筛选差异基因、研究分子机理的研究还未见报道。本试验以蜡样芽孢杆菌制剂饲喂肉鸡,结合SSH技术及DGGE技术(ACSSH),构建脾脏组织差异基因文库,筛选免疫相关差异基因,并与传统SSH技术进行对比,以期初步探索蜡样芽孢杆菌影响肉鸡免疫的分子机制及ACSSH技术的可行性。
1 材料和方法
1.1 芽孢杆菌制剂的制备
蜡样芽孢杆菌PAS38菌种由四川农业大学发酵工程实验室提供,通过固体表面培养48 h,收集菌体,添加适量玉米粉,烘干,磨碎得到菌粉,测定其活芽孢数量并调整为2×109 cfu/g,室温中保存备用。
1.2 试验动物分组及饲养
1日龄的艾维茵肉鸡80羽,购自四川省正大畜禽有限公司。基础日粮预饲7 d后,分为对照组(A组)和试验组(B组),每组3个重复,每个重复10羽。对照组饲喂基础日粮,试验组饲喂添加0.1% 蜡样芽孢杆菌PAS38制剂的基础日粮饲料。试验鸡采用笼养,每笼10羽肉鸡,自由采食和饮水。于42日龄时从每个重复随机选取2只放血处死,并迅速解剖采取脾脏,放于液氮中保存。
1.3 RNA的提取和cDNA合成
将脾脏组织于液氮中快速研磨,采用RNAiso Plus试剂提取组织总RNA,溶解于无RNA酶的超纯水中,并用核酸测定仪NanoDrop 2000测定其纯度和浓度。随后立即采用SmarterTM PCR cDNA Synthesis Kit(Clontech,USA)试剂盒进行第1链cDNA的合成,并用TE缓冲液将合成的第1链cDNA稀释5倍,于-20 ℃保存。采用Advantage 2 PCR Kit(Clontech,USA)试剂盒进行第2链cDNA的合成。第2链cDNA通过磁珠法PCR 产物纯化试剂盒进行纯化(Sangon Biotech)。
1.4 抑制消减杂交
对纯化后的第2链cDNA进行Rsa Ⅰ酶切,分为2份,分别连接2种不同的接头Adaptor1(5′-CTAATACGACTCACTATAGGGCTCGAGCGGCCGCCCGGGCAGGTACCTGCCCGGG-3′)和Adaptor2R(5′-CTAATACGACTCACTATAGGGCAGCGTGGTCGCGGCCGAGGTACC TCGGCCG-3′),作为Tester-1和Tester-2。将对照组未加接头的cDNA作为Driver,试验组加有Adapter1/Adaptor2R的cDNA作为Tester进行2轮杂交,视为正向文库;反之,以试验组未加接头的cDNA作为Driver,对照组加有接头的cDNA作为Tester进行杂交,为反向文库。完成2轮杂交后,以巢式PCR后的杂交产物为模板,将未消减杂交的Tester 巢式PCR产物作为对照,对内参基因β-actin进行扩增,以检测抑制消减杂交的效率。
1.5 SSH文库的构建
将杂交产物进行巢式PCR扩增,第一次PCR采用Adapter1和Adapter2R共有序列引物PCR Primer 1(引物序列:5′-CTAATACGACTCACTATAGGGC-3′)进行扩增。将第1次PCR产物稀释10倍,然后以Adapter1和Adapter2R的特异性序列Nested PCR Primer 1(引物序列:5′-TCGAGCGGCCGCCCGGGCAGGT-3′)和Nested PCR Primer 2R(引物序列:5′-AGCGTGGTCGCGGCCGAGGT-3′)作为引物进行第2次PCR。将纯化后的正向和反向PCR扩增产物连接于pUCm-T克隆载体,然后转化到DH5α感受态大肠杆菌细胞中,转化后利用氨苄抗生素和蓝白斑筛选阳性转化子。随机从正、反向文库中挑选400个白色克隆,利用第2次巢式PCR引物进行菌液PCR,检测插入片段的大小及条带单一性。将阳性克隆送往测序,构建SSH文库。
1.6 ACSSH文库的构建
第1次巢式PCR操作步骤与1.5相同,第2次巢式PCR,在引物Nested PCR Primer 1的5′ 端加上GC夹子再扩增,以用于DGGE。为追求更好的DGGE分离效果,设计不同序列、不同数量的GC夹子(表1)。将纯化后的巢式PCR产物进行DGGE分离,条件为:6% 聚丙烯酰胺凝胶,35%~65% 变性剂浓度梯度,电泳采用D-code DGGE系统(Bio-Rad),电泳缓冲液为1×TAE,电压200 V快速进样5 min,电压100 V,电泳960 min,电泳结束后进行硝酸银染色,并于凝胶成像分析系统白板上照胶。然后将DGGE图谱上出现的特征性条带割胶回收,用无菌去离子水冲洗3次,放入1.5 mL离心管中,加入100 μL TE缓冲液4 ℃过夜,取1 μL为模板,以不带GC夹子的Nested PCR Primer 1和Nested PCR Primer 2R为引物进行PCR扩增,并将PCR产物送往测序,构建ACSSH文库。
表1 不同数量的GC夹子序列
Tab.1 Different number of GC clamp sequence

引物名称Primer nameGC夹子数量/bpNumber of GC clips序列(5'-3')SequenceP1GC-140CGCCCGGGGCGCGCCCCGGGCGGGGCGGGGGCACGGGGGG P1GC-240CGCCCGCCGCGCCCCGCGCCCGTCCCGCCGCCCCCGCCCGP1GC-340CGCCGGGGGCGCGCCCCGGGCGGGGCGGGGGCACGGGGGGP1GC-420CGCCCGCCGCGCCCCGCGCCP1GC-510CGCCCGGGGC
1.7 测序及序列分析
将1.5选取的阳性克隆和1.6 DGGE分离条带的PCR产物委托北京擎科新业生物技术有限公司测序,并通过NCBI网站Blast功能对测序结果进行比对,去除冗余序列、载体序列和比对不上的序列,统计有效ESTs,然后通过Blast2Go软件对SSH文库进行GO注释分析,并筛选得到免疫相关基因。
2 结果与分析
2.1 cDNA的合成和酶切
对照组和试验组脾脏第2链cDNA及其酶切产物1.2% 琼脂糖凝胶电泳见图1,可以看出第2链cDNA条带大小不一,亮带主要集中在2 000 bp以上。酶切后,条带范围尤其是亮带位置明显下调,符合酶切效果。
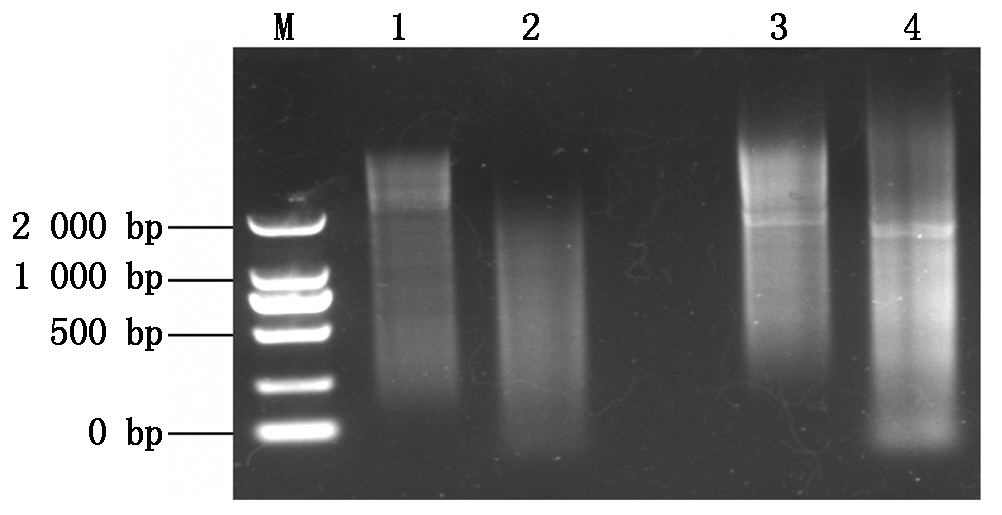
M.Marker 2000;1-2.对照组cDNA酶切前后电泳结果;3-4.试验组cDNA酶切前后电泳结果。
M.Marker 2000;1-2.The electrophoresis results of cDNA before and after enzyme digestion of control group;3-4.Electrophoresis results of cDNA before and after enzyme digestion of treatment group.
图1 脾脏组织cDNA的合成及酶切
Fig.1 Synthesis and enzyme digestion of splenic cDNA
2.2 抑制消减杂交效率检测
杂交前后β-actin扩增电泳结果如图2 所示,正向文库杂交产物在33个循环出现条带,未消减cDNA在23个循环已出现条带;反向文库杂交产物也是在33个循环出现条带,未消减cDNA在23个循环出现条带;均相差10个循环,表明文库消减效率较高,文库质量较好。
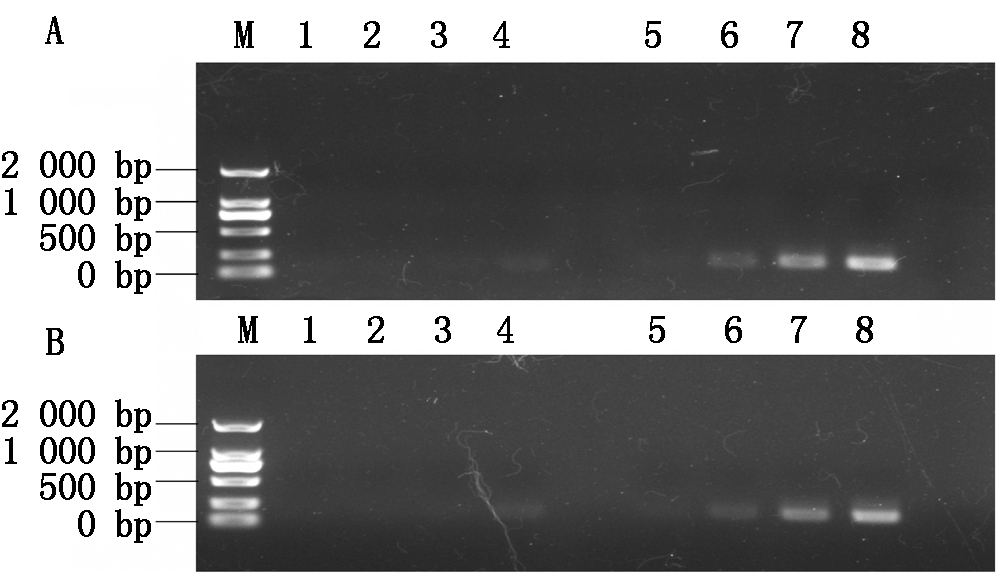
M.Marker 2000;A.正向文库;B.反向文库;1-4.杂交产物经过18,23,28,33个循环扩增后的电泳结果;5-8.未消减cDNA经过18,23,28,33个循环扩增后的电泳结果。
M.Marker 2000;A. Forward library;B. Reverse library;1-4 .The electrophoresis results of hybridized products after 18,23,28 and 33 cycles of amplification;5-8.The electrophoresis results of cDNA without subtractive hybridization after 18,23,28 and 33 cycles of amplification.
图2 抑制消减杂交效率检测
Fig.2 Detection of suppression subtractive hybridization efficiency
2.3 SSH文库的构建
随机挑选400个白色菌落进行菌液培养,菌液PCR显示其中378个为单一条带。测序结果通过NCBI网站Blast功能对测序结果进行比对,除去重复序列,统计其余ESTs见表2,正、反向文库分别得到63,56条有效ESTs。经过Gene ontology level 2聚类分析,生物进程分类见图3,总共包含9个与免疫相关的基因,正向文库包括多聚体IgA和IgM的连接链(JCHAIN)、铁蛋白重链1(FTH1)、嘌呤能受体p2x 7(P2RX7)、溶质载体家族7成员6(SLC7A6)、toll样受体7(TLR7)、胰岛素样生长因子1受体(IGF1R)、SMAD家庭成员7(SMAD7)。反向文库包括整合素亚单位α4(ITGA4)、细胞因子分解脱毒剂10(DOCK10)。
表2 SSH基因文库测序
Tab.2 Sequencing of SSH gene library
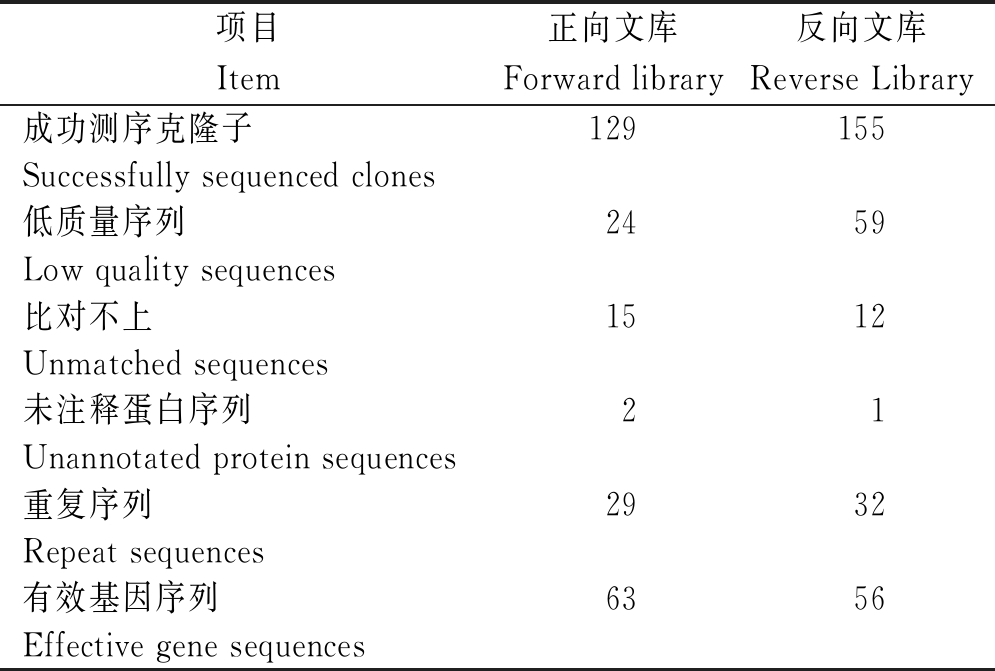
项目Item正向文库Forward library反向文库Reverse Library成功测序克隆子 129155Successfully sequenced clones低质量序列 2459Low quality sequences比对不上 1512Unmatched sequences未注释蛋白序列 21Unannotated protein sequences重复序列2932Repeat sequences有效基因序列6356Effective gene sequences
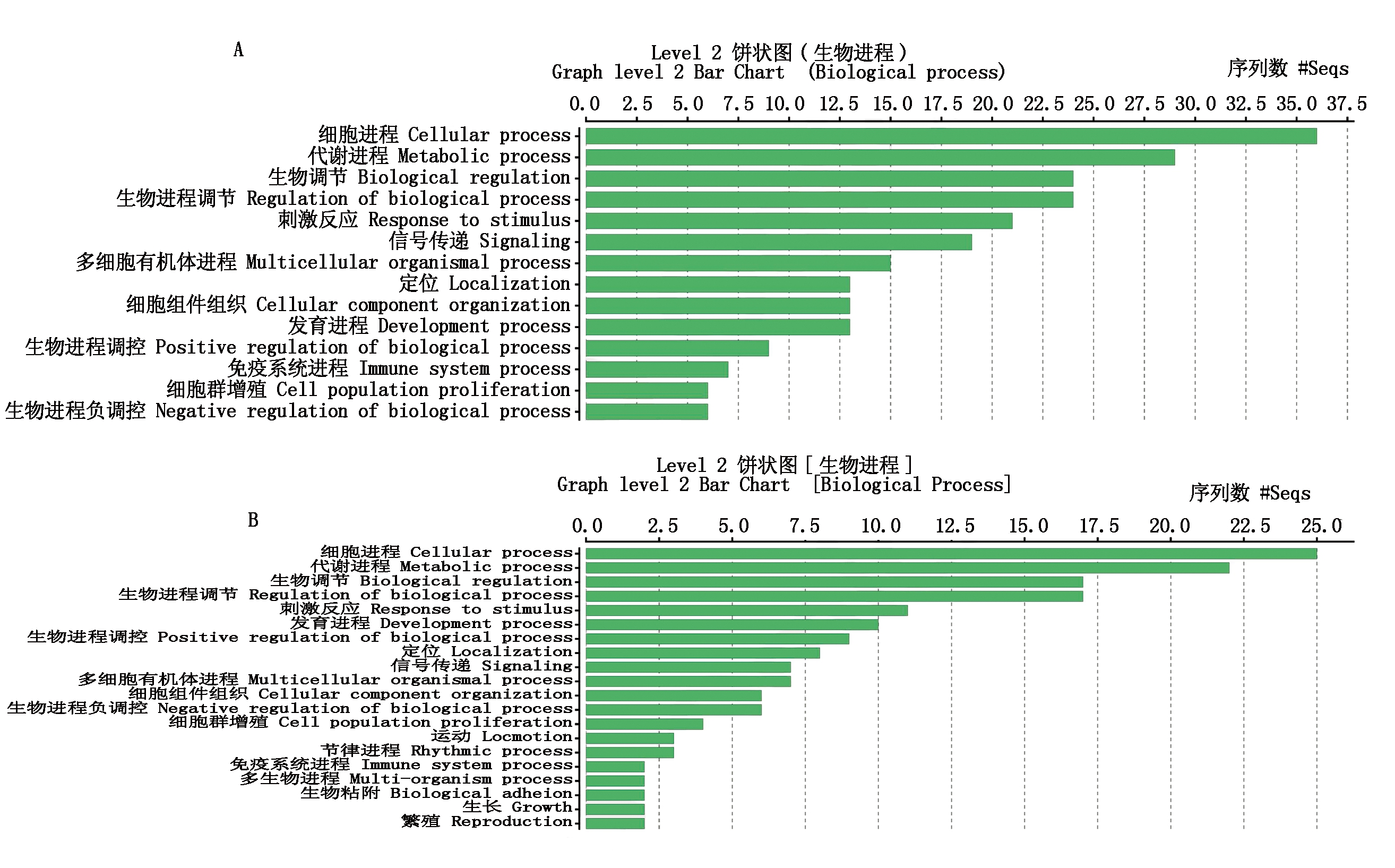
A.正向文库;B. 反向文库。
A. Forward library;B. Reverse library.
图3 Gene ontology水平2聚类分析生物进程分类
Fig.3 Gene ontology level 2 clustering analysis of biological process classification
2.4 ACSSH文库的构建
第1次DGGE电泳结果见图4-A,其中1号泳道为小鼠盲肠菌群16S rRNA基因V3区对照,2,4,6,8,10,12号泳道是分别以P1GC-1、P1GC-2、P1GC3、P1GC4、P1GC5和不带GC夹子为上游引物扩增的正向文库;3,5,7,9,11,13号泳道是分别以P1GC-1、P1GC-2、P1GC3、P1GC4、P1GC5和不带GC夹子为上游引物扩增的反向文库。可以看出,带40个GC夹子跑出的条带都十分模糊,无法区分单一条带;带20个和10个GC夹子跑出部分可以回收的单一条带,但整体还是很模糊;不带GC夹子跑出的条带较为清晰、单一。回收第1次DGGE电泳条带,进行第2次DGGE电泳见图4-B,其中1-9号泳道为正向文库,10-18号泳道为反向文库。可以看出,再次分离出多条条带。回收纯化第2次DGGE条带,进行常规PCR,对单一条带进行切胶回收,共选取52个条带测序,其中35个测序成功,27个为双峰,8个为单一峰,除去重复,比对得到5个基因,有24条 ESTs 是Gallus gallus paired box 5(PAX5)基因,5条为Gallus gallus serine and arginine rich splicing factor 3(SRSF3)基因,3条 为Gallus gallus La ribonucleoprotein domain family member 1B(LARP1B)基因,2条为Gallus gallus signal peptide peptidase like 2A(SPPL2A)基因,1条为Gallus gallus SEH1 like nucleoporin(SEH1L)基因。

A.第1次DGGE结果;B.第2次DGGE结果。
A .The result of first DGGE;B.The result of second DGGE.
图4 DGGE分离差异基因
Fig.4 Separation of differential genes by DGGE
3 讨论与结论
3.1 肉鸡饲喂蜡样芽孢杆菌对免疫基因表达的影响
益生菌制剂在目前已得到广泛的应用,近年来,有大量有关益生菌影响动物机体免疫相关基因表达的研究报道。Gadde等[14]研究发现,添加枯草芽孢杆菌能够促进TJ蛋白JAM-2、黏液素、ZO-1等紧密连接相关基因的表达,从而影响肉鸡肠道黏膜屏障的完整性,提高免疫力。Gong等[15]发现枯草芽孢杆菌能上调claudin-1、occludin、JAM-A和ZO-1等TJ蛋白,提高小鼠肠道屏障功能。朱沛霁[16]研究表明,枯草芽孢杆菌可诱导健康雪山鸡空肠黏膜TLR2基因表达,并下调大肠杆菌K88感染的雪山鸡TLR2和TLR4基因的表达,减缓炎症反应。
动物机体免疫系统是一个及其复杂的体系,不同物种,同一物种的不同个体,甚至同一个体在不同阶段、不同环境下,其免疫相关基因可能都会有不同的表达,筛选和鉴定免疫差异基因可以为揭示机体抵御病原的免疫机制以及不同条件下的免疫差异提供新的思路[17-18]。有许多学者采用SSH技术来筛选免疫相关差异基因,Gao等[19]在研究家蚕抵抗蚕核多面体病毒(Bombyxmori nuclear polyhedrosis virus,BmNPV)的免疫机制时,通过SSH技术构建了抗性品系和易感品系差异表达基因库,发现抗性种BC10上调了17个基因,这些基因涉及细胞代谢、跨膜转运、细胞骨架、蛋白酶、发育和免疫,可能与家蚕抵抗BmNPV有关。Liu等[20]采用SSH技术构建了脂多糖刺激黄颡鱼后其头肾差异表达基因文库,总共鉴定了95个基因,其中27个与免疫相关,这些发现的基因为了解鱼类的免疫反应提供了新的视角。
本试验中,利用SSH技术和ACSSH技术构建了饲喂蜡样芽孢杆菌PAS38制剂肉鸡脾脏差异基因表达文库,并筛选得到7个上调免疫相关基因JCHAIN、FTH1、P2RX7、SLC7A6、TLR7、IGF1R、SMAD7,2个下调免疫相关基因ITGA4、DOCK10。这是首次研究发现益生菌能影响这些免疫相关基因的表达,在今后的研究过程中,还需要对这些基因进行更深入地发掘,如采用基因沉默、基因过表达等技术,以进一步验证其在肉鸡免疫机制中的重要作用,为阐明蜡样芽孢杆菌促进机体免疫的分子机理奠定基础。
3.2 SSH和ACSSH技术筛选差异表达基因的比较
本试验中,利用传统SSH技术挑选387个阳性克隆测序,共筛选到119条差异基因,其中9条免疫相关基因。通过构建ACSSH,在巢式引物的基础上,设计引物、优化PCR 条件、DGGE的分离条件等,结果含有不同GC夹子的引物分离效果不同,40个和20 个GC夹子不能在DGGE 分离中得到清晰的条带,只有添加10 bp的GC夹子和不带GC夹子的引物能够在DGGE 电泳中分离得到少量的清晰条带。在回收的DGGE 条带中,再次扩增、纯化,难以获得单一的条带。再经过第2次DGGE电泳、回收、扩增、纯化,得到52条单一条带。测序结果表明只有23%的条带为完全单一的单峰,经过比对发现,大量的ESTs为相同基因,其中69% 的ESTs 都是PAX5 基因,14% 为SRSF3 基因,9% 为LARP1B 基因,共筛选得到5个差异基因,都为下调基因,且无免疫相关基因。其中占大部分比重的PAX5 基因是关键的转录因子,其可通过编码B 细胞特异性激活蛋白激活多种B 细胞特异性基因转录表达,并抑制非B 系细胞基因,在B 细胞早期定向分化发育中起着重要的调控作用,与免疫机制存在一定的关联[21-22]。利用2种方法筛选到的差异基因中,并没有出现重叠,这可能与ACSSH技术筛选得到的基因较少有关。
SSH技术结合DGGE技术来分离差异基因的方法效果并不理想,分析原因可能如下,一是基因片段数量和大小不太适合DGGE技术的要求:差异基因巢式PCR扩增产物电泳结果显示条带十分弥散,ESTs的大小从200~2 000 bp不一,且差异基因文库数量太大,而DGGE技术更适用于分离一定数量、一定大小的基因片段[23]。二是GC夹子的不确定性:DGGE技术主要用来分离细菌基因,本试验所采用的GC夹子序列主要适用于细菌16S rRNA 引物,其序列和数量是研究人员根据细菌16S rRNA 基因序列,通过大量试验设计、筛选出来的[24-25],难以自行设计,但Nested PCR Primer 1引物与细菌16S rRNA 引物并不相同,且SSH文库基因序列也与细菌16S rRNA基因序列大不相同,所以GC夹子序列可能并不适用于分离真核生物的差异基因文库。三是同一基因包含多条ESTs:脾脏转录组基因都是经过Rsa Ⅰ 酶切消化的,同一基因可能包含多个ESTs,所以在DGGE回收条带测序时可能会出现大量的重复,大大降低了试验效率。
结果表明,ACSSH 方法虽然可以分离得到差异基因条带,以及可得到免克隆测序条带,获得的差异基因以PAX5基因为主,但获得的差异基因数据偏少,不能满足分析的所需数据,而且费时费力、效率极低、效果不佳、测序双峰占比大从而影响结果的可靠性。这一结果,结合与SSH 方法构建的基因文库数据进行比较,将为后人研究提供资料。在今后的研究中,也将继续思考和探索如何改进SSH技术。
采用SSH技术构建饲喂蜡样芽孢杆菌PAS38制剂肉鸡脾脏差异表达基因文库,共得到119条差异基因,其中9条免疫相关基因,7个为上调基因,2个为下调基因。采用ACSSH技术构建文库,得到5条差异基因,都为下调基因,无免疫相关基因。从文库差异基因数量,试验效率等方面比较,SSH技术明显优于ACSSH技术,ACSSH技术不适用于筛选差异基因。
[1] Yan F,Polk D B. Probiotics:progress toward novel therapies for intestinal diseases[J]. Current Opinion in Gastroenterology,2010,26(2):95-101. doi:10.1097/MOG.0b013e328335239a.
[2] 张李荣. 三种益生菌对维鸡生长、小肠发育及盲肠微生物区系的影响[D]. 扬州: 扬州大学,2018.
Zhang L R. Effects of three probiotics on growth,small intestine development and cecum microorganism of chicks [D]. Yangzhou:Yangzhou University,2018.
[3] Narayanan G,Baskaralingam V,Jiann C C,Rekha R,Vijayakumar S,Anjugam M,Iswarya A. Dietary supplementation of probiotic Bacillus licheniformis Dahb1 improves growth performance,mucus and serum immune parameters,antioxidant enzyme activity as well as resistance against Aeromonas hydrophila in tilapia Oreochromis mossambicus[J]. Fish & Shellfish Immunology,2018(74):501-508. doi:10.1016/j.fsi.2017.12.066.
[4] Madej J P,Stefaniak T,Bednarczyk M. Effect of in ovo-delivered prebiotics and synbiotics on lymphoid-organs′ morphology in chickens[J]. Poultry Science,2015,94(6):1209-1219. doi:10.3382/ps/pev076.
[5] Zhang J C,Yu J F,Hong H L,Liu J,Lu H,Yan C. Identification of heavy metal pollutant tolerance-associated genes in Avicennia marina(Forsk.)by suppression subtractive hybridization[J]. Marine Pollution Bulletin,2017,119(1):81-91. doi:10.1016/j.marpolbul.2017.03.023.
[6] Yu Z B,Mu C K,Song W W,Li R H,Chen Y E,Wang C L. Screening of genes related to ovarian development in the swimming crab,Portunus trituberculatus,by suppression subtractive hybridization[J]. Genetics and Molecular Research,2015,14(4):18675-18686. doi: 10.4238/2015.December.28.16.
[7] Kang X L,Liu Y F,Zhang J B,Xu Q,Liu C,Fang M. Characteristics and expression profile of KRT71 screened by suppression subtractive hybridization cDNA library in curly fleece Chinese Tan Sheep[J]. DNA and Cell Biology,2017,36(7):1-13. doi:10.1089/dna.2017.3718.
[8] Muyzer G,Smalla K. Application of denaturing gradient gelelectrophoresis(DGGE)and temperature gradient gelelectrophoresis(TGGE)in microbialecology[J]. Antonie Van Leeuwenhoek,1998,73(1):127-141. doi:10.1023/a:1000669317571.
[9] 王雪寒,夏冬双,武志华,任兴波,丁一秀,马强,刘惠荣. 内蒙古西部地区土壤放线菌的多样性分析[J]. 基因组学与应用生物学,2018,37(10):4340-4348. doi:10.13417/j.gab.037.004340.
Wang X H,Xia D S,Wu Z H,Ren X B,Ding Y X,Ma Q,Liu H R. Analysis on the diversity of soil actinomycetes in the western region of Inner Mongolia[J].Genomics and Applied Biology,2018,37(10):4340-4348.
[10] Sevcan A,Aiyoub S E,Gozde O. Use of PCR-DGGE based molecular methods to assessment of microbial diversity during anaerobic treatment of antibiotic combinations[J]. Bioresource Technology,2015(192):735-740. doi:10.1016/j.biortech.2015.05.086.
[11] Garofalo C,Bancalari E,Milanovic′ V,Cardinali F,Osimani A,Sardaro M L S,Bottari B,Bernini V,Aquilanti L,Clementi F,Neviani E,Gatti M. Study of the bacterial diversity of foods:PCR-DGGE versus LH-PCR [J].International Journal of Food Microbiology,2017(242):24-36. doi:10.1016/j.ijfoodmicro.2016.11.008.
[12] Karina E M,Christian M,Marco V,Valencia F E,Ruas-Madiedo P,Delgado S. Bacterial diversity of the colombian fermented milk “Suero ![]() assessed by culturing and high-throughput sequencing and DGGE analysis of 16S rRNA gene amplicons[J]. Food Microbiology,2017(68):129-136. doi:10.1016/j.fm.2017.07.011.
assessed by culturing and high-throughput sequencing and DGGE analysis of 16S rRNA gene amplicons[J]. Food Microbiology,2017(68):129-136. doi:10.1016/j.fm.2017.07.011.
[13] Andrea O,Vesna M,Cristiana G,Cardinali F,Roncolini A,Sabbatini R,De Filippis F,Ercolini D,Gabucci C,Petruzzelli A,Tonucci F,Clementi F,Aquilanti L. Revealing the microbiota of marketed edible insects through PCR-DGGE,metagenomic sequencing and real-time PCR[J]. International Journal of Food Microbiology,2018(276):54-62. doi:10.1016/j.ijfoodmicro.2018.04.013.
[14] Gadde U,Oh S T,Lee Y S,Davis E,Zimmerman N,Rehberger T,Lillehoj H S. The effects of direct-fed microbial supplementation,as an alternative to antibiotics,on growth performance,intestinal immune status,and epithelial barrier gene expression in broiler chickens[J]. Probiotics & Antimicro,2017(9):397-405. doi:10.1007/s12602-017-9275-9.
[15] Gong Y,Li H,Li Y. Effects of Bacillus subtilis on epithelial tight junctions of mice with inflammatory bowel disease[J]. Journal of Interferon & Cytokine Research,2016,36(2):1-11. doi:10.1089/jir.2015.0030.
[16] 朱沛霁.枯草芽孢杆菌对雪山鸡生产性能、肠道健康和免疫机能的影响及机制[D].扬州:扬州大学,2017.
Zhu P Q. Effect of dietary supplementation of Bacillus Subtilis on growth performance,intestinal health and immune function responses of Xueshan Broiler[D]. Yangzhou:Yangzhou Universuty,2017.
[17] He Y,Wang A Q,Chen S,Wu Z,Zhang J Y,Wang M S,Jia R Y,Zhu D K,Liu M F,Yang Q,Wu Y,Sun K F,Chen X G,Cheng A C. Differential immune-related gene expression in the spleens of duck Tembusu virus-infected goslings[J]. Veterinary Microbiology,2017(212):39-47. doi:10.1016/j.vetmic.2017.08.002.
[18] Byadgi O,Chen Y C,Maekawa S,Wang P C,Chen S C. Immune-Related functional differential gene expression in Koi Carp(Cyprinus carpio)after challenge with Aeromonas sobria[J].International Journal of Molecular Sciences,2018,19(7):2107. doi:10.3390/ijms19072107.
[19] Gao L,Yang Y,Yao Q,Chen K. Differentially expressed genes in the midguts of BmNPV-susceptible and resistant silkworm strains determined using suppression subtractive hybridization[J]. Invertebrate Survival Journal,2018,15(1):256-264.
[20] Liu Q N,Xin Z Z,Chai X Y,Jiang S H,Li C F,Zhang H B,Ge B M,Zhang D Z,Zhou C L,Tang B P. Characterization of immune-related genes in the yellow catfish Pelteobagrus fulvidraco in response to LPS challenge[J]. Fish & Shellfish Immunology,2016(56):248-254. doi:10.1016/j.fsi.2016.05.019.
[21] Fujita T,Kitaura F,Fujii H. A critical role of the Thy28-MYH9 axis in b cell-specific expression of the Pax5 gene in chicken B cells[J]. PLoS One,2015,10(1):e0116579. doi:10.1371/journal.pone.0116579.
[22] Jamrog L,Chemin G,Fregona V,Coster L,Pasquet M,Oudinet C,Rouqui N,Prade N,Lagarde S,Cresson C,H brard S,Nguyen H N S,Bousquet M,Quelen C,Brousset P,Mancini S J C,Delabesse E,Khamlichi A A,Gerby B,Broccardo C. PAX5-ELN oncoprotein promotes multistep B-cell acute lymphoblastic leukemia in mice[J]. PNAS,2018,115(41):10357-10362. doi:10.1073/pnas.1721678115.
[23] Danilo E. PCR-DGGE fingerprinting:novel strategies for detection of microbes in food[J]. Journal of Microbiological Methods,2004,56(3):297-314. doi:10.1016/j.mimet.2003.11.006.
[24] Giusy F,Giovina R. Detection of polymorphisms within the FAS cDNA gene sequence by GC-clamp denaturing gradient gel electrophoresis[J]. Immunogenetics,1994,39(6):437-439. doi:10.1007/bf00176163.
[25] Luo H F,Qi H Y,Xue K,Wang X Y,Wang C,Zhang H X. Influence of application of GC-clamp on study of soil microbial diversity by PCR-DGGE[J]. Acta Ecologica Sinica,2003,23(10):2170-2175.