牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)是引起黏膜病/牛病毒性腹泻的主要致病原,为单股正链RNA病毒,与猪瘟病毒(CSFV)和绵羊边界病毒(BDV)同属于黄病毒科(Flaviviridae)瘟病毒属(Pestivirus)[1-2]。BVDV主要感染牛,也感染猪、山羊、绵羊和鹿等其他动物[3]。BVDV感染可导致怀孕母牛流产,早期胚胎坏死,胎儿发育迟缓或畸形,腹泻,慢性消耗综合征,致命性的黏膜疾病以及呼吸、免疫、生殖系统的疾病等[4]。此外,怀孕期间的母畜感染BVDV可引起新生动物的持续性感染(Persistently infected,PI),PI动物血清抗体虽呈阴性,但其终身携带病毒,并不断向周围环境排放病毒[5],是BVDV传播的主要来源,因此,对养殖业造成极大危害。
依据BVDV在细胞上是否引起细胞病变,BVDV可分为非细胞病变型(Noncytopathic,NCP)和致细胞病变型(Cytopathic,CP)[6-7]。根据5′-UTR基因序列差异,BVDV可分为2种基因型,即:BVDV-1型和BVDV-2型[8]。其中BVDV-1型目前已鉴定出21个亚型(1a-1u)[9-10],BVDV-2型已鉴定出4个亚型(2a-2d)。此外,欧洲病牛血清中还发现另一种新BVDV基因型,即:HoBi样BVDV-3型,该基因型又可分为Thai源和Brazilian源2种亚型[11]。BVDV分子流行病学表明,我国存在BVDV-1a、BVDV-1b、BVDV-1c、BVDV-1d、BVDV-1m、BVDV-1o、BVDV-1p、BVDV-1q、BVDV-2a和BVDV-2b亚型的流行毒株[12-14],但主要流行BVDV-1b和BVDV-1m亚型。目前,该病在世界范围内广泛流行,给全球畜牧业造成了严重的经济损失[15]。此外,牛血清在细胞培养及生物制品研发过程中广泛应用,如果血清中有NCP型BVDV的感染,将对生物制品行业产生很大的安全隐患。
本研究从甘肃某牛场采集腹泻牛粪便样品,并成功分离到1株BVDV-1a亚型毒株,不仅丰富了我国BVDV的分子流行病学数据,为该地区BVDV的防控提供了一定的参考依据,也为BVDV的致病机制的研究及疫苗研制奠定了坚实基础。
1 材料和方法
1.1 病毒、细胞与病料样品
BVDV NADL毒株采购自中国兽医药品监察所;牛肾细胞(MDBK)采购自中国科学院上海细胞库;DH5α感受态购自宝生物工程(大连)有限公司;牛腹泻粪便样品采集自甘肃地区某奶牛养殖场。
1.2 主要试验试剂
MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0、RT-PCR试剂盒、pMD18-T Vector、DNA凝胶回收试剂盒、DL1000 Maker均购自宝生物工程(大连)有限公司;胎牛血清、DMEM培养基购自美国GIBCO公司;FITC标记的BVDV荧光抗体采购自美国VMRD公司。
1.3 引物
用于扩增BVDV 5′-UTR与Npro的引物参考张康等[16-17]合成的引物,引物的详细资料见表1。
表1 扩增BVDV 5′-UTR与Npro的引物
Tab.1 Primers for amplifying BVDV 5′-UTR and Npro
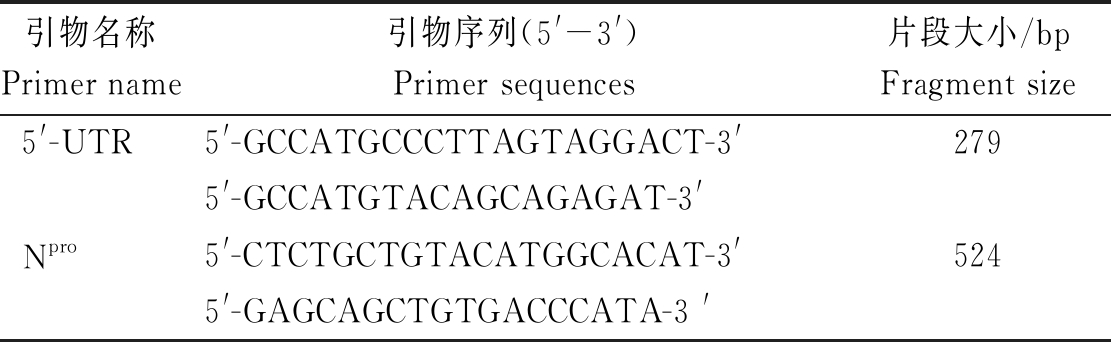
引物名称Primer name引物序列(5'-3')Primer sequences片段大小/bpFragment size5'-UTR5'-GCCATGCCCTTAGTAGGACT-3' 2795'-GCCATGTACAGCAGAGAT-3'Npro 5'-CTCTGCTGTACATGGCACAT-3'524 5'-GAGCAGCTGTGACCCATA-3 '
1.4 处理和鉴定病料样品
在牛粪便样品中加入适量的PBS缓冲液,充分溶解悬浮后,迅速离心收集上清液。根据病毒RNA提取试剂盒的指示,从上清液中提取RNA,然后进行RT-PCR扩增病毒5′-UTR,扩增产物经1.0 %琼脂糖凝胶电泳检测后送生工生物工程(上海)股份有限公司测序,从而确定BVDV阳性的样品。
1.5 病毒分离培养
在鉴定为BVDV阳性的粪便样品中加入适量的PBS缓冲液,经充分溶解悬浮后,低速离心收集上清液,上清液经0.22 μm滤膜过滤除菌后,接种于已长成单层的MDBK细胞,37 ℃吸附2 h后补加含2%胎牛血清的DMEM维持液于37 ℃、5% CO2条件下培养3 d,每天观察细胞病变情况。同时设立阴性对照组,即不接种粪便样品处理液的MDBK细胞。连续盲传至12代,提取病毒RNA,用RT-PCR技术扩增BVDV 5′-UTR和Npro片段。RT-PCR产物经1.0 %琼脂糖凝胶电泳检测及胶回收后克隆至pMD18-T载体,将鉴定为阳性的重组质粒送至生工生物工程(上海)股份有限公司测序。
1.6 免疫荧光检测
将盲传12代的病毒接种于长满单层MDBK细胞的24孔板中,不接种病毒的正常细胞为阴性对照,接种NADL毒株的孔为阳性对照。将24孔板置于37 ℃、5% CO2 培养箱中培养12 h后,弃营养液,PBS洗涤3次后,用4%多聚甲醛固定细胞;PBS洗涤3次后,根据BVDV的FITC法结合荧光抗体染色法,分别对试验组和对照组细胞进行染色;PBS洗涤3次后,用DAPI染色细胞核;PBS洗涤3次后,将24孔板置荧光显微镜下观察细胞染色情况。
1.7 TCID50测定
将第12代细胞培养物上清用不含血清的DMEM营养液进行10倍系列稀释,在长满单层MDBK细胞的96孔板中,以100 μL/孔接种各稀释度的样品,每个稀释度接种8孔,同时设立未接种BVDV的正常MDBK细胞作为阴性对照,置于37 ℃、5% CO2 条件下培养。12 h后,按照BVDV的FITC结合荧光抗体说明方法对所有MDBK细胞染色,并记录每孔荧光反应结果及其稀释度,根据Karber公式计算分离病毒的TCID50。
1.8 遗传进化分析
用DNAStar软件对第12代BVDV分离株的5′-UTR和Npro核苷酸序列与GenBank中已公布的BVDV各亚型的参考毒株和瘟病毒参考毒株进行比对分析,并在MEGA 7.0软件中采用邻接法绘制系统进化树。
2 结果与分析
2.1 分离株的培养特性和RT-PCR检测结果
将RT-PCR和序列分析检测为BVDV阳性的粪便样品经处理后在MDBK细胞上连续盲传至12代产生典型的细胞病变(图1),表明分离到的病毒株可能为导致细胞病变的CP型BVDV病毒株。将第12代细胞培养物收集后提取RNA,进行5′-UTR和Npro基因的RT-PCR扩增,扩增产物进行凝胶电泳检测,结果表明,分离培养物与BVDV NADL株均能在279(5′-UTR),524 bp(Npro)处分别出现特异性条带,且与预期大小一致(图2),而阴性对照无任何条带。将扩增片段的测序结果在GenBank上进行Blast比对分析,结果表明,该分离株为 BVDV,将其命名为BVDV-GSLY株。
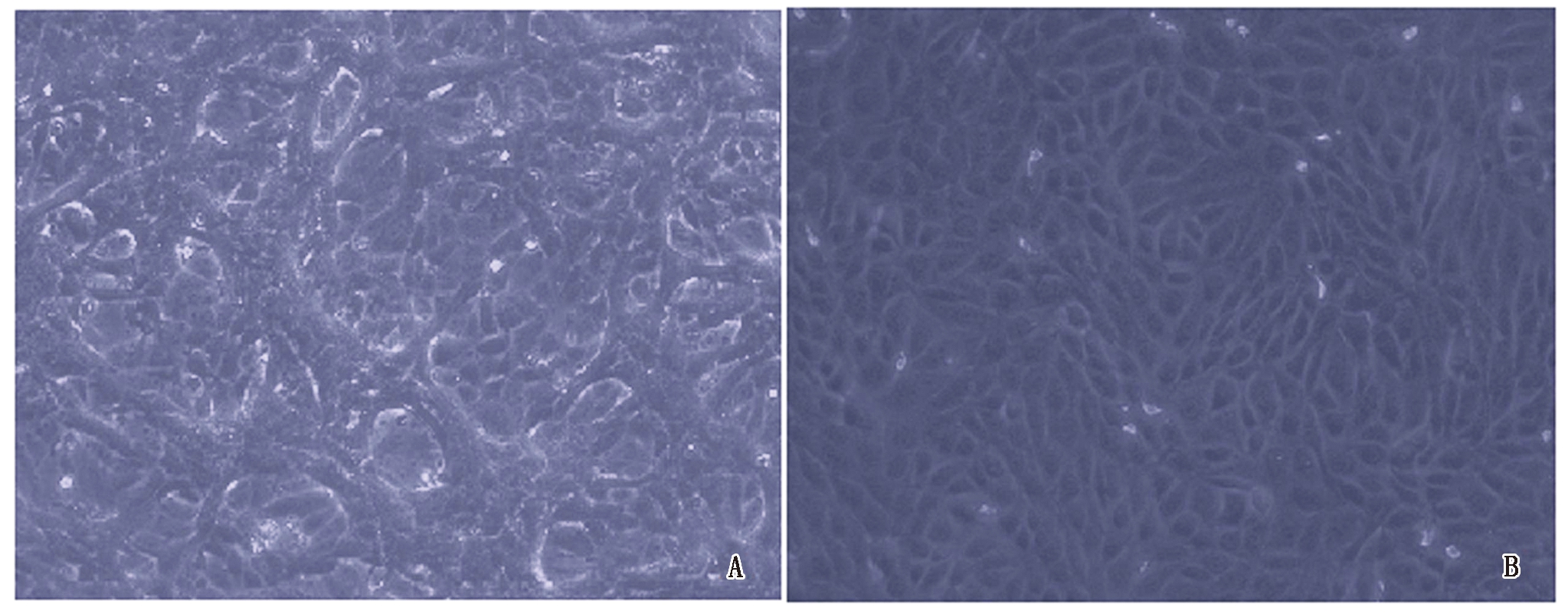
A.BVDV F12在MDBK细胞上产生细胞病变;B.MDBK健康细胞对照。
A.The cytopathic effect of BVDV F12 on MDBK cells;B.Normal MDBK control.
图1 BVDV感染MDBK细胞产生细胞病变(200×)
Fig.1 The cytopathic effect of BVDV on MDBK cells(200×)
2.2 分离病毒的免疫荧光试验鉴定与TCID50测定
将从病料样品中获得的BVDV-GSLY株和BVDV NADL株病毒液分别接种于MDBK细胞,培养12 h后,利用FITC结合荧光抗体对MDBK细胞进行染色,并置于荧光显微镜下观察。结果显示:未接种BVDV的正常MDBK细胞中没有荧光产生(图3-A),而BVDV NADL株(图3-B)和 BVDV-GSLY株(图3-C)感染的细胞胞浆中均可见特异性绿色荧光,表明该分离物是BVDV。用该方法检测病毒滴度,结果表明,BVDV-GSLY分离株的第12代细胞培养上清中病毒滴度可达107.8 TCID50/0.1 mL。
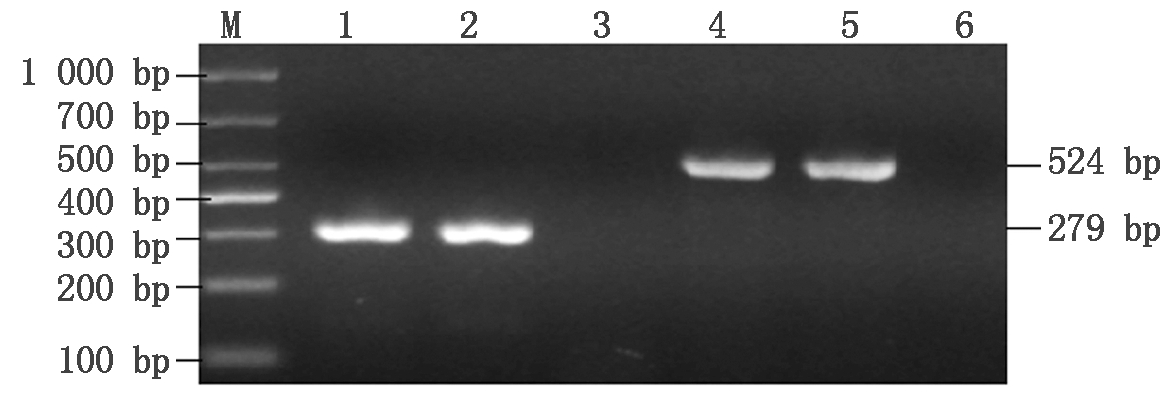
M.DL1000 Maker;1.BVDV-GSLY株5′-UTR扩增产物;2.NADL株5′-UTR扩增产物;3.阴性对照5′-UTR扩增产物;4.BVDV-GSLY株Npro扩增产物;5.NADL株Npro扩增产物;6.阴性对照Npro扩增产物。
M.DL1000 Maker;1.RT-PCR product of BVDV-GSLY 5′-UTR;2.RT-PCR product of NADL 5′-UTR;3.RT-PCR product of 5′-UTR gene of negative control;4.RT-PCR product of BVDV-GSLY Npro;5.RT-PCR product of NADL Npro;6.RT-PCR product of Npro gene of negative control.
图2 BVDV-GSLY株5′-UTR和Npro RT-PCR扩增结果
Fig.2 RT-PCR amplification of 5′-UTR and Npro of BVDV-GSLY strain
2.3 分离病毒的遗传进化分析
利用DNAStar软件中的MegAlign对BVDV-GSLY株5′-UTR核苷酸序列与GenBank中已公布的BVDV各亚型参考毒株及瘟病毒属的参考毒株进行核苷酸同源性分析,并用MEGA 7.0对BVDV-GSLY株5′-UTR基因序列与参考毒株序列绘制系统发生树。结果表明,BVDV-GSLY株的5′-UTR与HLJ-10(BVDV-2)、Italy-1/10-1(BVDV-3)、X818(BDV)、CSFV-BR-DAR-039/2009(CSFV)5′-UTR核苷酸序列相似性较低,分别为77.9%,74.2%,73.8%,75.0%,与NADL(BVDV-1)的5′-UTR核苷酸序列同源性较高,为95.4%。系统发生树结果也表明,分离株BVDV-GSLY与BVDV-2、BVDV-3、BDV和CSFV均不在同一进化分支上,亲缘关系较远,但与BVDV-1的9株参考毒株的亲缘关系较近,且与BVDV-1亚型的NADL株处于同一进化分支上(图4-A)。因此,BVDV-GSLY株为BVDV-1型。

A.阴性对照;B.NADL株;C.BVDV-GSLY株。
A.Negative control;B.NADL strain;C.BVDV-GSLY strain.
图3 BVDV-GSLY免疫荧光鉴定(200×)
Fig.3 Immunofluorescence of BVDV-GSLY in MDBK cells(200×)
为进一步确定BVDV-GSLY株的亚型,将BVDV-GSLY株的5′-UTR和Npro序列与GenBank 中各型BVDV参考毒株相应序列进行遗传进化分析,结果表明,BVDV-GSLY株5′-UTR与Npro核苷酸序列的遗传进化关系基本相同,BVDV-GSLY株与美国的SD1株位于同一分支,亲缘关系最近(图4-B、C)。5′-UTR和Npro核苷酸序列同源性分析也表明,BVDV-GSLY株与SD1株5′-UTR和Npro核苷酸序列相似性较高(分别为95.5%,91.5%),与其他亚型病毒株的核苷酸序列相似性较低(分别为84.27%~93.0%,73.3%~82.1%),表明BVDV-GSLY株属于BVDV-1a亚型。
3 讨论
牛病毒性腹泻(BVD)是严重危害世界养牛业的重要疾病之一,世界动物卫生组织(OIE)将其列为法定报告的动物疫病,我国也将其列为三类动物疫病[18]。1980年,我国首次分离到该病毒。近年来,流行病学调查表明我国大部分地区都有BVDV感染的报道,且牛、猪、鹿、羚羊等均不同程度的感染BVDV,该病已成为严重影响我国畜牧业健康发展的重要疫病之一[19]。本研究通过对甘肃某牛场中牛粪便样品进行检测,对RT-PCR鉴定为BVDV阳性的样本进行细胞接种、RT-PCR检测和免疫荧光试验,成功分离到1株BVDV(命名为BVDV-GSYL),该毒株在MDBK细胞上连传12代,可产生明显的CPE,证明BVDV-GSYL株为CP型。


A.BVDV 5′-UTR 基因的系统进化树;B.BVDV-1型5′-UTR 基因的系统进化树;C.BVDV-1型Npro基因的系统进化树。
A.The phylogenetic tree based on 5′-UTR of BVDV strains;B.The phylogenetic tree based on 5′-UTR of BVDV-1 strains;C.The phylogenetic tree based on Npro of BVDV-1 strains.
图4 BVDV-GSLY与参考毒株的遗传进化关系
Fig.4 Phylogenetic analysis of BVDV-GSLY and reference strains
由于BVDV 5′ UTR在BVDV基因组中相对保守,因此,常用该基因对BVDV进行分型。此外,在BVDV基因组中,具有较高的保守性的Npro基也可用于基因分型[20]。本研究用BVDV 5′ UTR基因和Npro基因的特异性引物经RT-PCR扩增BVDV-GSYL株的5′ UTR基因和Npro基因,其扩增产物分别为279,(5′-UTR),524 bp(Npro),与预期大小一致。分别将BVDV-GSYL株的5′ UTR基因序列和Npro基因序列与GenBank中已公布的参考毒株的对应序列进行比较,绘制系统进化树,分析表明,BVDV-GSYL株与美国的SD1株同源关系最近(5′-UTR和Npro核苷酸序列同源性分别为95.5%,91.5%),系统进化树也显示分离毒株BVDV-GSYL与SD1株位于同一分支,均属于BVDV-1a亚型。
根据以往报道,在甘肃地区肉牛中曾检测到BVDV-1u毒株,而本次研究为首次从该地区奶牛中分离得到BVDV-1a亚型毒株,且该毒株与先前研究的BVDV病毒株之间存在显著差异。随着甘肃地区荷斯坦奶牛地不断引进,与SD1株具有较高同源性的BVDV-GSLY 株可能已成为甘肃地区奶牛源致病型BVDV的主要流行株。
本研究从牛粪便样本中分离鉴定了1株BVDV-1a 型病毒,为我国甘肃地区BVDV病毒株的流行情况提供了可靠依据,对牛病毒性腹泻病的预防和诊治以及BVDV的致病机制的研究等方面奠定了参考基础。
[1] Simmonds P,Becher P,Bukh J,Gould E A,Meyers G,Monath T,Muerhoff S,Pletnev A,Rico-Hesse R,Smith D B,Stapleton J T.ICTV virus taxonomy profile:flaviviridae[J].J Gen Virol,2017,98(1):2-3.doi:10.1099/jgv.0.000672.
[2] Akagami M,Takayasu M,Ooya S,Kashima Y,Tsuzuku S,Ootani Y,Ouchi Y,Hayama Y.Screening of persistently infected cattle with Bovine viral diarrhea virus on dairy farms by using milk tanker and bulk tank milk samples for viral RNA and viral-specific antibody detection[J].J Vet Med Sci,2020,82(5):607-614.doi:10.1292/jvms.19-0634.
[3] Passler T,Walz P H. Bovine viral diarrhea virus infections in heterologous species[J].Anim Health Res Rev,2010,11(2):191-205.doi:10.1017/S1466252309990065.
[4] Lindberg A L E.Bovine viral diarrhoea virus infections and its control.A review[J].Vet Q,2003,25(1):1-16.doi:10.1080/01652176.2003.9695140.
[5] Benavides B,Casal J,Diéguez J F,Yus E,Moya S J,Armengol R,Allepuz A.Development of a quantitative risk assessment of Bovine viral diarrhea virus and bovine herpesvirus-1 introduction in dairy cattle herds to improve biosecurity[J].J Dairy Sci,2020,103(7):6454-6472.doi:10.3168/jds.2019-17827.
[6] Corapi W V,Donis R O,Dubovi E J.Monoclonal antibody analyses of cytopathic and noncytopathic viruses from Fatal bovine viral diarrhea virus infections[J].J Virol,1988,62(8):2823-2827.doi:10.1128/JVI.62.8.2823-2827.1988.
[7] de Camargo L J,Picoli T,Fischer G,de Freitas A C O,de Almeida R B,da Silva Pinto L.Antiviral activity of native banana lectin against Bovine viral diarrhea virus and Bovine alphaherpes virus type 1[J].Int J Biol Macromol,2020,157:569-576.doi:10.1016/j.ijbiomac.2020.04.125.
[8] Ridpath J F,Bolin S R.Differentiation of types 1a,1b and 2 Bovine viral diarrhea virus (BVDV)by PCR[J].Mol Cell Probes,1998,12(2):101-106.doi:10.1006/mcpr.1998.0158.
[9] Kuca T,Passler T,Newcomer B W,Neill J D,Galik P K,Riddell K P,Zhang Y J,Bayles D O,Walz P H.Changes introduced in the open reading frame of Bovine viral diarrhea virus during serial infection of pregnant swine[J]. Front Microbiol,2020,11:1138.doi:10.3389/fmicb.2020.01138.
[10] Ye ilba
ilba![]() K,Förster C,Ozyi
K,Förster C,Ozyi![]() it M O,Alpay G,Tuncer P,Thiel H J,König M.Characterisation of Bovine viral diarrhoea virus(BVDV)isolates from an outbreak with haemorrhagic enteritis and severe pneumonia[J].Vet Microbiol,2014,169(1-2):42-49.doi:10.1016/j.vetmic.2013.12.005.
it M O,Alpay G,Tuncer P,Thiel H J,König M.Characterisation of Bovine viral diarrhoea virus(BVDV)isolates from an outbreak with haemorrhagic enteritis and severe pneumonia[J].Vet Microbiol,2014,169(1-2):42-49.doi:10.1016/j.vetmic.2013.12.005.
[11] Bauermann F V,Flores E F,Ridpath J F.Antigenic relationships between Bovine viral diarrhea virus 1 and 2 and HoBi virus:possible impacts on diagnosis and control[J].J Vet Diagn Invest,2012,24(2):253-261.doi:10.1177/1040638711435144.
[12] Gao S D,Luo J H,Du J Z,Lang Y F,Cong G Z,Shao J J,Lin T,Zhao F R,Bel k S,Liu L H,Chang H Y,Yin H.Serological and molecular evidence for natural infection of Bactrian camels with multiple subgenotypes of Bovine viral diarrhea virus in Western China[J]. Vet Microbiol,2013,163(1-2):172-176.doi:10.1016/j.vetmic.2012.12.015.
k S,Liu L H,Chang H Y,Yin H.Serological and molecular evidence for natural infection of Bactrian camels with multiple subgenotypes of Bovine viral diarrhea virus in Western China[J]. Vet Microbiol,2013,163(1-2):172-176.doi:10.1016/j.vetmic.2012.12.015.
[13] Gong X W,Cao X A,Zheng F Y,Chen Q W,Zhou J Z,Yin H,Liu L H,Cai X P.Identification and characterization of a novel subgenotype of Bovine viral diarrhea virus isolated from dairy cattle in Northwestern China[J].Virus Genes,2013,46(2):375-376.doi:10.1007/s11262-012-0861-3.
[14] Zhu L Q,Lin Y Q,Ding X Y,Ren M,Tao J,Wang J Y,Zhang G P,Zhu G Q.Genomic sequencing and characterization of a Chinese isolate of Bovine viral diarrhea virus 2[J].Acta Virol,2009,53(3):197-202.doi:10.4149/av_2009_03_197.
[15] Pinior B,Firth C L,Richter V,Lebl K,Trauffler M,Dzieciol M,Hutter S E,Burgstaller J,Obritzhauser W,Winter P,Käsbohrer A.A systematic review of financial and economic assessments of Bovine viral diarrhea virus(BVDV)prevention and mitigation activities worldwide[J].Prev Vet Med,2017,137(Pt A):77-92.doi:10.1016/j.prevetmed.2016.12.014.
[16] 张康,王丹阳,王旭荣,张凯,张景艳,王磊,李建喜.牛病毒性腹泻病毒RT-PCR方法的建立[J].中国奶牛,2018,342(10):32-35.doi:10.19305/j.cnki.11-3009/s.2018.10.008.
Zhang K,Wang D Y,Wang X R,Zhang K,Zhang J Y,Wang L,Li J X.Development of RT-PCR assay for rapidly detecting of Bovine viral diarrhea virus[J].China Dairy Cattle,2018,342(10):32-35.
[17] 张淑琴,郭利,冷雪,张亭亭,吴永旺,武华.牛病毒性腹泻病毒BVDV-JL株的分离与鉴定[J].中国预防兽医学报,2011,33(3):181-184.doi:10.3969/j.issn.1008-0589.2011.03.04.
Zhang S Q,Guo L,Leng X,Zhang T T,Wu Y W,Wu H.Isolation and identification of a noncytopathogenic Bovine viral diarrhea virus JL isolate[J].Chinese Journal of Preventive Veterinary Medicine,2011,33(3):181-184.
[18] 常秋燕,郭富城,冶昡青,李凌浩,王悦萦,刘萍,苏强,马鹏,李林杰,金丽,马晓霞,冯玉萍.牛病毒性腹泻病毒Npro蛋白的原核表达及裂解效率[J].江苏农业学报,2019,35(5):1161-1166.doi:10.3969/j.issn.1000-4440.2019.05.023.
Chang Q Y,Guo F C,Ye X Q,Li L H,Wang Y Y,Liu P,Su Q,Ma P,Li L J,Jin L,Ma X X,Feng Y P.Prokaryotic expression and splitting decomposition rate of Npro protein of Bovine viral diarrhea virus[J].Jiangsu J of Agr Sci,2019,35(5):1161-1166.
[19] 刘存,邓永,梁琳,李金祥,张彦明,崔尚金.牛病毒性腹泻病毒链特异性SYBR Green荧光定量PCR方法的建立及应用[J].畜牧兽医学报,2019,50(10):2079-2087.doi:10.11843/j.issn.0366-6964.2019.10.014.
Liu C,Deng Y,Liang L,Li J X,Zhang Y M,Cui S J.Establishment and application of strand specific SYBR green real time PCR for detection of Bovine viral diarrhea virus[J].Acta Veterinaria et Zootechnica Sinica,2019,50(10):2079-2087.
[20] Baccili C C,Martin C C,Decaris N,Madureira K M,Chase C,Gomes V.Effects of 3 different commercial vaccines formulations against BVDV and BHV-1 on the inflammatory response of holstein heifers[J].Vet Sci,2019,6(3):69.doi:10.3390/vetsci6030069.