姬松茸(Agaricus blazei Murill,ABM)是一种食药两用真菌,具有提高机体免疫力、抗肿瘤生长、抗氧化等多种生物活性,这些功效均有大量文献支撑,是具有神奇功效的蘑菇[1-2]。进一步研究证明,姬松茸多糖是其发挥这些神奇功效的主要成分[3]。
通过基团修饰可以改变生物大分子的结构性状[4-6],可以提高其原本的活性,甚至可能激活之前没有表现出来的生物性状。多糖的基团修饰多是通过化学方法来进行的,常见方法包括硫酸化、烷基化、羧甲基化、磷酸化等,在此项研究之前,可以查到的姬松茸多糖的修饰方法主要是硫酸化[7-9],通过试验也确实证明了分子修饰对多糖生物活性的重要提升作用。有研究表明,磷酸化比硫酸化更能提升多糖的作用效果[10],但是姬松茸多糖的磷酸化效果还没有被验证,因此,本试验对姬松茸多糖进行磷酸化修饰,并对其修饰工艺、安全性、抑菌性进行研究,为其进一步研究奠定基础。
1 材料和方法
1.1 试验动物
昆明小鼠46只,购自天津医科大学实验动物中心,5~8周龄,体质量为(20±2)g。
1.2 菌株
大肠杆菌、沙门氏菌、链球菌、双球菌,均为猪源,由天津农学院实验室提供。
1.3 主要试剂
姬松茸多糖粗品:多糖纯度为58.63%,磷酸根含量为4.85%(磷酸根接枝量是通过磷酸根含量减去多糖自身的磷酸根含量计算得到),购买自康舟真菌多糖(上海)有限公司;三偏磷酸钠(简写STMP)、三聚磷酸钠(简写STPP)、三羟甲基氨基甲烷、VC、钼酸铵,均购买自Sigma-Aldrich(上海)贸易有限公司;透析袋:型号为D36mm,截流范围为8 000~14 000,采购自鼎国昌盛生物技术(北京)责任有限公司;大孔树脂D315,购买自一基实业(上海)有限公司;琼脂粉、酵母粉、胰蛋白胨,均购买自高科园海博生物技术(青岛)有限公司。
1.4 主要仪器
冷冻干燥机(仪器型号为Cool safe 100-9 Pro),购买自帝博思生物科技(上海)有限公司;冷冻离心机(仪器型号为TGL-20M),购买自重逢科学仪器(上海)有限公司;紫外分光光度计(仪器型号为UV-1100),购买自美谱达仪器(上海)有限公司;电导率仪(仪器型号为DDS-307A),购买自盛邦科学仪器(天津)有限公司;培养箱(仪器型号为2500),购买自澳华仪器(常州)有限公司。
1.5 姬松茸多糖进行磷酸化的制备工艺研究[10-11]
三偏磷酸钠和三聚磷酸钠根据不同比例配比,作为磷酸化选用试剂。姬松茸多糖进行纯化,然后配成4%比例的水溶液,取10 mL水溶液并加入磷酸化试剂和浓度为5%的硫酸钠,超声溶解后调节溶液pH值和温度,进行反应。待磷酸化反应结束,加入3倍量的95%的乙醇进行醇沉24 h,然后离心10 min,离心条件为4 ℃,3 000 r/min,离心后将得到的沉淀物进行烘干,烘干后60 ℃水浴中进行复溶。接下来放入D36 mm透析袋中透析,透析过程中监测溶液电导率的变动,电导率降至160 μs/cm后停止。透析液冷冻干燥后,即可得到磷酸化的姬松茸多糖。本试验采用单因素,即物料比、反应温度、磷酸化试剂配比、反应时间和pH值,研究单因素的最佳条件;进而利用正交试验,研究最佳工艺,所有试验设3次重复。检测过程中,多糖的含量选用苯酚硫酸法,磷酸根的含量选用钼蓝比色法。
1.6 磷酸化后的姬松茸多糖的急性毒性试验
将小鼠适应性饲养3 d后,选取40只随机分为4组,3个试验组和1个对照组,雌雄各半。小鼠禁食不禁水16 h,一次性腹腔注射,注射体积为30 mL/kg,试验组磷酸化姬松茸多糖剂量为:5,10,15 g/kg,对照组为生理盐水。经查,皮下注射的给药安全量为给药剂量超过5 g/kg,即可证明无毒。注射后10 d正常饲养并观察临床症状,最后扑杀。 数据分析采用SPSS 19.0,数据以“平均值±标准误”表示。测定内容及方法如下:
临床症状:记录试验组和对照组小鼠在10 d内的临床症状和死亡状况。
体质量及脏器指数:10 d后对所有小鼠进行扑杀,并进行尸检,肉眼观察脏器是否异常;每只小鼠称质量,并解剖,称质量其心、脾、肝、肾、肺、胃、小肠、卵巢/睾丸,分别计算小鼠脏器指数。
血液的生化指标:对小鼠眼球采血,利用自动生化仪,测定血清指标的AST、ALT、Crea。
组织学检查:将小鼠的心、脾、肝、肾、肺、胃、小肠、卵巢/睾丸制成组织切片,通过切片观察有无病变。
1.7 抑菌试验
将猪源链球菌、大肠杆菌、猪源双球菌、沙门氏菌分别在LB固体培养基上划线,并于37 ℃培养箱中培养24 h,4个菌株挑取单菌落接种于LB液体培养基中进行活化,37 ℃培养24 h,平板涂布计数,操作过程均采用无菌操作。抑菌效果通过牛津杯法药敏试验和MIC法最小抑菌浓度试验进行判定。
牛津杯法药敏试验:将磷酸化姬松茸多糖和姬松茸多糖作为2个试验组进行对比,2种多糖分别配置成不同浓度水溶液,浓度梯度为:0.3,0.15,0.075,0.037 5,0.018 75,0.009 375,0.004 687 5 g/mL,以及空白对照,空白对照为同体积蒸馏水。在LB固体培养基上涂布200 μL菌液,然后在涂布好菌液的每个培养皿中放置3个牛津杯,吸取前面配制好的多糖溶液,按照每个牛津杯150 μL的量加入到牛津杯中,各浓度设置3次重复。然后平皿正立着放入37 ℃生化培养箱中,培养24 h后测量多糖对病菌的抑菌圈直径。
MIC法测最小抑菌浓度:将磷酸化姬松茸多糖和姬松茸多糖作为2个试验组进行对比,每组使用10支试管,分别用LB培养基将多糖稀释至0.4,0.3,0.2,0.15,0.1,0.075,0.05,0.037 5 g/mL,第9支试管作为阴性对照组,只加多糖不加菌液,第10支试管作为阳性对照,只加菌液不加多糖,10支试管中分别加入上述液体2 mL。把菌悬液加水稀释,浓度为105 cfu/cm,在已经添加了2 mL液体的10支试管中分别加入100 μL菌悬液,在37 ℃摇床中振荡培养24 h。培养后分别从每支试管中取200 μL在LB固体培养基上进行涂布,37 ℃恒温生化培养箱中培养24 h,挑选平板上菌落清楚,能够进行计数的平皿进行计数,计算多糖对病菌的最小抑菌浓度。最小抑菌浓度(简写MIC),为平板菌落数大于等于10,小于等于20的多糖最小稀释浓度。
2 结果与分析
2.1 制备工艺的研究结果
以下分别为5个单因素试验以及正交试验的结果与分析。
物料比对磷酸化修饰的影响:控制单一变量,变量为物料比,即多糖质量比磷酸化试剂质量的比值,不同物料比的结果见图1所示,随着物料比的比值减小,磷酸根含量呈先增大后减小的趋势,当物料比为1∶3时达到最大值。
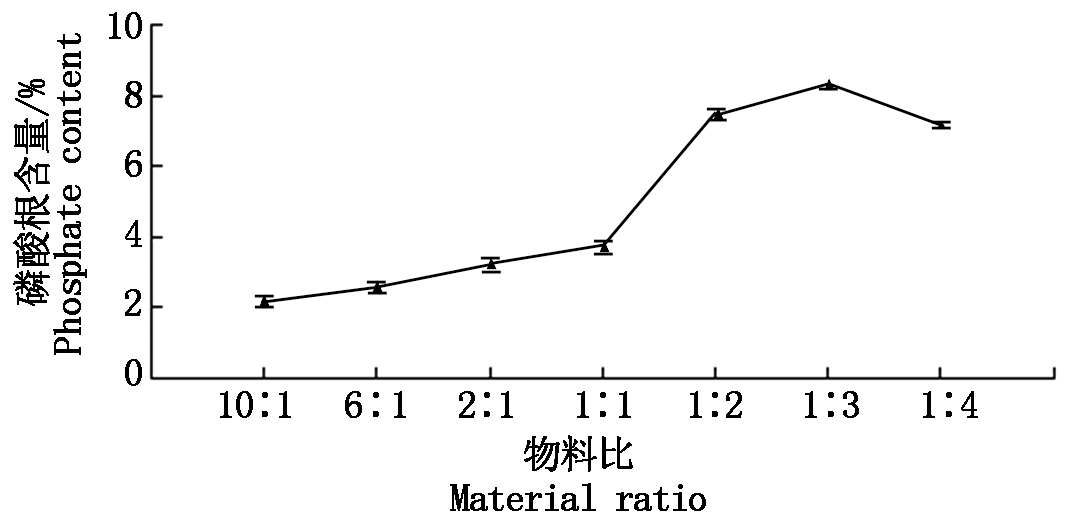
图1 不同的物料比对应的磷酸根含量
Fig.1 Phosphate content of different material ratio
磷酸化试剂配比对磷酸化修饰的影响:控制单一变量,变量为磷酸化试剂配比,即STPP与STMP的比值,不同磷酸化试剂配比的结果见图2所示,随着磷酸化试剂配比的增大,磷酸根含量没有固定的变化趋势,当磷酸化试剂配比为6∶1时达最大值,其次为5∶2。
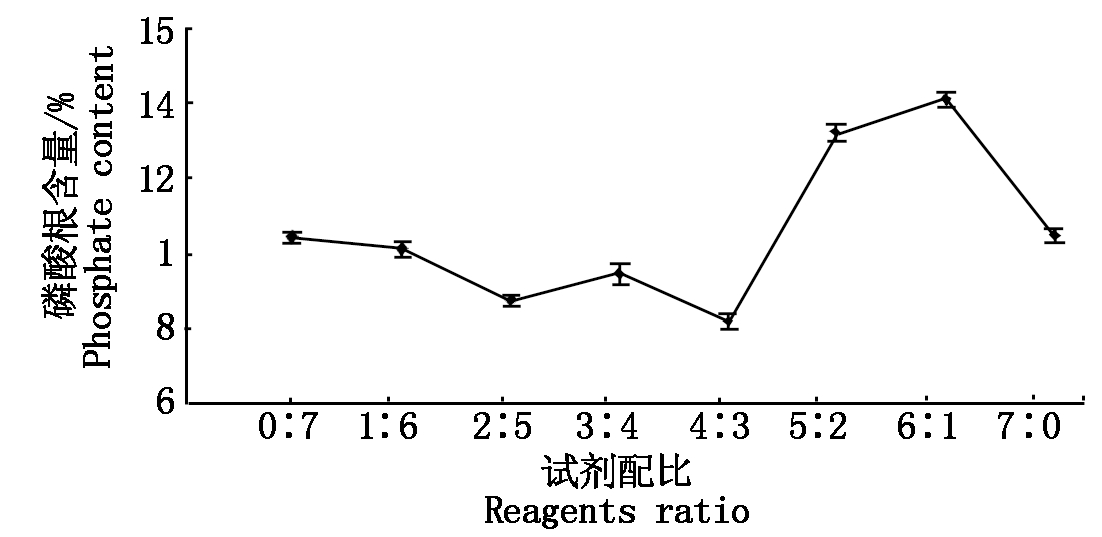
图2 不同的试剂配比对应的磷酸根含量
Fig.2 Phosphate content of different reagents ratio
反应温度对磷酸化修饰的影响:控制单一变量,变量为反应温度,不同光反应温度下的结果见图3,反应温度在30~100 ℃,随着反应温度的增加,磷酸根含量呈先增大后减小的趋势,当温度为90 ℃时达到最大值。
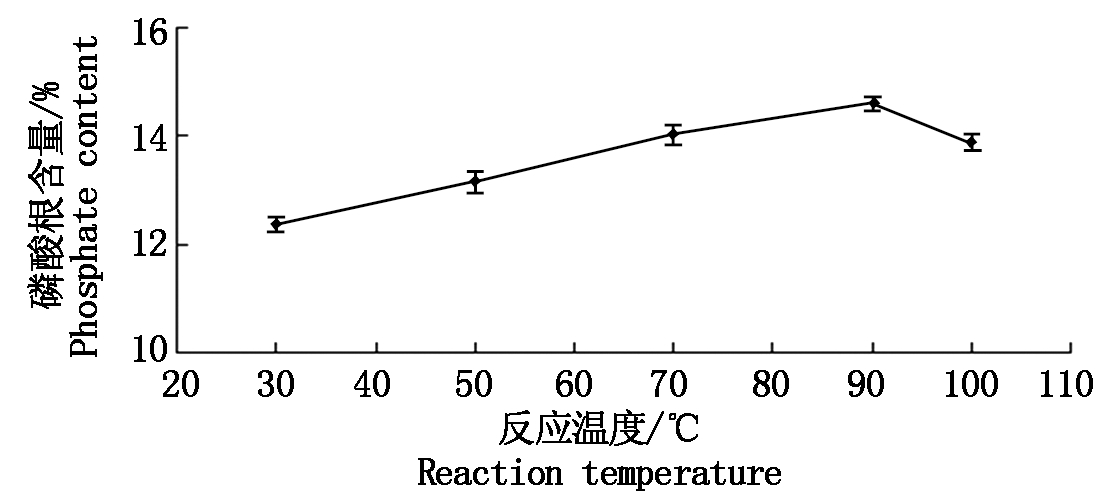
图3 不同的反应温度所对应的磷酸根含量
Fig.3 The content of phosphate in different reaction temperature
反应时间对磷酸化修饰的影响:控制单一变量,变量为反应时间,不同光反应时间下的结果见图4,反应时间在3~7 h,随着反应时间的增加,磷酸根含量呈先增大后减小的趋势,当反应时间为6 h时达到最大值。
pH值对磷酸化修饰的影响:控制单一变量,变量为反应的pH值,不同pH值下的结果见图5,pH值为6~10时随着pH值的增加,磷酸根含量呈先增大后减小的趋势,当pH值为9时达到最大值。由结构可知,过酸的试验条件不适宜姬松茸多糖磷酸化反应的进行。
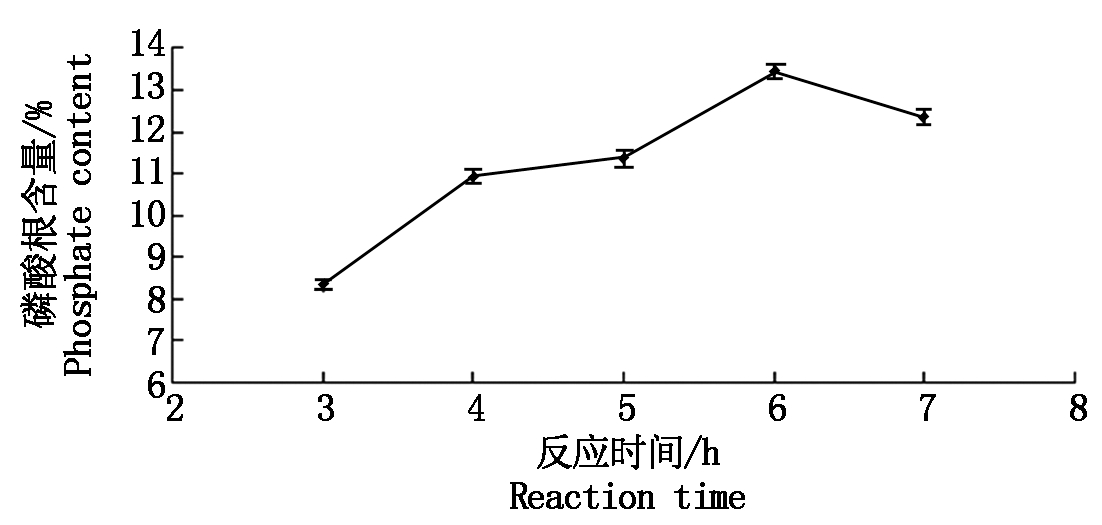
图4 不同的反应时间对应的磷酸根含量
Fig.4 The content of phosphate in different reaction time
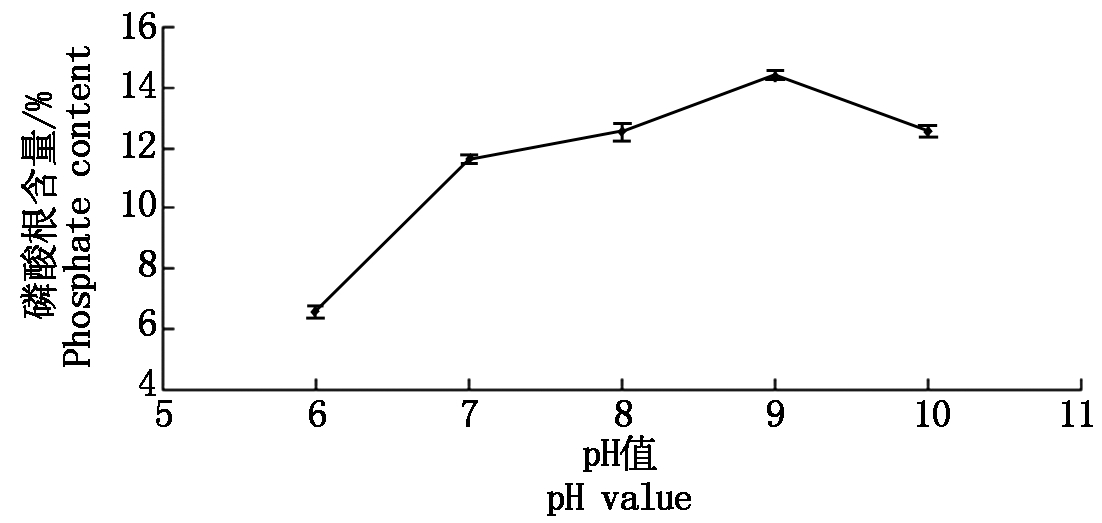
图5 不同的pH值对应的磷酸根含量
Fig.5 The phosphate content of different pH
正交设计结果:物料比对磷酸化试剂的添加量影响最大,因此,本试验将物料比1∶3作为固定条件,设计的正交试验为四因素三水平试验,设置3次平行试验。表1,2为各因素的选取水平及正交试验结果,极差分析得出磷酸化试剂配比对磷酸根含量影响较大,温度和pH值对多糖含量影响较大。结合正交试验结果和极差分析结果,确定最佳反应条件为:磷酸化反应试剂的配比是6∶1,磷酸化反应温度是95 ℃,磷酸化反应时间是5.5 h,磷酸化反应pH值是9。在此条件下,进行试验结果的验证,得到多糖含量为74.28%,磷酸根含量为13.99%,磷酸根接枝量9.14%,符合预计效果。
表1 正交试验设计
Tab.1 Design of orthogonal experiment

分组Group反应时间/h(A)Reaction time (A)反应温度/℃(B)Reaction temperature(B)磷酸化试剂配比(C)Proportion ofphosphorylation reagent(C)pH(D)15.5805∶2826.0906∶1936.5957∶010
表2 正交试验结果(n=3)
Tab.2 Results of orthogonal test(n=3)
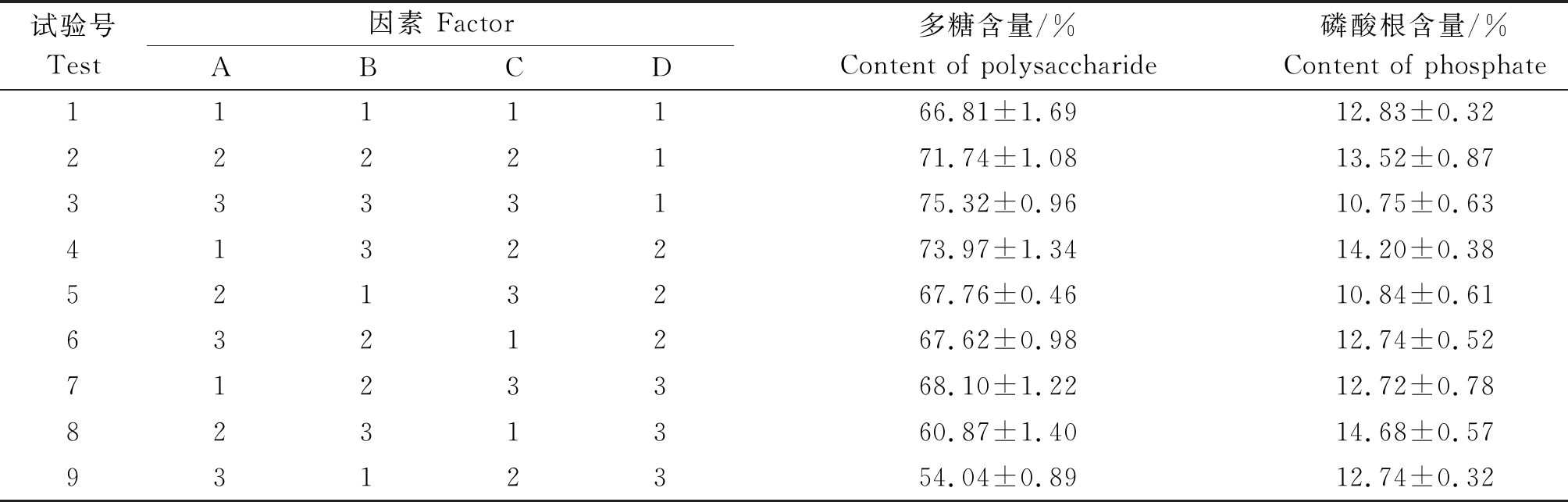
试验号Test因素 FactorABCD多糖含量/%Content of polysaccharide磷酸根含量/%Content of phosphate1111166.81±1.6912.83±0.322222171.74±1.0813.52±0.873333175.32±0.9610.75±0.634132273.97±1.3414.20±0.385213267.76±0.4610.84±0.616321267.62±0.9812.74±0.527123368.10±1.2212.72±0.788231360.87±1.4014.68±0.579312354.04±0.8912.74±0.32
2.2 急性毒性试验结果
小鼠临床状况及剖检眼观结果:本次安全评价试验的40只小白鼠全部存活,无共济失调现象、小鼠毛色表现正常、进食状态良好、呼吸及活动正常,各方面表现均无异常。对试验组和对照组小鼠处死处理,试验组与对照组相比较,试验组小白鼠的器官组织等一切正常,肉眼未发现病理变化。
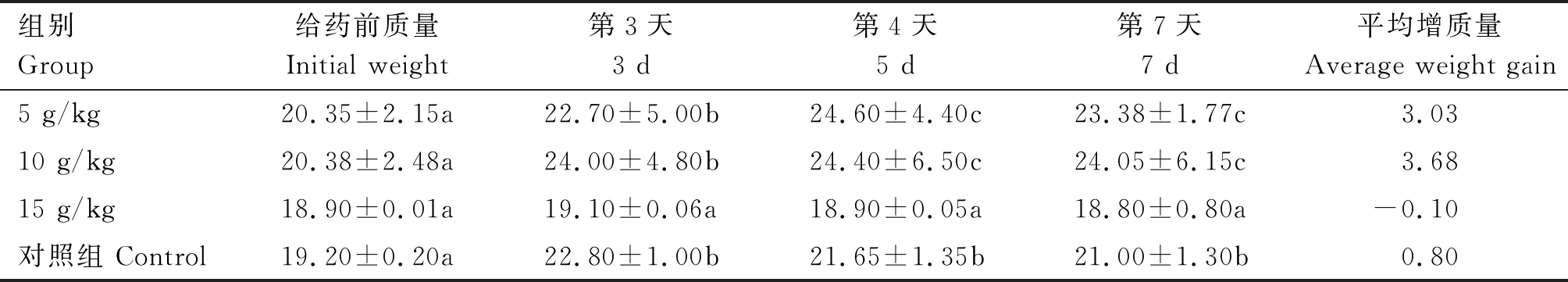
小鼠体质量及脏器指数影响结果:体质量结果见表3,体质量5,10 g/kg组较对照组有所增加,体质量15 g/kg组较对照组有所下降。脏器指数结果见表4,剖检观察试验组和对照组的脏器并无明显病变,通过脏器指数结果可以看出,腹腔注射磷酸化多糖以后的试验组,肝体比和脾体比指数均有所升高,这2个指数与小鼠集体的免疫功能关联较大,证明磷酸化多糖可以一定程度的提升小鼠的免疫系统功能。肺体比指数降低。肾体比指数中10,5 g/kg组有所提高,15 g/kg组降低。
表3 磷酸化姬松茸多糖对小鼠体质量的影响(n=40)
Tab.3 Phosphorylation of Agaricus blazei polysaccharide in mice body weight(n=40) g
注:同一列数值的字母如果相同,则代表差异不显著(P>0.05),如果不同则代表差异显著(P<0.05)。表4-5同。
Note:If the corner letters of the values in the same column are the same,the difference is not significant(P>0.05);if different,the difference is significant(P<0.05).The same as Tab.4-5.
组别Group给药前质量Initial weight第3天3 d第4天5 d第7天7 d平均增质量Average weight gain5 g/kg20.35±2.15a22.70±5.00b24.60±4.40c23.38±1.77c3.0310 g/kg20.38±2.48a24.00±4.80b24.40±6.50c24.05±6.15c3.6815 g/kg18.90±0.01a19.10±0.06a18.90±0.05a18.80±0.80a-0.10对照组 Control19.20±0.20a22.80±1.00b21.65±1.35b21.00±1.30b0.80
表4 各个组小鼠的脏器指数(n=40)
Tab.4 Organ coefficient of each group of mice(n=40)
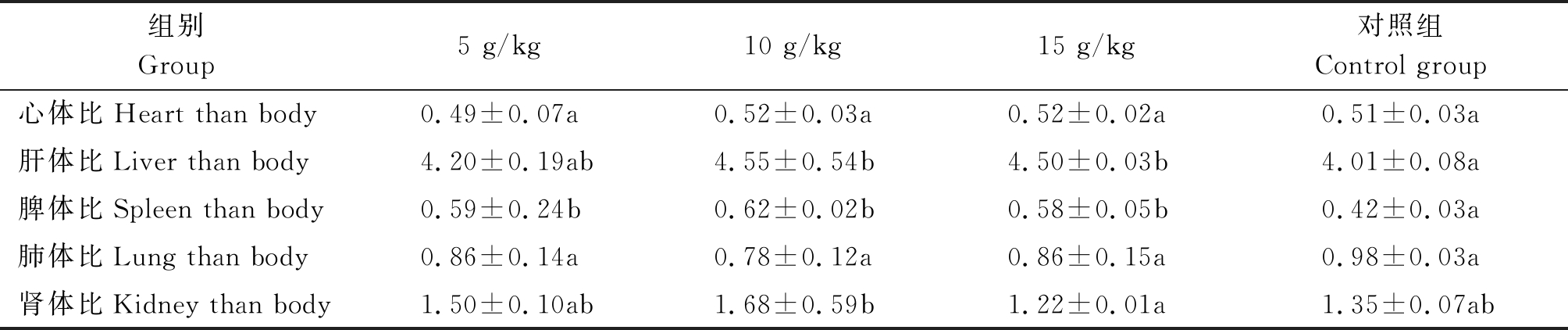
组别Group5 g/kg10 g/kg15 g/kg对照组Control group心体比Heart than body0.49±0.07a0.52±0.03a0.52±0.02a0.51±0.03a肝体比Liver than body4.20±0.19ab4.55±0.54b4.50±0.03b4.01±0.08a脾体比Spleen than body0.59±0.24b0.62±0.02b0.58±0.05b0.42±0.03a肺体比Lung than body0.86±0.14a0.78±0.12a0.86±0.15a0.98±0.03a肾体比Kidney than body1.50±0.10ab1.68±0.59b1.22±0.01a1.35±0.07ab
磷酸化姬松茸多糖对小鼠血清指标影响结果:血清指标结果见表5,给药7 d后的血液生化指标结果显示,3个试验组和对照组的CRE和ALT,其平均数值并没有显著差异,试验组的AST数值较对照组显著降低。
表5 小鼠的血清指标 (n=40)
Tab.5 Serum indexes of mice(n=40)
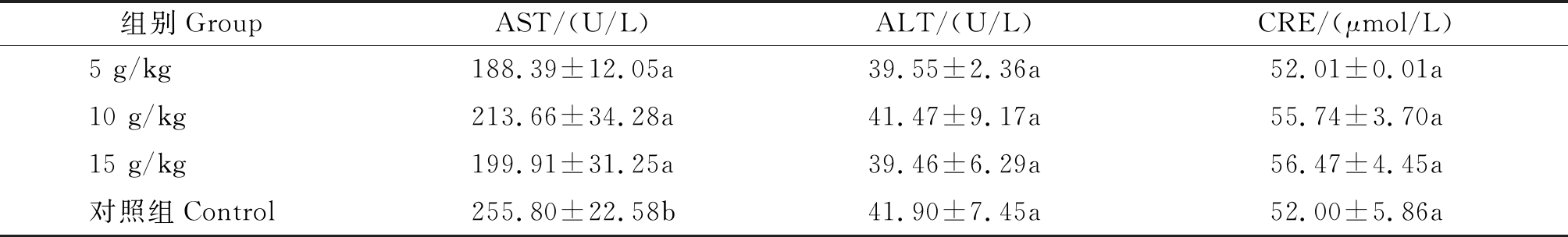
组别GroupAST/(U/L)ALT/(U/L)CRE/(μmol/L)5 g/kg188.39±12.05a39.55±2.36a52.01±0.01a10 g/kg213.66±34.28a41.47±9.17a55.74±3.70a15 g/kg199.91±31.25a39.46±6.29a56.47±4.45a对照组Control255.80±22.58b41.90±7.45a52.00±5.86a
病理组织检查结果:对试验组和对照组的各器官组织切片进行观察,均未见明显病变,没有显著差异。
2.3 抑菌试验结果
结果表明,多糖抑制病菌的试验中,经过磷酸化和未经磷酸化的姬松茸多糖均对沙门氏菌和大肠杆菌表现出良好的抑菌作用,对猪源双球菌和猪源链球菌抑菌作用均较差。两者相比,经过磷酸化修饰的多糖比未经过磷酸化修饰的多糖抑菌作用强(表6,7)。
表6 平均抑菌直径(n=3)
Tab.6 Average inhibitory diameter(n=3) mm
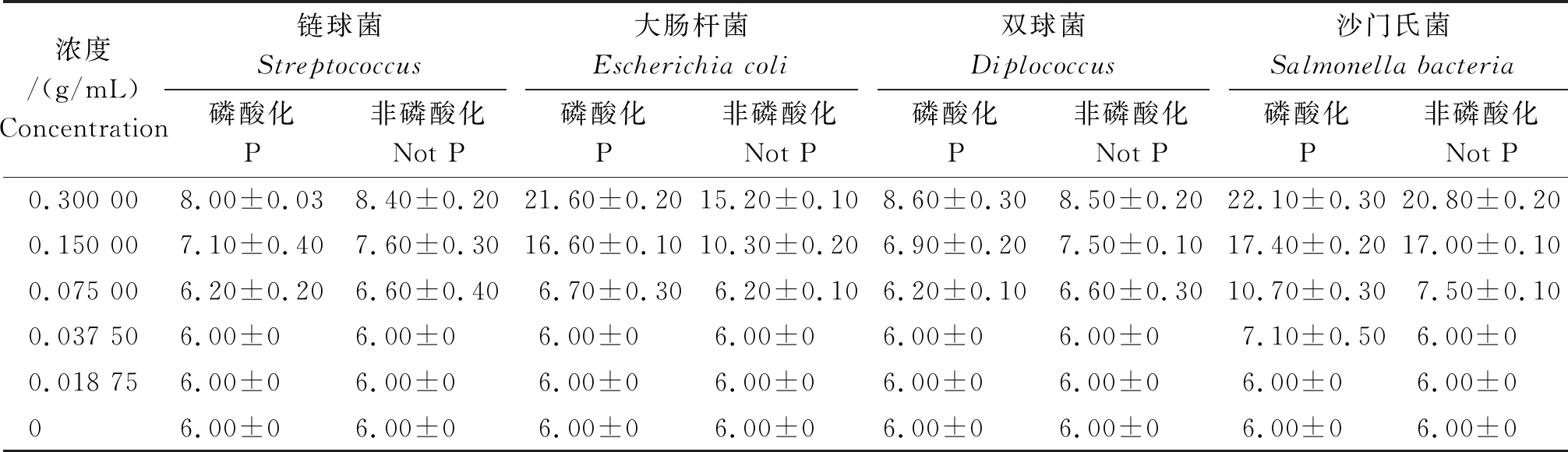
注:抑菌圈≥20 mm.高敏;10~19 mm.中敏;﹤10 mm.耐药。
Note:The bacteriostasis circle≥20 mm. High sensitivity;10-19 mm. Moderate sensitivity;<10 mm.Drug resistance.
浓度/(g/mL)Concentration链球菌Streptococcus磷酸化P非磷酸化Not P大肠杆菌Escherichia coli磷酸化P非磷酸化Not P双球菌Diplococcus磷酸化P非磷酸化Not P沙门氏菌Salmonella bacteria磷酸化P非磷酸化Not P0.300 008.00±0.038.40±0.2021.60±0.2015.20±0.108.60±0.308.50±0.2022.10±0.3020.80±0.200.150 007.10±0.407.60±0.3016.60±0.1010.30±0.206.90±0.207.50±0.1017.40±0.2017.00±0.100.075 006.20±0.206.60±0.406.70±0.306.20±0.106.20±0.106.60±0.3010.70±0.307.50±0.100.037 506.00±06.00±06.00±06.00±06.00±06.00±07.10±0.506.00±00.018 756.00±06.00±06.00±06.00±06.00±06.00±06.00±06.00±006.00±06.00±06.00±06.00±06.00±06.00±06.00±06.00±0
表7 最小抑菌浓度(n=3)
Tab.7 The minimal inhibitory concentration(n=3)
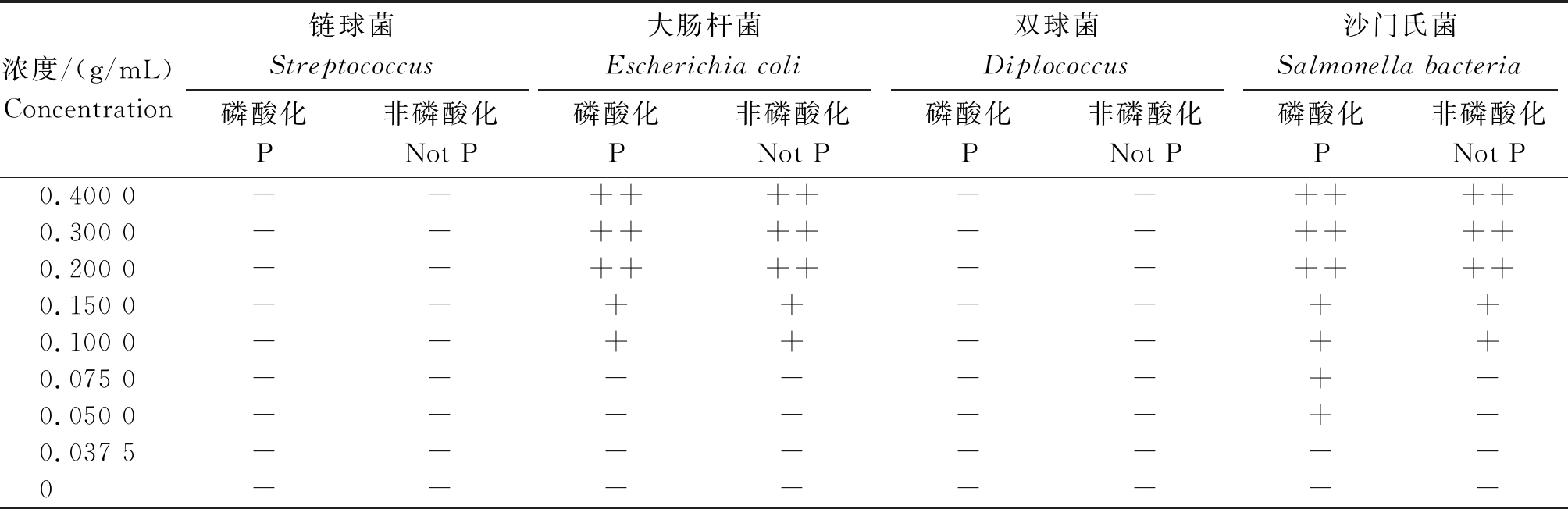
注:++.菌落数小于10;+.菌落数为10~20;-.菌落数大于20。
Note:++.The number of colonies is less than 10;+.The number of colonies is 10 to 20;-.The colony number is greater than 20.
浓度/(g/mL)Concentration链球菌Streptococcus磷酸化P非磷酸化Not P大肠杆菌Escherichia coli磷酸化P非磷酸化Not P双球菌Diplococcus磷酸化P非磷酸化Not P沙门氏菌Salmonella bacteria磷酸化P非磷酸化Not P0.400 0--++++--++++0.300 0--++++--++++0.200 0--++++--++++0.150 0--++--++0.100 0--++--++0.075 0------+-0.050 0------+-0.037 5--------0--------
3 讨论与结论
3.1 磷酸化多糖反应条件的筛选
多糖的生物活性取决于其分子性质,以姬松茸多糖的磷酸根接枝量和多糖含量作为磷酸化修饰的评价指标,磷酸根接枝量高,并且多糖含量高,代表修饰程度也较高[12-15]。本研究对姬松茸多糖进行磷酸化,方法采用三偏磷酸钠和三聚磷酸钠的配比,对反应试剂的配比、反应条件以及物料比都做了相关研究,得到一组最佳反应试验条件,此条件下,多糖含量可以达到74.28%,磷酸根含量可以达到13.99%,接枝量为9.14%。
3.2 小鼠的急性毒性试验
急毒试验进行安全评价的首要工作,为必须试验。本试验中,对小鼠的给药量分别为5,10,15 g/kg,试验小鼠身体状况及表现均正常,剖检后也没有任何病理变化,各试验组和对照组不存在显著性差异,所有小鼠均未见异常,可以证明姬松茸多糖磷酸化以后仍然安全无毒。
3.3 抑菌试验
药物残留问题是药物研发过程中很重要的考虑因素。多糖由于其无残留的特点被广泛应用于各种药物的研发[16-18],也包括抑菌药物。很多多糖都有很好的抑菌效果,发状念珠藻多糖被证明对沙门氏菌、大肠杆菌、金黄色葡萄球菌等致病菌和农用微生物枯草芽孢杆菌均有抑制效果[19]。香菇多糖也表现出相似的抑菌作用,对鼠伤寒沙门氏菌、金黄色葡萄球菌、枯草芽孢杆菌等均表现出抑制作用[20]。本研究中,对经过磷酸化修饰的姬松茸多糖和未经磷酸化修饰的姬松茸多糖两者进行对比,研究二者对本次试验中,对磷酸化前后的姬松茸多糖进行对比,测试二者对猪源链球菌、大肠杆菌、猪源双球菌、沙门氏菌的抑菌作用。结果表明,经过磷酸化和未经磷酸化的姬松茸多糖均对沙门氏菌和大肠杆菌表现出良好的抑菌作用,且经过磷酸化的姬松茸多糖的抑菌效果更好。试验说明,姬松茸多糖经过磷酸基团的修饰,提高了其本身的抑菌效果。
3.4 结论
在磷酸化姬松茸多糖的修饰反应条件研究工艺中,确定最佳反应条件为:磷酸化反应试剂的配比是6∶1,磷酸化反应温度是95 ℃,磷酸化反应时间是5.5 h,磷酸化反应pH值是9。此条件下的姬松茸多糖含量可以达到74.28%,磷酸根含量可以达到13.99%,接枝量达到9.14%。急性毒性试验中,最大剂量的磷酸化姬松茸多糖对小鼠不产生毒性,对姬松茸多糖药物的临床研发提供理论参考。多糖抑制病菌的试验中,经过磷酸化和未经磷酸化的姬松茸多糖均对沙门氏菌和大肠杆菌表现出良好的抑菌作用,在抑菌圈大小和最小抑菌浓度的数值上看,经过磷酸化的姬松茸多糖的抑菌效果更好。可见磷酸化修饰对姬松茸多糖的抑菌作用有提升作用。本试验测定了姬松茸多糖磷酸化修饰的最佳制备工艺,证明其安全性,并具有较好抑菌效果,具有进一步研究价值。
[1] 李晨光,冯翠萍,常明昌,孟俊龙,欧阳玉倩.TLR4抗体对姬松茸多糖作用巨噬细胞产生细胞因子的影响[J].营养学报,2015,37(5):490-494.doi:10.13325/j.cnki.acta.nutr.sin.2015.05.022.
Li C G,Feng C P,Chang M C,Meng J L,Ouyang Y Q.Influenoes of TLR4 antibody on Agarious blazei Murill polysaooharides effect in Raw264.7 cells[J].Journal of Nutrition,2015,37(5):490-494.
[2] 周宁.姬松茸多糖对人体健康的改善作用及机制[J].中国食用菌,2020(1):38-41.doi:10.13629/j.cnki.53-1054.2020.01.009.
Zhou N.The Effect and mechanism of Agaricus blazei polysaccharide on human health[J].Edible Fungi of China,2020(1):38-41.
[3] 王夏梅.姬松茸子实体多糖分离纯化、结构表征和免疫活性分析[D].无锡:江南大学,2016.
Wang X M.The isolation,purification,structure characterization and immunological activity analysis of polysaccharides from the fruiting bodies of Agaricus blazei Murill[D].Wuxi:Jiang Nan University,2016.
[4] 牛天增,许艳杰,李知瑾,李建伟,李明花,乔玉峰.香菇多糖结构修饰研究进展[J].中国现代应用药学,2015,32(7):895-900.doi:10.13748/j.cnki.issn1007-7693.2015.07.032.
Niu T Z,Xu Y J,Li Z J,Li J W,Li M H,Qiao Y F.Research progress on structural modification of lentinan[J]. Chinese Journal of Modern Applied Pharmacy,2015,32(7):895-900.
[5] 徐雅琴,付雪婷,王丽波,刘博,车发,杨昱.乙酰化修饰对黑穗醋栗果实多糖结构特性及活性的影响[J].精细化工,2019,36(12):2497-2475.doi:10.13550/j.jxhg.20190282.
Xu Y Q,Fu X T,Wang L B,Liu B,Ju F,Yang Y.Effects of acetylation modification on structural characteristics and bioactivities of polysaccharides from black currant[J].Fine Chemicals,2019,36(12):2497-2475.
[6] 谭西,周欣,陈华国.多糖结构修饰研究进展[J].食品工业科技,2019(4):341-349,356.doi:10.13386/j.issn1002-0306.2019.04.057.
Tan X,Zhou X,Chen H G.Research progress of polysaccharide structure modification[J].Science and Technology of Food Industry,2019(4):341-349,356.
[7] 白艳玲,尚晓娅,赵豪宾,刘欢,徐春兰,牛卫宁.分子修饰对多糖免疫活性影响的研究进展[J].食品工业科技,2014,35(20):393-397.doi:10.13386/j.issn1002-0306.2014.20.078.
Wang Y L,Shang X Y,Zhao H B,Liu H,Xu C L,Niu W N.Research progress in the effect of polysaccharIdes molecular modification on their immunological activity[J].Science and Technology of Food Industry,2014,35(20):393-397.
[8] Deng C,Fu H T,Xu J J,Shang J Y,Cheng Y M.Physiochemical and biological properties of phosphorylated polysaccharides from Dictyophora indusiata[J]. International Journal of Biological Macromolecules,2015(72):894 899.doi:10.1016/j.ijbiomac.2014.09.053.
[9] Chen F,Huang G L.Preparation and immunological activity of polysaccharides and their derivatives[J].International Journal of Biological Macromolecules,2018,112:211-216.doi:10.1016/j.ijbiomac.2018.01.169.
[10] 李益,钱慈,郭明,梁东军.香菇多糖磷酸化修饰的工艺研究[J].黑龙江大学自然科学学报,2013,30(5):664-670.doi:10.13482/j.issn1001-7011.2013.05.010.
Li Y,Qian C,Guo M,Liang D J.Optimization of lentinan phosphorylation[J].Journal of Natural Science of Heilongjiang University,2013,30(5):664-670.
[11] 张难,邱树毅,莫莉萍,王文平,吴远根.磷酸化香菇多糖的工艺优化[J].食品工业科技,2008(5):185-188.doi:10.13386/j.issn1002-0306.2008.05.007.
Zhang N,Qiu S Y,Mo L P,Wang W P,Wu Y G.Optimization of lentinan phosphorylation[J].Science and Technology of Food Industry,2008(5):185-188.
[12] Song Y,Ni Y Y,Hu X S,Li Q H.Effect of phosphorylation on antioxidant activities of pumpkin(Cucurbita pepo,Lady godiva)polysaccharide[J].International Journal of Biological Macromolecules,2015(81):41-48.doi:10.1016/j.ijbiomac.2015.07.055.
[13] Feng H B,Fan J,Yang S P,Zhao X L,Yi X.Antiviral activity of phosphorylated radix Cyathulae officinalis polysaccharide against Canine parvovirus in vitro[J].International Journal of Biological Macromolecules,2017,99:511-518.
[14] 马波,鞠家宽.硫酸酯化洋葱多糖的制备及其抗氧化活性的研究[J].中国食品添加剂,2019,30(6):73-78.
Ma B,Ju J K.Preparation and antioxidative activities of sulfated onion polysaccharides[J].China Food Additives,2019,30(6):73-78.
[15] 何淼,张宝康,粟灵琳,杜红旭,明珂,白景英,刘家国,王德云,武毅.磷酸化修饰对山豆根多糖抗Ⅰ型鸭肝炎病毒的效果的影响[J].南京农业大学学报,2020,43:1000-1010.
He M,Zhang B K,Su L L,Du H X,Ming K,Bai J Y,Liu J G,Wang D Y,Wu Y.Effect of phosphorylation on resisting Duck hepatitis virus Ⅰ effect of bush sophora root polysaccharide [J].Journal of Nanjing Agricultrual University,2020,43:1000-1010.
[16] 曲立娟,宋艳秋,张雁,钟瑞华,杨文捷,李国停,谢淑武.枸杞多糖对低雄激素不育模型大鼠影响的药效观察和作用机制研究[J].上海中医药杂志,2020(9):88-92,98.doi:10.16305/j.1007-1334.2020.1911117.
Qu L J,Song Y Q,Zhang Y,Zhong R H,Yang W J,Li G T,Xie S W.Effect of Lycium barbarum polysaccharide on hypoandrogen infertility model rats[J].Shanghai Journal of Traditional Chinese Medicine,2020(9):88-92,98.
[17] 鲁孟佳,徐越,郭抗抗,周宏超,卿素珠,张为民.硫酸化朱砂七多糖的制备及药效[J].中国兽医学报,2019,39(7):1355-1360.doi:10.16303/j.cnki.1005-4545.2019.07.20.
Lu M J,Xu Y,Guo K K,Zhou H C,Qing S Z,Zhang W M.Study on preparation and pharmacodynamics of sulfated polysaccharide from polygonum ciliinerve[J]. Chinese Journal of Veterinary Science,2019,39(7):1355-1360.
[18] 李皓月,李金霞,申力.中药多糖对肿瘤微环境的作用[J].浙江中医药大学学报,2019(9):1010-1014.doi:10.16466/j.issn1005-5509.2019.09.020.
Li H Y,Li J X,Shen L.Effect of Chinese medicine polysaccharide on tumor microenvironment[J].Journal of Zhejiang Chinese Medical University,2019(9):1010-1014.
[19] 郭金英,杜洁,李彤辉,任国艳,王萍,张玉先,李政军.发状念珠藻胞外多糖的抑菌与抗炎作用[J].食品科学,2015,36(9):190-193.doi:10.7506/spkx1002-6630-201509035.
Guo J Y,Du J,Li T H,Ren G Y,Wang P,Zhang Y X,Li Z J.Antimicrobial and antiinflammatory activities of extracellular polysaccharides from nostoc flagelliforme[J].Food Science and Technology,2015,36(9):190-193.
[20] 侯爱萍,张树梅.香菇多糖抗菌抗病毒普适性研究[J].药学研究,2015,34(4):199-201.doi:10.13506/j.cnki.jpr.2015.04.005.
Hou A P,Zhang S M.Investigation on the universality of antibiotic property of polysaccharide in lentinan[J]. Journal of Pharmaceutical Research,2015,34(4):199-201.