近年来,植物源农药由于具有高效、绿色、安全、环境友好的特点,已成为植物病害防控研究的热点。研究表明,许多植物提取物具有抑菌或抗真菌活性,石榴皮提取物联合生防酵母菌对柑桔采后腐烂有很强的抑制作用[1],葡萄藤提取物对葡萄霜霉病表现出显著的抑制作用[2],筛孔防己(Coscinium fenestratum)和蒌叶(Piper betle)提取液能完全抑制甘蓝链格孢菌(Alternaria brassicicola)菌丝的生长[3]。
研究表明,葱属植物(Allium spp.)具有抗菌活性。洋葱(A.cepa)和大蒜(A.sativum)汁和大蒜汁能显著抑制单核细胞增多性李斯特氏菌(Listeria monocytogenes)FLB6和FLB12的生长[4],大蒜多酚提取物能显著抑制对金黄葡萄球菌(Staphylococcus aureus),大肠杆菌(Escherichia coli)和铜绿假单胞菌(Pseudomonas aeruginosa)的生长[5]。洋葱鳞茎提取物能抑制镰刀菌孢子萌发和生长[6]。前期研究发现,韭菜(A.tuberosum)能显著抑制香蕉枯萎病菌(Foc4)菌丝生长,并能降低香蕉枯萎病的发病率[7]。
苹果轮纹病是苹果果实采后常见的病害之一。近年来,该病在我国主要苹果产区广泛流行。苹果轮纹病菌(Botryosphaeria berengriana f.sp.piricola)在生长期潜伏侵染苹果果实,并在贮藏期间引起腐烂,难以控制。苹果轮纹病可导致易感品种果实采收前损失50%,贮藏期间损失可高达79%[8]。前期研究发现,韭菜能显著抑制苹果轮纹病菌丝生长,并显著降低了其发病率[9]。韭菜、大蒜、洋葱和大葱(A.fistulosum)是典型的葱属植物,也是我国普遍流行的蔬菜作物。那么大蒜、洋葱、大葱等植物是否对苹果轮纹病菌生长同样具有显著的抑制作用,4种葱属植物的主要代谢物有什么异同,4种葱属植物中是否具有抑菌活性成分,针对上述问题,在本研究中,首先检测了4种葱属植物粗提物对苹果轮纹病菌的抑菌活性;然后,利用代谢组学方法,对4种葱属植物的代谢物进行了比较分析;最后,测定了4种葱属植物中5种含量最高的成分对苹果轮纹病的抑菌活性,以及对苹果果实轮纹病发生的抑制效应,以期为苹果轮纹病的防控提供有价值的参考。
1 材料和方法
1.1 试验材料
大蒜、大葱、洋葱和韭菜取自青岛农业大学胶州实验基地,植物按常规农艺措施栽培。取地下部分,即大葱的白色假茎、韭菜的根茎和大蒜、洋葱的鳞茎制备提取液并检测其对苹果轮病菌的抑制效应及代谢组分析。焦谷氨酸、磷酸、果糖、柠檬酸和葡萄糖等化学品购自成都麦卡希化工有限公司。苹果轮纹病菌前期分离于田间病果,并由青岛农业大学园艺学院果树栽培生理实验室保存。
1.2 检测4种葱属植物提取物对苹果轮纹病菌菌丝生长的抑制作用
用榨汁机将50 g准备好的植物材料粉碎,加入1 000 g水,过夜提取抗菌成分。将上清液以10 000 r/min离心10 min,然后通过0.22 μm膜滤器进行过滤灭菌,即为粗提取物原液(1 ×),4 ℃冰箱保存备用。在直径9 cm的培养皿中,加入18 mL马铃薯葡萄糖琼脂(PDA)培养基,然后分别添加2 mL不同稀释比例植物提取液(1 ×、10 ×和100 ×),混匀冷却。在PDA培养基中央接种一枚直径0.5 cm的新鲜苹果轮纹病菌菌饼,置于28 ℃,黑暗中培养。接种在不含任何植物提取物的PDA培养基上的菌饼作为对照。每种处理进行3次重复。培养3 d后测量菌斑直径以评估4种葱属提取物对苹果轮纹病菌的抑制作用。
1.3 葱属植物样品的提取和衍生化
取植物组织100 mg于5 mL管中,加入5颗钢珠,液氮冻存5 min,放入高通量组织研磨仪中,70 Hz 1 min。加入1 400 μL甲醇(-20 ℃),涡旋振荡30 s,加入60 μL的核糖醇(0.2 mg/mL)作为内标,涡旋振荡30 s。放入超声波机室温处理30 min,添加750 μL 氯仿和1 400 μL ddH2O(4 ℃),涡旋振荡1 min。14 000 r/min 4 ℃离心10 min,取上清液1 000 μL,转移到一个新的1.5 mL离心管中,样品用真空离心浓缩仪浓缩。加入60 μL甲氧基溶液涡旋振荡30 s,在37 ℃条件下反应2 h。最后加入60 μL BSTFA试剂(含1%三甲基氯硅烷),37 ℃条件下反应90 min。12 000 r/min 4 ℃离心10 min,取上清液加入到检测瓶中。从每个待测样本各取20 μL混合成QC样本。每种植物重复6次。
1.4 GC-MS检测
气相色谱仪Agilent 7890A GC/5975C MS联用仪(Agilent,USA)。 气相色谱采用HP-5MS毛细管柱(5%苯/95%甲基聚硅氧烷 30 m × 250 μm i.d.,Agilent J & W Scientific,Folsom,CA,USA),以1 mL/min的恒流氦气来分离衍生化物质。1 μL样品以分流比20∶1的方式通过自动进样器注入。注射温度为280 ℃,接口设置为150 ℃,离子源调整到230 ℃。升温程序以60 ℃为初始温度,持续2 min,以10 ℃/min,持续速率上升到300 ℃,停留5 min。质谱采用的是35~750 m/z的全扫描方法。
1.5 代谢组学数据处理
通过G1701 MSD ChemStation软件(E.02.00.493)将获得的原始数据转换成netCDF格式。利用R(v3.3.2)的XCMS程序包进行峰识别、峰过滤、峰对齐以获取质核比(m/z)和保留时间及峰面积等信息;结合AMDIS程序进行代谢物的注释,注释所用数据库为NIST商业数据库和Wiley Registry代谢组数据库。为使不同量级的数据能够进行比较,对数据进行峰面积的内标归一化。将归一化数据输入SIMCA-P13.0软件进行主成分分析(PCA)。使用R软件的Pheatmap(3.5.1)进行热图分析。使用R软件(3.5.1)的t.test函数,以P值≤0.05和VIP≥1的标准筛选差异代谢物。随后,利用KEGG进行代谢通路富集分析。
1.6 葱属植物主要活性成分对苹果轮纹病菌的抑制作用
将200 μL不同浓度的化合物(200,100,50 mg/mL)均匀涂抹在直径为9 cm的培养皿中的20 mL固化PDA培养基上。在培养基中央接种直径为0.5 cm的新鲜苹果轮纹病菌饼,然后在28 ℃的黑暗环境中培养。以接种在没有药剂的PDA培养基上的菌饼作为对照。每种处理进行3次重复。3 d后测量菌斑直径以评估葱属植物主要成分对苹果轮纹病菌菌丝生长的抑制作用。
取大小均匀且无病斑的苹果果实用流水洗涤后,75%酒精灭菌,再用灭菌去离子水冲洗3次。干燥后,在苹果赤道处用打孔器打直径为0.5 cm,深度为0.5 cm的孔,其中加入20 μL不同浓度的药剂(200,100,50 mg/mL)。1 h后,将直径为0.5 cm的新鲜苹果轮纹病菌饼接种到孔中。以添加无菌水替代药剂的苹果果实为对照。将所有果实放入塑料盒中,25 ℃培养。各种处理8次重复。每天测量病斑直径大小,持续7 d,并计算病程曲线下面积(AUDPC)[7],以评价各种物质对苹果果实轮纹病发生的抑制作用。
2 结果与分析
2.1 葱属植物提取物对真菌菌丝生长的影响
处理3 d后,4种葱属植物提取液对苹果轮纹病菌菌丝生长有很强的抑制作用(图1)。随着提取液浓度的增加,其抑制作用显著增强(ON:F=43.42,P<0.000 1;WO:F=886.6,P<0.000 1;GA:F=31.65,P<0.000 1;CL:F=71.46,P<0.000 1)。在整个试验过程中,4种提取液原液(1×)对苹果轮纹病菌菌丝生长的抑制率均高达100%。而在低浓度(100×)时,大蒜提取液的抑制率为72.24%,显著高于洋葱(16.97%)、大葱(40.62%)和韭菜(40.87%)(F=19.30,P<0.000 1)。
2.2 4种葱属植物的代谢物相对含量
4种葱属植物中共鉴定出78种代谢物,分为9类。其中氨基酸(Amino acid)、有机酸(Organic acid)和糖(Sugar)是最大的三类,分别含有25,22,9种物质,分别占32.05%,28.21%,11.54%。除此之外,还有磷酸(Phosphoric acid)、多元醇(Polyol)、脂肪酸(Fatty acid)、胺类(Amine)及其他类物质。在78种代谢物中,焦谷氨酸(Pyroglutamic acid)、磷酸(Phosphoric acid)、果糖(Fructose)、柠檬酸(Citric acid)和葡萄糖(Glucose)是4种葱属植物中平均含量最高的5种代谢物,分别占韭菜、大葱、洋葱和大蒜代谢物总量的56.44%,45.88%,67.38%,48.70%。
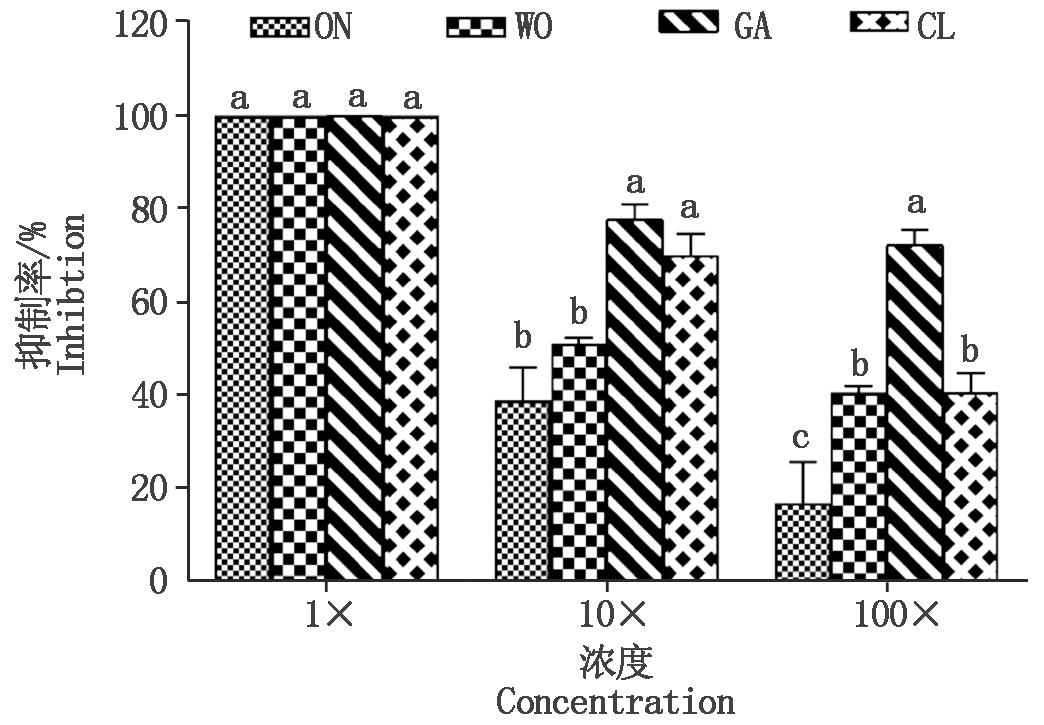
1×、10×和100×表示粗提物的稀释倍数,同一浓度下,不同字母表示差异显著(P<0.05)。ON.洋葱;WO.大葱;GA.大蒜;CL.韭菜。图2-4同。
1×,10×,and 100× represented the multiple dilutions of the crude extract.At the same concentration,different letters indicate significant differences.ON.Onion;WO.Welsh onion;GA.Garlic;CL.Chinese leek.The same as Fig.2-4.
图1 4种葱属植物粗提物对苹果轮纹病菌菌丝生长的抑制作用
Fig.1 The inhibition of crude extracts of the four Allium species against the mycelium growth Botryosphaeria berengriana
2.3 4种葱属植物中差异代谢物鉴定
4种葱属植物代谢物主成分分析(PCA)显示所有24个样品分为4组,分别对应于韭菜、洋葱、大葱和大蒜,而且4种物质彼此分开(图2)。随后,以P≤0.05和VIP≥1为标准,4种葱属植物之间共鉴定出43种差异显著的代谢物(图3)。韭菜中的果糖(Fructose)、异亮氨酸(Isoleucine)和丙酮酸(Pyruvic acid),大蒜中的柠檬酸(Citric acid)、酪氨酸(Tyrosine)和肌醇(Myo-inositol),大葱中的丙氨酸(Alanine)和4-氨基丁酸(4-Aminobutyric acid)以及洋葱中的半乳糖二酸(Galactaric acid)的相对含量显著高于其他3种葱属植物(图4)。
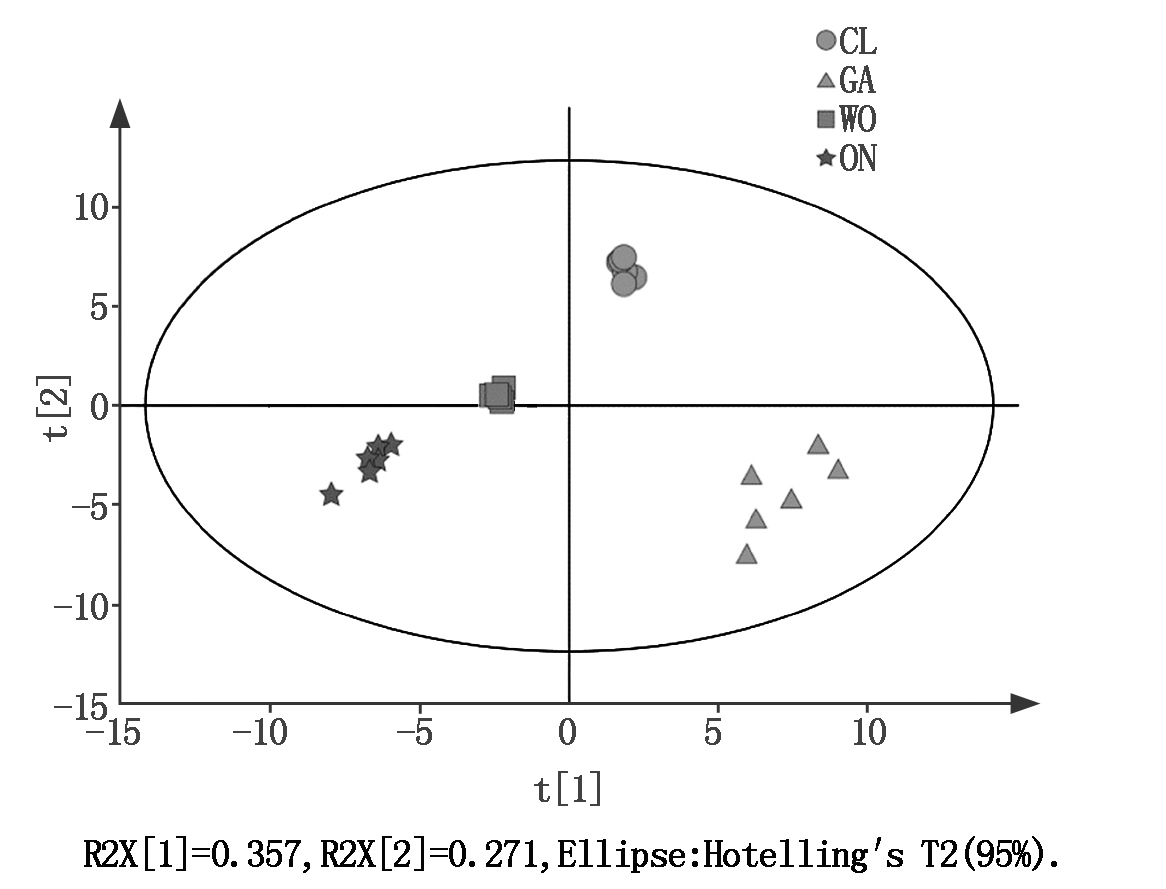
图2 4种葱属植物样品的主成分分析(PCA)得分曲线图
Fig.2 Principal component analysis(PCA)score plot of the samples from the four Allium species
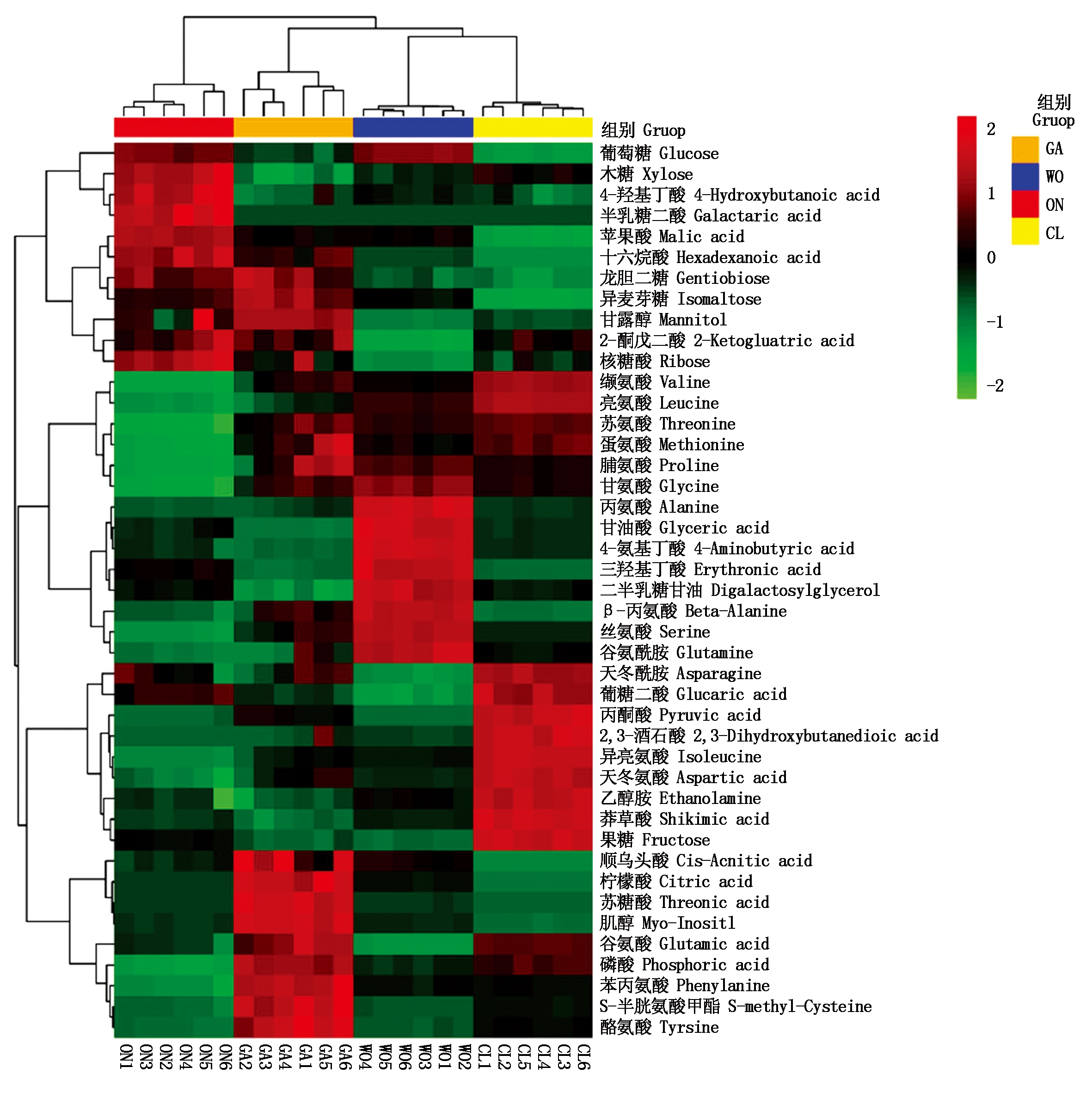
图3 4种葱属植物中43种显著差异代谢物的相对丰度热图
Fig.3 The heatmap showing relative abundance of the 43 significantly different metabolites of the four Allium species
2.4 显著差异代谢物的KEGG分析
43种显著差异代谢物注释到48个KEGG途径。 其中包括氨酰基-tRNA生物合成(15),丙氨酸、天冬氨酸和谷氨酸代谢(8),甘氨酸、丝氨酸和苏氨酸代谢(5)和柠檬酸盐循环/TCA循环(4)在内的8种代谢途径包含超过4种代谢产物。在48条KEGG途径中,有13条在4种葱属植物之间存在显著差异(表1)。其中,影响最大的3条代谢途径是丙氨酸、天冬氨酸和谷氨酸代谢(Osa00250),甘氨酸、丝氨酸和苏氨酸代谢(Osa00260)和柠檬酸盐循环(TCA循环)(Osa00020),而这3个途径相互联系在一起。而氨酰基-tRNA生物合成(Osa00970)途径包含15种代谢物,是最富集的代谢途径,共参与了6个途径中18个氨酰基-tRNA的合成。
2.5 葱属植物主要成分对苹果轮纹病的防控效应
4种葱属植物中平均丰度最高的5种代谢物中,果糖和葡萄糖对苹果轮纹病病菌的生长没有明显的抑制作用。但焦谷氨酸、磷酸和柠檬酸对苹果轮纹病病菌有很强的抑制作用(图5)。在整个试验期间,不同试验浓度的焦谷氨酸和柠檬酸对苹果轮纹病菌菌丝生长的抑制率在29.10%~100.00%,而不同试验浓度的磷酸均表现出100%的抑制作用。
试验进一步表明,焦谷氨酸、磷酸和柠檬酸对于苹果果实上轮纹病的发生具有明显的抑制作用。在接种后的前4 d,不同药剂处理的果实与未处理的对照病斑大小未表现出差异。处理5 d后,对照果实的病斑迅速扩大,但3种物质处理的果实病斑基本保持稳定。到第7天时,3种处理的果实与未处理的对照相比,病斑面积减小了44.38%~91.45%。在整个过程中,3种物质处理的果实AUDPC均显著低于未处理的对照(图6)。
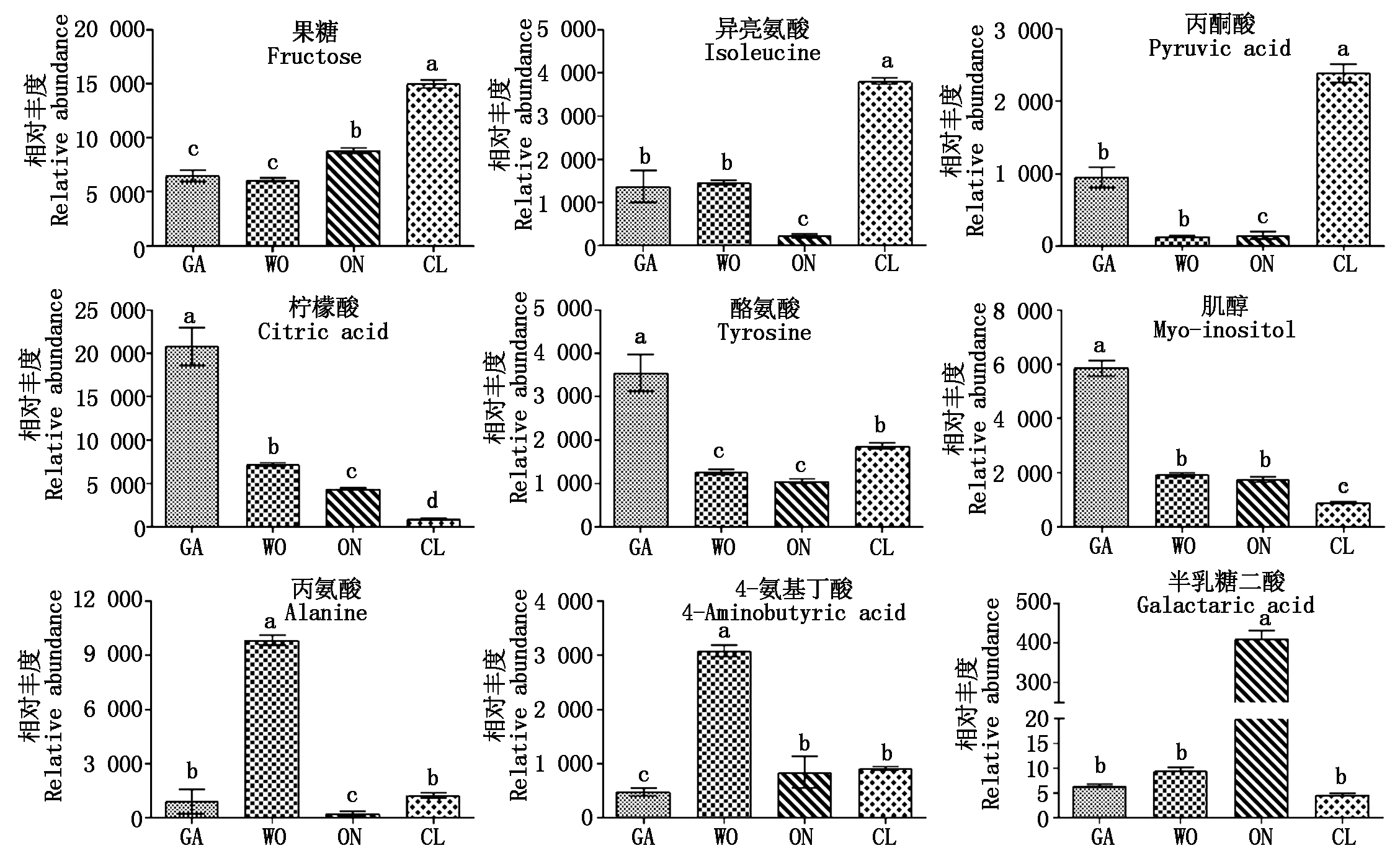
不同字母表示4种植物间差异显著(P<0.05)。
Different letters indicate significant differences.
图4 4种葱属植物中主要代谢物的相对量
Fig.4 The relative amounts of the dominant metabolites in each of the four Allium species
表1 4种葱属植物之间的13条KEGG途径显著差异
Tab.1 Thirteen KEGG pathways significantly different between the four Allum spp.
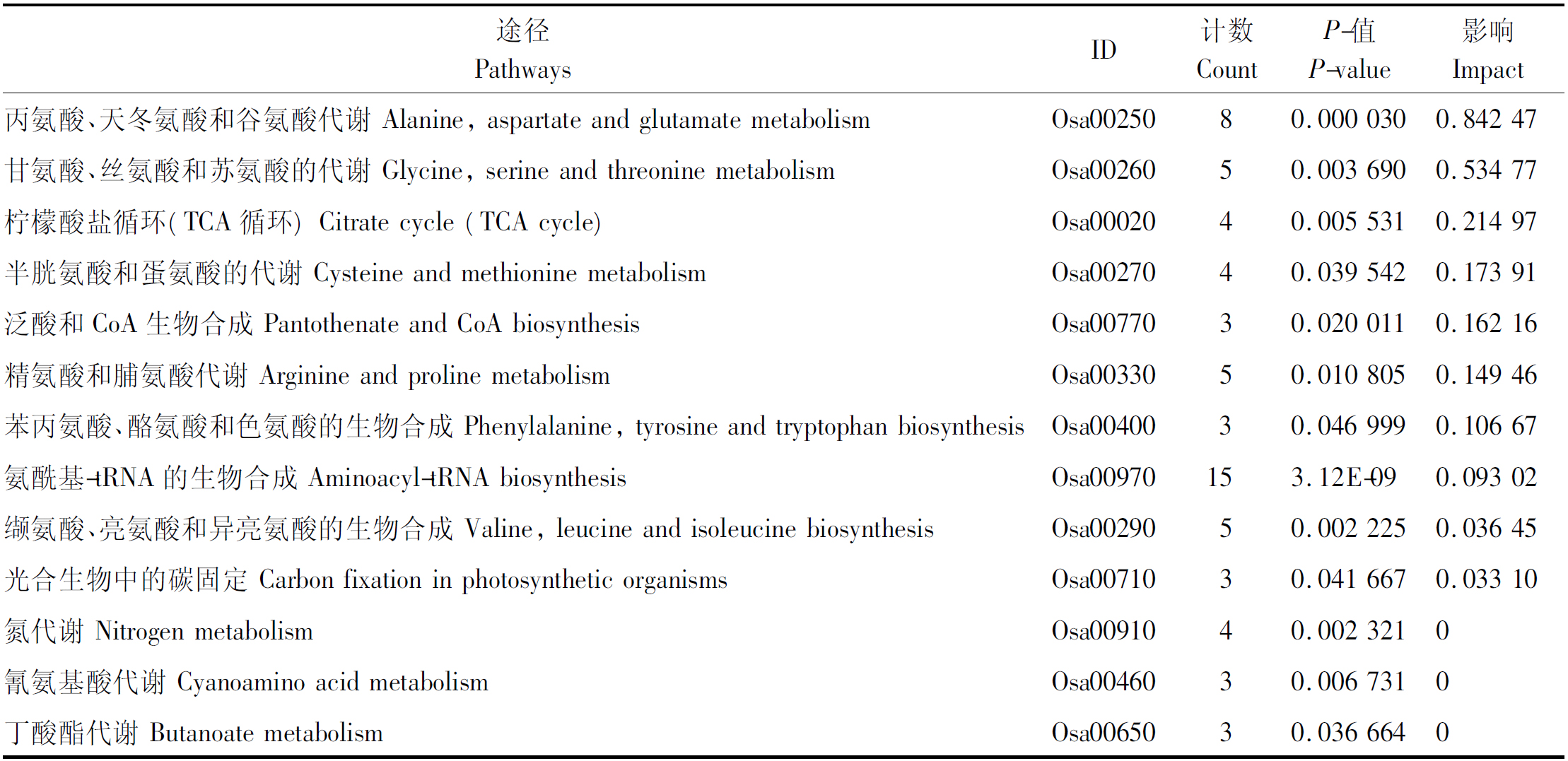
途径PathwaysID计数CountP-值P-value影响Impact丙氨酸、天冬氨酸和谷氨酸代谢 Alanine, aspartate and glutamate metabolismOsa0025080.000 0300.842 47甘氨酸、丝氨酸和苏氨酸的代谢 Glycine, serine and threonine metabolismOsa0026050.003 6900.534 77柠檬酸盐循环(TCA循环) Citrate cycle (TCA cycle)Osa0002040.005 5310.214 97半胱氨酸和蛋氨酸的代谢 Cysteine and methionine metabolismOsa0027040.039 5420.173 91泛酸和CoA生物合成 Pantothenate and CoA biosynthesisOsa0077030.020 0110.162 16精氨酸和脯氨酸代谢 Arginine and proline metabolismOsa0033050.010 8050.149 46苯丙氨酸、酪氨酸和色氨酸的生物合成 Phenylalanine, tyrosine and tryptophan biosynthe-sisOsa0040030.046 9990.106 67氨酰基-tRNA的生物合成 Aminoacyl-tRNA biosynthesisOsa00970153.12E-090.093 02缬氨酸、亮氨酸和异亮氨酸的生物合成 Valine, leucine and isoleucine biosynthesisOsa0029050.002 2250.036 45光合生物中的碳固定 Carbon fixation in photosynthetic organismsOsa0071030.041 6670.033 10氮代谢 Nitrogen metabolismOsa0091040.002 3210氰氨基酸代谢 Cyanoamino acid metabolismOsa0046030.006 7310丁酸酯代谢 Butanoate metabolismOsa0065030.036 6640
3 讨论
在本研究中,证明了大蒜、韭菜、大葱和洋葱对苹果轮纹病病菌有很强的抑制活性。在此基础上,发现4种葱属植物之间存在显著差异的43种代谢物。还证实了4种葱属植物中丰度最高的3种代谢物,柠檬酸、焦谷氨酸和磷酸对苹果轮纹病病菌的生长有显著的抑制作用,而且也能显著抑制苹果果实轮纹病的发生。
自古以来,人们就发现大蒜、洋葱等植物对细菌、真菌及病毒有具有一定的抗性,而且也用于治疗各种疾病。而现代科学研究为这种古老的实践提供了科学依据。目前葱属植物的各种提取物已在临床医学中得到了广泛的研究[10-12]。在农业生产中,大蒜提取物及其降解产物显著降低了葡萄灰霉病的危害程度[13]。韭菜能显著抑制番茄枯萎病[14],香蕉枯萎病菌[7]的发生,也能显著抑制十字花科植物叶斑病病菌的萌发[15]。在本研究中,证明了大蒜、大葱、洋葱和韭菜提取物对苹果轮纹病菌具有显著的抑制作用。值得注意的是高浓度(1×)的提取物对苹果轮纹病菌菌丝生长的抑制率可高达100%。本研究结果与前人的研究结果一致,再次证明了葱属植物具有广谱的杀菌活性,而且也为苹果轮纹病防控提供了一条潜在的途径。
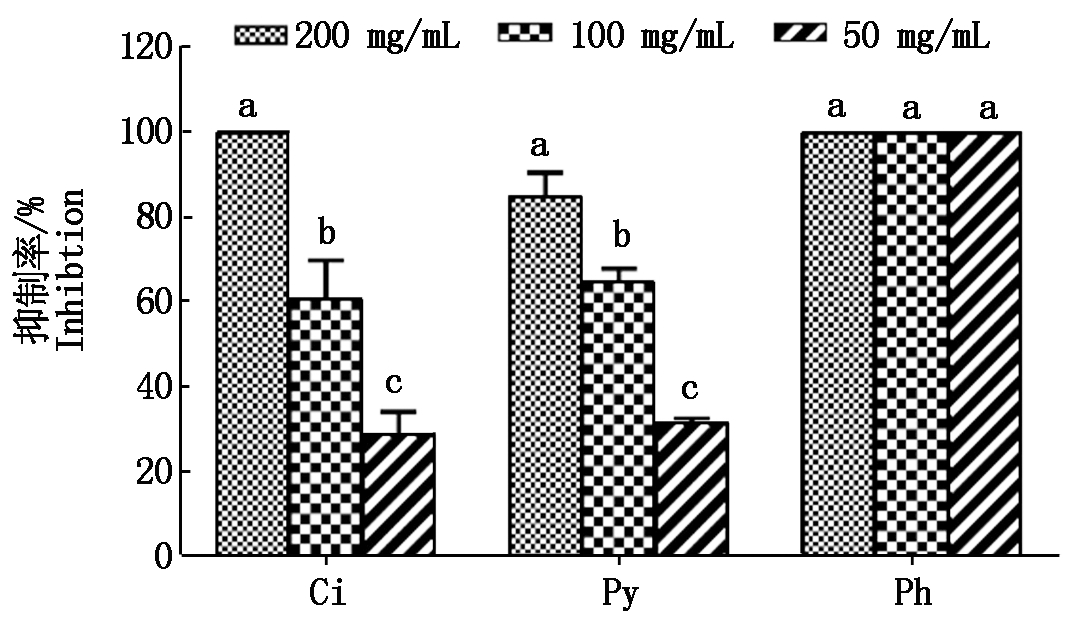
不同字母表示3种浓度间差异显著(P<0.05)。Ci.柠檬酸;Py.焦谷氨酸;Ph.磷酸。
Different letters represent the significant difference among the three concentrations.Ci.Citric acid;Py.Pyroglutamic acid;Ph.Phosphoric acid.
图5 葱属植物的3个主要成分对苹果轮纹病病菌菌丝体生长的抑制作用
Fig.5 Inhibition of the three main metabolites of Allium species against the mycelia growth of Botryosphaeria berengriana
研究表明,硫化物是在大蒜、洋葱等其他葱属植物中具有生物活性的主要物质[16-17]。而且与硫代亚磺酸酯(Thiosulfinates)有关。硫代亚硫酸盐可以分解形成多种硫化物,包括二烯丙基、甲基烯丙基和二丙基一、二、三、四硫化物,以及(E)和(Z)-大蒜烯(Ajoene)[18-19]。葱属植物中含有的硫化物对蜜蜂球囊菌(Ascosphaera apis)和香蕉枯萎病菌[20-21]、黄曲霉(Aspergillus flavus)、单核细胞增多性李斯特菌(Listeria monocytogenes)、大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、黑曲霉(Aspergillus niger)和寒沙门氏菌(Salmonella typhimuirum)[22]均有显著的抑制作用。
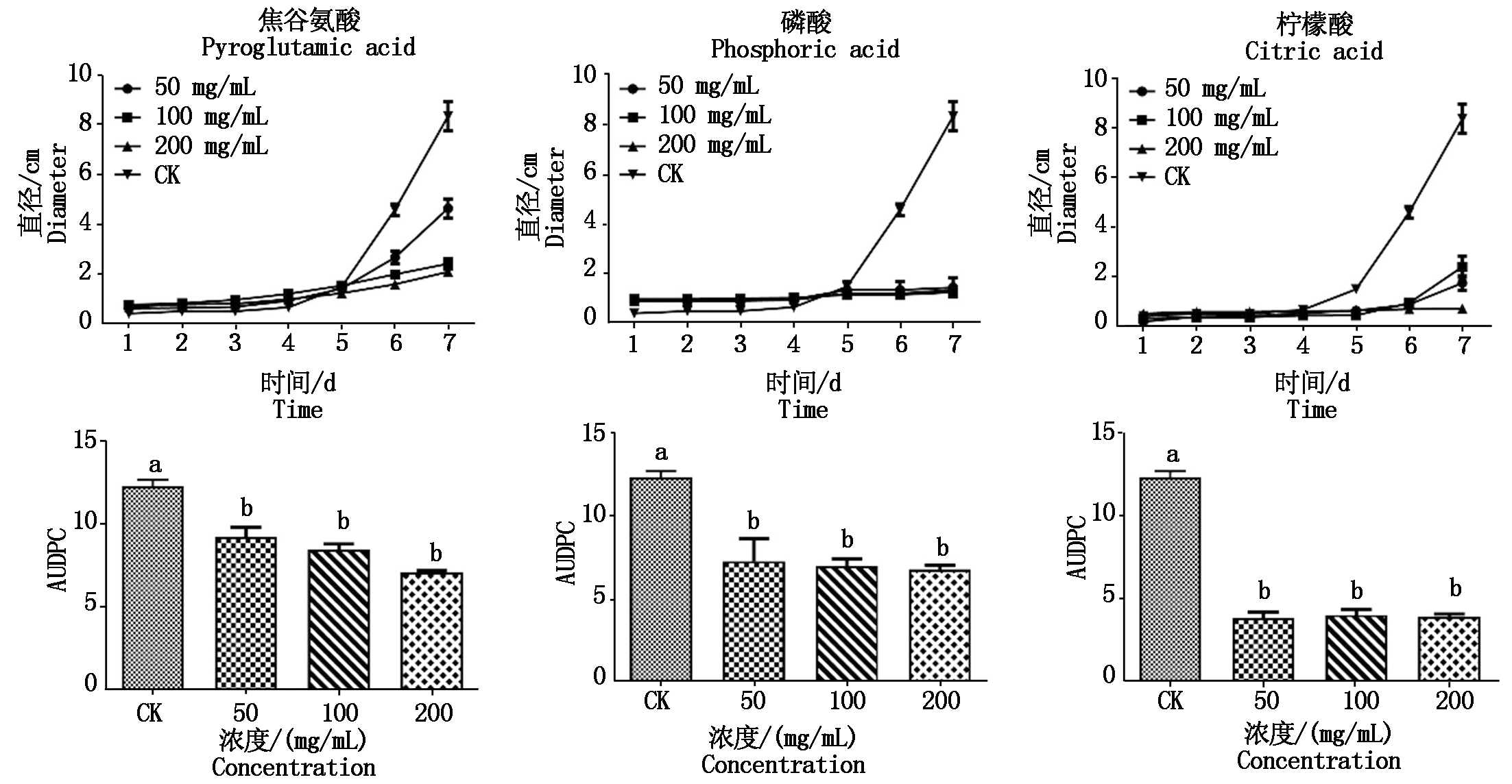
3种主要成分均能显著缩小病变范围和病程曲线下面积(AUDPC)。不同字母表示差异显著(P<0.05)。
All three main metabolites could significantly reduced the diameters of disease lesion and the area under the disease progress curve(AUDPC).Different letters indicate significant difference(P<0.05).
图6 葱属植物的3个主要成分对苹果轮纹病菌引起的苹果果实病害的抑制作用
Fig.6 Inhibition of the three main metabolites of Allium species on the disease development of apple fruits causes by Botryosphaeria berengriana
除了含硫化合物外,葱属植物中还含有其他抗菌物质,如皂苷(Saponins)、黄酮类(Flavonoids)、氮化合物(Nitrogen compounds)以及多肽类(Peptides)[19]。韭菜种子中不饱和脂肪酸单甘油酯(Monoglyceride)和天师酸(Tianshic acid)显著抑制辣椒疫霉菌(Phytophtohora capsici)的生长[23]。洋葱鳞茎中的抗真菌肽Allicepin[24]和大蒜鳞茎中抗真菌蛋白Allivin[25]对灰霉病菌(Botrytis cinerea)、尖孢镰刀菌(Fusarium oxysporum)、落花生球腔菌(Mycosphaerella arachidicola)和轮纹病菌(Physalospora piricola)等真菌的菌丝生长有显著抑制作用。
本研究证实了4种葱属植物中的焦谷氨酸、磷酸和柠檬酸能显著抑制苹果轮纹病菌的生长,而且也显著抑制苹果果实轮纹病的发生。研究表明,焦谷氨酸对枯草芽孢杆菌(Bacillus subtilis)、阴沟肠杆菌(Enterobacter cloacae)和恶臭假单胞菌(Pseudomonas putida)具有抑制作用[26]。磷酸对镰刀菌、曲霉菌和青霉菌具有较高的抗真菌活性[27],对葡萄霜霉病[28]和马铃薯晚疫病[29-30]的发生有显著的防控作用。柠檬酸对须毛癣菌(Trichophyton mentagrophytes)、白色念珠菌(Candida albicans)、烟曲霉(Aspergillus fumigatus)和马拉色菌(Malassezia furfur)的生长有显著的抑制作用[31]。研究表明,果糖和葡萄糖对真菌没有明显的影响,但前人研究表明,它们对植物病原真菌有间接的抑制作用[32-35],而这些物质与硫化物共同作用,使葱属植物具有广谱的抗菌特性。
[1] Kharchoufi S, Parafati L, Licciardello F, Muratore G, Hamdi M, Cirvilleri G, Restuccia C. Edible coatings incorporating pomegranate peel extract and biocontrol yeast to reduce Penicillium digitatum postharvest decay of oranges[J]. Food Microbiology,2018,74:107-112. doi: 10.1016/j.fm.2018.03.011.
[2] Billet K, Delanoue G, Arnault I, Besseau S, Oudin A, Courdavault V, Marchand P A, Giglioli-Guivarc′h N, Guérin L, Lanoue A. Vineyard evaluation of stilbenoid-rich grape cane extracts against downy mildew: a large-scale study[J]. Pest Management Science,2019,75(5):1252-1257. doi: 10.1002/ps.5237.
[3] Dethoup T, Songkumarn P, Rueangrit S, Suesa-Ard S, Kaewkrajay C. Fungicidal activity of Thai medicinal plant extracts against Alternaria brassicicola causing black spot of Chinese kale[J]. European Journal of Plant Pathology,2018,152(1):157-167. doi: 10.1007/s10658-018-1460-5.
[4] Abdellatif S H, Abdel-Shafi S, Ali A E, Ismaiel A A, Enan G. Inhibition of two listeria strains in vitro and in situ by nisin, onion and garlic juices separately and in combinations[J].Wulfenia,2018,25(1):194-231.
[5] Fratianni F, Riccardi R, Spigno P, Ombra M N, Cozzolino A, Tremonte P, Coppola R, Nazzaro F. Biochemical characterization and antimicrobial and antifungal activity of two endemic varieties of garlic (Allium sativum L.) of the Campania Region, Southern Italy[J]. Journal of Medicinal Food,2016,19(7):686-691. doi:10.1089/jmf.2016.0027.
[6] Zhang Y S, Qiu G, Zhang Y N, Li Y T, Wang X Z. Controlling Fusarium wilt disease in melon (Cucumis melo L.) using tillered onion bulb extract[J]. Pakistan Journal of Botany,2017,49(4):1615-1623.
[7] Huang Y H, Wang R C, Li C H, Zuo C W, Wei Y R, Zhang L, Yi G J . Control of Fusarium wilt in banana with Chinese leek[J].European Journal of Plant Pathology,2012,134(1):87-95. doi: 10.1007/s10658-012-0024-3.
[8] Li Y, Han L R, Zhang Y Y, Fu X C, Chen X Y, Zhang L X, Mei R H, Wang Q. Biological control of apple ring rot on fruit by Bacillus amyloliquefaciens 9001[J]. Plant Pathol J,2013,29(2):168-173. doi: 10.5423/PPJ.SI.08.2012.0125.
[9] 赵刚, 张卫娜, 左存武, 黄永红. 韭菜提取物及其主要活性物质防控苹果轮纹病发生的研究[J]. 中国生物防治学报,2017,33(2):273-280. doi: 10.16409/j.cnki.2095-039x.2017.02.019.
Zhao G, Zhang W N, Zuo C W, Huang Y H. Control effect of Chinese leek extract and its main bioactive components on apple ring rot incidence[J]. Chinese Journal of Biological Control, 2017,33(2):273-280.
[10] Sung Y Y, Kim D S, Kim S H, Kim H K. Aqueous and ethanolic extracts of welsh onion, Allium fistulosum, attenuate high-fat diet-induced obesity[J]. BMC Complementary and Alternative Medicine,2018,18(1):105. doi:10.1186/s12906-018-2152-6.
[11] Chan J Y, Yuen A C, Chan R Y, Chan S W. A review of the cardiovascular benefits and antioxidant properties of allicin[J].Phytotherapy Research,2013,27(5):637-646. doi: 10.1002/ptr.4796.
[12] Shetty S, Thomas B, Shetty V, Bhandary R, Shetty R M. An in vitro evaluation of the efficacy of garlic extract as an antimicrobial agent on periodontal pathogens: A microbiological study[J].AYU,2014,34(4):445-451. doi: 10.4103/0974-8520.127732.
[13] Gándara-Ledezma A, Corrales-Maldonado C, Rivera-Domínguez M, Martínez-Téllez M, Vargas-Arispuro I. Post-harvest control of gray mold in table grapes using volatile sulfur compounds from Allium sativum[J].Journal of the Science of Food and Agriculture,2014,95(3):497-503. doi: 10.1002/jsfa.6757.
[14] Yu J Q. Allelopathic suppression of Pseudomonas solanacearum infection of tomato (Lycopersicon esculentum) in a Tomato-Chinese Chive (Allium tuberosum) intercropping system[J]. Journal of Chemical Ecology,1999,25(11):2409-2417. doi: 10.1023/a:1020809805081.
[15] Ho W C, Wu T Y, Su H J, Ko W H. Effect of oriental medicinal plant extracts on spore germination of Alternaria brassicicola and nature of inhibitory substances from speedweed[J]. Plant Disease,2007,91(12):1621-1624. doi: 10.1094/PDIS-91-12-1621.
[16] Ruddraraju K V, Parsons Z, Lewis C D, Gates K S. Allylation and alkylation of biologically relevant nucleophiles by diallyl sulfides[J].The Journal of Organic Chemistry,2017,82(1):776-780. doi: 10.1021/acs.joc.6b02517.
[17] Leontiev R, Hohaus N, Jacob C, Gruhlke M C H, Slusarenko A J. A Comparison of the antibacterial and antifungal activities of Thiosulfinate analogues of allicin[J]. Scientific Reports,2018,8(1):6763. doi: doi:10.1038/s41598-018-25154-9.
[18] Benkeblia N, Lanzotti V. Allium thiosulfinates: chemistry, biological properties and their potential utilization in food preservation[J]. Food,2007,1(2):193-201.
[19] Lanzotti V, Bonanomi G, Scala F. What makes Allium species effective against pathogenic microbes?[J].Phytochemistry Reviews,2013,12(4):751-772. doi: doi: 10.1007/s11101-013-9295-3.
[20] Zuo C W, Li C Y, Li B, Wei Y R, Hu C H, Yang Q S, Yang J, Sheng O, Kuang R B, Deng G M, Biswas M K, Yi G J. The toxic mechanism and bioactive components of Chinese leek root exudates acting against Fusarium oxysporum f. sp. cubense tropical race 4[J]. European Journal of Plant Pathology,2015,143(3):447-460. doi: 10.1007/s10658-015-0697-5.
[21] Zuo C W, Zhang W N, Chen Z J, Chen B H, Huang Y H. RNA sequencing reveals that endoplasmic reticulum stress and disruption of membrane integrity underlie dimethyl trisulfide toxicity against Fusarium oxysporum f. sp.cubense tropical race 4[J]. Frontiers in Microbiology,2017,8:1365. doi: 10.3389/fmicb.2017.01365.
[22] El-Sayed H, Chizzola R, Ramadan A A, Edris A E. Chemical composition and antimicrobial activity of garlic essential oils evaluated in organic solvent, emulsifying, and self-microemulsifying water based delivery systems[J]. Food Chemistry,2017,221:196-204. doi: 10.1016/j.foodchem.2016.10.052.
[23] Sang S M, Lao A N, Wang Y S, Chin C, Rosen R T, Ho C T. Antifungal constituents from the seeds of Allium fistulosum L.[J].Journal of Agricultural and Food Chemistry,2002,50(22):6318-6321. doi: 10.1021/jf025651o.
[24] Wang H, Ng T. Isolation of allicepin, a novel antifungal peptide from onion (Allium cepa) bulbs[J]. Journal of Peptide Science,2004,10(3):173-177. doi:10.1002/psc.509.
[25] Wang H, Ng T. Purification of allivin, a novel antifungal protein from bulbs of the round-cloved garlic[J].Life Sciences,2001,70(3):357-365. doi: 10.1016/S0024-3205(01)01399-6.
[26] Huttunen E, Noro K, Yang Z N. Purification and identification of antimicrobial substances produced by two Lactobacillus casei strains[J]. International Dairy Journal,1995,5(5):503-513. doi: doi:10.1016/0958-6946(95)00030-7.
[27] Lin C D, Chen T C. Relative antifungal efficacies of phosphoric acid and other compounds on fungi isolated from poultry feed[J]. Animal Feed Science and Technology,1995,54(1):217-226. doi: doi:10.1016/0377-8401(94)00760-7.
[28] Magarey P A, Wachtel M F, Newton M R. Evaluation of phosphonate, fosetyl-Al and several phenylamide fungicides for post-infection control of grapevine downy mildew caused by Plasmopara viticola[J].Australasian Plant Pathology,1991,20(2):34-40. doi: 10.1071/app9910034.
[29] Johnson D A, Inglis D A, Miller J S. Control of potato tuber rots caused by oomycetes with foliar applications of phosphorous acid[J].Plant Disease,2004,88(10):1153-1159.doi:10.1094/pdis.2004.88.10.1153.
[30] Cooke L R, Little G. The effect of foliar application of phosphonate formulations on the susceptibility of potato tubers to late blight[J].Pest Management Science,2002,58(1):17-25. doi:10.1002/ps.408.
[31] Shokri H. Evaluation of inhibitory effects of citric and tartaric acids and their combination on the growth of Trichophyton mentagrophytes, Aspergillus fumigatus, Candida albicans, and Malassezia furfur[J]. Comparative Clinical Pathology,2011,20(5):543-545. doi:10.1007/s00580-011-1195-6.
[32] Peng B, Su Y B, Li H, Han Y, Guo C, Tian Y M, Peng X X. Exogenous alanine and/or glucose plus kanamycin kills antibiotic-resistant bacteria[J]. Cell Metabolism,2015,21(2):249-262. doi: 10.1016/j.cmet.2015.01.008.
[33] Kremmydas G F, Tampakaki A P, Georgakopoulos D G. Characterization of the biocontrol activity of pseudomonas fluorescens strain X reveals novel genes regulated by glucose[J]. PLoS One,2013,8(4):e61808. doi: 10.1371/journal.pone.0061808.
[34] Sui Y, Liu J. Effect of glucose on thermotolerance and biocontrol efficacy of the antagonistic yeast Pichia guilliermondii: theory and applications in pest management[J]. Biological Control,2014,74(3):59-64. doi: 10.1016/j.biocontrol.2014.04.003.
[35] Wu C W, Wu X J, Wen C, Peng B, Peng X X, Chen X H, Li H. Fructose promotes growth and antifungal activity of Penicillium citrinum[J]. Protein & Cell,2016,7(7):527-532. doi: 10.1007/s13238-016-0280-7.