烟草甲虫(Lasioderma serricorne)属于鞘翅目(CoLeoptera)窃蠹科(Anobiidae)毛食骸甲属( Lasioderma),由于其复杂的食性,给工业企业烟叶仓储带来极大危害。全国每年因虫害导致的烟叶损失率约1.64%[1]。目前,国内外所采用的常规防治方法主要包括物理防治、化学药剂防治和生物防治3种[2]。物理防治主要以高、低温杀虫以及改变仓储气体成分为主,此方法对仓储环境、设施配套、成本预算都有极高要求。化学防治多以药剂喷雾和熏蒸为主,这种方法可能会使烟草甲虫产生抗药性,且污染环境[3-4]。防治工作所面临的困难以及防治方法的改进已经成为烟草工业生产过程中亟待解决的问题之一。
近年来生物防治多以经济、安全、高效且无公害走进公众视野,成为发展潜力较大的领域。微生物防治是生物防治的重要组成部分之一。苏云金芽孢杆菌(Bacillus thuringiensis,简称Bt)能在自身种群动态繁殖过程中形成芽孢,同时伴随大量伴孢晶体蛋白的代谢。此类晶体蛋白(Parasporal crystal protein),又称δ-内毒素,通常是指在生长稳定期所产生的cry和cyt蛋白,及生长期所产生的VIPs蛋白。这些蛋白是Bt最主要的特异性杀虫成分,且对人畜无毒,不污染环境,符合绿色生态防控理念[5-8]。已有报道Bt伴孢晶体蛋白对玉米、水稻、棉花、马铃薯等作物有显著的害虫防治效果[9-11],但近年来对于烟草领域的生物防虫报道研究较少。鉴于此,本研究利用苏云金芽孢杆菌所代谢出的伴孢晶体蛋白来控制烟草甲虫种群数量,旨在为利用生物性技术防治烟叶仓储害虫提供理论依据。
1 材料和方法
1.1 材料和仪器
供试复烤片烟品种为云烟87(贵州桐梓C2F,2017),由甘肃烟草工业有限责任公司提供;供试烟草甲幼虫由湖南华望熏蒸消毒有限公司提供。
QIAcube核酸提取仪(德国Qiagen),Qubit荧光定量仪(美国 Thermo Fisher Scientific),水平电泳仪(美国BIO-RAD),凝胶成像系统(美国BIO-RAD GeLDoc EZ),QIAxceL Advanced全自动电泳分析仪(德国Qiagen),PCR仪(德国Eppendorf),高通量测序平台(美国IlluminaMiniSeq),光学显微镜(日本OLympus CKX53+EP50),扫描电镜(日本NeoScopeⅡJCM6000),离心机(德国Eppendorf),紫外分光光度计(美国 Agilent Cary60)。
1.2 试验方法
1.2.1 烟叶表层菌体提取、分离纯化 参照文献对烟叶表层菌体提取、分离纯化[12],具体为称取 3个平行烟叶样品,每个样品取5 g倒入装有50 mL醋酸钠液体培养基(牛肉膏5 g,蛋白胨1 g,醋酸钠(CH3COONa·3H2O)4 g,ddH2O 100 mL,pH值 7.0)的100 mL锥形瓶中。在培养基中分别加入终浓度为400 μg/mL的青霉素钠盐和硫酸庆大霉素,摇床培养(200 r/min,30 ℃)4 h。取10 mL加入到灭菌的离心管内,300 r/min离心15 min,取上清液2 mL于65 ℃ 水浴15 min,取热处理后的种子液0.1 mL涂于NA平板培养基中倒置培养48 h。从平板上选取菌落形态圆形,表层呈干燥状,菌落边缘粗糙、不齐,略带放射状向周围散开等具有典型Bt菌落特征的菌落进一步纯化培养。分离的菌体置于4 ℃冰箱中避光、低温保存备用。
1.2.2 菌株生理生化及16S rDNA 测序鉴定 参照文献对分离菌株进行生理生化鉴定[13-14]。对具有Bt特征的菌株进行总DNA提取,以浓度和质量符合要求的DNA样品为模板,使用16S通用引物(27F:AGAGTTTGATCMTGGCTCAG;1492R:TACGGYTACCTTGTTACGACTT)进行扩增。PCR反应体系:12.8 μL ddH2O;3 μL Buffer;2 μL dNTP;3 μL Primer1;3 μL Primer2;1 μL DNA模板;0.2 μL酶,总体积30 μL。扩增程序:95 ℃ 5 min;95 ℃ 30 s,50 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min;12 ℃保存。将扩增后的PCR产物进行测序,并将各个测序结果在NCBI上进行BlastN比对分析。
1.2.3 Bt菌株伴孢晶体形态及基因型鉴定 参考文献[15-16],将Bt菌株接种在液体培养基(1 L ddH2O 加入蛋白胨 5 g,牛肉膏 3 g,氯化钠 10 g,pH值7.0)上,放入200 r/min,30 ℃ 恒温培养箱中培养48 h。然后制作载玻片,使用光学显微镜进行观察并捕捉图像;将紫外灭菌后的烟叶浸泡于液体培养基中30 min,取出后自然晾干,用液氮低温冷冻、干燥;喷金之后将制备好的样品置于扫描电镜下观察并进行图像记录。
参考文献[17-18]方法,针对分离出的苏云金芽孢杆菌所含有的伴孢晶体基因型分别使用通用引物进行鉴定,如表1所示。PCR反应体系:15 μL Mix,2 μL Mg2+(25 mmol/L),2 μL DNA模板,10 μmol/L 引物各0.5 μL,ddH2O补齐至30 μL。扩增程序:95 ℃ 6 min;95 ℃ 1 min;退火温度根据不同的引物而设定(表1),退火时间50 s;72 ℃ 1 min;30 个循环;72 ℃ 10 min;12 ℃ 保存。取反应产物20 μL利用全自动电泳仪进行检测。伴孢晶体蛋白基因型可依据电泳条带片段的大小确定。
表1 鉴定苏云金芽孢杆菌cry、cyt基因型所用通用引物及引物特性
Tab.1 Characteristics of general and specific primers for cry,cyt of Bacillus thuringiensis

识别基因Gene引物序列Primer sequences产物片段大小/bpSize退火温度/℃The annealing temperaturecry15'-CATGATTCATGCGGCAGATAAAC-3' 277~274585'-TTGTGACACTTCTGCTTCCCATT-3'cry25'-GTTATTCTTAATGCAGATGAATGGG-3' 689~701555'-CGGATAAAATAATCTGGGAAATAGT-3cry35'-CGTTATCGCAGAGAGATGACATTA-AC-3' 589~604585'-CATCTGTTGTTTCTGGAGGCAAT-3'cry45'-GCATATGATGTAGCGAAACAAGCC-3' 439605'-GCGTGACATACCCATTTCCAGGTCC-3cry7、cry85'-AAGCAGTGAATGCCTTGTTTAC-3' 420~423545'-CTTCTAAACCTTGACTACTT-3'cry115'-TTAGAAGATACGCCAGATCAAGC-3' 305515'-CATTTGTACTTGAAGTTGTAATCCC-3'cry5、cry12、cry14、cry215'-TTACGTAAATTGGTCAATCAAG-CAAA-3' 474~489505'-AAGACCAAATTCAATACCAGGGTT-3'cry85'-ATGAGTCCAAATAATCTAAATG-3'373~37649 5'-TTTGATTAATGAGTTCTTCCACTCG-3'cyt15'-AACCCCTCAATCAACAGCAAGG-3' 522~525515'-GGTACACAATACATAACGCCACC-3'cry135'-CTTTGATTATTTAGGTTTAGTTCAA-3' 313505'-TTGTAGTACAGGCTTGTGATTC-3'
1.2.4 Bt菌株伴孢晶体的提取制备 参考文献[19]方法,将菌落接种到NA液体培养基中培养(30 ℃,200 r/min),使用紫外分光光度计每间隔2 h测定OD600吸光度并对菌液进行染色镜检。待伴孢晶体出现后每隔2 h取10 mL菌液于15 mL离心管中,加入200 μL 600 μg/mL溶菌酶溶液,轻微振荡混匀,静止20 min后染色镜检观察细胞的完整性。将溶解后的菌株于-20 ℃冷冻30 min,取出放入40 ℃水浴中15 min,此操作重复3次后进行离心收集(14 000 r/min,20 min),去上清液,无菌水重悬洗涤至少量泡沫,冷冻干燥备用。
1.2.5 伴孢晶体蛋白对烟草甲幼虫的毒力活性测定方法 参考文献[20]方法,将伴孢晶体称质量,悬浮在无菌蒸馏水中,分别制备成浓度为150,100,50,10 mg/L的菌液,-20 ℃保存备用。取15 g烟叶经紫外灭菌,将100 mL菌液均匀喷洒于烟叶表面,为了使叶片每个部位都能浸润,中途需翻动2~3次,放入灭菌培养皿中自然晾干。每个培养皿放入30头3~4周龄的烟草甲幼虫,于人工气候箱(30 ℃、相对湿度75 %)中培养。每个浓度处理4组,每组6个平行。分别于1,2,3,4 d后观察幼虫死亡数量,并计算死亡率(%)和校正死亡率。
2 结果与分析
2.1 菌株鉴定
通过菌落形态观察,共分离得到菌株11株。生理生化分析符合苏云金芽孢杆菌特性的1株,命名为GSYC1。菌株的生理生化特性结果(表2)为接触酶反应、VP、葡萄糖产酸、明胶水解、淀粉水解、革兰氏染色、水解蛋白、卵黄卵磷脂、硝酸盐还原、过氧化氧酶产生、利用蔗糖均为阳性,分解水杨甘、尿酸反应、木糖产酸、吲哚产生均为阴性。反应指标同鉴定手册中一致。初步将菌株GSYC1鉴定为苏云金芽孢杆菌。
表2 GSYC1生理生化特性鉴定结果
Tab.2 The result of physiological and biochemical characters of the strain GSYC1

注:+.阳性或能够利用;-.阴性或不能够利用。
Note:+. Positive or can use;-. Negative or can not use.
菌株Bacteria生理生化反应Physiological biochemical reactionGSYC1接触酶反应VP葡萄糖产酸分解水杨甘尿酸反应明胶水解淀粉水解木糖产酸革兰氏染色水解蛋白卵黄卵磷脂硝酸盐还原吲哚产生过氧化氧酶产生利用蔗糖 + ++ - - + + - ++++-++
为进一步鉴定,对GSYC1进行菌株总DNA提取,浓度为20 ng/μL,以条带清晰的总DNA为模板进行16S菌株保守序列PCR扩增。扩增产物经1%琼脂糖凝胶电泳分析,约1 500 bp 处有一条特异扩增条带(图1)。对目的基因条带进行回收、测序。将测序结果在NCBI上进行BlastN比对分析,结果表明(图2)所示,经过系统发育树的分析证明分离株与苏云金芽孢杆菌16S rRNA序列的同源性高达99.93%,因此,分离出的GSYC1菌株属于苏云金芽孢杆菌。
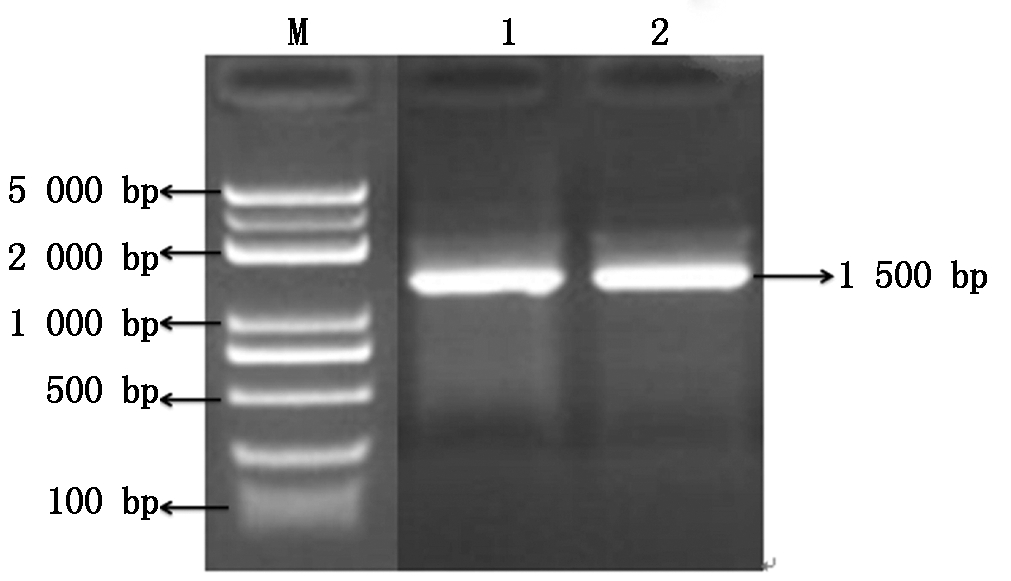
Marker(100~5 000 bp)
图1 菌株GSYC1的基因扩增
Fig.1 The PCR products amplified from the 16S rDNA gene of strain GSYC1
2.2 Bt菌株伴孢晶体形态及基因型分析
运用光学显微镜和扫描电镜确定 Bt 菌株所代谢的伴孢晶体蛋白形状,从而初步推测菌株所含伴孢晶体基因类型。通过图3所示,GSYC1菌株在芽孢期能分离出芽孢并产生球形和菱形的伴孢晶体蛋白。在已报道的文献中提出,菱形晶体一般是cry1型基因编码;立方形晶体和方形晶体分别由cry2和cry3型基因编码;无定形晶体由cry4型基因编码;球形晶体由cry8、cry30、cry40、cry11型基因编码[21-24]。因此,推测GSYC1菌株可能含有cry1、cry8、cry30、cry40、cry11型基因。
对不同基因型晶体蛋白所对应的毒力活性进行深入研究表明,cry1、cry2和cry3、cry7、cry8分别对鳞翅目和鞘翅目有毒力活性;cry4、cry10、cry11和cyt1对双翅目有活性;cry5、cry12、cry13、cry14和cry21有杀线虫的活性[25-27]。但从伴孢晶体形态角度看,cry8和cry11都是球形结构,然而所对应的杀虫活性却不相同。因此,可以表明相同形状的伴孢晶体,其所携带的基因型和定向的杀虫活性也是有区别的。鉴于此,为了更加明确GSYC1菌株伴孢晶体蛋白的基因型以及所对应的杀虫活性,本研究对分离的苏云金芽孢杆菌进行了目的条带扩增。由图4可见,分别在270 bp左右和370 bp左右,GSYC1扩增出清晰的目的片段条带,说明GSYC1菌株分别含有cry1和cry8 2种伴孢晶体基因。这2种基因型分别对鳞翅目和鞘翅目昆虫有定向生物毒力活性。
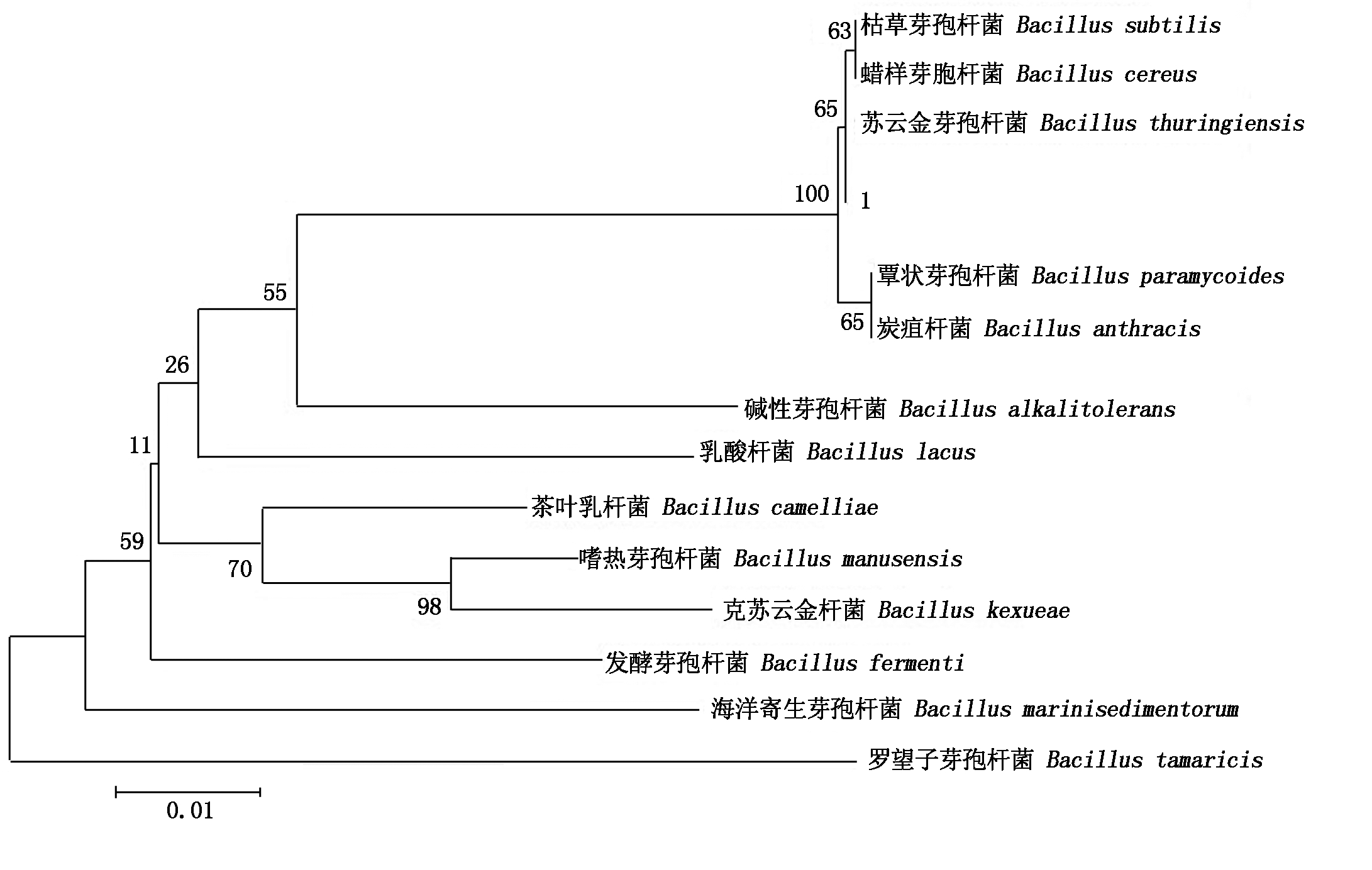
图2 菌株GSYC1的系统发育分析
Fig.2 Phylogenetic tree of GSYC1 with other microorganism
2.3 Bt菌株伴孢晶体蛋白的提取
运用紫外分光光度计测定菌体不同生长时期的吸光度;光学显微镜观察形态特征,从而判断菌株生长周期及伴孢晶体的代谢规律。由图5可知,菌体生长的迟缓期出现于0~8 h,镜检观察结果显示,菌体形态完整、数量较少、移动迟缓;菌体在8~20 h达到生长的对数期,镜检观察发现菌体数量较前期呈倍数增长;菌体于22~34 h逐步进入生长稳定期,且22 h镜检观察时芽孢出现脱落,24 h开始代谢伴孢晶体;34 h后镜鉴结果显示大量菌体开始死亡,代谢出现迟缓,进入生长衰退期。对菌群处于稳定期的伴孢晶体进行提取并称质量检测,结果表明,菌群在24~34 h内伴孢晶体的平均代谢量为0.010 0~0.012 2 g/mL,其中26 h伴孢晶体的代谢量达到峰值。

A.40× 油镜观察;B. JCM6000 扫描电镜观察。
A. 40× oil mirror observation;B. JCM6000 scanning electron microscope observation.
图3 菌株的光学显微镜和扫描电镜观察
Fig.3 The observation of strain GSYC01 under optical microscope and SEM

M.Size Marker(50-800 bp);A.Lignment Marker(15-3 000 bp).
图4 菌株GSYC1伴孢晶体基因型鉴定
Fig.4 Genotype identification of strain GSYC1 concomitant cell crystals
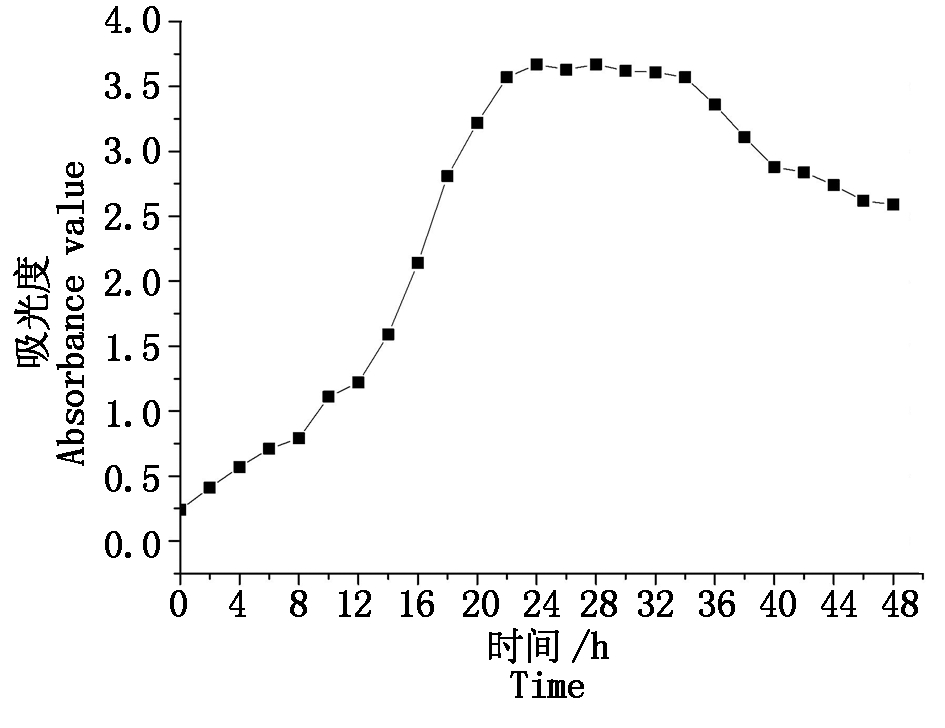
图5 GSYC1生长曲线
Fig.5 The growth curve of GSYC1
2.4 Bt菌株伴孢晶体蛋白对烟草甲幼虫的生物毒力活性分析
2.4.1 烟草甲幼虫死亡形态对比 利用伴孢晶体蛋白重悬液对烟草甲幼虫进行生物活性测定,同时以水作为阴性对照。发现当使用不同浓度晶体悬液感染1 d后,烟草甲幼虫就有死亡现象出现,而对照处理在第4天时出现死亡。但不同处理条件下烟草甲幼虫的死亡状态差异显著:晶体悬液感染的烟草甲幼虫,第2天会出现行动迟缓、反应迟钝等特征;随着感染时间的推移,出现虫体消化道变黑等特点。最终死亡时整个虫体变黑褐色,甚至腐烂;尤其是浓度150 mg/L的晶体悬液感染的幼虫已经呈现出黑色,而对照供试幼虫却没有此种现象的出现,并且幼虫虫体死亡后仍保持白色(图6)。根据δ-内毒素的杀虫机制同时结合烟草甲幼虫的死亡特征可以表明,造成这种现象产生很可能就是伴孢晶体蛋白。当烟草甲虫取食附着有伴孢晶体的烟叶后,晶体会随着消化系统进入甲虫的碱性(pH值>10)中肠并立刻溶解。溶解后的晶体会释放某种原毒素,这种毒素会与中肠蛋白酶相结合,在共同的作用下直接穿过甲虫围食膜并激活肾小管中肠上皮细胞,与其受体完成特异性结合,然后导致体内形成大量孔洞,最终变黑死亡[28-29]。
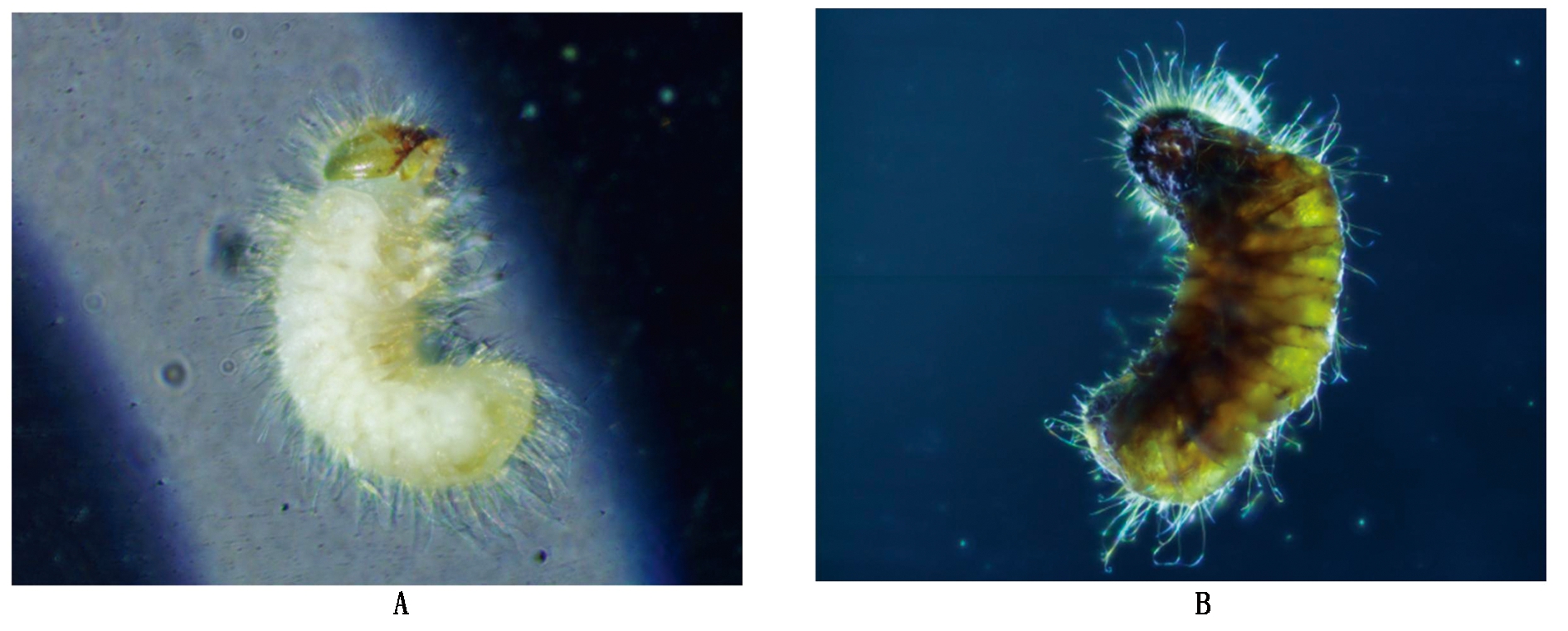
A.无菌水;B.200 mg/L Bt菌株。
A. ddH2O;B. 200 mg/L strain Bt.
图6 烟草甲虫在显微镜下的死亡形态对比
Fig.6 Comparison of the death morphology of Lasioderma serricorne under the microscope
2.4.2 对烟草甲幼虫的生物毒力效果验证 研究发现,如表3所示,烟草甲幼虫死亡率随着感染天数的增加而升高。对照处理在4 d时出现死亡现象,平均死亡数小于1头。其他4个不同浓度的晶体悬液分别感染1 d后烟草甲幼虫出现死亡现象,其中10 mg/L浓度感染后的死亡率已接近30%,其余较高浓度梯度感染后的死亡率均大于50%。150 mg/L浓度感染1 d后的校正死亡率分别是100,50,10 mg/L的1.27,1.48,2.90倍。经不同浓度梯度分别感染4 d后,对照死亡率仅为(1.11±1.72)%,平均死亡数为0.33头;最低浓度10 mg/L感染后的校正死亡率已达50%;最高浓度150 mg/L感染4 d后的校正死亡率已接近100%。该结果表明,从烟叶中分离得到的GSYC1菌株,其代谢的晶体蛋白不仅能在复配晶体悬液后于烟叶表层表现出较高的生物毒力活性,而且伴随着伴孢晶体蛋白浓度的增加,其表现出的生物毒力活性也会相应升高。
表3 不同Bt伴孢晶体蛋白浓度和处理时间对烟草甲的毒力效果(n=6)
Tab.3 The killing effect of different Bt concentration and treatment time on Lasioderma serricorne(n=6)
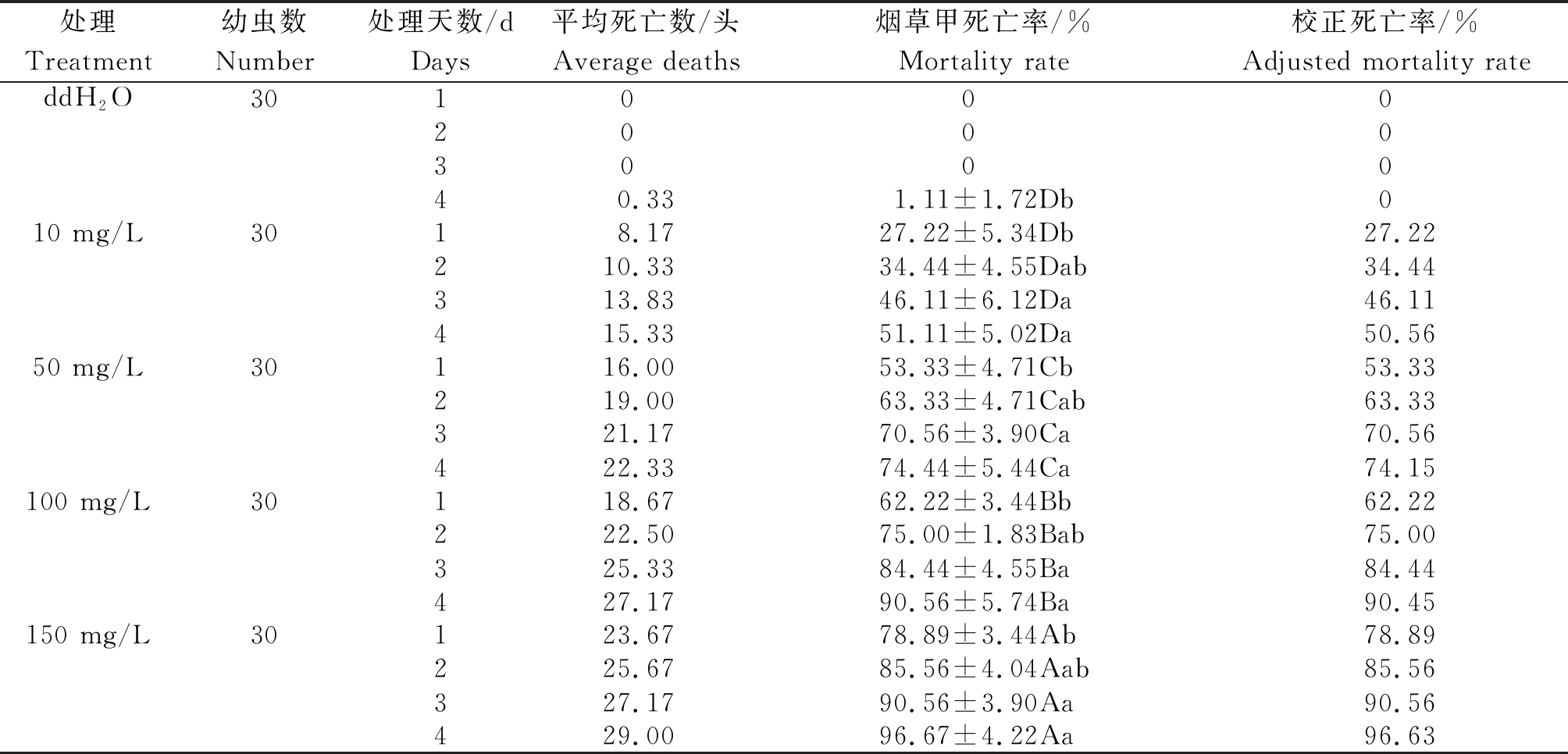
注:同行数据后不同大写字母表示不同试验浓度间差异显著(P<0.05);同列数据后不同小写字母表示不同处理天数间差异显著(P<0.05)。
Note:Different capital letters in the same line represent significant differences among different concentration in P<0.05;Different lowercase in the same column represent significant differences among different treatment days in P<0.05.
处理Treatment幼虫数Number处理天数/dDays平均死亡数/头Average deaths烟草甲死亡率/%Mortality rate校正死亡率/%Adjusted mortality rateddH2O3010002000300040.331.11±1.72Db010 mg/L3018.1727.22±5.34Db27.22210.3334.44±4.55Dab34.44313.8346.11±6.12Da46.11415.3351.11±5.02Da50.5650 mg/L30116.0053.33±4.71Cb53.33219.0063.33±4.71Cab63.33321.1770.56±3.90Ca70.56422.3374.44±5.44Ca74.15100 mg/L30118.6762.22±3.44Bb62.22222.5075.00±1.83Bab75.00325.3384.44±4.55Ba84.44427.1790.56±5.74Ba90.45150 mg/L30123.6778.89±3.44Ab78.89225.6785.56±4.04Aab85.56327.1790.56±3.90Aa90.56429.0096.67±4.22Aa96.63
3 讨论与结论
伴孢晶体是苏云金芽孢杆菌区别于其他芽孢杆菌的重要代谢特征,不同形态的伴孢晶体对昆虫的毒力表现出明显差异[30]。Li等[31]曾提出不同形状的伴孢晶体混合可能比单一有效,并抑制昆虫抗性。通过镜检观察发现,筛选出的GSYC1菌株代谢的伴孢晶体表现出大、中、小多种菱形、球形混杂的现象,这些蛋白之间可能起到相互促进的作用,与杀虫活性有一定的关联,后续研究中相关作用机理仍需进一步论证。
本研究通过分离菌株生理生化、形态、16S rDNA、基因型4个方面鉴定。结果表明:该菌株营养体细胞为杆状,生理生化特性显示与苏云金芽孢杆菌的特性相吻合,菌株的测序结果显示与苏云金芽孢杆菌ISJ33核糖体RNA部分序列的同源性高达99.93%。即分离出的GSYC1菌株是苏云金芽孢杆菌,可以代谢出毒力鳞翅目和鞘翅目的cry1菱形晶体蛋白和cry8球形晶体蛋白;22~34 h为菌株生长稳定期;24 h开始代谢伴孢晶体蛋白,其代谢过程总体呈现先升后降的趋势,在26 h代谢量达到峰值。对晶体蛋白进行分离、提取,生物毒力活性试验结果显示,使用150,100 mg/L浓度晶体蛋白感染3~4周龄的烟草甲幼虫,4 d后死亡率分别达(96.67±4.22)%,(90.56±5.74)%。烟草甲幼虫在不同浓度梯度感染后的死亡形态均变为黑褐色。伴孢晶体蛋白对烟草甲的致死率随浓度和时间的增加而逐步提高。因此,运用苏云金芽孢杆菌代谢出的伴孢晶体蛋白进行烟草甲虫的防治将会发挥很大潜力。
[1] Waright S P,Ramos M E. Characterization of the synergistic interaction between Beauveria bassiana strain GHA and Bacillus thuringiensis morrisoni strain tenebrionis applied against colorado potato beetle larvae[J]. Journal of Invertebrate Pathology,2017,144:47-57.doi:10.1016/j.jip.2017.01.007.
[2] 齐绪峰,宋纪真,Yeonho J,Byungrae J,李建洪. 苏云金芽孢杆菌防治烟草害虫研究进展[J]. 烟草科技,2006(4):58-61.doi:10.3969/j.issn.1002-0861.2006.04.016.
Qi X F,Song J Z,Yeonho J,Byungrae J,Li J H. Progress in the control of tobacco pests by Bacillus thuringiensis[J]. Tobacco Science and Technology,2006(4):58-61.
[3] 刘军. 充氮气调对烟草甲的防治效果试验[J].湖北农业科学,2016(9):2249-2251.doi:10.14088/j.cnki.issn0439-8114.2016.09.022.
Liu J. The control effect of nitrogen filling on Lasioderma serricorne[J]. Hubei Agricultural Sciences,2016(9):2249-2251.
[4] 吴彦,郭姗姗,韦建玉,张文娟,白森,邓宾玲,黄东业,白家峰,杜树山.连翘挥发油对两种烟草仓储害虫的毒杀作用[J].中国烟草科学,2016,37(3):67-78. doi:10.13496/j.issn.1007-5119.2016.03.012.
Wu Y,Guo S S ,Wei J Y,Zhang W J,Bai S,Deng B L,Huang D Y,Bai J F,Du S S. Insecticidal activities of the Forsythia suspense essential oil against two tobacco storage insects[J]Chinese Tobacco Science,2016,37(3):67-78.
[5] 崔晓,徐艳霞,刘俊杰,郭兆奎,王光华. 芽孢杆菌在农业生产中的应用[J].土壤与作物,2019,8(1):32-42. doi:10.11689/j.issn.2095-2961.2019.01.004.
Cui X,Xu Y X,Liu J J,Guo Z K,Wang G H. Progress in the control of stored grain pests by plant insecticides[J].Soils and Crops,2019,8(1):32-42.
[6] 李雪,马玉超,李煦,于慧敏,张建.苏云金芽孢杆菌伴孢晶体的研究进展[J].安徽农业科学,2012,40(10):5920-5924.doi:10.13989/j.cnki.0517-6611.2012.10.153.
Li X,Ma Y C,Li X,Yu H M,Zhang J. Research progress on spore crystal of Bacillus aureus suyun[J]. Anhui Agricultural Sciences,2012,40(10):5920-5924.
[7] Hemandez C S,Andrew R,Bel Y,Ferré J. Isolation and toxicity of Bacillus thuringiensis from Potato-growing areas in Bolivia[J]. J Invertebr Pathol,2005,88(1):8-16. doi:10.1016/j.jip.2004.10.006.
[8] 薛欢. 苏云金芽孢杆菌杀虫晶体蛋白研究及应用概述[J]. 江苏林业科技,2016,43(2):39-43. doi:10.3969/j.issn.1001-7380.2016.02.012.
Xue H. Research progress on Bacillus thuringiensis insecticidal crystal proteins[J].Journal of Jiangsu Forestry Science & Technology,2016,43(2):39-43.
[9] Romeis J,Meissle M,Bigler F.Transgenic crops expressing Bacillus thuringiensis toxins and biological control[J]. Nature Biotechnology,2006,24(1):63-71.doi:10.1038/nbt1180.
[10] Icoz I,Stotzky G. Fate and effects of insect-resistant Bt crops in soil ecosystems[J].Soil Biology and Biochemistry,2008,40(3):559-586. doi:10.1016/j.soilbio.2007.11.002.
[11] Griffiths B S,Heckmann L H,Caul S,Thompson J,Scrimgeour C,Krogh P H. Varietal effects of eight paired lines of transgenic Bt maize and near-isogenic non-Bt maize on soil microbial and nematode community structure[J]. Plant Biotechnology Journal,2007,5(1):60-68. doi:10.1111/j.1467-7652.2006.00215.x.
[12] 杨自文,吴宏文.从土壤中高效分离苏云金芽孢杆菌的方法[J].中国生物防治,2000,16(1):6-30. doi:10.16409/j.cnki.2095-039x.2000.01.008.
Yang Z W,Wu H W. A method for efficient isolation of Bacillus thuringiensis from soil[J].Chinese Journal of Biological Control,2000,16(1):6-30.
[13] 梁梅娟,苏佩冰,殷欢,陈靖欣. 苏云金芽孢杆菌的鉴定[J]. 分析检测,2018,20:129-132. doi:10.16736/j.cnki.cn41-1434/ts.2018.20.040.
Liang M J,Su P B,Yin H,Chen J X. Identification of Bacillus thuringiensis[J].Analysis and Testing,2018,20:129-132.
[14] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
Dong X Z,Cai M Y. Handbook for identification of common bacterial systems[M]. Beijing:Science Press,2001.
[15] 赵宇,刘宏伟,路杨,王一平,李娜,关宇,张正坤,杜茜. 一株对玉米螟高毒力的苏云金芽孢杆菌的鉴定及其杀虫活性[J].玉米科学,2017,25(6):148-152. doi:10.13597/j.cnki.maize.science.20170623.
Zhao Y,Liu H W,Lu Y,Wang Y P,Li N,Guan Y,Zhang Z K,Du Q. Identification and toxicity evaluation of a new Bacillus thuringiensis strain[J].Journal of Maize Sciences,2017,25(6):148-152.
[16] 吴洪福,郭淑元,李海涛,高继国.苏云金芽孢杆菌杀虫晶体蛋白结构和功能研究进展[J].东北农业大学学报,2009 ,40(2):118-122. doi:10.19720/j.cnki.issn.1005-9369.2009.02.028.
Wu H F,Guo S Y,Li H T,Gao J G. Research progress on structure and function of Bacillus thuringiensis insecticidal crystal protein[J]. Journal of Northeast Agricultural University,2009,40(2):118-122.
[17] Ben-dov E,ZaritskyA,Dahan E,Barak Z,Sinai R,Manasherob R,Khamraev A,Troitskaya E,Dubitsky A,Berezina N,Margalith Y. Extended screening by PCR for seven cry-group genes from field-collected strains of Bacillus thuringiensis[J]. Applied and Environmental Microbiology,1997,63(12):4883-4890.doi:10.1021/cen-v075n018.p036.
[18] Patricia T G,Maria M I,Benito P A,Luis J,Galán W,Ricardo G F,Reyes S,Tamez G,Cristina R P. Characterization of mexican Bacillus thuringiensis strains toxic for lepidoptera[J]. Journal of Invertebrate Pathology,2004,86(1-2):7-18. doi:10.1016/j.jip.2004.02.009.
[19] 张月,李海涛,刘荣梅,高继国. 苏云金芽胞杆菌cry2Ab34基因的克隆、表达和杀虫活性分析[J].生物技术通报,2017,33(4):185-190. doi:10.13560/j.cnki.biotech.bull.1985.2017.04.024.
Zhang Y,Li H T,Liu R M,Gao J G. Cloning,expression,and insecticidal activities of gene cry2Ab34 from Bacillus thuringiensis[J]. Biotechnology Bulletin,2017,33(4):185-190.
[20] 胡逸超,孙建生,李季刚,邹克兴,苏赞,梁伟,蔡联合,邹承武. 对烟草甲幼虫有毒杀作用的苏云金芽孢杆菌的分离与鉴定[J].基因组学与应用生物学,2019,38(11):5053-5057.doi:10.13417/j.gab.038.005053.
Hu Y C,Sun J S,Li J G,Zou K X,Su Z,Liang W,Cai L H,Zou C W. Isolation and identification of Bacillus thuringiensis strain against Lasioderma serricorne[J].Genomics and Applied Biology,2019,38(11):5053-5057.
[21] 刘臣,张丹丹,王泽宇,陈 琳,李国平,梁革梅. 棉铃虫对不同Bt蛋白的抗性及交互抗性研究[J]. 应用昆虫学报,2018,55(1):55-60. doi:10.7679/j.issn.2095-1353.2018.009.
Liu C,Zhang D D,Wang Z Y,Chen L,Li G P,Liang G M. Resistance,and cross-resistance,of Helicoverpa armigera to different Bt proteins[J].Chinese Journal of Applied Entomology ,2018,55(1):55-60.
[22] 张文飞.苏云金芽孢杆菌杀虫成分的多样性及其杀虫机理[C]//热带亚热带微生物资源遗传多样性与基因发掘利用研讨会论文集,三亚,2005:72-78.
Zhang W F. Diversity of insecticidal components of Bacillus thuringiensis and its insecticidal mechanism[C]//Proceedings of the 2005 National Wordshop on Genetic Diversity & Gene Discovery of Tropical and Subtropical Microbe Resources,Sanya,2005:72-78.
[23] Bai Y Y,Jiang M X,Cheng J A. Impacts of environmental factors on degradation of Cry 1 Ab insecticidal protein in leaf-blade powders of transgenic Bt rice[J].Agricultural Sciences in China,2007,6(2):167-174. doi:10.1016/S1671-2927(07)60031-5.
[24] Bravo A,Gill S S,Soberon M. Mode of action of Cry and Cyt toxins and their potential for insect control[J]. Toxicon,2007,49(4):423-435. doi:10.1016/j.toxicon.2006.11.022.
[25] 陆慧慧,林志强,谭万忠,罗华东,鲜菲,毕朝位,余洋,杨宇衡. 苏云金芽孢杆菌CPB012菌株的杀虫功能基因鉴定及其对害虫的控制作用[J]. 中国农业科学,2015,48(6):1112-1121. doi:10.3864/j.issn.0578-1752.2015.06.08.
Lu H H,Lin Z Q,Tan W Z,Luo H D,Xian F,Bi C W,Yu Y,Yang Y H. Insecticidal protein genes of Bacillus thuringiensis strain CPB012 and its effects in controlling different insect pests[J].Scientia Agricultura Sinica,2015,48(6):1112-1121.
[26] Asano S,Yamashita C,Lizuka T,Takeuchi K,Yamanaka S,Cerf D,Yamamoto T. A strain of Bacillus thuringiensis subsp. galleriae containing a novel cry8 gene highly toxic to Anomalacuprea(Coleoptera:Scarabaeidae)[J].Biological Control,2003,28(2):191-196. doi:10.1016/S1049-9644(03)00060-4.
[27] Elleuch J,Jaoua S,Darriet F,Chandre F,Tounsi S,Zghal R Z. Cry4Ba and Cyt1Aa proteins from Bacillus thuringiensis israelensis:Interactions and toxicity mechanism against Aedes aegypti[J]. Toxicon,2015,104:83-90. doi:10.1016/j.toxicon.2015.07.337.
[28] Chen Z W,He F,Xiao Y T,Liu C X,Li J H,Yang Y B,Ai H,Peng J X,Hong H Z,Liu K Y. Endogenous expression of a Bt toxin receptor in the Cry1Ac-susceptible insect cell lineand its synergistic effect with cadherin on cytotoxicity of activated Cry1Ac[J]. Insect Biochemistry and Molecular Biology ,2015,59:1-17. doi:10.1016/j.ibmb.2015.01.014-17.
[29] 李超峰. 苏云金芽孢杆菌杀虫活性的增效机制研究进展[J]. 生物技术进展,2018,8(1):14-20. doi:10.19586/j.2095-2341.2017.0067.
Li C F. Progress on synergistic mechanism of the insecticidal activity of Bacillius thuringiensis[J]. Current Biotechnology,2018,8(1):14-20.
[30] Chen W B,Lu G Q ,Cheng H M ,Liu C X,Xiao Y T,Xu C,Shen Z C,Soberón M,Bravo A,Wu K M. Transgenic cotton co-expressing chimeric Vip3AcAa and Cry1Ac confers effective protection against Cry1Ac-resistant cotton bollworm[J]. Transgenic Research,2017,26(6):763-774. doi:10.1007/s11248-017-0048-8.
[31] Li H,Bouwer G.Evaluation of the synergistic activities of Bacillus thuringiensis Cry proteins against Helicoverpa armigera (Lepidoptera:Noctuidae)[J]. Journal of Invertebrate Pathology,2014,121:7-13. doi:10.1016/j.jip.2014.06.005.