烟草黑胫病是由烟草疫霉(Phytophthora nicotianae)引起的一种毁灭性土传病害,常导致烟草根和茎基部坏死、植株变黄凋萎,严重影响烟草的产量和品质。烟草疫霉属于藻菌界卵菌门卵菌纲霜霉目霜疫霉科疫霉属,主要以菌丝体和厚垣孢子随病残体在土壤中越冬,翌年条件适宜时,病菌产生孢子囊和游动孢子完成初侵染,经风、雨传播进行再侵染[1-2]。烟草黑胫病在我国除黑龙江省外的其他烟区普遍发生,其中河南省为历史上的重病区,近年来随着连作烟田面积的扩大和连作年限的延长,该病害逐年加重[3-4]。目前国内外已发现烟草疫霉存在4个生理小种(0、1、2、3),我国已报道的烟草疫霉生理小种有0和1号小种[5-7],河南省以1号小种为优势小种[8-10]。近年来,DNA分子标记技术在真菌的遗传多样性分析方面得到广泛应用[11-12],已报道的河南省烟草疫霉多数菌株的遗传分化水平较低[10,13-14]。目前,对河南省烟草疫霉群体遗传结构的深入研究较少,本研究拟利用随机扩增多态性DNA(Randomly amplified polymorphic DNA,RAPD)分子标记对河南省烟草疫霉的遗传多样性与遗传结构进行系统研究,旨在明确河南省烟草疫霉群体的遗传多样性水平和遗传结构组成,为有效防控烟草黑胫病提供理论指导。
1 材料和方法
1.1 供试菌株
本研究所用的菌株由河南科技大学植物检疫实验室提供,菌株的采集信息见表1。
表1 供试烟草疫霉菌株的采集信息
Tab.1 Collecting information of tested P. nicotianae isolates
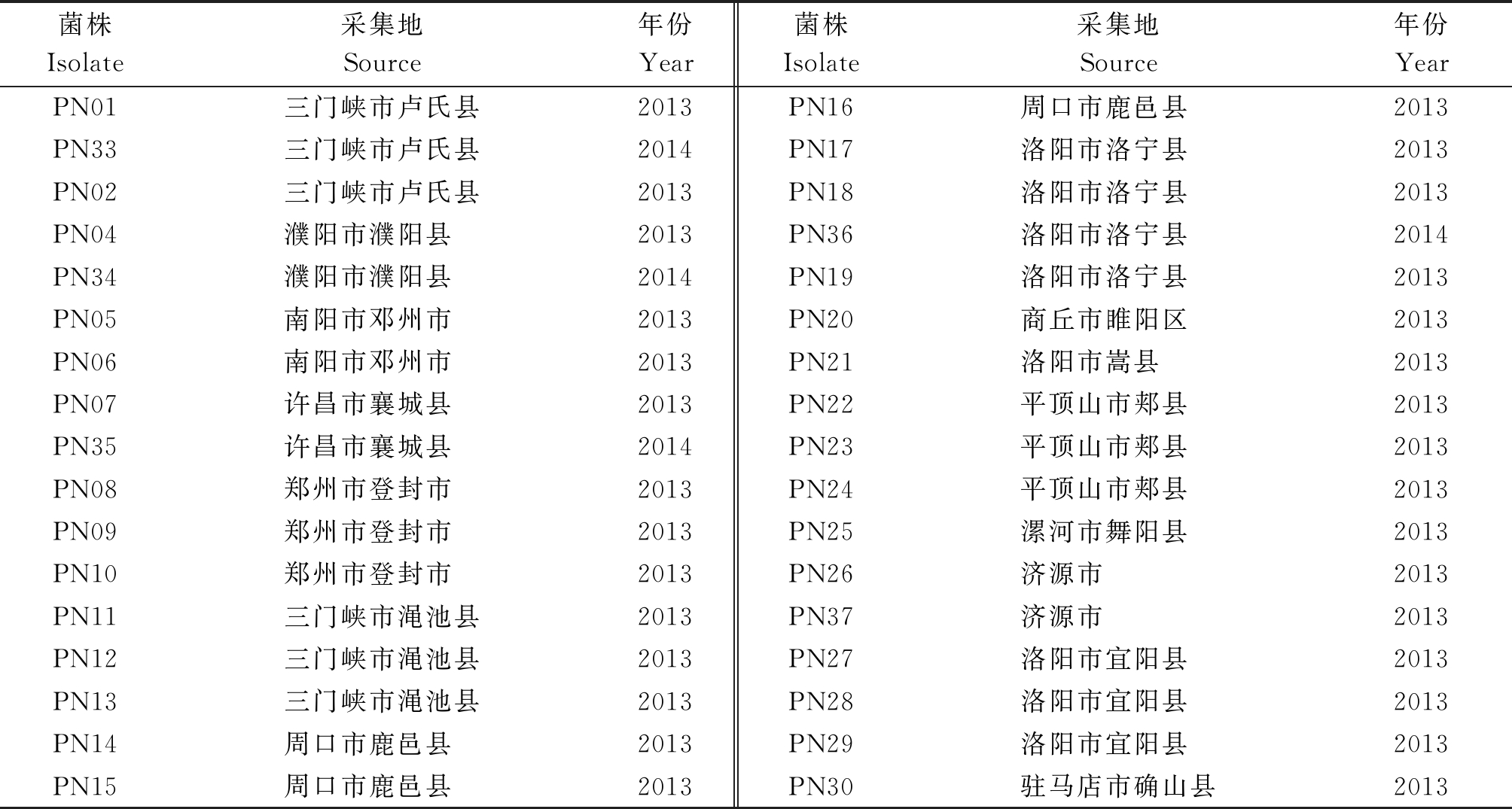
菌株Isolate采集地Source年份Year菌株Isolate采集地Source年份YearPN01三门峡市卢氏县2013PN16周口市鹿邑县2013PN33三门峡市卢氏县2014PN17洛阳市洛宁县2013PN02三门峡市卢氏县2013PN18洛阳市洛宁县2013PN04濮阳市濮阳县2013PN36洛阳市洛宁县2014PN34濮阳市濮阳县2014PN19洛阳市洛宁县2013PN05南阳市邓州市2013PN20商丘市睢阳区2013PN06南阳市邓州市2013PN21洛阳市嵩县2013PN07许昌市襄城县2013PN22平顶山市郏县2013PN35许昌市襄城县2014PN23平顶山市郏县2013PN08郑州市登封市2013PN24平顶山市郏县2013PN09郑州市登封市2013PN25漯河市舞阳县2013PN10郑州市登封市2013PN26济源市2013PN11三门峡市渑池县2013PN37济源市2013PN12三门峡市渑池县2013PN27洛阳市宜阳县2013PN13三门峡市渑池县2013PN28洛阳市宜阳县2013PN14周口市鹿邑县2013PN29洛阳市宜阳县2013PN15周口市鹿邑县2013PN30驻马店市确山县2013
1.2 DNA的提取
烟草疫霉菌株接种于10%V8液体培养基(V8汁100 mL,蒸馏水900 mL,CaCO3 3 g)中25 ℃黑暗培养,5 d后过滤收集菌丝,经液氮研磨成粉末状,然后采用CTAB法[15]提取DNA,置于-20 ℃冰箱保存备用。
1.3 RAPD-PCR反应
RAPD-PCR反应体系(25 μL):10×PCR Buffer 2.5 μL,MgCl2 (25 mmol/L) 1.5 μL,dNTPs (2.5 mmol/L) 2 μL,Taq DNA聚合酶0.25 μL,引物(10 μmol/L) 2 μL,模板DNA 0.5 μL,添加ddH2O至25 μL。反应条件为:95 ℃预变性2 min,95 ℃变性60 s,36 ℃退火60 s,72 ℃延伸2 min,36个循环,72 ℃延伸5 min,10 ℃保存。每个引物的扩增重复2~3次,PCR产物通过加入溴化乙啶的1%琼脂糖凝胶电泳检测,并拍照记录。
1.4 数据分析
将电泳图中条带的有无作为统计参数,有条带的标记为1,无条带的标记为0。使用POPGENE 1.31 软件[16]计算主要遗传多样性参数:观测等位基因数、有效等位基因数、Nei’s基因多样性指数和Shannon信息指数;采用NTSYS-pc 2.10软件[17] 计算各菌株间的遗传相似系数,并进行基于非加权平均法(Unweighted pair-group method arithmetic average,UPGMA)聚类分析和主成分分析;利用STRUCTURE2.3软件[18]基于贝叶斯模型分析烟草疫霉的遗传结构。选用混合祖先模型,设定群体数目K=1~10,不作数迭代(Length of burn-in period)为10 000次,不作数迭代后的MCMC(Markov Chain Monte Carlo)为100 000次,每个K值进行10次重复计算,参考Evanno的方法确定最适K值[19],计算Q值并绘制遗传结构图。
2 结果与分析
2.1 遗传多样性分析
采用已选定的6条RAPD引物对34个烟草疫霉菌株进行扩增,结果显示,总的DNA条带数为30个,其中多态性条带数为27个,多态性比率为90%(表2);引物RAPD04的扩增条带数和多态性条带数均最多,为9,其扩增情况见图1。利用POPGENE 1.31 软件计算得出,观测等位基因数为1.900 0,有效等位基因数为1.485 1,Nei’s基因多样性指数为0.271 0,Shannon信息指数为0.402 8。这些参数的数值整体偏低,说明河南省烟草疫霉的遗传多样性水平较低。
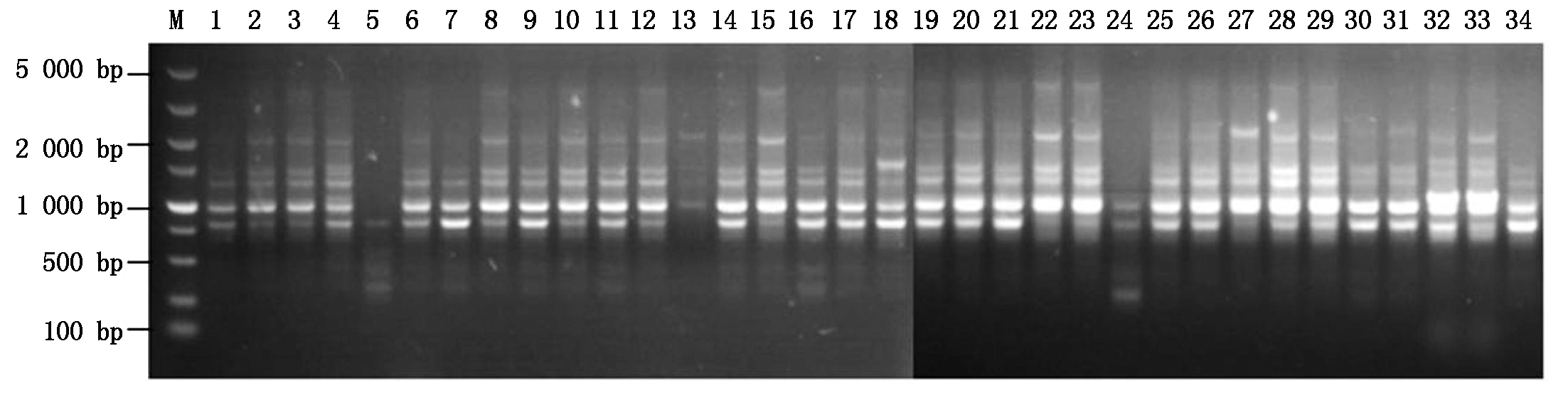
M.DL5000 DNA Marker;1-34.烟草疫霉菌株。
M.DL5000 DNA Marker; 1-34.P.nicotianae isolates.
图1 引物RAPD04对34株烟草疫霉的扩增结果
Fig.1 Amplification of 34 P. nicotianae isolates by primer RAPD04
表2 所用的RAPD引物
Tab.2 RAPD primers used
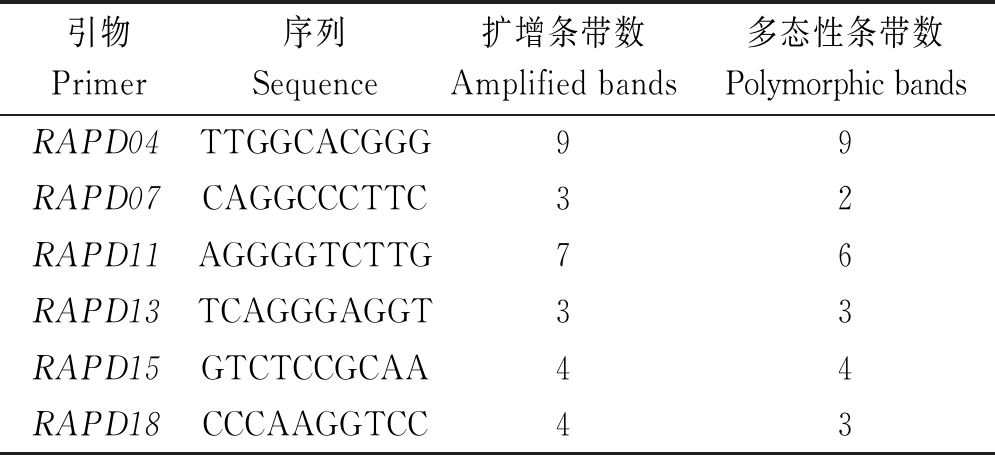
引物Primer序列Sequence扩增条带数Amplified bands多态性条带数Polymorphic bandsRAPD04TTGGCACGGG99RAPD07CAGGCCCTTC32RAPD11AGGGGTCTTG76RAPD13TCAGGGAGGT33RAPD15GTCTCCGCAA44RAPD18CCCAAGGTCC43
2.2 UPGMA聚类分析
利用NTSYS-pc 2.10软件计算34个烟草疫霉菌株之间的遗传相似系数,可知各菌株间的遗传相似系数在0.59~1.00,通过非加权平均法进行聚类分析,在遗传相似系数0.80的位置可将34个菌株划分为6个类群(图2)。类群Ⅰ包括26个菌株,占菌株总数的76.47%,为优势类群。该类群的菌株在河南省除濮阳地区以外的11个地区均有分布。类群Ⅱ仅包括PN4一个菌株,类群Ⅲ包括PN28和PN29 2个菌株,类群Ⅳ仅包括PN16一个菌株,类群Ⅴ包括PN21和PN34 2个菌株,类群Ⅵ包括PN27和PN37 2个菌株。烟草疫霉菌株之间存在着遗传相似系数为1.00的现象,例如PN2和PN33之间,PN1、PN12和PN14之间,PN13、PN19和PN20之间,PN5、PN8、PN10、PN15、PN17、PN18、PN23、PN26、PN35和PN36之间,说明这些菌株的遗传分化程度较低。
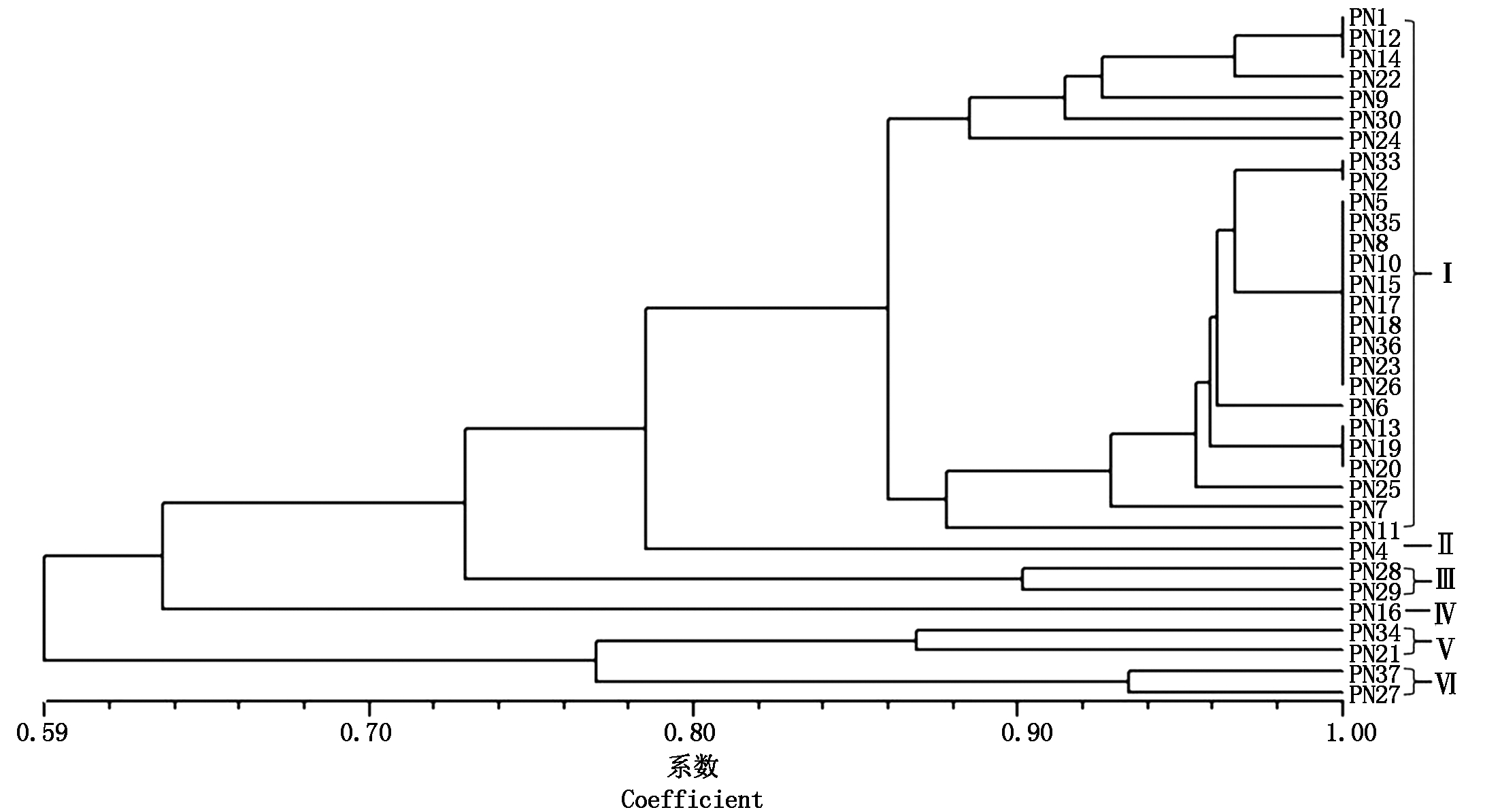
图2 34株烟草疫霉的UPGMA聚类分析
Fig.2 UPGMA dendrogram of 34 Phytophthora nicotianae isolates
2.3 主成分分析
基于RAPD标记数据对34株烟草疫霉进行主成分分析,根据第1和第2主坐标构建主成分分析二维图(图3),由图3可知,主成分分析结果和UPGMA聚类分析结果相一致,UPGMA聚类中遗传相似系数为1的菌株在主成分分析中聚为一个点,UPGMA聚类中类群Ⅰ、Ⅱ、Ⅴ、Ⅵ的菌株在主成分分析中也分别聚在4个类群,但是类群Ⅲ的PN28和PN29 2个菌株没有聚在一起,其中PN29与类群Ⅳ的PN16相距较近,可能是因为第1和第2主坐标的贡献率分别为38.66%,14.77%,还有其他因素没有考虑。
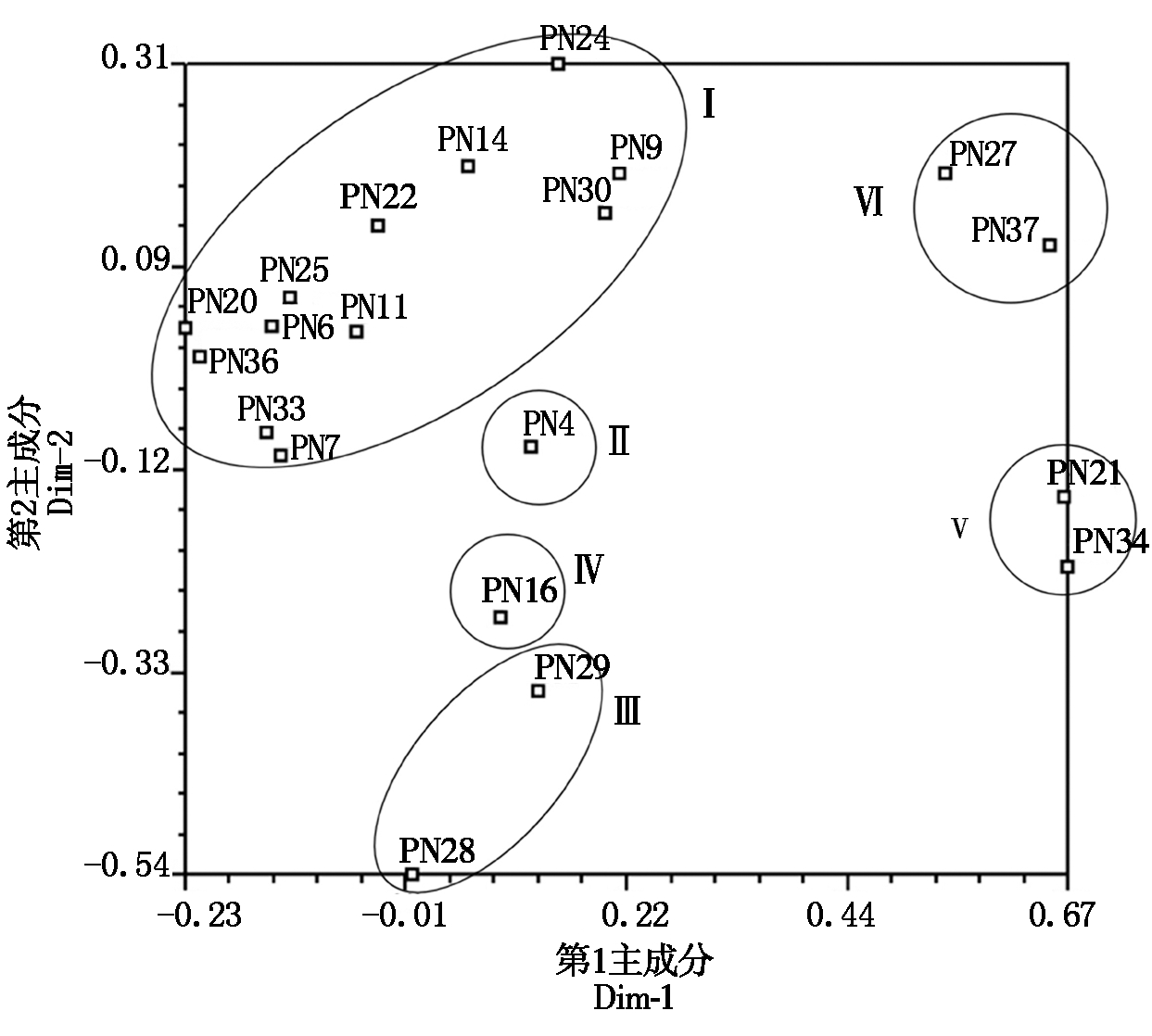
图3 34株烟草疫霉的主成分分析
Fig.3 Principal coordinate analysis of 34 P.nicotianae isolates
2.4 遗传结构分析
使用STRUCTURE软件对烟草疫霉群体遗传结构进行分析,在 K=1~10中,K=2时达到最大拟然值,因此,基于贝叶斯模型推测河南省烟草疫霉群体起源于2个祖先亚群,即亚群Ⅰ和亚群Ⅱ(图4)。从图中可以看出,河南省烟草疫霉群体中亚群Ⅰ和亚群Ⅱ所占比例分别为72.73%,27.27%,说明亚群Ⅰ为优势亚群。以50%类群属性比例作为划分依据将河南省烟草疫霉分为C1和C2 2个类群,C1类群(单个菌株中亚群Ⅰ占比超过50%)包括25个菌株,其中PN19、PN20、PN13、PN17、PN5、PN23、PN26、PN35、PN8、PN10、PN18、PN36、PN15、PN33和PN2等15个菌株中亚群Ⅰ所占比例超过95%;C2类群(单个菌株中亚群Ⅱ占比超过50%)包括9个菌株,其中PN27、PN37、PN21和PN34等4个菌株中亚群Ⅱ所占比例超过98%,因此,55.88%的烟草疫霉菌株遗传组分非常单一。

绿色色块为亚群Ⅰ; 红色色块为亚群Ⅱ。
Green represented subpopulation Ⅰ; Red represented subpopulation Ⅱ.
图4 34株烟草疫霉的遗传结构(K=2)
Fig.4 The genetic structure of 34 P.nicotianae isolates (K=2)
3 结论与讨论
本研究利用筛选获得的6条RAPD引物对来自河南省12个地区的34个烟草疫霉菌株进行分析,扩增出的条带中多态性条带比率为90%,说明河南省烟草疫霉存在一定的遗传多样性。但计算得出Nei’s基因多样性指数为0.271 0,Shannon信息指数为0.402 8,这2个指数数值偏低,同时一些菌株间的遗传相似系数为1.00,说明河南省烟草疫霉的遗传多样性处于较低水平,这与刘芳等[10]和封松利等[13]对河南省烟草疫霉遗传多样性的研究结果是一致的。
本研究利用STRUCTURE软件对河南省烟草疫霉遗传结构的进一步分析表明,河南烟草疫霉群体可能来自于2个祖先亚群,群体中亚群Ⅰ所占比例远大于亚群Ⅱ,亚群Ⅰ为优势亚群,并且超过半数菌株的遗传组分相对单一。而崔林开等[20]的研究结果显示,河南省烟草疫霉群体可能来自于3个祖先亚群,可能是由于使用的分子标记不同导致分析的位点不同,从而造成分析结果有一定的偏差,但最终的结果显示河南省烟草疫霉大多数菌株的遗传组分单一,这些菌株来自于2或3个祖先亚群,即河南省烟草疫霉群体的遗传结构较为简单。
[1] 张凯,谢利丽,武云杰,张小全,杨铁钊. 烟草黑胫病的发生及综合防治研究进展[J]. 中国农业科技导报,2015,17(4):62-70. doi:10.13304/j.nykjdb.2015.145.
Zhang K,Xie L L,Wu Y J,Zhang X Q,Yang T Z. Research progress on occurrence of tobacco black shank and its integrated control[J]. Journal of Agricultural Science and Technology,2015,17(4):62-70.
[2] 高文华,李江美. 烟草黑胫病防治研究进展[J]. 热带农业科技,2020,43(1):50-54. doi:10.16005/j.cnki.tast.2020.01.007.
Gao W H,Li J M. Advances in research of black shank control in tobacco[J].Tropical Agricultural Science & Technology,2020,43(1):50-54.
[3] 金子纯,王爱国,魏珂,赵哲. 烟草黑胫病的发病规律及综合防治技术[J]. 现代农业科技,2017(17):122-123. doi:10.3969/j.issn.1007-5739.2017.17.073.
Jin Z C,Wang A G,Wei K,Zhao Z. Occurrence regularity and integrated control techniques of tobacco black shank[J]. Modern Agricultural Science and Technology,2017(17):122-123.
[4] 孙向阳,苗圃,董昆乐,李丽华,赵世民,江凯,康业斌. 洛阳市烟草黑胫病与根腐病概述[J]. 现代农业科技,2017(5):118-119,122. doi:10.3969/j.issn.1007-5739.2017.05.079.
Sun X Y,Miao P,Dong K L,Li L H,Zhao S M,Jiang K,Kang Y B. Overview of tobacco black shank and root rot in Luoyang City[J].Modern Agricultural Science and Technology,2017(5):118-119,122.
[5] 张超群,周泽科,陈荣华,张根平,蒋军喜. 江西烟区烟草黑胫病菌生理小种研究初报[J]. 中国烟草学报,2016,22(4):107-110. doi:10.16472/j.chinatobacco.2014.463.
Zhang C Q,Zhou Z K,Chen R H,Zhang G P,Jiang J X. Preliminary report of research on Phytophthora parasitica physiological races in tobacco growing areas in Jiangxi province[J]. Acta Tabacaria Sinica,2016,22(4):107-110.
[6] Gallup C A,McCorkle K L,Ivors K L,Shew D. Characterization of the black shank pathogen,Phytophthora nicotianae,across North Carolina tobacco production areas[J]. Plant Disease,2018,102(6):1108-1114. doi:10.1094/PDIS-02-17-0295-RE.
[7] 赵百英. 烟草黑胫病研究进展[J]. 乡村科技,2016(17):84-85. doi:10.19345/j.cnki.1674-7909.2016.17.051.
Zhao B Y. Research progress on tobacco black shank[J]. Xiangcun Keji,2016(17):84-85.
[8] 王智发,刘延荣,谢成颂,张广民,陈瑞泰. 我国烟草黑胫病菌生理小种鉴定[J]. 山东农业大学学报,1987,18(1):1-8.
Wang Z F,Liu Y R,Xie C S,Zhang G M,Chen R T. Identification of races of Phytophthora parasitica var. nicotianae in China[J].Journal of Shandong Agricultural University,1987,18(1):1-8.
[9] 苗圃,王海涛,李淑君,康业斌. 河南省烟草黑胫病菌生理小种鉴定[J]. 西北农业学报,2013,22(10):204-207. doi:10.7606/j.issn.1004-1389.2013.10.036.
Miao P,Wang H T,Li S J,Kang Y B. Identification of physiological race of Phytophthora parasitica var. nicotianae in Henan Province[J].Acta Agriculturae Boreali-occidentalis Sinica,2013,22(10):204-207.
[10] 刘芳,奚家勤,董洪旭,牟文君,马聪,徐敏,宋纪真,胡利伟. 河南植烟区烟草黑胫病菌生理小种的鉴定及遗传多样性分析[J]. 烟草科技,2016,49(6):15-21. doi:10.16135/j.issn1002-0861.20160603.
Liu F,Xi J Q,Dong H X,Mou W J,Ma C,Xu M,Song J Z,Hu L W. Genetic diversity analysis and physiological race identification of Phytophthora parasitica var. nicotinanae in Henan tobacco planting areas[J].Tobacco Science & Technology,2016,49(6):15-21.
[11] Atallah Z K,Subbarao K V. Population biology of fungal plant pathogens,in plant fungal pathogens[M].New Jersey:Humana Press,2012.doi:10.1007/978-1-61779-501-5_20.
[12] 张蕊,于琳,李国庆,张静.基于RAPD标记分析葡萄孢属类似真菌Amphobotrys ricini的遗传多样性[J]. 华中农业大学学报,2018,37(5):32-39. doi:10.13300/j.cnki.hnlkxb.2018.05.005.
Zhang R,Yu L,Li G Q,Zhang J. RAPD-based analysis of genetic diversity of Botrytis-like fungus Amphobotrys ricini[J]. Journal of Huazhong Agricultural University,2018,37(5):32-39.
[13] 封松利,蒋士君,宋鹏宇,王海涛,邢国珍,康业斌,李淑君,郑文明. 基于线粒体及核DNA序列的河南烟草黑胫病菌群体遗传多样性分析[J]. 中国农业大学学报,2014,19(6):16-22. doi:10.11841/j.issn.1007-4333.2014.06.03.
Feng S L,Jiang S J,Song P Y,Wang H T,Xing G Z,Kang Y B,Li S J,Zheng W M. Population genetic diversity of Phytophthora parasitica var. nicotianae in Henan Province of China revealed by nuclear and mitochondrial DNA sequencing[J]. Journal of China Agricultural University,2014,19(6):16-22.
[14] 崔林开,高鹏飞,刘精精,康业斌,胡艳红,赵启美. 烟草疫霉SSR分子标记的开发与初步应用[J]. 植物病理学报,2018,48(4):474-481. doi:10.13926/j.cnki.apps.000175.
Cui L K,Gao P F,Liu J J,Kang Y B,Hu Y H,Zhao Q M. Development of SSR markers for Phytophthora nicotianae and its preliminary application[J].Acta Phytopathologica Sinica,2018,48(4):474-481.
[15] Ippolito A,Schena L,Nigro F. Detection of Phytophthora nicotianae and P. citrophthora in citrus roots and soils by nested PCR[J]. European Journal of Plant Pathology,2002,108(9):855-868. doi:10.1023/A:1021208106857.
[16] Yeh F C,Yang R C,Boyle T. Popgene (version 1.31) quick user guide[Z]. Canada:University of Alberta and Centre for International Forestry Research,1999.
[17] Rohlf F J. NTSYS-pc:Numerical taxonomy and multivariate analysis system (version 2.10) user guide[Z]. New York:State University of New York,2004.
[18] Pritchard J K,Stephens M,Donnelly P. Inference of population structure using multilocus genotype data[J]. Genetics,2000,155(2):945-959.
[19] Evanno G,Regnaut S,Goudet J. Detecting the number of clusters of individuals using the software STRUCTURE:a simulation study[J]. Molecular Ecology,2005,14(8):2611-2620. doi:10.1111/j.1365-294X.2005.02553.x.
[20] 崔林开,赵珊珊,高鹏飞,郭金利,康业斌,胡艳红. 河南省烟草黑胫病菌群体遗传结构的SSR分析[J]. 中国烟草学报,2018,24(5):51-56. doi:10.16472/j.chinatobacco.2017.395.
Cui L K,Zhao S S,Gao P F,Guo J L,Kang Y B,Hu Y H. Genetic structure analysis of Phytophthora nicotianae population in Henan province by SSR marker[J]. Acta Tabacaria Sinica,2018,24(5):51-56.