新疆独特的气候和自然条件有利于辣椒(Capsicumm annuum)产业的发展。新疆日照长、气候干燥、多晴少雨、昼夜温差大,有利于光合作用和养分积累,辣椒品质优异,辣椒红色素、维生素C含量高,具有发展辣椒产业得天独厚的自然优势。辣椒产业已经成为新疆具有国内市场竞争优势的特色产业,已形成完整的产业链体系,也是我国区域农业经济参与国际市场竞争的典范,对实现新疆农业产业结构调整、促进农民增收、带动地方经济发展具有重要意义。
辣椒病毒病发病周期短、流行速度快,给新疆辣椒产业造成了严重的经济损失。近年来,随着南疆辣椒种植面积的逐年增加和种植年限延长,在喀什地区疏附县、疏勒县、英吉沙县等地辣椒病毒病的发生及危害程度日趋加重。已知世界各地陆续报道的辣椒病毒有70种以上[1-3],而我国报道的已达20余种,其中RNA病毒主要有辣椒轻斑驳病毒(Pepper mild mottle virus,PMMoV)、辣椒脉黄化病毒(Pepper vein yellows virus,PeVYV)、红辣椒脉斑驳病毒(Chilli veinal mottle virus,ChiVMV)、番茄花叶病毒(Tomato mosaic virus,ToMV)、番茄斑萎病毒(Tomato spotted wilt virus,TSWV)、番茄褪绿病毒(Tomato chlorosis virus,ToCV)、番茄斑驳花叶病毒(Tomato mottle mosaic virus,ToMMV)、 番茄不孕病毒(Tomato aspermy virus,TAV)、黄瓜花叶病毒(Cucumber mosaic virus,CMV)、烟草花叶病毒(Tobacco mosaic virus,TMV)、烟草轻型绿花叶病毒(Tobacco mild green mosaic virus,TMGMV)、烟草扭脉病毒(Tobacco vein distorting virus,TVDV)、烟草丛顶病毒(Tobacco bushy top virus,TBTV)、马铃薯X病毒(Potato virus X,PVX)、马铃薯Y病毒(Potato virus Y,PVY)、芜菁花叶病毒(Turnip mosaic virus,TuMV)、苜蓿花叶病毒(Alfalfa mosaic virus,AMV)、蚕豆萎蔫病毒(Broad bean wilt virus,BBWV)等,DNA病毒主要有番茄黄化曲叶病毒(Tomato yellow leaf curl virus,TYLCV)等[4-10]。
本试验对在新疆喀什地区采集到的辣椒病毒病样本进行分子生物学鉴定,以明确引起喀什辣椒病毒病的病毒种类,为针对性地控制该病害的发生提供科学依据。
1 材料和方法
1.1 试验材料
2018-2019年,在新疆喀什辣椒主产区调查辣椒病毒病发生情况,采集辣椒植株表现为心叶发黄皱缩、卷曲、花叶、植株矮化等症状的叶片样本,以及斑驳症状的果实样本,分别装在采集袋中,保存于-80 ℃冰箱,用于核酸提取的后续试验。
植物RNA提取试剂TRIzol、Taq DNA聚合酶购自北京全式金生物技术有限公司;反转录试剂盒FastQuant RT Kit购自北京天根生物科技有限公司;2 × TaqMix购自北京博迈德科技有限公司。
1.2 供试引物信息
本试验所使用辣椒病毒病分子检测特异性引物共19种,引物信息见表1。
表1 辣椒病毒病分子检测的引物信息
Tab.1 Primers used for detecting virus of the peper virus diseases

病毒引物引物序列(5'-3')PCR产物/bp参考文献VirusPrimerSequenceFragment sizeReference PVYPVY-FGCTCTAGAAGTTTGGGTTATGATGGAT-GGGGATG420[10]PVY-RCGGAATTCAATCACCCTGCCACCTCTATToMVToMV-1ATGTCTTACTCAATCACTTC480 [11]ToMV-2TTAAGATGCAGGTGCAGAGGTMVTMV-1CTGTTTAGCCGGTTTGGT470[12]TMV-2TCCCTTTACGGACATCACCMVCMV-FCGTTTAGTGACTTCAGACAG735 [13]CMV-RATGGACAAATCTGAATCAACTSWVTSWV-1AACCCCGAACATTTCATAGA425 [14]TSWV-2TCAGACAGGATTGGAGCCACTYLCVTYLCV-1TAATCATTTCCACGCCCGTCTCG648 TYLCV-2GGTTCTCATACTTGGCTGCCTCCTToCVToCV-FGGTTTGGATTTTGGTACTACATTCAGT450 [15]ToCV-RAAACTGCCTGCATGAAAAGTCTCPVXPVX-1AGTGGTATGGAACTGGATG308 [16]PVX-2TTATGGTGGTGGTAGAGTGAToMMVToMMVdFCTGGAGAAGACTGGGTCTAG 1 193 [17]ToMMVdR TTCGGTAAGTTCAATGGGACCT AMVAMVdF GTGCGTATAGATGCCGGTTC 900 AMVdR GAGCGAATAGGACTTCATACC ChiVMVChiVMVdF GGAAARGCNCCNTAYAT 790 ChiVMVdR CGCGCTAATGACATATCGGT TAVTAVdFATGGCCCAAAACGGTACGG 657 TAVdRTCACACCGGGAGCGTTGAAGPeVYVPeVYVdFCGTGGAAGCGTGCTACTCG 579 PeVYVdR CTCATCAGTGAAGACTCGACC
表1(续)

病毒引物引物序列(5'-3')PCR产物/bp参考文献VirusPrimerSequenceFragment sizeReference TMGMVTMGMVdF GAGGAAATTGAGGATAATGTAAGTG 700 TMGMVdR ACGCCATACCACAGTATACAC CGMMVCGMMVdF ATGGCTTACAATCCGATCAC 481 CGMMVdRCTAAGCTTTCGAGGTGGTAGCTuMVTuMVdF TAAACGGAATGTGGGTGATGATGG 377 TuMVdRGTCCTCGGTCGTATGCCTTTCC PMMoVPMMoV-F CTACCCATGGCATACACAGTTACCAGTG 472 PMMoV-RGGAATTCAGGAGTTGTAGCCCACGTAATBTVTBTVdF TACCACACCTAAACAGCGTTG 1 049 TBTVdR CTCATCTCCCGCTAAGTCAG BBWVR2F-FTTGAACCCGGAAAAAGGGAGTGTG1 300 [18]R2F-RTTGCTAGGYCCAGGYAAATTGTA
1.3 植物总DNA、RNA提取及反转录
取发病的叶片和果实样本,加液氮研磨成粉末状,根据试剂盒说明从辣椒样品中提取总 RNA、DNA。以辣椒感病样本总RNA为模板,以各病毒特异性引物的下游引物为反转录引物,使用反转录试剂盒(北京天根生物)合成病毒cDNA。反转录反应体系(10 μL)为:模板RNA 2 μL,5 × gDNA Buffer 2 μL,Rnase-Free H2O 6 μL,42 ℃温浴3 min,立即置于冰上2 min,再加入以下试剂:Primer Mix 2 μL,RT-Enzyme Mix 1 μL,10 × Fast RT-Buffer 2 μL,RNase-Free H2O 5 μL,总体积20 μL。42 ℃温浴15 min,再 95 ℃温浴3 min,然后立即置于冰上保存。
1.4 RT-PCR检测
将反转录得到的cDNA或DNA分别用辣椒病毒病特异性引物(表1)进行检测。PCR反应体系(20 μL)为:上下游引物各0.5 μL,模板cDNA或DNA 1 μL,2×Taq PCR Master Mix 10 μL,ddH2O补足。PCR扩增条件为:94 ℃预变性4 min;94 ℃变性30 s,X ℃(根据表1中各病毒检测引物的Tm值设定)退火30 s,72 ℃延伸45 s,共35个循环;72 ℃补充延伸10 min。1.5%琼脂糖凝胶电泳检测PCR产物。利用NCBI核酸数据库进行Blast(http://blast.ncbi.nlm.nih.gov/)序列比对,根据同源性确定病毒种类。
2 结果与分析
2.1 辣椒疑似病株的田间症状
2018-2019年,新疆喀什部分地区辣椒病毒病发生严重,棚室及露地辣椒病毒病植株症状表现多样,有的植株心叶皱缩、丛生,叶片上卷,增厚变脆,植株矮化,早期感病植株矮化明显(图1-A);有的植株叶片表现为斑驳或黄绿相间的花叶症状,同时伴随心叶缩小(图1-B);果实症状明显,呈现深绿及浅绿相间的不规则斑驳(图1-C)。

A.心叶缩小、丛生,叶片上卷,植株矮化;B.叶片不规则褪绿变黄;C.果实褪绿斑。
A.Small leaves,rolled up and plants dwarf;B.Irregular chlorosis and yellowing of leaves;C.Chlorotic spot of fruit.
图1 疑似辣椒病毒病植株症状表现
Fig.1 Symptoms of suspected virus-infected pepper
2.2 辣椒疑似病毒病样本分子检测
分别提取16份疑似辣椒病株样品的总RNA、DNA,以其为模板,利用不同辣椒病毒的特异性引物(表1)进行RT-PCR扩增。结果表明:只有引物CMV-F/CMV-R和PMMoV-F/PMMoV-R,在病椒样品中分别扩增出大小约为735,472 bp的特异条带(图2),其他病毒种类均未检出。测序后经Blast比对,扩增出大小约为735 bp特异条带的分离物与GenBank上登录的CMV的相似性均达到99.0%以上,扩增出大小约为472 bp特异条带的分离物与GenBank上登录的PMMoV的相似性均达到99.0%以上。因此,表明喀什地区辣椒疑似病毒病样本被CMV与PMMoV复合侵染。
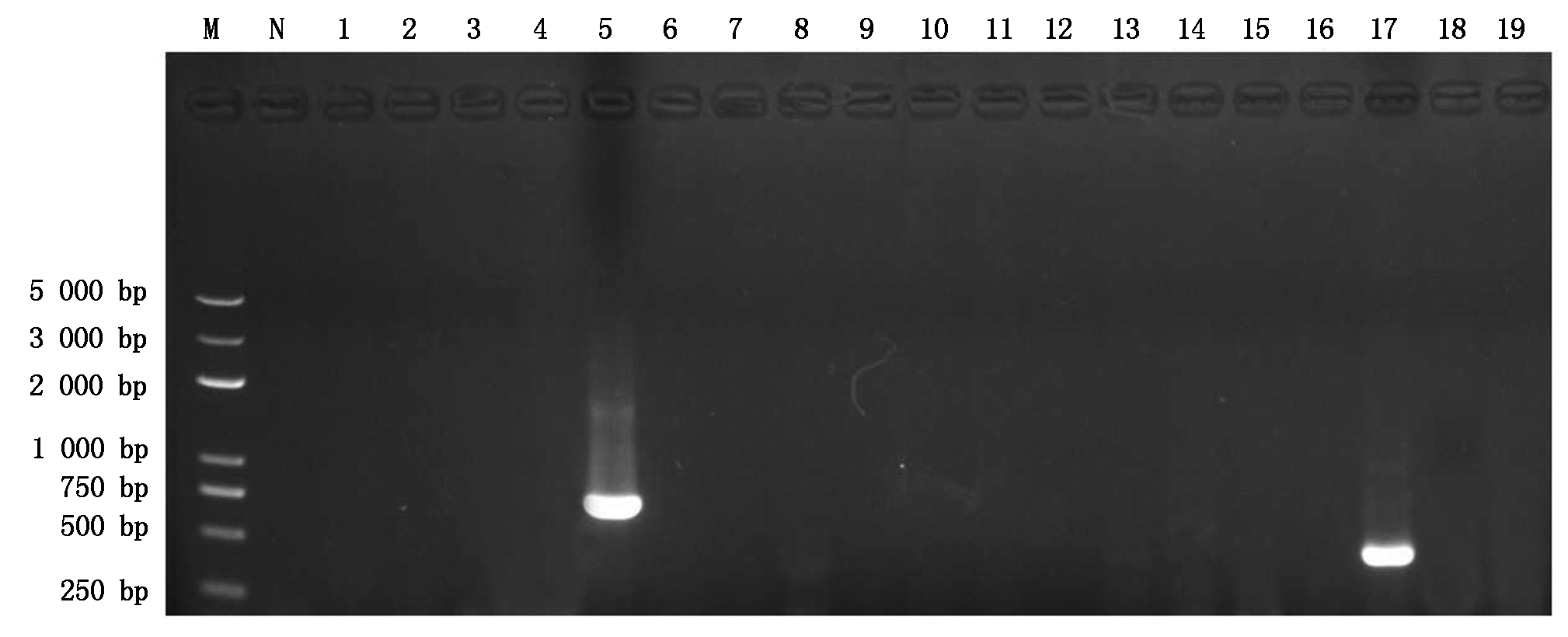
M.分子质量标准BM5000 DNA Marker;N.阴性对照;1.番茄花叶病毒;2.烟草花叶病毒;3.番茄斑驳花叶病毒;4.马铃薯Y病毒;5.黄瓜花叶病毒;6.苜蓿花叶病毒;7.红辣椒脉斑驳病毒;8.番茄不孕病毒;9.番茄斑萎病毒;10.马铃薯X病毒;11.辣椒脉黄化病毒;12.烟草轻型绿花叶病毒;13.黄瓜花叶病毒;14.芜菁花叶病毒;15.番茄黄化曲叶病毒;16.番茄褪绿病毒;17.辣椒轻斑驳病毒;18.烟草丛顶病毒;19.蚕豆萎蔫病毒。
M.BM5000 DNA Marker;N.ddH2O;1.ToMV;2.TMV;3.ToMMV;4.PVY;5.CMV;6.AMV;7.ChiVMV;8.TAV;9.TSWV;10.PVX;11.PeVYV;12.TMGMV;13.CGMMV;14.TuMV;15.TYLCV;16.ToCV;17.PMMoV;18.TBTV;19.BBWV.
图2 新疆喀什辣椒病毒病样本不同引物PCR扩增结果
Fig.2 PCR amplification of susupected virus-infected peper samples using different primers
2.3 CMV和PMMoV聚类分析结果
利用 Mega 5.10软件的 Phylogeny方法,将得到的CMV分离物和PMMoV核苷酸序列与GenBank中有代表性的相应分离物序列进行比对。结果显示,新疆地区辣椒分离物与CMV核酸序列有较高的相似性,并且与韩国西葫芦分离物(GU327368.1)在同一分支上,相似性达到95%,而与同一属的其他CMV的相似性较远;而PMMoV序列聚类分析显示,新疆地区PMMoV分离物与日本辣椒分离物(AB276030.1)形成一大分支,亲缘关系最近(99%)(图3)。
3 结论与讨论
新疆特别是喀什地区,具有高温、干旱的气候条件,有利于辣椒植株进行光合作用和养分积累,提高品质,但同时也适合病毒病的发生和繁殖蔓延。通过对在喀什地区采集的表现病毒病症状的辣椒样品进行总RNA提取、RT-PCR检测和系统发育分析,结果表明,新疆喀什辣椒病毒病样品被CMV和PMMoV复合侵染。
黄瓜花叶病毒CMV属于雀麦花叶病毒科(Bramoviridae)黄瓜花叶病毒属(Cucumovirus)成员,是已知的寄主范围最多、分布最广、最具经济重要性的植物病毒之一,主要借助蚜虫以非持久性的方式进行传播,也可通过种子或者汁液摩擦等进行传播。近年来,黄瓜花叶病毒在全国各地对辣椒的危害日益严重,主要危害叶片和果实,引起辣椒植株矮化、花叶、皱缩、果实畸形,造成严重减产[19-20]。
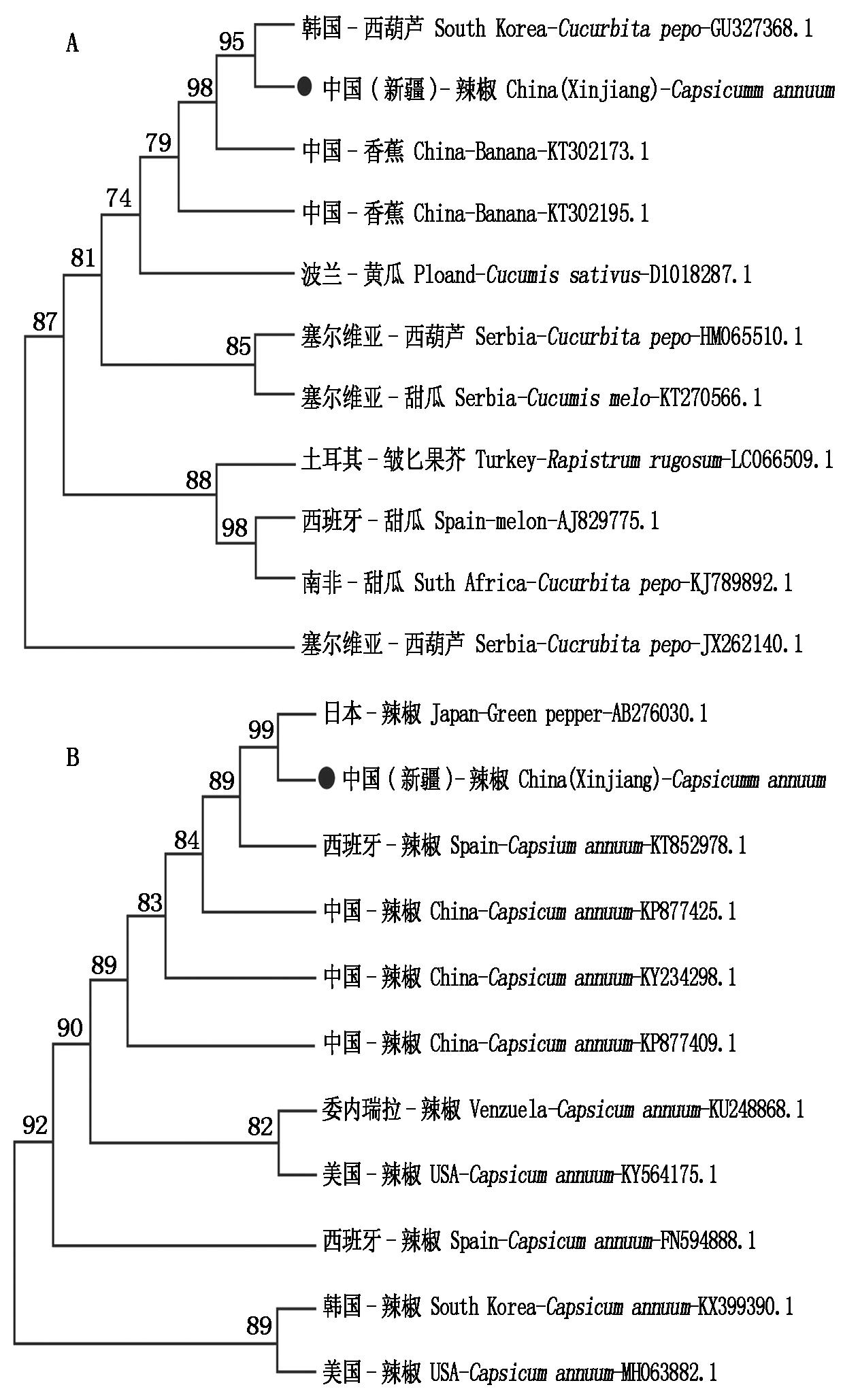
图3 基于CMV(A)和PMMoV(B)基因组部分核酸序列的系统进化树
Fig.3 Phylogeny tree based on partial nucleotide sequences of CMV and PMMoV
辣椒轻斑驳病毒PMMoV属于烟草花叶病毒属(Tobamovirus)成员,是辣椒上的重要病毒种类之一,主要通过种子和汁液摩擦传毒,危害叶片和果实,初期症状不明显或呈现轻度褪绿、皱缩,严重时会出现斑驳或黄绿相间的花叶症状,果实呈现褐色坏死斑、条纹或浅黄色斑驳,失去商品性和食用价值,在全世界范围内严重威胁辣椒产业发展。1994年,我国在新疆辣椒上首次发现PMMoV[21],随后相继扩展至陕西、山东、北京等地,在个别地区已成为辣椒首要病毒病[22-23]。
近年来,2种或多种病毒复合侵染造成病毒病的现象在田间发生普遍[4,24-25]。寄主植物在田间位置不动,其在整个生育期可能会受到不同病毒的多次复合侵染,复合侵染方式包括交叉保护作用、协生作用和干扰作用等[26]。交叉保护作用是指先入侵的病毒保护寄主植物,使其不受另一种病毒的感染;协生作用是指2种异源病毒同时侵染寄主植物,产生比其中任何一种病毒单独侵染更为严重的症状;干扰作用往往会导致2种异源病毒对寄主植物的侵染均受到一定的影响。病毒对寄主植物的协生作用通常发生在亲缘关系较远的2种病毒之间,本研究CMV和PMMoV复合侵染辣椒的作用方式是否为协生作用,还有待进一步确定。但鉴于侵染辣椒的病毒种类较多,需要对喀什辣椒病毒病的发生及危害情况等进行详细调研,以制定有效的防治策略,减少病毒病侵染造成的经济损失。
[1] Koeda S, Homma K, Kamitani M, Mari Kamitani, Nagano A J, Taniguchi M, Pohan N, Kesumawati E. Pepper vein yellows virus 9: a novel polerovirus isolated from chili pepper in Indonesia[J]. Archives of Virology Volume,2020,165(12): 3017-3021. doi:10.1007/s00705-020-04838-6.
[2] Liu M Y,Liu X N,Li X,Zhang D Y,Dai L Y,Tang Q J. Complete genome sequence of a Chinese isolate of Pepper vein yellows virus and evolutionary analysis based on the CP,MP and RdRp coding regions[J].Archives of Virology,2016,161(3):677-683. doi:10.1007/s00705-015-2691-9.
[3] Li Y Y,Wang Y,Hu J,Xiao L,Tan G L,Lan P X,Liu Y,Li F. The complete genome sequence,occurrence and host range of Tomato mottle mosaic virus Chinese isolate[J]. Virology Journal,2017,14:15. doi:10.1186/s12985-016-0676-2.
[4] 冯耿,辛敏,曹孟籍,王莉爽,李莉,王锡锋. 深度测序发现贵阳发生的辣椒病毒病由多种病毒复合侵染所致[J]. 植物病理学报, 2017,47(5): 591-597. doi:10.13926/j.cnki.apps.000113.
Feng G,Xin M,Cao M J,Wang L S,Li L,Wang X F. Identification of multiple viruses infecting hot pepper in Guiyang by deep sequencing[J].Acta Phytopathologica Sinica,2017,47(5):591-597.
[5] 赵尊练,史联联,谭根堂,严小良. 陕西省辣椒主产区辣椒病毒病病原种类鉴定及其分布研究[J]. 中国农业科学,2004,37(11):1738-1742. doi:10.3321/j.issn:0578-1752.2004.11.028.
Zhao Z L, Shi L L, Tan G T, Yan X L. Study on pepper (Capsicum annuum L.) virus disease and its distribution in the Guanzhong area of Shaanxi Province[J].Scientia Agricultura Sinica,2004,37(11):1738-1742.
[6] 陈青,廖富荣,陈红运,谢毅璇,陈加福,蔡金镭,林石明. 辣椒上烟草轻型绿花叶病毒的鉴定[J]. 植物病理学报,2013,43(6):651-654. doi:10.13926/j.cnki.apps.2013.06.012.
Chen Q,Liao F R,Chen H Y,Xie Y X,Chen J F,Cai J L,Lin S M. Identification of Tobacco mild green mosaic virus infecting pepper[J]. Acta Phytopathologica Sinica,2013,43(6):651-654.
[7] 龚明霞,赵虎,王萌,吴星,赵曾菁,黄金梅,何志,王日升. 广西辣椒病毒病调查及病原种类初步鉴定[J]. 中国蔬菜, 2020(4): 74-79.
Gong M X,Zhao H,Wang M,Wu X,Zhao Z J,Huang J M,He Z,Wang R S. Investigation and preliminary identification of pathogeny species of pepper virus disease in Guangxi[J]. China Vegetables ,2020(4):74-79.
[8] 姚玉荣,陈国华,冯兰香,谢丙炎. 北运蔬菜基地辣椒病毒病病原种类的分子检测[J]. 中国蔬菜,2013(10):84-89. doi:10.3969/j.issn.1000-6346.2013.10.014.
Yao Y R,Chen G H,Feng L X,Xie B Y. Molecular detection of pepper viruses in southern vegetable production bases[J]. China Vegetables, 2013(10):84-89.
[9] 郭思瑶,童艳,黄娅,罗信福,青玲. 重庆辣椒病毒病病原初步鉴定和分析[J]. 园艺学报,2015,42(2):263-270. doi:10.16420/j.issn.0513-353x.2014-0774.
Guo S Y,Tong Y,Huang Y,Luo X F,Qing L. Preliminary identification and analyses of viruses causing pepper virus disease in Chongqing,China[J].Acta Horticulturae Sinica,2015,42(2):263-270.
[10] 高苇,王勇,张春祥,张安盛,竺晓平. 天津地区辣椒病毒病调查及毒源种类初步鉴定[J]. 山东农业科学,2016,48(3):91-94. doi:10.14083/j.issn.1001-4942.2016.03.023.
Gao W,Wang Y,Zhang C X,Zhang A S,Zhu X P. Investigation and pathogen preliminary identification of pepper virus disease in Tianjin[J]. Shandong Agricultural Sciences,2016,48(3):91-94.
[11] 王少立,谭玮萍,杨园园,代惠洁,孙晓辉,乔宁,竺晓平. 山东省辣椒主要病毒种类的分子检测与鉴定[J]. 中国农业科学,2017,50(14):2728-2738. doi:10.3864/j.issn.0578-1752.2017.14.009.
Wang S L,Tan W P,Yang Y Y,Dai H J,Sui X H,Qiao N,Zhu X P. Molecular detection and identification of main viruses on pepper in Shandong Province[J]. Scientia Agricultural Sciences,2017,50(14):2728-2738.
[12] Ge B B, Liu G J, Wang H Q. First report of Tomato mosaic virus infecting pepino in China[J].Plant disease,2012,96(11):1704. doi:10.1094/PDIS-05-12-0475-PDN.
[13] Niu Y B, Qing L, Yao M, Wang, D F, Liu J D, Wang J S.First report of Tobacco mosaic virus in Abutilon theophrasti in China[J]. Plant Disease,2009,93(11):1221. doi:10.1094/PDIS-93-11-1221B.
[14] 宋婷婷, 陈荣溢, 杨雷亮.应用多重RT-PCR检测烟草上的TMV和CMV[J]. 辽宁农业科学,2007(1):53-54. doi:10.3969/j.issn.1002-1728.2007.01.019.
Song T T,Chen R Y,Yang L L. Detection of TMV and CMV in tobacco by multiplex RT-PCR[J].Liaoning Agricultural Sciences,2007(1):53-54.
[15] 陈利达,石延霞,谢学文,曹金强,柴阿丽,李宝聚. 我国不同地区番茄主要病毒病种类的分子检测与分析[J]. 华北农学报,2020,35(1):185-193. doi:10.7668/hbnxb.20190230.
Chen L D,Shi Y X,Xie X W,Cao J Q,Chai A L,Li B J. Molecular detection and analyses of main viruses on tomato in China[J].Acta Agriculturae Boreali-Sinica,2020,35(1):185-193.
[16] Dovas C I,Katis N I,Avgelis A D. Multiplex detection of criniviruses associated with epidemics of a yellowing disease of tomato in Greece[J]. Plant Disease,2002,86(12):1345-1349. doi:10.1094/PDIS.2002.86.12.1345.
[17] 孙琦,张春庆. 马铃薯X病毒的RT-PCR检测[J]. 园艺学报,2003,30(6):687-689. doi:10.3321/j.issn:0513-353X.2003.06.011.
Sun Q,Zhang C Q. Detection of Potato virus X by reverse transcription polymerase chain reaction[J].Acta Horticulturae Sinica,2003,30(6):687-689.
[18] 刘勇,李凡,李月月,张松柏,高希武,谢艳,燕飞,张安盛,戴良英,程兆榜,丁铭,牛颜冰,王升吉,车海彦,江彤,史晓斌,何自福,吴云锋,张德咏,青玲,严婉荣,杨学辉,汤亚飞,郑红英,唐前君,章松柏,章东方,蔡丽,陶小荣. 侵染我国主要蔬菜作物的病毒种类、分布与发生趋势[J].中国农业科学,2019,52(2):239-261. doi:10.3864/j.issn.0578-1752.2019.02.005.
Liu Y ,Li F,Li Y Y,Zhang S B,Gao X W,Xie Y,Yan F,Zhang A S,Dai L Y,Cheng Z B,Ding M,Niu Y B,Wang S J,Che H Y,Jiang T,Shi X B,He Z F,Wu Y F,Zhang D Y,Qing L,Yan W R,Yang X H,Tang Y F,Zheng H Y,Tang Q J,Zhang S B,Zhang D F,Cai L,Tao X R. Identification,distribution and occurrence of viruses in the main vegetables of China[J]. Scientia Agricultura Sinica,2019,52(2):239-261.
[19] 张建云,许文博,刘升学,黄家风. 侵染加工番茄的BBWV2的分子鉴定及田间检测[J]. 石河子大学学报(自然科学版),2013,31(6):675-679. doi:10.3969/j.issn.1007-7383.2013.06.003.
Zhang J Y,Xu W B,Liu S X,Huang J F. ldentification and detection of Broad bean wilt virus 2(BBWV2)infecting processing tomato[J]. Journal of Shihezi University (Natural Science),2013,31(6):675-679.
[20] 于海龙,张正海,曹亚从,张宝玺,王立浩. 辣椒抗黄瓜花叶病毒病研究进展[J]. 园艺学报,2019,46(9):1813-1824. doi:10.16420/j.issn.0513-353x.2019-0489.
Yu H L,Zhang Z H,Cao Y C,Zhang B X,Wang L H. Progress of resistance to Cucumber mosaic virus in pepper[J]. Acta Horticulturae Sinica,2019,46(9):1813-1824.
[21] 向本春, 谢浩, 崔星明, 李春, 刘素萍, 席德慧, 尹玉琦. 新疆辣椒轻微斑驳病毒的分离鉴定[J]. 病毒学报, 1994, 10(3): 240-245. doi:10.13242/j.cnki.bingduxuebao.000860.
Xiang B C, Xie H, Cui X M, Li C, Liu S P, Xi D H, Yin Y Q.Isolation and identification of Pepper mildmottle tobamo virus in Xinjiang[J]. Chinese Journal of Virology, 1994, 10(3): 240-245.
[22] 郭广君,刁卫平,刘金兵,潘宝贵,戈伟,王述彬. 辣椒抗黄瓜花叶病毒病研究进展[J]. 华北农学报,2014,29(S1):77-84. doi:10.7668/hbnxb.2014.S1.017.
Guo G J,Diao W P,Liu J B,Pan B G,Ge W,Wang S B. Research process of resistance to Cucumber mosaic virus in pepper[J]. Acta Agriculturae Boreali-Sinica,2014,29(S1):77-84.
[23] 李晓冬,吴元华. 辣椒轻斑驳病毒研究进展[J]. 生态学杂志,2016,35(10):2831-2837.doi:10.13292/j.1000-4890.201610.018.
Li X D,Wu Y H. Research progress on Pepper mild mottle virus[J]. Chinese Journal of Ecology,2016,35(10):2831-2837.
[24] 于海龙,靳远,刘婧,张宝玺,张正海,曹亚从,王立浩. 我国辣椒病毒病发生情况及发展趋势-基于2018年和2019年辣椒主产区的调查[J]. 中国蔬菜, 2020 (9): 25-30.
Yu H L, Jin Y, Liu J, Zhang B X, Zhang Z H, Cao Y C, Wang L H. Occurrence and development trend of pepper virus disease in China-based on main pepper producing areas investigation in 2018 and 2019[J]. China Vegetables, 2020 (9): 25-30.
[25] Chai A L,Chen L D,Li B J,Xie X W,Shi Y X. First report of a mixed infection of Tomato mottle mosaic virus and Tobacco mild green mosaic virus on eggplants in China[J]. Plant Disease,2018,102(12):2668. doi:10.1094/PDIS-04-18-0686-PDN.
[26] 鲁瑞芳, 李为民, 彭学贤. 植物病毒协生作用及其分子机理[J]. 中国病毒学,2001,16(3):195-201.
Lu R F,Li W M,Peng X X. Molecular mechanism of synergism of plant virus[J]. Virologica Sinica,2001,16(3):195-201.