重金属镉广泛存在于土壤,为作物非必需元素。镉元素易通过植物 Fe2+、Zn2+、Mn2+、Ca2+ 等元素的离子运输通道协同运输进入植株,被植株吸收并积累,通过食物链进入人体而危害人类健康,镉的过量积累已成为全球重大环境问题之一[1-5]。作物对镉吸收、运输、转运和积累的规律已被广泛揭示,根际土壤中的镉元素被根系吸附,通过质外体和共质体2种途径进入根细胞,当根际土壤中的镉过量时,植物会启动趋利避害措施来降低镉的毒害作用:一方面根系会通过镉的质外体和共质体运输途径的调节阻止镉的摄入[6],如细胞壁是植物抵抗重金属毒性的第一道屏障,根系的细胞壁可与镉、铅等重金属结合并将其固定,细胞壁上有许多带负电成分,纤维素、半纤维素、果胶和蛋白质组分等,能结合镉离子而限制镉的跨膜转运,从而减轻重金属元素积累对跟细胞的毒害,在细胞壁的镉阻滞过程发挥着重要作用[7];另一方面,从根系吸收的镉主要储存在根细胞液泡等部位并被固定,以减少向地上部的运送[4,8-11],液泡占据了植物成熟细胞的大部分体积,是植物细胞解毒的重要细胞器[12],液泡可通过质膜上的离子转运蛋白,将胞浆中的镉转运入液泡,并通过中和反应将游离的镉元素固定与隔离,从而降低其在胞浆中的浓度,阻滞镉元素转运往其他组织器官,最大限度降低镉元素对植株的毒害作用[13-14]。
植物在长期的适应过程中逐步形成特定的自我解毒机理,大部分植物不同部位镉的积累符合根>茎>叶的基本规律,但是不同作物间由于对镉的应答策略不同,各组织与器官间镉积累存在较大差异,甚至同一作物各品种间也存在高富集和低富集生态类型,这种差异多数受遗传因素的影响[4]。一些Fe2+、Zn2+和Ca2+等离子通道转运体家族如重金属转运ATP酶AtHMA3[15]、Ca2+ 特异性运输蛋白CAXs[16]、天然抵抗力相关巨噬细胞蛋白家族NRAMPs[17]、多向耐药性相关蛋白AtPDR8[18]、螯合素类镉结合性转运蛋白PCs[19]、转运蛋白OsZIP1[20]以及一些胁迫反应基因参与了植物体内镉积累的调控[21-24],如超积累生态型景天中,SaHMA3在地上部的表达量要明显高于根部,过表达SaHMA3显著提高了烟草植物对镉的耐性和积累量,却抑制了镉从根部向地上部的转运,而NRAMP家族5个基因在景天不同生态型植株中不同组织器官之间表达差异较大[25]。镉胁迫会诱导甘薯产生胁迫响应来减少毒害作用,如叶片总叶绿素含量减少、膜脂过氧化产物丙二醛含量升高、超氧阴离子产生速率增加、过氧化氢含量升高、SOD、CAT活性先上升后下降、POD活性在处理期间一直处于上升趋势[26]。
研究发现甘薯(Ipomoea batatas L.)储藏根的镉积累量低于吸收根及地上部茎叶[27],且薯肉镉含量远低于薯皮镉含量[28],因而甘薯在镉污染耕地的综合利用中具有广阔的应用前景。土壤中镉元素被甘薯根系吸收后,通过韧皮部向地上部和食用根转运,地上部茎叶有向薯肉运输镉的能力,不同品种之间根系的镉吸附能力、薯肉镉含量与地上部茎叶镉含量比值、薯肉镉含量与吸收根镉含量的比值存在较大差异[29-31]。笔者前期研究发现甘薯不同生长部位镉含量随着根际土壤镉含量的增加而增加,甘薯镉积累受根系镉的质外体和共质体运输途径的共同调节,在1.0 μmol Cd2+的水培条件下,呼吸抑制剂CCCP或DNP处理能有效降低根系对镉的摄入[32]。进一步分析发现不同组织与器官之间镉积累速率存在较大差异,甘薯薯肉中的镉主要来源于地上部的转运,而不是直接从薯皮运送进入薯肉,但是薯肉的镉低积累特性仍不明确[32]。
为进一步明确甘薯镉积累与分配方式,本研究比较了在镉中度污染土壤(0.6 mg/kg)和镉重度污染土壤(2.0 mg/kg)的生长条件下(土壤环境质量标准GB15618)甘薯各组织器官镉分配与积累的时空差异,分析了与之对应的甘薯中镉积累相关同源基因的表达差异,明确了甘薯各组织器官间镉积累特性与镉积累应答方式,以解析薯肉镉低积累形成的机制。
1 材料和方法
1.1 试验材料与生长条件
试验材料为湘薯20号。试验在长沙市芙蓉区湖南省农业科学院实验基地温室大棚内完成,平均年日照时数约为1 600 h。盆栽用花盆口径为55 cm,高40 cm,每盆装土量基本一致,以低于盆口3 cm位置为准,每盆栽插3株薯苗,盆栽用土壤使用氯化镉溶液配制。薯苗生长期间按照大田管理办法实施,使用的化肥镉含量符合肥料中镉限量标准(GB/T23349-2009)的规定。
盆栽用土壤来源于同一地块,平均全镉含量为0.20 mg/kg,pH值5.3。土壤自然干燥后粉碎,用网孔口径为4.75 mm的筛网去除砾石等杂物,按1∶10的重量比加入所需氯化镉母液,充分搅拌混匀,每周1次,持续5周,配制过程在大棚内完成,避免雨水直接冲洗土壤。分别在配制前与试验结束后取土样检测镉含量,确定土壤Cd最终浓度为(0.21±0.03)mg/kg(阴性对照)、(0.62±0.13)mg/kg、(2.01±0.19)mg/kg,pH值5.3±0.5。
在甘薯生长前期不同时间点镉积累差异分析试验中,统一使用等重量未添加镉的土壤,使用的花盆不漏底。在移栽后第30天,每盆添加等量氯化镉溶液并加清水浇透,之后及时浇水保持土壤湿润。
1.2 取样时间与取样方法
甘薯不同组织部位镉分布及基因表达差异分析试验于2016年5月12日移栽,生长136 d以后取样,2017年5月19日移栽,生长139 d以后取样,2018年5月22日移栽,生长131 d以后取样。薯肉膨大期不同时间点镉积累差异分析试验分别于2017年5月19日移栽,2018年5月22日移栽,2019年5月13日移栽,在移栽后60 d开始取样,每20 d取一次样,直至生长至180 d。甘薯生长前期不同时间点镉积累差异分析试验分别于2017年5月19日移栽,2018年5月22日移栽,2019年5月13日移栽,在移栽后第30天开始取样,取样时间为0 h,2 h(0.083 d),6 h(0.25 d),12 h(0.5 d),1 d,2 d,3 d,4 d,6 d,9 d,14 d,28 d。
镉含量检测用样品的取样方法为:①吸收根,在土壤含水量较高时小心将盆土倒出,轻轻抖落根系附着的土壤,大量清水冲掉残留土壤后,用0.5 mmol/L的EDTA溶液浸洗3次,吸水纸去掉表面流水,取2 g须根鲜样,直接测镉含量。②薯肉,取3个大中薯(单个薯质量大于100 g)清洗干净,用刀剥离薯块外周皮层,分别将薯皮与薯肉切丝后,各取100 g,105 ℃杀青30 min,70 ℃烘干至恒质量,测取干率。③茎段,分别取接近地表第2个茎节段往上5 cm茎段、中间5 cm茎段与顶叶下第2个茎节往下5 cm茎段,剥离获得外周皮与中柱,各取2 g鲜样,直接测镉含量。④叶片,顶叶下第2个茎节位置叶片,取叶片中间1/3和叶柄中段各2 g鲜样,直接测镉含量。⑤地上部混合样,取地上部第2个茎节位置以上所有茎叶,大量清水冲洗干净后,阴凉处凉至无明显流水,切碎后取100 g茎叶,105 ℃杀青30 min,70 ℃烘干至恒质量,测取干率。
基因表达差异用样品取样与镉含量检测用样品的取样同时进行,取样部位与取样方法一致,获取样品后迅速至于液氮并及时转移到-80 ℃超低温冰箱冻存。
1.3 样品镉含量检测
按照食品安全国家标准食品中镉的测定(GB 5009.15-2014)进行检测,硝化仪为天津LABOTERY 公司的XJS36-42W,原子吸收光谱仪为德国Analytik Jena AG 公司的ZEEnit 700P。每批72个样品中含有2个标准物质(GB 5009.15-2014)和2个空白样品进行质量比对。
1.4 镉吸收与转运相关候选基因及qPCR引物
从https://www.ncbi.nlm.nih.gov/数据库及参考文献中筛选植物镉积累调控相关的基因,在 http://sweetpotato.plantbiology.msu.edu/blast.shtml数据库中利用Blast工具获得甘薯基因组中镉积累调控相关基因的同源基因序列,并利用Beacon designer 7软件设计qPCR引物。胁迫响应相关基因IbCAT3、IbGST、IbPOD、IbSOD、IbAPX、内参基因IbTubulin引物直接根据参考文献使用的引物序列[33]。引物由武汉奥科鼎盛生物科技有限公司合成,引物信息见表1。
1.5 基因表达分析
使用植物TRNzol RNA提取试剂盒(中国北京天根)提取植株的根、茎和叶中提取总RNA,并用反转录试剂盒(TaKaRa PrimeScript RT Master Mix)合成cDNA。定量实时PCR(qRT PCR)采用SYBR Premix Ex-Taq(Tli RNaseH Plus;中国北京TaKaRa)和瑞士罗氏诊断公司LightCycler®960实时定量PCR系统检测基因表达水平。
1.6 数据统计与分析
薯肉等干样镉含量按照干率换算成鲜质量镉含量,计算公式为:鲜质量镉含量=干粉镉含量×干率/100。
表1 qPCR引物信息
Tab.1 Primer information for qPCR

引物名称Primer name引物序列Primer sequence引物名称Primer name引物序列Primer sequenceIbNRAMP-1F5'-GAGCACTGTAGAAAGGAATA-3'IbNRAMP-1R5'-GTGGTATTTTGAAGAGCATG-3'IbNRAMP-2F5'-TCTGCTTAAGGATTCTCTAG-3'IbNRAMP-2R5'-AACCCCTGCATTATATACTG-3'IbNRAMP-3F5'-AGCAGATATTCAGGAGGTTA-3'IbNRAMP-3R5'-GAGAGCCATAGTTGAAATAAG-3'IbPDR-1F5'-ACCAGAATGATGTTTGTGAA-3'IbPDR-1R5'-GCTCATCCATGAAGATAATAGA-3'IbPDR-2F5'-CTCAGGAAATGAGAGATCAG-3'IbPDR-2R5'-GTCTCCATCAATGTATCCAC-3'IbXCD1F5'-GGGTACGAGATAATCTTGAG-3'IbXCD1R5'-CACACTTGAATGATCCAATC-3'IbHMA1F5'-CTTGCTTGATTGTCATCTTC-3'IbHMA1R5'-GACTCTGTATGAGAGGATTTG-3'IbHMA2F5'-GCTCATCACATTCATTCTTC-3'IbHMA2R5'-CCTGGAAGGATCTTAATCAC-3'IbHMA3F5'-CTTGCTTCTTGTTGTAATCC-3'IbHMA3R5'-CCTCAATGCTAGATAATGTTG-3'IbHMA4F5'-CCGATAAGATCAGAGAACTG-3'IbHMA4R5'-GAGGTTGTTCTTGATGAGAA-3'IbH(+)-ATPaseF5'-GGACCCTTACACTAAACAAG-3'IbH(+)-ATPaseR5'-CAGACAACATCCCAACAATA-3'IbCa2+-ATPaseF5'-AGAGCAGTTTGCTAATGAAG-3'IbCa2+-ATPaseR5'-CCACAATTCCTATACAAGTGTA-3'IbZIP3F5'-CTGCGGGTATACTAATTTAC-3'IbZIP3R5'-CCTACTTTTGTGTATCTATAATAAC-3'IbZIP5F5'-CACTGGAATCACTAAAGTAC-3'IbZIP5R5'-AACCCAACATTTCTGTATTG-3'IbZIP7F5'-GGGTTGTGAGTAAGAAATTAG-3'IbZIP7R5'-GAGACACCAATTTCTGTTTC-3'IbCAX1F5'-CGTTGAAGAATGGAATGATG-3'IbCAX1R5'-CTGGACTTTGTGGTAATGAA-3'IbCAX2F5'-TGGTGAAATACTCCCTCTTG-3'IbCAX2R5'-TCTGCTCCTTCTTGATATTG-3'IbPCS1F5'-GCAAGGATGATAAGGTAGAA-3'IbPCS1R5'-CTCTGTGTCTTAATCGTACA-3'IbLCDF5'-CCGATGACTTCTTCCTTAAC-3'IbLCDR5'-CAGCAGTAGTAGCATTATCC-3'IbMTPF5'-CACCTCTCGTAAATAAAGAA-3'IbMTPR5'-GACTGTTAAGATCCCTTTAC-3'IbMTPBF5'-CGCAACAAGAATACAATACG-3'IbMTPBR5'-GCATCAGTTAAAACAGCAAG-3'IbAPXF5'-CTCGACACTACCACTCCTATCT-3'IbAPXR5'-CGTGACTCCACCGACAAATAA-3'IbSODF5'-ACATCACGGTTGGAGAAGATG-3'IbSODR5'-TCGGGATCACCATGAACAAC-3'IbPODF5'-GGCGGAGGATGCTGTTAAT-3'IbPODR5'-GGGAAGGATGAGAAGGTTGAAG-3'IbCAT3F5'-GTTCGGTTCTCCACTGTTATCC-3'IbCAT3R5'-CACCAGATCAAAGTTACCCTCTC-3'IbGSTF5'-CGGTGTTGAGAGTCTTGG-3'IbGSTR5'-AGGAAATGTGGTTGTTTGTG-3'IbTubulinF5'-CTCAAGAGGGTCTCAGCAATAC-3'IbTubulinR5'-TGTCAAGTAACGCCCATGTC-3'
qPCR按照相对定量值进行分析,以非污染土壤中生长的植株所对应组织部位为对照,采用2-ΔΔCT法计算相关基因表达[34]。
统计显著性用IBM SPSS Statistics 23软件进行显著性差异检验,采用Compare Means中One-way ANOVA步骤,Duncan计算法进行分析,结果以平均值±s(标准差)表示,P值小于0.01。qPCR数据先用10的对数进行归一化换算,再用HemI 1.0软件绘制基因表达差异分析的热图,3次生物学重复数据同时在热图中显示。不同时间点镉积累数据分析使用Graphpad Prism 8.0软件进行绘制。
2 结果与分析
2.1 甘薯中镉元素的空间积累特性
以平均镉含量为0.2 mg/kg的土壤栽培(二级土壤)为对照CK,比较分析了镉含量为0.6 mg/kg(中度污染)及镉含量为2.0 mg/kg(重度污染)的土壤盆栽条件下湘薯20号甘薯不同组织或器官的镉含量(表2)。在土壤镉含量为0.2 mg/kg栽培(CK)条件下,各组织器官之间鲜质量镉含量不存在极显著差异;在土壤镉含量为0.6 mg/kg及土壤镉含量为2.0 mg/kg的栽培条件下,甘薯吸收根、茎下段部位镉含量均显著高于地上部各组织器官及薯肉,除下段茎外的地上部其他组织器官及薯肉之间镉含量差异较小;甘薯镉积累在空间上符合吸收根>茎下段>茎中段>薯皮>茎上段>叶、薯肉的规律。随着土壤镉含量的增加,各组织或器官镉积累量逐渐增加,相对于对照,土壤镉含量为0.6 mg/kg的栽培条件下,各组织或器官镉含量增加倍数为3.05~8.75,茎中段镉含量增长倍数最高;土壤镉含量为2.0 mg/kg的栽培条件下,各组织或器官镉积累量增加倍数为6.25~26.89,吸收根中镉浓度增长倍数最高,叶片镉浓度增长倍数最低,此时薯肉中镉浓度增长倍数仅次于吸收根与茎下段周皮,上升较快。随着土壤镉含量的增加,仅土壤镉含量为2.0 mg/kg的栽培条件下吸收根与茎下段-周皮部位镉富集指数有显著上升,各组织或器官镉积累的富集指数变化较小;与之相反,随着土壤镉含量的增加,各组织器官的转运系数均出现明显下降。试验结果说明,土壤中的镉元素被甘薯吸收后,按照地下部向地上部转运的方向镉积累逐渐减弱,大部分被吸收的镉积累于吸收根与茎下段位置;甘薯薯块中薯皮与薯肉之间镉积累存在较大差异,推测薯皮仍具有吸收根矿质元素吸收与转运的功能,薯肉为主要的储藏器官,具有镉元素低吸收、低积累的特性。
2.2 镉积累相关基因甘薯中同源基因检索与分析
从参考文献中筛选出部分镉积累调控相关的基因。其中AtPDR8、AtCAX1、AtPCS1、OsMTP1、AtMTPB、IbXCD1等蛋白在拟南芥、水稻等植物中,一方面参与了根系细胞膜镉元素的分泌外排,另一方面将细胞过量镉元素转运至液泡内,通过质体特殊的隔离与固定作用来降低过量镉离子的毒害作用;而OsNRAMP1、OsZIP1、AtHMA3、H(+)-ATPase、Ca2+-ATPase 1等蛋白可以通过钙、锌、锰等离子的协同运输完成镉离子的吸收与富集;IbCAT3、IbGST、IbPOD、IbSOD、IbAPX等蛋白酶基因主要参与了植物的胁迫响应。在甘薯基因组数据库中进行比对,发现这些离子通道蛋白基因在拟南芥与甘薯等作物之间具有较高的同源性,推测在高等植物中,这类基因在功能上具有较高的保守性。由于甘薯为异源六倍体作物,分析发现这类基因存在多个重复性拷贝,但目前欠缺基因功能分析的数据(表3)。
表2 甘薯不同位点镉含量
Tab.2 Cadmium concentration in different sites of sweetpotato
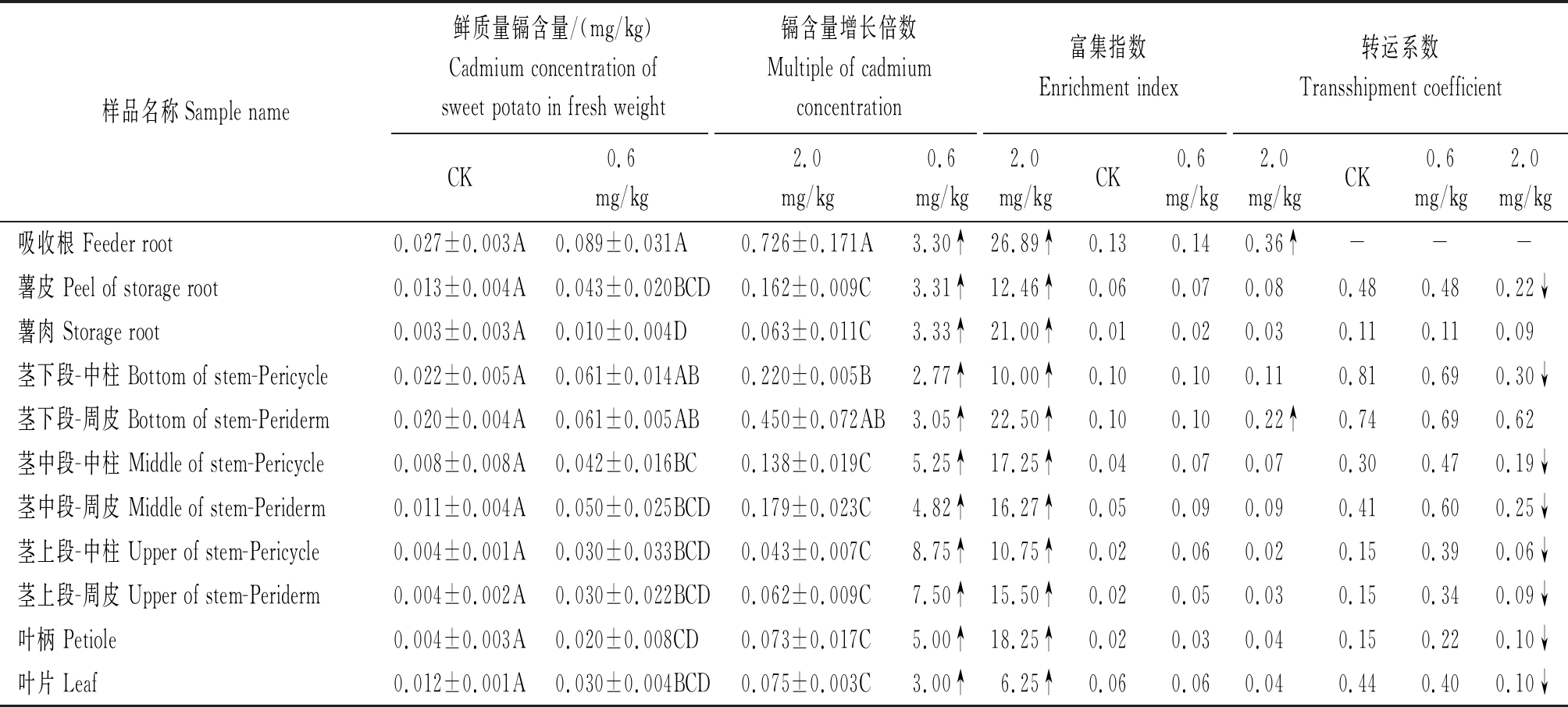
注:各样本镉含量数据为3 a重复数据的平均值,使用“均值±方差”的表示方式,后缀字母为P=0.01时显著性差异分析结果,显著上升或下降指标用“↑”或者“↓”表示。
Note:The cadmium concentration data of each sample is the average value of 3 years repeated data,which were expressed in "mean ± variance",P =0.01,the significant difference analysis results are indicated by "↑" or "↓".
样品名称Sample name鲜质量镉含量/(mg/kg)Cadmium concentration ofsweet potato in fresh weight镉含量增长倍数Multiple of cadmiumconcentration富集指数Enrichment index转运系数Transshipment coefficientCK0.6mg/kg2.0mg/kg0.6mg/kg2.0mg/kgCK0.6mg/kg2.0mg/kgCK0.6mg/kg2.0mg/kg吸收根 Feeder root0.027±0.003A0.089±0.031A0.726±0.171A3.30↑26.89↑0.130.140.36↑---薯皮 Peel of storage root0.013±0.004A0.043±0.020BCD0.162±0.009C3.31↑12.46↑0.060.070.080.480.480.22↓薯肉 Storage root0.003±0.003A0.010±0.004D0.063±0.011C3.33↑21.00↑0.010.020.030.110.110.09茎下段-中柱 Bottom of stem-Pericycle0.022±0.005A0.061±0.014AB0.220±0.005B2.77↑10.00↑0.100.100.110.810.690.30↓茎下段-周皮 Bottom of stem-Periderm0.020±0.004A0.061±0.005AB0.450±0.072AB3.05↑22.50↑0.100.100.22↑0.740.690.62茎中段-中柱 Middle of stem-Pericycle0.008±0.008A0.042±0.016BC0.138±0.019C5.25↑17.25↑0.040.070.070.300.470.19↓茎中段-周皮 Middle of stem-Periderm0.011±0.004A0.050±0.025BCD0.179±0.023C4.82↑16.27↑0.050.090.090.410.600.25↓茎上段-中柱 Upper of stem-Pericycle0.004±0.001A0.030±0.033BCD0.043±0.007C8.75↑10.75↑0.020.060.020.150.390.06↓茎上段-周皮 Upper of stem-Periderm0.004±0.002A0.030±0.022BCD0.062±0.009C7.50↑15.50↑0.020.050.030.150.340.09↓叶柄 Petiole0.004±0.003A0.020±0.008CD0.073±0.017C5.00↑18.25↑0.020.030.040.150.220.10↓叶片 Leaf0.012±0.001A0.030±0.004BCD0.075±0.003C3.00↑6.25↑0.060.060.040.440.400.10↓
表3 镉积累相关基因信息
Tab.3 Summary of genes related to cadmium accumulation
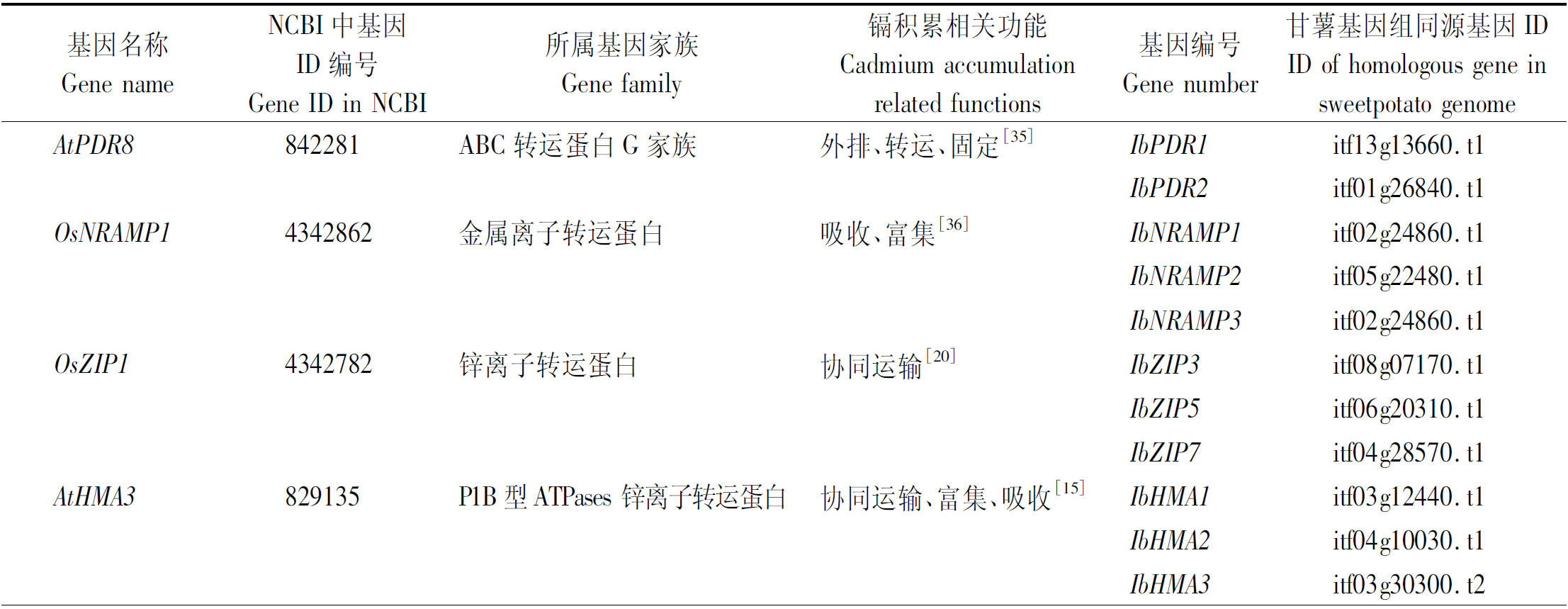
基因名称Gene nameNCBI中基因ID编号Gene ID in NCBI所属基因家族Gene family镉积累相关功能Cadmium accumulationrelated functions基因编号Gene number甘薯基因组同源基因IDID of homologous gene insweetpotato genomeAtPDR8842281ABC转运蛋白G家族外排、转运、固定[35]IbPDR1itf13g13660.t1IbPDR2itf01g26840.t1OsNRAMP14342862金属离子转运蛋白吸收、富集[36]IbN-RAMP1itf02g24860.t1IbN-RAMP2itf05g22480.t1IbN-RAMP3itf02g24860.t1OsZIP14342782锌离子转运蛋白协同运输[20]IbZIP3itf08g07170.t1IbZIP5itf06g20310.t1IbZIP7itf04g28570.t1AtHMA3829135 P1B型ATPases 锌离子转运蛋白协同运输、富集、吸收[15]IbHMA1itf03g12440.t1IbHMA2itf04g10030.t1IbHMA3itf03g30300.t2
表3(续)

基因名称Gene nameNCBI中基因ID编号Gene ID in NCBI所属基因家族Gene family镉积累相关功能Cadmium accumulationrelated functions基因编号Gene number甘薯基因组同源基因IDID of homologous gene insweetpotato genomeIbHMA4itf07g02080.t2AtCAX1818395 钙、锰、锌等阳离子交换蛋白外排、协同运输、固定[16,37]IbCAX1itf02g07780.t3IbCAX2itf14g15960.t2AtPCS1831845 天冬氨酰蛋白酶家族蛋白外排、协同运输、固定[19]IbPCS1itf07g17250.t1AtLCD825386磷酸吡哆醛依赖性转移酶超家族蛋白缓解镉胁迫、富集[38]IbLCDitf07g19240.t1OsMTP14337694 Metal tolerance protein外排、协同运输、固定[39]IbMTPitf12g15060.t2AtMTPB817490 Metal tolerance protein B1外排、协同运输、固定[40]IbMTPBitf04g29240.t1AtH(+)-AT-Pase838297H(+)-ATPase协同运输、富集、吸收[41]IbH(+)-AT-Paseitf06g26520.t1AtCa2+-AT-Pase 1837296Calcium ATPase协同运输、富集、吸收[42]IbCa2+-ATPaseitf03g30810.t1AtXCD1820259糖基水解酶超家族外排、协同运输、固定[43]IbXCD1itf03g07430.t1IbCAT3过氧化氢酶胁迫响应itf07g00160IbGST谷胱甘肽S-转移酶胁迫响应itf04g24540IbPOD过氧化物酶超家族胁迫响应itf09g09800IbSOD超氧化物酶超家族胁迫响应itf13g19030IbAPX抗坏血酸过氧化物酶胁迫响应itf09g09790IbTubulinβ微管蛋白内参基因itf04g29110
2.3 镉积累相关基因的空间表达差异
随着土壤镉含量的增加,甘薯中镉积累相关同源基因的表达存在较大差异。如图1所示,土壤镉含量为2.0 mg/kg的栽培条件下,IbMTP、IbMTPB、IbNRAMP1等基因在甘薯各组织均有显著增强,而IbCAX1等基因仅在吸收根等部位有增强表达;基因IbHMA1、IbHMA2、IbHMA3、IbHMA4或者基因IbNRAMP1、IbNRAMP2、IbNRAMP3及基因IbZIP3、IbZIP5、IbZIP7虽然在mRNA序列上具有高度同源性,但是其转录水平存在极大差异,推测这类基因在甘薯基因组中存在多个基因座的重复或者基因拷贝的重复。胁迫响应相关的基因随着土壤中镉含量的增加表达均逐渐增强,且在土壤镉含量为0.6 mg/kg的栽培条件下,相关基因主要在吸收根茎下段被诱导表达;在土壤镉含量为2.0 mg/kg的栽培条件下,相关基因主要在根、茎、叶各部位均被诱导表达,该变化趋势与不同土壤镉含量栽培条件下各组织器官中镉含量的变化趋势基本一致(表2)。
2.4 甘薯镉积累的时间差异
甘薯移栽后生长一个月,添加氯化镉至土壤镉含量浓度约为2.0 mg/kg,检测不同时间点各组织器官的镉含量。分析发现各组织器官的镉含量均有增加趋势(图2-A),其中吸收根镉含量增加最为显著,在3~4 d时间内鲜质量镉含量迅速从0.1 mg/kg增长至较高3.3 mg/kg,随后增长趋于稳定;茎下段、茎上段、叶片等部位鲜质量镉含量在0.5 d时才有明显的增长,且增长速度与幅度远低于吸收根;比较茎下段、茎上段、叶片等部位的镉转运系数可看出(图2-B),在处理后第1天的时间点,各位点的转运系数均达到最大值,随后逐渐降低。镉转运系数的降低,主要是由于吸收根镉含量增长幅度与增长持续时间均大于其他组织器官,说明此阶段吸收根对土壤中的镉有较强的阻滞作用。各组织器官在镉含量增长至较大值时均有稍微下降趋势,推测与植株持续生长导致生物量的增长有关。栽插后30 d左右甘薯开始出现铅笔状膨大根,比较不同时间点膨大根镉含量与地上部茎叶平均镉含量差异(图2-C),可见地上部茎叶镉含量增长速度明显大于膨大根,说明甘薯吸收根吸收的镉更易转运往地上部茎叶,而不是直接转运往膨大根,推测膨大根发育为薯块的过程中,其积累的干物质主要源自于茎叶光合作用的产物,薯肉中的积累的镉主要源于光合产物的协同运输。检测生长130 d左右植株不同生长位点的叶片镉含量可发现(图2-D),从顶叶开始往下,各叶片鲜质量镉含量逐渐增加,越靠近地表的叶片镉含量越高,推测叶片中积累的镉元素并不容易发生二次转移,而是随着叶龄的增长积累量逐渐增大。本结果说明,甘薯吸收的镉会从吸收根开始就近固定与隔离,从而阻滞其进一步往上运输而造成更大毒害作用,根系吸收的镉元素不易直接运输至薯肉,因而甘薯从土壤中吸收的镉元素分配至薯肉的比例保持在相对较低值。

图1 镉含量0.6,2.0 mg/kg土壤生长条件下甘薯镉积累相关基因的空间表达差异
Fig.1 Spatial expression differences of genes relate to cadmium accumulation in sweetpotato which were grown in soil with 0.6,2.0 mg/kg cadmium
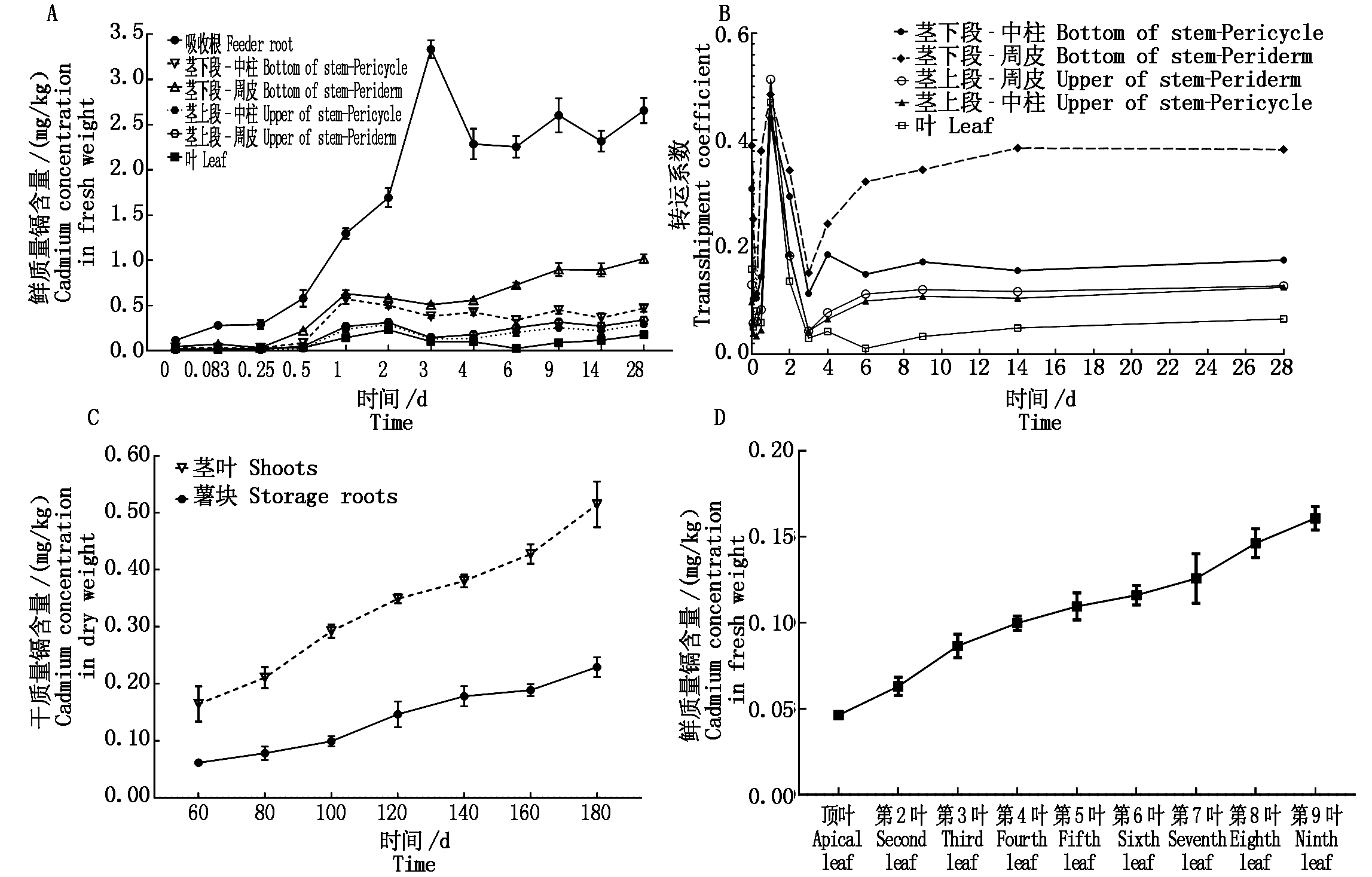
A.不同时间点甘薯各组织器官镉含量变化;B.不同时间点甘薯各组织器官镉转运系数变化;C.移栽60 d后不同时间点甘薯薯肉及地上部茎叶镉含量变化;D.移栽130 d后自上而下单个叶片镉含量变化。
A.Changes of cadmium concentration in sweetpotato at different growth time;B.Changes of cadmium transport coefficient in sweetpotato at different growth time;C.Changes of cadmium concentration in fleshed storage roots and shoots with the increase in the growth time after 60 days of transplanting;D.The cadmium concentration in single leaf from top to bottom after 130 days transplanting.
图2 镉含量2.0 mg/kg土壤生长条件下甘薯不同生长时间点镉积累规律分析
Fig.2 Cadmium accumulation pattern of sweetpotato at different growth time when planted in the soil with 2.0 mg/kg cadmium
2.5 甘薯镉积累相关基因的时间表达差异
由于在添加氯化镉处理后第1天的时间点,各位点的转运系数均达到最大值,本研究比较分析了在处理1 d后甘薯主要组织器官镉积累调控相关基因的表达差异。从qPCR结果可见(图3),在处理后1 d,不同组织器官胁迫响应相关基因均受诱导而表达明显上调;大部分镉转运、外排、隔离固定等相关基因在吸收根、薯皮及茎中有上调表达的响应,在储藏根、叶片中受诱导表达趋势不明显。推测薯块、茎叶等部位虽然参与了胁迫响应,但是其镉积累调控方式与吸收根等部位存在明显差异。

图3 甘薯移栽30 d土壤中添加2.0 mg/kg的镉后甘薯镉积累相关基因的空间表达差异
Fig.3 Spatial expression differences of genes relate to cadmium accumulation in sweetpotato when the soil was added 2.0 mg/kg cadmium after 30 days transplanting
3 讨论与结论
本研究分析了甘薯镉积累与分布的空间规律,认为在不同组织或者器官中,吸收根的镉积累量最大,在镉中度污染土壤中,甘薯吸收的镉主要积累在吸收根系,往地上部转运量较少,随着土壤中镉浓度增加,根系镉积累量达到饱和时,甘薯地上部各组织器官开始自下而上出现明显的镉积累,减少Cd通过韧皮部向可食根的转移。有研究通过双硫腙(Dithizone)组织化学染色的方法检测了甘薯根的组织切片结构中镉的分布情况[31],发现镉处理后根表皮、内皮细胞壁都会变厚,根表皮积累的镉元素明显高于根中柱部位,这一研究佐证了甘薯自下而上完成镉吸收与积累的空间积累特性,与本研究结论相吻合,但是甘薯薯肉镉积累规律与这一规律相悖。
笔者前期的研究发现甘薯镉积累在不同品种之间也存在较大差异,这种品种间的差异在茎、叶等部位最为显著,而薯肉中镉含量普遍低于薯皮和地上部茎叶甘薯可通过韧皮部,将茎、叶部位额镉运输至储藏根,因而茎、叶对镉的固定与转运能力,直接影响到植株通过韧皮部往储藏根运输镉的量,进而决定了储藏根镉的含量差异[30]。本研究提供了甘薯中镉积累相关同源基因的时空表达数据,这些基因与拟南芥等植物已知的基因之间存在较高的同源性,说明这类基因在高等植物中的保守性较高,而在甘薯中,这些基因多存在多个同源拷贝,各拷贝之间表达模式存在差异,这种差异可能是甘薯不同品种间镉积累差异性形成的原因。相对于镉积累相关基因,本研究认为随着植株镉积累量的增加,胁迫响应相关基因受镉胁迫诱导表达的趋势更为明显,这间接反映了镉积累对甘薯植株的毒害作用。在后续工作中,研究将分析不同品种之间各基因拷贝表达模式与植株镉积累的关系,为解析镉耐性和积累的机理提供参考数据。
镉污染土壤中甘薯的镉积累在空间上遵循自下而上积累的基本规律,镉含量积累符合根>茎>叶的特性;各组织器官随时间积累植株镉积累量逐渐增加,且在各组织器官的镉不易发生二次转移。但是甘薯薯肉的镉积累规律较为特殊,薯肉镉积累量低于薯皮、茎、叶等部位,且随着生长时间的增加,薯肉镉积累速率也远低于地上部茎叶,推测甘薯薯肉镉的积累特性与地上部镉的转运相关。植物镉积累和转运相关的基因在甘薯基因组存在同源基因,且多数存在多个同源拷贝,各拷贝之间的时空表达模式存在差异,推测这种表达差异与甘薯的积累特性有关。
[1] Jhanji S,Sadana U S. Genotypic variation in partitioning of dry matter and manganese between source and sink organs of rice under manganese stress[J]. Plant Cell Reports,2014,33(8):1227-1238. doi:10.1007/s00299 -014-1611-x.
[2] Jhanji S,Sadana U S,Shankar A,Shukla A K. Manganese influx and its utilization efficiency in wheat[J]. Indian Journal of Experimental Biology,2014,52(6):650-657.
[3] Li L Z, Tu C, Wu L H, Peijnenburg W J G M, Ebbs S, Luo Y M.Pathways of root uptake and membrane transport of Cd2+ in the zinc/cadmium hyperaccumulating plant Sedum plumbizincicola[J].Environmental Toxicology and Chemistry,2017,36(4):1038-1046. doi:10.1002/etc.3625.
[4] Song Y,Jin L,Wang X J . Cadmium absorption and transportation pathways in plants[J]. International Journal of Phytoremediation,2017,19(2):133-141. doi:10.1080/15226514.2016.1207598.
[5] 刘意章,肖唐付,熊燕,宁增平,双燕,李航,马良,陈海燕.西南高镉地质背景区农田土壤与农作物的重金属富集特征[J].环境科学,2019,40(6):2877-2884. doi:10.19303/j.issn.1008-0384.2019.03.014.
Liu Y Z,Xiao T F,Xiong Y,Ning Z P,Shuang Y,Li H,Ma L,Chen H Y.Accumulation of heavy metals in agricultural soils and crops from an area with a high geochemical background of cadmium,Southwestern China[J].Environmental Science,2019,40(6):2877-2884.
[6] Liu H W,Wang H Y,Ma Y B,Wang H H,Shi Y. Role of transpiration and metabolism in translocation and accumulation of cadmium in tobacco plants(Nicotiana tabacum L.)[J]. Chemosphere,2016,144:1960-1965. doi:10.1016/j.chemosphere.2015.10.093.
[7] Fu X P,Dou C M,Chen Y X,Chen X C,Shi J Y,Yu M G,Xu J . Subcellular distribution and chemical forms of cadmium in Phytolacca americana L.[J].Journal of Hazardous Materials,2011,186(1):103-107. doi:10.1016/j.jhazmat.2010.10.122.
[8] Chen X H,Ouyang Y N,Fan Y C,Qiu B Y,Zhang G P,Zeng F R. The pathway of transmembrane cadmium influx via calcium-permeable channels and its spatial characteristics along rice root[J]. Journal of Experimental Botany,2018,69(21):5279-5291. doi:10.1093/jxb/ery293.
[9] Zhang J,Martinoia E L,Young S. Vacuolar transporters for cadmium and arsenic in plants and their applications in phytoremediation and crop development[J]. Plant Cell Physiololgy,2018,59(7):1317-1325.doi:10.1093/pcp/pcy006.
[10] Parvaiz A,Maryam S,Nazir A B,Mohd R W,Alvina G K,Lam-Son P T. Alleviation of cadmium toxicity in Brassica juncea L.(Czern. & Coss.)by calcium application involves various physiological and biochemical strategies[J]. PLoS One,2015,10(1):e0114571. doi:10.1371/journal.pone.0114571.
[11] Stephan C. Safer food through plant science:reducing toxic element accumulation in crops[J]. Journal of Experimental Botany,2019,70(20):5537-5557. doi:10.1093/jxb/erz366.
[12] Pittman J K. Managing the manganese:molecular mechanisms of manganese transport and homeostasis[J].The New Phytologist,2005,167(3):733-742. doi:10.1111/j.1469-8137.2005.01453.x.
[13] Wu F B,Dong J,Qian Q Q,Zhang G P. Subcellular distribution and chemical form of Cd and Cd-Zn interaction in different barley genotypes[J]. Chemosphere,2005,60(10):1437-1446. doi:10.1016/j.chemosphere.2005.01.071.
[14] Xin J L,Huang B F,Dai H W,Liu A Q,Zhou W J,Liao K B. Characterization of cadmium uptake,translocation,and distribution in young seedlings of two hot pepper cultivars that differ in fruit cadmium concentration[J]. Environmental Science and Pollution Research International,2014,21(12):7449-7456.doi:10.1007/s11356-014-2691-4.
[15] Mélanie M,Jér me C,Antoine G,Pascaline A,Nathalie L,Alain V,Pierre R. AtHMA3,a P1B-ATPase allowing Cd/Zn/Co/Pb vacuolar storage in Arabidopsis[J].Plant Physiology,2009,149(2):894-904.doi:10.1104/pp.108.130294.
me C,Antoine G,Pascaline A,Nathalie L,Alain V,Pierre R. AtHMA3,a P1B-ATPase allowing Cd/Zn/Co/Pb vacuolar storage in Arabidopsis[J].Plant Physiology,2009,149(2):894-904.doi:10.1104/pp.108.130294.
[16] Zhao J,Toshiro S,Mei H,Guo Y Q,Cheng N H,Kendal D H. Interaction between Arabidopsis Ca2+/H+ exchangers CAX1 and CAX3[J]. The Journal of Biological Chemistry Vol,2009,284(7):4605-4615. doi:10.1074/jbc.M804462200.
[17] Santiago A,Rémy C,Carine A,Léon D,Frédéric D,David C,Loren C,Jean-François B,Stéphane M,Catherine C. Intracellular distribution of manganese by the trans-golgi network transporter NRAMP2 is critical for photosynthesis and cellular redox homeostasis[J]. The Plant Cell,2017,29(12):3068-3084.doi:10.1105/tpc.17.00578.
[18] Sheng Y B,Yan X X,Huang Y,Han Y Y,Zhang C,Ren Y B,Fan T T,Xiao F M,Liu Y S,Cao S Q. The WRKY transcription factor,WRKY13,activates PDR8 expression to positively regulate cadmium tolerance in Arabidopsis[J].Plant Cell and Environment,2019,42(3):891-903. doi:10.1111/pce.13457.
[19] Kühnlenz T,Holger S,Shimpei U,Stephan C. Arabidopsis thaliana phytochelatin synthase 2 is constitutively active in vivo and can rescue the growth defect of the PCS1-deficient cad1-3 mutant on Cd-contaminated soil[J].Journal of Experimental Botany,2014,65(15):4241-4253. doi:10.1093/jxb/eru195.
[20] Liu X S,Feng F J,Zhang B Q,Wang M Q,Cao H W,Justice K R,Chen X,Yang Z M. OsZIP1 functions as a metal efflux transporter limiting excess zinc,copper and cadmium accumulation in rice[J].BMC Plant Biology,2019,19:283. doi:10.1186/s12870-019-1899-3.
[21] Gu L J,Zhao M L,Ge M,Zhu S W,Cheng B J,Li X Y. Transcriptome analysis reveals comprehensive responses to cadmium stress in maize inoculated with arbuscular mycorrhizal fungi[J].Ecotoxicology and Environmental Safety,2019,30(186):109744. doi:10.1016/j.ecoenv.2019.109744.
[22] Seiichiro H,Daigo S,Hitomi F. Toxicometallomics of cadmium,manganese and arsenic with special reference to the roles of metal transporters[J]. Toxicological Research,2019,35(4):311-317. doi:10.5487/TR.2019.35.4.311.
[23] Ramin B,Mahsa M,Mohammad R B. Genotypic variation for cadmium tolerance in common bean(Phaseolus vulgaris L.)[J]. Ecotoxicology and Environmental Safety,2020,1(190):110178. doi:10.1016/j.ecoenv.2020.110178.
[24] Kocadal K,Alkas F B,Battal D,Saygi S. Cellular pathologies and genotoxic effects arising secondary to heavy metal exposure:A review[J].Human & Experimental Toxicology,2020,39(1):3-13.doi:10.1177/0960327119874439.
[25] 张杰.超积累植物东南景天Cd耐性和积累的分子机制[D].杭州:浙江大学,2015.
Zhang J.Molecular mechanisms of Cd tolerance and accumulation in metal hyperaccumulator Sedum alfredii[D].Hangzhou:Zhejiang University,2015.
[26] 胡玉龙,李雪华,赵苹艺,丁楚楚,徐甜甜,孙存华.镉胁迫对甘薯苗生理生化指标的影响[J].湖北农业科学,2015,54(4):858-861. doi:10.14088/j.cnki.issn0439-8114.2015.04.021.
Hu Y L,Li H,Zhao P Y,Ding C C,Xu T T,Sun C H.Effects of cadmium stress on physiologic and biochemical characteristics of sweet potato[J].Hubei Agricultural Science,2015,54(4):858-861.
[27] Cheng S F,Huang C Y. Accumulation of cadmium uptake from soilin the edible root of root vegetables[J].Journal of Environmental Management,2007,17:137.
[28] 刘兰英,吕新,陈丽华,黄薇,涂杰峰,余华,上官亮,谢亚兴.土壤镉胁迫对甘薯品质和镉、锌吸收的影响[J].福建农业学报,2019,34(3):344-351. doi:10.19303/j.issn.1008-0384.2019.03.014.
Liu L Y,Lü X,Chen L H,Huang W,Tu J F,Yu H,Shangguan L,Xie Y X. Cd and Zn uptakes and quality of sweetpotatoes under Cd-stress[J].Fujian Journal of Agricultural Science,2019,34(3):344-351.
[29] Huang B F,Xin J L,Dai H W,Zhou W J,Peng L J. Identification of low-Cd cultivars of sweet potato(Ipomoea batatas (L.)Lam.)after growing on Cd-contaminated soil:uptake and partitioning to the edible roots[J]. Environmental Science and Pollution Research International,2015,22(15):11813-11821.doi:10.1007/s11356-015-4449-z.
[30] Xin J L,Dai H W,Huang B F. Assessing the roles of roots and shoots in the accumulation of cadmium in two sweet potato cultivars using split-root and reciprocal grafting systems[J]. Plant and Soil,2016,412(1-2):413-424. doi:10.1007/s11104-016-3079-7.
[31] Huang B F,Dai H W,Zhou W J,Peng L J,Li M Z,Wan R J,He W T. Characteristics of Cd accumulation and distribution in two sweet potato cultivars[J].International Journal of Phytoremediation,2019,21(4):391-398. doi:10.1080/15226514.2018.1524846.
[32] Zhang D W, Dong F, Zhang Y, Huang Y L, Zhang C F. Mechanisms of low cadmium accumulation in storage root of sweetpotato(Ipomoea batatas L.)[J].Journal of Plant Physiology,2020,254:153262.doi:10.1016/j.jplph.2020.153262.
[33] Tang J,Wang S Q,Hu K D,Huang Z Q,Li Y H,Han Z,Chen X Y,Hu L Y,Yao G F,Zhang H. Antioxidative capacity is highly associated with the storage property of tuberous roots in different sweetpotato cultivars[J]. Scientific Reports,2019,9(1):11141.doi:10.1038/s41598-019-47604-8.
[34] Livak K J ,Schmittgen T D . Analysis of relative gene expression data using Real-time quantitative PCR and the 2-ΔΔCT Method[J].Methods,2001,25(4):402-408. doi:10.1006/meth.2001.1262.
[35] Kim D Y ,Lucien B,Masayoshi M,Enrico M,Lee Y S. The ABC transporter AtPDR8 is a cadmium extrusion pump conferring heavy metal resistance[J]. Plant Journal,2007,50(2):207-218. doi:10.1111/j.1365-313X.2007.03044.x.
[36] Ryuichi T,Yasuhiro I,Hiromi N,Naoko K N. Role of the iron transporter OsNRAMP1 in cadmium uptake and accumulation in rice[J]. Plant Signaling & Behavior,2011,6(11):1813-1816.doi:10.4161/psb.6.11.17587.
[37] Wu Q Y,Toshiro S,Kimberly A W,Han J S,Chang K K,Kendal D H,Park S. Expression of an Arabidopsis Ca2+/H+ antiporter CAX1 variant in petunia enhances cadmium tolerance and accumulation[J].Journal of Plant Physiology,2011,15,168(2):167-73. doi:10.1016/j.jplph.2010.06.005.
[38] Shen J J ,Qiao Z J,Xing T J,Zhang L P,Liang Y L,Jin Z P,Yang G D,Wang R,Pei Y X. Cadmium toxicity is alleviated by AtLCD and AtDCD in Escherichia coli[J].Journal of Applied Microbiology,2012,113(5):1130-1138. doi:10.1111/j.1365-2672.2012.05408.x.
[39] Natasha D,Surajit B,Mrinal K M. Enhanced cadmium accumulation and tolerance in transgenic tobacco overexpressing rice metal tolerance protein gene OsMTP1 is promising for phytoremediation[J].Plant Physiology and Biochemistry,2016,105:297-309.doi:10.1016/j.plaphy.2016.04.049.
[40] Magdalena M,Anna K,Anna P,Ewa M D,Ewelina P,Arnold G,Sophie F. Two metal-tolerance proteins,MTP1 and MTP4,are involved in Zn homeostasis and Cd sequestration in cucumber cells[J].Journal of Experimental Botany,2015,66(3):1001-1015. doi:10.1093/jxb/eru459.
[41] Chen J,Sylvie L,Petr O,Azam N V,Saman A P,Cristina V,Jose L R,Wolf B F,Seung Y R. Uncovering Arabidopsis membrane protein interactome enriched in transporters using mating-based split ubiquitin assays and classification models[J].Frontiers in Plant Science,2012,21(3):124. doi:10.3389/fpls.2012.00124.
[42] Wu Z Y,Liang F,Hong B M,Young Y C,Michael R S,Jeffrey F H,Heven S. An endoplasmic reticulum-bound Ca(2+)/Mn(2+)pump,ECA1,supports plant growth and confers tolerance to Mn(2+)stress[J].Plant Physiology, 2002,130(1):128-137. doi:10.1104/pp.004440.
[43] Chen J,Yang L B,Gu J,Bai X Y,Ren Y B,Fan T T,Han Y,Jiang L,Xiao F M,Liu Y S,Cao S Q. MAN3 gene regulates cadmium tolerance through the glutathione-dependent pathway in Arabidopsis thaliana[J].The New Phytologist,2015,205(2):570-582.doi:10.1111/nph.13101.