甜樱桃(Prunus avium L.),因其体积较大又名大樱桃,属于非常典型的核果类果实,甜樱桃皮薄肉嫩、果肉饱满、色泽亮丽、味道鲜美,营养价值格外丰富。甜樱桃不仅果肉有食用价值关键是甜樱桃的根和叶等均有药用价值,补血益气、舒经活络、温补健脾等保健作用。由于果实特性的原因采后甜樱桃极易腐烂褐变,不耐贮藏保鲜,在运输和贮藏过程中有很大的限制,褐变不仅会改变果实的风味和色泽,还会使营养成分受到破坏[1-2],给消费者带来不便的同时还影响着经济和商品的价值。因此,减缓褐腐的发生,提高甜樱桃的品质质量,就显得尤为重要。PPO、POD、SOD和CAT都是与果蔬褐变息息相关的酶[3],PPO、POD等参与了果蔬褐变、衰老等过程,在紫甘薯[4]、马铃薯[5]、莲藕[6]、苹果[7]等试验过程中已被证实。吴振先等[8]研究发现POD具有极高的浓度,在荔枝果皮褐变过程中已被证实。褐变是多种酶共同作用的结果,而不是单一因素所致。Richard-forget等[9]在梨试验研究发现,在PPO存在的情况下,POD会加剧酚的降解,促进梨加速褐变。诸多研究表明,在生菜[10]、桃[11]、荔枝[12 ]以及竹笋[13]的褐变试验过程中,PPO、POD等均有参与,皱丽红等[14]和张亚伟等[15]在砂梨果实褐变试验中,表明果实褐变发生的严重程度与PPO活性相关性高于其与POD、CAT、SOD的相关性。总之,酶活性变化在果实褐变过程中有非常重要的作用。但是相关酶基因表达量的变化与褐变关系的研究却鲜有报道。本试验研究EBR处理对甜樱桃贮藏期间果实褐变指数及PPO、POD、CAT、SOD活性的影响,并通过实时定量反转录-聚合酶链反应(Reverse transcription-polymerase chain reaction,RT-qPCR)对各贮藏时期不同处理的甜樱桃果实的PPO、POD、CAT、SOD基因表达量进行了分析,以进一步阐明甜樱桃果实褐变与PPO、POD、CAT、SOD基因之间的关系,为通过基因工程的方法抑制甜樱桃果实褐变提供依据。
1 材料和方法
1.1 材料与试剂
供试甜樱桃品种先锋采自北京市林业果树科学研究院实验基地(采摘时果实可溶性固形物含量为17.5%,硬度为1.53 kg/cm2),挑选大小相近、色泽相似、成熟度一致、完整未受损伤的果实采后立即运回实验室进行处理。
试剂:2,4-表油菜素内酯(购自上海源叶生物科技有限公司);乙酸-乙酸钠缓冲液、邻苯二酚、磷酸缓冲液、PVP、愈创木酚溶液、H2O2溶液、TritonX-100、磷酸二氢钠、磷酸氢二钠(分析纯);RNA提取试剂盒(天根RNAprep Pure Plant Kit);RevertAid First Strand cDNA Synthesis Kit、2×SYBR Green qPCR Master mix(BIO RAD TCS0803),引物由生工生物工程(上海)股份有限公司设计完成。
1.2 仪器与设备
3K15型高速冷冻离心机,Sigma公司;DW-40L262型海尔立式低温冰箱,青岛海尔特种电器有限公司。VORTEX-5旋涡混匀器,海门市其林贝尔仪器制造有限公司;MJ Mini型PCR仪器,美国Bio-Rad有限公司;CFX96型荧光定量PCR仪器,美国Bio-Rad有限公司;UV-4型全能型凝胶成像分析系统,苏州宾达机柜有限公司;DYY-10C型电泳仪,北京市六一仪器厂。
1.3 试验方法
1.3.1 材料处理 不同浓度的2,4-表油菜素内酯(5,10 μmol/L)浸泡甜樱桃10 min,对照是蒸馏水浸泡,自然晾干后,在将透明塑料盒置于纸箱中保鲜处理[16]前,为了方便后期取样将甜樱桃用规格相同的塑料小盒进行分装并贴相应的标签,置于温度为(0±0.5)℃,湿度为85%~90%的冷库中贮藏60 d,每隔15 d取一次样进行相应的分析测定。每组每次分别选用100个果实,沿果心外侧切分果实,迅速将果心切成块状用液氮急冻,然后置于-80 ℃下保存备用。各重复3次。
1.3.2 果实褐变指数的测定 果实褐变指数参照王春生等[17]的方法进行测定。随机挑选 60个樱桃果实,纵向切开后观察果肉的褐变程度。将褐变程度分为 4个等级,1 级褐变面积小于总面积的1/10,2 级褐变面积为总面积的1/10~1/3,3 级褐变面积为总面积的1/3~2/3,4 级褐变面积为总面积的 2/3~1,计算公式:
果实褐变指数![]()
1.3.3 PPO、POD、CAT、SOD酶活性的测定 多酚氧化酶(Polyphenoloxidase,PPO)、过氧化物酶(Phenylalanine ammonia,POD)、过氧化氢酶(Catalase,CAT)、超氧化物歧化酶(Superoxide dismutase,SOD)等酶活性采用比色法[18]测定。
1.3.4 甜樱桃果实总RNA的提取 根据RNA提取试剂盒(天根RNAprep Pure Plant Kit)的方法提取RNA。根据琼脂凝胶电泳以及超微量分光光度计测定结果,检测RNA提取的质量,符合要求的RNA进行下一步试验。
1.3.5 引物设计与合成 根据NCBI中PPO、POD、CAT及SOD的mRNA序列信息(GAJZ01003884、GAJZ01001588、EF165590、JP376926)设计特异性引物。采用Aactin(登录号:FJ560908)作为内参基因。Prime 5软件设计引物序列后由上海生工合成。 所用引物如表1所示。
表1 实时定量PCR特异性引物序列
Tab.1 Specific primer sequences for qRT-PCR

基因名称Gene name基因号Gene ID引物序列(5'-3')Primer sequence扩增片段大小/bpFragment sizePaAactinFJ560908F:TCAATGTGCCTGCCATGTAT164R:AGCAAGGTCCAGACGAAGAAPaCATEF165590F:GCGTTTAACCCTGCTTTTGT205R:TAACCTCCTCATCCCTGTGCPaSODJP376926F:TTAGGTAAGGGCGGTTGTTG212R:TTGTGTTCAGTCCCCTCTCAPaPODGAJZ01001588F:TCTCGCACTGCAACAAATTC245R:TCTGGCGCTAGTGAACAAAGPaPPOGAJZ01003884F:CTGCCGACACCAACTAGTCA163R:GCGGTGGTACGATTACGATT
1.3.6 cDNA的合成 反转录所用反应体系如表2所示。反转录和成cDNA的程序:首先42 ℃逆转录60 min,之后在70 ℃条件下反应5 min使逆转录酶热失活。得到的cDNA产物储存在-20 ℃备用。
1.3.7 实时定量PCR 反应体系 实时定量PCR 的反应程序为,95 ℃预变性10 min,之后在95 ℃条件下变性15 s,60 ℃条件下退火30 s,共进行40个循环。每个基因重复3次。采用 2-ΔΔCt的方法对基因的相对表达量进行计算。
表2 反转录反应体系
Tab.2 The reaction system of RT-PCR
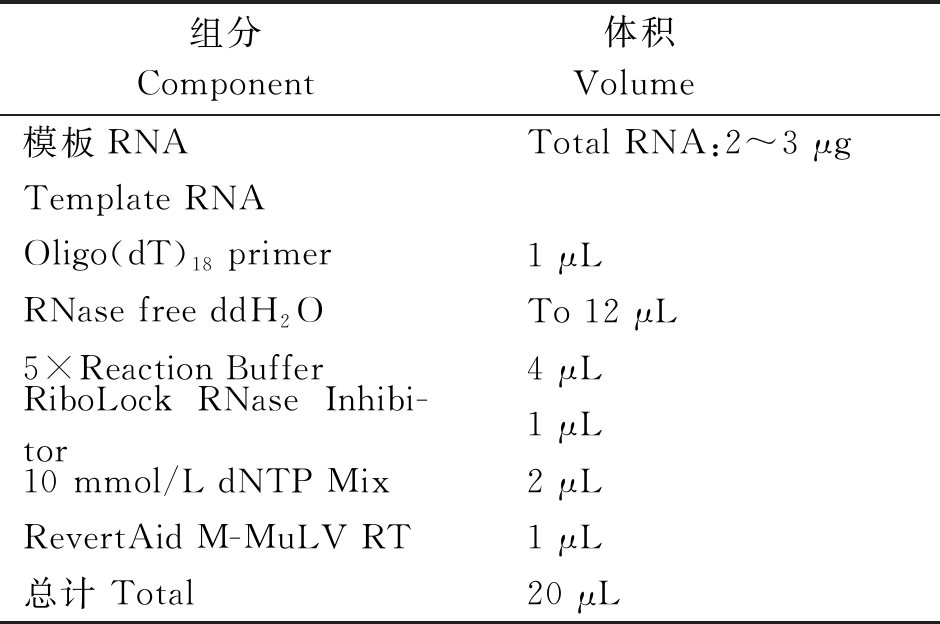
组分Component体积 Volume 模板RNATotal RNA:2~3 μgTemplate RNAOligo(dT)18 primer1 μLRNase free ddH2OTo 12 μL5×Reaction Buffer4 μLRiboLock RNase Inhibi-tor1 μL10 mmol/L dNTP Mix2 μLRevertAid M-MuLV RT1 μL总计 Total20 μL
1.4 数据处理与分析
采用Excel 2017对试验数据进行分析并绘图,相关性分析采用SPSS 18.0软件进行。
2 结果与分析
2.1 EBR处理对甜樱桃果实褐变指数的影响
褐变不仅影响果实外观,还会引起营养成分的变化,是果实采后品质劣变的一个重要指标(表3)。甜樱桃在贮藏过程中,随着贮藏时间的延长果实褐变指数逐渐升高,EBR处理可以延缓果实褐变指数的升高,在贮藏60 d时5,10 μmol/L EBR处理的果实褐变指数分别比对照组低了40.1%和26.7%。
表3 EBR处理对甜樱桃果实褐变指数的影响
Tab.3 EBR treatment of sweet cherry fruit browning index %
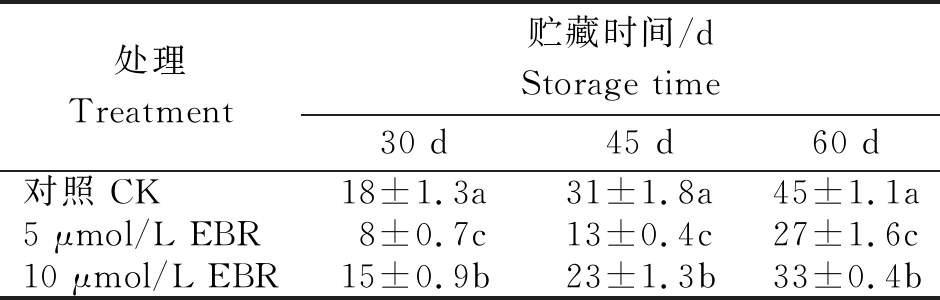
注:不同字母表示差异达5%显著水平。
Note:Different letters indicate significant difference at 5% level.
处理Treatment贮藏时间/dStorage time30 d45 d60 d 对照 CK18±1.3a31±1.8a45±1.1a5 μmol/L EBR8±0.7c13±0.4c27±1.6c10 μmol/L EBR15±0.9b23±1.3b33±0.4b
2.2 EBR处理对甜樱桃果实PPO和POD活性的影响
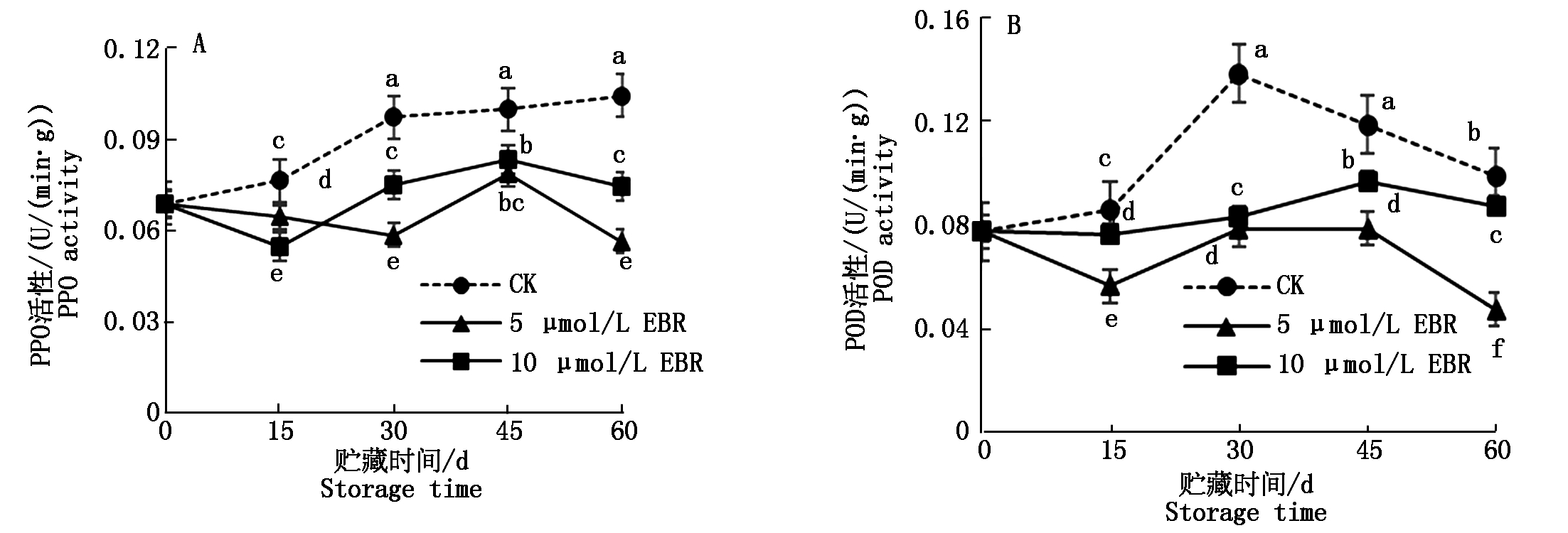
多酚氧化酶(PPO)几乎在大多数的植物组织中都会有,在酶的作用下直接将酚类物质催化成为醌类物质,导致酶促褐变的发生[19]。贮藏过程中果蔬细胞的破损会使酶和底物直接接触,促进了酶促褐变的发生[20]。如图1-A所示,对照组果实PPO酶活性在贮藏过程中呈上升趋势,EBR处理的果实中PPO酶活性呈先下降后上升再下降的趋势,到贮藏末期60 d EBR不同浓度处理果实中的PPO酶活性显著低于对照组(P<0.05),其中5 μmol/L EBR处理效果最为显著,结果表明,5 μmol/L EBR处理可以显著提高甜樱桃果实的贮藏保鲜效果。
过氧化物酶(POD)也广泛存在于植物组织中,在植物的抗逆防御以及多种生物途径中都发挥着重要的作用[21]。POD是植物在遭受逆境胁迫时体内酶促防御反应中的一个重要酶[22]。如图1-B所示,对照组果实中POD酶活性在贮藏过程中呈先升高后降低的趋势,EBR处理延缓了POD酶活性高峰出现的时间,降低了其活性高峰值,到贮藏末期60 d时EBR处理组果实中POD活性低于对照,其中5 μmol/L EBR处理的POD活性最低,与对照差异显著(P<0.05)。结果表明,5 μmol/L EBR处理可以有效提高甜樱桃贮藏保鲜效果。
不同字母表示差异达5%显著水平。图2-4同。
Different letters indicate significant difference at 5% level.The same as Fig.2-4.
图1 EBR处理对甜樱桃贮藏期间PPO和POD活性的影响
Fig.1 Effects of EBR treatment on PPO and POD activities of sweet cherry fruits during storage
2.3 EBR处理对甜樱桃果实CAT、SOD活性的影响
过氧化氢酶(CAT)是一种内源H2O2清除剂,能够有效保持氧代谢平衡,保护膜结构不受破坏,维持细胞和组织的完整性[23]。由图2-A可以看出,对照组果实中CAT酶活性呈先降低后升高再降低的波动变化趋势。不同浓度的EBR处理均可不同程度地提高CAT酶活性,其中5 μmol/L EBR处理效果最佳,EBR处理对CAT活性的影响与草莓果实[24]中的研究结果一致。
超氧化物歧化酶(SOD)能够有效清除代谢过程中产生的活性氧,使活性氧含量降低,抑制褐变的发生。由图2-B可以看出,在贮藏过程中对照组果实中SOD酶活性呈先上升后下降趋势,不同浓度EBR处理都可以提高SOD酶活性,使其活性在贮藏前30 d显著升高并一直保持较高水平,其中又以5 μmol/L EBR处理效果最佳。以上结果说明,5 μmol/L EBR处理能够显著增加其抗氧化能力,可以有效减缓甜樱桃发生褐变。
结合PPO、POD、CAT、SOD酶活性的变化趋势与甜樱桃果实的褐变指数变化,可以看出对照组果实的褐变指数随贮藏时间的延长而逐渐升高,可能与贮藏期间PPO、POD酶活性逐渐升高有关,酶活性的升高加速了果实的褐变。而EBR处理组的果实褐变指数低于对照,可能与EBR处理提高了CAT和SOD酶活性有关,酶活性的升高能清除氧和自由基,有效抑制了酶促褐变的发生。
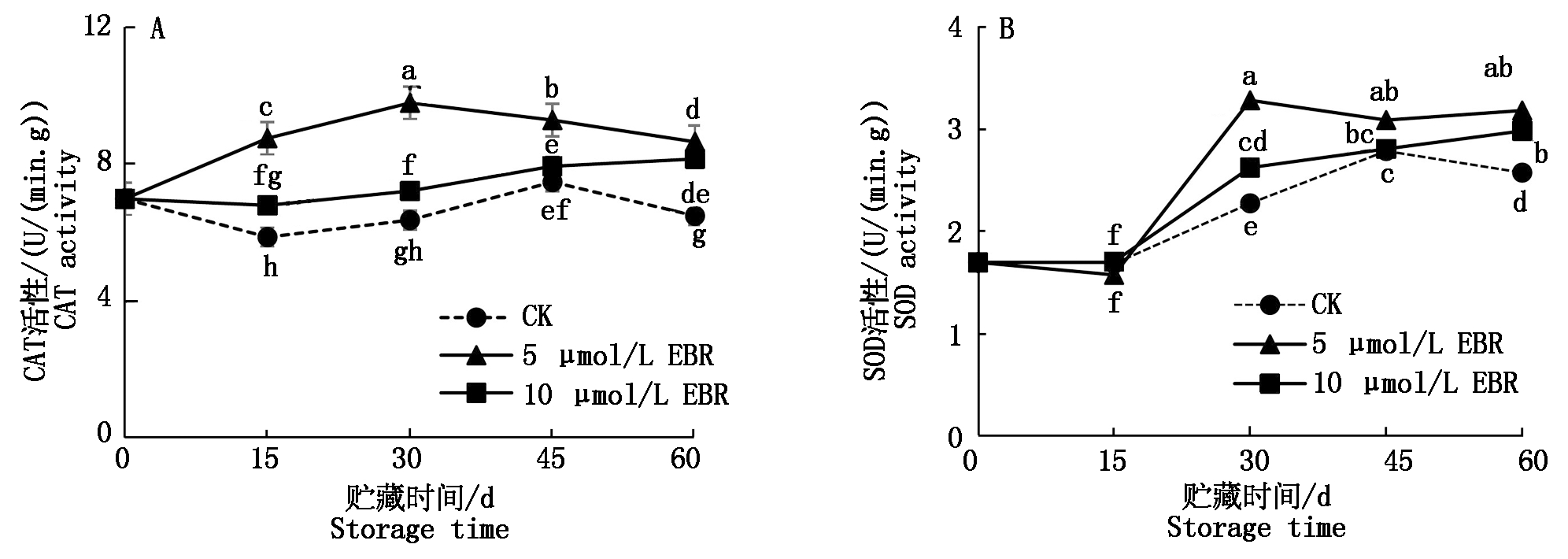
图2 EBR处理对甜樱桃贮藏期间CAT和SOD活性的影响
Fig.2 Effects of EBR treatment on CAT and SOD activities of sweet cherry fruits during storage
2.4 EBR处理对甜樱桃果实PPO和POD表达量的影响
由图3-A可以看出,对照组果实中PPO基因的相对表达量随贮藏时间的延长而升高,不同浓度EBR处理都显著抑制了PPO基因的表达,其中5 μmol/L EBR处理效果最佳。由图3-B可以看出POD基因的相对表达量在贮藏后期略有降低,EBR处理的果实中POD基因的表达量在贮藏过程中一直低于对照,其处理效果与对酶活性的影响一致。
2.5 EBR处理对甜樱桃果实CAT和SOD表达量的影响
由图4-A可以看出,对照组果实中CAT基因的相对表达量随贮藏时间的延长而降低,不同浓度EBR处理都显著提高了CAT基因的表达水平,其中5 μmol/L EBR处理效果最佳。由图4-B可以看出SOD基因的相对表达量呈先降低后升高趋势,EBR处理的果实中SOD基因的表达量在贮藏30 d后一直高于对照,其处理效果与对酶活性的影响一致。
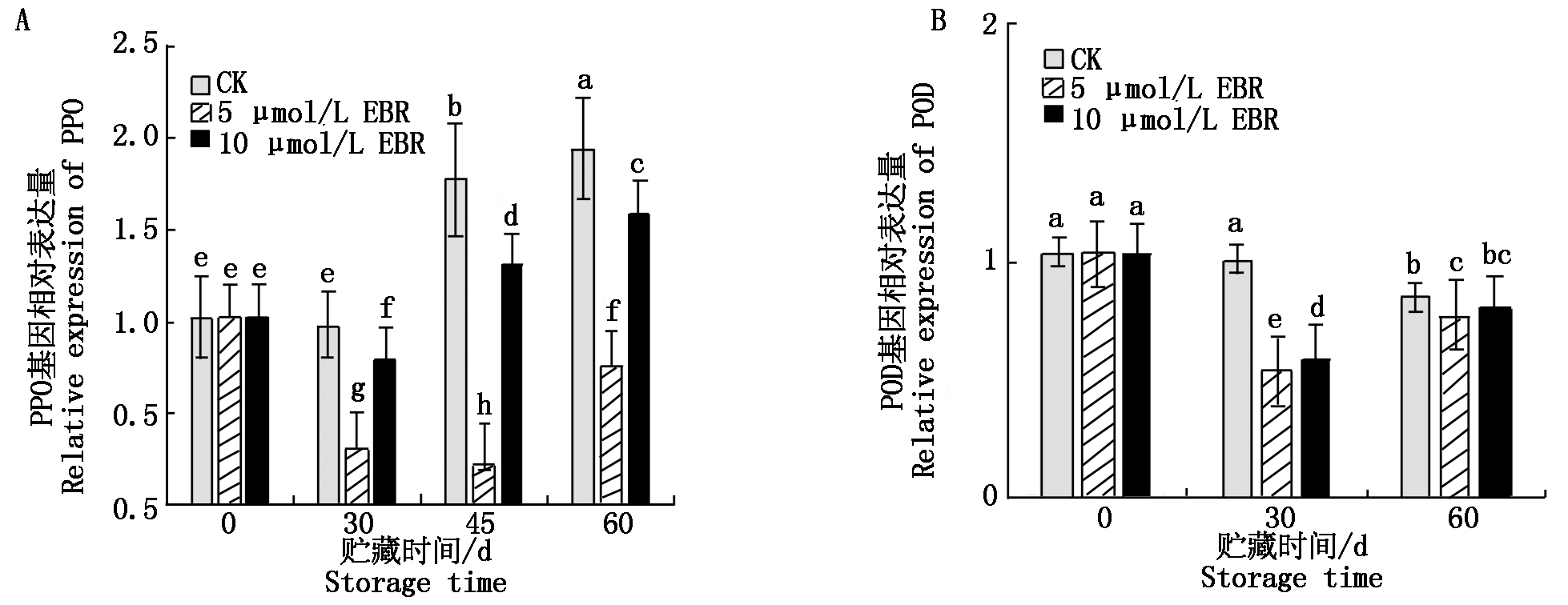
图3 EBR处理对甜樱桃果实贮藏期间PPO和POD表达量的影响
Fig.3 Effects of EBR treatment on PPO and POD expression in sweet cherry fruit during storage
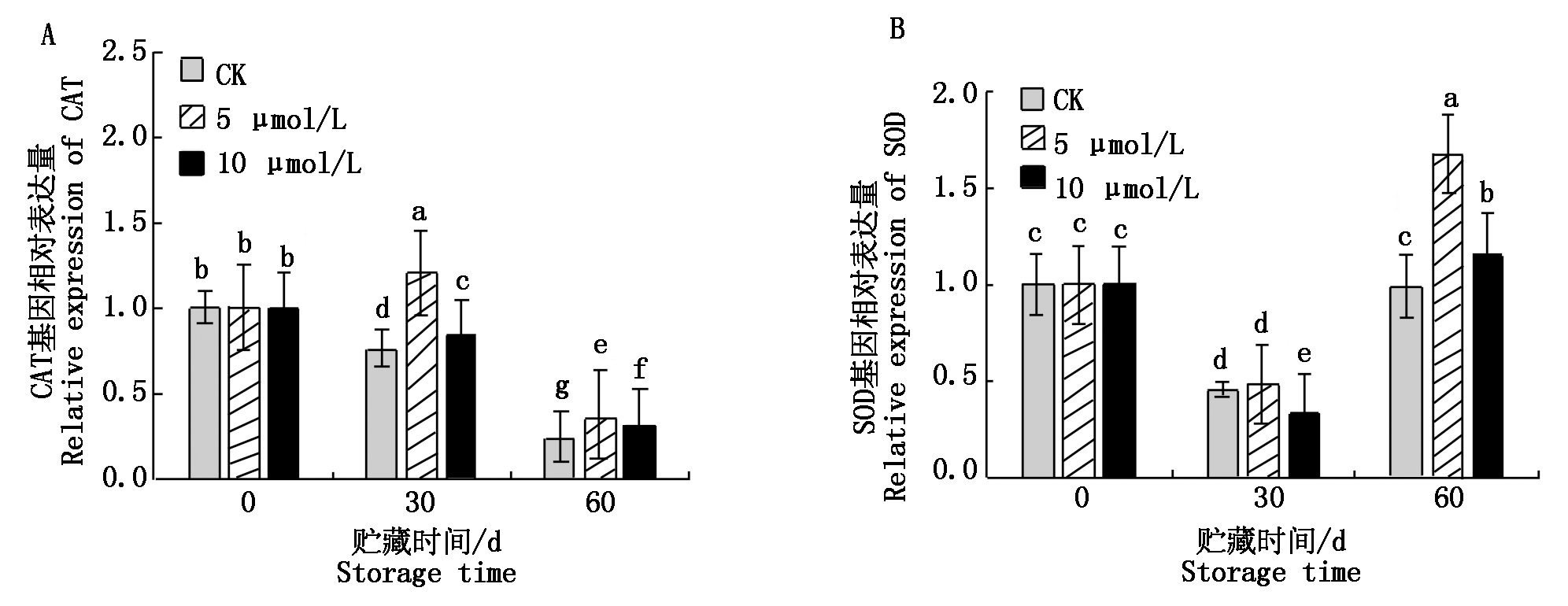
图4 EBR处理对甜樱桃果实贮藏期间CAT和SOD表达量的影响
Fig.4 Effects of EBR treatment on CAT and SOD expression in sweet cherry fruit during
2.6 PPO、POD、CAT及SOD表达量与果实褐变的相关性分析
将PPO、POD、CAT及SOD基因的相对表达量与甜樱桃果实的褐变指数做相关性分析,结果如表4中所示。由表中可以看出,果实褐变指数与PPO和POD基因的相对表达量在0.01水平上极显著正相关,与CAT基因的相对表达量在0.01水平上极显著负相关,与SOD基因的相对表达量在0.05水平上显著负相关。结果表明,PPO、POD、CAT和SOD基因的表达水平与甜樱桃果实褐变的发生密切相关。
表4 PPO、POD、CAT及SOD的相对表达量与褐变指数的相关性分析
Tab.4 The correlation analysis between PPO,POD,CAT and SOD relative expression and browning index
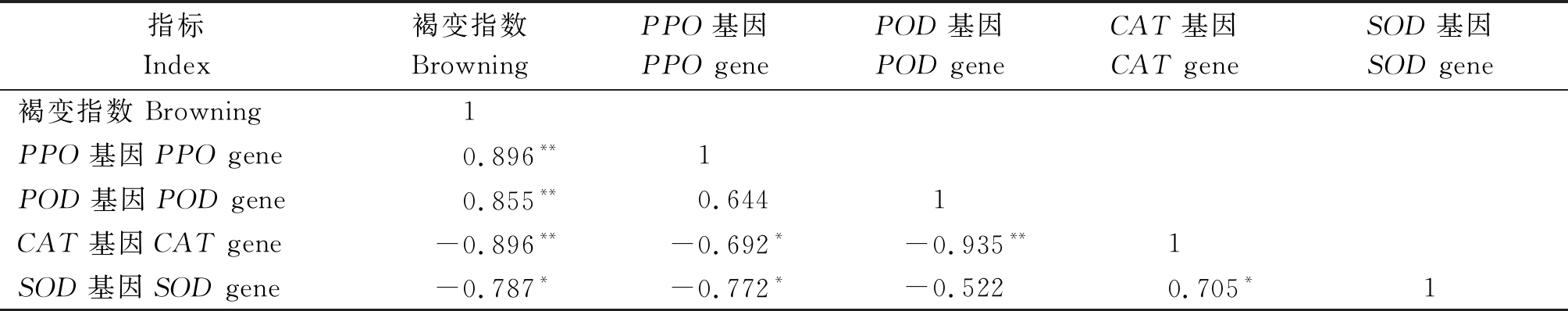
注:*.在0.05水平上显著相关;**.在0.01水平上显著相关。
Note:*.Results are significant correlation at 0.05 level;**.Results are significant correlation at 0.01 level.
指标Index褐变指数BrowningPPO基因PPO genePOD基因POD geneCAT基因CAT geneSOD基因SOD gene褐变指数 Browning1PPO基因 PPO gene0.896**1POD基因 POD gene0.855**0.6441CAT基因 CAT gene-0.896**-0.692*-0.935**1SOD基因 SOD gene-0.787*-0.772*-0.5220.705*1
3 讨论与结论
PPO、POD、CAT及SOD活性在果实褐变发生过程中有着至关重要的调节作用,研究表明,甜樱桃果实褐变严重程度与这4种酶活性的高低存在密切关系。组织褐变是果蔬在贮藏保鲜过程中发生的一种较为典型的生理代谢紊乱现象[25]。一般认为,酶促褐变过程中褐色或黑色物质产生的原因是在酶的作用下组织中酚类物质氧化为醌类物质,再聚合生成醌类物质。由于酚类物质和多酚氧化酶(Polyphenoloxidase,PPO)位置分布的不同在一定程度上减缓了褐变的发生,但在采后贮藏保鲜过程中由于不适当因素的逆境胁迫导致组织失水、细胞膜结构的完整性遭到破损,活性氧清除酶活性下降,自由基的积累增多,细胞膜透性增大[26],使酚类物质和酶类物质反应生成活性极高的醌类物质,进一步聚合反应,生成黑色或褐色色素,引起果实褐变[27],直接影响果实营养成分的流失、降低食用性和商品性[25]。在对荔枝[28-29]的褐变进行研究时发现,荔枝果皮的褐变与PPO和POD有着密切的关系。本研究发现,甜樱桃果实的褐变指数与PPO和POD基因的相对表达量与在0.01水平上呈极显著正相关。在荔枝的研究中发现荔枝果皮褐变指数上升的同时POD活性也上升,POD也是果实酶促褐变过程中一种重要的酶,其能将果实中的酚类物质氧化成醌类物质,进一步聚合形成黑色物质。与本研究中甜樱桃果实褐变指数、PPO、POD活性趋势一致。SOD广泛存在于生物体内,与果实褐变密切相关。SOD能抑制酶促褐变的发生,反应后生成H2O2和O2,可以有效清除代谢过程中产生的活性氧。许宙等[30]在新高梨的研究中发现新高梨的褐变严重程度与SOD活性呈负相关,与本研究的结果一致。Zhang等[30]在荔枝贮藏的研究中发现,果皮发生褐变时,其POD活性上升,与本研究结果一致。
综上,EBR处理在贮藏过程中有效抑制甜樱桃果实的褐变,在贮藏过程中能提高CAT和SOD活性及基因的表达量,抑制PPO和POD活性及其基因的表达水平,其中5 μmol/L EBR处理效果最佳。表明EBR处理可以较好地保持甜樱桃果实贮藏过程中的品质及风味。
[1] 王宝刚,李文生,侯玉茹,杨军军,苗飞,冯晓元.甜樱桃物流及气调箱贮藏期间的品质变化[J].果树学报,2014(5):953-958.doi:10.13925/j.cnki.gsxb.20140096.
Wang B G,Li W S,Hou Y R,Yang J J,Miao F,Feng X Y.Changes of sweet cherry logistics and gas box during storage[J]. Journal of Fruit Science,2014(5):953-958.
[2] 王珊珊,朱志强,农绍庄,张平.樱桃冰温塑料箱式气调保鲜的效果[J].果树学报,2010(5):843-847.doi:10.13925/j.cnki.gsxb.2010.05.035.
Wang S S,Zhu Z Q,Nong S Z,Zang P.Effect of plastic-type air-conditioning on cherry ice temperature plastic box [J].Journal of Fruit Science,2010(5):843-847.
[3] 胡文忠.鲜切果蔬科学与技术[M].北京:化学工业出版社,2009.
Hu W Z.Fresh-cut fruits and vegetables science and technology [M].Beijing:Chemical Industry Press,2009.
[4] 高路,李新华.紫甘薯贮藏期间多酚氧化酶活性及褐变强度变化的研究[J].食品科学,2008,29(6):424-428.doi:10.3321/j.issn:1002-6630.2008.06.095.
Gao L,Li X H.Study on change of polyphenol oxidase activity and browning degree of purple sweet potato during storage[J].Food Science,2008,29(6):424-428.
[5] 朱新鹏,胡恒.马铃薯加工中褐变的研究进展[J].农产品加工学刊,2013(2):60-62.doi:10.3969/j.issn.1671-9646(X).2013.02.014.
Zhu X P,Hu H.Research progress on browning in potato processing [J].Journal of Agricultural Processing,2013(2):60-62.
[6] 郝亚勒.鲜切莲藕酶促褐变控制的研究[J].湖北农业科学,2014,53(11):2620-2623.doi:10.3969/j.issn.0439-8114.2014.11.035.
Hao Y L.Study on enzymatic browning control of fresh cut lotus root[J].Hubei Agricultural Sciences, 2014,53(11):2620-2623.
[7] 张芳,张永茂,康三江.鲜切苹果褐变抑制的研究[J].中国食物与营养,2011,17(7):58-60.doi:10.3969/j.issn.1006-9577.2011.07.015.
Zhang F,Zhang Y M,Kang S J.Studies on browning inhibition of fresh-cut apple[J].China Food and Nutrition,2011,17(7):58-60.
[8] 吴振先,苏美霞,陈维信,胡桂兵.贮藏荔枝果皮多酚氧化酶及过氧化物酶与褐变的研究[J].华南农业大学学报,1998,19(1):12-15.
Wu Z X,Su M X,Chen W X,Hu G B.Studies on the polyphenol oxidase,peroxidase and browning of litchi peel [J].Journal of South China Agricultural University,1998,19(1):12-15.
[9] Richard-forget F C,Gauillard F A.Oxidation of chlorogenic acid,catechins,and 4-methylcatechol in model solutions by combinations of pear polyphenol oxidase and per oxidase:a possible involvement of peroxidase in enzymatic browning[J].Journal of Agricultural and Food Chemistry,1997,45(7):2472-2476.doi.:10.1021/jf970042f.
[10] Zhan L J,Li Y,Hu J Q.Browning inhibition and quality preservation of fresh-cut romaine lettuce exposed to high intensity light[J].Innovative Food Science and Emerging Technologies,2012,14:70-76.doi:10.1016/j.ifset.2012.02.004.
[11] Jin P,Zheng Y,Tang S.A combination of hot air and methyljasmonate vapor treatment allevlates chilling injury of peach fruit[J].Postharvest Biology and Techology,2009,52(1):24-29.doi:10.1016/j.postharvbio.2008.09.011.
[12] Sun J,Xiang X,Yu C Y.Variations in contents of browning substrates and activies of some related enzymes during litchi fruit development[J].Scientia Horticulturae,2009,120(4):555-559.doi:10.1016/j.scienta.2008.12.006.
[13] 罗自生,张莉.壳聚糖/纳米SiOx复合涂膜对鲜切竹笋品质和生理的影响.[J].中国农业科学,2010,43(22):4694-4700.doi:10.3864/j.issn.0578-1752.2010.22.017.
Luo Z S,Zhang L.Effects of chitosan/Nano-SiO2 and composite coatings on the quality and physiology of fresh-cut bamboo shoots[J].Chinese Agricultural Sciences,2010,43(22):4694-4700.
[14] 皱丽红,张玉星.砂梨果肉褐变与酚类物质及相关酶活性的相关分析[J].果树学报,2012,29(6):1022-1026.doi:10.13925/j.cnki.gsxb.2012.06.017.
Zhou L H,Zhang Y X.Correlation analysis of browning and phenolic matter and related enzymes activities in prickly pear[J].Journal of Fruit Science,2012,29(6):1022-1026.
[15] 张亚伟,陈义伦.不同品种梨汁酶促褐变因子及相关性[J].中国农业科学,2011,44(9):1880-1887.doi:10.3864/j.issn.0578-1752.2011.09.015.
Zhang Y W,Chen Y L.Enzymatic browning factors and their correlation in pear juice[J].China Agricultural Sciences,2011,44(9):1880-1887.
[16] 周慧,王愈,王云香,李文生,王宝刚.EBR处理对甜樱桃贮藏期间品质及生理特性的影响 [J].食品工业科技,2018,39(12):290-295.doi:10.13386/j.issn1002-0306.2018.12.052.
Zhou H,Wang Y,Wang Y X,Li W S,Wang B G.Effects of EBR treatment on quality and physiological characteristics of sweet cherry during storage[J].Science and Technology of Food Industry,2018,39(12):290-295.
[17] 王春生,赵迎丽,王华瑞,李建华,施俊凤,张晓宇.气调贮藏对玉露香梨品质的影响[J].保鲜与加工,2007,7(5):25-28.doi:10.3969/j.issn.1009-6221.2007.05.011.
Wang C S,Zhao Y L,Wang H R,Li J H,Shi J F,Zhang X Y.Effect of modified atmosphere storage on the quality of Jade Lu pear [J].Preservation and Processing, 2007,7(5):25-28.
[18] 曹建康,姜微波,赵玉梅.果蔬采后生理生化试验指导[M].北京:中国轻工业出版社,2007:60-62.
Cao J K,Jiang W B,Zhao Y M.Fruit and vegetable post-harvest physiology and biochemistry test guidance[M].Beijing:China Light Industry Press,2007:60-62.
[19] 马跃,胡文忠,程双,姜爱丽,毕阳.鲜切对果蔬生理生化的影响及其调控方法[J].食品工业科技,2010,2(31):338-341.doi:10.13386/j.issn1002-0306.2010.02.066.
Ma Y,Hu W Z,Cheng S,Jiang A L,Bi Y.Effects of fresh cut on the physiological and biochemical changes of fruits and vegetables extremely[J].Food Industry Science, 2010,2(31):338-341.
[20] 潘永贵,陈维信.鲜切果蔬酶促褐变物理控制研究进展[J].农产品加工学刊,2007,12:7-9.doi:10.3969/j.issn.1671-9646-B.2007.12.002.
Pan Y G,Chen W X.Research advances in the physical control of fresh-cut fruits and vegetables enzymatic browning[J]. Journal of Agricultural Processing,2007,12:7-9.
[21] Saraiva J A,Nunes claudia S,Coimbra M A.Purification and characterization of olive peroxidase-evidence for the occurrence of a pectin binding peroxidase[J].Food Chemistry,2007,101(4):1571-1579.doi:10.1016/j.foodchem.2006.04.012.
[22] 谭谊谈,曾凯芳.鲜切果蔬酶促褐变关键酶研究进展[J].食品科学,2011,32(17):376-379.
Tan Y T,Zeng K F.Progress in the key enzymes of enzymatic browning in fresh-cut fruits and vegetables[J].Food Science,2011,32(17):376-379.
[23] 阙娟,金昌海,汪志君,尤海芹.梨果实后熟衰老过程中温度对活性氧清除的影响[J].广州食品工业科技,2004,20(3):41-44.doi:10.3969/j.issn.1673-9078.2004.03.014.
Que J,Jin C H,Wang Z J,You H Q.Effect of temperature on active oxygen scavenging in the process of postharvest senescence of pear[J].Guangzhou Food Science and Technology,2004,20(3):41-44.
[24] 李园园,王莉,周梦洁,张瑜,金鹏,郑永华.2,4-表油菜素内酯对草莓果实贮藏品质及抗氧化活性的影响[J].食品科学,2018,39(1):279-284.doi:10.7506/spkx1002-6630-201801042.
Li Y Y,Wang L,Zhou M J,Zhang Y,Jin P,Zheng Y H.Effect of 2,4-epibrassinolide on storage quality and antioxidant activity of strawberry fruits[J].Food Science,2018,39(1):279-284.
[25] 鞠志国,朱广廉.水果贮藏期间的组织褐变问题[J].植物生理学通讯,1988,24(4):46-48.doi:10.13592/j.cnki.ppj.1988.04.021.
Ju Z G,Zhu G L.Organizational browning problems during fruit storage[J].Physiophysiology,1988,24(4):46-48.
[26] 鞠志国,原永兵,刘成连,战淑敏,辛士海.急降温对活性氧和梨果心褐变的影响[J].中国农业科学,1994,27(5):77-81.
Ju Z G,Yuan Y B,Liu C L,Zhan S M,Xin S H.Effect of acute cooling on reactive oxygen species and pear browning [J].Chinese Journal of Agricultural Sciences,1994,27(5):77-81.
[27] 闫师杰.鸭梨采后果实褐变机理的影响因素及发生机理的研究 [D].北京:中国农业大学,2005.
Yan S J,Pear fruit postharvest browning mechanism of the influencing factors and mechanism of research[D].Beijing:China Agricultural University,2005.
[28] Neog N,Salkl A L.Control of postharvest pericarp browning of litchi(Litchi chinensis Sonn)[J].Journal of Food Science and Technology,2010,47:100-104.doi:10.1007/s13197-010-0001-9.
[29] Zhang Z K,Huber D J,Qua h X.Enzymatic browing and antioxidant activities in harvested litchi fruit as influenced by apple polyphenols[J].Food Chemistry,2015,171:191-199.doi:10.1016/j.foodchem.2014.09.001.
[30] 许宙,周文化,周其中.鲜切新高梨褐变相关酶活性研究[J].湖南林业科技, 2008,35(2):17-20. doi:10.3969/j.issn.1003-5710.2008.02.006.
Xu Z, Zhou W H, Zhou Q Z. Study on the enzyme activity correlated to browning in the fresh-cut Niitaka pear[J].Hunan Forestry Science & Technology, 2008, 35(2):17-20.
[31] Zhang Z Q,Pang X Q,Jia Z I.Role of peroxidase in anthocyanin degradation in litchi pericarp browning[J].Food Chemistry,2001,75:217-221.doi:10.1016/j.foodchem.2004.03.023.