甜瓜是世界畅销的高档果品,我国甜瓜栽培面积和产量居世界首位。春季提早栽培和秋季延后栽培是保障甜瓜周年供应的重要茬口。但早春和秋冬时节,外界气温低、阴雨天气多,加之设施覆盖材料遮蔽,甜瓜幼苗会长时间处于低温(<15 ℃)弱光(3 000~4 000 lx)状态,生长减缓,发育不良,出现生理伤害[1]。因此,低温弱光是冬春保护地栽培中影响甜瓜生产效益的重要障碍因素,选育耐低温弱光品种是甜瓜育种的重要目标[2]。
低温弱光会诱发植物产生系统反应抵御逆境,如脯氨酸、可溶性糖、可溶性蛋白等与植物抗逆性密切相关的物质含量增加[3-4],SOD、CAT和POD等保护酶活性变化[5-6],类胡萝卜素和叶绿素等光合色素含量降低[7-8],以及根系丙二醛含量上升[9]等,最终导致植株株高、茎粗、地上部鲜质量、叶片数、叶色、根系活力等形态特征和生长量发生变化[10]。在众多表型和生理变化中,准确地选择与胁迫处理紧密相关的指标,使用统一的数据处理方法,是耐性评价结果复现与交流的基础。甜瓜耐低温弱光鉴定指标和数据处理方法尚未统一,不同学者提出了各自的鉴定指标和数据处理方法。高青海等[10]对20份薄皮甜瓜进行低温弱光处理,测定株高、地上部干质量、根长等12个表型指标,通过计算各指标相对值(低温弱光胁迫下数值与对照条件下数值的比值),利用主成分分析和逐步回归,建立了以12个表型为变量的甜瓜幼苗期耐低温弱光方程,并指出,相对根系鲜质量和相对叶片数等对低温弱光胁迫响应敏感,可以作为鉴定甜瓜耐低温弱光鉴定指标,该鉴定方法的测量和分析过程均较繁琐。李静[9]通过比较3个甜瓜品种幼苗表型(株高、根冠比等)和生理指标(叶绿素和丙二醛含量)的变化幅度(低温弱光胁迫下数值与对照条件下数值的差值),指出叶绿素和丙二醛在品种间差异明显,可以作为鉴定指标。
经实际观察,甜瓜幼苗经过低温弱光处理,出现叶色变黄和沤根情况。叶片叶绿素和根系丙二醛,是众多学者普遍认可的与低温弱光逆境表型密切相关的生理指标。但怎样充分考虑低温弱光处理前,不同甜瓜材料间生理指标的差异对低温弱光处理后测量数据的影响,建立统一的数据处理方式,目前还未见相关报道。为此,本研究以胁迫后叶片叶绿素和根系丙二醛含量测量值与胁迫前后2个指标的变幅2组数据,作为甜瓜耐低温弱光生理指标耐性评价依据[11];同时调查供试甜瓜材料经过低温弱光处理后的伤害指数;通过比较伤害指数和生理指标鉴定结果,确定生理指标评价依据的正确性,为甜瓜耐低温弱光育种过程中,鉴定数据处理方式标准化提供依据。同时,筛选甜瓜耐低温弱光特性极端材料,用以相关分子标记的筛选工作。
1 材料和方法
1.1 植物材料
8份供试甜瓜材料为本单位多年选育高代核心亲本,编号为P51、P53、P60、P131、P136、P143、P148和P149。选取饱满种子,常规催芽,种子露白后播种于32孔穴盘中,每个材料播种3盘。播种后,置于光照培养箱中培养,培养温度为25 ℃/18 ℃(16 h/8 h,白天/黑夜),湿度为75%,光照强度为 30 000 lx。
1.2 试验方法
甜瓜幼苗长至两叶一心期,取一盘甜瓜幼苗,参照宋慧等[11]报道的方法,测量幼苗第1片新叶叶绿素SPAD值和根系丙二醛(MDA)含量,数值记为CK1。取第2盘幼苗在正常条件下继续培养15 d,测量SPAD值和MDA含量,数值记为CK2。转移第3盘幼苗至低温弱光处理环境,处理条件为15℃/8℃(12 h/12h,白天/黑夜),湿度为75%,光照强度为4 000 lx。处理15 d后,首先依照伤害分级标准:
0级:子叶绿色,第1新叶绿色,第2新叶绿色,植株继续生长;
1级:子叶黄色,第1新叶绿色,第2新叶绿色,植株继续生长;
2级:子叶黄色,第1新叶绿色,第2新叶绿色,植株生长缓慢;
3级:子叶黄色,第1新叶绿色,第2新叶绿色,植株生长停止;
4级:子叶黄色,第1新叶黄色,第2新叶绿色,植株生长缓慢;
5级:子叶黄色,第1新叶黄色,第2新叶黄色,植株停止生长。
计算伤害指数![]() 再测量低温弱光处理后的植株SPAD值和MDA含量,数值分别记为A和B。最后利用SPSS软件的ANOVA功能和S-N-K法多重比较,对8份甜瓜材料在低温弱光处理后的SPAD和MDA值(A和B)进行评价,结合︱CK1-A︱和︱CK1-B︱,判断不同材料对低温弱光耐受能力。
再测量低温弱光处理后的植株SPAD值和MDA含量,数值分别记为A和B。最后利用SPSS软件的ANOVA功能和S-N-K法多重比较,对8份甜瓜材料在低温弱光处理后的SPAD和MDA值(A和B)进行评价,结合︱CK1-A︱和︱CK1-B︱,判断不同材料对低温弱光耐受能力。
2 结果与分析
2.1 8份甜瓜材料低温弱光伤害指数结果
8份甜瓜材料在低温弱光条件下处理15 d后,子叶和新叶出现不同程度的黄化,生长点活力下降(图1)。根据伤害指数结果(表1),伤害指数越大,耐低温弱光性能越差,8份材料对低温弱光胁迫耐受能力排序为:P143>P60>P51>P53>P131>P149>P148>P136。其中,P143经过低温弱光胁迫,植株虽然瘦弱,但是叶片保持绿色,生长点继续生长,伤害指数最低,为13.8±2.1;P60和P51的植株经胁迫停止生长,但全株仅子叶发黄,新叶保持绿色,对低温弱光表现一定耐受,伤害指数分别为36.3±2.6和37.5±4.5。P148、P149和P136表现不耐低温弱光,全株发黄,植株停止生长,伤害指数均大于90。P53和P131耐受能力居中,伤害指数分别为56.3±2.7和70.0±1.6。

图1 8份甜瓜材料低温胁迫处理前(CK1)和处理后(AB)的植株生长情况
Fig.1 The growth of 8 melon seedlings before(CK1)and after(AB)low temperature and low light stress
2.2 依照叶绿素和丙二醛含量评价8份甜瓜耐低温弱光特性
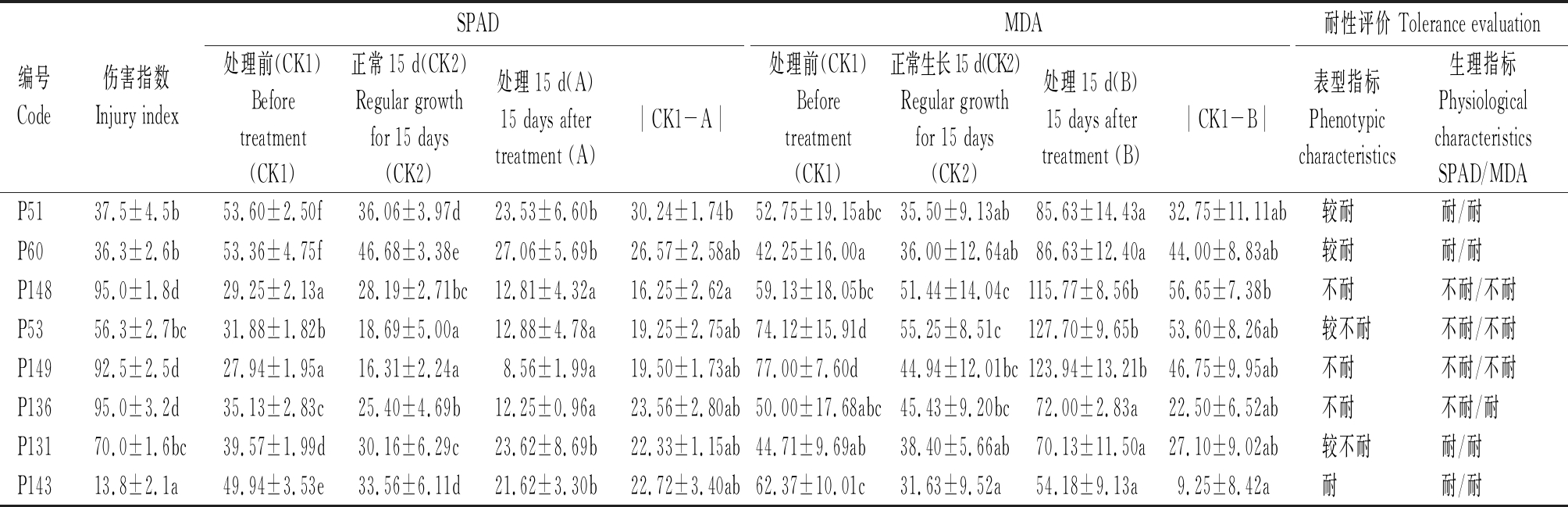
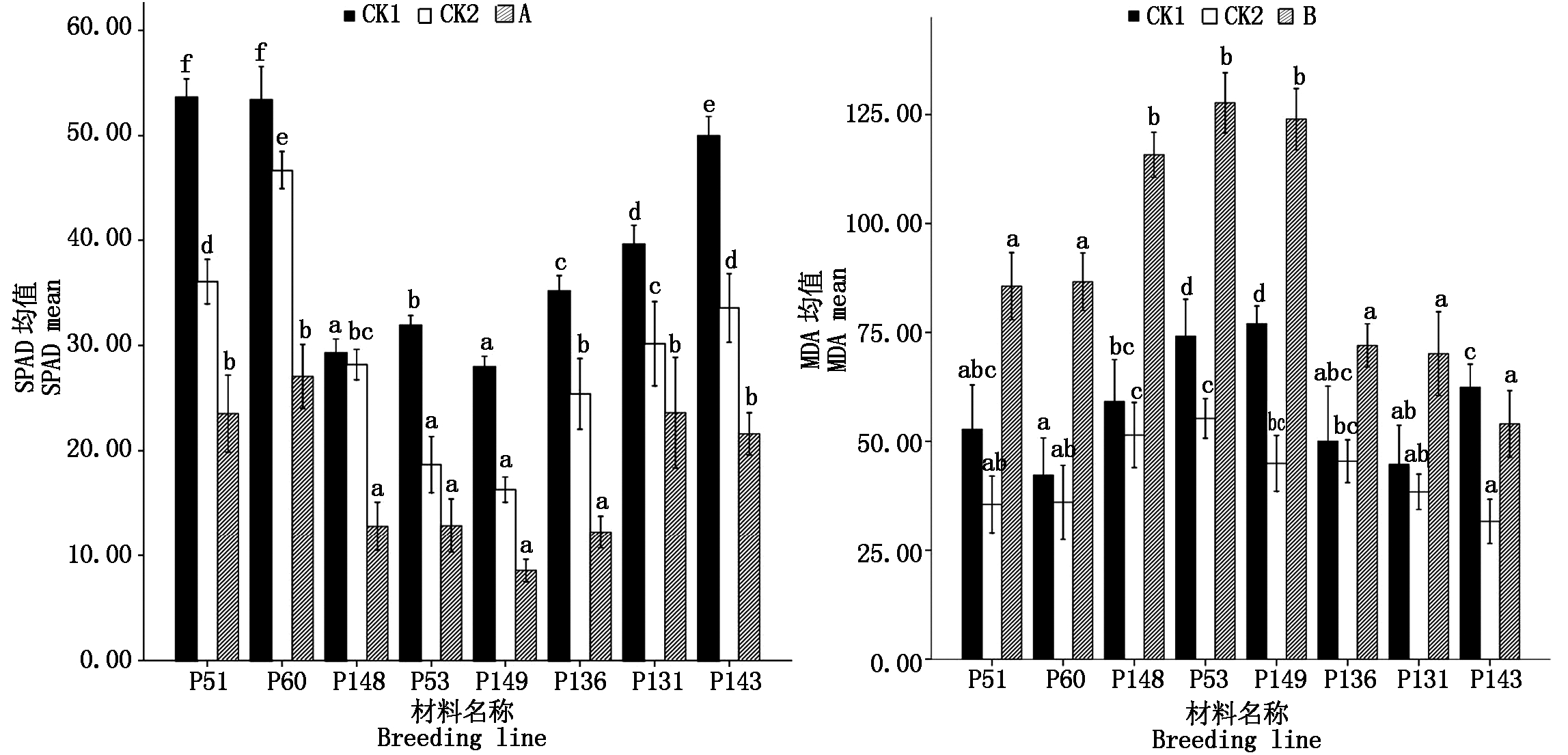
8份甜瓜材料处理前(CK1)、正常生长15 d(CK2)和低温弱光胁迫处理15 d的SPAD值(A)和MDA值(B)见表1。不同材料之间,处理前(CK1)和正常生长15 d以后(CK2)的SPAD值和MDA值均存在显著性差异。表明不同甜瓜材料在胁迫处理之前,SPAD值和MDA值已经存在显著性差异;正常培养15 d,SPAD值和MDA值之间的差异仍然存在。多重比较结果显示,在处理前(CK1)和正常生长15 d(CK2)2种情况下,SPAD值和MDA值的显著性字母范围分别为a~f/a~e和a~c/a~c,表明不同材料之间SPAD值比MDA值变异幅度大,地上部分的叶绿素含量比地下部分的丙二醛含量变化大,地下部分的生长相对稳定。由图2直观可见,植株正常生长15 d,甜瓜叶片SPAD值和根系MDA值均下降,表明植株叶片叶绿素含量降低,叶片逐渐老化,但是根系活力上升,植株生长稳健。
表1 供试甜瓜材料的伤害指数及处理前、正常生长15 d和低温弱光胁迫处理15 d的SPAD和MDA值
Tab.1 Injury index and SPAD and MDA values measured before(CK1)and after(AB)low temperature and low light stress and 15 days after regular growth(CK2)of 8 melon seedlings
注:不同小写字母表示P<0.05水平差异显著。
Note:Different lowercase letters means significant difference at the P<0.05 level.
编号Code伤害指数Injury indexSPADMDA耐性评价 Tolerance evaluation处理前(CK1)Beforetreatment (CK1)正常15 d(CK2)Regular growthfor 15 days (CK2)处理15 d(A)15 days aftertreatment (A)︱CK1-A︱处理前(CK1)Beforetreatment (CK1)正常生长15 d(CK2)Regular growthfor 15 days (CK2)处理15 d(B)15 days aftertreatment (B)︱CK1-B︱表型指标Phenotypiccharacteristics生理指标PhysiologicalcharacteristicsSPAD/MDAP5137.5±4.5b53.60±2.50f36.06±3.97d23.53±6.60b30.24±1.74b52.75±19.15abc35.50±9.13ab85.63±14.43a32.75±11.11ab较耐耐/耐P6036.3±2.6b53.36±4.75f46.68±3.38e27.06±5.69b26.57±2.58ab42.25±16.00a36.00±12.64ab86.63±12.40a44.00±8.83ab较耐耐/耐P14895.0±1.8d29.25±2.13a28.19±2.71bc12.81±4.32a16.25±2.62a59.13±18.05bc51.44±14.04c115.77±8.56b56.65±7.38b不耐不耐/不耐P5356.3±2.7bc31.88±1.82b18.69±5.00a12.88±4.78a19.25±2.75ab74.12±15.91d55.25±8.51c127.70±9.65b53.60±8.26ab较不耐不耐/不耐P14992.5±2.5d27.94±1.95a16.31±2.24a8.56±1.99a19.50±1.73ab77.00±7.60d44.94±12.01bc123.94±13.21b46.75±9.95ab不耐不耐/不耐P13695.0±3.2d35.13±2.83c25.40±4.69b12.25±0.96a23.56±2.80ab50.00±17.68abc45.43±9.20bc72.00±2.83a22.50±6.52ab不耐不耐/耐P13170.0±1.6bc39.57±1.99d30.16±6.29c23.62±8.69b22.33±1.15ab44.71±9.69ab38.40±5.66ab70.13±11.50a27.10±9.02ab较不耐耐/耐P14313.8±2.1a49.94±3.53e33.56±6.11d21.62±3.30b22.72±3.40ab62.37±10.01c31.63±9.52a54.18±9.13a9.25±8.42a耐耐/耐
植株经过低温弱光处理15 d后,不同材料间处理后的SPAD和MDA值(A和B值)存在显著性差异(表1),多重比较结果的显著性字母范围缩小到a~b,较好地区分了低温弱光耐性和感性材料。根据8份供试甜瓜SPAD的A值S-N-K多重比较结果(表1、图2),低温胁迫后P60、P131、P51和P143叶片叶绿素含量显著高于P149、P136、P148和P53,表现耐低温弱光。根据材料的MDA的B值S-N-K多重比较结果(表1、图2),确定P143、P131、P136、P51和P60的MDA含量显著低于P149、P53和P148,根系活力较强,表现耐胁迫。综合A值和B值的评价结果,8份材料中7份材料的耐性评价结果一致,低温弱光耐性材料是P143、P131、P60和 P51;不耐材料是P149、P53、P148;2个指标评价一份材料(P136)的结果不一致。SPAD的评价P136结果为不耐低温弱光,而MDA的评价结果为耐低温弱光。
不同小写字母表示P<0.05水平差异显著。
Different lowercase letters means significant difference at the P<0.05 level.
图2 8份甜瓜材料低温弱光处理前(CK1)、正常生长15 d(CK2)和低温弱光处理15 d后的SPAD值(A)和MDA值(B)
Fig.2 The SPAD value and MDA value collected before(CK1)and after(A and B)low temperature and low light stress and 15 days after regular growth(CK2)in 8 melon seedlings
图2可见,叶片SPAD值(A值)较处理前(CK1)大幅下降,降幅超过了正常生长15 d SPAD的变化幅度;而根系MDA值(B值)较CK1则大幅上升,与正常生长15 d MDA值的变化规律完全相反(图2)。表明植株经过低温弱光胁迫,叶片加速老化,根系活力下降,植株的地上部和地下部的生长均受到抑制。不同材料间处理后的SPAD和MDA值变化幅度(︱CK1-A︱和︱CK1-B︱)也存在显著差异(表1)。A值越大、B值越小、变化幅度(︱CK1-A︱和︱CK1-B︱)小的材料,表现为叶绿素含量较高、根系活力较强,耐受低温弱光能力强;相反,A值越小、B值越大,变化幅度大的材料,则表现为叶片老化严重,根系活力降低,不耐低温弱光。
2.3 低温弱光伤害指数和SPAD/MDA含量2种方法的鉴定结果比较及极端材料筛选
由表1可以看出,通过伤害指数和SPAD/MDA含量2种鉴定方法共同筛选到的耐低温弱光材料有3个,分别是P143、P60和P51;不耐低温弱光材料有3个,分别是P53、P148、P149。对于P136的耐性评价,表型伤害指数和SPAD的结果一致,均为不耐低温弱光,而MDA的评价结果为耐低温弱光。这主要是因为表型伤害指数的调查性状主要是植株叶片颜色和地上部分的生长情况,这与SPAD值反映植株叶片叶绿素含量具有相关性,两者的评价结果一致性高。而MDA反映的是植株地下部分对低温弱光的适应性,结合SPAD和MDA对材料进行耐性评价更全面。根据SPAD和MDA评价P136的结果,该材料根部生长较其他敏感材料耐逆性强,材料整体耐低温弱光性居中。从表1可见,对于P131的耐性判断,表型伤害指数和生理SPAD/MDA含量结果不一致,表型伤害指数评价结果为较不耐低温弱光,SPAD/MDA含量鉴定结果为耐低温弱光。由于SPAD和MDA可以同时评价材料地上部和地下部对低温弱光的耐受能力,评价结果更全面,且P131经过胁迫处理,SPAD和MDA的变幅(︱CK1-A︱和︱CK1-B︱)居中,表现出对低温弱光胁迫一定的耐受性,因此,鉴定结果应以生理指标为准。其余供试甜瓜材料的生理和表型鉴定结果吻合度好,最终选择耐低温弱光甜瓜材料P143和敏感材料P149,用以后续甜瓜耐低温弱光分子标记筛选。
3 讨论和结论
植物的生长发育易受诸多环境因素的影响,其中,温度和光照较为显著[12]。研究表明,低温弱光抑制红芸豆[6]、葫芦[8]、辣椒[13]和西瓜[14]等作物的幼苗生长,叶绿素含量显著降低,光合作用受阻,代谢功能永久丧失[15-16]。黄丽芳等[17]报道了西葫芦幼苗在低温弱光胁迫后,表现出明显的缺绿症状,叶片黄化严重,叶绿素含量变幅加大。同时,低温弱光条件下,植物体内产生大量活性氧(ROS),与细胞膜发生膜脂过氧化反应,破坏细胞膜结构,产生丙二醛。丙二醛含量直接反映植物细胞膜伤害程度,丙二醛含量越低,表明植物抗逆性越强,受伤程度越小[18-19]。刘凯歌等[20]研究发现,随着低温弱光处理时间增加,敏感甜椒品种较耐受品种的丙二醛含量增幅变大。本试验结果显示,甜瓜在低温弱光条件下叶片SPAD值大幅下降,根系MDA值大幅上升,这与其他作物逆境处理后的表现规律一致。
不同基因型甜瓜幼苗在正常生长条件下,均表现为叶色绿,生长点健康,表型差异不显著;但经测量,不同基因型甜瓜幼苗在低温弱光胁迫之前,SPDA和MDA含量(CK1)已经存在显著差异。不同基因型甜瓜幼苗经过低温弱光处理后,材料间SPDA和MDA含量(A和B值)和变幅(︱CK1-A︱和︱CK1-B︱)均存在显著差异,表明不同材料受低温弱光的抑制程度不同。是否应该引入处理前SPAD和MDA含量(CK1),通过相差或者比值降低材料间原始差异,以正确利用胁迫处理后的SPAD和MDA测量值,准确反应植株的差异,很多学者的结论不尽相同,影响鉴定方法的统一。本研究通过比较低温弱光伤害指数和处理后SPAD和MDA含量(A和B)2种方法的鉴定结果,明确不同类型的甜瓜幼苗,经过低温弱光胁迫后,叶片SPAD值和根系MDA值(A值和B值)的差异,即可准确反应材料之间耐受低温弱光特性的差异,无需引入CK1;但是可以通过变幅︱CK1-A︱和︱CK1-B︱辅助了解不同材料对胁迫的敏感程度。该结论与何晓童等[6]报道一致,其指出,低温弱光胁迫下,小红芸豆比英国大红芸豆叶绿素含量下降幅度明显,认为相比小红芸豆,英国大红芸豆具有较强的低温弱光适应性。明确作物胁迫处理后的数据处理方式,对统一甜瓜耐低温弱光鉴定方法是个有益的补充;同时,也为其他逆境胁迫数据处理起到借鉴作用。
[1] 李小平,姜宏立,郑传举,刘路广,罗金耀,陈小宝,程国银. 低温弱光对典型大棚作物生长影响的试验研究[J]. 灌溉排水学报,2019,38(S2):48-51.doi:10.13522/j.cnki.ggps.20190196.
Li X P,Jiang H L,Zheng C J,Liu L G,Luo J Y,Chen X B,Cheng G Y. Experimental study on response of greenhouse crops under low irradiance and temperature[J]. Journal of Irrigation and Drainage,2019,38(S2):48-51.
[2] 周峰. 甜瓜耐低温、耐弱光鉴定方法和鉴定指标研究[D]. 扬州:扬州大学,2012.
Zhou F. Studies on appraisal method and index of low temperature resistance and low light tolerance in melon [D].Yangzhou:Yangzhou Univesity,2012.
[3] 董玉梅,焦自高,王崇启,肖守华. 低温弱光胁迫对网纹甜瓜嫁接苗与自根苗某些物质含量的影响[J]. 山东农业大学学报(自然科学版),2005,36(1):67-69.doi:10.3969/j.issn.1000-2324.2005.01.014.
Dong Y M,Jiao Z G,Wang C Q,Xiao S H. Effect of low temperature and poop light on contents of some substances of grafted and own root melon seedlings[J]. Journal of Shandong Agricultural University(Natural Science),2005,36(1):67-69.
[4] 严立斌,孟雅宁,张红肖,范妍芹. 甜(辣)椒耐低温弱光种质资源的筛选利用[J]. 蔬菜,2019(12):22-28.
Yan L B,Meng Y N,Zhang H X,Fan Y Q. Screening and utilization of low temperature and low light resistant germplasm resources of sweet(spicy)pepper[J]. Vegetables,2019(12):22-28.
[5] 乔宏宇,周艳丽,高红春. 低温弱光对不同砧木甜瓜嫁接苗生理指标的影响[J]. 东北农业科学,2016,41(2):84-87. doi:10.16423/j.cnki.1003-8701.2016.02.020.
Qiao H Y,Zhou Y L,Gao H C. Effect of low temperature and poor light on some physiological indexes of melon seedlings grafted on different rootstocks[J]. Journal of Northeast Agricultural Sciences,2016,41(2):84-87.
[6] 何晓童,王盛祥,王玉萍. 低温弱光对红芸豆幼苗生长及生理生化特性的影响[J]. 甘肃农业大学学报,2019,54(1):80-88. doi:10.13432/j.cnki.jgsau.2019.01.011.
He X T,Wang S X,Wang Y P. Effects of low temperature and week light on growth and physiological and biochemical characteristics of red kidney bean seedlings[J]. Journal of Gansu Agricultural University,2019,54(1):80-88.
[7] 陈年来,王兴虎,安黎哲,王刚. 低温对厚皮甜瓜幼苗光合特性的影响[J]. 冰川冻土,2009,31(5):986-991.
Chen N L,Wang X H,An L Z,Wang G. Effect of low temperature on photosynthetic properties of melon seedlings[J]. Journal of Glaciology and Geocryology,2009,31(5):986-991.
[8] 赵燕,张雪,吕童,呼忠婷. 低温弱光对工艺葫芦幼苗叶绿素荧光特性及光合特性的影响[J]. 安徽农业科学,2020,48(4):49-52. doi:10.3969/j.issn.0517-6611.2020.04.015.
Zhao Y,Zhang X,Lü T,Hu Z T. Effects of low temperature and low light on chlorophyll fluorescence and photosynthetic characteristics of calabash seedlings[J]. Journal Anhui Agricultural Science,2020,48(4):49-52.
[9] 李静. 低温弱光胁迫对甜瓜幼苗生长及生理指标的影响[J]. 河南农业科学,2012,41(5):106-109. doi:10.15933/j.cnki.1004-3268.2012.05.029.
Li J. Effects of chilling and low light on vegetative and physiological parameters of melon seedlings[J]. Journal of Henan Agricultural Sciences,2012,41(5):106-109.
[10] 高青海,王亚坤,郭远远. 薄皮甜瓜种质资源苗期耐低温弱光鉴定及形态指标选择[J]. 浙江农业学报,2016,28(8):1360-1367. doi:10.3969/j.issn.1004-1524.2016.08.13.
Gao Q H,Wang Y K,Guo Y Y. Identification for tolerance to low temperature and weak light and selection for morphological indexes of melon at seedling stage[J]. Acta Agriculturae Zhejiangensis,2016,28(8):1360-1367.
[11] 宋慧,张凌霄,黄芸萍,臧全宇. 低温弱光胁迫下甜瓜幼苗叶片叶绿素和根系丙二醛变化规律研究[J]. 宁波农业科技,2018,3:14-16.
Song H,Zhang L X,Huang Y P,Zang Q Y. Effects of low temperature and low light stress on leave chlorophyll and root MDA contents of melon seedlings[J]. Ningbo Agricultural Sciences,2018,3:14-16.
[12] 李琦.低温弱光对甜瓜幼苗生理特性的影响[D].武汉:华中农业大学,2012.doi:10.7666/d.Y2161856.
Li Q. Effects of low temperature and low light stress on physiological characteristics of melon seedlings[D].Wuhan:Huazhong Agricultural University,2012.
[13] 王春萍,黄启中,雷开荣,吕中华,静一,黄任中,林清,郑勇.低温弱光下辣椒幼苗叶绿素荧光特性及其与品种耐性的关系[J].园艺学报,2015,42(9):1798-1806.doi:10.16420/j.issn.0513-353x.2015-0148.
Wang C P,Huang Q Z,Lei K R,Lü Z H,Jing Y,Huang R Z,Lin Q,Zheng Y. Chlorophyll fluorescence characteristics of pepper seedlings under low temperature and weak light and their relationship to varieties tolerance[J]. Acta Horticulturae Sinica,2015,42(9):1798-1806.
[14] 侯伟,孙爱花,杨福孙,詹园凤,李尚真,周兆德.低温胁迫对西瓜幼苗光合作用与叶绿素荧光特性的影响[J].广东农业科学,2014,13:35-39.doi:10.16768/j.issn.1004-874x.2014.13.024.
Hou W,Sun A H,Yang F S,Zhan Y F,Li S Z,Zhou Z D. Effects of low temperature stress on photosynthesis and chlorophyll fluorescence in watermelon seedlings[J]. Guangdong Agricultural Science,2014,13:35-39.
[15] 颉建明,郁继华,黄高宝,冯致.低温弱光下辣椒叶片 PSⅡ光能吸收和转换变化及与品种耐性的关系[J].中国农业科学,2011,44(9):1855-1862.doi:10.3864/j.issn.0578-1752.2011.09.012.
Xie J M,Yu X H,Huang G B,Feng Z. Correlations between changes of absorption and transformation of light energy by PSⅡ in pepper leaves and the variety tolerance under low temperature and weak light[J]. Scientia Agricultura Sinica,2011,44(9):1855-1862.
[16] 周超凡,吴帼秀,李婷,毕焕改,李清明,艾希珍.外源H2S 对低温下日光温室黄瓜光合作用及抗氧化系统的影响[J].园艺学报,2016,43(3):462-472.doi:10.16420/j.issn.0513-353x.2015-0808.
Zhou C F,Wu G X,Li T,Bi H G,Li Q M,Ai X Z. Effect of exogenous hydrogen sulfide on photosynthesis and antioxidant system of cucumber leaves under low temperature in solar-greenhouse[J]. Acta Horticulturae Sinica,2016,43(3):462-472.
[17] 黄丽芳,刘建汀,王彬,温庆放,朱海生,林碧英. 低温弱光对西葫芦幼苗生长生理指标的影响[J]. 福建农业科技,2018,7:11-16. doi:10.13651/j.cnki.fjnykj.2018.07.003.
Huang L F,Liu J D,Wang B,Wen Q F,Zhu H S,Lin B Y. Effects of low temperature and weak illumination on physiological indices of summer squash seedlings[J]. Fujian Agricultural Science,2018,7:11-16.
[18] 常静,郭磊,巩在武. 低温弱光胁迫对辣椒叶片生理特性和光合特性的影响[J]. 江苏农业科学,2017,45(10):113-116.doi:10.15889/j.issn.1002-1302.2017.10.032.
Chang J,Guo L,Gong Z W. Effects of low temperature and low light stress on physiological and photosynthesis characteristics of pepper seedlings[J]. Jiangsu Agricultural Science,2017,45(10):113-116.
[19] 孟雅宁,严立斌,张红肖,范妍芹.低温弱光胁迫对甜椒幼苗生长及生理指标的影响[J].辣椒杂志,2019,1:22-25.doi:10.16847/j.cnki.issn.1672-4542.2019.01.007.
Meng Y N,Yan L B,Zhang H X,Fan Y Q. Effects of low temperature and low light density on the growth and physiological indexes of sweet pepper seedlings[J]. Journal of China Capsicum,2019,1:22-25.
[20] 刘凯歌,龚繁荣,宋云鹏,张丽丽. 低温弱光对甜椒幼苗生长和生理生化指标的影响及其与品种耐性的关系[J]. 北方园艺,2020,3:8-14. doi:10.11937/bfyy. 20192253.
Liu K G,Gong F R,Song Y P,Zhang L L. Effects of low temperature and weak light on the growth and physiological and biochemical indexes of sweet pepper seedlings and the relationship to varieties tolerance[J]. Northern Horticulture,2020,3:8-14.