黄瓜(Cucumis sativus L.)是葫芦科最重要的蔬菜作物之一,起源于喜马拉雅山脉南部,喜欢温暖潮湿的环境,对水分缺乏十分敏感[1]。水分是黄瓜生长发育过程中的关键限制因素,当土壤缺水时通常会发生干旱胁迫,干旱胁迫会导致黄瓜产量、品质下降,造成严重的经济损失[2]。前人关于黄瓜抗旱性已在不同方面进行的研究[3-9]。一氧化碳(CO)在刺激的干旱胁迫下参与氢气(H2)诱导的不定根发育,并通过改变相对生理指数减轻氧化损伤[3]。Cui等[4]基于生理和iTRAQ的蛋白质组学分析揭示了CO2浓度升高缓解黄瓜幼苗干旱胁迫的机制。CsCER1参与黄瓜表皮蜡质的合成,过表达该基因可以提高缺水条件下的耐旱性[5]。外源施加的过氧化氢可通过增加植物的抗氧化防御系统及其渗透调节能力来显著增强黄瓜的抗旱性[6]。在转基因黄瓜中诱导烟草PR-2d启动子/uidA(GUS)基因,结果表明,这可以改善对黄瓜生物和非生物刺激的反应[7]。通过增加ABA的生物合成和敏感性,将黄瓜嫁接到丝瓜上提高了黄瓜抗旱性[8]。由3株植物促生根瘤菌(PGPR)菌株(蜡状芽孢杆菌AR156,枯草芽孢杆菌SM21和沙雷氏菌XY21)组成的联合体(简称BBS),BBS通过保护黄瓜细胞,维持光合作用效率和根系活力以及增加一些抗氧化酶活性,增加了黄瓜对干旱胁迫的诱导性系统耐受性[9]。
MYB转录因子是普遍存在于植物中的一类重要转录因子,参与植物生长发育、生理代谢、细胞形态和模式建成等生理过程,广泛分布于所有真核生物中[10]。MYB 蛋白的共同特征是 DNA 结合区(MYB结构域),该结构域一般由植物中1~4个不完全重复序列(R)。MYB 家族根据重复序列的数目和位置分为4个亚家族,即 4R-MYB、R1R2R3-MYB、R2R3-MYB 和 1R-MYB[11-12]。NCBI中已录入的MYB基因在2013年3月时达到29313个[13]。组成这些基因构成了植物(Transcription Factor,TF)的大家族,据报道,R2R3亚家族中很多成员在植物响应非生物胁迫过程中发挥了多种功能[14]。第一个在双子叶模式植物拟南芥中发现的R2R3亚家族的 MYB 基因AtMYB2受激素ABA诱导,响应植物的抗旱应答[15]。拟南芥中的GaMYB85基因异位表达的转基因植物通过气降低孔密度、降低气孔开放率的方式提高对干旱的耐受能力[16]。MYB94、MYB96通过增加表皮蜡的生物合成响应干旱胁迫[17-19]。田薯中IbMYB116基因可能通过转基因拟南芥中的JA信号通路激活ROS清除系统来增强抗旱性[20]。水稻中OsMYB4[21],OsMYB3R-2[22]和OsMYB2[23],它们的过表达能够明显提高水稻抗旱性。番茄和苹果中MdoMYB121蛋白过表达能够增强其对干旱胁迫的耐受性[24]。
干旱是阻碍黄瓜生长和发育以及产量的重要非生物限制因素。当前的全球气候变化模型预测,随着总体温度的升高,在未来的几十年中,缺水现象将变得更加严重[25]。黄瓜的种植及培育将面临严峻问题,为了研究黄瓜响应干旱机制,本研究以前期通过EMS诱变获得的黄瓜蜡脂缺失突变体为试验材料进行转录组分析,获得了一个在蜡质缺乏突变体中上调的差异表达基因,CsaV3_3G039670(log2FC=1.10),该基因属于MYB转录因子家族,是拟南芥中R2R23亚家族MYB94转录因子的同源基因,因此,命名为CsMYB94,并对基因CsMYB94进行克隆,通过对分析CsMYB94基因结构和CsMYB94基因在黄瓜各组织中的表达情况,获得初步结论为CsMYB94在黄瓜响应干旱过程中发挥作用,这一结论为了解黄瓜响应干旱机制提供理论参考。
1 材料和方法
1.1 试验材料
本试验材料种为华南型黄瓜649和以649为野生型经EMS诱变得到的蜡质缺失突变体。2019年5月1日直播于湘潭基地温室大棚,采用常规方式管理。播种55 d后,选取长势一致的黄瓜植株,选取植株顶部幼嫩叶片、开花当天的子房、开花前一天的雄花、植株生长点附近的卷须、距顶端较近的茎,用锡箔纸把采集的实验材料包好并迅速投入到液氮中,回到实验室后马上置于-80 ℃超低温冰箱中冷存备用。
1.2 RNA的提取及cDNA的合成
采用参考文献[26]中方法对1.1中备用的试验材料进行总RNA的提取,对提取的RNA进行 UV-240 紫外分光光度计浓度测定,要求OD260/280为1.8~2.0。利用RNA反转录盒子(康为世纪 HiFiScript cDNA Synthesis Kit)把准备好的各组织部位的RNA反转录为cDNA,置于-20 ℃冰箱保存备用。
1.3 CsMYB94基因的克隆与测序
本实验室在前期获得黄瓜EMS诱变蜡质突变体基础上,对其进行了转录组分析,获得了一个在蜡质突变体中显著上调表达的基因CsaV3_3G039670(log2FC=1.10)。该基因属于MYB转录因子家族中R2R3亚家族,其拟南芥中同源基因MYB94通过调节植物表皮蜡质的方式响应干旱胁迫。为了研究黄瓜响应干旱机制,因此,以基因CsaV3_3G039670的cDNA序列为模板,利用Primer 5.0软件设计引物(上游引物:5′-ATGGGAAGGCCTCCATGT-3′,下游引物:5′-CTAGAACACCGGCGACAACT-3′)对其进行克隆,命名为CsMYB94。目的片段长度为885 bp。MYB94基因克隆程序:94 ℃预变性5 min后变性30 s,55 ℃复性30 s,72 ℃延伸60 s,34个循环,72 ℃ 10 min。利用琼脂糖凝胶电泳观察克隆情况,将克隆产物纯化、回收,将产物连接到P-Clone007载体(购自擎科生物工程(长沙)股份有限公司)上,将连接产物转化到大肠杆菌感受态 DH5α 中,利用含有Amp(氨苄青霉素)( 100 mg/mL) 的 LB 固体琼脂培养基进行菌落筛选,随机挑取较圆、大小均匀的单菌落摇菌,待菌液浑浊后进行菌液 PCR 验证,将出现目的基因的菌液送擎科生物工程(长沙)股份有限公司进行测序。
1.4 CsMYB94蛋白生物信息学分析
在黄瓜基因组数据库(http://cucurbitgenomics.org/)找到CsMYB94蛋白。利用在线软件http://smart.embl-heidelberg.de/smart/show_motifs.pl分析CsMYB94蛋白结构域。利用http://web.Expasy.org/protparam/对CsMYB94蛋白一级结构进行预测和分析、利用https://web.Expasy.org/protscale/对CsMYB94蛋白疏水性及亲水性预测。利用在线软件https://npsa-prabi.Ibcp.fr/cgi-bin/npsa-automat.pl?page=/NPSA/npsa-sopma.Html预测MYB94蛋白质的二级结构;利用https://swissmodel.Expasy.org/对CsMYB94蛋白三级结构预测;蛋白序列亚细胞定位:http://www.Softberry.Com;在national center for biotechnology information(NCBI)中利用Blast程序找到与CsMYB94蛋白质同源性高的植物蛋白质序列、下载下来并以FAST形式保存文本,再通过MEGA 5.0软件将CsMYB94蛋白质序列和其他同源性高的植物蛋白质序列采用邻近相连的方法构建CsMYB94蛋白质的系统发育树。
1.5 CsMYB94表达模式分析
以CsMYB94基因序列为模板设计引物(上游引物:5′-CCACCACTCGCTTTCAATCC-3′,下游引物:5′-TCGAGATTCCTCCGGTGAAG-3′),以1.2中的反转录获得的cDNA作为模板。利用Toyobo公司的SYBR-Green试剂盒染料,和 iCycler iQTM 5 real-time PCR检测系统(Bio-Rad,Hercules,CA,USA),内参为黄瓜基因CsActin(上游引物:5′-CGCTCTTCTTGCTTTCACCCTT-3′,下游引物:5′-TACCTTGCCTTGGAGTATTTGG-3′),每个模板3次重复进行qRT-PCR,qRT-PCR条件同1.3。采用比较CT法(ΔΔCT) 对荧光定量 PCR 扩增数据进行处理。
2 结果与分析
2.1 CsMYB94基因的克隆
利用Primer 5.0软件设计CsMYB94基因引物,PCR扩增产物通过测序鉴定无误后,便获得了黄瓜649中基因CsMYB94的cDNA编码序列。通过黄瓜基因组数据库(http://cucurbitgenomics.org/)可知(图 1),CsMYB94基因CDS全长885 bp,外显子和内含子各有3个,编码氨基酸294个。
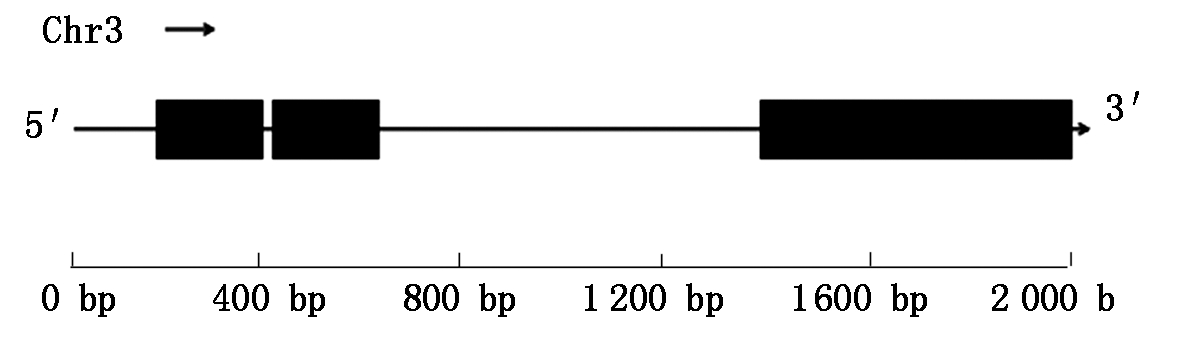
黑色矩形.外显子;实线.内含子。
Black rectangles.Exon;Solid lines.Intron.
图1 CsMYB94 基因结构示意图
Fig.1 Schematic diagram of CsMYB94 gene structure
2.2 CsMYB94基因生物信息学分析
对已经克隆的CsMYB94 蛋白结构域分析发现,CDS序列中第13-63 aa和第66-114 aa位置各有一个DNA-结合结构域,CsMYB94基因属于MYB家族中R2R3类转录因子(图 2)。CsMYB94蛋白分子式为C1426H2242N404O454S11;预期分子量为3.27 ku;理论等电点为6.53;带负电荷的残基(Asp + Glu)37个,带正电荷的残基(Arg + Lys)35个;原子总数4 537个;在酵母体内的半衰期大于20 h,在大肠杆菌体内大于10 h。CsMYB94蛋白不稳定指数Ⅱ级57.40,属于不稳定蛋白质。脂肪指数64.42;亲水性的平均值(GRAVY)为-0.737,说明CsMYB94蛋白为疏水性蛋白。CsMYB94 蛋白的二级结构包含56.46%的无规则卷曲Cc,32.99%的α-螺旋Hh和10.54%的延伸链Ss。三级结构为紧密复杂的螺旋结构。通过亚细胞定位软件分析发现,CsMYB94 蛋白被定位在细胞核。
2.3 CsMYB94蛋白系统发育树的构建
在NCBI数据库中,利用Blast程序搜索与CsMYB94蛋白质同源性高的不同植物的蛋白质序列,通过筛选后,获得12个与CsMYB94蛋白质同源性高蛋白质序列:甜瓜(Cucumis melo)、南瓜(Cucurbita moschata)、苦瓜(Momordica charantia)、黄连木(Pistacia vera )、枣(Ziziphus jujuba)、莫雷利亚草(Morella rubra)、栎(Quercussuber)、毛果杨(Populus trichocarpa)、胡杨(Populus euphratica)、毛白杨(Populus tomentosa)、白藻(Prosopis alba)、古巴棉(Gossypium barbadense)的MYB蛋白构建系统进化树分析。通过分析可知,黄瓜CsMYB94蛋白与白藻聚在一起(图 3),说明CsMYB94蛋白在蛋白结构上比较保守。与同为葫芦科植物苦瓜、南瓜、甜瓜亲缘关系较近,在前人研究报道中还没有对该进化机制及相关生物学功能的鉴定。
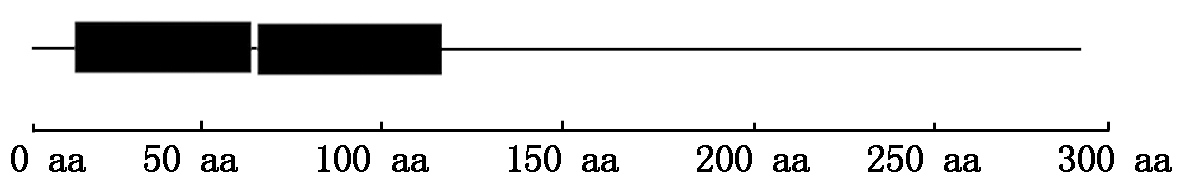
黑色矩形.DNA-结合结构域。
Black rectangles.DNA-binding domain.
图2 CsMYB94 蛋白结构域示意图
Fig.2 Schematic diagram of the CsMYB94 protein domain
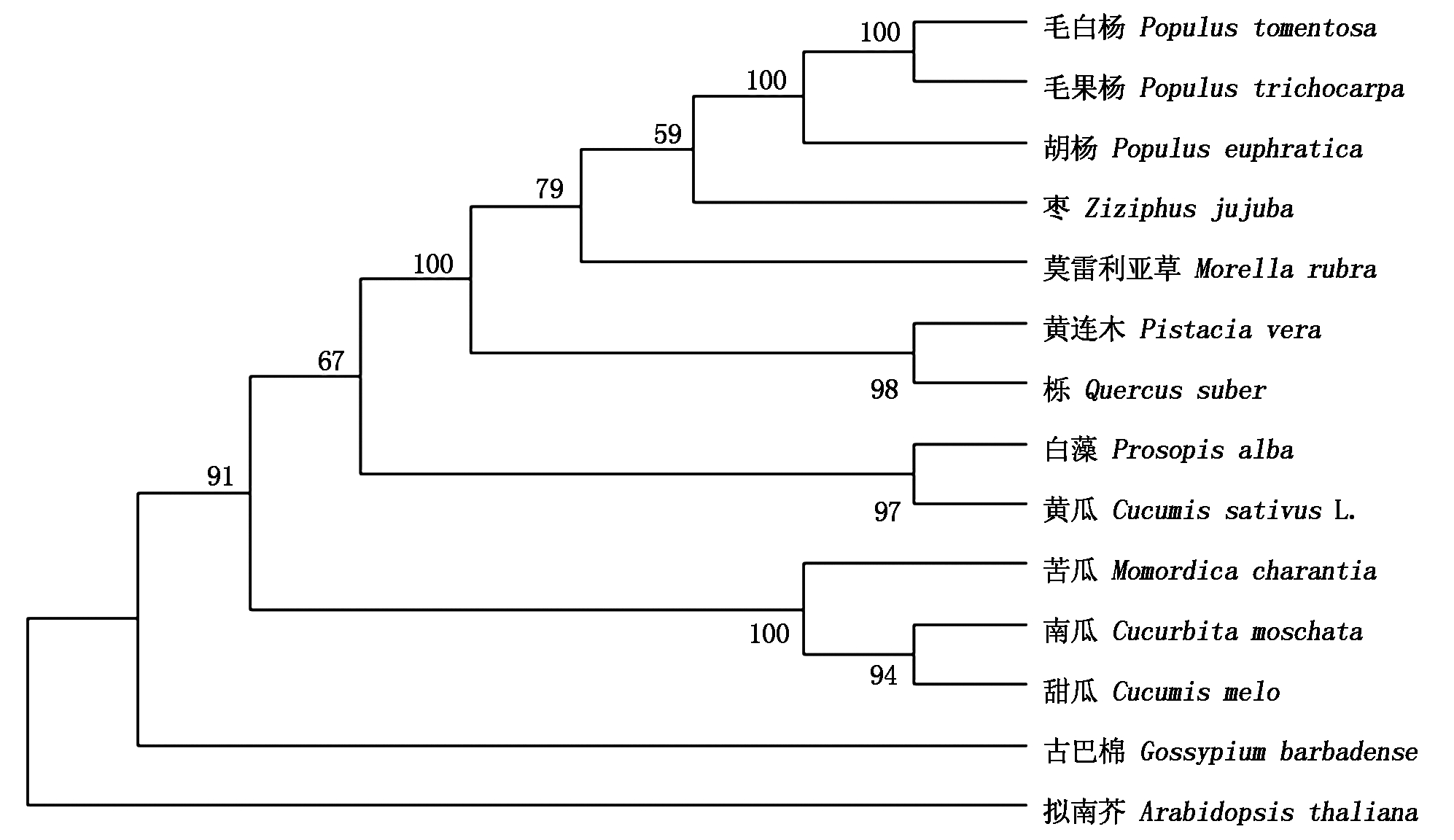
图3 CsMYB94 进化分析
Fig.3 Phylogenetic analysis of CsMYB94 in cucumber and its homologs
2.4 CsMYB94基因表达模式分析
以CsMYB94基因序列为模板设计上、下游引物,以黄瓜基因CsActin为内参,通过qRT-PCR分析发现,CsMYB94基因在不同组织部位均有表达,且CsMYB94基因在黄瓜叶片中表达量最高,子房中表达量次之,在卷须、雄花和茎中的表达量最低且表达情况无显著性差异(图4),说明CsMYB94基因的在黄瓜中具有组织特异性表达。
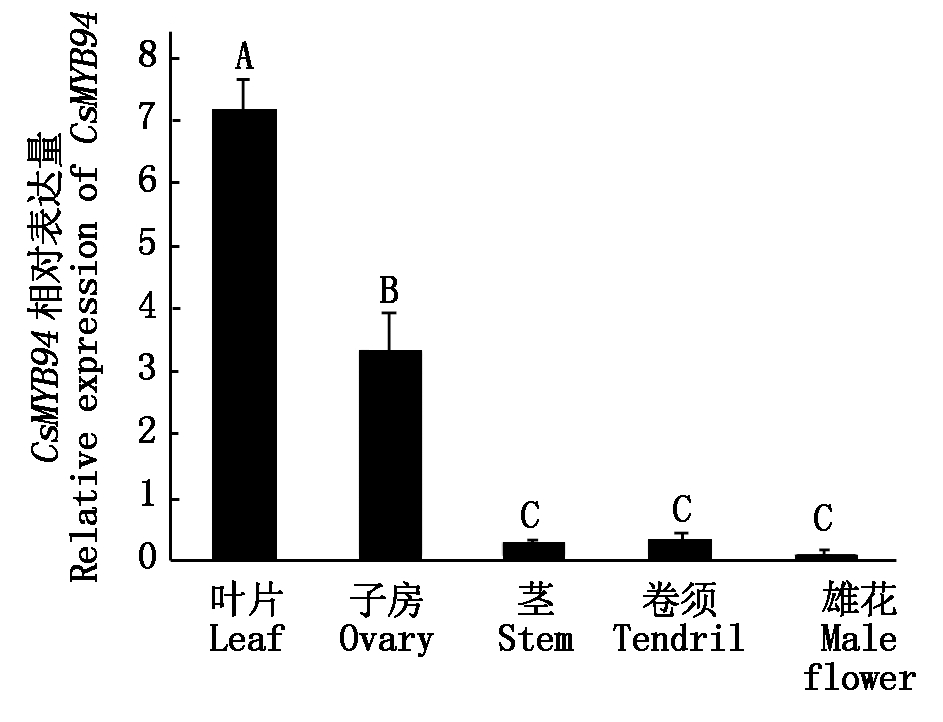
不同大写字母表示CsMYB94 基因在不同组织中表达差异极显著(P<0.01)。
The different letters mean that the CsMYB94 gene is extremely significant difference among different tissues (P<0.01).
图4 CsMYB94 表达模式分析
Fig.4 Expression analysis of CsMYB94 in cucumber
3 结论与讨论
干旱是全球农业生产的主要限制之一,特别是在干旱和半干旱地区地区。此外,由于全球气候变化和对土地利用的不当,导致降雨分布不均[27]。人口增长带来的水资源加剧了许多国家干旱的频率和严重程度地区。为了确保黄瓜干旱下的丰收,探索黄瓜在干旱逆境中的调控机制对黄瓜生产的可持续发展具有重要意义[28]。
本试验从前期蜡质突变体的转录组数据中找出一个与干旱有关的显著上调的差异表达基因CsMYB94。CsMYB94 基因的CDS全长885 bp,编码294个氨基酸,包含2个保守结构域,属于典型的R2R3类MYB转录因子。亚细胞定位分析发现,CsMYB94 蛋白定位在细胞核内。这与前人研究结果一致,Stracke等[12]报道MYB 蛋白家族的基因表达产物在细胞核中,接着在邢铮[29]和苏连泰[30]的研究中也得到相同结果,相似结果也在其他植物中的 MYB 基因家族成员中陆续发现[31]。通过构建同源进化树表明,CsMYB94基因编码的蛋白与多数亲缘关系相对较近的植物进化规律一致,与白藻中同源基因编码的蛋白相似性最高,说明CsMYB94蛋白在功能很保守。通过qRT-PCR 试验发现,CsMYB94 基因在黄瓜中表达具有组织特异性,在试验材料649的叶片和子房中表达量较高,且与雄花、茎、卷须中的表达量均达到极显著差异。
CsMYB94 基因和拟南芥中MYB94为同源基因,拟南芥MYB94基因在CaMV35S启动子的控制下在茶花中过表达,转基因茶花表现出正常的生长发育状态并增强抗旱性。与非转基因植物相比,转基因叶片表面的表皮蜡晶体沉积和总蜡负荷显著增加。这表明,MYB94介导的蜡生物合成基因的转录调控可以提高植物的抗旱性[17]。烟草(Nicotiana glauca)[32]、棉花(Gossypium hirsutum)[33]和芝麻(Sesamum indicum)[34]等植物中也有类似报道。通过因此推测,基因CsMYB94也是通过调节表皮蜡质的方式响应干旱胁迫。
[1] Yang X Q, Zhang W W, Li Y, He H L, Bie B B, Ren G L, Zhao J L, Wang Y L, Nie J T, Pan J S, Cai R. High-resolution mapping of the dull fruit skin gene D in cucumber (Cucumis sativus L.)[J].Molecular Breeding,2014,33(1):15-22.doi:10.1007/s11032-013-9927-8.
[2] Jaleel C A,Manivannan P A,Wahid A,Somasundaram R A,Panneerselvam R. Drought stress in plants:A review on morphological characteristics and pigments composition[J].International Journal of Agriculture and Biology,2009,11(1):100-105. doi:10.3763/ijas.2009.0459.
[3] Chen Y, Wang M, Hu L L, Liao W B, Dawuda M M, Li C L. Carbon monoxide is involved in hydrogen gas-induced adventitious root development in cucumber under simulated drought stress[J].Frontiers in Plant Science,2017,8:128. doi:10.3389/fpls.2017.00128.
[4] Cui Q Q, Li Y M, He X R,Li S H,Zhang X,Liu S H,Zhang X,Liu B B,Zhang D L,Li Q M. Physiological and iTRAQ based proteomics analyses reveal the mechanism of elevated CO2 concentration alleviating drought stress in cucumber(Cucumis sativus L.)seedlings[J].Plant Physiology and Biochemistry, 2019,143:142-153. doi:10.1016/j.plaphy.2019.08.025.
[5] Wang W J,Zhang Y,Xu C,Ren J J,Liu X F,Black K,Gai X S,Wang Q,Ren H Z. Cucumber ECERIFERUM1,(CsCER1),which influences the cuticle properties and drought tolerance of cucumber,plays a key role in VLC alkanes biosynthesis[J].Plant Molecular Biology, 2015,87:219-233. doi:10.1007/s11103-014-0271-0.
[6] Sun Y,Wang H,Liu S,Peng X. Exogenous application of hydrogen peroxide alleviates drought stress in cucumber seedlings[J].South African Journal of Botany,2016,106:23-28. doi:10.1016/j.sajb.2016.05.008.
[7] Yin Z M,Hennig J,Szwacka M,Malepszy S. Tobacco PR-2d promoter is induced in transgenic cucumber in response to biotic and abiotic stimuli[J].Journal of Plant Physiol,2004,161(5):621-629. doi:10.1078/0176-1617-00737.
[8] Liu S S, Li H, Lǚ X Z, Ahammed G J, Xia X J, Zhou J, Shi K, Asami T, Yu J Q, Zhou Y H.Grafting cucumber onto luffa improves drought tolerance by increasing ABA biosynthesis and sensitivity[J]. Science Reports,2016,6:20212. doi:10.1038/srep20212.
[9] Wang C J, Yang W, Wang C, Gu C, Niu D D, Liu H X, Wang Y P, Guo J H. Induction of drought tolerance in cucumber plants by a consortium of three plant growth-promoting rhizobacterium strains[J].PLoS One,2012,7(12):e52565. doi:10.1371/journal.pone.0052565.
[10] 冯盼盼,陈鹏,洪文杰,赵小英,刘选明. 拟南芥MYB转录因子家族研究进展[J].生命科学研究,2016,20(6):555-560.doi:10.16605/j.cnki.1007-7847.2016.06.016.
Feng P P,Che P,Hong W J,Zhao X Y,Liu X M. Advances in Arabidopsis MYB transcription factor family[J].Life Science Research,2016,20(6):555-560.
[11] Ogata K, Kanei-Ishii C, Sasaki M, Hatanaka H, Nagadoi A, Enari M, Nakamura H, Nishimura Y, Ishii S, Sarai A. The cavity in the hy-drophobic core of Myb DNA-binding domain is reserved for DNA recognition and trans-activation[J].Nature Structural Biology,1996,3:178-187. doi:10.1038/nsb0296-178.
[12] Stracke R, Werber M, Weisshaar B. The R2R3-MYB gene family in Arabidopsis thaliana[J].Current Opinion in Plant Biology,2001,4(5):447-456. doi:10.1016/S1369-5266(00)00199-0.
[13] 牛义岭,姜秀明,许向阳. 植物转录因子 MYB 基因家族的研究进展[J].分子植物育种,2016,14(8):2050-2059.doi:10.13271/j.mpb.014.002050.
Niu Y L,Jiang X M,Xu X Y. Research progress of plant transcription factor MYB gene family[J].Molecular Plant Breeding,2016,14(8):2050-2059.
[14] Du H,Yang S S,Liang Z,Feng B R,Liu L,Huang Y B,Tang Y X. Genome-wide analysis of the MYB transcription factor superfamily in soybean[J].BMC Plant Biology,2012,15(1):106-127. doi:10.1186/1471-2229-12-106.
[15] Abe H, Yamaguchi-Shinozaki K, Urao T, Iwasaki T, Hosokawa D, Shinozaki K. Role of Arabidopsis MYC and MYB homologs in drought-and abscisic acid-regulated gene expression[J].Plant Cell,1997,9(10) :1859-1868.doi: 10.1105/tpc.9.10.1859.
[16] Butt H I, Yang Z E,Gong Q, Chen E Y, Wang X Q, Zhao G, Ge X Y, Zhang X Y, Li F H. GaMYB85,an R2R3 MYB gene,in transgenic Arabidopsis plays an important role in drought tolerance[J].BMC Plant Biology,2017,17:142. doi:10.1186/s12870-017-1078-3.
[17] Lee S B,Hyun U K,Suh M C.MYB94 and MYB96 additively activate cuticular wax biosynthesis in Arabidopsis[J].Plant Cell Physiol,2016,57(11):2300-2311. doi: 10.1093/pcp/pcw147.
[18] Lee S B, Suh M C. Cuticular wax biosynthesis is up-regulated by the MYB94 transcription factor in Arabidopsis[J].Plant Cell Physiol, 2015,56(1):48-60. doi:10.1093/pcp/pcu142.
[19] Lee S B,Kim H, Kim R J,Suh M C.Overexpression of Arabidopsis MYB96 confers drought resistance in Camelina sativa via cuticular wax accumulation[J].Plant Cell Reports, 2014,33(9):1535-1546. doi:10.1007/s00299-014-1636-1.
[20] Zhou Y Y, Zhu H, He S Z, Zhai H, Zhao N, Xing S, Wei Z, Liu Q. A novel sweetpotato transcription factor gene IbMYB116 enhances drought tolerance in transgenic Arabidopsis[J].Front Plant Science,2019,15,10:1025. doi:10.3389/fpls.2019.01025.
[21] Pasquali G,Biricolti S,Locatelli F,Baldoni E,Mattana M. Osmyb4 expression improves adaptive responses to drought and cold stress in transgenic apples[J].Plant Cell Reports,2008,27:1677-1686. doi:10.1007/s00299-008-0587-9.
[22] Dai X Y,Xu Y Y,Ma Q B,Xu W Y,Wang T,Xeu Y B,Chong K.Overexpression of an R1R2R3 MYB gene,OsMYB3R-2,increases tolerance to freezing,drought,and salt stress in transgenic Arabidopsis[J].Plant Physiol,2007,143(4):1739-1751. doi:10.1104/pp.106.094532.
[23] Yang A,Dai X Y,Zhang W H. A R2R3-type MYB gene,Os-MYB2,is involved in salt,cold,and dehydration tolerance in rice[J].Experimental Botany,2012,63(7):2541-2556. doi:10.1093/jxb/err431.
[24] Wang R K,Cao Z H,Hao Y J. Overexpression of a R2R3 MYB gene MdSIMYB1 increases tolerance to multiple stresses in transgenic tobacco and apples[J].Physiol Plant,2014,150(1):76-87. doi:10.1111/ppl.12069.
[25] Wu S,Ning F,Zhang Q B,Wu X L,Wang W. Enhancing omics research of crop responses to drought under field conditions[J].Frontiers in Plant Science,2017,8:174. doi:10.3389/fpls.2017.00174.
[26] 曹稳. 黄瓜花斑叶突变体及候选基因鉴定[D].哈尔滨:东北农业大学,2019.
Cao W. Identification of cucumber variegated leaf mutants and candidate genes[D].Harbin:Northeast Agricultural University,2019.
[27] Bacon M A. In water use efficiency in plant biology[M].Boca Raton:Blackwell Publishing,2004.
[28] IPCC. Contribution of working groups Ⅰ,Ⅱ and Ⅲ to the fourth assessment report of the intergovernmental panel on climate change[R].Climate Change 2007,Synthesis report 104,Geneva:Switzerland,2017.
[29] 邢铮. 马铃薯基因 StR2R3-MYB1 的克隆与功能分析[D].长沙:湖南农业大学,2014.
Xing Z. Cloning and functional analysis of potato gene StR2R3-MYB1[D].Changsha:Hunan Agricultural University,2014.
[30] 苏连泰. 大豆 MYB 转录因子 GmMYBJI 和 GmMYB2 的克隆与功能分析[D].长春:吉林大学,2013.
Su L T. Isolation and characterization of MYB transcrip tion factors,GmMYBJ1 and GmMYBJ2,from soybean (Glycine max L.)[D].Changchun:Jilin University,2013.
[31] Tang Y H, Bao X X, Zhi Y L, Wu Q, Guo Y R, Yin X H, Zeng L Q, Li J, Zhang J, He W L, Liu W B, Wang Q W, Jia C K, Li Z K, Liu K.Overexpression of a MYB family gene,OsMYB6,increases drought and salinity stress tolerance in transgenic rice[J].Frontiers in Plant Science,2019,10:168. doi:10.3389/fpls.2019.00168.
[32] Cameron K D,Teece M A,Smart L B. Increased accumulation of cuticular wax and expression of lipid transfer protein in response to periodic drying events in leaves of tree tobacco[J]. Plant Physiol, 2006,140(1):176 183. doi: 10.1104/pp.105.069724.
[33] Bondada B R,Oosterhuis D M,Murphy J B,Kim K S. Effect of water stress on the epicuticular wax composition and ultrastructure of cotton (Gossypium hirsutum L.) leaf,bract,and boll[J].Environment & Experimental Botany,1996,36(1):61-65,67-69. doi:10.1016/0098-8472(96)00128-1.
[34] Kim K S,Park S H,Jenks M A . Changes in leaf cuticular waxes of sesame (Sesamum indicum L.) plants exposed to water deficit[J].Plant Physiol,2007,164(9):1134-1143. doi:10.1016/j.jplph.2006.07.004.