谷子(Setaria italica)作为中国的传统杂粮作物,具有抗旱耐瘠、营养丰富、粮饲兼用的特点,在我国农业供给侧结构性改革中发挥着重要作用[1-3]。近几年随着谷子简化栽培技术和农机农艺一体化技术的开发,为山区谷子的规模化种植提供了技术支持,河北省山区谷子正在从零星、小面积种植向规模化种植转变,尤其在太行山浅山区域和承德等丘陵地带表现明显[4-5]。然而,受山区土地限制,多年连作所导致的连作障碍问题突出,而背后的机理尚不明确。
近些年来,国内外学者对于作物连作障碍的形成机理从多方面进行了研究,涉及化感自毒作用、土壤酶活变化、土壤微生物群落变化、作物生理抗性改变等方面[6-9]。耿士均[10]、刘建国等[11]研究发现,随着相关作物土壤连作障碍程度的增加会导致土壤养分失衡、相关作物生长受抑制。Hiddink等[12]、Ying等[13]发现,有益微生物减少而病原微生物富集、土壤微生物区系和多样性失调,是导致连作障碍发生的最主要原因。沈宝云等[14]研究发现,马铃薯植株叶片SOD、POD和CAT活性表现出随着连作年限延长先上升后下降的特征,植株抗逆能力受到影响。妙佳源等[15]发现,谷子连作会降低产量,并对土壤养分及酶活性有显著影响。但迄今为止,连作障碍的相关研究主要集中在小麦、棉花、黄瓜、花生、西瓜、烟草、中药材等上,在谷子上则报道较少,特别是其对连作障碍的生理性和病理性机制还缺乏系统研究。
针对上述问题,本研究分别采集春谷区和夏谷区的山区谷子不同年份的连作土壤,通过盆栽试验对谷子有效养分的吸收、土壤pH值、植株相关抗逆酶活性的测定来明确连作的生理致害机理;利用宏基因组测序技术来明确微生物群落种类和丰度的变化规律,旨在较为系统地揭示山区谷子连作障碍的可能原因,为山区谷子产业的规模化和绿色发展提供科学依据。
1 材料和方法
1.1 试验材料
试验用土在2017年分别取自丰宁县黄旗镇的谷子连作0(前茬作物为大豆),1,2,3 a的土壤和在临城县西冷水村的谷子连作0 a(前茬作物为玉米),1,2,3 a的土壤。每块地采用5点取样法,用小钢铲去掉表层土后,采集5~20 cm耕层土壤,每个样点取50 kg的土壤,随即装入塑料袋中带回,同一地区、同一连作年限土样混匀后即作为谷子盆栽土壤和测样土壤。
盆栽试验所用的谷子品种为:冀谷39。
氮磷钾复合肥(硫酸钾型):史丹利化肥股份有限公司,N∶P2O5∶K2O =15∶15∶15;总养分≥45%。
1.2 试验方法
1.2.1 试验设计 测样土壤于2017年5月从丰宁县黄旗镇和临城县西冷水村取回,经去除石块、大颗粒等杂质和过筛后,及时放入-80 ℃冰箱储存,用于宏基因组测序、pH值测定、有效养分(全氮、速效磷、速效钾)测定。
盆栽试验于2017年6月在河北省农林科学院谷子研究所进行。试验采用直径为25 cm、高16.5 cm的花盆作为器皿进行试验。每盆分别装入风干后敲碎过筛的不同连作程度的土壤7.5 kg,加去离子水至湿度适中,向其中加入等量的N、P、K肥料,选用饱满的冀谷39种子,采用穴播的方式播种,每穴2粒,每盆10株,出苗后每穴留健苗1株,植株间间距保持一致。试验设8个处理,分别为黄旗镇连作0 a土壤(H0)、连作1 a土壤(H1)、连作2 a土壤(H2)、连作3 a土壤(H3);西冷水村连作0 a土壤(L0)、连作1 a土壤(L1)、连作2 a土壤(L2)、连作3 a土壤(L3),每个处理3次重复。生育期间精细管理,及时浇水。待出苗后45 d时测定植株叶片中POD、CAT、SOD等活性。
1.2.2 测定方法 土壤有效养分(全氮、速效磷、速效钾)测定[16]:全氮测定采用凯氏定氮法;速效磷测定采用碳酸氢钠溶解-钼锑抗比色法;速效钾测定采用醋酸铵溶解-火焰光度计法。
土壤pH值测定[16]:利用pH仪测定其悬浮液的pH值。
土壤宏基因组测序:测样土壤寄送至上海派森诺生物科技有限公司,在Illumina MiSeq平台上进行高通量测序,并进行菌群多样性组成谱分析(细菌+真菌)。
谷子植株叶片酶活测定[17-19]:POD(过氧化物酶)采用愈创木酚法测定;CAT(过氧化氢酶)采用紫外吸收法测定;SOD(超氧化物歧化酶)采用氮蓝四唑光化还原法测定。
1.2.3 数据统计 采用SPSS 17.0分析软件对所有数据进行方差分析和差异显著性检验。其中,图表中小写英文字母不同表示处理间差异达到了显著水平(P<0.05)。
2 结果与分析
2.1 连作效应对土壤全氮、速效磷、速效钾的影响
图1结果显示,随着连作年份的增长,土壤全氮含量显著降低(P<0.05),速效磷和速效钾含量先增高再降低(P<0.05)。说明连作可导致土壤固氮能力下降,同时影响速效磷和钾的吸收和利用。另外可以看出,春谷区速效磷和速效钾明显高于夏谷区,可能与春谷区试点黄旗镇常年使用有机肥,有利于提高土壤磷钾释放,增加可吸收磷钾含量有关,这一结果也从侧面证明有机肥对连作障碍有一定解除作用。
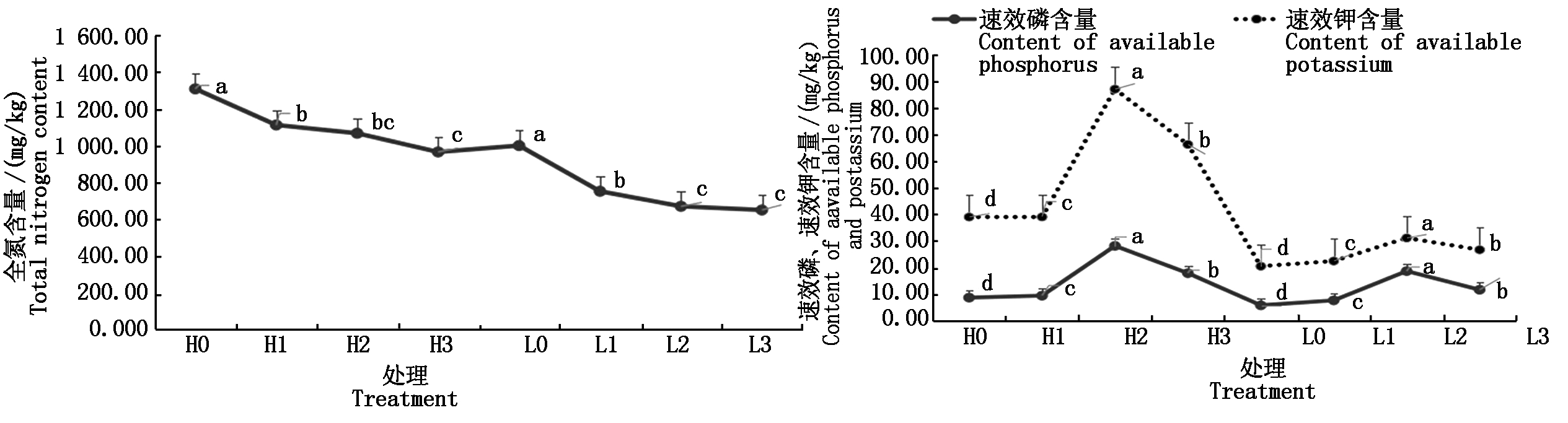
图1 连作效应对土壤全氮、速效磷、速效钾含量的影响
Fig.1 Effects of continuous cropping on the content of soil total N, available P,available K
2.2 连作效应对土壤pH值的影响
图2结果显示,随着连作年份的增加,土壤pH值呈逐年增高的趋势(P<0.05),最高可达9.24。其中以春谷区土壤pH值升高较大,3 a由8.01升高至9.16。由土壤pH值变化可以看出,连作对土壤pH值影响较大,土壤pH值升高,偏碱性,有利于真菌类有害微生物的繁衍生长。与连作田白发病、镰刀菌导致的根部腐烂病等真菌病害逐年增加相一致。
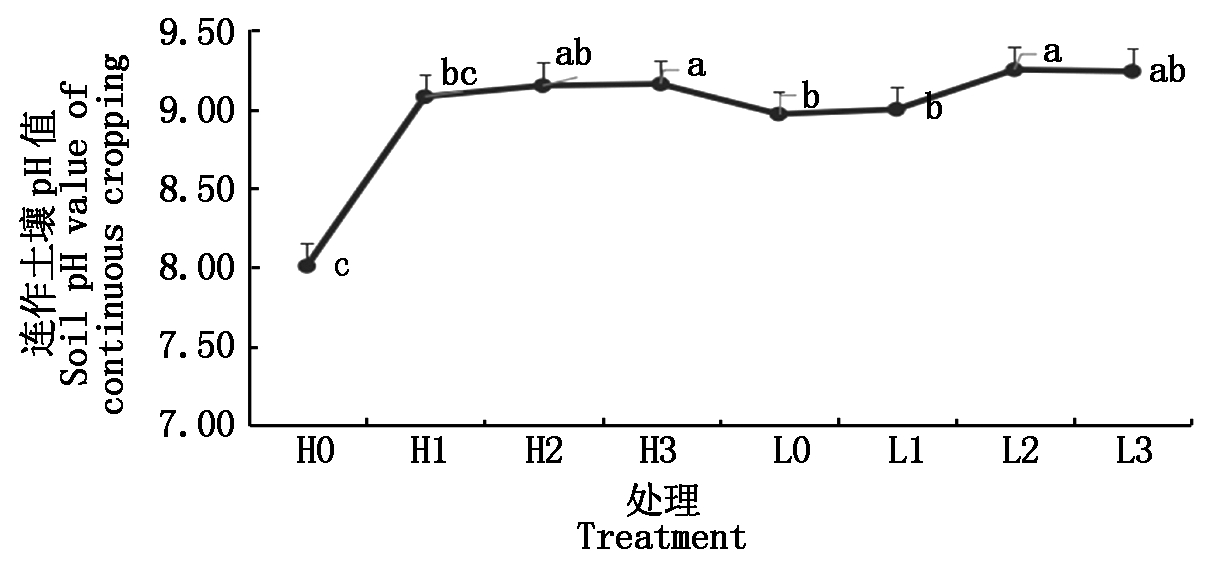
图2 连作效应对土壤pH值的影响
Fig.2 Influence of continuous cropping effect on soil pH value
2.3 连作效应对植株叶片酶活(SOD/POD/CAT)的影响
图3结果显示,连作可引起植株主要抗逆酶活的显著变化(P<0.05)。随着土壤连作时间的增加,植株SOD活性(以鲜质量计)持续升高,POD和CAT活性先升高后降低,黄旗和临城2个点的增长趋势一致。植株SOD活性持续升高,可能是由于随着土壤生态环境破坏,植株在逆境胁迫下,为保持正常生长调节酶活,抵抗逆境对植株造成的伤害;POD和CAT活性先升高后降低,可能是胁迫超出植物忍受极限,导致 POD和CAT活性(以鲜质量计)在升高至最高点后,随连作时间增加又逐渐降低。
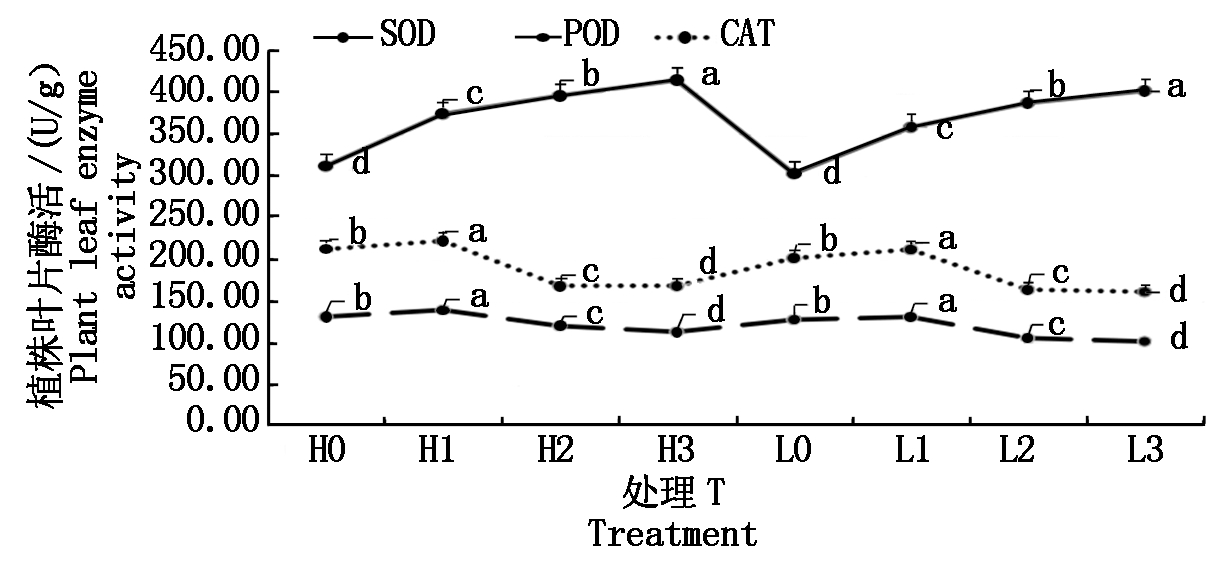
图3 连作效应对植株叶片酶活(SOD/POD/CAT)的影响
Fig.3 Effects of continuous cropping on SOD/POD/CAT activity in plant leaves
此外,春谷区4个样品中的3种酶的活性略高于夏谷区4个样品中的3种酶的活性,可能与定点地块春谷区连作导致的各类苗期危害明显高于夏谷区,环境胁迫压力大于夏谷区所致。
2.4 连作土壤宏基因组测序
2.4.1 门水平上连作土壤的细菌结构与丰度分析 在门的分类等级上,如图4所示,发现8个测样土壤中占总微生物数95%~97%的群落主要分布在9个细菌门,分别是变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、浮霉菌门(Planctomycetes)、芽单胞杆菌门(Gemmatimonadetes)、绿屈挠菌门(Chloroflexi)、疣微菌门(Verrucomicrobia)、拟杆菌门(Bacteroidetes)和硝化螺旋菌门(Nitrospirae)。可以看出,随着连作时间的延长,这9个细菌门并未出现有规律性的变化。
此外,春谷区和夏谷区土壤中的细菌结构和丰度差异不明显。其中春谷区变形菌门呈逐年上升趋势;具有一定抗生作用的放线菌门呈逐年下降趋势;酸杆菌门呈下降趋势;拟杆菌门整体呈上升趋势;夏谷区变形菌门和放线菌门保持平稳,硝化螺旋菌门有上升趋势,芽单胞杆菌门整体呈呈下降趋势;酸杆菌门呈上升趋势。
2.4.2 纲水平上连作土壤的真菌结构与丰度分析 在纲的分类等级上,如图5所示,统计不同土样中微生物的多样性及其所占比例,发现8个土样中占总微生物数95%~97%的群落主要分布在5个真菌纲,分别是粪壳菌纲(Sordariomycetes)、黑粉菌纲(Ustilaginomycetes)、座囊菌纲(Dothideomycetes)、银耳纲(Tremellomycetes)、散囊菌纲(Eurotiomycetes)。可以看出,随着连作时间的延长,在春谷区和夏谷区的土壤中黑粉菌纲的丰度不断增大,且春谷区土壤中的黑粉菌丰度(28.5%)远高于夏谷区土壤中的黑粉菌丰度(1.7%)。说明随着连作时间的延长,春谷区土壤受到黑粉菌侵染感病的几率远高于夏谷区土壤。

图 4 门水平上连作土壤的细菌结构与丰度分析
Fig.4 Analysis of bacterial structure and abundance in continuous cropping soil at phylum level
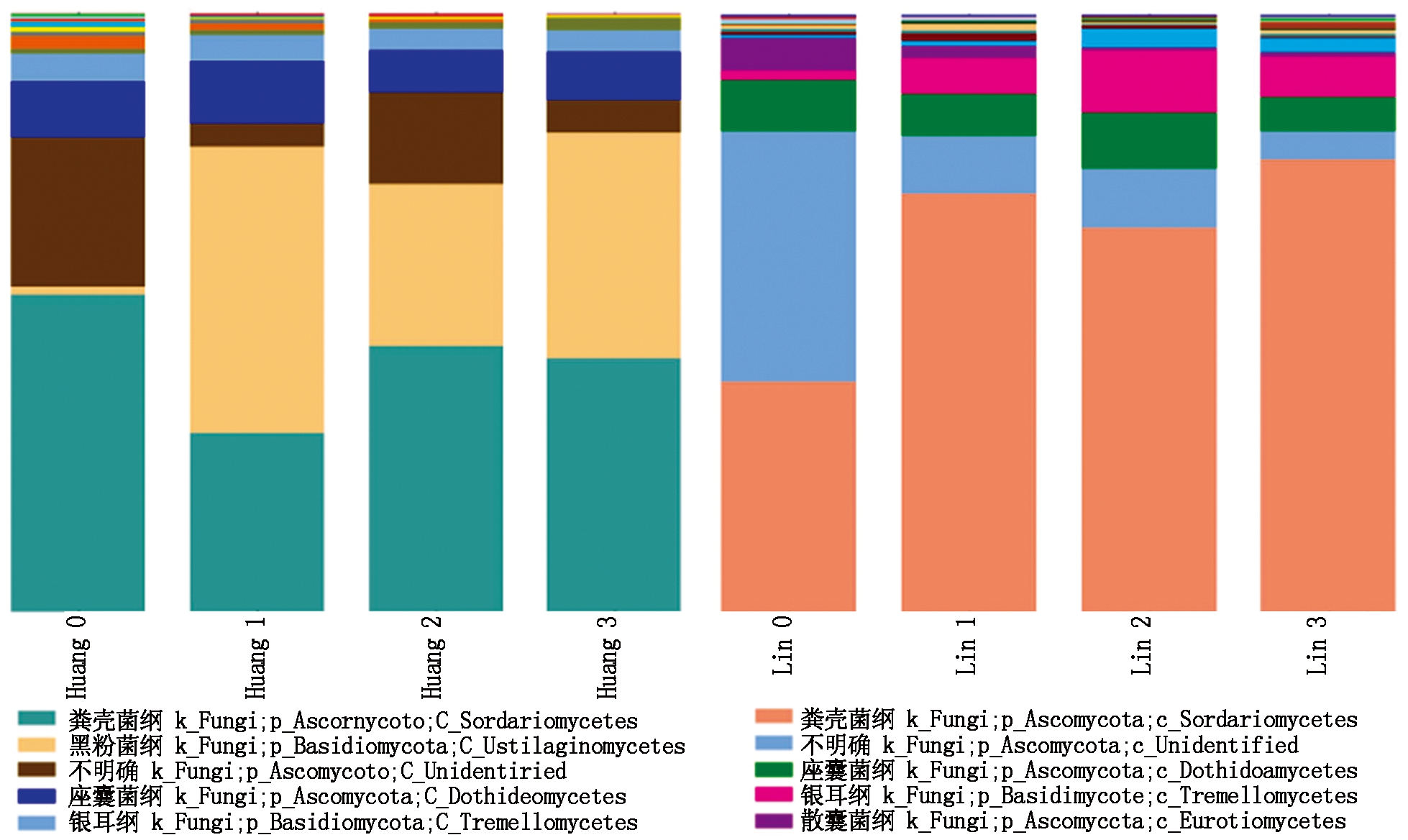
图5 纲水平上连作土壤的真菌结构与丰度分析
Fig.5 Analysis of fungi structure and abundance in continuous cropping soil at class level
2.4.3 结合聚类分析的细菌群落组成热图分析 属水平上的细菌群落组成热图分析结果(图6)表明,8个样品中丰度大于0.1%的属有50个,但在不同样品中的丰度有差异。春谷区的样品Huang 0和Huang 1差异不大,到了Huang 2和Huang 3细菌组成丰度出现较大变化。说明在春谷区连作效应在初期并不明显,而到后期对土壤细菌群落的结构影响变大。而夏谷区的4个样品间细菌组成丰度差异较大,说明在夏谷区连作效应从初期到后期均对土壤的细菌群落组成有较大影响。
2.4.4 结合聚类分析的真菌群落组成热图分析 属水平上的真菌群落组成热图分析结果(图7)表明,8个样品中丰度大于0.1%的属有50个,但在不同样品中的丰度有较大差异。春、夏谷区的8个样品间真菌组成丰度差异较大,说明在春、夏谷区连作效应从初期到后期均对土壤的真菌群落组成有较大影响。
2.4.5 细菌群落组成结构主成分分析图(PCA) 图8结果表明,春谷区中Huang 0和Huang 1相似度最高,细菌群落组成结构最为相似。其他的样品差异度较高。这同细菌群落组成热图分析(图6)相一致。在春谷区连作效应在初期并不明显,而到后期对土壤细菌群落的结构影响变大。
2.4.6 真菌群落组成结构主成分分析图(PCA) 图9结果表明,8个样品中真菌群落组成结构的差异度较高。这同真菌群落组成热图分析(图7)相一致。说明在春、夏谷区连作效应从初期到后期均对土壤的真菌群落组成有较大影响。

图6 结合聚类分析的细菌群落组成热图分析
Fig.6 Heat map analysis of bacterial community composition combined with cluster analysis

图7 结合聚类分析的真菌群落组成热图分析
Fig.7 Heat map analysis of fungi community composition combined with cluster analysis
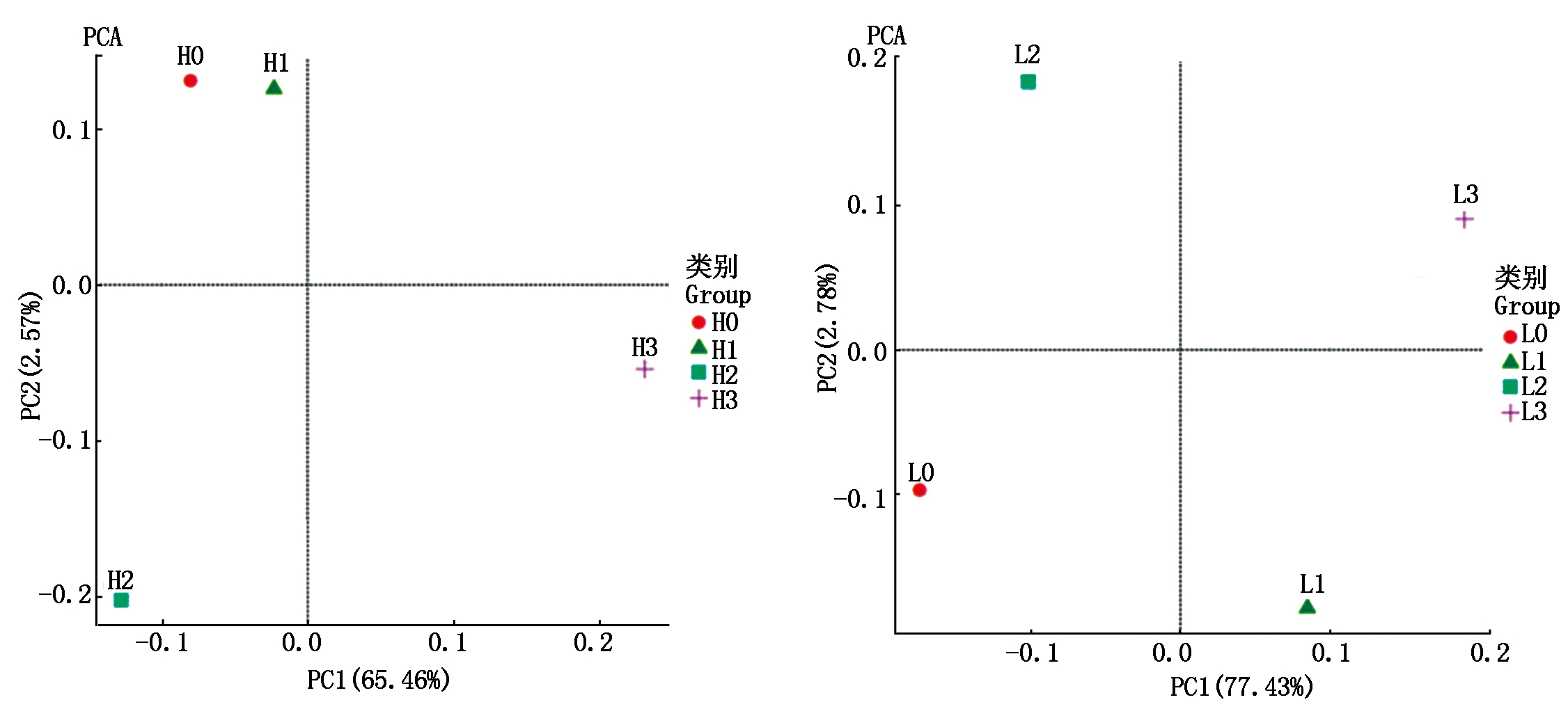
图8 细菌群落组成结构主成分分析图(PCA)
Fig.8 Composition of bacterial community principal component analysis(PCA)
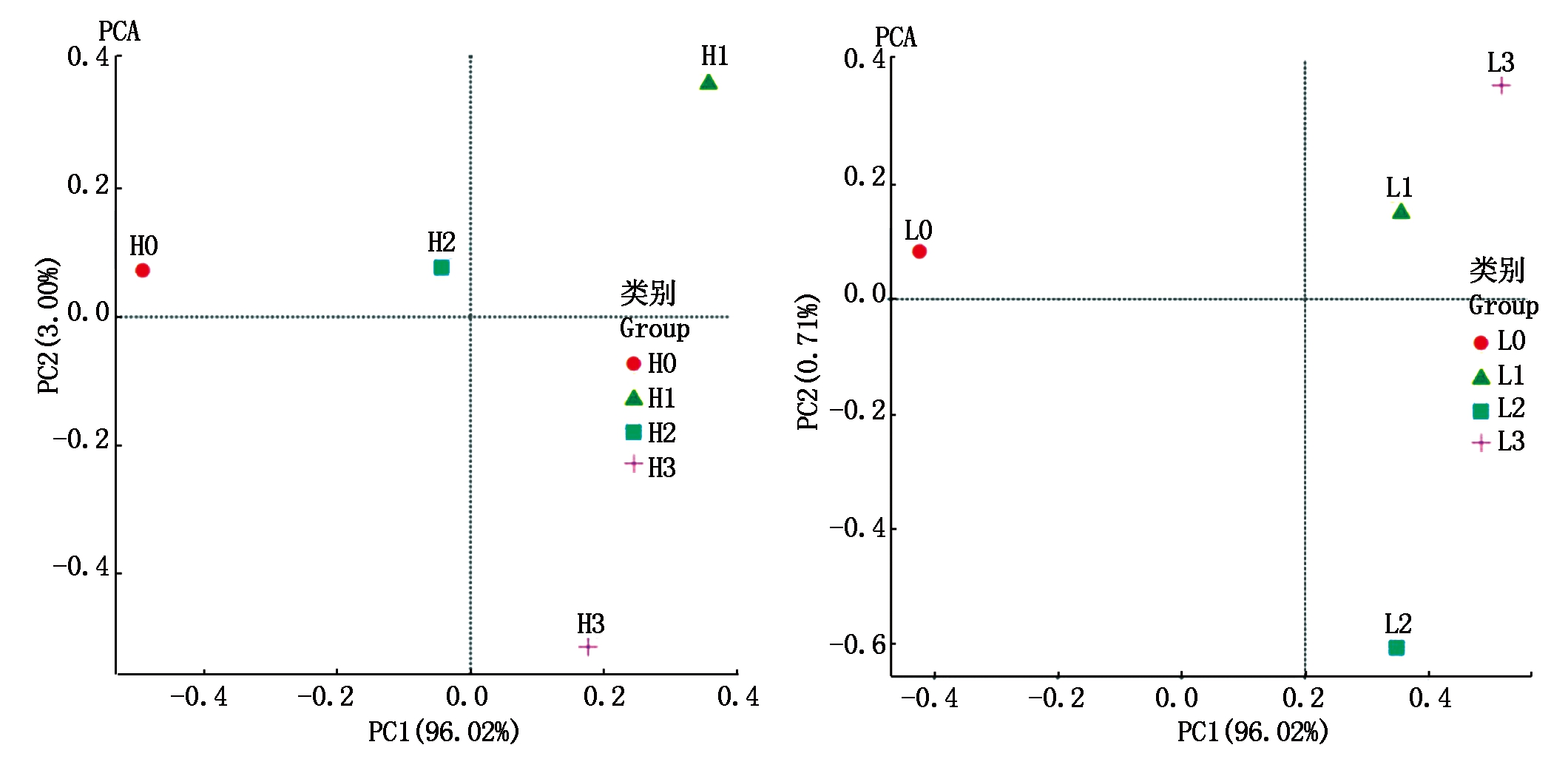
图9 真菌群落组成结构主成分分析图(PCA)
Fig.9 Composition of fungi community principal component analysis(PCA)
2.4.7 细菌群落分类等级树 通过图10可以看出,春谷区4个土样中的细菌物种结构主要分布在7个门,分别是变形菌门、放线菌门、酸杆菌门、浮霉菌门、芽单胞杆菌门、绿屈挠菌门、拟杆菌门。较夏谷区土样中多1个拟杆菌门。其他无明显差异。
2.4.8 真菌群落分类等级树 通过图11可以看出,春、夏谷区8个土样中的真菌物种结构都分布在2个门,分别是子囊菌门(Ascomycota)、担子菌门(Basidiomycota)。有所不同的是,担子菌门下的黑粉菌科在春谷区的土壤中含量明显高于夏谷区土壤。这同“连作土壤的真菌结构与丰度分析”结果(图5)相一致。
3 结论与讨论
山区谷子连作种植模式会导致植株生长受抑制、土传病害持续发生、根系发育异常,最终使谷子产量和品质受到较大影响,而相关机理研究较少,缺乏系统性的研究工作。本研究对具有代表性的河北省丰宁县黄旗镇和临城县西冷水村连作0~3 a土壤样品进行采集,通过对土壤全氮、速效磷、速效钾的含量、土壤pH值、谷子植株相关抗逆酶活性和土壤中微生物群落种类和丰度的测定和分析,从生理性和病理性两方面初步揭示了山区谷子连作障碍机理。
土壤中全氮、速效磷、速效钾的含量和土壤pH值是反映连作土壤生理性变化的几个重要指标。本研究结果表明,随着连作年份的增长,山区谷子土壤全氮含量显著降低,速效磷和速效钾含量先增高再降低。其土壤有效养分的变化趋势同耿士均[10]的研究结果相似,而与周华兰等[20]的速效磷、速效钾和pH值的研究结果不同。这就说明在不同作物之间,其连作土壤的有效养分含量及pH值的变化趋势可能略有不同。
抗氧化物酶(SOD、POD、CAT)可通过清除作物体内过量的活性氧和细胞中的过氧化氢,使作物产生耐受性,提高抗逆能力。本研究结果表明,随着连作年份的增长,谷子植株SOD活性持续升高,POD和CAT活性先升高后降低。结果同沈宝云等[14]的前3 a连作土壤的研究结果相似。笔者分析认为,植株SOD活性持续升高,可能是由于随着土壤生态环境破坏,植株在逆境胁迫下,为保持正常生长调节酶活,抵抗逆境对植株造成的伤害;POD和CAT活性先升高后降低,可能是胁迫超出植物忍受极限,导致 POD和CAT活性在升高至最高点后,随连作时间增加又逐渐降低。需要注意的是,同沈宝云等[14]的5 a连作结果相比,本研究在取样时长上缺乏长期性,植株抗氧化物酶的长期连作(5或10 a)变化趋势还未可知,需进一步做长期定位试验。
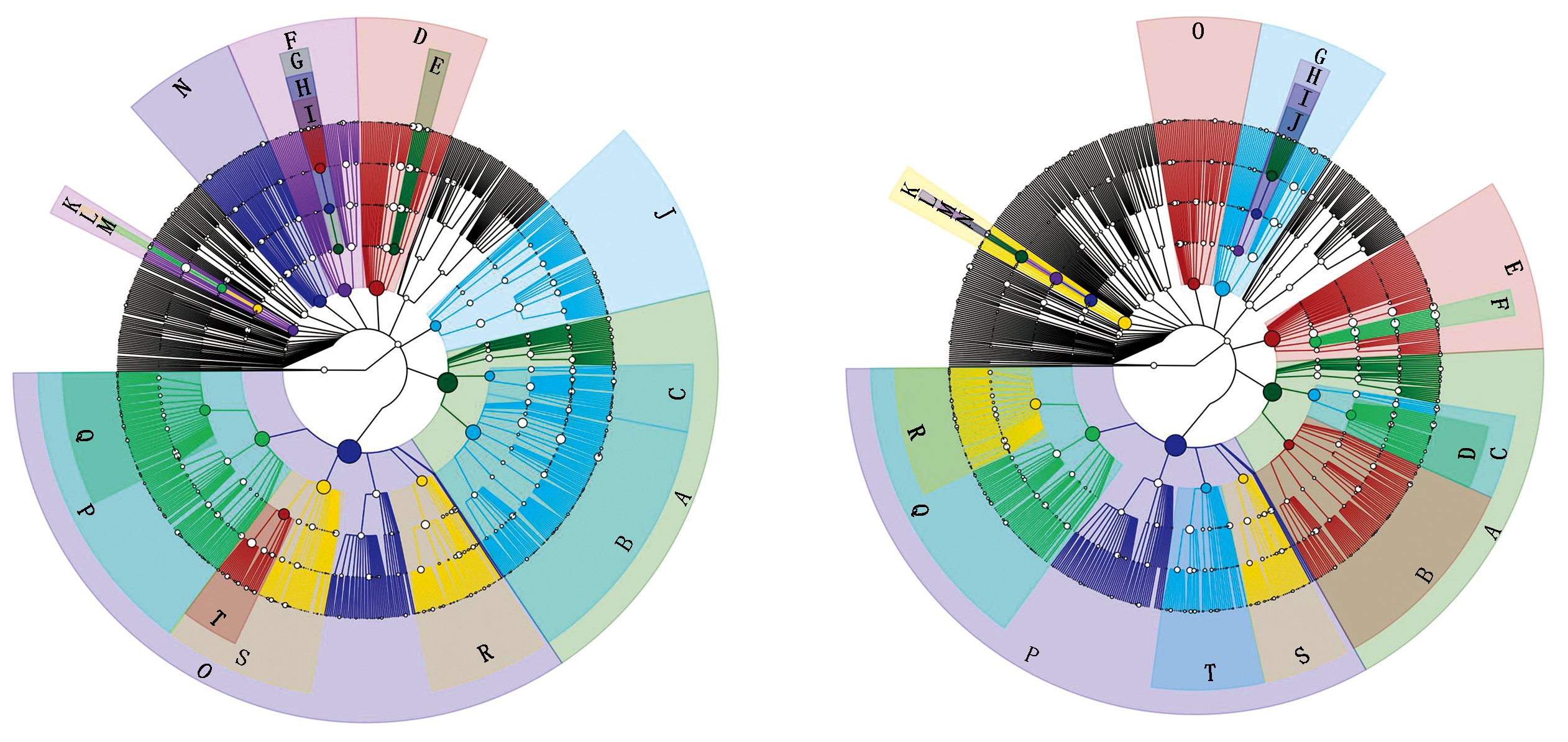
Ⅰ.春谷区土壤细菌结构图:A.放线菌门;B.放线菌门;C.嗜热油菌纲;D.酸杆菌门;E.未知种群;F.浮霉菌门;G.浮霉菌纲;H.浮霉菌目;I.浮霉状菌科;J.拟杆菌门;K.芽单胞菌门;L.芽单胞菌门;M.芽单胞菌目;N.绿弯菌门;O.变形菌门;P.甲型变形菌纲;Q.根瘤菌目;R.β-变形菌纲;S.丙型变形菌纲;T.黄色单胞菌目。Ⅱ.夏谷区土壤真菌结构图:A.放线菌门;B.放线菌门;C.嗜热油菌纲;D.土壤红杆菌目;E.酸杆菌门;F.未知种群;G.浮霉菌门;H.浮霉菌纲;I.浮霉菌目;J.浮霉状菌科;K.芽单胞菌门;L.芽单胞菌门;M.芽单胞菌目;N.芽单胞菌科;O.绿弯菌门;P.变形菌门;Q.根瘤菌目;R.β-变形菌纲;S.丙型变形菌纲;T.黄色单胞菌目。
Ⅰ.Soil bacterial structure map in spring valley area:A.p_Actinobacteria;B.c_Actinobacteria;C.c_Thermoleophilia;D.p_Acidobacteria;E.c_Subgroup_6;F.p_Planctomycetes;G.c_Planctomycetacia;H.o_Planctomycetales;I.f_Planctomycetaceae;J.p_Bacteroidetes;K.p_Gemmatinonadetes;L.c_Gemmatimonadetes;M.o_Gemmatinonadales;N.p_Chloroflexi;O.p_Proteobacteria;P.c_Alphaproteobacteria;Q.c_Rhizobiales;R.c_Betaproteobacteria;S.c_Gammaproteobacteria;T.o_Xanthomonadales.Ⅱ.Soil bacterial structure map in summer valley area:A.p_Actinobacteria;B.c_Actinobacteria;C.c_Thermoleophilia;D.o_Solirubrobacterales;E.p_Acidobacteria;F.c_Subgroup_6;G.p_Planctomycetes;H.c_Planctomycetacia;I.o_Planctomycetales;J.f_Planctomycetaceae;K.p_Gemmatimonadetes;L.c_Gemmatimonadetes;M.o_Gemmatimonadates;N.f_Gemmatimonadaceae;O.c_Alphaproteobacteria;P.p_Proteobacteria;Q.c_Alphaproteobacetria;R.o_Rhizobiales;S.c_Betaproteobacteria;T.c_Gammaproteobacteria.
图10 细菌群落分类等级树
Fig.10 Bacterial community classification tree

Ⅰ.春谷区土壤真菌结构图:A.子囊菌纲;B.粪壳菌纲;C.小囊菌科;D.小囊菌科;E.粪壳菌目;F.毛壳科;G.肉座菌目;H.葡萄穗霉属;I.丛赤壳科;J.座囊菌纲;K.格孢腔菌目;L.茎点菌;M.散囊菌纲;N.担子菌门;O.黑粉菌纲;P.黑粉菌目;Q.黑粉菌科;R.银耳纲;S.银耳目;T.隐球菌。Ⅱ.夏谷区土壤真菌结构图:A.子囊菌纲;B.粪壳菌纲;C.粪壳菌目;D.肉座菌目;E.漆斑病菌;F.支顶孢属;G.丛赤壳科;H.虫囊菌纲;I.刺盾炱目;J.刺壳菌科;K.座囊菌纲;L.格孢腔菌目;M.茎点霉属;N.担子菌门;O.银耳纲;P.银耳目;Q.隐球菌属;R.黑粉菌纲;S.黑粉菌目;T.黑粉菌科。
Ⅰ.Soil fungi structure map in spring valley area:A.p_Ascomycota;B.c_Sordariomycetes;C.o_Microascales;D.f_Microascaceae;E.o_Sordariales;F.f_Chaetomiaceae;G.o_Hypocreales;H.g_Stachybotrys;I.f_Nectriaceae;J.c_Dothideomycetes;K.o_Pleosporales;L.g_Phoma;M.c_Eurotiomycetes;N.p_Basidiomycota;O.c_Ustilaginomycetes;P.o_Ustilaginales;Q.f_Ustilaginaceae;R.c_Tremellomycetes;S.o_Tremellales;T.g_Cryptococcus.Ⅱ.Soil fungi structure map in summer valley area:A.p_Ascomycota;B.c_Sordariomycetes;C.o_Sordariales;D.o_Hypocreales;E.g_Myrothecium;F.g_Acremonium;G.f_Nectriaceae;H.c_Eurotiomycetes;I.o_Chaetothyriales;J.f_Chaetothyriaceae;K.c_Dothideomycetes;L.o_Pleosporates;M.g_Phoma;N.p_Basidiomycota;O.c_Tremellomycetes;P.o_Tremellales;Q.g_Cryptococcus;R.o_Ustilaginomycetes;S.o_Ustilaginales;T.f_Ustilaginaceae.
图11 真菌群落分类等级树
Fig.11 Fungi community classification tree
宏基因组测序技术具备通量高、成本低的特点,近些年来被广泛应用于土壤微生物种类、丰度分析及多样性检测等研究工作。本研究结果表明,山区谷子连作对土壤微生物群落种类和数量有较大影响,导致土壤微生物生态平衡被破坏,放线菌、芽孢杆菌等部分有益菌群降低,黑粉菌等致病菌群升高,是造成连作障碍的可能原因之一。这同大部分的相关研究结果相似[21]。此外,本试验由于受宏基因组测序技术数据库限制,未能检出线虫病[22]群体的变化情况。另外,白发病菌[23]的群体变化情况也未检测出,可能和白发病菌冬孢子破壁较难,普通的DNA提取技术未能提取到白发病菌的DNA信息有关。但对连作田病害发生程度调查结果显示,白发病菌和黑穗病、线虫病等均呈逐年增加的趋势。分子检测结果将在开发相应的土壤中白发病菌和线虫分离技术的基础上,进行补充监测。
本项研究工作对初步揭示山区谷子连作障碍机理具有一定的理论指导意义,但有些部分的工作内容还需进一步完善。例如,土壤有机质和微量元素的测定、土壤相关酶活变化的趋势、自毒分泌物检测及含量变化分析和微生物菌落功能分析和预测等。
[1] 程汝宏.我国谷子育种与生产现状及发展方向[J].河北农业科学,2005,9(4):86-90.doi:10.3969/j.issn.1088-1631.2005.04.022.
Cheng R H.The present situation of foxtail millet(Setaria italica beauv)breeding and production as well as the further research directions in China[J].Journal of Hebei Agricultural Science,2005,9(4):86-90.
[2] 张爱霞,刘晓东,王桂荣,李珊珊,王慧军.谷子主要营养品质性状遗传差异与选择研究[J].中国农学通报,2012,28(21):58-62.doi:10.11924/j.issn.1000-6850.2011-3483.
Zhang A X,Liu X D,Wang G R,Li S S,Wang H J.Studies on genetic effects and selection of important nutrient quality characters in millet[J].Chinese Agricultural Science Bulletin,2012,28(21):58-62.
[3] 刁现民.谷子产业化发展的现状与未来[J].农产品加工,2008(3):10-11.doi:10.3969/j.issn.1671-9646-C.2008.03.005.
Diao X M.Current situation and future of millet industrialization development[J].Processing of Agricultural Products,2008(3):10-11.
[4] 李顺国,夏雪岩,刘猛,赵宇,刘斐,程汝宏,王慧军.我国谷子轻简高效生产技术研究进展[J].中国农业科技导报,2016,18(2):19-24.doi:10.13304/j.nykjdb.2015.356.
Li S H,Xia X Y,Liu M,Zhao Y,Liu F,Cheng R H,Wang H J.The research progress of millet production technology of light simplicity in China[J].Journal of Agricultural Science and Technology,2016,18(2):19-24.
[5] 吴海岩,刘焕新,杨志杰,李霄鹤,焦海,王长军,张国军.谷子生产机械化现状及发展趋势分析[J].农业技术与装备,2012(6):14-17.doi:10.3969/j.issn.1673-887X.2012.12.004.
Wu H Y,Liu H X,Yang Z J,Li X H,Jiao H,Wang C J,Zhang G J.Analysis of current situation and development trend of millet production mechanization[J].Agricultural Technology and Equipment,2012(6):14-17.
[6] 吴林坤,林向民,林文雄.根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J].植物生态学报,2014,38(3):298-310.doi:10.3724/SP.J.1258.2014.00027.
Wu L K,Lin X M,Lin W X.Advances and perspective in research on plant-soil-microbe interactions mediated by root exudates[J].Chinese Journal of Plant Ecology,2014,38(3):298-310.
[7] 胡国彬,董坤,董艳,郑毅,汤利,李欣然,刘一鸣.间作缓解蚕豆连作障碍的根际微生态效应[J].生态学报,2016,36(4):1010-1020.doi:10.5846/stxb201407011357.
Hu G B,Dong K,Dong Y,Zheng Y,Tang L,Li X R,Liu Y M.Effects of cultivars and intercropping on the rhizosphere microenvironment for alleviating the impact of continuous cropping of faba bean[J].Acta Ecologica Sinica,2016,36(4):1010-1020.
[8] Bron P A,van Baarlen P,Kleerebezem M.Emerging molecular insights into the interaction between probiotics and the host intestinal mucosa[J]. Nature Reviews Microbiology,2012,10:66-78.doi:10.1038/nrmicro2690.
[9] 张恩平,张文博,张淑红,李亮亮,李天来.苯甲酸和肉桂酸对番茄幼苗根部保护酶及膜质过氧化的影响[J].西北农业学报,2010,19(1):l86-190.doi:10.3969/j.issn.1004-1389.2010.01.040.
Zhang E P,Zhang W B,Zhang S H,Li L L,Li T L.Effects of exogenic benzoic acid and cinnamic acid on the root oxidative damage of tomato seedlings[J].Acta Agriculturae Boreali-occidentalis,2010,19(1):l86-190.
[10] 耿士均.专用微生物肥克服土壤连作障碍及机理的研究[D].兰州:兰州大学,2012.
Geng S J.Research on the amending of continuous cropping obstacle soils and its mechanism with special microbial fertilizer[D].Lanzhou:Lanzhou University,2012.
[11] 刘建国,张伟,李彦斌,孙艳艳,卞新民.新疆绿洲棉花长期连作对土壤理化性状与土壤酶活性的影响[J].中国农业科学,2009,42(2):725-733.doi:10.3864/j.issn.0578-1752.2009.02.044.
Liu J G,Zhang W,Li Y B,Sun Y Y,Bian X M.Effects of long-term continuous cropping system of cotton on soil physical-chemical properties and activities of soil enzyme in oasis in Xinjiang[J].Scientia Agricultura Sinica,2009,42(2):725-733.
[12] Hiddink G A,Termorshuizen A J,van Bruggen A H C.Mixed cropping and suppression of soilborne diseases[M]//Lichtfouse E.Genetic engineering,biofertilisation,soil quality and organic fanning,sustainable agriculture reviews.Netherlands:Springer,2010,4:119-146.
[13] Ying Y X,Ding W L,Zhou Y Q,Li L.Influence of Panaxginseng continuous cropping on metabolic function of soil microbial communities[J].Chinese Herbal Medicines,2012,4(4):329-334.doi:10.3969/j.issn.1674-6384.2012.04.011.
[14] 沈宝云,刘星,王蒂,孟品品,张俊莲,邱慧珍.甘肃省中部沿黄灌区连作对马铃薯植株生理生态特性的影响[J].中国生态农业学报,2013,21(6):689-699.doi:l0.3724/SP.J.1011.2013.00689.
Shen B Y,Liu X,Wang D,Meng P P,Zhang J L,Qiu H Z.Effects of continuous cropping on potato eco-physiological characteristics in the Yellow River irrigation area of the central Gansu Province[J].Chinese Journal of Eco-Agriculture,2013,21(6):689-699.
[15] 妙佳源,李夏,周达,高扬,高小丽,王鹏科,高金锋,杨璞,冯佰利.连作对谷子土壤酶活性及养分的影响[J].干旱地区农业研究,2016,34(3):123-126.doi:10.7606/j.issn.1000-7601.2016.03.1.
Miao J Y,Li X,Zhou D,Gao Y,Gao X L,Wang P K,Gao J F,Yang P,Feng B L.Effects of foxtail millet continuous cropping on soil enzyme activities and nutrients[J].Agricultural Research in the Arid Areas,2016,34(3):123-126.
[16] 张甘霖,龚子同.土壤调查实验室分析方法[M].北京:科学出版社,2012.
Zhang G L,Gong Z T,Laboratory analysis methods for soil survey[M].Beijing:Science Press,2012.
[17] 王爱国,罗广华,邵从本,吴淑君,郭俊彦.大豆种子超氧化物歧化酶的研究[J].植物生理学报,1983,9(1):77-83.
Wang A G,Luo G H ,Shao C B,Luo G H,Guo J Y. A study on the superoxide dismutase of soybean seeds[J].Plant Physio1ogy Journal,1983,9(1):77-83.
[18] Chance B. Methods on enzymology [M]. New York:Academic Press,1955:764 -765.
[19] 华东师范大学.植物生理学实验指导[M].北京:人民教育出版社,1980.
East China Normal University. Test guide of laboratory of plant physiology[M]. Beijing:The People′s Education Press,1980.
[20] 周华兰,彭亚丽,李婷,谢鹰飞,唐丽梅,王榕,熊兴耀,王万兴,胡新喜.马铃薯连作对土壤理化性质和生物学特性的影响[J].2019,45(6):611-616. doi:10.13331/j.cnki.jhau.2019.06.008.
Zhou H L,Peng Y L,Li T,Xie Y F,Tang L M,Wang R,Xiong X Y,Wang W X,Hu X X.Effects of potato continuous cropping on soil physicochemical and biological properties[J].Journal of Hunan Agricultural University:Science and Technology,2019,45(6):611-616.
[21] 龚治翔,马晓寒,任志广,朱金峰,黄元炯,王蒙蒙,陈征,许自成.连作烤烟根际土壤细菌群落16S rDNA-PCR-DGGE分析[J].中国农业科技导报,2018,20(2):39-47.doi:10.13304/j.nykjdb.2017.0231.
Gong Z X,Ma X H,Ren Z G,Zhu J F,Huang Y J,Wang M M,Chen Z,Xu Z C.Analysis of bacterial communities in rhizosphere soil of continuous cropping flue-cured tobacco using 16S rDNA-PCR-DGGE[J].Journal of Agricultural Science and Technology,2018,20(2):39-47.
[22] 刘彤彤,卢巧芳,王男麒,王天琪,刘环环,左元梅.根系分泌物抑制连作障碍线虫病的根际调控机制及其应用[J].植物营养与肥料学报,2019,25(6):1038-1046.doi:10.11674/zwyf.18284.
Liu T T,Lu Q F,Wang N Q,Wang T Q,Liu H H,Zuo Y M.The rhizosphere regulation mechanism and use of root exudates to inhibit continuous monocropping barrier by nematode disease[J].Journal of Plant Nutrition and Fertilizers,2019,25(6):1038-1046.
[23] 李燕,徐立军,周俊阁,师建华.连作土壤改良对温室草莓土传病害及白粉病的消减研究[J].2016,32(9):52-53,202.doi:10.3969/j.issn.1672-0873.2016.09.023.
Li Y,Xu L J,Zhou J G,Shi J H.Reduction of soil-borne diseases and powdery mildew in greenhouse strawberries by continuous cropping soil improvement[J].Chinese Horticultural Abstracts,2016,32(9):52-53,202.