作为一类重要的人工合成化合物,邻苯二甲酸酯(PAEs)常被用作增塑剂,是塑料制品生产行业的重要化工原料之一[1]。PAEs具有内分泌干扰性,影响人类生殖健康,甚至具有潜在的“三致效应”[2-3]。因此,邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二(2-乙基己)酯(DEHP)等部分邻苯二甲酸酯类化合物被美国环保署(EPA)和我国列为环境优先控制的有毒污染物。大量调查发现,PAEs已经成为环境中最普遍存在的有机污染物之一[4-6],而土壤介质是PAEs重要的储藏库和中转站[7-8]。
研究证实,土壤中的PAEs会通过水解、光解、微生物降解等多种途径进行代谢,而微生物降解是PAEs衰减的最主要途径[9]。因此,驯化分离高效降解菌成为PAEs污染环境生物修复的重要基础性工作[10-11]。近年来,国内外学者从污泥、土壤、河道底泥等不同环境介质中已经成功分离出诸多PAEs高效降解菌[12-15]。通过对部分菌株降解PAEs的途径进行研究,发现邻苯二甲酸单丁酯(MBP)、邻苯二甲酸单乙基己基酯(MEHP)等邻苯二甲酸单酯(MPEs)是PAEs代谢过程的重要中间产物[16-17]。毒理学研究发现,MEHP 对海洋青鳉(Oryzias melastigma)具有内分泌干扰效应[18-20];与DEHP相比,MEHP对H295R细胞类固醇激素合成关键基因表达的影响较明显[21]。
目前,关于PAEs中间代谢物MPEs的研究主要集中于动物的毒理学效应[22-24],对于土壤中PAEs降解过程产生的MPEs是否会对作物产生毒害效应的相关研究尚未开展。本研究选择小麦作为供试植物,通过种子萌发试验考察DBP和MBP对小麦种子发芽、根和芽伸长的影响,通过水培试验研究DBP和MBP对小麦幼苗保护酶活性的影响,旨在探明PAEs及其代谢物对作物生长的毒害效应,为科学评估PAEs的生态风险提供参考依据。
1 材料和方法
1.1 试验材料
供试小麦品种为青麦6号。DBP和MBP分别购自北京百灵威科技有限公司和梯希爱(上海)化成工业发展有限公司,其余试剂均为分析纯,购自国药集团。
试验所用的霍格兰德营养液配方为Ca(NO3)2·4H2O 945 mg/L、KNO3 607 mg/L、NH4·H2PO4 115 mg/L、MgSO4·4H2O 493 mg/L、H3BO3 2.86 mg/L、MnCl2·4H2O 1.81 mg/L、ZnSO4·7H2O 0.22 mg/L、CuSO4·5H2O 0.08 mg/L、(NH4)2Mo7O24·4H2O 0.02 mg/L、FeSO4·7H2O 27.85 mg/L、Na2-EDTA 37.25 mg/L。
1.2 试验方案
1.2.1 种子萌发试验 选取若干大小均匀、颗粒饱满的小麦种子用5%的过氧化氢溶液浸泡消毒20 min,然后反复用蒸馏水冲洗直至干净。DBP和MBP溶液分别设置5,10,20,50,80 mg/L 5个浓度水平,同时设置未添污染物的溶液作为空白对照CK。在玻璃培养皿底层铺一层脱脂棉保持水分,再放一层无灰定性滤纸,分别加入5 mL上述不同浓度梯度的DBP和MBP处理溶液,用镊子将小麦种子均匀放于玻璃培养皿中,保持种子腹沟向下、胚根末端和生长方向呈直线。盖好玻璃培养皿,置于生化培养箱中25 ℃暗处培养,每个处理15粒小麦种子,并设置3个重复,每天观察种子萌发情况并记录种子的发芽数,并测量种子萌发时长出的芽和根的长度。试验时间为7 d,试验结束后计算种子的发芽率、根长和茎长抑制率。
1.2.2 幼苗生长试验 选取大小均匀、颗粒饱满的小麦种子,用5%的过氧化氢溶液浸泡消毒20 min,然后用蒸馏水反复冲洗干净,洗去种皮表面的各种菌类和消毒液。将洗净擦干后的小麦种子于玻璃培养皿中,置于培养箱中暗处25 ℃催芽24 h,待小麦种子全部发芽后,移入人工气候箱,设置晚上白天的时间均为12 h,温度为25 ℃,待长出叶子后添加1/4霍格兰德营养液。至小麦幼苗长到一定高度时,选择生长状况大致相似的小麦幼苗分别移栽到不同DBP、MBP处理浓度的棕色玻璃瓶中,每个浓度设置3个重复,以1/4霍格兰德营养液作为对照空白CK,于处理后的第10天取样测定幼苗SOD活性、POD活性、CAT活性和MDA含量。
1.3 测定方法
根据张志良等[25]的方法,采用氮蓝四唑光化还原法测定超氧化物歧化酶(SOD)活性,采用愈创木酚法测定过氧化物酶(POD)的活性,采用H2O2法测定过氧化氢酶(CAT)活性,采用硫代巴比妥酸法测定丙二醛(MDA)含量。
1.4 数据处理与分析
试验数据利用Excel 2013进行统计处理,利用SPSS 21.0进行单因素方差分析和t检验,利用Origin 9.0进行作图。
2 结果与分析
2.1 DBP和MBP对小麦种子发芽率的影响
图1为 DBP和MBP对小麦种子发芽率的影响。由图可以看出,在CK处理中,种子发芽率为93.33%,随着DBP和MBP浓度的逐渐升高,发芽率均有不同程度地降低。对DBP而言,在不同的浓度水平下,发芽率均显著低于对照(P<0.05),在80 mg/L浓度水平下,发芽率达到最低值(51.11%),表明DBP对发芽率有显著的抑制作用;对MBP而言,在5,10,20 mg/L浓度水平下,发芽率介于82.22%~91.11%,与CK无显著差异(P>0.05),未表现出抑制作用,在50,80 mg/L浓度水平下,发芽率分别为77.78%,60.00%,显著低于对照(P<0.05),表明在高浓度水平下MBP对种子萌发具有显著的抑制作用。在10,20,50,80 mg/L浓度水平下,DBP处理组的发芽率均低于MBP处理组,但无显著差异(P>0.05)。
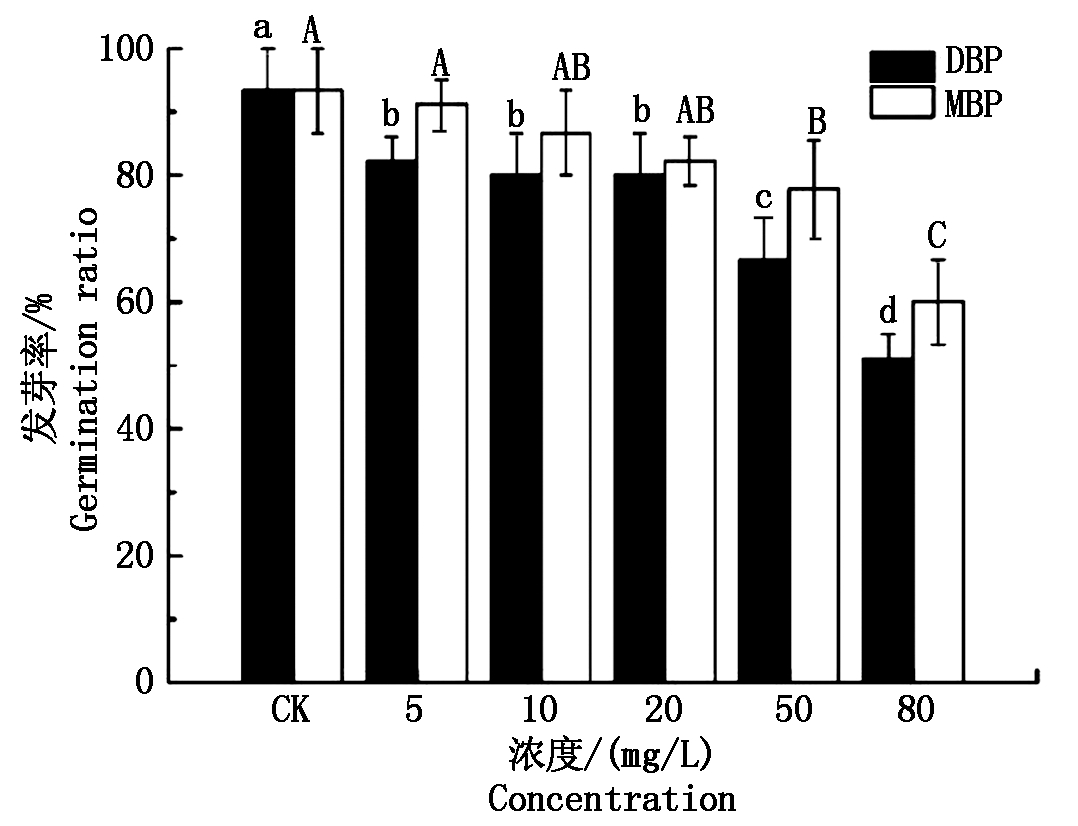
不同的小写字母表示BDP处理不同浓度之间差异显著(P<0.05);不同的大写字母表示MBP处理不同浓度之间差异显著(P<0.05)。图2-6同。
Different small letters indicate significant differences at 0.05 level between different DBP treatments;Different big letters indicate significant difference at 0.05 level between different MBP treatments.The same as Fig.2-6.
图1 DBP和MBP对小麦种子发芽率的影响
Fig.1 Effects of DBP and MBP on the germination rate of wheat seeds
2.2 DBP和MBP对小麦种子芽长、根长抑制率的影响
图2为DBP和MBP对小麦种子芽长和根长抑制率的影响。由图可以看出,随着DBP和MBP浓度的升高,小麦种子的芽长抑制率均有不同程度地升高,对芽长的抑制作用逐渐增强。对DBP而言,在5,10,20 mg/L中低浓度水平下,芽长抑制率介于14.08%~22.69%,无显著差异(P>0.05);当浓度水平升至50,80 mg/L,抑制率分别高达56.19%,81.80%,显著高于中低浓度水平,对小麦种子的芽长表现出明显的抑制作用。对MBP而言,芽长抑制率随浓度水平升高而增高的规律与DBP处理相似,而且在相同的浓度水平下,MBP对芽长的抑制作用稍低于DBP,但未表现出显著差异(P>0.05)。
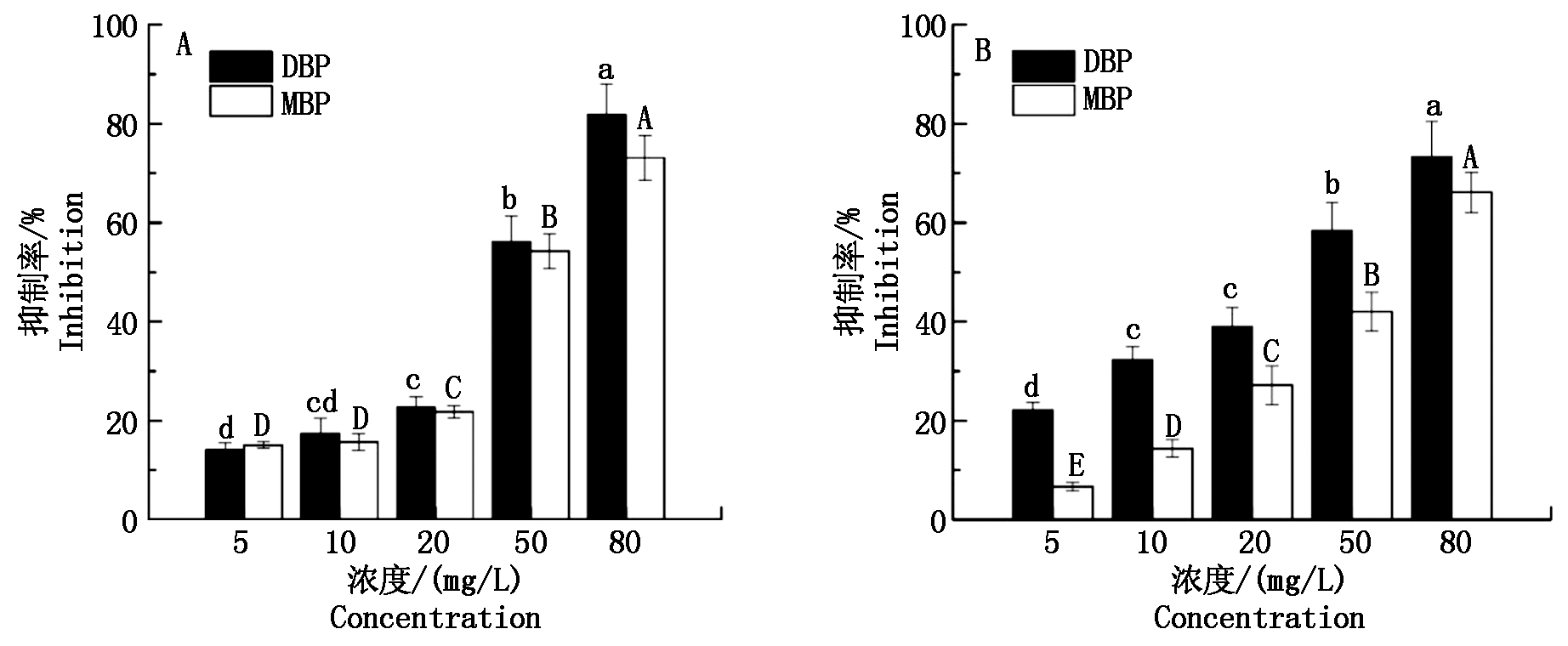
A.芽长;B.根长。
A.Root length;B.Bud length.
图2 DBP、MBP对小麦种子芽长和根长抑制率的影响
Fig.2 Effects of DBP and MBP on the inhibition rate of root and bud length of wheat seeds
由图2还可以看出,随着DBP和MBP浓度的升高,小麦种子的根长抑制率均有显著升高,不同浓度水平下的根长抑制率存在显著差异(P<0.05),在80 mg/L浓度水平下,DBP和MBP处理组根长抑制率分别达到最高值(73.33%,66.15%)。在5,10,20,50 mg/L浓度水平下,DBP对根长的抑制作用显著高于MBP(P<0.05),但在80 mg/L浓度水平下,DBP与MBP对芽长的抑制作用未表现出显著差异(P>0.05)。
进一步分析发现,在5~50 mg/L浓度水平下,DBP对根长的抑制率稍高于对芽长的抑制率,而在80 mg/L浓度水平下,DBP对芽长的抑制率稍高于对根长的抑制率;MBP对芽长的抑制率在不同的浓度水平下均高于对根长的抑制率。
2.3 DBP和MBP对小麦幼苗SOD酶活性的影响
图3为DBP和MBP对小麦幼苗SOD活性的影响。由图可以看出,随着DBP和MBP浓度的逐渐升高,小麦幼苗SOD活性均呈现先升高后下降的趋势。当DBP浓度为10,20,50 mg/L时,SOD活性达到最高值,分别为30.42,31.86,30.42 U/(g·min),显著高于其他处理(P<0.05);当MBP浓度为10,20 mg/L时,SOD活性达到最高值,分别为28.48,30.15 U/(g·min),显著高于其他处理(P<0.05)。在50,80 mg/L浓度水平下,DBP处理组幼苗SOD活性显著高于MBP处理组(P<0.05),而在其他浓度水平下,DBP与MBP处理组幼苗SOD活性无显著差异(P>0.05)。
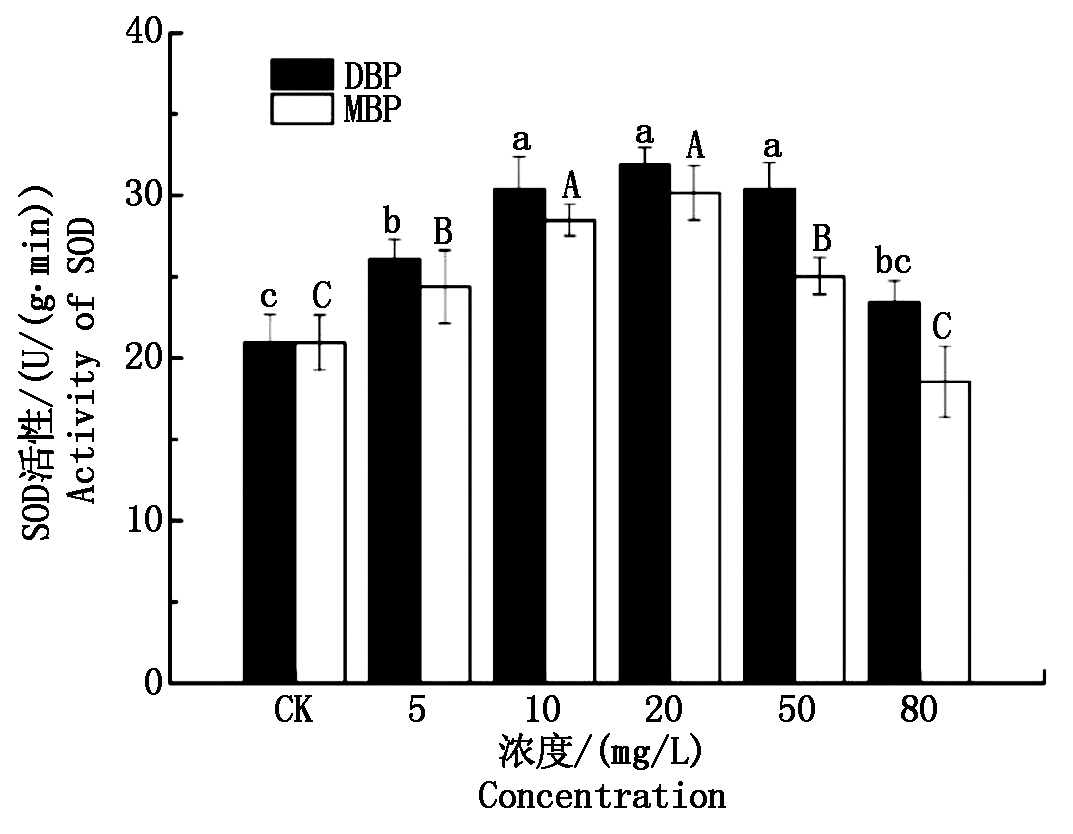
图3 DBP和MBP对小麦幼苗SOD活性的影响
Tab.3 Effects of DBP and MBP on SOD activity of wheat seedlings
2.4 DBP和MBP对小麦幼苗POD酶活性的影响
图4为DBP和MBP对小麦幼苗POD活性的影响。由图可以看出,随着DBP和MBP浓度的逐渐升高,小麦幼苗POD活性均呈现先升高后下降的趋势,均显著高于空白对照(P<0.05)。在20 mg/L浓度水平下,DBP和MBP处理的小麦幼苗POD活性均达到最高值,分别为14 958.26,13 853.74 U/(g·min),显著高于其他处理(P<0.05)。在5,20 mg/L浓度水平外,DBP处理组幼苗SOD活性显著高于MBP处理组(P<0.05)。
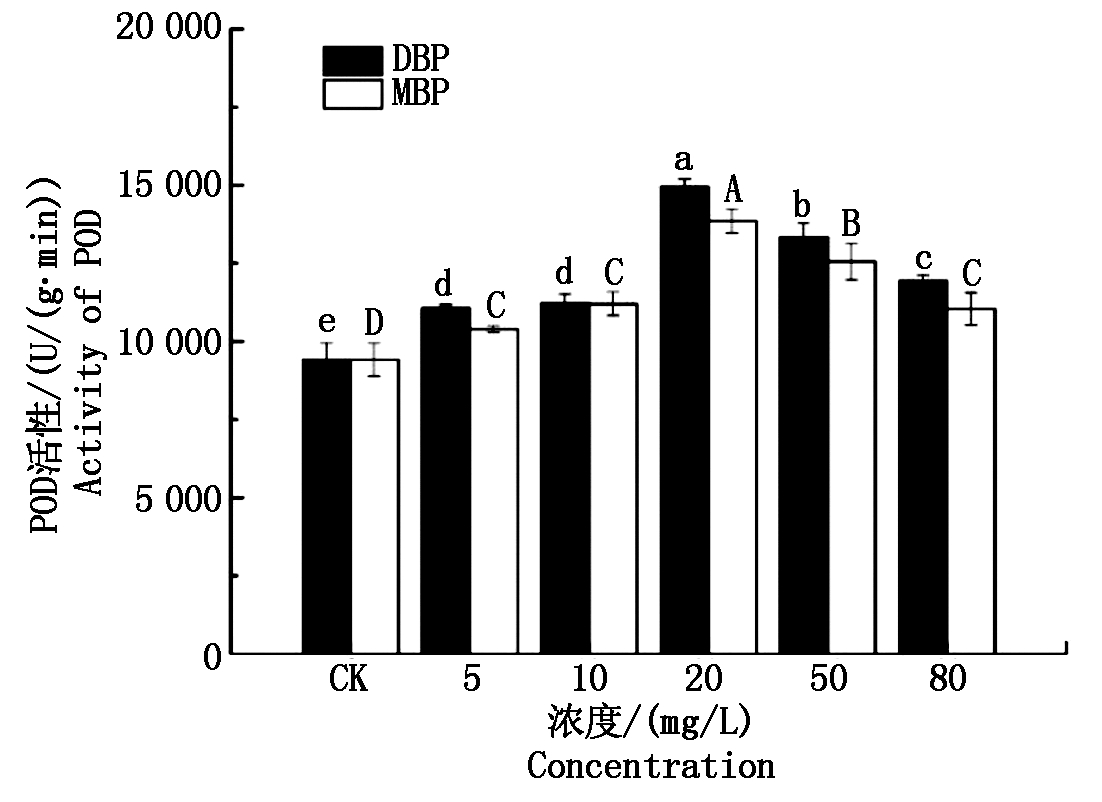
图4 DBP和MBP对小麦幼苗POD活性的影响
Tab.4 Effects of DBP and MBP on POD activity of wheat seedlings
2.5 DBP和MBP对小麦幼苗CAT活性的影响
图5为DBP和MBP对小麦幼苗CAT活性的影响。由图可以看出,随着DBP和MBP浓度的逐渐升高,小麦幼苗CAT活性整体上呈现先升高后下降的趋势。在5,10 mg/L浓度水平下,MBP处理组小麦幼苗CAT活性与对照无显著差异(P>0.05),而在20~80 mg/L浓度水平,MBP处理组小麦幼苗CAT活性均显著高于对照(P<0.05)。在20 mg/L浓度水平下,DBP和MBP处理的小麦幼苗CAT活性均达到最高值,分别为1 901.58,1 768.86 U/(g·min),显著高于其他处理(P<0.05),在10,20,50,80 mg/L浓度水平下,DBP处理组幼苗CAT活性显著高于MBP处理组(P<0.05)。
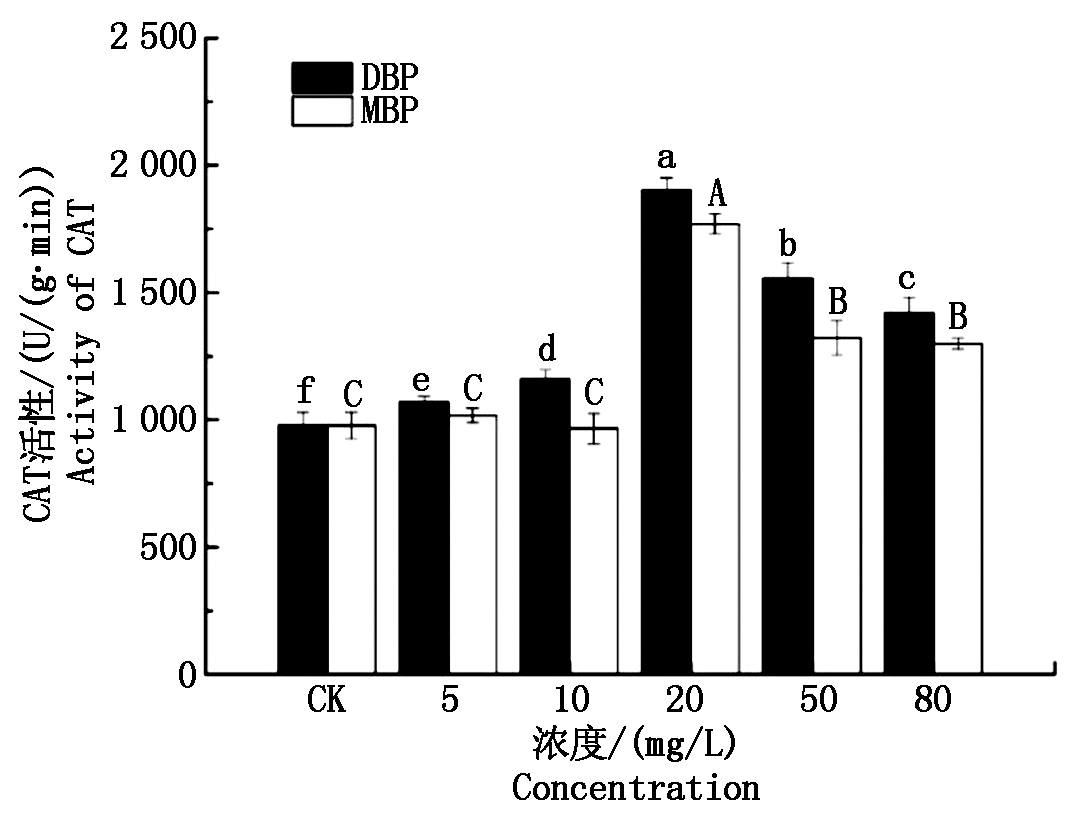
图5 DBP和MBP对小麦幼苗CAT活性的影响
Tab.5 Effects of DBP and MBP on CAT activity in wheat seedlings
2.6 DBP和MBP对小麦幼苗MDA含量的影响
图6为DBP和MBP对小麦幼苗MDA含量的影响。由图可以看出,在5 mg/L浓度水平下,DBP和MBP处理组小麦幼苗MDA(以鲜质量计)与对照无显著差异(P>0.05),但随着DBP和MBP浓度由10 mg/L升至80 mg/L,小麦幼苗MDA含量均呈显著上升趋势。在80 mg/L浓度水平下,DBP和MBP处理组小麦幼苗MDA达到最高值,分别为0.012 2,0.011 8 μmol/g。在10,20,50 mg/L浓度水平下,DBP处理组幼苗MDA含量显著高于MBP处理组(P<0.05),在10,20,50,80 mg/L浓度水平下,DBP处理组幼苗CAT活性显著高于MBP处理组(P<0.05)。
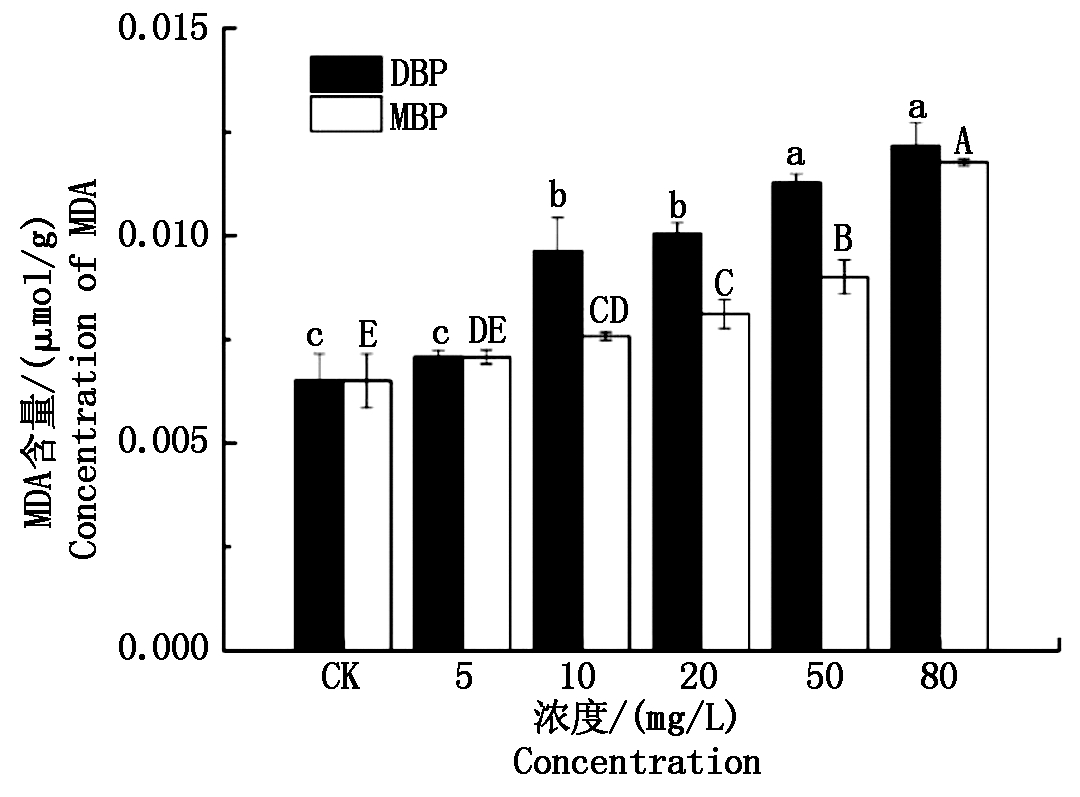
图6 DBP和MBP对小麦幼苗MDA含量的影响
Tab.6 Effects of DBP and MBP on MDA content in wheat seedlings
3 讨论与结论
种子萌发试验被看作是经典的高等植物毒理学研究方法,常被用于考察评价污染物胁迫下植物的发芽情况、根系发育状况及其对污染物的抵抗能力[26]。相关研究已经证实,DBP会抑制小麦种子的发芽率,当浓度达到40~50 mg/L时,小麦种子的发芽率受到明显的抑制作用,而且随着DBP浓度的升高,其抑制作用增强[27-28],这与本研究结果比较相似,但在本研究中同时考察了DBP的代谢物MBP对小麦种子发芽率的影响,发现当MBP浓度达到50 mg/L时,小麦种子发芽率显著低于对照,且随着浓度升高,发芽率显著降低。在10,20,50,80 mg/L浓度水平下,DBP与MBP处理组的种子发芽率无显著差异(P>0.05),这表明土壤中DBP代谢过程产生的MBP对植物种子萌发也存在抑制作用,因此,在相关研究的盆栽试验中发现PAEs对种子萌发的影响很可能有其代谢产物的贡献。
种子萌发后根长和芽长的变化是鉴定幼苗抗逆性的重要指标。与发芽率的变化趋势相似,在DBP和MBP胁迫下,小麦的根长和芽长抑制率随着污染物浓度升高而显著增高,DBP的抑制作用仍然稍高于MBP,但并不存在显著差异。DBP和MBP对于根长和芽长的抑制作用却表现出不同的规律,在5~20 mg/L的浓度水平下,DBP对根长的抑制作用明显高于芽长,当浓度升至50,80 mg/L浓度水平下,DBP对根长和芽长的抑制作用表现为无显著差异。由于植物络合毒物分子最重要的部分和最容易受到有毒分子影响的部位是其所出生的根生长点细胞,进而表现为根的长度受到抑制[29],在本研究的种子萌发试验中,小麦种子长期暴露于DBP的胁迫环境中,小麦体内细胞的分裂将会受到严重的影响,从而抑制根生长,这与戚云[30]关于PAEs对小麦种子萌发的研究结果相似。与DBP有所不同,在不同浓度水平下,MBP总体表现为对芽长的抑制率高于根长,这可能与其本身的分子结构有关,MBP的分子体积和质量较DBP小,且水溶性要好于DBP,故MBP会更容易进入植物体内,在芽中积累从而发生毒害作用。
在正常的生长环境中,植物体内活性氧自由基(ROS)的产生与清除速率处于动态平衡状态,一旦植物体处于逆境条件,植物体内的ROS代谢平衡会遭到破坏,过多的ROS开始在植物体内积累使膜脂过氧化程度加剧,对细胞造成伤![]() 和H2O2具有强氧化性,可以损伤植物体生物膜的机构和功能,导致植株加快老化[32-33]。为了应对
和H2O2具有强氧化性,可以损伤植物体生物膜的机构和功能,导致植株加快老化[32-33]。为了应对![]() 和H2O2水平的升高,植物体会通过提高抗氧化系统酶活性,减轻环境条件胁迫的伤害,从而保证植物正常的生理功能[34]。抗氧化酶SOD、POD、CAT能有效清除植物体内的
和H2O2水平的升高,植物体会通过提高抗氧化系统酶活性,减轻环境条件胁迫的伤害,从而保证植物正常的生理功能[34]。抗氧化酶SOD、POD、CAT能有效清除植物体内的![]() 和H2O2,是植物抗氧化酶系统中最重要的保护酶。其中,SOD能将毒性较强的
和H2O2,是植物抗氧化酶系统中最重要的保护酶。其中,SOD能将毒性较强的![]() 歧化为毒性较轻的H2O2,CAT和POD协同作用将H2O2转化为H2O和O2[32]。因此,抗氧化酶活性水平的高低能反映出植物体抵抗氧化胁迫的能力。本试验结果表明,在DBP、MBP胁迫处理下,小麦幼苗SOD、CAT和POD酶活性随着DBP、MBP浓度的升高整体呈先上升后下降的趋势,这与戚云[30]的研究结果相似。在浓度为5 mg/L时,3种酶的活性已显著高于对照,表明DBP、MBP胁迫已经使小麦幼苗ROS的产生速率加快,进而引起SOD、CAT和POD等抗氧化酶活性的增强,开始清除ROS,可以在一定程度上缓解DBP、MBP对小麦幼苗的毒害作用,保证小麦幼苗的正常生长。当浓度达到20 mg/L时,SOD、CAT和POD的活性均达到最高值,并随着DBP、MBP浓度的进一步升高而逐渐下降,这表明20 mg/L的浓度水平对小麦幼苗的伤害较为严重,这可能是抗氧化酶对DBP、MBP耐受性的一个临界值。DBP、MBP浓度一旦超过20 mg/L,抗氧化酶的活性降低,ROS的清除速率下降,细胞开始发生膜脂过氧化损伤。
歧化为毒性较轻的H2O2,CAT和POD协同作用将H2O2转化为H2O和O2[32]。因此,抗氧化酶活性水平的高低能反映出植物体抵抗氧化胁迫的能力。本试验结果表明,在DBP、MBP胁迫处理下,小麦幼苗SOD、CAT和POD酶活性随着DBP、MBP浓度的升高整体呈先上升后下降的趋势,这与戚云[30]的研究结果相似。在浓度为5 mg/L时,3种酶的活性已显著高于对照,表明DBP、MBP胁迫已经使小麦幼苗ROS的产生速率加快,进而引起SOD、CAT和POD等抗氧化酶活性的增强,开始清除ROS,可以在一定程度上缓解DBP、MBP对小麦幼苗的毒害作用,保证小麦幼苗的正常生长。当浓度达到20 mg/L时,SOD、CAT和POD的活性均达到最高值,并随着DBP、MBP浓度的进一步升高而逐渐下降,这表明20 mg/L的浓度水平对小麦幼苗的伤害较为严重,这可能是抗氧化酶对DBP、MBP耐受性的一个临界值。DBP、MBP浓度一旦超过20 mg/L,抗氧化酶的活性降低,ROS的清除速率下降,细胞开始发生膜脂过氧化损伤。
MDA是膜脂过氧化的主要产物之一,其含量是反映逆境条件下植物细胞膜受害程度的重要指标[31]。本研究结果表明,当DBP或MBP浓度≥10 mg/L时,对MDA影响开始显著,说明此时污染物胁迫可能已经开始导致植物细胞内ROS的代谢失衡,抗氧化酶的活性逐渐下降,ROS的过量累积使膜脂过氧化反应加剧,从而MDA含量上升,这与抗氧化酶活动的变化规律基本一致。
在本试验中,相同的浓度水平下,SOD、CAT和POD的活性均表现为DBP高于MBP,之前的相关研究已经证实DBP会影响小麦幼苗的生理指标,往往认为DBP是导致作物毒性效应的主要污染物,容易忽略代谢产物MBP的作用。在实际环境条件下,土壤中会有PAEs代谢产物MPEs的存在,而在植物体内PAEs也会被代谢为MPEs。目前,关于PAEs在植物细胞内部代谢详细过程的研究较少。但有研究者发现,邻苯二甲酸酯在植物体内的代谢过程主要位于根部,并且可能与羧酸酯酶有关,DBP的代谢产物主要为MBP和邻苯二甲酸(PA)[35]。董又铭[36]在小麦对DBP和DEHP污染的防御应答机制研究中也发现小麦植株有MBP的存在,表明植物吸收DBP后会代谢为MBP,而DBP和MBP很可能会共同作用于植物体,其协同作用可能会促使ROS产生速率加快,从而破坏植物细胞。作为DBP的代谢产物,MBP也会被作物直接吸收累积[37],同样可能在植物体内发生代谢活动,从而降低其毒性效应。为了进一步证明代谢产物MBP对植物体毒害效应的贡献,在后续试验中仍需加强对DBP在植物体内代谢速率、代谢路径的相关研究,从而更加科学地评估土壤PAEs污染带来的生态风险。
[1] Staples C A,Peterson D R,Parkerton T F,Adams W J. The environmental fate of phthalate esters:A literature review[J]. Chemosphere,1997,35(4):667-749. doi:10.1016/S0045-6535(97)00195-1.
[2] Qu R J,Feng M B,Sun P,Wang Z Y. A comparative study onantioxidant status combined with integrated biomarker response in Carassius auratus fish exposed to nine phthalates[J]. Environmental Toxicology,2015,30(10):1125-1134.doi:10.1002/tox.21985.
[3] Bhatia H,Kumar A,Ogino Y,Gregg A,Chapman J,McLaughlin M J,Iguchic T. Di-n-butyl phthalate causes estrogenic effects in adult male Murray rainbowfish (Melanotaenia fluviatilis)[J]. Aquatic Toxicology,2014,149:103-115.doi:10.1016/j.aquatox.2014.01. 025.
[4] Gupta S,Gadi R. Temporal variation of phthalic acid esters (PAEs) in ambient atmosphere of delhi[J]. Bulletin of Environmental Contamination and Toxicology,2018,101(2):153-159.doi:10.1007/s00128-018-2337-1.
[5] Ramzi A,Gireeshkumar T R,Habeeb R K,Manu M,Balachandran K K,Chacko J,Chandramohanakumar N. Distribution and contamination status of phthalic acid esters in the sediments of a tropical monsoonal estuary,Cochin-India[J].Chemosphere,2018,210:232-238.doi:10.1016/j.chemosphere.2018.06.182.
[6] Gao D W,Li Z,Wang H,Liang H. An overview of phthalate acid ester pollution in China over the last decade:Environmental occurrence and human exposure[J]. Science of the Total Environment,2018,645:1400-1409. doi:10.1016/j.scitotenv.2018.07.093.
[7] Hu X Y,Wen B,Shan X Q. Survey of phthalate pollution in arable soils in China[J]. Journal of Environmental Monitoring,2003,5(4):649-653. doi:10.1039/b304669a.
[8] He L Z,Gielen G,Bolan N S,Zhang X K,Qin H,Huang H G,Wang H L. Contamination and remediation of phthalic acid esters in agricultural soils in China:a review[J]. Agronomy for Sustainable Development,2015,35(2):519-534.doi:10.1007/s13593-014-0270-1.
[9] 翟斌,王朝万,张巍,张永江,王化杰.环境介质中邻苯二甲酸酯类化合物的环境行为及生态风险研究进展[J].环境与健康杂志,2016,33(11):1030-1034. doi:10.16241/j.cnki.1001-5914.2016.11.023.
Zhai B,Wang C W,Zhang W,Zhang Y J,Wang H J. Environmental behavior and ecotoxicological risk of phthalic acid esters:a review of recent studies[J]. Journal of Environmental Health,2016,33(11):1030-1034.
[10] 吴琼,张晓峰,任伟,李守林,段亚萍.邻苯二甲酸酯的污染现状及微生物降解研究进展[J].微生物学杂志,2018,38(2):122-128.doi:10.3969/j.issn.1005-7021.2018.02.018.
Wu Q,Zhang X F,Ren W,Li S L,Duan Y P. Advances in pollution status and microbio-degradation of phthalates[J].Journal of Microbiology,2018,38(2):122-128.
[11] 王玉婷,刘方,任文杰,滕应.酞酸酯污染农田土壤生物修复研究进展[J].微生物学杂志,2018,38(4):126-134. doi:10.3969/j.issn.1005-7021.2018.04.017.
Wang Y T,Liu F,Ren W J,Teng Y. Advances in bioremediation of phthalate contaminated farmland soil[J].Journal of Microbiology,2018,38(4):126-134.
[12] Sarkar J,Chowdhury P P,Dutta T K. Complete degradation of di-n-octyl phthalate by Gordonia sp. strain Dop5[J].Chemosphere,2013,90(10):2571-2577. doi:10.1016/j.chemosphere.2012.10.101.
[13] Whangsuk W,Sungkeeree P,Nakasiri M,Thiengmag S,Mongkolsuk S,Loprasert S. Two endocrine disrupting dibutyl phthalate degrading esterases and their compensatory gene expression in Sphingobium sp. SM42[J].International Biodeterioration & Biodegradation,2015,99:45-54.doi:10.1016/j.ibiod.2014.12.006.
[14] 张颖,王丽华,陈艺洋,王蕾,周长健,付嘉伟,范新会.一株DBP高效降解菌的筛选及降解特性研究[J].东北农业大学学报,2016,47(8):46-54.doi:10.3969/j.issn.1005-9369.2016.08.006.
Zhang Y,Wang L H,Chen Y Y,Wang L,Zhou C J,Fu J W,Fan X H. Study on isolation and identification of a Di-n-butyl phthalate (DBP)-degrading strain and its degradation characteristics[J].Journal of Northeast Agricultural University, 2016,47(8):46-54.
[15] 杨婧,郭楚玲,刘沙沙,党志,卢桂宁.邻苯二甲酸酯降解菌的筛选、降解特性及土壤修复研究[J].农业环境科学学报,2018,37(5):933-940.doi:10.11654/jaes.2017-1689.
Yang J,Guo C L,Liu S S,Dang Z,Lu G N. Isolation and characterization of phthalate-degrading bacterial strain,and its application in phthalate-contaminated soil[J]. Journal of Agro-Environment Science,2018,37(5):933-940.
[16] 高静静,陈丽玮,王宜青,陈长生,俞悦,王平.一株邻苯二甲酸二(2-乙基己基)酯(DEHP)高效降解菌的筛选及其降解特性[J].环境化学,2016,35(11):2362-2369.doi:10.7524/j.issn.0254-6108.2016.11.2016040103.
Gao J J,Chen L W,Wang Y Q,Chen C S,Yu Y,Wang P. Isolation,identification of a DEHP-degrading bacterium and its high effective biodegradation characteristics[J]. Environmental Chemistry, 2016,35(11):2362-2369.
[17] 王嘉翼,樊双虎,任超,王俊欢,杨婷,贾阳,李先军,闫艳春.一株黄色杆菌的分离鉴定及对邻苯二甲酸酯的降解研究[J].生物技术通报,2018,34(10):157-164.doi:10.13560/j.cnki.biotech.bull.1985.2018-0393.
Wang J Y,Fan S H,Ren C,Wang J H,Yang T,Jia Y,Li X J,Yan Y C. Identification of newly isolated Xanthobacter sp. and its degradability to phthalic acid esters[J]. Biotechnology Bulletin,2018,34(10):157-164.
[18] 叶婷,杨丹,李灿.MEHP对胚胎期海水青鳉(Oryzias melastigma)的内分泌干扰效应[J].海洋环境科学,2018,37(6):857-863.doi:10.13634/j.cnki.mes.2018.06.033.
Ye T,Yang D,Li C. Endocrine-disrupting effects of MEHP on marine medaka (Oryzias melastigma) Embryos[J].Marine Environmental Science,2018,37(6):857-863.
[19] 叶婷,康美,黄乾生,方超,陈亚檞,董四君.邻苯二甲酸二(2-乙基己)酯和邻苯二甲酸单乙基己基酯对幼年期及青年期海洋青鳉(Oryzias melastigma)的内分泌干扰效应[J].环境化学,2014(4):543-550.doi:10.7524/j.issn. 0254-6108.2014.04.002.
Ye T,Kang M,Huang Q S,Fang C,Chen Y J,Dong S J. Endocrine-disrupting effects of DEHP and MEHP on the fry and juvenile stage medaka (Oryzias melastigma)[J].Environmental Chemistry,2014(4):543-550.
[20] 叶婷,康美,黄乾生,董四君.邻苯二甲酸二(2-乙基己)酯(DEHP)和邻苯二甲酸单乙基己基酯(MEHP)长期暴露对海洋青鳉(Oryzias melastigma)内分泌干扰效应的评价[J].生态毒理学报,2014,9(2):253-260.doi:10.7524/AJE.1673-5897.20130722001.
Ye T,Kang M,Huang Q S,Dong S J. Endocrine-disrupting effects of DEHP and MEHP on Oryzias melastigma under long-term exposure[J].Asian Journal of Ecotoxicology,2014,9(2):253-260.
[21] 叶婷,董四君,王佳,杨丹,杨大星,李灿.DEHP及其代谢产物MEHP对MLTC-1细胞凋亡和类固醇激素合成基因表达的影响[J].环境卫生学杂志,2018,8(4):281-287,293.doi: 10.13421/j.cnki.hjwsxzz.2018.04.001.
Ye T,Dong S J,Wang J,Yang D,Yang D X,Li C. Effects of DEHP and its metabolite MEHP on cell apoptosis and the expression of steroidogenic genes in MLTC-1 cells[J].Journal of Environmental Hygiene,2018,8(4):281-287,293.
[22] 李玉秋,段志文,裴秀丛,张玉敏,马明月.DEHP、MEHP对小鼠胚胎干细胞细胞毒性的研究[J].实用药物与临床,2016,19(8):925-928.doi:10.14053/j.cnki.ppcr.201608001.
Li Y Q,Duan Z W,Pei X C,Zhang Y M,Ma M Y. Effect of DEHP and MEHP on the cytotoxicity of embryonic stem cell of mouse[J]. Practical Pharmacy and Clinical Remedies,2016,19(8):925-928.
[23] 燕美玲. MEHP对原代培养新生大鼠下丘脑神经元的毒性作用[D].天津:天津医科大学,2014.
Yan M L. The toxicity of mono(2-ethylhexyl) phthalate on primary cultured hypothalamic neurons of neonatal rats[D]. Tianjin:Tianjin Medical University,2014.
[24] 万旭英,朱玉平,马玺里,朱江波,郑怡文,侯娟,王飞,刘珍,张天宝.邻苯二甲酸二(2-乙基己基)酯及其代谢产物MEHP对体外大鼠卵泡发育的影响[J].卫生研究,2010,39(3):268-270,274.doi:10.19813/j.cnki. weishengyanjiu.2010.03.002.
Wan X Y,Zhu Y P,Ma X L,Zhu J B,Zheng Y W,Hou J,Wang F,Liu Z,Zhang T B. Effect of DEHP and its metabolite MEHP on in vitro rat follicular development[J].Journal of Hygiene Research,2010,39(3):268-270,274.
[25] 张志良,瞿伟菁,李小芳.植物生理学实验指导[M].4版.北京:高等教育出版社,2009.
Zhang Z L,Qu W J,Li X F. Plant physiology experiment guide[M]. 4th Edition.Beijing:Higher Education Press,2009.
[26] Wang X D,Sun C,Gao S X,Wang L S,Shoukui H. Validation of germination rate and root elongation as indicator to assess phytotoxicity with Cucumis sativus[J].Chemosphere,2001,44(8):1711-1721.doi:10.1016/s0045-6535(00) 00520-8.
[27] Gao M L,Dong Y M,Zhang Z,Song W H,Qi Y. Growth and antioxidant defense responses of wheat seedlings to di-n-butyl phthalate and di (2-ethylhexyl) phthalate stress[J].Chemosphere,2017,172:418-428.doi:10.1016/j. chemosphere.2017.01.034.
[28] 张慧芳,苗艳明,丁献华,毕润成.邻苯二甲酸酯对小麦幼苗生理指标的影响[J].安徽农业科学,2010,38(7):3374-3377.doi:10.3969/j.issn.0517-6611.2010.07.029.
Zhang H F,Miao Y M,Ding X H,Bi R C. Effects of phthalates on physiological indices of wheat seedlings[J].Journal of Anhui Agricultural Science,2010,38(7):3374-3377.
[29] 孙铁珩,周启星,李培军.污染生态学[M].北京:科学出版社,2001.
Sun T H,Zhou Q X,Li P J. Pollution ecology[M]. Beijing:Higher Education Press,2001.
[30] 戚云. DBP、DEHP对小麦的毒理学效应研究[D].天津:天津工业大学,2016.
Qi Y. Toxicological effects of DBP and DEHP on wheat[D]. Tianjin:Tianjin Polytechnic University,2016.
[31] Baileyserres J,Mittler R. The roles of reactive oxygen species in plant cells[J]. Plant Physiology, 2006,141(2):311-311.doi:10.1104/pp.104.900191.
[32] 刘聪,董腊嫒,林建中,刘选明.逆境胁迫下植物体内活性氧代谢及调控机理研究进展[J].生命科学研究,2019,23(3):253-258.doi:10.16605/j.cnki.1007-7847.2019.03.012.
Liu C,Dong L Y,Lin J Z,Liu X M. Research advances on regulation mechanism of reactive oxygen species metabolism under stresses[J]. Life Science Research,2019,23(3):253-258.
[33] 李格,孟小庆,蔡敬,董婷婷,李宗芸,朱明库.活性氧在植物非生物胁迫响应中功能的研究进展[J].植物生理学报,2018,54(6):951-959.doi:10.13592/j.cnki.ppj.2018.0052.
Li G,Meng X Q,Cai J,Dong T T,Li Z Y,Zhu M K. Advances in the function of reactive oxygen species in plant responses to abiotic stresses[J]. Plant Physiology Journal,2018,54(6):951-959.
[34] Suneja Y, Gupta A K, Bains N S. Bread wheat progenutors:Aegilops tauschii (DD genome) and Triticum dicoccoides (AABB genome) reveal differential antioxidative response under water stress[J]. Physiology and Molecular Biology of Plants, 2017,23(1):99-114. doi:10.1007/s12298-016-0409-4.
[35] Lin Q Q,Chen S Y,Chao Y Q,Huang X F,Wang S Z,Qiu R L. Carboxylesterase-involved metabolism of di-n-butyl phthalate in pumpkin (Cucurbita moschata) seedlings[J]. Environmental Pollution, 2017,220:421-430.doi:10.1016/j.envpol. 2016.09.084.
[36] 董又铭.小麦对PAEs污染的防御应答机制[D].天津:天津工业大学,2018.
Dong Y M. Mechanism of defense response on wheat to PAEs pollution[D]. Tianjin:Tianjin Polytechnic University,2018.
[37] 李晓贝,张腾,周昌艳,白冰,陈珊珊.4种蔬菜对DBP和DEHP及其代谢物的吸收累积研究[J].农业资源与环境学报,2018,35(1):87-94.doi:10.13254/j.jare.2017.0202.
Li X B,Zhang T,Zhou C Y,Bai B,Chen S S. Absorption and accumulation of Di-n-butyl phthalate(DBP) and Di(2-ethylhexyl) phthalate (DEHP) and metabolites in four vegetables[J]. Journal of Agricultural Resources and Environment,2018,35(1):87-94.