植物的果实长度是最直观呈现给消费者的品质性状之一,其生长发育是一个庞大复杂的机制,受多方面因素调控[1]。研究表明,植物激素介导的果实生长发育调控是其中的主要因素。Aux/IAA基因家族在植物果实生长发育过程中发挥了重要调控作用[1-2]。王垒等[2]选择了具有显著Aux/IAA蛋白结构的6个基因(Csa020459、Csa006680、Csa003118、Csa016715、Csa018571和Csa012115),通过试验证明了这些基因均可影响黄瓜果实的早期生长发育,导致黄瓜果实发育发生变化[3-4]。另外,Liu等[5]验证了Aux/IAA家族基因对葫芦科作物果实成熟有调控作用。此外,在其他作物中也发现了Aux/IAA家族基因对不同部位生长发育起着重要的调控作用[6]。如拟南芥AtIAA3、 AtIAA14、 AtIAA19和 AtIAA28等基因影响侧根发育[7-9],玉米中ZmIAA2、 ZmIAA5、 ZmIAA7、 ZmIAA21、 ZmIAA22、 ZmIAA28 和 ZmIAA29 等基因影响根系和幼苗的发育[10-11],番茄SlIAA2、 SlIAA12、 SlIAA13、 SlIAA15和 SlIAA17等基因对根和茎的生长发育具有调控作用[12-13]。Atsushi等[14]发现拟南芥中生长素诱导基因IAA29受光敏色素相互作用因子PIF4和PIF5的调控,从而在不同的光周期条件下得到下胚轴显著变短的ATHB2突变体。董秀春等[15-16]验证AtIAA26 同源基因 PoptrIAA26.1 和 PoptrIAA26.2 在生长发育期的白杨顶端分生组织、 幼叶、 成熟叶、 雄花序以及花芽中都有显著表达。
黄瓜果实长度是重要农艺性状之一,直接和产量相关。目前,关于黄瓜果实生长发育调控机制研究取得了一些进展。Zhao等[17]从不同黄瓜家系中发现了一对MADS-box家族的等位基因,其中黄瓜CsFULI1A可以抑制细胞的分裂和扩张,使生长素运输神经递质PIN-FORMED1表达量受阻,直接导致黄瓜果实的生长素积累量下降,导致黄瓜果实变短,而CsFULIC过表达则对黄瓜果实长度没有影响。另外,黄瓜果实的生理机制也极大地受到基因水平调控的影响。黄瓜中sf1编码了一个葫芦科植物特有的环形E3连接酶,由于这种突变导致其增强自身的泛素化和降解,从而使得ACS2在果实中积累量上升[18]。ACS2的功能性紊乱导致乙烯产量减少,抑制果实细胞分裂导致黄瓜出现短果性状[18]。Weng等[19]发现12个关于果实生长发育的数量性状位点(QTLs),其中FS1.1和FS1.2参与黄瓜果实径向生长,FS3.2和FS3.3调控黄瓜果实延伸。Xu等[20]发现黄瓜果肉厚度基因Csa2M058670.1编码一个SET域蛋白赖氨酸甲基转移酶。其启动子区域出现4 bp的缺失导致黄瓜呈现薄果肉表型[20]。虽然目前对于调控黄瓜果实长度变化有了一定进展,但是人们还是不清楚黄瓜果实发育机制。在前期获得黄瓜EMS诱变短果突变体基础上,对其进行了转录组分析,获得了一个在短果突变体中上调表达的差异表达基因,CsIAA29(log2FC=2.09)。为了研究黄瓜果实发育机制,本研究对CsIAA29进行了克隆,并对其基因和启动子结构以及表达模式进行了分析,初步预测CsIAA29在黄瓜果实生长发育中的功能,为进一步了解黄瓜生长发育机制奠定坚持的基础。
1 材料和方法
1.1 试验材料
选择华南型黄瓜649为试验材料。2019年春季在邵阳农场常规种植。盛花期分别取长势良好的嫩叶、开花当天子房、果皮、生长点(距茎尖3个节间)以及开花前2 d雄花,取材之后立即放入到液氮中之后放置到-80 ℃的冰箱中进行保存备用。
1.2 CsIAA29的克隆、测序
本实验室在前期获得黄瓜EMS诱变短果突变体基础上,对其进行了转录组分析,获得了一个在短果突变体中上调表达的差异表达基因,CsIAA29(log2FC=2.09)。为了研究黄瓜果实发育机制,以CsIAA29基因(Csa2G381840)的cDNA序列为模板,利用Primer 5.0软件设计引物(上游引物:5′-ATGGAGCTACAACTTGGCCT-3′,下游引物:5′-TCATTCTTTGTTTCTGTTGCCA-3′)对该基因进行克隆。TRIzol法提取649黄瓜叶片总 RNA[21],利用康为世纪 HiFiScript box反转录成cDNA,反转录后cDNA为模板对CsIAA29进行PCR克隆。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s;56 ℃复性30 s;72 ℃延伸60 s;GOTO 36个循环;72 ℃ 10 min。经1.0%琼脂糖凝胶电泳鉴定,观察到明亮条带后利用回收凝胶试剂盒纯化回收,回收产物连接T载体,转化到大肠杆菌 DH5α 中,利用LB固体培养基(含100 mg/mL Amp)进行菌落筛选,挑取形状规则均匀单菌落摇菌,菌液浑浊后进行菌液PCR验证,验证目的基因后送擎科生物工程(长沙)股份有限公司进行测序。
1.3 CsIAA29基因生物信息学分析
利用不同分析软件对CsIAA29进行生物信息学分析,利用Expasy(http://web.expasy.org/protparam)进行CsIAA29基因蛋白结构分析,分别对氨基酸构成(Atomic composition)、不稳定系数(Instability index)、脂肪系数(Aliphatic index)、总平均亲水性GRAVY(Crand average of hydropathicity)、消光系统(Extinction coeffients)和预计半衰期检测(Estimated half-life)进行分析。利用PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred)进行蛋白质二级结构预测。利用pfam(http://pfam.xfam.org/)对蛋白质结构域进行预测。
1.4 CsIAA29系统进化树构建
利用美国国立生物技术信息中心数据库(http://www.ncbi.nlm.nih.gov/)中的Blast程序,检索不同植物中同源性高的IAA29蛋白序列。利用MEGA 7.0将CsIAA29与其他高同源性植物IAA29蛋白序列相连比对,根据比对结果构建系统进化树。
1.5 CsIAA29表达模式分析
利用TRIzol法[21]提取野生型649黄瓜叶片、子房、生长点、茎和雄花RNA。利用康为世纪 HiFiScript box反转录成cDNA,同一部位3次生物学重复。设计qRT-PCR引物(http://www.genscript.com)(上游引物:5′-GAAGCAAGCAGTAGGATGGC-3′,下游引物:5′-TGTGGTGAACATGGTGAGGA-3′)。以CsAction作为黄瓜基因的内参对照,使用SYBR-Green试剂盒添加样品,利用i Cycler i QTM5 Real-time PCR检测系统进行qRT-PCR。qRT-PCR的反应条件为:96 ℃,1 min;94 ℃,15 s,60 ℃,15 s,72 ℃,45 s;40个循环。每个样品3次重复。
1.6 CsIAA29启动子元件分析
通过黄瓜基因组数据库(http://cucurbitgenomics.org)中CsIAA29基因序列找到启动子区域。利用PLANTCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)分析CsIAA29启动子区域中各调控元件相关功能。
2 结果与分析
2.1 CsIAA29生物信息学分析
通过PCR扩增产物的测序,获得黄瓜649中的CsIAA29的cDNA编码区序列。编码区包括4个外显子和3个内含子,全长624 bp,共编码207个氨基酸(图1)。蛋白跨膜结构域显示CsIAA29无跨膜结构,推测可能由于CsIAA29是转录因子,所以无跨膜结构而在膜外进行作用。对CsIAA29的蛋白质结构分析显示,其蛋白质为C1062H1634N302O313S7。在网状细胞中的预计半衰期为30 h,酵母中的预计半衰期超过20 h,大肠杆菌中的预计半衰期大于10 h。CsIAA29蛋白不稳定系数为46.63(<40稳定,>40不稳定),结果证明,CsIAA29蛋白结构不稳定。脂肪系数为71.16,总平均亲水性为-0.831。通过蛋白质结构域预测发现CsIAA29有4个结构域,符合Aux/IAA家族的结构域特征,初步估计4个结构域的功能应该和Aux/IAA家族Ⅰ、Ⅱ、Ⅲ和Ⅳ是一致的。
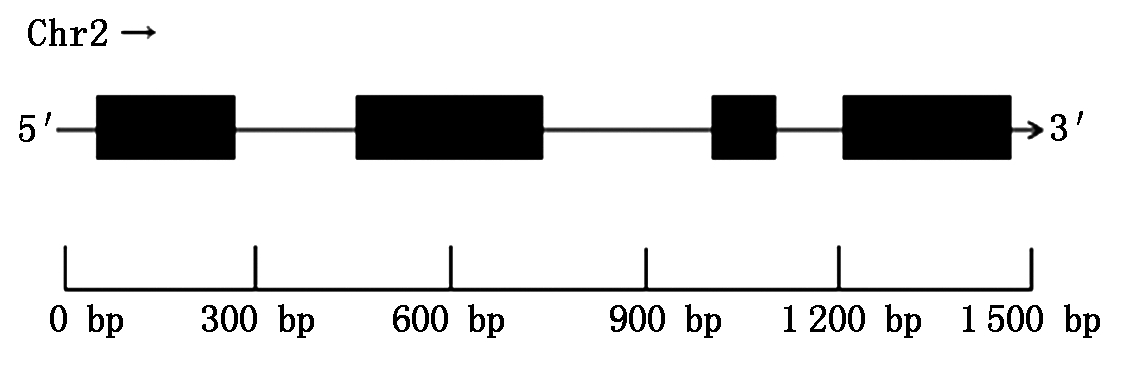
黑色方块.外显子;实线.内含子。
Black blocks.Exon;Solid lines.Intron.
图1 CsIAA29 基因结构图
Fig.1 Structure of CsIAA29 gene
2.2 CsIAA29系统进化分析
利用Blast检索美国国立生物技术信息中心数据库(https://www.ncbi.nlm.nih.gov/),得到CsIAA29在不同植物中的同源蛋白序列,在检索结果中选取18个不同物种的同源性相对较高的IAA29蛋白序列,分别是:马铃薯、枣、番木瓜、榴莲、蓖麻、猕猴桃、棉花、黄麻、可可、葡萄、杨、甜瓜、蓝果树、白桦、毛果杨、橡胶树、茶、南瓜。用MEGA 7.0软件制作系统进化树比对分析,结果显示,黄瓜CsIAA29与其他葫芦科作物如甜瓜和南瓜中的IAA29蛋白亲缘关系较近(图2)。
2.3 黄瓜CsIAA29不同组织的表达模式
qRT-PCR的结果显示,CsIAA29基因在黄瓜不同检测组织中均有表达,CsIAA29基因在黄瓜的子房中表达水平高于其他组织的表达量,在茎、生长点、雄花和叶片中表达量依次下降(P<0.01)(图3),表明CsIAA29基因表达具有组织特异性。
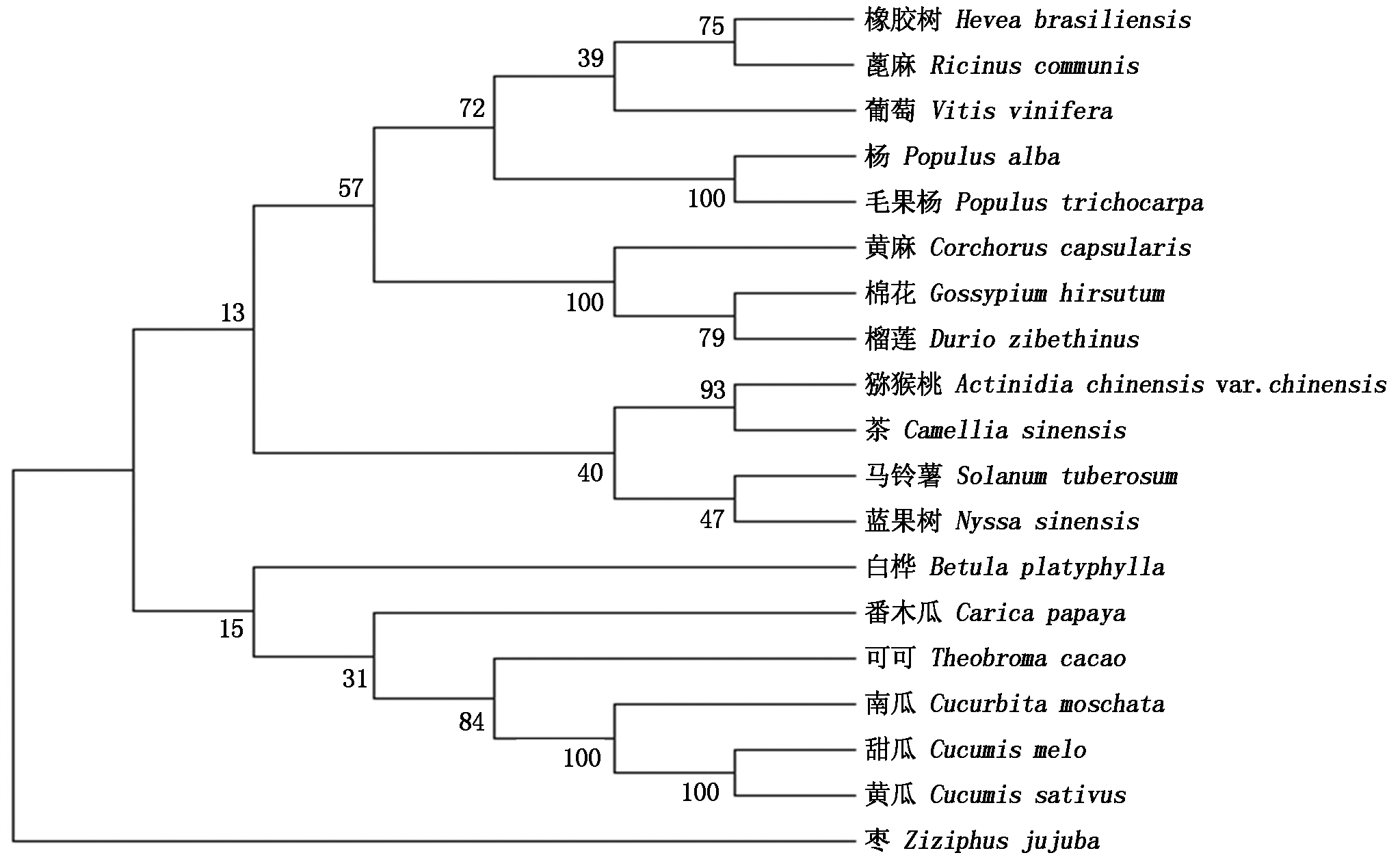
图2 CsIAA29 系统进化树
Fig.2 CsIAA29 phylogenetic tree
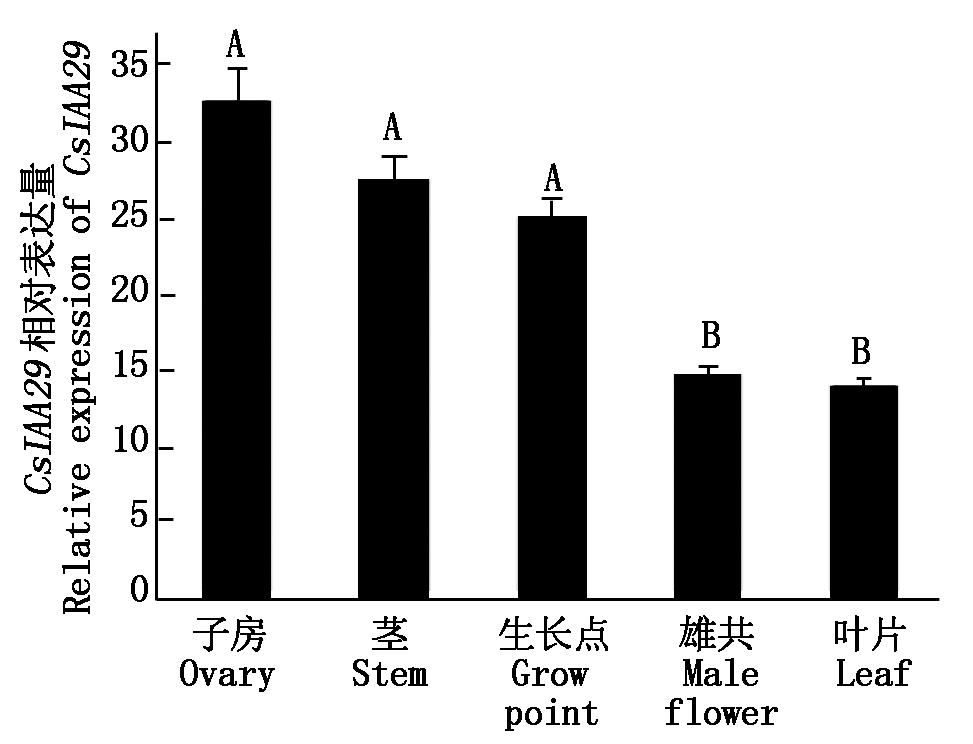
大写字母A、B表示CsIAA29 基因在不同组织中表达差异极显著(P < 0.01)。The letter A,B mean that the CsIAA29 gene is extremely significantl difference among different tissues (P<0.01).
图3 CsIAA29表达模式分析
Fig.3 Expression analysis of CsIAA29 in cucumber
2.4 CsIAA29启动子元件功能分析
在黄瓜基因组数据库中(http://cucurbitgenomics.org/)找到长度约2 000 bp的CsIAA29启动子序列,利用PLANTCAT(http://bioinformaticspsb/webtools/plantcare/)对启动子区域包含元件进行功能分析。结果显示,CsIAA29启动子序列中共检测到29个基因启动子元件(表1),其中ABRE参与脱落酸反应过程;G-BOX、G-box、L-box、TATA-box、GT1-motify、TCCC-motify等均是光响应元素的一部分,推测和生长素介导受体相结合后发挥作用,参与植物的光合作用和极性运输,并且介导生长素转导信号的发挥;ARE和MBS可以参与厌氧诱导;TC-rich repeat是顺式作用元素参与防御和压力反应;另外CsIAA29是Aux/IAA家族的转录基因,所以启动子中包括了GCN4-motif和TATC-box顺式调控元件分别影响增强子区域顺式表达和胚乳的表达;结合CsIAA29基因启动子元件分析结果,推测该基因可能与黄瓜果实生长发育机制有关。
3 结论与讨论
目前,对于植物果实的生长发育分子机制和激素水平研究热度持续上升,科学认为植物的生长发育与植物本身内源激素的变化有关联。不同的内源激素水平上发生变化都会使得植物在生长发育过程中出现果实表型的一系列变化,能够增强或减弱植物对于外界环境胁迫的抵御性。果实的发育机制是一个庞大而复杂的机理,其中已经被鉴定出来一些家族基因从分子水平方面对植物内源激素产生正负调节作用,如同本研究的Aux/IAA家族基因。Aux/IAA家族基因均是由4个保守结构域组成:结构域Ⅰ负责蛋白的阻遏,结构域Ⅱ负责蛋白的快速降解,结构域Ⅲ和Ⅳ则负责ARF和Aux/IAA 2个家族蛋白互作形成同源或异源二聚体,促进基因早期转录,调节下游基因的表达[22]。根据构建的转导模型可以看出转导过程中生长素浓度低使得Aux/IAA中的抑制子与ARF转录因子结合抑制ARF活性。浓度提高时生长素与受体结合后再与Aux/IAA结合能力增强,导致其被泛素化进而被26S蛋白酶体降解,与乙烯调节的生理机制有很大的相似之处,推测各基因家族之间在调节植物内源激素分泌水平上面有很大的关联[18,23]。不同的园艺作物中均已经鉴定出来多个Aux/IAA家族的转录因子。植物中的Aux/IAA家族基因虽然众多,但是仍然存在一些问题。目前Aux/IAA家族基因在模式植物拟南芥和番茄的基因功能鉴定方面数据相对完整,而黄瓜中此类家族基因的功能鉴定仍然需要完善。本试验通过前期的转录组试验发现了一个短果突变体中差异性表达的基因CsIAA29,其含有4个功能域的功能预测和其他家族基因结构域功能相同。拟南芥中的同源基因AtIAA29的基因功能是调控植物体内吲哚乙酸的合成量从而控制植物的生长[14],因此,推测CsIAA29基因可能在黄瓜果实内源生长素和生长素受体结合过程中发挥作用,从而起到介导生长素运输改变黄瓜果实长度的作用[14]。通过构建同源进化树表明,CsIAA29基因编码的蛋白与多数亲缘关系相对较近的植物进化规律一致。
表 1 黄瓜CsIAA29基因启动子调控元件功能分析
Tab.1 Functional analysis of regulatory elements of CsIAA29 gene promoter in cucumber

位点名称Site nameCsIAA29碱基序列Base sequence功能FunctionABRE+ACGTG参与脱落酸反应ARE-AAACCA参与厌氧诱导GATA-motif+GATAGGG光响应因素一部分BOX4+CCACGT参与光响应保守DNA模块一部分CAAT-box+CAAT/CAATCG启动子和增强子区域中的顺式作用元件GCN4-motif-GCCACT顺式调控元件参与胚乳的表达GT1-motif+GGTTAA光响应元素的一部分G-BOX+GATAGGA光响应元素的一部分G-box+GCCACGTGGA光响应元素的一部分L-box-ATCCCACCTAC光响应元素的一部分TCCC-mtify-TCTCCCT光响应元素的一部分TATA-box+/-ATATAA/TATA转录开始核心启动子TC-rich repeats+ATTCTCTAAC顺式作用元素参与防御和压力反应F-box+CTATTCTCATT参与盐胁迫反应Unnamend_1+/-CGTGG/GCCACGTG-GC60K蛋白结合位点LAMP-element-CTTTATCA光响应元素的一部分MBS+CAACTG参与厌氧诱导TATC-box-TATCCCA顺式调控元件参与胚乳的表达ERE+ATTTTAAAAT-TATA-box-TATATAMYB+/-CAACCA/TAACCAMyb-binding site+CAACAGMYC+CATTTGMyc+TCTCTTASTRE-AGGGGMyb-CAACTGTCA-TCATCTTCATUnnamend_4+CTCCACTCATCCT se-quence-ACTCATCCT
Aux/IAA家族基因虽然数量众多,但是不同的基因和转录因子之间的功能和时空表达模式仍然存在一定的差异。植物的生长发育从幼苗期开始内源激素在不同的器官部位和生长时期都有一定的调节作用[24]。本试验的qRT-PCR结果表明,CsIAA29基因是Aux/IAA家族基因的转录因子,在黄瓜各器官部位内的表达量虽然相差不大,但是仍然存在差异,子房中被检测到的表达量相对较高,其次是在茎和叶片等部位。推测黄瓜中同源基因CsIAA29调节子房等发育器官中的吲哚乙酸的含量从而促进或抑制果实的发育。
启动子序列分析表明,CsIAA29基因启动子具有转录因子所具备的常见调控元件,包括CAAT-box这类增强子区域中的顺式作用元件和TATA-box转录开始的核心元件等。在前人的研究中,Aux/IAA家族基因连同ARF家族基因在果实生长素运输过程中发挥重要的作用,果实内在发育机制很复杂,是由不同的基因影响各部位分子水平和激素水平共同发生变化导致外在果型出现变化,且在生长发育的过程中常常受到非生物性胁迫的诱导出现变化,气候环境等一系列外在因素都会引起内在激素水平的改变。定位到细胞核的一个木薯Aux/IAA家族基因MeIAA能够促进活性氧的累积和植物体内丙二醛的含量,使得植株耐涝性能增强[25]。而黄瓜中也发现单性结实的黄瓜其生长素含量是非单性结实黄瓜的二倍[26]。前人研究表明,Aux/IAA家族基因在调控果实形态发育以及糖类等营养物质积累等方面有很大作用,而Aux/IAA家族转录因子在不同植物的开花授粉、果实形态发育以及果型的塑造等方面作用明显[27]。当出现干旱、盐逆境等胁迫处理条件时,水稻的Aux/IAA家族基因表达量均有显著上调,番茄的表达量也呈上升趋势[28]。综上表明,CsIAA29基因可能通过参与生长素和生长素受体结合后的运输和一些逆境胁迫下的激素水平方面改变来影响黄瓜果实的生长发育,具体机理仍然需要进一步的研究。
[1] 李亚男,冯霞,陈大清. ARF、Aux/IAA和生长素受体对基因表达的调控[J].安徽农学通报,2008,14(7):36-39. doi:10.16377/j.cnki.issn1007-7731.2008.07.003.
Li Y N,Feng X,Chen D Q. Regulation of gene expression by ARF,Aux/IAA and auxin receptor[J].Anhui Agricultural Science Bulletin,2008,14(7) :36-39.
[2] 王垒,陈劲枫,娄丽娜,娄群峰,贾利. 黄瓜果实中ARF和Aux/IAA基因对外源激素的应答[J].西北植物学报,2011,31(6) :1127-1131.
Wang L,Chen J F,Lou L N,Lou Q F,Jia L. Response of ARF and Aux/IAA genes to exogenous hormones in cucumber fruits[J].Acta Botanica Boreali-occidentalis Sinica,2011,31(6):1127-1131.
[3] Wang L,Lou L N,Yan L Y,Lou Q F,Chen J F. A differential expression analysis of some Aux/IAA family genes in cucumber fruit during the early development[J].Journal of Nanjing Agricultural University,2011,34(4):156-198.
[4] 傅丰庆. 黄瓜果实发育调控的分子机理研究[D].杭州:浙江大学,2008.
Fu F Q. Molecular mechanism of regulation of cucumber fruit development[D].Hangzhou:Zhejiang University,2008.
[5] Liu K D,Yuan C C,Feng S X,Zong S T,Li H L,Zhong J D,Shen C J,Liu J X. Genome-wide analysis and characterization of Aux/IAA family genes related to fruit ripening in papaya (Carica papaya L.)[J].BMC Genomics,2017,18(1):892-1024. doi:10.1186/s12864-017-3722-6.
[6] 司马晓娇,郑炳松. 植物生长素原初响应基因Aux/IAA研究进展[J].浙江农林大学学报,2015,32 (2) :313-318. doi:10.11833/j.issn.2095-0756.2015.02.021.
Sima X J,Zheng B S. Research progress of auxin primary response gene Aux/IAA[J].Journal of Zhejiang University,2015,32 (2) :313-318.
[7] Guille T J,Hagen G. Auxin response factors[J].Current Opinion in Plant Biology,2007,10(5) :453-460. doi:10.1016/j.pbi.2007.08.014.
[8] Reed J W. Roles and activities of Aux/IAA proteins in Arabidopsis[J].Trends Plant Sci,2001,6(9):420-425. doi :10.1016/S1360-1385(01)02042-8.
[9] Sato A,Yama K T. Over-expression of the noncanonical Aux/IAA genes causes auxin-related aberrant phe-notypes in Arabidopsis[J].Physiol Plant,2008,133 (2) :397-405. doi :10.1111/j.1399-3054.2008.01055.x.
[10] Middleton A M,King J R,Bennett M J,Owen M R. Mathematical modeling of the Aux/IAA negative feedback loop[J].Bull Math Biol,2010,72 (6) :1383-1407. doi :10.1007/s11538-009-9497-4.
[11] Wang Y J,Deng D X,Bian Y L,Lü Y P,Xie Q. Genome-wide analysis of primary auxin-responsive Aux/IAA gene family in maize(Zea mays L.)[J].Molecur, 2010,37(8):3991-4001. doi:10.1007/s11033-010-0058-6.
[12] 李小靖. 番茄SlIAA9、SlIAA14基因启动子克隆及功能分析[D].海口:海南大学,2010.
Li X J. Cloning and functional analysis of promoters of SlIAA9 and SlIAA14 genes in tomato[D].Haikou :Hainan University,2010.
[13] Wu J,Peng Z,Liu S Y,He Y J,Cheng L,Kong F L,Wang J,Lu G. Genome-wide analysis of Aux/IAA gene family in Solanaceae species using tomato as a model[J]. Mol Genet Genomics,2012,287(4):295-311.doi:10.1007/s00438-012-0675-y.
[14] Atsushi K,Yamashino T,Nakamichi N,Niwa Y,Nakanishi H,Mizuno T. Phytochrome-interacting factor 4 and 5 (PIF4 and PIF5) activate the homeobox ATHB2 and auxin-inducible IAA29 gene in the coincidence mechanism underlying photoperiodic control of plant growth of Arabidopsis thaliana[J].Plant Cell, 2011,52 (8) :1315-1329.doi :10.1093/pcp/pcr076.
[15] 董秀春,樊金会,于学宁. Aux/IAA 基因家族的毛白杨PtIAA1的克隆和序列分析[J].分子植物育种,2007,5(4):565-571. doi:10.3969/j.issn.1672-416X.2007.04.020.
Dong X C,Fan J H,Yu X N. Cloning and sequencing of PtIAA1 from populus tomentosa,a member of the Aux/IAA gene family[J].Molecular Plant Bred,2007,5 (4):565-571.
[16] Kalluri U C,Difazio S P,Brunner A M,Tukan G A. Genome-wide analysis of Aux/IAA and ARF gene families in Populus trichocarpa[J].BMC Plant Biol,2007,7 (1) :59. doi :10.1186/1471-2229-7-59.
[17] Zhao J Y,Li J,Che C,Pan Y P,Li Y Q,Hou Y,Zhao W S,Zhong Y T,Ding L,Yan S S,Sun C Z,Liu R Y,Yan L Y,Wu T,Li X X,Weng Y X,Zhang X L. A functional allele of CsFUL1 regulates fruit length through repressing CsSUP and inhibiting auxin transport in cucumbert[J].Plant Cell,2019,31(6):1289-1307.doi:10.1105/tpc.18.00905.
[18] Xin T X,Zhang Z,Li S,Zhang S,Li Q,Zhang Z H,Huang S W,Yang X Y. Gentic regulation of ethylene dosage for cucumber fruit elongation[J].Plant Cell,2019,31(5):1063-1076.doi:10.1105/tpc.18.00957.
[19] Weng Y Q,Colle M,Wang Y H,Yang L M,Rubstion M,Sherman A,Ophir R,Grumet R. QTL mapping in multiple populations and development stages reveals dynamic quantitative trait loci for fruit size in cucumbers of different market classes[J].Theor Appl Genet,2015,128(9):1747-1763.doi:10.1007/s00122-015-2544-7.
[20] Xu X W,Lu L,Zhu B Y,Xu Q,Qi X H,Chen X H. QTL mapping of cucumber fruit flesh thickness by SLAF-seq[J].Sci Rep,2015,7 (58) :158-192. doi :10.1038/srep15829.
[21] 吴铠朝,黄诚梅,李杨瑞,吴建明.TRIzol试剂法快速高效提取3种作物不同组织总RNA[J].甘肃农业大学学报,2012,43(12):1934-1939.doi:10.3969/j:issn.2095-1191.2012.12.1934.
Wu K C,Huang C M,Li Y R,Wu J M. Rapid and efficient extraction of total RNA from different tissues of three crops by TRIzol reagent method[J].Journal of Gansu Agricultural University, 2012,43(12) :1934-1939.
[22] Tom J F. Aux/IAA proteins and auxin signal transduction[J].Trens Plant Sci,1998,3(6):205-207.doi:10.1016/S1360-1385(98)01244-8.
[23] Kazama H,Dan H,Imaseki H,Wasteneys G. Exposure to ethylene stimulates cell division and alters the fate and polarity of hypocotyl epidermal cells[J].Plant Physiol,2004,134(4):16141623.doi:10.1104/pp.103.031088.
[24] Wang S C,Hagen G,Guilfoyle T J. Aux/IAA proteins contain a potent transcriptional repression domain[J]. Plant Cell Online,2004,16(2):533-543.doi:10.4161/psb.24526.
[25] 樊书宏,施海涛,刘国银. 一个木薯Aux/IAA转录因子的克隆及调节活性氧功能分析[J].分子植物育种,2019,17(102):362-369.doi:10.13271/j.mpb.017.000362.
Fan S H,Shi H T,Liu G Y. Cloning and functional analysis of a cassava Aux/IAA transcription factor and its regulation of reactive oxygen species[J].Molecular Plant Breeding,2019,17(102):362-369.
[26] 王垒. 黄瓜单性吉实相关基因的分离、表达及SSR标记分析[D].南京:南京农业大学,2011.
Wang L. Isolation,expression and SSR marker analysis of unisexual gene related to cucumber[D].Nanjing:Nanjing Agricultural University,2011.
[27] 李俊男,燕晓杰,李枢航,张荣沭. 植物AUX/IAA基因家族研究进展[J].中国农学通报,2018,34(15):89-92.doi:10.1111/tpj.12882.
Li J N,Yan X J,Li S H,Zhang R S. Advances in research on AUX/IAA gene family in plants[J]. China Agricultural Science Bulletin,2018,34(15):89-92.
[28] Shinozaki Y,Hao S,Kojima M,Sakakibara H,Ozeki-lida Y,Zheng Y,Fei Z J,Zhong S L,Giovannoni J J,Rose J K C,Okabe Y,Heta Y,Ezura H,Ariizumi T. Ethylene suppresses tomato(Solanuml ycopersicum)fruit set through modification of gibberellin metabolism[J].Plant Cell, 2015,83(2) :237-251. doi :10.1111/tpj.12882.