桃(Prunus persica (L.) Batsch) 由于果实营养丰富,是最受人们喜爱的时令水果之一,广泛分布于世界各地。桃产业在我国农业产业体系中占有重要地位,其果品生产具有很强的区域性特点。冀东北地区地处桃栽培适宜区的北线,北方冬季严寒、生长季热量不足及早春的变温,是栽培桃树的限制因子,也是限制其地理分布的主要因素,桃树在这些地区由于秋冬季的寒潮周期性发生冻害,严重时甚至会导致植株死亡,给果树生产造成了严重的损失。目前,冀东北地区在生产中存在的主要问题是品种结构不合理,凸显为抗寒品种比例低、品种抗寒性差(如21世纪、中华寿桃等),品质欠佳(如外观品质普遍差、着色不良等)等问题,严重制约了该地区桃产业的健康发展。因此,影响冀东北地区桃树发展的主要问题是缺少高抗寒的优良品种。秋燕是河北省农林科学院昌黎果树研究所从2002年开始,选用在冀东北地区适应性强的主栽品种燕红桃作为亲本,采用自然实生选种的方法选育出的新品种,该品种树体和花芽抗寒性强,冬季无抽条现象[1]。
近年来,双向凝胶电泳(Two-dimensional gel electrophoresis,2-DE)技术被广泛应用于农业[2-4]、医学[5-6]和微生物学[7]等研究领域,利用2-DE 技术能够比较分析生物样品在不同条件下蛋白质组学的动态变化,尤其是抗逆性差异蛋白质的分析及鉴定。Marouf等[8]发现盐胁迫下小麦耐盐品种(Moghan 3)过氧化物还原蛋白BAS1和Cu/Zn-SOD蛋白对盐胁迫具有很好的防御作用。Koehler等[9]研究发现,草莓耐寒品种(Jonsok)在低温胁迫下类黄酮合成蛋白增加,且Cu/Zn-SOD蛋白活性高于不耐寒品种(Frida)。此外,陈奇等[10]通过对低温胁迫前后超强抗寒品种白菜型冬油菜陇油7号蛋白组学的研究发现,鉴定出11个与低温胁迫相关的蛋白质点,这些蛋白包括光合作用相关的蛋白、糖代谢相关的蛋白、物质运输相关的蛋白和逆境响应相关的蛋白。因此,本试验以秋燕桃一年生休眠枝条皮层为材料,利用2-DE技术对低温胁迫下蛋白质的表达进行全面分析,鉴定其响应低温的相关蛋白及代谢途径,挖掘与抗寒性关系密切的蛋白,以期阐明桃树枝条抗寒的分子机制,为研究桃抗寒的分子机制提供新线索,也为桃抗寒育种提供新的候选蛋白。
1 材料和方法
1.1 试验材料
供试材料为秋燕桃,由河北省农林科学院昌黎果树研究所选育,该品种抗寒性较强,适应性广,尤其在经历2009-2010年冬季低温后,树势健壮,生长结果正常[1]。
1.2 低温处理及样品采集
在冬季休眠期随机采集树冠外围生长一致且健壮的一年生枝条,粗度为0.3~0.6 cm置于冰上,迅速带回实验室,置于高低温湿热交变试验箱内进行低温胁迫处理。试验设温度-5 (CK),-15,-25 ℃计3个处理,以3 ℃/h升至目的温度后持续48 h,取出样品后,撕下皮层组织,将其剪成碎末,用液氮磨成碎末,置于-70 ℃冰箱中冷冻保存,用于后续的蛋白提取。每处理枝条50根,3次重复。
1.3 蛋白的提取和浓度的测定
参照滕云龙等[11]的改良Tris-HCl法提取总蛋白质。采用Bradford法[12]测定蛋白质浓度。
1.4 双向电泳
对不同低温胁迫处理的桃一年生休眠枝条皮层总蛋白质进行双向电泳,第1向等点聚焦(IEF)使用(24 cm,pH 4~7)的IPG胶条,参照李陈[13]的方法进行操作,质谱胶(考染)的上样量为1 200 μg,等电聚焦程序为:S1 stp 500 V 1:00 Hr;S2 grd 1 000 V 1:00 Hr;S3 grd 8 000 V 3:00 Hr;S4 stp 8 000 V 5:36 Hr,整个聚焦过程所用总电压:约60 kVh。
第2向垂直电泳采用浓度为12.5%丙烯酰胺凝胶进行SDS-PAGE电泳[13]。12.5%SDS-PAGE凝胶为:6张胶的量:丙烯酰胺溶液220 mL,pH值8.8 Tris-HCl 125 mL,10%SDS 5.3 mL,ddH2O 180 mL,20%过硫酸氨1 mL,TEMED 138 μL,总体积531.438 mL)。电泳结束经考马斯亮蓝染色、脱色后通过凝胶扫描使用扫描仪(MICROTEK ScanMaker i800)进行扫描,并采用ImageMaster 2D platinum 5.0(GE)分析软件进行图像分析。
1.5 质谱鉴定和数据分析
找出差异蛋白点,送往广州辉骏生物科技有限公司进行MAL-DI-TOF-TOF MS鉴定,所得蛋白质数据用Mascot软件在(Uniprot)数据库中进行检索。
1.6 RT-PCR
根据鉴定的差异蛋白点氨基酸序列,在桃转录组数据库中进行检索,获得编码差异蛋白的目的基因序列,设计引物克隆获得部分编码序列,基于克隆获得的编码序列设计RT-PCR 引物序列见表1,对差异表达蛋白编码的基因的表达趋势进行分析。
由于桃芽含多糖多酚,采用tiangen的RNAprep Pure多糖多酚植物总RNA提取试剂盒(DP441)提取总RNA。使用Bestar qPCR RT Kit试剂盒将得到的样品RNA进行反转录合成cDNA。按照转录组序列,
表1 RT-PCR 分析引物序列
Tab.1 Primer sequences RT-PCR analysis

ID引物序列(5'-3')Sequence(5'-3')扩增产物长度/bpProduct lengthP-actin.FGGCTCAGTCTAAGCGTGGTA90P-actin.RTGGCAGGAGTGTTGAATGTCM5VVU6FGGTGAAGCATGAAGGCTCAG123M5VVU6RTCTGGCAGCTCAACAAACACE3W0K1FTGCGAATCCCTCCTGCTTAT240E3W0K1RAACGGTCTCTCCAACGCATAM5XCZ6FAGGAGTTTGAGAAGTCCGGG170M5XCZ6RCTTAACTCCGGTGGTGGTCTD8L7V9FGAAATCGGAAGCGGACCAAA191D8L7V9RTCGTGGACAAGGTCGATGAAM5WUQ0FGTTCCCTGGTGACTATGGCT236M5WUQ0RAGCTAGGGTTGCCCAAGTAG
设计引物克隆获得部分编码序列。RT-PCR 扩增的反应体系为10 μL(DBI Bestar® SybrGreen qPCRmasterMix),Primer F(10 μmol/L) 0.5 μL,Primer R(10 μmol/L) 0.5 μL,反转录 cDNA 模板1 μL,ddH2O 8 μL。PCR反应条件:95 ℃ 2 min,94 ℃ 20 s,58 ℃ 20 s,72 ℃ 20 s,40循环。溶解曲线分析:94 ℃ 30 s,65 ℃ 30 s,94 ℃ 30 s每个样重复3次。
2 结果与分析
2.1 不同温度胁迫下蛋白质双向电泳分析
采用pH值4~7的非线性IPG干胶条和12.5% SDS-PAGE胶对不同温度胁迫下样品蛋白进行分离,经考马斯亮蓝染色后,获得了分辨率和重复性较好的双向电泳图谱。本研究采用双向电泳分析软件(ImageMaster 2D platinum 5.0)比较分析了不同温度胁迫下秋燕桃在-5,-15,-25 ℃低温处理48 h蛋白质组表达变化,上样量为1 200 μg。通过质谱鉴定发现,有150个蛋白质点的表达丰度在低温胁迫后发生明显变化,丰度显著上调的有97个,丰度显著下调的有53个。以-5 ℃(CK)为对照,对表达量变化在1.5倍以上的蛋白点进行检测,检测到在-15 ℃低温胁迫表达量上调的蛋白点有50个,-15~-25 ℃表达量上调的蛋白点也有50个,其中重复蛋白有3个,这3个蛋白点随着温度的降低,蛋白丰度逐渐加强,在温度较高的时候,这3个蛋白质的表达丰度较低或不表达,但是随着温度的降低这3个蛋白才表达、并发挥功能,使植物体内发生一系列变化,进而使植物耐受或抵御低温的能力加强。反之,以-5 ℃(CK)为对照,受-15 ℃低温诱导表达量下调的蛋白点有4个,-15~-25 ℃表达量下调的蛋白点有49个,二者之间无重复蛋白(图1)。低温导致一些正常蛋白的表达通路受阻,使部分蛋白质的表达受到抑制,表达量下降,以适应低温胁迫。蛋白表达量分析结果表明,不同的低温胁迫下,蛋白的表达量是不一样的,温度不同蛋白的种类也不一样。
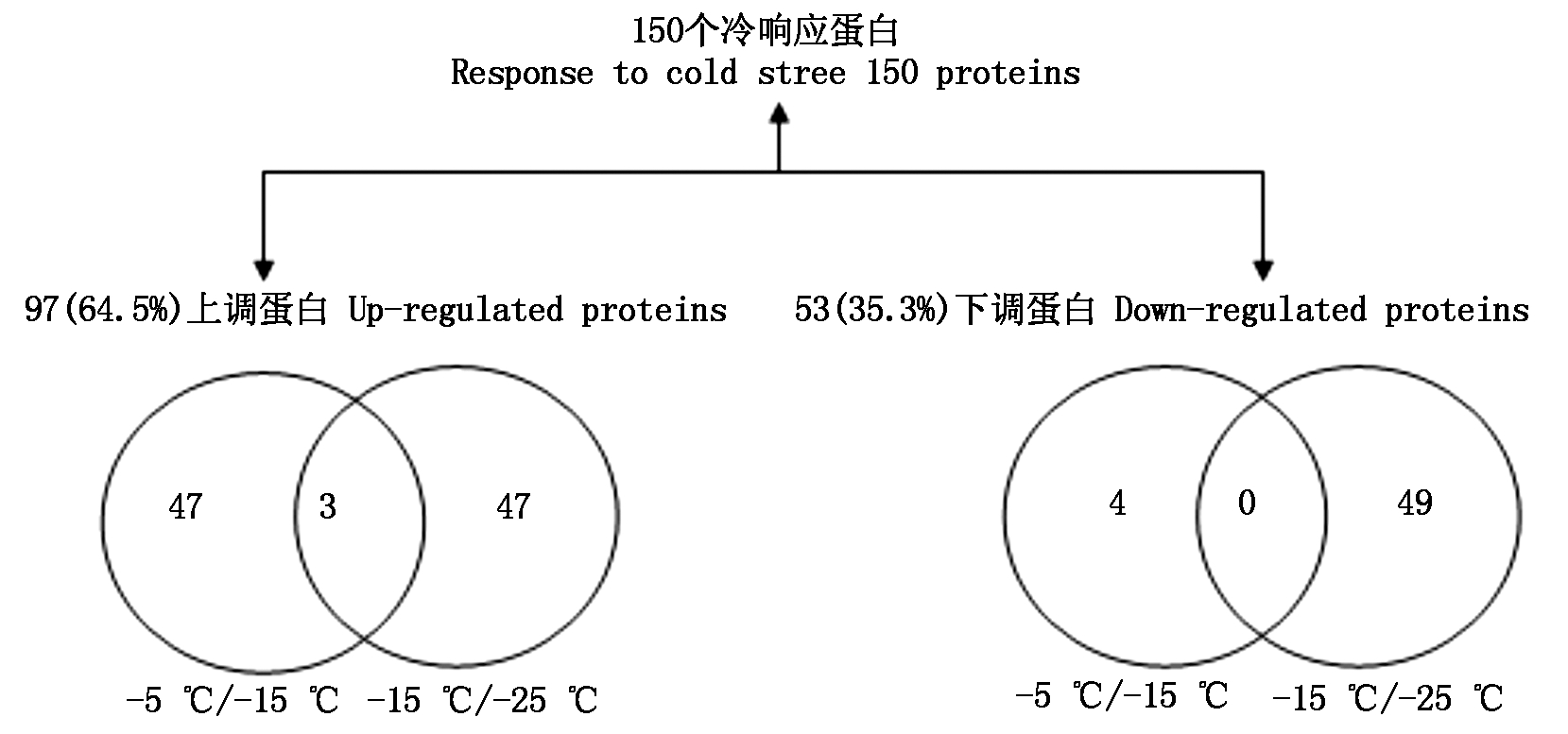
图1 不同温度下蛋白的表达分布示意图
Fig.1 Proteins expression under different temperature stress
2.2 差异蛋白质的质谱分析
采用MALDI-TOF-MS质谱对差异表达蛋白点进行功能预测分析,成功鉴定了20个蛋白点(表2),根据代谢功能可以分为7类,10.0%的蛋白属于氨基糖和核苷酸糖代谢(M5X1P7、M5WI79),15.0%的蛋白属于蔗糖和淀粉代谢(M5X0X3、M5VVU6、M5W2P3),5% 氨基酸代谢(M5WVV1),5% MAPK信号通路(M5VJ82),5%苯丙酸代谢(A0A251PFJ6),5% DNA复制(M5Y5L6),5%花生四烯酸代谢(D8L7V9)。
A0A251PFJ6、D8L7V9、M5WUQ0、M5VVY1、A0A251PHH3、M5WI79、M5WVV1、A0A251QND3、M5X0X3、M5VVU6和M5W2P3这11个蛋白表现出随着低温胁迫的加强表达量上调,其中,A0A251PFJ6、A0A251PHH3和M5WI79分别是酪氨酸酶Cu-bd结构域蛋白、PAP纤维蛋白结构域和几丁质酶结构域蛋白1;M5WVV1是甘氨酸裂解系统H蛋白,D8L7V9是环氧化物水解酶3,M5WUQ0是叶绿素a/b结合蛋白,M5VVU6是Alpha淀粉酶,M5VVY1、A0A251QND3、M5X0X3和M5W2P3是未知蛋白。M5X1P7、M5X0Z3、M5Y5L6和I3WEU4这4种蛋白在-5,-15 ℃没有检测到,但是在-25 ℃时有检测到。
表2 部分桃差异蛋白点MALDI-TOF-TOF/MS的鉴定结果
Tab.2 MALDI-TOF-TOF/MS identification of the differential protein spots of peach
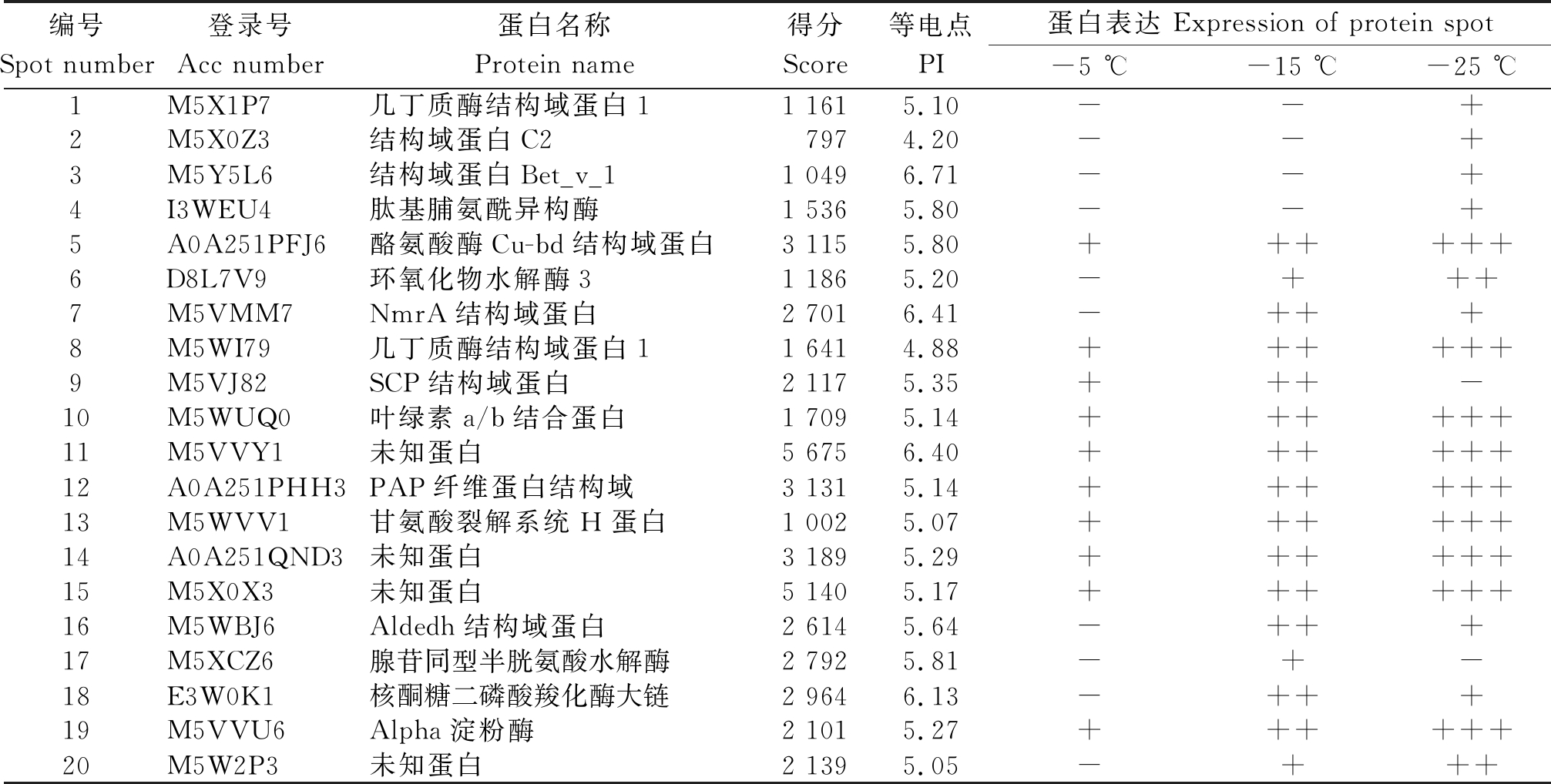
注:-代表蛋白没有丰度显示;+代表蛋白丰度,+的多少代表丰度的强弱。
Note:- represents protein abundance is not shown;+ represents protein abundance, and the number of + represents the strength of protein abundance.
编号Spot number登录号Acc number蛋白名称Protein name得分Score等电点PI蛋白表达 Expression of protein spot-5 ℃-15 ℃-25 ℃1M5X1P7几丁质酶结构域蛋白11 1615.10--+2M5X0Z3结构域蛋白C27974.20--+3M5Y5L6结构域蛋白Bet_v_11 0496.71--+4I3WEU4肽基脯氨酰异构酶1 5365.80--+5A0A251PFJ6酪氨酸酶Cu-bd结构域蛋白3 1155.80++++++6D8L7V9环氧化物水解酶31 1865.20-+++7M5VMM7NmrA结构域蛋白2 7016.41-+++8M5WI79几丁质酶结构域蛋白11 6414.88++++++9M5VJ82SCP结构域蛋白2 1175.35+++-10M5WUQ0叶绿素a/b结合蛋白1 7095.14++++++11M5VVY1未知蛋白5 6756.40++++++12A0A251PHH3PAP纤维蛋白结构域3 1315.14++++++13M5WVV1甘氨酸裂解系统H蛋白1 0025.07++++++14A0A251QND3未知蛋白3 1895.29++++++15M5X0X3未知蛋白5 1405.17++++++16M5WBJ6Aldedh结构域蛋白2 6145.64-+++17M5XCZ6腺苷同型半胱氨酸水解酶2 7925.81-+-18E3W0K1核酮糖二磷酸羧化酶大链2 9646.13-+++19M5VVU6Alpha淀粉酶2 1015.27++++++20M5W2P3未知蛋白2 1395.05-+++
2.3 差异蛋白相关基因的定量PCR分析
由于蛋白质的翻译经常伴随发生磷酸化、糖基化和可变剪切等翻译后的修饰,一个基因有可能会调控多个蛋白,致使基因的表达量和蛋白质的表达量不一致,出现蛋白质水平和基因水平的相关变化不一致的现象。通过RT-PCR分析发现所检测的蛋白质有5个蛋白质水平和基因水平表达变化一致(图2)。以-5 ℃(CK)为对照,D8L7V9、M5WUQ0和M5VVU6受-15,-25℃低温胁迫表达量逐渐上调;M5XCZ6和E3W0K1这2个基因在-15 ℃表达量上调,-25 ℃表达量下调,蛋白表达受到抑制。这一结果表明,D8L7V9(环氧化物水解酶)、M5WUQ0(叶绿素a/b结合蛋白)和M5VVU6(Alpha淀粉酶)可能是桃树抵抗低温的关键蛋白。

不同小写字母表示差异显著(P<0.05)。
Different lowercase letters indicate significant difference(P<0.05).
图2 相关基因的差异表达变化趋势
Fig.2 Expression patterns of the related genes
3 结论与讨论
低温胁迫下,植物体内的蛋白质发生了一系列变化,一部分蛋白丰度增加,一部分蛋白丰度下降,这种蛋白质的消长现象说明,植物遭受逆境胁迫后可能通过调节基因的转录、翻译来影响特异蛋白质的含量,进行自身调节,最终达到抵抗寒冷的目的。
3.1 涉及能量和碳水化合物代谢的蛋白
碳水化合物是植物细胞结构的主要成分和主要供能物质,在逆境胁迫下,碳水化合物代谢是植物能量的主要来源[14]。本研究中发现一些参与糖和淀粉代谢的蛋白质有显著变化。Alpha淀粉酶可以水解淀粉内部的α-1,4-糖苷键,水解产物为糊精、低聚糖和单糖,可溶性的单糖更容易被植物吸收利用。在本研究中,M5VVU6(Alpha淀粉酶)受低温诱导丰度显著增加。在许多物种上也有同样的发现,这个蛋白在低温胁迫下呈增加趋势。这些结果表明,低温倾向于诱导产生更多的可溶性单糖,这与我们的结果一致。这些可溶性糖可以作为渗透调节物质或基质,用于其他生物合成过程。Li等[15]研究认为,植物在非生物胁迫下可溶性糖含量的增加是一种典型的适应性反应,因此,那些与可溶性糖含量增加相关的上调蛋白可能有助于提高螺旋藻对低温的耐受性。以前的几项研究也表明,低温下可溶性糖浓度的增加与生物体内的低温耐受性呈正相关,因此,可溶性糖的含量可以作为评价桃耐低温能力的生化指标之一[16-18]。利用RT-PCR表达分析得出,M5VVU6(Alpha淀粉酶)相对表达量受低温胁迫上调,与蛋白质表达趋势基本一致,这一结果表明,该蛋白在桃树抵抗低温中起着关键的作用。
叶绿素a/b结合蛋白是自然界中含量最丰富的一种膜蛋白,是叶绿素和蛋白质的复合体,能使捕光和能量传导的速率提高。有证据表明,在逆境胁迫下,敲除或者调低一个叶绿素a/b结合蛋白家族成员能降低植物对逆境的抵抗能力[19]。在本研究中受低温诱导叶绿素a/b结合蛋白(M5WUQ0)丰度增强,这与在抗寒品种Longyou 7在低温胁迫下叶绿素a/b结合蛋白丰度显著上调结果一致,低温胁迫促进光能的吸收及传递,其活性的增强,有助于捕光面积的增大和捕光效率的提高,促进碳水化合物代谢,加强蔗糖利用效率等,从而增强植物本身对寒冷的抵抗能力[20]。RT-PCR表达分析也验证该蛋白对应基因的相对表达量受低温胁迫上调,与蛋白质表达趋势基本一致。这一结果表明,叶绿素a/b结合蛋白的上调表达可能是桃树适应低温逆境的一种保护策略。
由8个大亚基和8个小亚基组成核酮糖-1,5-二磷酸羧化酶(Rubisco)是光合作用C3反应中重要的羧化酶,也是光呼吸中不可缺少的加氧酶,也是光合作用中决定碳同化速率的关键酶。核酮糖二磷酸羧化酶大亚基(E3W0K1)在-15 ℃时丰度最强,在-25 ℃时减弱,利用RT-PCR表达分析验证该蛋白对应基因的相对表达量与蛋白质表达趋势基本一致,说明在-15 ℃低温情况下该酶被诱导表达,以增强植物的抗击低温的能力,但是随着温度降低到-25 ℃光合机构受损,进行光合作用的质子传递和光合磷酸化过程受到抑制,这与抗寒品种Longyou 7在低温胁迫下Rubisco蛋白丰度显著下调结果一致[21]。
3.2 涉及氨基酸合成代谢的蛋白
氨基酸和其他可溶性含氮化合物被认为是无机氮同化的主要产物,用于蛋白质和核酸的生物合成。前人研究表明,氨基酸可以作为信号分子和渗透压分子,调节植物在胁迫条件下的离子转运和促进解毒作用[22]。本试验检测到差异蛋白M5WVV1参与氨基酸的代谢,在低温胁迫时浓度增大,氨基酸合成的增加,一方面作为渗透调节细胞维持渗透平衡;另一方面又具有维持细胞成分损伤修复动态平衡的能力,减轻生物体的损伤程度,提高植物对低温的耐受性。Szabados等[23]和Claussen[24]研究发现,在低温胁迫下脯氨酸含量增加可能是它结合蛋白质的疏水性,增加蛋白质的亲水性,提高蛋白质稳定性,螺旋藻中脯氨酸含量的增加可能是一种保护机制对抗低温胁迫。
3.3 涉及苯丙酸合成代谢的蛋白
植物次生代谢过程是植物在生命过程中对生态环境适应的结果,它在处理植物与生态环境的关系中充当着重要的角色。许多植物在受到生物和非生物刺激后,产生并大量积累次生代谢产物,以增强自身的免疫力和抵抗力[25]。苯丙酸是多种酚类化合物的前体物质,在植物中具有多种功能,参与植物细胞的应激反应[26-28]。本试验中酪氨酸酶Cu-bd结构域蛋白(一种含铜的氧化还原酶蛋白,A0A251PFJ6),受低温胁迫丰度增强,该蛋白通过调节苯丙酸合成代谢调控黄酮类化合物合成,高水平黄酮类物质可能保护桃免受寒冷引起的氧化胁迫,有助于提高植物对低温的抵抗力。
3.4 涉及信号转导的蛋白
蛋白激酶(Mitogen-activated protein kinase,MAPK)是信号从细胞表面传导到细胞核内部的重要传递者,是信号转导途径中比较重要的一种信号分子。低温导致细胞膜的流动性发生改变,被质膜蛋白如Ca2+通道等感知,导致Ca2+流入细胞内,激活钙响应蛋白激酶和MAPK级联响应,从而调节COR基因表达[29]。在-15 ℃逆境胁迫下SCP结构域蛋白(M5VJ82)丰度增加,借助它们将信号不断传递并放大,从而启动基因的转录表达,最后通过基因产物的作用对外界信号在生理生化等方面做出适合的调节反应,从而保护植物不受伤害;-25 ℃被抑制表达,这也证明了信号转导途径不止一条,不同环境胁迫下,启用的途径是不一样的。
3.5 涉及DNA复制的蛋白
结构域蛋白在植物生长发育以及影响逆境胁迫等方面起着重要的作用。有研究证明,LEA3家族蛋白结构域具有保护生物大分子不受逆境胁迫损伤的类分子伴侣功能,因为在逆境条件下,亲水结构域易于形成a-螺旋的有序结构[30];含有Jmic结构域的蛋白家族是植物中广泛存在的一类去甲基化酶家族参与植物生长发育及抗病的调控[31]。本试验中在逆境胁迫下参与DNA复制蛋白结构域Bet_v_1(M5Y5L6)丰度的增加,有利于维持蛋白的稳定构象,保护细胞内相关蛋白的活性,防止目的蛋白的聚合,从而达到抵抗逆境的危害。
3.6 其他蛋白
环氧化物水解酶(Epoxide hydrolase,EHs)普遍存在于哺乳动物中,具有调节新陈代谢、解毒、调节信号分子三大功能,环氧化物水解酶在致癌物的形成中扮演一定角色,被作为肝癌的早期标志[32]。郑柳城等[33]在水稻上发现10种EHs的同源序列,经分析发现主要参与角质层的形成,应激反应,以及病原防御等生理过程。在本研究中,环氧化物水解酶(D8L7V9)受低温诱导丰度显著增加。利用RT-PCR表达分析也验证该蛋白对应基因的相对表达量受低温胁迫上调,与蛋白质表达趋势基本一致。这一结果表明,D8L7V9和M5VVU6、M5WUQ0一样可能是桃抵抗低温的关键蛋白之一。
通过不同低温胁迫下蛋白质组的比较分析及RT-PCR表达验证,明确了不同低温胁迫下的蛋白质组差异及表达变化,筛选鉴定了差异表达蛋白点。相关差异表达蛋白参与了植物能量和碳水化合物代谢、氨基酸合成代谢、苯丙酸合成代谢、信号转导和DNA复制等,随着低温胁迫的增加Alpha淀粉酶、叶绿素a/b结合蛋白,环氧化物水解酶和几种结构域蛋白丰度的增加,也暗示了可能这些代谢途径和特异蛋白在桃的抗寒机制中起重要作用,但其作用机制尚不清楚,有待进一步研究。
[1] 常瑞丰,王召元,张立莎,李永红,陈湖,韩继成,刘国俭.晚熟桃新品种秋燕[J].园艺学报,2016,43(11):2281-2282.doi:10.16420/j.issn.0513-353x.2016-0330.
Chang R F,Wang Z Y,Zhang L S,Li Y H,Chen H,Han J C,Liu G J. A new late-ripening peach cultivar Qiuyan′[J].Acta Horticulturae Sinica,2016,43(11):2281-2282.
[2] Mamonea G,Stasioa L D,Caro S D,Picariello G,Nicolai M A,Ferranti P. Comprehensive analysis of the peanut allergome combining 2-DE gel-based and gel-free proteomics[J].Food Research International,2019,116:1059-1065.doi:10.1016/j.foodres.2018.09.045.
[3] Li L J,Lu X C,Ma H Y,Lyu D G. Comparative proteomic analysis reveals the roots response to low root-zone temperature in Malus baccata[J].Journal of Plant Research,2018,131:865-878. doi:10.1007/s10265-018-1045-6.
[4] Zhou Y,Wu X X,Zhang Z,Gao Z H. Comparative proteomic analysis of floral color variegation in peach[J]. Biochemical and Biophsical Research Communications,2015,464(4):1101-1106. doi:10.1016/j.bbrc.2015.07.084.
[5] Zeng G Q,Zhang P F,Li C,Peng F,Li M Y,Xu Y,Yu F L,Chen M J,Yi H,Li G Q,Chen Z C,Xiao Z Q. Comparative proteome analysis of human lung squamous carcinoma using two different methods:two-dimensional gel electrophoresis and iTRAQ analysis[J].Technology in Cancer Research and Treatment,2012,11(4):395-408. doi:10.7785/tcrt.2012.500287.
[6] Strohkamp S,Gemoll T,Habermann J K. Possibilities and limitations of 2DE-based analyses for identifying low-abundant tumor markers in human serum and plasma[J]. Proteomics,2016,16(19):2519-2532. doi:10.1002/pmic.201600154.
[7] Swatton J E,Prabakaran S,Karp N A,Lilley K S,Bahn S. Protein profiling of human postmortem brain using 2-dimensional fluorescence difference gel electrophoresis(2-D DIGE)[J]. Molecular Psychiatry,2004,9(2):128-143. doi:10.1038/sj.mp.4001475.
[8] Marouf K,Mohammad R N,Yousefzadeh S.Protein pattern analysis in tolerant and susceptible wheat cultivars undersalinity stress conditions[J]. Acta Agriculturae Slovenica,2018,111(3):545-558. doi:10.14720/aas.2018.111.3.03.
[9] Koehler G,Wilson R C,Goodpaster J V,Sonsteby A,Lai X Y,Witzmann F A,You J S,Rohloff J,Randall S K,Alsheikh M. Proteomic study of low-temperature responses in strawberry cultivars (Fragaria ananassa) that differ in cold tolerance[J]. Plant Physiology,2012,159:1787-1805. doi:10.1104/pp.112.198267.
[10] 陈奇,袁金海,刘自刚,孙万仓,方彦,赵新旺,马 骊,蒲媛媛,赵艳宁,曾秀存.白菜型冬油菜‘陇油7号’叶片响应低温胁迫的差异蛋白鉴定与分析[J].中国生态农业学报,2017,25(3):381-390. doi:10.13930/j.cnki.cjea.160581.
Chen Q,Yuan J H,Liu Z G,Sun W C,Fang Y,Zhao X W,Ma L,Pu Y Y,Zhao Y N,Zeng X C. Differentially expressed proteins in response to low temperature in Brassica campestris Longyou No. 7 seedlings[J]. Chinese Journal of Eco-Agriculture,2017,25(3):381-390.
[11] 滕云龙,李春敏,赵永波,曾广娟,陈东玫,董文轩,张新忠.苹果实生树韧皮部中阶段转变特异蛋白质的SDS-PAGE分析[J].华北农学报,2009,24(1):112-114.doi:10.7668/hbnxb.2009.01.025.
Teng Y L,Li C M,Zhao Y B,Zeng G J,Chen D M,Dong W X,Zhang X Z. SDS-PAGE analysis of phase change-related proteins in phloem in apple( Malus domestica Borhk.)[J]. Acta Agriculturae Boreali-Sinica,2009,24(1):112-114.
[12] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1-2):248-254. doi:10.1016/0003-2697(76)90527-3.
[13] 李陈.人脐血间充质干细胞源性的类许旺细胞与人胎儿坐骨神经许旺细胞差异蛋白组学的研究[D].蚌埠:蚌埠医学院,2014.
Li C.Analysis of different proteomics between human umbilical cord blood mesenchymal stem cells derived schwann-like cells and fetal sciatic nerve′s schwann cells[D]. Bengbu:Bengbu Medical College,2014.
[14] Shi X F,Wang X B,Cheng F,Cao H S,Liang H,Lu J Y,Kong Q S,Bie Z L. iTRAQ-based quantitative proteomics analysis of cold stress-induced mechanisms in grafted watermelon seedlings[J].Journal of Proteomics,2019,192:311-320. doi:10.1016/j.jprot.2018.09.012.
[15] Li Q Y,Chang R,Sun Y J,Li B S. iTRAQ-based quantitative proteomic analysis of Spirulina platensis in response to low temperature stress[J].PLoS One,2016,13(4):e0196442.doi:10.1371/joumal.pone.0196442.
[16] Zhao N,Hou M,Wang T,Chen Y F,Lü Y,Li Z R,Zhang R,Xin W T,Zou X Y,Hou L. Cloning and expression patterns of the brine shrimp(Artemia sinica) glycogen phosphorylase (GPase) gene during development and in response to temperature stress[J].Molecular Biology Reports,2014,41:9-18. doi:10.1007/s11033-013-2764-3.
[17] Nam M H,Huh S M,Kim K M,Park W W,Seo J B,Cho K,Kim D Y,Kim B G,Yoon I I. Comparative proteomic analysis of early salt stress-responsive proteins in roots of SnRK2 transgenic rice[J]. Proteome Science,2012,10:25. doi:10.1186/1477-5956-10-25.
[18] Xu J,Li Y,Sun J,Du L,Zhang Y,Yu Q,Liu X. Comparative physiological and proteomic response to abrupt low temperature stress between two winter wheat cultivars differing in low temperature tolerance[J]. Plant Biol,2013,15(2):292-303. doi:10.1111/j.1438-8677.2012.00639.x.
[19] 徐艳红.拟南芥捕光叶绿素a/b结合蛋白参与脱落酸信号转导[D].北京:中国农业大学,2011.
Xu Y H. Light-harvesting ChlorophII a/b binding proteins are involved in ABA signaling in Arabidopsis[D].Beijing:China Agricultural University,2011.
[20] Xu Y Z,Zeng X C,Wu J,Zhang F Q,Li C X,Jiang J J,Wang Y P,Sun W C. iTRAQ-based quantitative proteome revealed metabolic changes in winter turnip rape (Brassica rapa L.) under cold stress[J]. Int J Mol Sci,2018,19(11):3346. doi:10.3390/ijms19113346.
[21] Zeng X C,Xu Y Z,Jiang J J,Zhang F Q,Ma L,Wu D W,Wang Y P,Sun W C. Identification of cold stress responsive microRNAs in two winter turnip rape (Brassica rapa L.) by high throughput sequencing[J]. BMC Plant Biol,2018,18:52-64. doi:10.1186/s12870-018-1242-4.
[22] Mansour M M F. Nitrogen containing compounds and adaptation of plants to salinity stress[J]. Biol Plant,2000,43:491-500. doi:10.1023/a:1002873531707.
[23] Szabados L,Savoure A. Proline:a multifunctional amino acid[J]. Trends Plant Sci,2010,15(2):89-97. doi:10.1016/j.tplants.2009.11.009.
[24] Claussen W. Proline as a measure of stress in tomato plants[J]. Plant Science,2005,168:241-248. doi:10.1016/j.plantsci.2004.07.039.
[25] Deng Y X,Lu S F. Biosynthesis and regulation of phenylpropanoids in plants[J]. Critical Reviews in Plant Sciences,2017,36(4):257-290.doi:10.1080/07352689.2017.1402852.
[26] Bonawitz N D,Chapple C. The genetics of lignin biosynthesis:connecting genotype to phenotype[J]. Annual Review of Genetics,2010,44:337-363. doi:10.1146/annurev-genet-102209-163508.
[27] Vanholme R,Storme V,Vanholme B,Sundin L,Cristensen J H,Goeminne G,Halpin C,Rohde A,Morreel K,Boerjan W. A systems biology view of responses to lignin biosynthesis perturbations in Arabidopsis[J]. Plant Cell,2012,24:3506-3529.doi:10.2307/41692822.
[28] Vanholme R,Cesarino I,Rataj K,Xiao Y G,Sundin L,Goeminne G,Kim H,Cross J,Morreel K,Araujo P,Welsh L,Haustraete J,McClellan C,Vanholme B,Ralph J,Simpson G G,Halpin C,Boerjan W. Caffeoyl shikimate esterase (CSE) is an enzyme in the lignin biosynthetic pathway in Arabidopsis[J]. Science,2013,341(6150):1103-1106. doi:10.1126/science.1241602.
[29] Zhu J K. Abiotic stress signaling and responses in plants[J]. Cell,2016,167(5):313-324. doi:10.1016/j.cell.2016.08.029.
[30] 张亨. 逆境胁迫下LEA3蛋白亲水结构域的类分子伴侣功能研究[D].绵阳:西南科技大学,2015.
Zhang H. Investigationg of chaperone-like function of the LEA3 hydrophilic domain under stress conditions[D].Mianyang:Southwest University of Science and Technology,2015.
[31] 刘士霞. 逆境胁迫相关蛋白和含有Jmic结构域的组蛋白去甲基化酶在番茄抗病中的功能研究[D].杭州:浙江大学,2018.
Liu S X. Functional analysis of stress-associated proteins and Jmic domain-containing histone demethylases in disease resistance against Botrytis cinerea and pst DC3000 in tomato[D]. Hangzhou:Zhejiang Uiniversity,2018.
[32] Panigrahy D,Kalish B T,Huang S,Bielenberg D R,Le H D,Yang J,Edin M L, Lee C R,Benny O, Mudge D K,Butterfield C E,Mammoto A,Mammoto T,Inceoglu B,Jenkins R L, Simpson M A, Akino T, Lih F B, Tomer K B, Ingber D E,Hammock B D, Falck J R,Manthati V L, Kaipainen A, D′Amore P A, Puder M, Zeldin D C, Kieran M W.Epoxyeicosanoids promote organ and tissue regeneration[J]. Proc Natl Acad Sci USA,2013,110(33):13528-13533.doi:10.1073/pnas.1311565110.
[33] 郑柳城,朱宏波.水稻水溶性环氧化合物水解酶的生物信息学分析[J].生物信息学,2009,7(2):108-112.doi:10.3969/j.issn.1672-5565.2009.02.007.
Zheng L C,Zhu H P. Bioinformatics analysis on epoxide hydrolase of rice (Oryza saliva)[J]. China Journal of Bioinformaties,2009,7(2):108-112.