牡丹(Paeonia suffruticosa)与芍药(Paeonia lactiflora)同属于芍药科芍药属,被誉为“花王”和“花相”,是我国的传统名花。1948年国际上首次成功获得了牡丹与芍药组间杂种并命名为Itoh。Itoh杂种具有观赏价值高、抗病性强等优势,因此国内外展开了芍药属组间远缘杂交育种工作[1-2]。我国于2006年获得了首例牡丹、芍药组间杂种,但是芍药属的组间杂交具有严重的不亲和性,主要表现为花粉与柱头不能正常识别,花粉萌发受阻,花粉管生长缓慢等[3]。有研究表明,授粉后花粉的萌发、生长等过程与其内源激素密切相关[4-5]。张鹏等[6]在杨树的自交亲和性研究中发现,自交雌蕊的吲哚乙酸(IAA)、赤霉素(GA3)及玉米素核苷(ZR)含量等均高于杂交,且自交中花粉管生长明显快于杂交。芍药属组间杂交中也发现了高含量的ZR、IAA和GA3有利于花粉-柱头识别及花粉的萌发等[7-9]。因此,加深对激素调控机制的研究可能是解决远缘杂交不亲和的途径之一。
ATP结合盒(ATP-binding cassette, ABC)转运蛋白是一类普遍存在于原核和真核生物细胞中的超家族膜整合蛋白,通常含有2个ABC结构域,能借助水解ATP释放的能量转运物质,含有2个跨膜结构域,可介导底物的跨膜运输[8]。ABC家族分为ABCA、ABCB、ABCC等 8个亚族,其中最大的2个亚族为ABCB与ABCG[9-10]。ABC家族蛋白不仅参与植物体内金属离子、脂质的运输,还参与植物体内激素、次生代谢物与外源物质的运输,调节植物的生长发育[8,11-12]。ABCB作为ABC转运蛋白的家族成员,可以调控细胞内的IAA水平,参与IAA的极性运输[13-14]。而ABCG中的部分家族成员被发现可将ABA运出细胞外,且可能调控影响ABA的信号传导及生物合成[15-18]。ABCF亚族的相关研究报道较少,在苹果、铁皮石斛等物种中已克隆到该同源基因[19-20]。研究表明,苹果花粉MdABCF转运蛋白在细胞膜表达,其跨膜Tran区与苹果花柱S-RNase结合,通过转运S-RNase,在微丝、微管骨架的辅助作用下进入花粉管胞质,调控微丝微管骨架解聚,导致花粉管生长停滞,出现自交不亲和[19]。由此猜测ABCF基因可能参与远缘杂交不亲和过程。
前期研究发现,芍药自交亲和,芍药、牡丹远缘杂交不亲和,且不亲和的关键时期为杂交后24,36 h[21-22]。本试验以芍药粉玉奴自交、芍药粉玉奴×牡丹凤丹白杂交24,36 h的柱头为材料,拟从芍药柱头中克隆出下调显著的差异基因PlABCF3,对其进行生物信息学分析,并检测其在芍药属自交与杂交后不同时期的相对表达情况,联系内源激素GA3、ZR、IAA及ABA含量的变化趋势,以期为进一步解决芍药属远缘杂交不亲和提供理论依据。
1 材料和方法
1.1 试验材料
供试材料均来自河南省优质花卉蔬菜种苗工程研究中心,母本选取芍药品种粉玉奴、父本选取牡丹品种凤丹白。在母本花蕾松蕾期进行去雄、套袋,去雄2 d后连续3 d进行3次授粉。随后取粉玉奴自交、粉玉奴×凤丹白杂交授粉后的自交与杂交24,36 h柱头。将柱头经由液氮速冻后放置于-80 ℃冰箱保存,随后进行RNA提取及转录组试验。
1.2 试验方法
1.2.1 柱头总RNA提取和cDNA合成 使用试剂盒(天根生化科技有限公司,北京)进行柱头总RNA提取,使用PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒(TaKaRa,日本)将RNA反转录成cDNA第一链,产物放于-20 ℃贮存。
1.2.2 PlABCF3基因的分离克隆 根据转录组测序结果所获得的PlABCF3注释序列,设计特异引物PlABCF3-F和PlABCF3-R(表1)。以cDNA第一链为模板,进行全长PCR扩增。使用20 μL反应体系:2×fast pfu master mix 10 μL,Primer F 1 μL,Primer R 1 μL,cDNA 1 μL,加ddH2O至20 μL。PCR反应程序:94 ℃预变性3 min;94 ℃变性30 s,58 ℃退火45 s,72 ℃延伸90 s,33个循环;72 ℃延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测,回收预期大小片段的条带,连接T载体,转化大肠杆菌感受态细胞,蓝白斑筛选后挑选阳性菌落进行测序。测序后拼接序列获得PlABCF3基因cDNA全长序列。
表1 芍药PlABCF3基因克隆及荧光定量 PCR 所用引物
Tab.1 The primers used for gene clonina and fluorescent quantitation PCR of PlABCF3 of Paeonia lactiflora
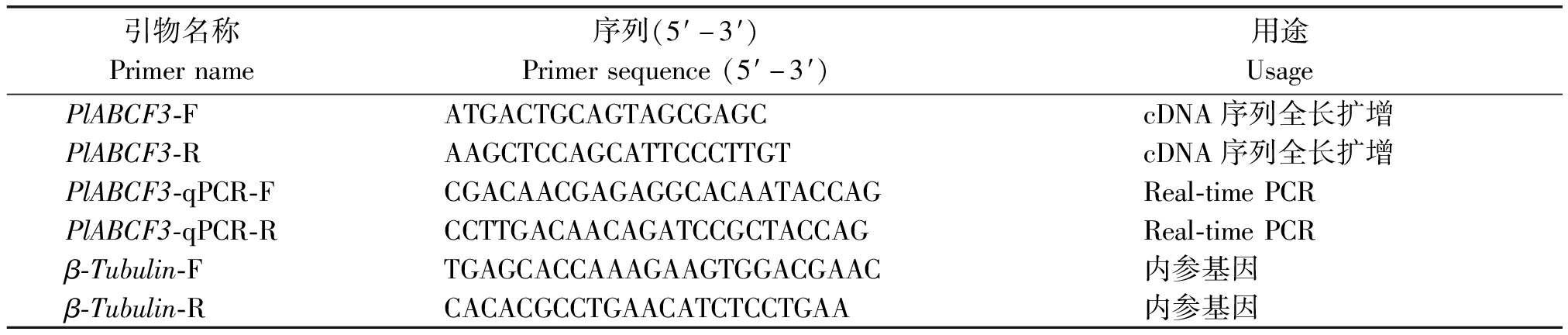
引物名称Primername序列(5′-3′)Primersequence(5′-3′)用途UsagePlABCF3-FATGACTGCAGTAGCGAGCcDNA序列全长扩增PlABCF3-RAAGCTCCAGCATTCCCTTGTcDNA序列全长扩增PlABCF3-qPCR-FCGACAACGAGAGGCACAATACCAGReal-timePCRPlABCF3-qPCR-RCCTTGACAACAGATCCGCTACCAGReal-timePCRβ-Tubulin-FTGAGCACCAAAGAAGTGGACGAAC内参基因β-Tubulin-RCACACGCCTGAACATCTCCTGAA内参基因
1.2.3 PlABCF3基因生物信息学分析 PlABCF3基因开放阅读框的查找利用在线网页ORF Finder(https://indra.mullins.microbiol.washington.edu/sms2/orf_find.html),然后利用ProtParam(http://web.expasy.org/protparam/)、TMpred(http://www.ch.embnet.org/software/TMPRED _form.html)、SignalP 5.0 Server(http://www.cbs.dtu.dk/services/SignalP/)在线网页分析PlABCF3蛋白序列的理化性质、跨膜结构和信号肽信息。利用GOR4软件预测PlABCF3蛋白二级结构,并使用Swiss-model(https://swissmodel.expasy.org/interactive)进行三级结构预测。使用DNAMAN 8.0软件对PlABCF3基因编码蛋白的氨基酸序列进行推测并分析其与其他物种氨基酸序列的关系。用NCBI数据库中的Blastp搜索同源序列,并用DNAMAN 8.0软件比对氨基酸序列的同源性;使用MEGA 7.0构建系统发育树,Bootstrap值设置为1 000。
1.2.4 PlABCF3基因的表达分析 根据克隆得到的PlABCF3基因序列设计实施定量引物PlABCF3-qPCR-F和PlABCF3-qPCR-R,选取β-Tubulin为内参基因(表1)。分别以粉玉奴自交、粉玉奴×凤丹白杂交24,36 h的柱头cDNA 为模板,使用SYBR Premix ExTaq TM试剂盒(宝日医生物技术有限公司)在ABI 7900 Real-Time PCR System仪(美国应用生物系统中国公司)上进行实时荧光定量PCR。实时定量反应体系及反应程序参照He等[21]方法进行,每个反应包括3个生物学重复。按照 2-ΔΔCT法计算出基因的相对表达量[23]。
1.2.5 内源激素含量的测定 采用酶联免疫吸附法(ELISA)测定植物内源激素含量,参照试剂盒附带操作说明书并重复3次,分别测定自交24 h与杂交24 h芍药雌蕊内的GA3、ZR、IAA及ABA含量。并将内源激素的测定结果与PlABCF3基因表达分析的测定结果使用SPSS计算其R值,找出其中存在的变化关系。
2 结果与分析
2.1 PlABCF3基因全长cDNA克隆与序列特征分析
通过对粉玉奴(P. lactiflora Fenyunu)自交、粉玉奴(P. lactiflora Fenyunu)×凤丹白(P. ostii Fengdanbai)杂交24,36 h柱头的转录组数据进行分析(转录组数据已上传至NCBI,登录号:PRJNA592882),对差异基因进行GO、KEGG富集,发现在ABC转运蛋白中富集明显,表明ABC转运蛋白参与了芍药属杂交不亲和作用。根据对基因注释的研究,挑选影响芍药属远缘杂交的关键差异基因PlABCF3,在序列注释的基础上,用该基因序列设计特异引物,以粉玉奴自交、粉玉奴×凤丹白杂交授粉后24,36 h柱头混合cDNA为模板PCR扩增基因全长,获得1条2 151 bp的条带(图1)。转化测序后进行序列拼接,分析其为完整的开放阅读框,编码716个氨基酸,是一条完整的基因序列。
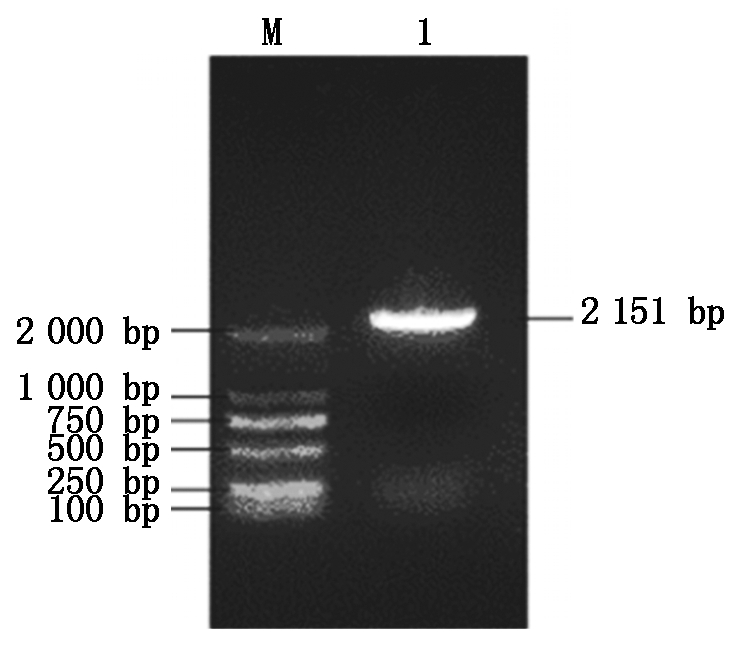
M.DL2000 Marker; 1.PlABCF3基因的PCR产物。
M.DL2000 Marker; 1.PCR product of PlABCF3.
图1 芍药PlABCF3基因克隆
Fig.1 Cloning of PlABCF3 in P. lactiflora
使用DNAMAN 8.0软件对基因编码蛋白的氨基酸序列进行推测,并基于氨基酸序列分析蛋白保守结构域,为ABC转运蛋白的F家族系列。在NCBI上将PlABCF3基因的氨基酸序列进行Blastp比对,利用MEGA 7.0将PlABCF3序列与拟南芥的ABCFs序列进行对比,结果显示,PlABCF3与AtABCF3聚类在同一分支(图2),表明其与AtABCF3亲缘性最近,该片段确为芍药的ABCF3基因,并将其命名为PlABCF3,GenBank登录号为MT123594。
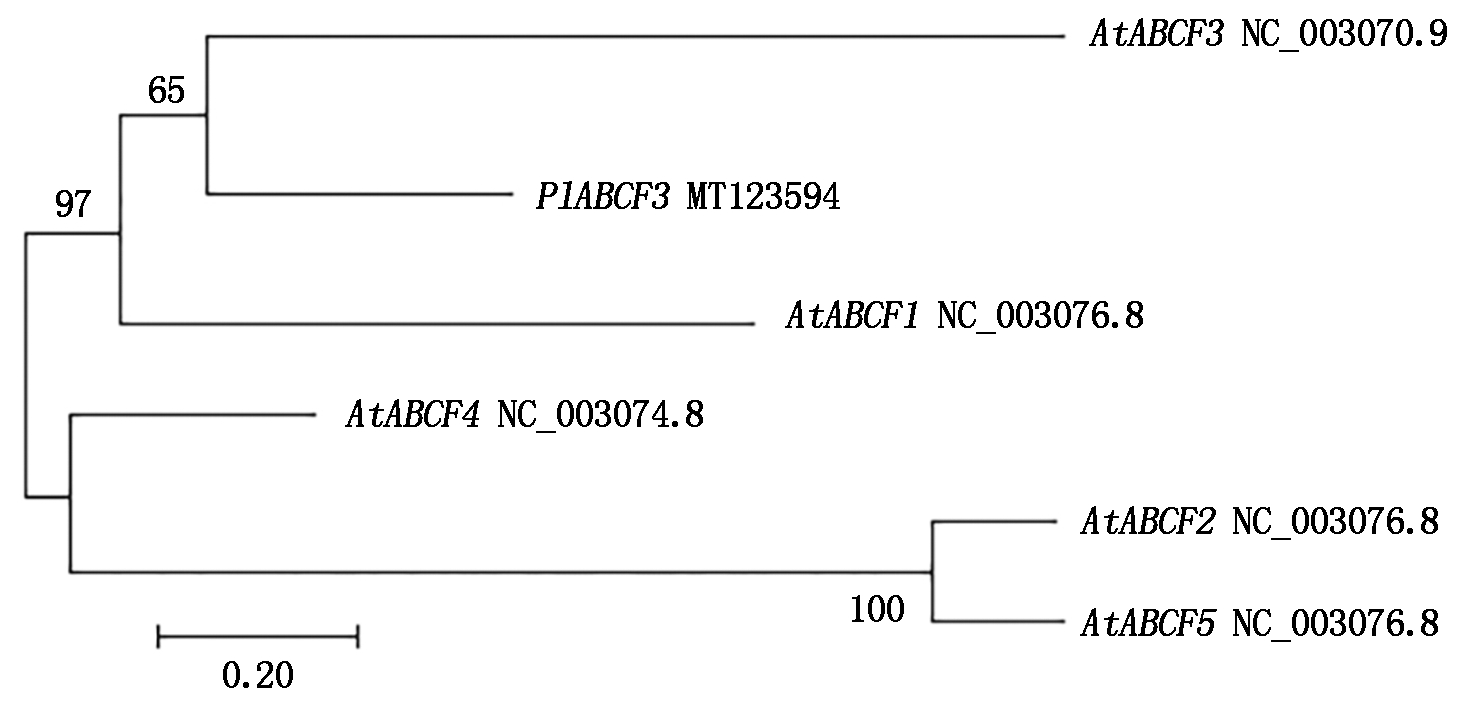
图2 芍药PlABCF3与拟南芥AtABCFs的系统进化树分析
Fig.2 Phylogenetic tree of PlABCF3 and AtABCFs of Arabidopsis thaliana
利用NCBI的Blastp对芍药ABCF3基因氨基酸序列进行比对,选取同源性排在前19的植物利用MEGA 7.0软件构建系统发育树(图3)。芍药与博落回聚类到一起后与茶树、黄胡萝卜、芝麻、樟子松和葡萄等形成一个分支,其他13种植物为另一个分支,表明芍药与博落回亲缘关系较近。

图3 芍药PlABCF3与其他物种ABCF3的系统进化树分析
Fig.3 Phylogenetic tree of PlABCF3 and the known ABCF3 in the other plants species
从NCBI数据库中下载博落回、葡萄、蓖麻、桑树、胡桃、木薯、樟子松、栎树、茶树、黄连木共10个物种的ABCF3氨基酸序列,使用DNAMAN 8.0进行序列比对(图4)。结果发现其相似性在85.38%~88.02%,其中与博落回的相似性最高,各序列之间的差异性不大,推断其功能接近或类似。


图4 PlABCF3基因与其同源基因编码氨基酸序列的对比
Fig.4 Alignment of PlABCF3 with amino acid sequences encoded by homologous genes
综上,进一步说明克隆的PlABCF3属于ABC家族基因,其功能有待进一步试验验证。
2.2 编码蛋白理化性质与结构的预测
在线工具ProtParam分析表明,PlABCF3理论分子质量约为79.7 ku,原子总数为11 198个,预测分子式C3528H5594N982O1067S27,理论等电点(pI)为5.79,说明蛋白呈酸性。该蛋白由20种氨基酸组成。亮氨酸(Leu)含量最高,占比10.2%;甘氨酸(Gly)含量次之,占比为8.1%;色氨酸(Trp)含量最低,占比0.6%。负电荷氨基酸残基(Asp+Glu)总电荷为100,正电荷氨基酸残基(Arg+Lys)总电荷数83。不稳定系数38.27,半衰期30 h,脂肪系数87.82,总亲水性平均系数-0.304,根据数据可推测这是一个带负电荷的稳定亲水性蛋白。由TMpred预测得知可能具有2个跨膜螺旋区,分别位于608-626个,660-677个氨基酸。SignalP 5.0预测显示该蛋白不具有信号肽切割位点。使用GOR4预测该蛋白的二级结构(图5-A、B),结果显示α-螺旋(Alpha helix)占39.11%,延伸链(Extended strand)占15.64%,而最大的结构元件是不规则卷曲(Random coil),占45.25%。并使用Swiss-model进行三级结构预测,结果显示其蛋白结构复杂(图5-C)。

A、B.PlABCF3蛋白的二级结构预测;C.PlABCF3蛋白的三级结构预测;B:蓝色.α-螺旋;橙色.无规则卷曲;红色.延伸链。
A, B.Secondary structure prediction of PlABCF3 protein; C.Three-level structure prediction of PlABCF3 protein;B:Blue.Alpha helix;Orange.Random coil;Red.Extended strand.
图5 芍药PlABCF3蛋白氨基酸序列的结构预测分析
Fig.5 The structure prediction of amino acid sequence of PlABCF3 protein
2.3 PlABCF3基因的表达与内源激素含量测定结果分析
比对粉玉奴×凤丹白杂交24,36 h,以及粉玉奴自交24,36 h 2种情况中PlABCF3基因的表达水平分析(图6),结果表明:PlABCF3的基因相对表达量在杂交24 h与自交24 h之间无显著差异,杂交36 h显著低于自交36 h,杂交36 h的相对表达量最低且与自交24 h、杂交24 h、自交36 h相比均差异显著,符合转录组测序结果预期的下调趋势。
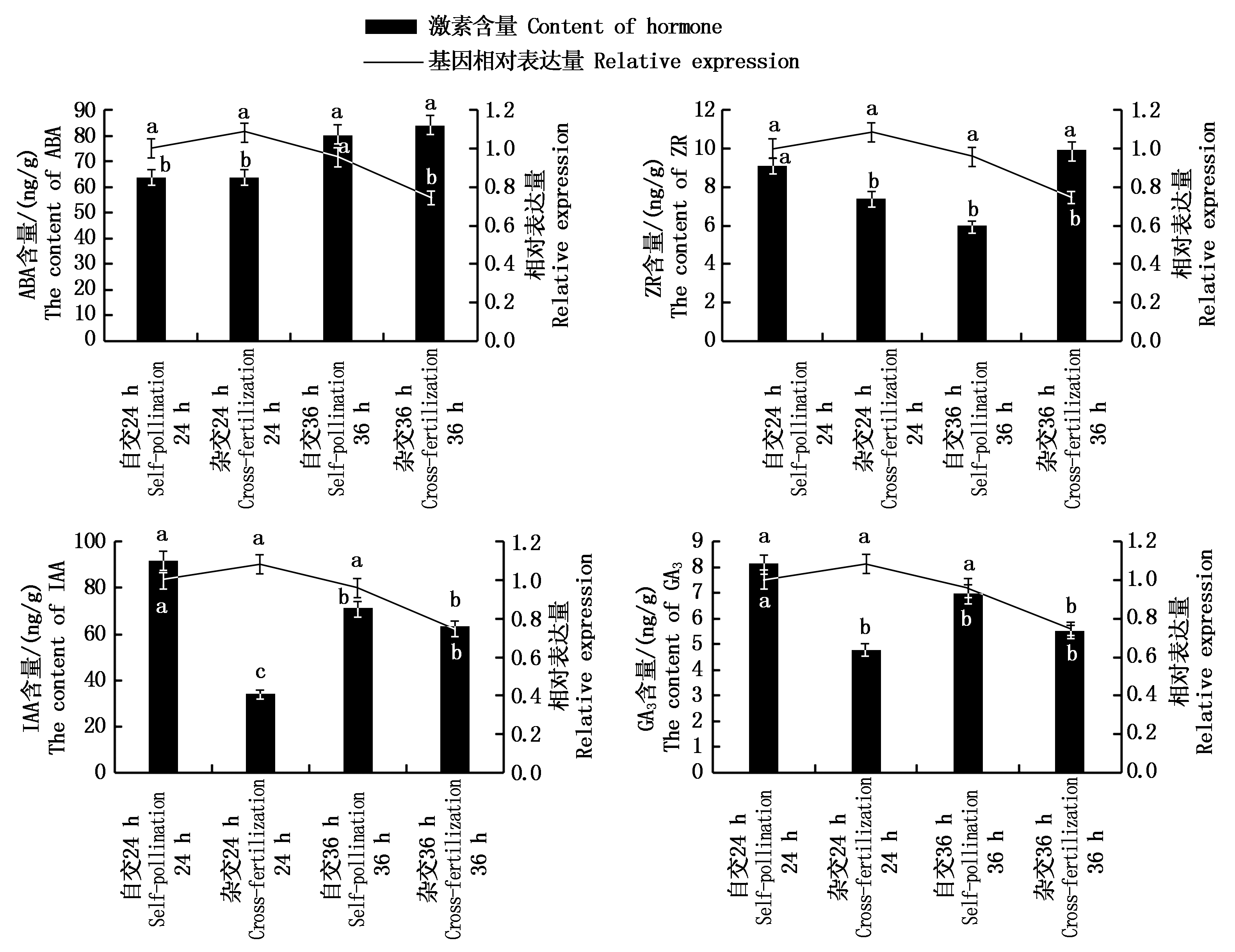
不同字母表示处理间存在显著性差异(P<0.05)。
The difference letters indicate significant differences among different treatments(P<0.05).
图6 PlABCF3在不同时期的自交、杂交柱头中的表达量及内源激素含量的动态变化
Fig.6 The relative expression level of PlABCF3 and dynamic changes of endogenous hormones in the stigmas of self-cross and hybridization in different periods
雌蕊中的ABA含量在杂交24 h与自交24 h时无显著差异,在杂交36 h时最高,与自交36 h差异不显著,二者均显著高于24 h的含量;ZR含量在杂交24 h时显著低于自交24 h,在杂交36 h时显著高于自交36 h,在杂交36 h时最高,与自交24 h差异不显著;GA3及IAA含量在同一时期均为自交高于杂交,其中在24 h的含量差异显著,36 h的含量差异不显著。
对比内源激素测定结果发现,PlABCF3的相对表达量与ABA、ZR含量显著负相关(R=-0.837,-0.565,P<0.01);但与IAA含量的负相关关系(R=-0.232)及与GA3含量的正相关关系(R为0.089)均未达显著水平。通过比较关系系数R值与显著性水平P值进行相关性分析可知,PlABCF3相对表达量与ABA含量之间的动态趋势高度相关(|R|>0.7,P<0.01),与ZR含量之间的动态趋势中度相关(|R|>0.4,P<0.01),而与IAA、GA3含量有相关性但相关性较低。
3 结论与讨论
本研究从芍药粉玉奴与牡丹凤丹白杂交柱头中克隆得到一个新的ABCF3基因,其CDS全长为2 151 bp,编码716个氨基酸。同源序列与系统进化分析表明,PlABCF3基因核苷酸序列与AtABCF3基因的核苷酸序列具有较高的同源性,PlABCF3氨基酸序列与博落回同源性最高,表明该克隆片段属于ABC家族基因,可能具有ABC家族基因功能。荧光定量检测结果表明,杂交36 h中该基因的相对表达量最低,下调明显。由此推测PlABCF3与芍药属远缘杂交不亲和相关。而通过对自交24,36 h及杂交24,36 h的内源激素含量测定结果分析可发现激素含量发生明显变化,ABA、ZR含量在杂交36 h时含量最高,IAA、GA3含量在杂交中均低于同时期的自交。数据分析表明,PlABCF3相对表达量与ABA含量之间的动态趋势高度负相关,与ZR含量之间的动态趋势中度负相关,而与IAA、GA3含量有相关性但相关性较低。
在前期的研究中表明,芍药与牡丹远缘杂交授粉后柱头对异源花粉的特异性排斥产生强烈的胼胝质反应,且大部分花粉不能萌发,花粉管出现扭曲肿胀等现象,授粉后36 h表现明显[21-22]。Wu等[24]研究表明,IAA和GA3对离体花粉管生长有促进作用,而ABA对花粉管生长有抑制作用,在授粉过程中表现为游离IAA和GA3增加、ABA减少。其他研究中也发现,低水平的IAA、ZR与花粉变形及结实有关,高水平的ABA可在一定程度上抑制花粉的萌发、花粉管的伸长以及花粉管的变形扭曲[25-26]。内源激素与芍药属杂交过程中的亲和性密切相关,而ABC转运蛋白参与激素IAA、ABA等的运输[27-29],Kamimoto等[30]研究表明,当细胞质中的IAA浓度较低时,ABC转运蛋白的家族成员介导NPA敏感性的改变从而使IAA向内转运,而在较高的内源IAA浓度下,其影响生长素抑制剂NPA的敏感性使IAA向外转运。阎波等[31]研究表明,ABC的家族成员参与了ABA的吸收与外排,影响植物迅速响应逆境胁迫。因此,推测PlABCF3可能通过调控激素变化影响芍药属的远缘杂交不亲和。
吕换男等[32]对金坠梨和鸭梨花粉的差异性表达蛋白质的研究中发现,ABC转运蛋白在授粉过程中参与了花粉和花柱的相互识别过程,且可能影响了金坠梨花柱S-RNase进入花粉管的运输过程而导致其亲和性突变。Meng等[33]在苹果自交不亲和性研究中发现,S-RNase被MdABCF蛋白从花柱中转运至花粉管的囊泡内,而自我S-RNase可通过降解花粉管中RNA导致蛋白质合成受阻,起到抑制花粉管伸长的作用[34-35]。Choi等[36]研究发现,ABC转运蛋白的家族成员ABCB蛋白影响拟南芥的花粉活力与种子产量。李依民等[20]发现,铁皮石斛2个F家族ABC转运蛋白基因在花药发育过程中具有较高的协调性,在时空和组织上表达受到严格调控,调控器官发育。由此推断,PlABCF3极有可能通过调控S-RNase抑制花粉管的伸长,并参与调节激素进一步影响花粉萌发、花粉管生长及干扰花粉花柱的识别过程,从而导致最终的芍药属远缘杂交不亲和。
本研究使用RT-PCR技术从芍药柱头中克隆得到一个新的ABCF3基因,PlABCF3的 CDS全长为2 151 bp,编码716个氨基酸,同源序列与系统进化分析表明,PlABCF3与AtABCF3具有较高的同源性,在对比其他物种的ABCF3序列分析中发现,PlABCF3氨基酸序列与博落回同源性最高, PlABCF3蛋白与博落回的ABCF3相似性最高。根据在线软件可推测PlABCF3是一个带负电荷的稳定亲水性蛋白,可能具有2个跨膜螺旋区、不具有信号肽切割位点。荧光结果显示,PlABCF3的表达量在杂交24 h与自交24 h之间无显著差异,杂交36 h显著低于自交36 h,杂交36 h的相对表达量最低,符合转录组测序结果预期的下调趋势。将荧光定量结果对比内源激素含量测定结果发现,PlABCF3的相对表达量与ABA、ZR含量显著负相关(R分别为-0.837,-0.565,P<0.01),与IAA含量的负相关系数(-0.232)及与GA3含量的相关系数(0.089)均未达显著水平。这说明PlABCF3基因在芍药属远缘杂交中与内源激素有着密切的关系,为芍药属远缘杂交不亲和分子研究提供理论基础。
[1] 马翔龙,吴敬需,刘少华.伊藤牡丹发展现状与展望[J].中国花卉园艺, 2018(16):28-31.doi:10.3969/j.issn.1009.8496.2018.16.013.
Ma X L, Wu J X, Liu S H.Present situation and prospect of the development of Itoh hybrid peonies[J].China Flowers & Horticulture, 2018(16):28-31.
[2] 杨柳慧,张建军,王琪,朱炜,张滕,于晓南.5个芍药属伊藤杂种的倍性鉴定及核型分析[J].植物研究, 2017, 37(4):535-541.doi:10.7525/j.issn.1673-5102.2017.04.008.
Yang L H, Zhang J J, Wang Q, Zhu W, Zhang T, Yu X N.Ploidy identification and karyotype analysis of five Itoh hybrid peonies[J].Bulletin of Botanical Research, 2017, 37(4):535-541.
[3] Hao Q, Aoki N, Katayama J, Kako T, Cheon K S, Akazawa Y, Kobayashi N.Crossability of American tree peony ′High Noon′ as seed parent with Japanese cultivars to breed superior cultivars[J].Euphytica, 2013, 191:35-44.doi:10.1007/s10681-012-0853-3.
[4] Ma K F, Song Y P, Huang Z, Lin L Y, Zhang Z Y, Zhang D Q.The low fertility of Chinese white poplar:dynamic changes in anatomical structure, endogenous hormone concentrations, and key gene expression in the reproduction of a naturally occurring hybrid[J].Plant Cell Reports, 2013, 32:401-414.doi:10.1007/s00299-012-1373-2.
[5] Mesejo C, Yuste R, Martínez-Fuentes A, Reig C, Iglesias D J, Primo-Millo E, Agust M.Self-pollination and parthenocarpic ability in developing ovaries of self-incompatible clementine mandarins(Citrus clementina)[J].Physiology Plant, 2013, 148(1):87-96.doi:10.1111/j.1399-3054.2012.01697.x.
[6] 张鹏,周骏辉,荆艳萍.杨树授粉亲和性与雌蕊生理生化变化的关系[J].东北林业大学学报, 2014, 42(6):11-14, 33.doi:10.3969/j.issn.1000-5382.2014.06.003.
Zhang P, Zhou J H, Jing Y P.Relationship between physiological and biochemical changes in pistil and pollination compatibility of popla[J].Journal of Northeast Forestry University, 2014, 42(6):11-14, 33.
[7] 贺丹,解梦珺,吕博雅,王政,刘艺平,何松林.牡丹与芍药的授粉亲和性表现及其生理机制分析[J].西北农林科技大学学报(自然科学版), 2017, 45(10):129-136.doi:10.13207/j.cnki.jnwafu.2017.10.016.
He D, Xie M J, Lü B Y, Wang Z, Liu Y P, He S L.Analysis of pollination affinity performance and its physiological mechanism in Paeonia sufruticosa and Paeonia factiflora[J].Journal of Northwest A & F University(Natural Science Edition), 2017, 45(10):129-136.
[8] Chien V H, Leyva-González M A, Osakabe Y, Tran U T, Nishiyama R, Watanabe Y, Tanaka M, Seki M, Yamaguchi S, Dong N V, Yamaguchi-Shinozaki K, Shinozaki K, Herrera-Estrella L, Tran L P.Plant ABC proteins-a unified nomenclature and updated inventory[J].Trends Plant Science, 2008, 13(4):151-159.doi:10.1016/j.tplants.2008.02.001.
[9] 曹冠华,柏旭,陈迪,张晓蓉,贺森.ABC转运蛋白结构特点及在植物和真菌重金属耐性中的作用与机制[J].农业生物技术学报, 2016, 24(10):1617-1628.doi:10.3969/j.issn.1674-7968.2016.10.019.
Cao G H, Bai X, Chen D, Zhang X R, He S.Structure characteristics of ABC transporter protein and the function and mechanism on enhancing resistance of plants and fungi to heavy metals[J].Journal of Agricultural Biotechnology, 2016, 24(10):1617-1628.
[10] Ponte-Sucre A.Availability and applications of ATP-binding cassette(ABC)transporter blockers[J].Applied Microbiology and Biotechnology, 2007, 76(2):279-286.doi:10.1007/s00253-007-1017-6.
[11] Dean M, Rzhetsky A, Allikmets R.The human ATP-binding cassette(ABC)transporter super family[J].Genome Research, 2001,11(7):1156-1166.doi:10.1101/gr.184901.
[12] Dean M, Annilo T.Evolution of the ATP-binding cassette(ABC)transporter superfamily in vertebrates[J].Annual Review of Genomics and Human Genetics, 2005, 6:123-142.doi:10.1146/annurev.genom.6.080604.162122.
[13] Kubeš M, Yang H B, Richter G L, Cheng Y, M odzińska E, Wang X, Blakeslee J J, Carraro N, Petr
odzińska E, Wang X, Blakeslee J J, Carraro N, Petr šek J, Zažímalov
šek J, Zažímalov E, Hoyerov
E, Hoyerov K, Peer W A, Murphy A S.The Arabidopsis concentration-dependent influx/efflux transporter ABCB4 regulates cellular auxin levels in the root epidermis[J].The Plant Journal, 2012, 69(4):640-654.doi:10.1111/j.1365-313X.2011.04818.x.
K, Peer W A, Murphy A S.The Arabidopsis concentration-dependent influx/efflux transporter ABCB4 regulates cellular auxin levels in the root epidermis[J].The Plant Journal, 2012, 69(4):640-654.doi:10.1111/j.1365-313X.2011.04818.x.
[14] Kaneda M, Schuetz M, Lin B S P, Chanis C, Hamberger B, Western T L, Ehlting J, Samuels A L.ABC transporters coordinately expressed during lignification of Arabidopsis stems include a set of ABCBs associated with auxin transport[J].Journal of Experimental Botany, 2011, 62(6):2063-2077.doi:10.1093/jxb/erq416.
[15] Kuromori T, Miyaji T, Yabuuchi H, Shimizu H, Sugimoto E, Kamiya A, Moriyama Y, Shinozaki K.ABC transporter AtABCG25 is involved in abscisic acid transport and responses[J].Proceedings of the National Academy of Sciences of the USA, 2010, 107(5):2361-2366.doi:10.1073/pnas.0912516107.
[16] Merilo E, Jalakas P, Laanemets K, Mohammadi O, Hõrak H, Kollist H, Brosché M.Abscisic acid transport and homeostasis in the context of stomatal regulation[J].Molecular Plant, 2015, 8(9): 1321-1333.doi:10.1016/j.molp.2015.06.006.
[17] Kuromori T, Sugimoto E, Shinozaki K.Arabidopsis mutants of AtABCG22, an ABC transporter gene, increase water transpiration and drought susceptibility[J].The Plant Journal, 2011, 67(5): 885-894.doi:10.1111/j.1365-313X.2011.04641.x.
[18] Chien V H, Leyva-Gonzálezc M A, Osakabe Y, Uyen T T, Rie N, Yasuko W, Maho T, Motoaki S, Shinjiro Y, Nguyen V D, Kazuko Y S, Kazuo S, Luis H E, Lam P T.Positive regulatory role of strigolactone in plant responses to drought and salt stress[J].Proceedings of the National Academy of Sciences of the USA, 2014, 111(2):851-856.doi:10.1073/pnas.1322135111.
[19] 孟冬.苹果MdABCF转运S-RNase至花粉管影响自交不亲和反应[D].北京: 中国农业大学, 2014.
Meng D.Apple ABCF transport S-RNase into pollen tube effecting self-incompatibility[D].Beijing: China Agriculture University, 2014.
[20] 李依民,雷根平,颜永刚,彭亮, 张娜, 刘亮亮, 黑小斌, 李欢, 张岗, 郭顺星.铁皮石斛2个F家族ABC转运蛋白基因的克隆和表达研究[J].中草药, 2017, 48(15):3153-3159.doi:10.7501/j.issn.0253-2670.2017.15.022.
Li Y M, Lei G P, Yan Y G, Peng L, Zhang N, Liu L L, Hei X B, Li H, Zhang G, Guo S X.Molecular cloning and expression analysis of two genes encoding F family ATP-binding cassette transporters in Dendrobium officinale[J].Chinese Traditional and Herbal Drugs, 2017, 48(15):3153-3159.
[21] He D, Lou X Y, He S L, Lei Y K, Lü B V, Wang Z, Zheng Y B, Liu Y P.Isobaric tags for relative and absolute quantitation-based quantitative proteomics analysis provides novel insights into the mechanism of cross-incompatibility between tree peony and herbaceous peony[J].Functional Plant Biology, 2019, 46(5):417-427.doi:10.1071/FP18163.
[22] 贺丹,王雪玲,高晓峰,吕博雅,刘艺平,何松林.牡丹芍药远缘杂交亲和性[J].东北林业大学学报, 2014(7):65-68.doi:10.13759/j.cnki.dlxb.2014.07.016.
He D, Wang X L, Gao X F, Lü B Y, Liu Y P, He S L.Intergeneric cross-compatibility between peonies[J].Journal of Northeast Forestry University, 2014(7):65-68.
[23] Schmittgen T D, Livak K J.Analyzing Real-time PCR data by the comparative CT method[J].Nature Protocols, 2008, 3(6):1101-1108.doi: 10.1038/nprot.2008.73.
[24] Wu J Z, Qin Y, Zhao J.Pollen tube growth is affected by exogenous hormones and correlated with hormone changes in styles in Torenia fournieri L.[J].Plant Growth Regulation, 2008, 55(2):137-148.doi:10.1007/s10725-008-9268-5.
[25] 许明,白明义,魏毓棠.紫菜薹细胞质雄性不育系及其保持系在不同发育时期内源激素的变化[J].西北农业学报, 2007, 16(3):124-127,135.doi:10.3969/j.issn.1004-1389.2007.03.032
Xu M, Bai M Y, Wei Y T.Changes in endogenous hormone between B. campestris ssp.chinensis var.purpurea Hort.CMS linesand their maintainer line at different development stages[J].Acta Agriculturae Boreali-occidentalis Sinica, 2007, 16(3):124-127,135.
[26] Chen D, Zhao J.Free IAA in stigmas and styles during pollen germination and pollen tube growth of Nicotiana tabacum[J].Physiologia Plantarum, 2008, 134(1):202-215.doi:10.1111/j.1399-3054.2008.01125.x
[27] Geisler M.Plant ABC transporters[M].Switzerland: Springer International Publishing, 2014.
[28] Kang J Y, Hwang J U, Lee M, Kim Y Y, Assmann S M, Martinoia E, Lee Y.PDR-type ABC transporter mediates cellular uptake of the phytohormone abscisic acid[J].Proceedings of the National Academy of Sciences of the United States of America,2010, 107(5):2355-2360.doi:10.1073/pnas.0909222107.
[29] 邵若玄,沈忆珂,周文彬,方佳,郑炳松.植物ATP结合盒(ABC)转运蛋白研究进展[J].浙江农林大学学报, 2013, 30(5):761-768.doi:10.11833/j.issn.2095-0756.2013.05.020.
Shao R X, Shen Y K, Zhou W B, Fang J, Zheng B S.Recent advances for plant ATP-binding cassette transporters[J].Journal of Zhejiang A&F University, 2013, 30(5):761-768.
[30] Kamimoto Y, Terasaka K, Hamamoto M, Takanashi K, Fukuda S, Shitan N, Sugiyama A, Suzuki H, Shibata D, Wang B J, Pollmann S, Geisler M, Yazaki K.Arabidopsis ABCB21 is a facultative auxin importer/exporter regulated by cytoplasmic auxin concentration[J].Plant and Cell Physiology, 2012, 53(12):2090-2100.doi:10.1093/pcp/pcs149.
[31] 阎波,刘思思,陈娟,郭顺星.药用植物铁皮石斛ABC转运蛋白基因的鉴定及其差异表达分析[J].药学学报, 2018, 53(7):1177-1189.doi:10.16438/j.0513-4870.2018-0117.
Yan B, Liu S S, Chen J, Guo S X.Identification and differential expression analysis of ABC transporter gene from medicinal plant Dendrobium officinale[J].Acta Pharmaceutica Sinica, 2018, 53(7): 1177-1189.
[32] 吕换男,马聚泽,郝艳,左波,黄佳,王海静,武军凯.‘鸭梨’及其自交亲和性芽变‘金坠梨’花粉ABC转运蛋白家族分析[J].河北科技师范学院学报, 2019, 33(2):1-11.doi:10.3969/J.ISSN.1672-7983.2019.02.001.
Lü H N, Ma J Z, Hao Y, Zuo B, Huang J, Wang H J, Wu J K.Proteomic analysis of ABC transporters from self-incompatible ′Yali′ and its spontaneous self-compatibl mutant ′Jinzhuili′[J].Journal of Hebei Normal University of Science & Technology, 2019, 33(2):1-11.
[33] Meng D, Gu Z Y, Li W, Wang A D, Yuan H, Yang Q, Li T Z.Apple MdABCF assists in the transportation of S-RNase into pollen tubes[J].The Plant Journal, 2014, 78(6):990-1002.doi:10.1111/tpj.12524.
[34] Goldraij A, Kondo K, Lee C B, Hancock C N, Sivaguru M, Vazquez-Santana S, Kim S, Phillips T E, Cruz-Garcia F, McClure B.Compartmentalization of S-RNase and HT-B degradation in self-incompatible Nicotiana[J].Nature, 2006, 439(7078):805-810.doi:10.1038/nature04491.
[35] Luu D T, Qin X K, Morse D, Cappadocia M.S-RNase uptake by compatible pollen tubes in gametophytic self-incompatibility[J].Nature, 2000, 407(6804): 649-651.doi:10.1038/35036623.
[36] Choi H, Jin J Y, Choi S, Hwang J U, Kim Y Y, Suh M C, Lee Y.An ABCG/WBC-type ABC transporter is essential for transport of sporopollenin precursors for exine formation in developing pollen[J].The Plant Journal: for Cell and Molecular Biology, 2011, 65(2):181-193.doi:10.1111/j.1365-313X.2010.04412.x.