干旱胁迫对植物的生长、光合作用、气孔运动、营养代谢等产生不良影响,进一步影响植物的生长发育,造成作物产量和品质显著下降。全球干旱、半干旱地区约占土地总面积的36%,占耕地面积的43%。中国是世界上主要干旱国家之一,干旱与半干旱土地面积约占全国土地面积的52.5%,占全国耕地面积的38%[1]。我国每年因干旱造成的粮食减产占气象灾害损失的50%左右。谷子(Setaria italica(L.)Beauv)古称粟,起源于我国黄河流域,是禾本科狗尾草属的一个栽培种(2n=2X=18),是世界上最古老的栽培作物,迄今已经有8 700多年的历史[2]。我国谷子的种植面积约200万hm2,约占世界谷子总面积的80%,产量占世界总产的90%[3]。谷子以其抗旱耐瘠、营养丰富、耐储藏著称。另外,谷子还是优良的饲草作物,是旱区畜牧业重要的饲料来源[4]。谷子的抗旱优势已被人们熟知和接受,对谷子抗旱性的研究也越来越受到人们的重视。代小冬等[5]认为,在PEG渗透剂模拟干旱胁迫下,谷子活力抗旱指数、相对发芽势、相对发芽率、相对胚芽长、相对胚根长与萌发抗旱指数极显著正相关,可以作为谷子萌芽期抗旱性鉴定的指标。高汝勇等[6]研究了12个谷子品种的发芽率、发芽指数、根长、苗高、鲜质量、活力指数,并采用模糊隶属函数对其抗旱性进行了评价。Qie等[7]利用谷子品种豫谷1号与青狗尾草构建的RIL群体定位到18个与抗旱相关的QTL。Li等[8]研究发现,SiARDP参与了依赖于ABA的信号传导途径,在提高谷子抗旱方面发挥了重要作用。Feng等[9]通过对谷子中39个核因子Y(NF-Y)基因的功能分析发现,SiNF-YA1和SiNF-YB8可以激活相关抗旱基因,提升谷子生理状态,达到抗旱的目的。Tang等[10]对抗旱品种豫谷1号和干旱敏感品种安-04在干旱条件下的转录组进行分析,并结合耐旱相关的QTL,确定了20个抗旱候选基因。Wang等[11]发现,在干旱胁迫条件下有14个miRNAs 的表达量上调,4个miRNAs的表达量下调。Pan等[12]利用定量蛋白质组学分析的方法发现了321个蛋白与谷子的抗旱性相关。谷子的抗旱性研究虽然取得了一定的进展,但是由于谷子是区域性的小杂粮作物,对其研究的广度和深度还远远不够。鉴于此,本研究利用山西2010和K359×M4-1构建的F2群体为作图群体,采用 2b-RAD测序技术构建遗传连锁图谱,并进行谷子萌芽期抗旱相关QTL定位,以期鉴定一些新的、可稳定遗传的QTL位点,为解析谷子抗旱机制及抗旱新品种选育提供理论基础。
1 材料和方法
1.1 试验材料
供试材料山西2010和K359×M4-1分别来源于山西省农业科学院经济作物研究所和河北省农林科学院谷子研究所。山西2010不仅具有较强的萌芽期抗旱性,而且在谷子苗期抗旱性鉴定评价中表现良好。K359×M4-1虽然具有兼抗咪唑乙烟酸和拿捕净2种除草剂的优异性状,但是其萌芽期抗旱性较弱。以山西2010为母本,K359×M4-1为父本配制杂交组合,获得包含100个单株的F2群体,并利用F2∶3家系的抗旱性确定F2群体的表型。
1.2 谷子萌芽期干旱胁迫处理
利用20%的PEG 6000对亲本及100个F2∶3家系种子进行萌芽期抗旱性鉴定。每份材料选择饱满的种子,首先用5%次氯酸钠消毒15 min,然后用ddH2O冲洗干净。选择50粒灭过菌的种子放入直径为9 cm的培养皿中,然后将培养皿放入培养箱,28 ℃暗培养。每个培养皿中加入5 mL 20%的PEG 6000,作为干旱胁迫处理;加入5 mL ddH2O,作为对照,重复3次。
1.3 萌芽期抗旱性调查
分别调查第2,4,6,8天种子的发芽数,并将第2,4,6,8天的种子萌发率记为nd2、nd4、nd6、nd8。参考Bouslama等[13]的方法计算萌发指数(PI,Promptness index)和萌发抗旱指数(SIDR,Sprout index of drought resisting),PI=1.00nd2+0.75nd4+0.50nd6+0.25nd8,SIDR=处理萌发指数/对照萌发指数。
1.4 建库测序与基因分型
提取萌发种子的基因组DNA,抽提合格后,利用2b-RAD五标签串联技术进行测序文库构建,文库质控合格后在Illumina Hiseq X10平台进行Paired-end测序(青岛欧易生物科技有限公司)。利用SOAP软件[14]将各样品的测序数据比对到参考序列上,获得可用于分型的Unique标签数目及深度。利用最大似然法进行SNP位点的分型。为保证后续分析的准确性,分型工作完成后对分型结果进一步过滤:①剔除所有样品中低于80%个体可以分型的位点;②剔除MAF低于0.01的位点;③剔除含有1种或4种碱基型的SNP位点;④剔除标签内多于2个SNP的位点;⑤剔除只有1种分型的位点。然后筛选亲本纯合的SNP差异位点,并进行子代分型转化。
1.5 遗传图谱构建
使用Joinmap 4.1[15]软件剔除相似度=1的冗余标记,剔除X2>100的标记,剔除可分型个体数<80%的标记。将符合条件的标记利用Joinmap 4.1 软件进行连锁图谱的构建,标记以LD>5进行分群,使用回归算法和Kosambi′s函数[16]计算遗传距离。
1.6 基因定位
根据作图群体表型数据,结合遗传连锁图谱,对性状利用MapQTL[17]软件进行QTL分析。具体分析步骤如下:①利用置换检验做1 000次重复,估算单个连锁群范围内α=0.05水平上的LOD阈值;②利用区间作图法(Interval mapping,IM)进行QTL分析,在每条连锁群上每隔1 cM对QTL存在的可能性扫描一次;③以单个连锁群范围内α=0.05水平上的LOD值作为阈值,即出现一个LOD峰值大于或等于阈值时视为该位点存在一个QTL。LOD峰值位置即为相应QTL基因最可能的位置。
2 结果与分析
2.1 亲本与100个F2∶3家系的萌芽期抗旱性分析
山西2010的萌芽期抗旱性较好,萌发抗旱指数达到0.92,K359×M4-1的萌芽期抗旱性较差,仅为0.64。F2群体的萌发抗旱指数在0.47~0.94。表现出连续偏正态分布(图1),表明该性状为多基因控制的数量性状。
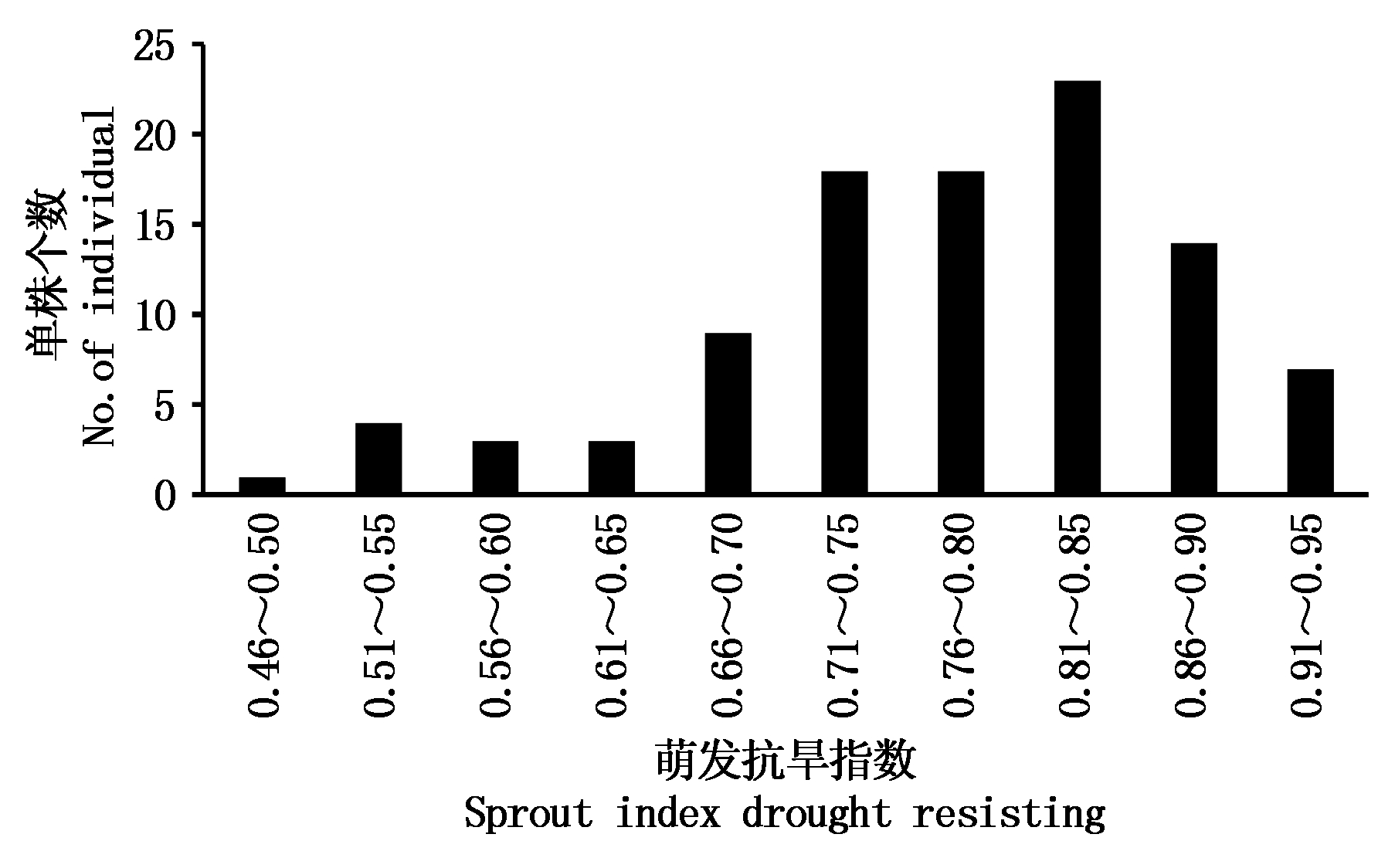
图1 亲本及F2群体萌芽期抗旱性分析
Fig.1 Sprout index of drought resisting of parents and F2 population
2.2 遗传连锁图谱构建结果
以山西2010与K359×M4-1杂交得到F2群体为作图群体,利用筛选到的583个SNP标记进行遗传图谱的构建,获得一张包含9个连锁群的图谱,总长为566.8 cM,标记平均间隔为0.97 cM(表1)。每条染色体长度为31.4~94.3 cM,平均长度为63.0 cM。染色体标记数目为31~106个,平均数目为64.8个。
表1 构建的遗传连锁图谱信息
Tab.1 Detailed information of constructed genetic linkage map
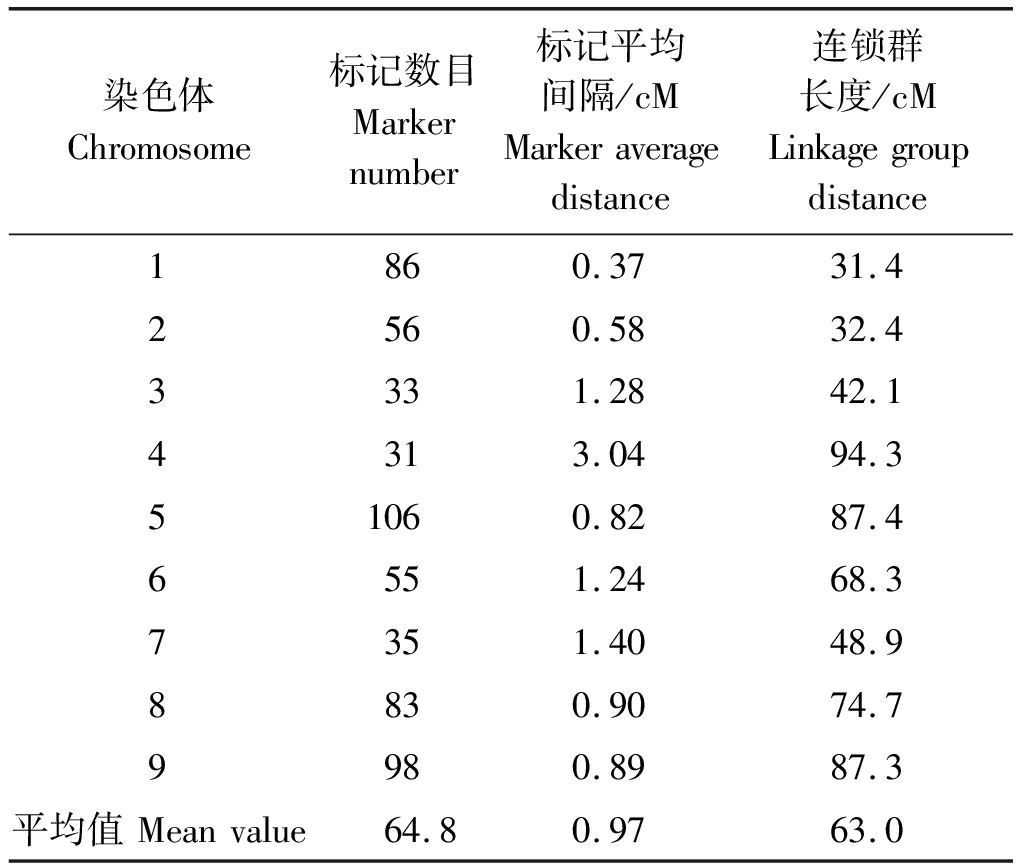
染色体Chromosome标记数目Markernumber标记平均间隔/cMMarkeraveragedistance连锁群长度/cMLinkagegroupdistance1860.3731.42560.5832.43331.2842.14313.0494.351060.8287.46551.2468.37351.4048.98830.9074.79980.8987.3平均值Meanvalue64.80.9763.0
2.3 萌芽期抗旱性分析
利用MapQTL软件对萌芽期抗旱性进行QTL分析,共检测到3个萌芽期抗旱性相关QTL位点,分别位于第5,6染色体上,分别命名为qSIDR-5a、qSIDR-6a和qSIDR-6b(表2、图2),可解释12.4%~14.3%的表型变异,其中,第5染色体上qSIDR-5a的表型贡献率最高,达到14.3%。

图2 谷子萌芽期抗旱性QTL检测
Fig.2 QTL detection of drought resistance at germination stage of foxtail millet
表2 F2群体中检测到的萌芽期抗旱性QTL
Tab.2 QTL affecting drought resistance at germination stage of foxtail millet detected in F2 population

QTL染色体Chromosome标记区间MarkerintervalLOD值LODscore可解释的表型变异/%PVEqSIDR-5a5Chr5-1468537~Chr5-16487923.3514.3qSIDR-6a6Chr6-3082960~Chr6-31952842.8712.4qSIDR-6b6Chr6-3082960~Chr6-31952842.8712.4
3 结论与讨论
干旱是限制作物生长的主要非生物逆境之一,对作物的产量和品质造成了严重的影响。谷子起源于我国,并在长期的驯化和栽培过程中适应了干旱、半干旱地区的生态环境,成为一种优良的抗旱资源,在作物抗旱种质利用方面具有独特的研究价值[18]。另外,谷子具有基因组小、重复序列少、生育期短、繁殖系数高等特点,已渐渐成为功能基因组研究的新模式作物。所以,谷子在抗旱机制研究方面具有显著的优势。
萌芽期是作物对水分最敏感的时期,如果该时期受到干旱,将会对作物的正常生长和产量水平造成极大的影响[19]。萌芽期抗旱性研究在对谷子抗旱性早期鉴定和适宜干旱半干旱地区谷子品种选择方面具有重要的意义。萌发抗旱指数是评价种子萌芽期抗旱性的可靠指标[13]。利用这个指标,已经成功鉴定出谷子[5,20]、水稻[21]、玉米[22]等作物的萌芽期抗旱性。
近年来,分子标记技术在作物抗逆性研究和优质、高产、多抗品种选育方面发挥了重要作用[23-27]。过去常用于遗传连锁图谱构建的第2代分子标记主要是 RFLP、AFLP、RFLP、ISSR和SSR等,随着高通量测序技术的发展,SNP因具有良好的多态性和极高的丰度成为植物遗传育种研究中的理想遗传标记[28]。众多学者利用SNP标记构建了多种作物的连锁图谱,并成功对控制小麦抽穗期和开花期[29]、玉米叶色[30]、铝胁迫下甘蓝型油菜萌发期相关性状[31]、甜瓜果实苦味[32]等的基因进行了定位。利用SNP遗传图谱研究谷子萌芽期抗旱性还属首次。本研究利用SNP遗传图谱,对干旱胁迫条件下亲本及作图群体种子的萌发抗旱指数进行了QTL定位分析。共检测到3个控制谷子萌芽期抗旱性的QTL,分别位于第5和第6染色体上。其中第5染色体上qSIDR-5a的表型贡献率最高,达到14.3%。通过与Qie等[7]研究结果比较发现,本研究定位的3个萌芽期抗旱QTL均未找到相同区间报道,是新的QTL。
谷子抗旱机制复杂,关于抗旱分子机制的研究还处于起步阶段。随着谷子基因组学和功能基因组学研究的不断深入,越来越多的谷子抗旱相关基因将会不断被挖掘,本研究结果可为阐明谷子抗旱分子机制和指导谷子生产实际奠定坚实的基础。
[1] 赵松岭.集水农业引论[M].西安:陕西科学技术出版社,1996:15-16.
Zhao S L.Introduction to catchment agricrlture[M].Xi′an:Shaanxi Science and Technology Press,1996:15-16.
[2] Lu H Y,Zhang J P,Liu K,Wu N Q,Li Y M,Zhou K S,Ye M L,Zhang T Y,Zhang H J,Yang X Y,Shen L C,Xu D K,Li Q.Earliest domestication of common millet(Panicummiliaceum)in East Asia extended to 10 000 years ago[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(18):7367-7372.doi:10.1073/pnas.0900158106.
[3] 刁现民.中国谷子生产与产业发展方向[C]//柴岩.中国小杂粮产业发展报告.北京:中国农业科学技术出版社,2007:32-43.
Diao X M.Production and industrial development direction of foxtail millet in China[C]//Chai Y.Development report of minor cereal crops industry in China.Beijing:China Agricultural Science and Technology Press,2007:32-43.
[4] 崔永伟.中西部地区小杂粮的生产优势与存在问题及对策研究[J].中国农业科技导报,2008,10(3):54-57.doi:10.3969/j.issn.1008-0864.2008.03.009.
Cui Y W.Studies on the advantages and existing problems of minor cereal crops productionin midwest China and countermeasure[J].Journal of Agricultural Science and Technology,2008,10(3):54-57.
[5] 代小冬,杨育峰,朱灿灿,鲁晓民,王春义,杨晓平,杨国红,李君霞.谷子萌芽期对干旱胁迫的响应及抗旱性评价[J].华北农学报,2015,30(4):139-144.doi:10.7668/hbnxb.2015.04.024.
Dai X D,Yang Y F,Zhu C C,Lu X M,Wang C Y,Yang X P,Yang G H,Li J X.Seed germination response to drought stress and drought resistance evaluation of foxtail millet[J].Acta Agriculturae Boreali-Sinica,2015,30(4):139-144.
[6] 高汝勇,时丽冉,崔兴国,李明哲.谷子品种抗旱性评价[J].河南农业科学,2013,42(12):28-32.doi:10.15933/j.cnki.1004-3268.2013.12.024.
Gao R Y,Shi L R,Cui X G,Li M Z.Assessment of drought resistance of Setaria italica varieties[J].Journal of Henan Agricultural Sciences,2013,42(12):28-32.
[7] Qie L F,Jia G Q,Zhang W Y,Schnable J,Shang Z L,Li W,Liu B H,Li M Z,Chai Y,Zhi H,Diao X M.Mapping of quantitative trait locus(QTLs)that contribute to germination and early seedling drought tolerance in the interspecific cross Setaria italica×Setaria viridis[J].PLoS One,2014,9(7):101868-101875.doi:10.1371/journal.pone.0101868.
[8] Li C, Yue J,Wu X W, Xu C, Yu J J.An ABA-responsive DRE-binding protein gene from Setaria italica,SiARDP,the target gene of SiAREB,plays a critical role under drought stress[J].Journal of Experimental Botany,2014,65(18):5415-5427.doi:10.1093/jxb/eru302.
[9] Feng Z J,He G H,Zheng W J,Lu P P,Chen M,Gong Y M,Ma Y Z,Xu Z S.Foxtail millet NF-Y families:genome-wide survey and evolution analyses identified two functional genes important in abiotic stresses[J].Frontiers in Plant Science,2015,6:1142.doi:10.3389/fpls.2015.01142.
[10] Tang S,Li L,Wang Y Q,Chen Q N,Zhang W Y,Jia G Q,Zhi H,Zhao B H,Diao X M.Genotype-specific physiological and transcriptomic responses to drought stress in Setaria italica(an emerging model for Panicoideae grasses)[J].Scientific Reports,2017,7(1):10009-10023.doi:10.1038/s41598-017-08854-6.
[11] Wang Y Q,Li L,Tang S,Liu J G,Zhang H S,Zhi H,Jia G Q,Diao X M.Combined small RNA and degradome sequencing to identify miRNAs and their targets in response to drought in foxtail millet[J].BMC Genetics,2016,17:57.doi:10.1186/s12863-016-0364-7.
[12] Pan J W,Li Z,Wang Q G,Garrell A K,Liu M,Guan Y A,Zhou W Q,Liu W.Comparative proteomic investigation of drought responses in foxtail millet[J].BMC Plant Biology,2018,18:315.doi:10.1186/s12870-018-1533-9.
[13] Bouslama M,Schapaugh W T.Stress tolerance in soybeans.Ⅰ.Evaluation of three screening techniques for heat and drought tolerance[J].Crop Science,1984,24(5):933-937.doi:10.2135/cropsci1984.0011183X002400050026x.
[14] Li R Q,Yu C,Li Y R,Lam T W,Yiu S M,Kristiansen K,Wang J.SOAP2:an improved ultrafast tool for short read alignment[J].Bioinformatics,2009,25(15):1966-1967.doi:10.1093/bioinformatics/btp336.
[15] Van J W.JionMap 4,software for the calculation of genetic linkage maps in experimental populations[M].Wageningen:Kyazma Besloten Vennootshap met beperkte aansprak-elijkhed,2006.
[16] Kosambi D D.The estimation of map distances fromrecombination values[M].New Delhi:Springer,2016:125-130.
[17] Van Ooijen J W.MapQTL® 5,Software for the mapping ofquantitative trait loci in experimental populations[M].Wageningen:Kyazma Besloten Vennootshap met beperkte aansprak-elijkhed,2004.
[18] 田伯红,张立新,宋淑贤.谷子新品种在旱作农业中的地位[J].中国种业,2004(4):17-18.doi:10.3969/j.issn.1671-895X.2000.04.008.
Tian B H,Zhang L X,Song S X.The role of foxtail millet varieties in dry farming[J].China Seed Industry,2004(4):17-18.
[19] 山仑.我国西北地区植物水分研究与旱地农业增产[J].植物生理学通讯,1983(5):7-10.doi:10.13592/j.cnki.ppj.1983.05.002.
Shan L.Study on plant water and raising the production of dryland farming in northwest China[J].Plant Physiology Communications,1983(5):7-10.
[20] 朱学海,宋燕春,赵治海,石云素,刘颖慧,黎裕,王天宇.用渗透剂胁迫鉴定谷子芽期耐旱性的方法研究[J].植物遗传资源学报,2008,9(1):62-67.doi:10.13430/j.cnki.jpgr.2008.01.009.
Zhu X H,Song Y C,Zhao Z H,Shi Y S,Liu Y H,Li Y,Wang T Y.Methods for identification of drought tolerance at germination period of foxtail millet by osmotic stress[J].Journal of Plant Genetic Resources,2008,9(1):62-67.
[21] 安永平,强爱玲,张媛媛,张文银,曹桂兰,韩龙植.渗透胁迫下水稻种子萌发特性及抗旱性鉴定指标研究[J].植物遗传资源学报,2006,7(4):421-426.doi:10.13430/j.cnki.jpgr.2006.04.009.
An Y P,Qiang A L,Zhang Y Y,Zhang W Y,Cao G L,Han L Z.Study on characteristics of germination and drought-resistance index by osmotic stress in rice[J].Journal of Plant Genetic Resources,2006,7(4):421-426.
[22] 张健,池宝亮,黄学芳,张冬梅,郭志华.以活力抗旱指数作为玉米萌芽期抗旱性评价指标的初探[J].华北农学报,2007,22(1):22-25.doi:10.3321/j.issn:1000-7091.2007.01.006.
Zhang J,Chi B L,Huang X F,Zhang D M,Guo Z H.Primary study on the vigour index of drought resistance asthe appraise index in corn germination stage[J].Acta Agriculturae Boreali-Sinica,2007,22(1):22-25.
[23] 林静,张云辉,陈海元,朱晓妹,张所兵,汪迎节,方先文.水稻地方品种苗期耐盐 QTL的定位[J].华北农学报,2019,34(S1):1-5.doi:10.7668/hbnxb.201751449.
Lin J,Zhang Y H,Chen H Y,Zhu X M,Zhang S B,Wang Y J,Fang X W.Mapping of salt tolerance QTLs at seedling stage of landrace rice[J].Acta Agriculturae Boreali-Sinica,2019,34(S1):1-5.
[24] 王棋,范淑秀,郭江华,陈兆赫,梁银培,刘振宇,殷业超,王嘉宇.利用籼粳交RIL群体对水稻发芽期和苗期耐冷性的QTL分析[J].华北农学报,2019,34(1):83-88.doi:10.7668/hbnxb.201751291.
Wang Q,Fan S X,Guo J H,Chen Z H,Liang Y P,Liu Z Y,Yin Y C,Wang J Y.QTL analysis of cold tolerance at germination and seedling stage of rice[J].Acta Agriculturae Boreali-Sinica,2019,34(1):83-88.
[25] 唐朝臣,高建明,韩芸,罗峰,裴忠有,孙守钧.高粱苗期耐盐碱性QTL定位[J].华北农学报,2015,30(3):42-47.doi:10.7668/hbnxb.2015.03.008.
Tang C C,Gao J M,Han Y,Luo F,Pei Z Y,Sun S J.Identification of QTLs associated with complex salt-alkaline tolerance at the seedling stage in sorghum[J].Acta Agriculturae Boreali-Sinica,2015,30(3):42-47.
[26] 黄冰艳,齐飞艳,孙子淇,苗利娟,房元瑾,郑峥,石磊,张忠信,刘华,董文召,汤丰收,张新友.以分子标记辅助连续回交快速提高花生品种油酸含量及对其后代农艺性状的评价[J].作物学报,2019,45(4):546-555.doi:10.3724/SP.J.1006.2019.84096.
Huang B Y,Qi F Y,Sun Z Q,Miao L J,Fang Y J,Zheng Z,Shi L,Zhang Z X,Liu H,Dong W Z,Tang F S,Zhang X Y.Improvement of oleic acid content in peanut(Arachis hypogaea L.)by marker assisted successive backcross and agronomic evaluation of derived lines[J].Acta Agronomica Sinica,2019,45(4):546-555.
[27] 李永聪,黄俊,廖花,陈海龙,杨丰宇,赖怡帆,张旭辉,刘金灵,王国梁,刘雄伦.分子标记辅助选择改良水稻恢复系R389及其杂交种稻瘟病抗性[J].华北农学报,2018,33(2):112-118.doi:10.7668/hbnxb.2018.02.016.
Li Y C,Huang J,Liao H,Chen H L,Yang F Y,Lai Y F,Zhang X H,Liu J L,Wang G L,Liu X L.Improving blast resistance of rice restorer 389 and its hybrid through molecular marker-assisted selection[J].Acta Agriculturae Boreali-Sinica,2018,33(2):112-118.
[28] Kim C K,Yoon U H,Lee G S,Park S H,Seol Y J,Lee H K,Hahn J H.An integrated database to enhance the identification of SNP markers for rice[J].Bioinformation,2009,4(6):269-270.doi:10.6026/97320630004269.
[29] 王克森,董爽爽,李法计,郭军,台述强,王利彬,程敦公,穆平,刘建军,李豪圣,赵振东,曹新有,张玉梅.小麦抽穗和开花期相关QTL定位与分析[J].山东农业科学,2020,52(1):17-23.doi:10.14083/j.issn.1001-4942.2020.01.003.
Wang K S,Dong S S,Li F J,Guo J,Tai S Q,Wang L B,Cheng D G,Mu P,Liu J J,Li H S,Zhao Z D,Cao X Y,Zhang Y M.QTL mapping and analysis of heading time and flowering time of wheat[J].Shandong Agricultural Sciences,2020,52(1):17-23.
[30] 刘忠祥,寇思荣,连晓荣,杨彦忠,王晓娟,何海军,周玉乾,周文期.玉米黄绿叶突变体表型鉴定及基因初步定位[J].植物遗传资源学报,2020,21(2):452-458.doi:10.13430/j.cnki.jpgr.20190611002.
Liu Z X,Kou S R,Lian X R,Yang Y Z,Wang X J,He H J,Zhou Y Q,Zhou W Q.Phenotypic identification and low-resolution mapping of a yellow-green leaf mutant in maize[J].Journal of Plant Genetic Resources,2020,21(2):452-458.
[31] 王瑞莉,王刘艳,叶桑,郜欢欢,雷维,吴家怡,袁芳,孟丽姣,唐章林,李加纳,周清元,崔翠.铝毒胁迫下甘蓝型油菜种子萌发期相关性状的QTL定位[J].作物学报,2020,46(6):832-843.doi:10.3724/SP.J.1006.2020.94154.
Wang R L,Wang L Y,Ye S,Gao H H,Lei W,Wu J Y,Yuan F,Meng L J,Tang Z L,Li J N,Zhou Q Y,Cui C.QTL mapping of seed germination-related traits in Brassica napus L.under aluminum toxicity stress[J].Acta Agronomica Sinica,2020,46(6):832-843.
[32] 李娜,尚建立,周丹,李楠楠,王吉明,马双武.一个获得与缺失变异(PAV)调控甜瓜果实苦味[J].植物遗传资源学报,2020,21(2):377-385.doi:10.13430/j.cnki.jpgr.20190625001.
Li N,Shang J L,Zhou D,Li N N,Wang J M,Ma S W.A presence-absence variation(PAV)regulates fruit bitter in melon(Cucumis melo L.)[J].Journal of Plant Genetic Resources,2020,21(2):377-385.