敖汉细毛羊是我国具有代表性的毛肉兼用细毛羊品种[1-2]。敖汉细毛羊是通过杂交培育得到的品种,它的父系和母系分别为前苏联美利奴羊和内蒙古当地的蒙古羊[3]。羊的毛囊能够产生被毛,羊毛的产量也与毛囊息息相关[4]。因此,对于敖汉细毛羊来说,羊毛的品质尤为重要。现阶段,它已有适应性强、体质结实繁殖率高、体格大等优势[5],但还需要进一步提高净毛产量,增加羊毛长度。因此,对于毛囊发育有关的基因的研究就很有必要。毛囊发育中起重要作用的有胰岛素样生长因子(IGF)家族、表皮生长因子(EGF)家族、转化生长因子β(TGF-β)以及成纤维细胞生长因子(FGF)家族等[6-7]。
BMPs正是TGF-β家族中的成员,隶属于TGF-β超家族[8],是一种具有分泌功能的蛋白,其成员有很多种[9]。有研究表明,BMPs对毛囊生长发育的作用主要表现为抑制[10],其表达量在毛囊发育的退行期最高并随着毛囊的周期性生长发育呈现出周期性变化[11]。而BMPRs可与BMPs发生拮抗作用,间接促进毛囊的生长。毛青青[12]通过对小鼠的研究结果表明,BMP6基因是影响皮肤和毛囊发育的一个关键性基因。BMPR1B属于BMPs家族的Ⅰ型受体成员[13],它受到BMPs家族的控制,BMPs的表达同时依赖于BMPRs类受体。BMPs和BMPRs在毛囊的发育过程中均起到一定的作用,前人已经对BMP6[14]和BMPR1B[15]的功能进行了研究,本研究在此基础上,通过共转染开展了两基因相互作用研究,旨在为进一步的育种工作提供依据。
1 材料和方法
1.1 试验材料
选取40日龄的健康胎羊并及时消毒处理。
TRIzol(Roche)试剂、蛋白裂解液、EcoRⅠ限制性内切酶、KpnⅠ限制性内切酶、T4 DNA连接酶、pcDNA3.1质粒、DH5α感受态细胞、DMEM(基础培养基)、胰蛋白酶、标准胎牛血清、DPBS(磷酸缓冲盐溶液)、Lipofectamine 2000、反转录试剂盒、SoSo试剂盒、切胶回收试剂盒、质粒提取试剂盒、培养皿等均购自青岛尚赛科贸有限公司。
1.2 试验方法
1.2.1 引物设计在绵羊 BMP6和BMPR1B基因序列(GenBank登录号分别为XM_027958445.1和NM_001009431.1)CDS区外侧设计引物并在上、下游引物的5′加入同源臂。BMP6基因完成后的引物序列:(F)5′-TTTAAACTTAAGCTTGGTACCATGATC CTGGTAACCGAATGCTG-3′;(R)5′-TGGATCCGAG CTCGGTACCTCAGCGGCACACATCCCTCCACTA-3′。BMPR1B基因完成后的引物序列:(F)5′-TTTAAAC TTAAGCTTGGTACCATGCTTTTGCGAAGTTCAGG-3′;(R)5′-TGGATCCGAGCTCGGTACCTCAGAGCTTAAT GCCTGGGACTCTGAC-3′。
PCR扩增后琼脂糖凝胶电泳检测,PCR体系(25 μL):DNA模板1 μL,上下游引物各1 μL,Green Mix 12.5 μL,ddH2O 9.5 μL。
1.2.2 目的基因与表达载体同源重组 对表达载体pcDNA3.1进行EcoRⅠ单酶切,体系为:EcoRⅠ、KpnⅠ1 μL;pcDNA3.1 5 μL;Buffer 5 μL;ddH2O 39 μL。通过胶回收获得较为纯净的目的基因以及pcDNA3.1,通过T4 DNA连接酶将其连接。而后转至DH5α感受态细胞后振荡培养,提取阳性质粒。
1.2.3 成纤维细胞的培养 取40日龄胎羊组织置于培养皿中,用 75%的酒精清洗后再用含双抗的PBS清洗。洗净后将其剪成1.5 mm3左右,放入新皿中,加胎牛血清,置于培养箱CO2浓度5%、37 ℃条件下,4 h后加培养液。24 h后,用PBS冲洗后更换培养液,定时观察。细胞生长到95%左右进行传代培养。
1.2.4 细胞转染 传代后稀释pcDNA3.1-BMP6、pcDNA3.1-BMPR1B和脂质体,需转染pcDNA3.1-BMP6质量为6 030.41 ng,pcDNA3.1-BMPR1B质量为6 030.41 ng,培养液448.4 μL。脂质体取20 μL用培养液稀释到500 μL。对照组,取培养液500 μL,脂质体取20 μL用培养液稀释到500 μL。试验组、对照组室温各孵育10 min。将脂质体和pcDNA3.1-BMP6、pcDNA3.1-BMPR1B两者进行混匀,室温孵育20 min。将混合物加入到培养皿中,缓慢加入4 mL培养液(培养液不含血清不含双抗)。在培养箱CO2浓度5%、37 ℃条件下,培养6 h后换液,继续培养36 h。
1.2.5 细胞转染后的RT-PCR 扩大培养转染成功的单细胞,之后用TRIzol(Roche)试剂对转染后的细胞进行RNA的提取并反转录成cDNA。通过PrimerPremier 5.0软件设计BMP6、BMPR1B和GAPDH基因荧光定量PCR引物序列(表1)。
表1 qPCR引物信息
Tab.1 qPCR primers information
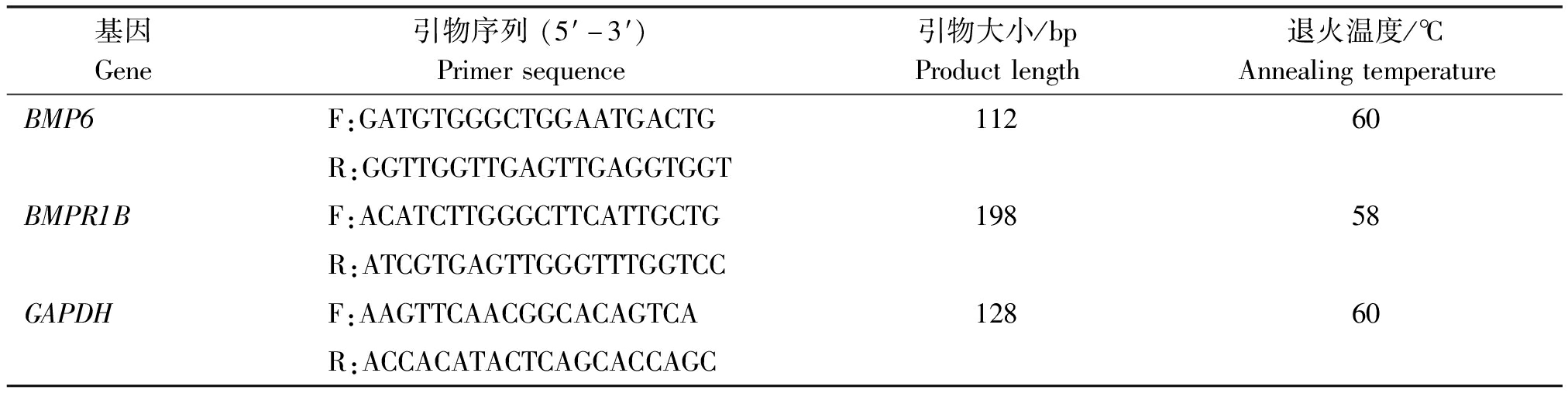
基因Gene引物序列(5′-3′)Primersequence引物大小/bpProductlength退火温度/℃AnnealingtemperatureBMP6F:GATGTGGGCTGGAATGACTG11260R:GGTTGGTTGAGTTGAGGTGGTBMPR1BF:ACATCTTGGGCTTCATTGCTG19858R:ATCGTGAGTTGGGTTTGGTCCGAPDHF:AAGTTCAACGGCACAGTCA12860R:ACCACATACTCAGCACCAGC
1.2.6 Western Blot 裂解并提取细胞中的蛋白质,电泳后对蛋白质进行PVDF转膜2 h后封闭蛋白质2 h;TBST洗膜3次,每次5 min;稀释一抗,用一抗孵育PVDF膜12 h;用TBST洗膜3次,每次5 min;稀释二抗,孵育1.5 h;在暗室中曝光。条带灰度值用Image J软件分析。
2 结果与分析
2.1 目的基因扩增
图1为PCR后凝胶电泳分析结果,扩增条带单一明亮,大小分别位于537,1 509 bp处,与已知大小相符。
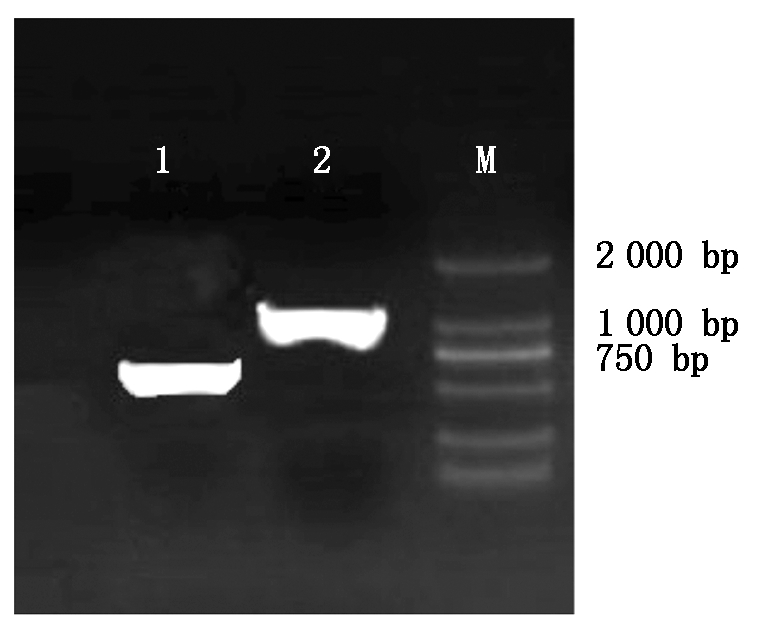
M.2000 Marker;1.BMP6基因扩增条带(537 bp);2.BMPR1B基因扩增条带(1 509 bp)。
M.2000 Marker;1.BMP6 gene amplification product(537 bp);2.BMPR1B gene amplification product(1 509 bp).
图1 目的基因PCR扩增
Fig.1 Target gene PCR amplification
2.2 pcDNA3.1载体单酶切及纯化
酶切结果如图2所示,pcDNA3.1载体为大小5 428 bp,图中条带与其大小所吻合,可用于后期的试验。
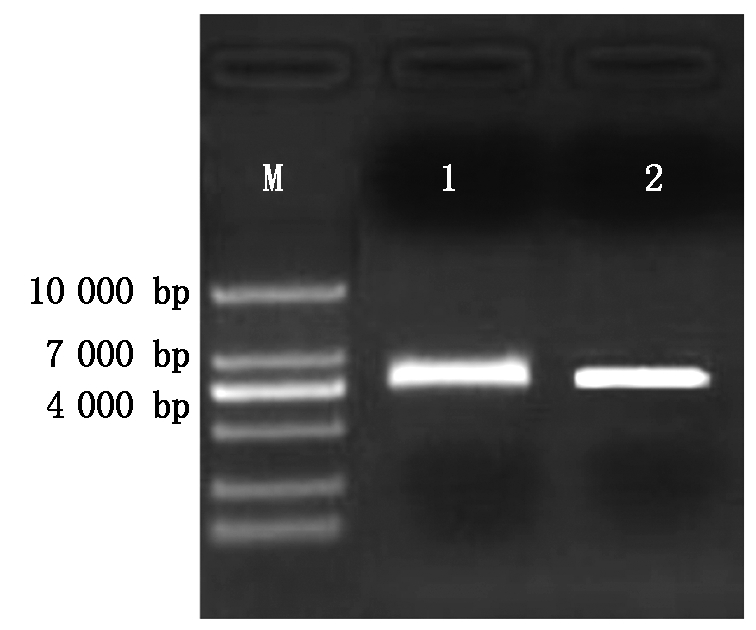
M.10000 Marker;1.pcDNA3.1载体KpnⅠ单酶切;2.pcDNA3.1载体EcoRⅠ单酶切。
M.10000 Marker;1.pcDNA3.1 plasmid KpnⅠsingle enzyme digested;2.pcDNA3.1 plasmid EcoRⅠsingle enzyme digested.
图2 pcDNA3.1表达载体单酶切
Fig.2 pcDNA3.1 vector single enzyme digested
2.3 表达载体pcDNA3.1与目的片段重组及鉴定
菌液PCR电泳结果如图3,扩增条带单一明亮,位于537,1 509 bp处,分别为BMP6、BMPR1B基因。菌液测序后用Blast比对,经测序比对后碱基均未发生突变。提取重组质粒,如图4所示,1,2为pcDNA3.1-BMP6重组质粒,大小为5 965 bp;3,4为pcDNA3.1-BMPR1B,大小为6 937 bp,与图中条带相符,成功构建重组质粒。
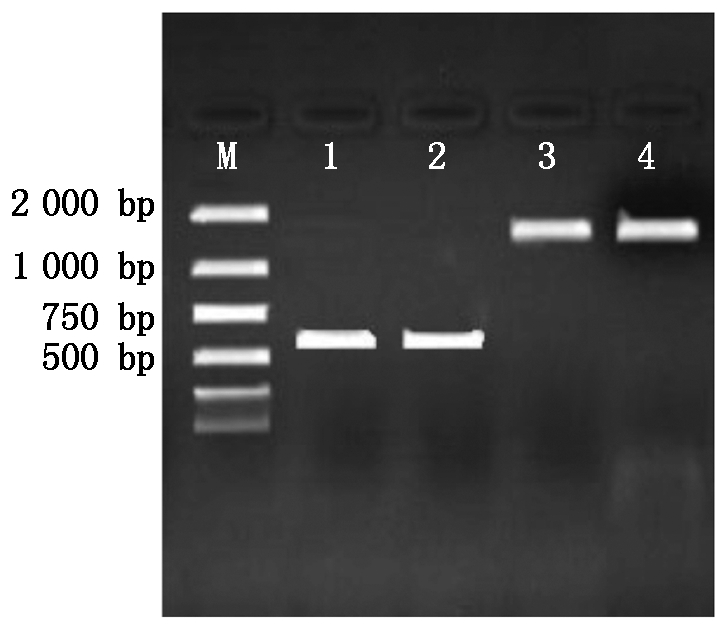
M.2000 Marker;1,2.BMP6菌液PCR;3,4.BMP1B菌液PCR。
M.2000 Marker;1,2.BMP6 bacterial PCR;3,4.BMPR1B bacterial PCR.
图3 菌液PCR扩增
Fig.3 PCR amplification of bacterial solution
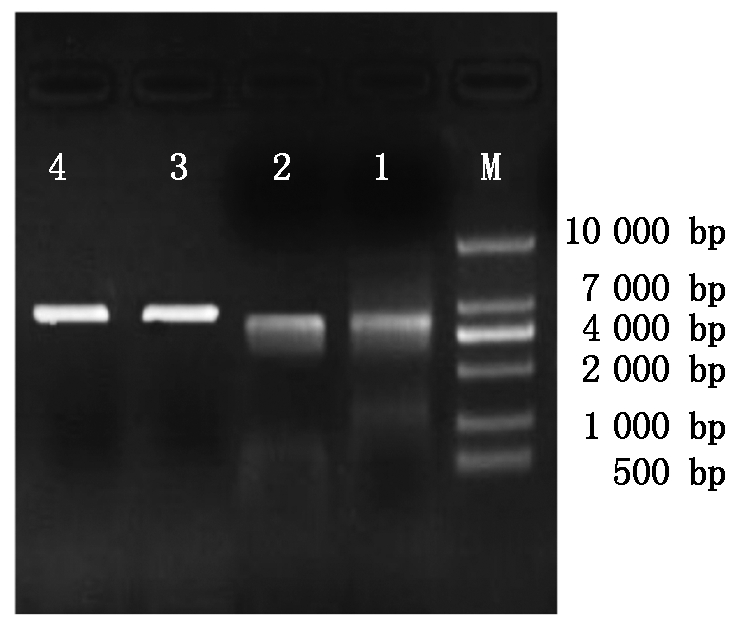
M.10000 Marker;1,2.pcDNA3.1-BMP6重组质粒;3,4.pcDNA3.1-BMPR1B重组质粒。
M.10000 Marker;1,2.pcDNA3.1-BMPR6 recombinant plasmids;3,4.pcDNA3.1-BMPR1B recombinant plasmids.
图4 重组质粒的提取
Fig.4 Extraction of recombinant plasmid
2.4 细胞培养
细胞培养24 h后逐渐贴壁,组织块的四周逐渐有细胞游出。传代培养在细胞密度约为95%时进行,采用胰蛋白酶消化法,2 000 r/min的转速下离心处理分离,成纤维细胞,之后扩大培养。观察结果如图5,6所示。

图5 成纤维细胞原代培养(×100)
Fig.5 Primary culture of fibroblasts(×100)
图6 成纤维细胞传代培养(×100)
Fig.6 Passage culture of fibroblasts(×100)
2.5 实时荧光定量PCR检测mRNA的表达
对RT-PCR引物检测结果如图7所示,扩增条带单一明亮,可进行后续RT-PCR。
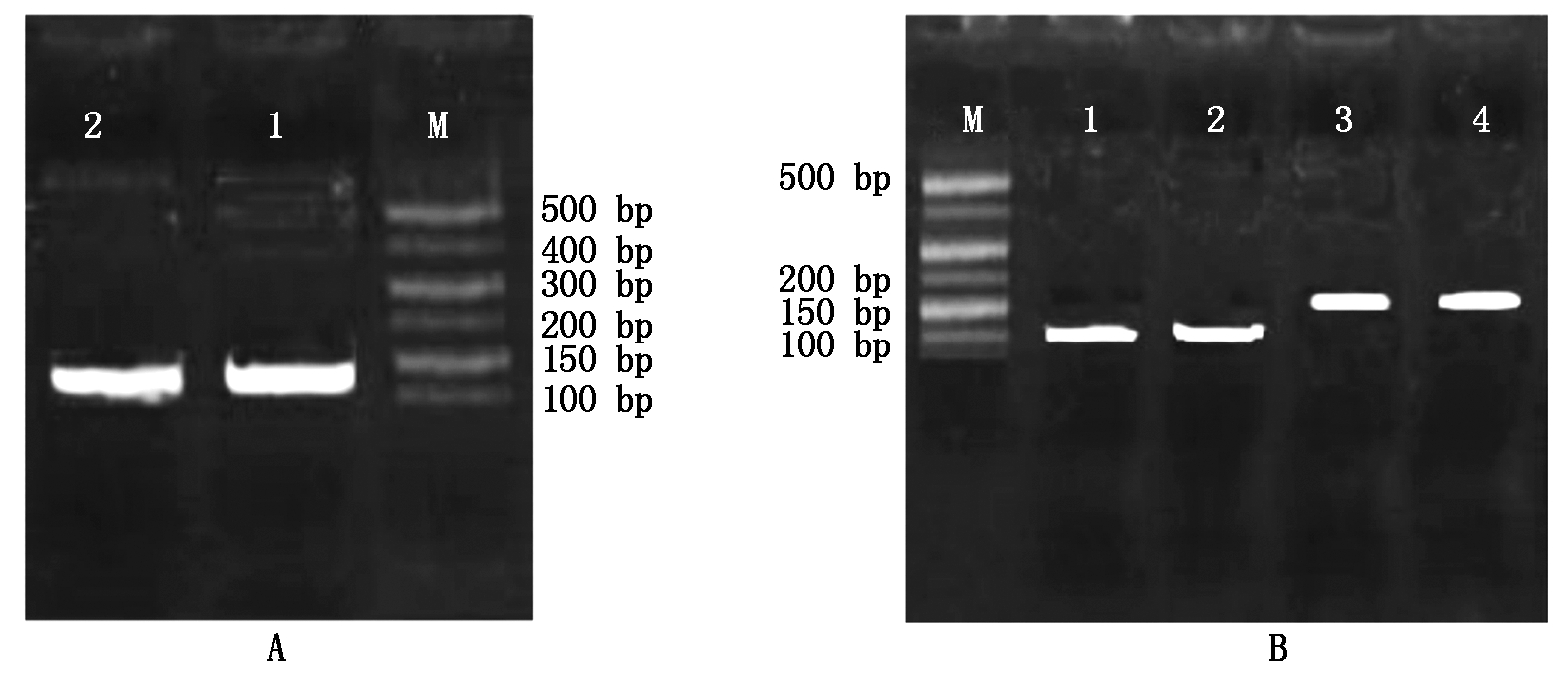
M.500 Marker;1,2.GAPDH扩增条带(A); M.500 Marker;1,2.BMP6扩增条带;3,4.BMPR1B扩增条带(B)。
M.500 Marker;1,2.Reference gene GAPDH amplification band(A);M.500 Marker; 1,2.Target gene amplification band BMP6;3,4.Target gene BMPR1B amplification band(B).
图7 内参基因GAPDH(A)目的基因BMP6、BMPR1B(B)PCR扩增
Fig.7 Amplification products of the reference gene GAPDH(A), target gene BMP6,Chordin(B)
图8为实时荧光定量扩增曲线和溶解曲线,曲线清晰且峰值清晰单一,表明在实时荧光定量PCR过程中得到了特异性的扩增产物,可用来进行定量分析。经共转染后,BMPR1B基因的表达量极显著提高(P<0.01),BMP6基因无明显变化(图9)。
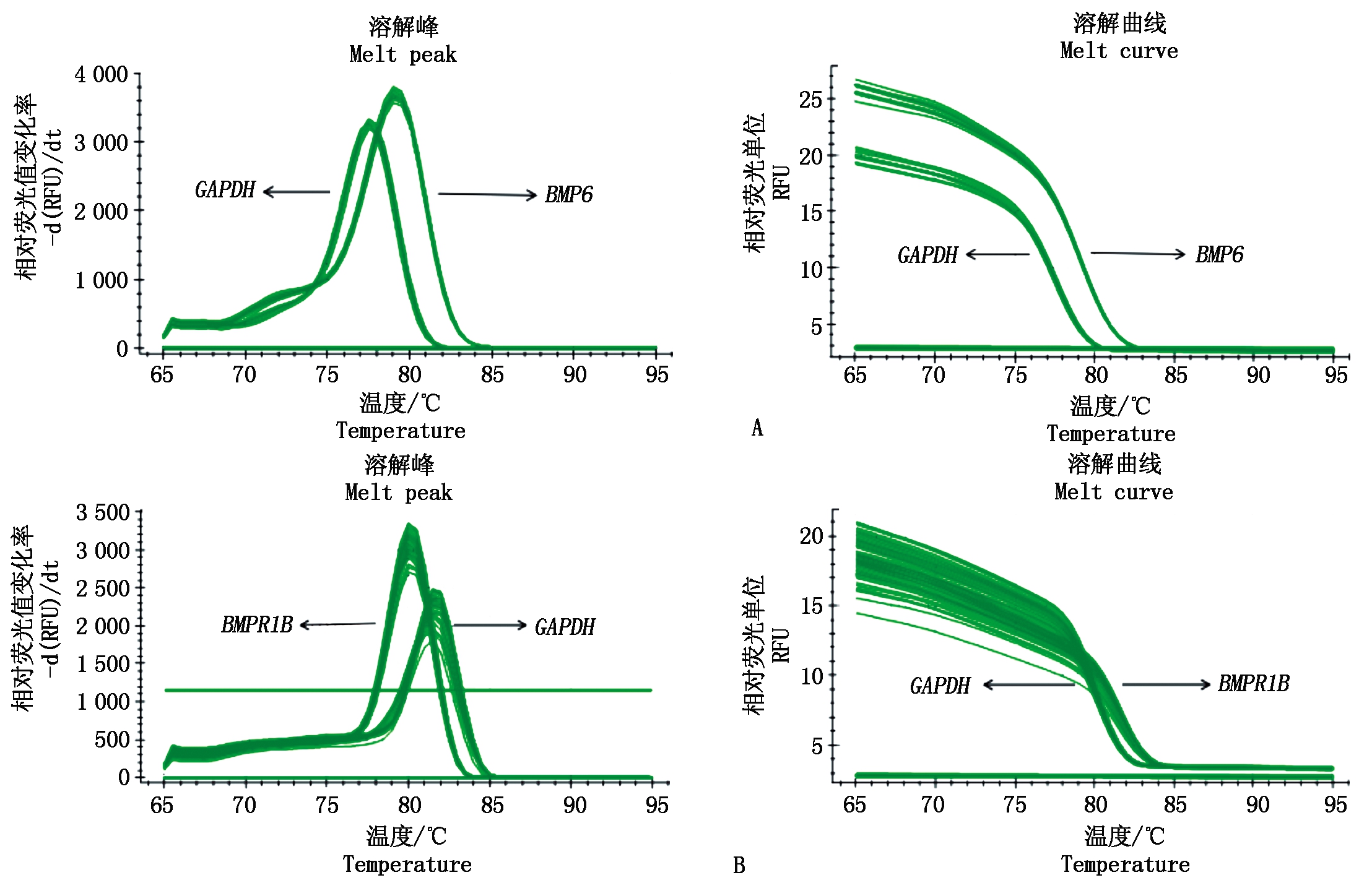
图8 熔解曲线峰值图和扩增曲线图
Fig.8 Peak melting curve and amplification curve
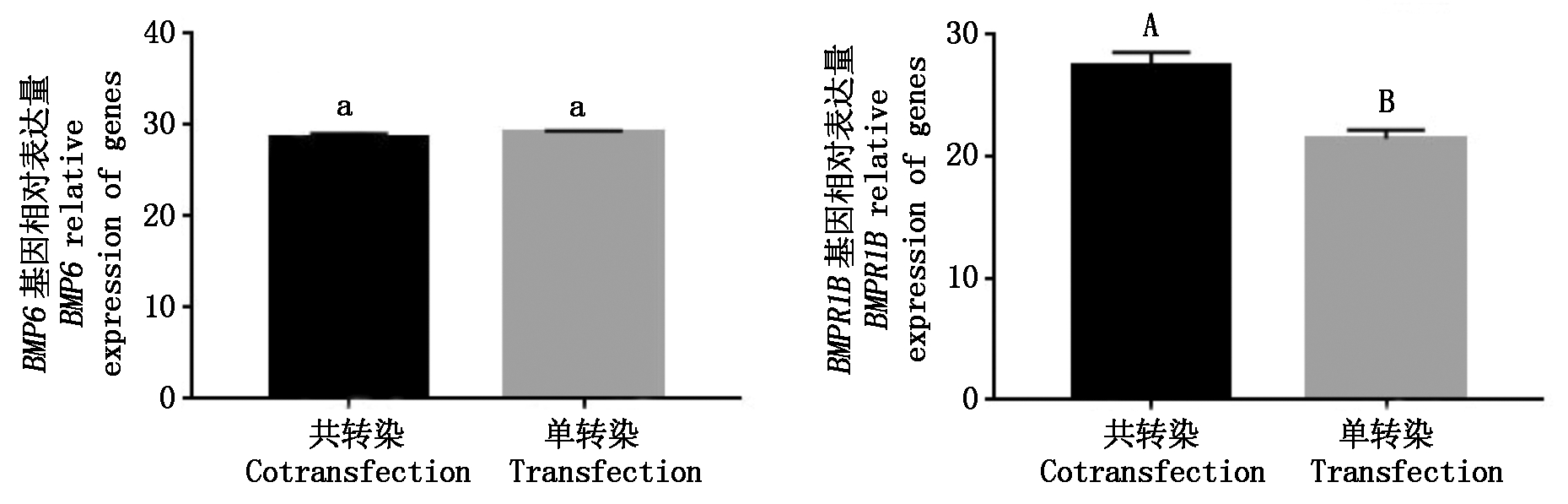
不同大写字母表示差异极显著(P<0.01);相同小写字母表示差异不显著(P>0.05)。图12同。
The different capital letter mean extremely significant difference(P<0.01); The same small letter mean no significant difference(P>0.05).The same as Fig.12.
图9 BMP6、BMPR1B基因mRNA相对表达量
Fig.9 Relative expression of BMP6 and BMPR1B mRNA
2.6 Western Blot检测蛋白的表达
Western Blot结果如图10,其灰度值用Image J软件分析灰度值。由图11可知,经共转染成纤维细胞后BMPR1B蛋白的表达极显著高于单转染组(P<0.01),BMP6蛋白的表达无明显变化,与基因表达结果一致。
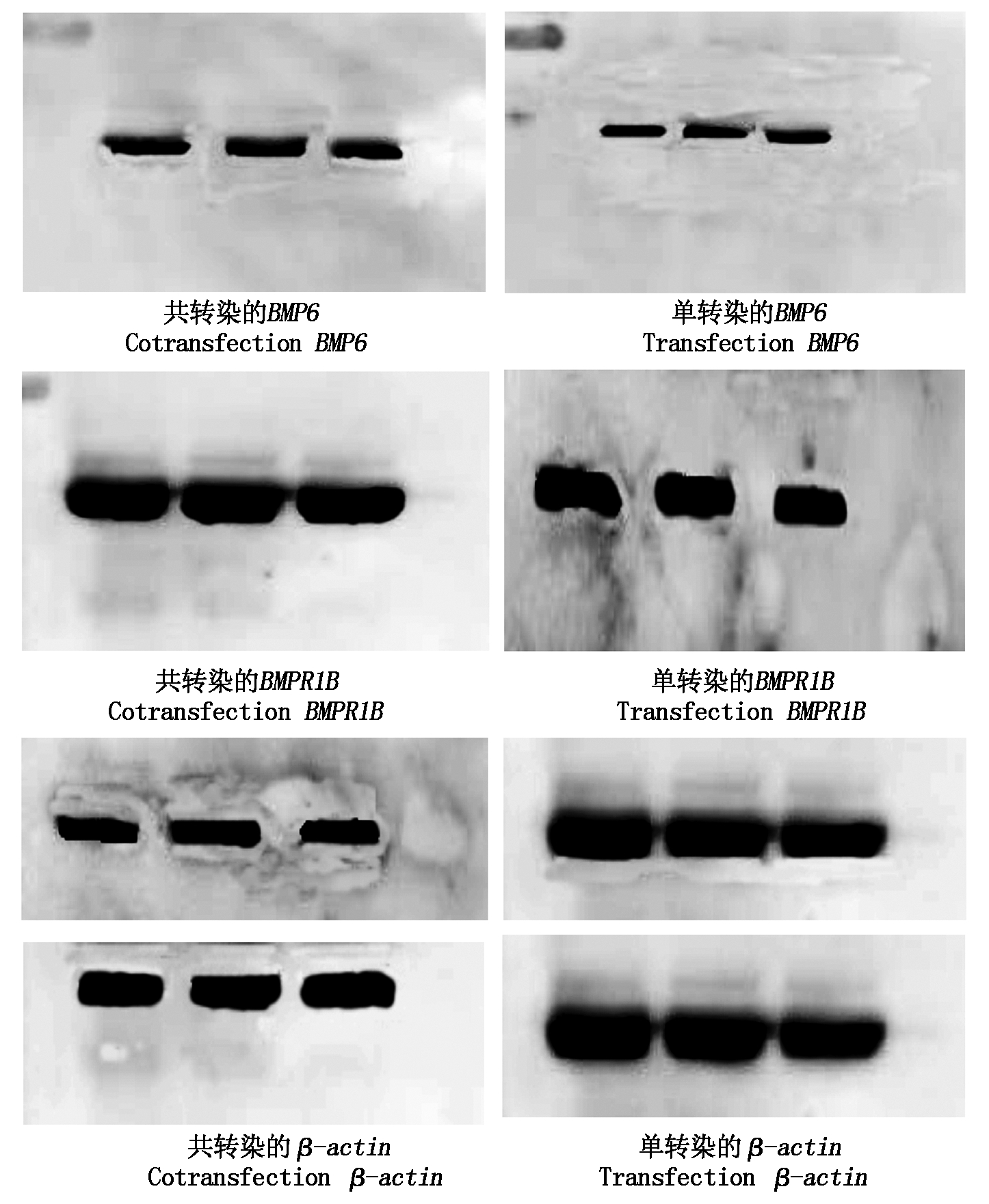
图10 BMP6、BMPR1B蛋白条带
Fig.10 BMP6 and BMPR1B protein bands
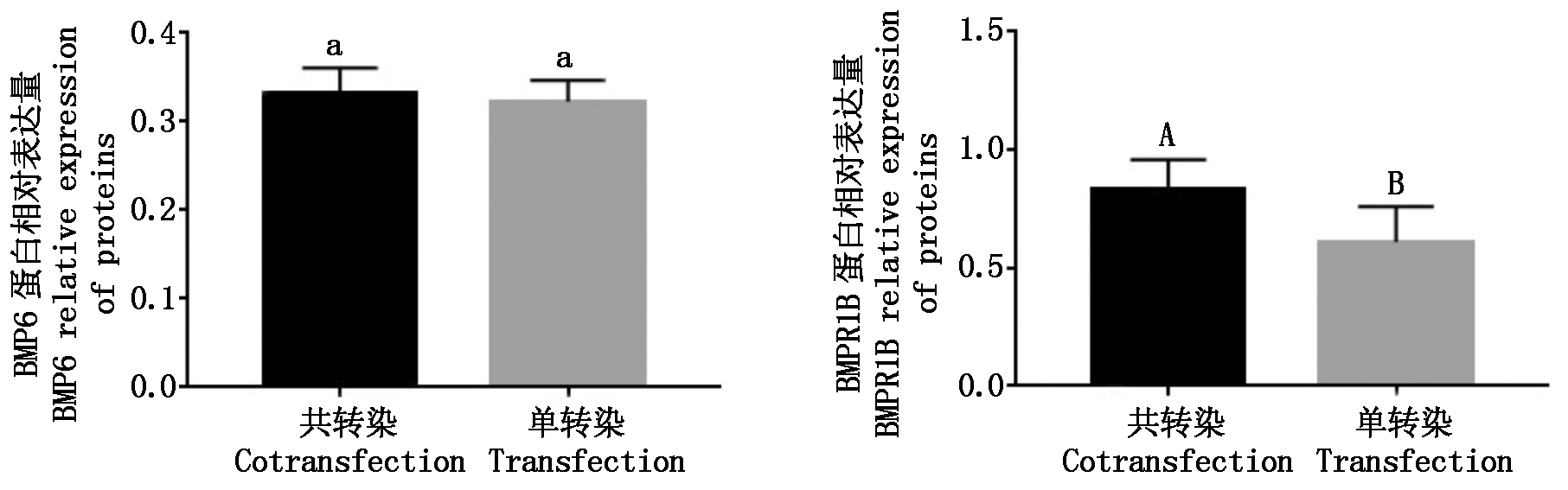
图11 BMP6、BMPR1B蛋白相对表达量
Fig.11 Relative expression of BMP6 and BMPR1B protein
3 讨论和结论
BMP6是BMP家族的一员[16]。文献中已有相关研究,BMP家族在绒山羊毛囊发育的退行期表达量最高,在生长期其表达量会降低,随着毛囊的周期性生长而呈现周期性变化[17],对毛囊的生长发育具一定的抑制作用。McMahon等[18]研究表明,Noggin基因对毛囊的发育具有一定的促进作用,其作用机制是基于抑制BMP基因家族的活性。相关研究证实,在敲除小鼠BMP6基因的受体BMPR1A后,小鼠的毛囊形态发生了改变,严重的甚至导致光秃[19]。而BMPR1B基因也属于BMP信号通路中的一员,因此推测BMP6与BMPR1B这2个基因间可能存在基因的相互作用。对BMPR1B基因的研究就目前来说主要集中在动物的生殖、繁殖等方向。尤其是在排卵过程中有着重要作用,过表达BMPR1B基因的美利奴羊对卵巢颗粒细胞分化、卵泡发育、排卵等有很大影响[20],大大提高了排卵率。但对于BMPR1B基因在细毛羊毛囊中的研究还比较罕见,并且关于BMP6基因与BMPR1B基因间的相互作用目前尚未发现报道。因此,本试验通过对pcDNA3.1-BMP6和pcDNA3.1-BMPR1B载体的构建并将其转染至成纤维细胞,采用实时荧光定量PCR、Western Blot检测其表达,研究两基因间的相互作用,从细胞水平上验证了两基因间的互做以及对细毛羊毛囊的影响。
本研究通过对pcDNA3.1-BMP6、pcDNA3.1-BMPR1B的构建,测定转染成纤维细胞后mRNA及蛋白的表达量。结果表明,共转染成纤维细胞后BMPR1B基因的表达量极显著升高且共转染组的表达量极显著高于单转染组(P<0.01),BMP6共转染组与单转染组表达量近乎相同。由此推断,BMP6基因可能会促进BMPR1B基因的表达,而BMPR1B对BMP6基因的表达几乎没有影响。可为进一步的分子育种工作提供依据。
[1] 刘海山,李恒荣,于洪杰,刘俊茹,张富.敖汉细毛羊品种形成与发展前景[J].当代畜禽养殖业,2001(8):33.doi:10.14070/j.cnki.15-1150.2001.08.033.
Liu H S,Li H R,Yu H J,Liu J R,Zhang F.Breed formation and development prospect of Aohan fine wool sheep[J].Modern Animal Husbandry,2001(8):33.
[2] 柳楠,王春亮,贺建宁,程明,刘开东,刘积凤,赵金山.敖汉细毛羊不同部位皮肤毛囊发育及形态结构研究[J].中国畜牧杂志,2015,51(17):1-5.doi:10.3969/j.issn.0258-7033.2015.17.001.
Liu N,Wang C L,He J N,Cheng M,Liu K D,Liu J F,Zhao J S.Study on skin hair follicle development and morphology of different body parts of Aohan fine wool sheep[J].Chinese Journal of Animal Science,2015,51(17):1-5.
[3] Halloy J, Bernard B A, Loussouarn G, Goldbeter A.Modeling the dynamics of human hair cycles by a follicular automaton[J].Proceedings of the National Academy of Sciences, 2000, 97(15): 8328-8333.doi:10.1073/pnas.97.15.8328.
[4] 马馨,陈洋,姜怀志.哺乳动物毛囊结构特征及调控机制[J].中国草食动物科学,2013,33(1):53-56.doi:10.3969/j.issn.2095-3887.2013.01.015.
Ma X,Chen Y,Jiang H Z.Structural characteristics of hair follicles and its regulation mechanism in mammals[J].China Herbivores,2013,33(1):53-56.
[5] 敖汉细毛羊新品种的培育[J].辽宁农业科学,1972(S2):31-37.
Breeding of a new breed of Aohan fine wool sheep[J].Liaoning Agricultural Sciences,1972(S2):31-37.
[6] Exan R J V, Hardy M H.Aspatial relationship between innervation and the early differentiation of vibrissa folicles in the embryonic mouse[J].Journal of Anatomy, 2008, 131(6): 643-656.
[7] 李树伟.影响绵羊毛纤维与毛囊结构及生产性状的分子机理研究[D].长春:吉林大学,2008.
Li S W.Study on molecular mechanism of wool fiber and hair follicle structure and production traits in sheep[D].Changchun:Jilin University,2008.
[8] Stenn K S, Paus R.Controls of hair follicle cycling[J].Physiol Rev, 2001, 81(1): 449-494.doi:10.1152/physrev.2001.81.1.449.
[9] Andl T,Ahn K,Kairo A,Chu E Y,Wine-Lee L,Reddy S T,Croft N J,Cebra-Thomas J A,Metzger D,Chambon P,Lyons K M,Mishina Y,Seykora J T,Crenshaw E B,Millar S E.Epithelial Bmprla regulates differentiation and proliferation in postnatal hair follicles and is essential for tooth development[J].Development,2004,131(4): 2257-2268.doi:10.1242/dev.01125.
[10] Oryan A,Alidadi S,Moshiri A,Bigham-sadegh A.Bone morphogenetic proteins: A powerful osteoinductive compound with non-negligible side effects and limitations[J].Biofactors, 2014,40(5):459-481.doi:10.1002/biof.1177.
[11] 崔晓,曾维惠,夏育民.毛囊发育与周期性生长的调控信号研究进展[J].中国皮肤性病学杂志,2019,33(9):1081-1084.doi:10.13735/j.cjdv.1001-7089.201901017.
Cui X,Zeng W M,Xia Y M.Advances in molecular mechanisms regulating the development and cycling of hair follicles[J].The Chinese Journal of Dermatovenereology, 2019,33(9):1081-1084.
[12] 毛青青.鼠神经生长因子联合丙种球蛋白治疗小儿脱髓鞘型吉兰-巴雷综合征的临床和神经电生理研究[D].济南:山东大学,2012.
Mao Q Q.Clinical and electrophysiological research on treatment of mouse nerve growth factor and intravenous immunoglobulin for demyelinating type of guillain-barresyndtome in childhood[D].Jinan:Shandong University,2012.
[13] 胡月,史册,刘苍维,闫广兴,郝新青,王爽爽,孙宏晨.Ⅰ型BMP受体ACVR1介导的BMP信号通路在鼠下颌骨发育中的作用[C]//中华口腔医学会口腔生物医学专业委员会.2018全国口腔生物医学学术年会论文汇编.南昌,2018:1.doi:10.26914/c.cnkihy.2019.019761.
Hu Y,Shi C,Liu C W,Yan G X,Hao X Q,Wang S S,Zhou Y J,Sun H C.The role of type I BMP receptor ACVR1-mediated BMP signaling pathway in rat mandibular development[C]//Professional committee of stomatology, Chinese society of stomatology.Proceedings of the 2018 national symposium on stomatology.Professional Committee of stomatology, Chinese stomatology society: Chinese stomatology society,Nanchang,2018:1.
[14] 张梦瑶,杨峰,刘开东,刘积凤,柳楠,贺建宁.利用同源重组构建BMP6基因真核表达载体及在成纤维细胞中表达量的研究[J].中国畜牧杂志,2018,54(8):101-106.doi:10.19556/j.0258-7033.2018.08.101.
Zhang M Y,Yang F,Liu K D,Liu J F,Liu N, He J N.Study on construction of eukaryotic expression vector for BMP6 gene by homologous recombination and its expression in fibroblasts[J].Chinese Journal of Animal Science, 2018,54(8):101-106.
[15] 王小佳,贺建宁,程明,刘开东,刘积凤,柳楠.BMPR1B基因在细毛羊皮肤毛囊中的表达及与羊毛性状关系的研究[J].中国畜牧杂志,2017,53(1):33-38.doi:10.19556/j.0258-7033.2017-01-033.
Wang X J,He J N,Cheng M,Liu K D,Liu J F,Liu N.Expression of BMPR1B gene in skin and its association with wool traits in fine wool sheep[J].Chinese Journal of Animal Science, 2017,53(1):33-38.
[16] Menendez M I,Clark D J, Carlton M, Flanigan D C,Jia G, Sammet S,Weisbrode S E, Knopp M V,Bertone A L.Direct delayed human adenoviral BMP-2 or BMP-6 gene therapy for bone and cartilage regeneration in a pony osteochondral model[J].Osteoarthritis and Cartilage, 2011, 19(8):1066-1075.doi:10.1016/j.joca.2011.05.007.
[17] 谷博.辽宁绒山羊次级毛囊周期性发育相关基因表达的研究[D].长春:吉林农业大学,2013.
Gu B.Study of expression of genes that is related to periodic development of Liaoning cashmere goat secondary follice[D].Changchun:Jilin Agricultural University,2013.
[18] McMahon J A,Takada S,Zimmerman L B,Fan C M,Harland R M,McMahon A P.Noggin-mediated antagonism of BMP signaling is required for growth and patterning of the neural tube and somite[J].Genes Dev,1998,12(10):1438-1452.doi:10.1101/gad.12.10.1438.
[19] Botchkarev V A,Botchkareva N V,Sharov A A,Gilchrest B A,Funa K,Huber O.Modulation of BMP signaling by noggin is required for induction of the secondary(nontylotrich)hair follicle[J].J Invest Dermatol, 2002, 118(1):3-10.doi:10.1046/j.1523-1747.2002.01645.x.
[20] 闫秋良,武斌,曹阳,金海国,马惠海.影响绵羊排卵率的单基因突变[J].当代畜牧,2016(27):45-48.
Yan Q L,Wu B,Cao Y,Jin H G,Ma H H.Effect of mutations in single genes on ovulation rate in sheep[J].Contemporary Animal Husbandry,2016(27):45-48.