小麦赤霉病(Fusarium head blight,FHB)由禾谷镰孢菌(Fusarium graminearum)引起,不仅造成小麦大幅度减产[1],还能产生真菌毒素(Mycotoxin deoxynivalenol),给农业生产、生态造成巨大的损失[2]。其中以脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)毒性最强[3-5],可导致人、畜中毒,还对小麦细胞、组织及种子的萌发有毒害作用。多年来DON污染范围非常广泛,在病菌致病过程中起到重要的作用,被认为是主要的致病因子。因此,DON污染比产量损失更受人们的关注。由于降水增加、秸秆还田等因素,小麦赤霉病在我国小麦各大主产区频繁大面积发生[6],已成为黄淮麦区小麦的主要病害,严重影响小麦的产量和品质[7-8]。
由于抗性资源匮乏,已鉴定和开发的抗病资源有限,传统育种方法未能有效控制小麦赤霉病原菌及其毒素的危害[9]。长期以来,小麦赤霉病的防治以多菌灵、甲基硫菌灵、多酮等化学杀菌剂为主,导致严重的环境污染和生态环境问题,也在一定程度上诱发了病原菌的抗药性和增强产毒量[10]。而生物防治主要是通过微生物间的抗生、竞争、重寄生、溶菌作用及微生物代谢产物诱导植物产生抗病性,从而有效控制镰刀菌的蔓延,还能有效降低DON[11]。生物防治具有不污染环境、对人畜比较安全、防治作用持久、产品无残留、对病原菌杀伤特异性强、易于同其他植物保护措施协调配合并能节约能源等优点。所以生物防治是目前最具潜力并具有良好农药替代效果的植物病害安全防治技术[12]。
内生菌能够参与植物的防卫功能,增强植物抗逆性、抗病害的能力,且种类多、分布广[13],内生菌对植物病害的生物防治及开发应用引起了人们的广泛关注和重视。小麦赤霉病生物防治中生防菌多是从小麦根际土壤中分离得到,从小麦组织中分离拮抗内生菌的报道相对较少[14-15],而且生防菌调控禾谷镰孢菌毒素合成相关报道较为少见。鉴于此,从以上问题着手,以小麦赤霉病为目标病原菌,通过分离河南省邓州市发病小麦的穗部样品,平板对峙法筛选得到1株对禾谷镰孢菌具有强烈抑制作用的贝莱斯芽孢杆菌YB-144菌株,并深入研究其对PH-1孢子、菌丝和DON毒素合成的影响,为持续开发利用拮抗菌株YB-144防治小麦赤霉病和有效控制DON毒素合成提供理论依据。
1 材料和方法
1.1 供试材料
1.1.1 供试植物 2019年,于河南省邓州市河口村小麦田,采集小麦赤霉病发病的穗部,用保鲜袋带回,备用。
1.1.2 供试病原菌 禾谷镰孢菌菌株PH-1由西北农林科技大学许金荣教授团队提供。辣椒炭疽病菌(Colletotrichum capsici)、小麦纹枯病菌(Rhizoctonia cerealis)、花生果腐病菌(Fusarium moniliforme)、小麦根腐病菌(Bipolaris sorokiniana)、棉花枯萎病菌(Fusarium oxysporumf vesinfectum)、黄瓜枯萎病菌(Fusarium oxysporum f.sp. cucumerinum)、芹菜早疫病菌(Alternaria solani)、西瓜枯萎病菌(Fusarium oxysporum f.sp.niveum)、花生白绢病菌(Sclerotium rolfsii Sacc)由河南省农业科学院植物保护研究所分离、保存。
1.1.3 供试培养基 PDA培养基:马铃薯200 g、琼脂20 g、葡萄糖20 g,加无菌水定容到1 000 mL,121 ℃高温高压灭菌;PDB培养基:马铃薯200 g、葡萄糖20 g,加无菌水定容到1 000 mL,121 ℃高温高压灭菌,备用;LB培养基:胰蛋白胨10 g、NaCl 10 g、酵母浸粉5 g、琼脂20 g,加无菌水定容到1 000 mL,121 ℃高温高压灭菌,备用;NA培养基:胰蛋白胨10 g、牛肉膏5 g、NaCl 5 g、琼脂20 g,加无菌水定容到1 000 mL,121 ℃高温高压灭菌,备用;CMC培养基:羧甲基纤维素钠15 g、NH4NO3 1 g、酵母膏1 g、MgSO4·7H2O 0.5 g、KH2PO4 1 g,加无菌水定容到1 000 mL,121 ℃高温高压灭菌,备用;TBI培养基:蔗糖30 g、磷酸钾1 g、MgSO4·7H2O 0.5 g、氯化钾0.5 g、七水硫酸铁10 mg、L-精氨酸871 mg、25 000×微量元素溶液40 μL、植物凝胶0.3 g,加无菌水定容到1 000 mL,121 ℃高温高压灭菌,备用。
1.2 试验方法
1.2.1 小麦内生菌的分离纯化 以采集到的小麦穗部样本作为内生菌的分离对象,称取10 g发病小麦穗部(小穗、穗轴、护颖等),用无菌水冲洗,75%的酒精浸泡2~3 min,再用3%次氯酸钠表面消毒4~5 min,用无菌水洗2~3次,最后放入已灭菌的研钵中研磨,待研碎后,研钵内加入10 mL无菌水,吸取1 mL再依次稀释10-2,10-3,10-4梯度,吸取100 μL于NA培养基平板上涂布,并以最后一次冲洗的无菌水为对照,验证表面消毒效果,每个梯度稀释液及对照各涂3个平板,28 ℃培养2~4 d,根据菌落颜色和形状挑取不同的单菌落进行多次纯化,按照常规方式试管斜面划线后4 ℃保存备用。
1.2.2 小麦赤霉病拮抗内生菌的分离筛选 小麦赤霉病菌拮抗内生菌的筛选采用平板对峙培养法。用已灭菌的打孔器(6 mm)从活化好的菌株PH-1平板上打孔,无菌牙签挑取菌饼将菌丝朝下反接于PDA平板上,于恒温培养箱28 ℃环境下倒置培养,24 h后待菌丝开始蔓延时,用灭菌牙签蘸取微量上述保存的内生菌单菌落,对称点接在距离菌饼20 mm处,并设置对照组(未接内生菌的平板),28 ℃恒温培养5 d,待对照组长满后,比对试验组有无抑菌圈出现,并测量抑菌圈半径。为了保证试验数据的可靠性,还需进行平板对峙复筛。选择抑菌距离在5 mm以上的内生菌进行复筛,筛选出拮抗性最强且拮抗性能稳定的细菌,对具有抑菌能力的菌株进行试管斜面划线后4 ℃保存备用。
1.2.3 小麦赤霉病拮抗内生菌的鉴定 依据菌体形态特征及生理生化指标进行鉴定,参照《伯杰氏细菌鉴定手册》(第8版)[16],判断菌株YB-144的分类地位。按照细菌基因组DNA快速抽提试剂盒说明书提取菌株YB-144的基因组DNA,并以菌株YB-144的基因组DNA为模板,采用细菌通用引物27-F(5′-AGAGTTTGATCCTGGCTCAG-3′)/1492-R(5′-GGTTACCTTGTTACGACTT-3′)扩增其16S rDNA基因序列。PCR产物由生工生物工程(上海)股份有限公司进行测序,测序结果用Blast软件与GenBank中的已知序列进行比对。采用Mega 4.0软件对菌株YB-144进行系统发育树构建。通过上述形态特征、生理生化指标以及分子特征初步判定该菌株分类地位。
1.2.4 菌株YB-144抑菌谱测定 参照1.2.2的方法测定菌株YB-144对辣椒炭疽病菌、小麦纹枯病菌、花生果腐病菌、小麦根腐病菌、棉花枯萎病菌、黄瓜枯萎病菌、芹菜早疫病菌、西瓜枯萎病菌、花生白绢病菌9种植物病原菌的拮抗特性。
1.2.5 菌株YB-144对菌株PH-1菌丝和孢子形态的影响 将菌株YB-144与PH-1在PDA平板上进行对峙培养,以只接种菌株PH-1的PDA平板为对照组,28 ℃倒置培养4 d。待对照组菌丝长满培养基后,分别挑取处理组抑菌带周围菌丝和对照组菌落边缘菌丝,用无菌水清洗2~3次,在显微镜下观察菌丝形态。
将菌株PH-1接种于PDA平板上,28 ℃、倒置培养3~5 d,待长满后,用无菌牙签挑取菌丝接种于装有CMC培养基摇瓶中,28 ℃、150 r/min培养3~5 d,用已灭菌的擦镜纸过滤收集孢子液,无菌水漂洗3~4次,加到PDB培养基中,终含量为105个/mL,再将提前摇好的YB-144菌液加到上述含有PH-1孢子液的PDB培养基中,终含量为106个/mL,25 ℃培养15 h,分别在不同时间段观察孢子萌发情况,以加等量的PDB液体替代拮抗菌菌液为对照,重复3次,计算孢子萌发率。
1.2.6 菌株YB-144对PH-1中DON合成的影响 将菌株PH-1 接种于PDA平板上,28 ℃倒置培养5 d,按照1.2.5方法诱导孢子,收集孢子液,无菌水漂洗2~3次,加到TBI培养基中,终含量为104个/mL。再将提前摇好的菌株YB-144加到上述含有PH-1孢子液的TBI培养基中,终含量为106个/mL,25 ℃培养3 d用DON毒素测定试剂盒(Beacon公司),并按说明进行DON毒素检测,以单独在TBI培养基中培养的PH-1为对照,每个处理重复3次。
上述测定DON含量的同时,收集3 d时的培养物,RNA提取参照Yang等[17]的方法,利用TRIzol试剂,cDNA通过TaKaRa公司的cDNA反转录试剂盒(PrimeScriptTM RT reagent Kit)。根据 DON 合成途径中Tri3、Tri5、Tri8基因CDS 序列设计引物[18-19],由生工生物工程(上海)合成引物,并以上述cDNA为模板,Tubulin基因作为内参基因,利用TaKaRa公司RT-PCR反应试剂盒(SYBR®Premix Ex TaqTM)进行荧光定量PCR。基因的相对表达量通过2-ΔΔCt方法计算[20]。
2 结果与分析
2.1 小麦赤霉病拮抗内生菌的筛选
从小麦穗部样品中共分离得到256株内生细菌,平板对峙结果表明,共有78株细菌在PDA培养条件下均表现出对菌株PH-1的拮抗作用,占所得分离细菌总数的30.5%,对得到的78株细菌进行复筛,平板对峙结果发现有8株菌株(YB-144、XH-16、XH-89、XH-25、XH-43、XH-22、XH-1、XH-143)对菌株PH-1有较好的抑制作用。XH-48复筛结果发现对菌株PH-1无抑制效果(图1-A),其中,菌株YB-144对菌株PH-1的抑制作用最强,抑菌带为13.6 mm, 抑制率为71.9%(图1-B)。菌株XH-16、XH-43、XH-89、XH-25、XH-22、XH-1、XH-143对PH-1也有一定的抑制作用,抑菌带宽度分别为11.2,10.7,10.4,10.2,9.7,8.3,9.8 mm,因此,选择菌株YB-144进行进一步试验研究。
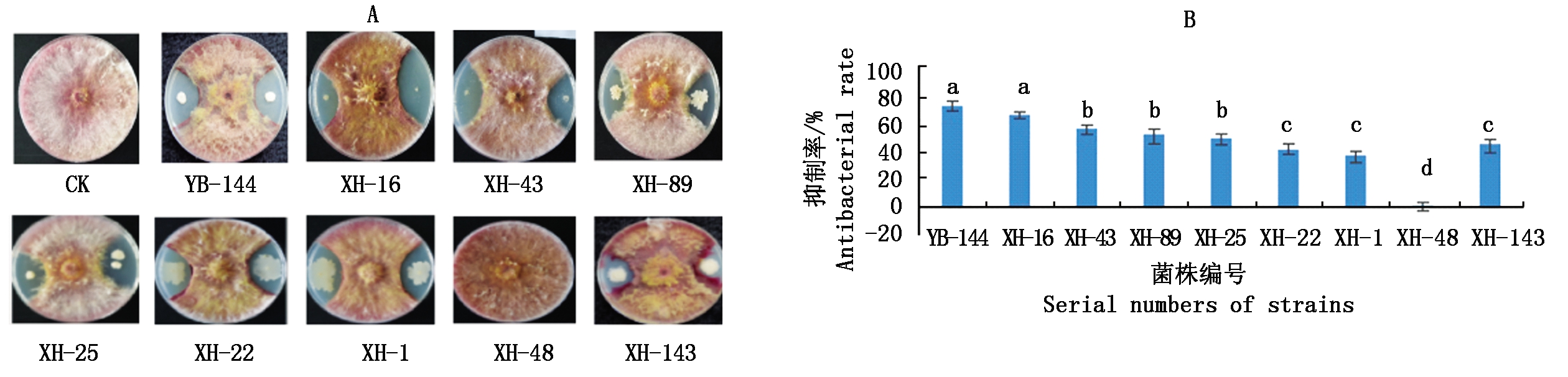
不同小写字母表示差异显著(P<0.05)。图5同。
Different lowercase letters indicate significant differences(P<0.05).The same as Fig.5.
图1 筛选抑制菌株PH-1生长有效菌株(A)及抑制率(B)
Fig.1 Screening of effective strain for growth inhibition(A)and antibacterial rate(B)of PH-1
采用平板对峙法对1.1.2中的9种植物病原真菌的拮抗效果进行测定,结果如表1所示,表现出较为广谱的抑菌效果,其中对小麦纹枯病菌和小麦根腐病菌的抑制效果最好,抑菌带宽度分别为10,8 mm,对芹菜早疫病菌、西瓜枯萎病菌、辣椒炭疽病菌、花生果腐病菌、黄瓜枯萎病菌的抑制效果一般,抑菌带宽度分别6.7,4.1,7.0,5.0,4.5 mm,对花生白绢病菌和棉花枯萎病菌的抑制效果最弱,抑菌带宽度只有0.6,2.5 mm。表明菌株YB-144有一定的广谱抑菌性(图2)。

A.花生果腐病菌;B.辣椒炭疽病菌;C.棉花枯萎病菌;D.小麦纹枯病菌;E.西瓜枯萎病菌。
A.F.moniliforme;B.Colletotrichum capsici;C.Fusarium oxysporumf vesinfectum;D.Rhizoctonia cerealis;E.Fusarium oxysporum f.sp. niveum.
图2 菌株YB-144对主要病原菌抑菌效果
Fig.2 Bacteriostatic effect of strain YB-144 on main pathogenic fungi
表1 菌株YB-144对不同病原菌的抑菌作用
Tab.1 Effect of YB-144 on different pathogenic bacteria
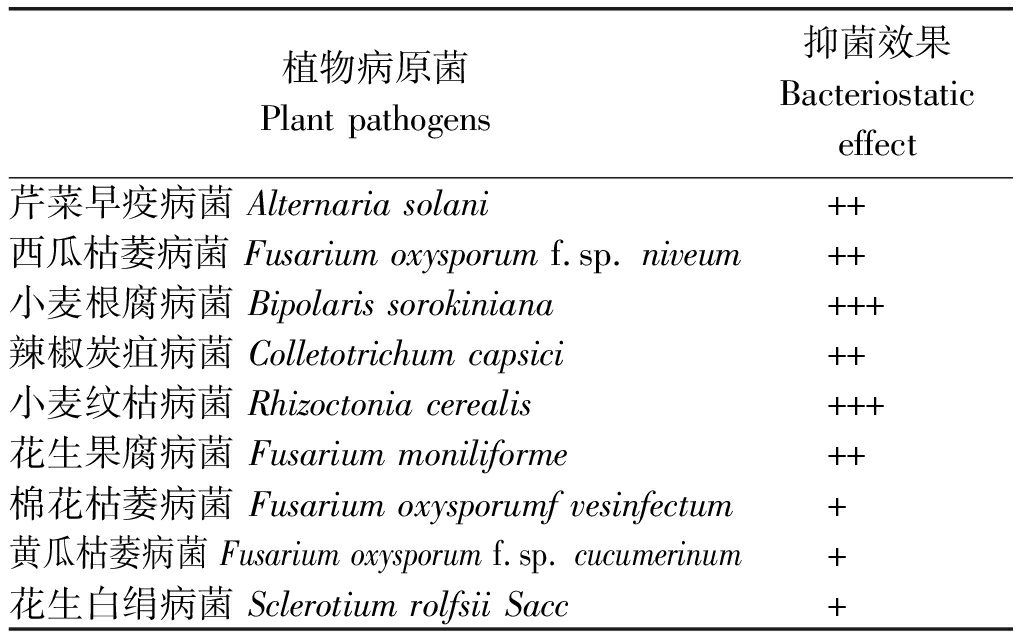
植物病原菌Plantpathogens抑菌效果Bacteriostaticeffect芹菜早疫病菌Alternariasolani++西瓜枯萎病菌Fusariumoxysporumf.sp.niveum++小麦根腐病菌Bipolarissorokiniana+++辣椒炭疽病菌Colletotrichumcapsici++小麦纹枯病菌Rhizoctoniacerealis+++花生果腐病菌Fusariummoniliforme++棉花枯萎病菌Fusariumoxysporumfvesinfectum+黄瓜枯萎病菌Fusariumoxysporumf.sp.cucumerinum+花生白绢病菌SclerotiumrolfsiiSacc+
注:+++.抑菌带7~10 mm;++.抑菌带4~7 mm;+.抑菌带1~4 mm。
Note:+++.Bacteriostasis zone was 7-10 mm;++.Bacteriostasis zone was 4-7 mm;+.Bacteriostasis zone was 1-4 mm.
2.2 菌株YB-144对菌株PH-1孢子和菌丝的影响
与对照组相比,在PDA和PDB培养基中,与菌株PH-1共培养的菌株YB-144均可以显著抑制PH-1的生长。为了解潜在的作用模式,在显微镜下观察孢子和菌丝形态,显微镜下可看到孢子萌发率显著下降,共培养15 h后孢子萌发抑制率可达81.67%(表2),对照组孢子形态完好,无畸形产生(图3-A),处理组孢子变畸形、异常膨大并且还有部分溶解现象(图3-B)。显微镜下对照组PH-1菌丝表面光滑、饱满(图3-C),处理组PH-1菌丝出现异常膨胀、肿胀和部分溶解(图3-D),这些结果表明,菌株YB-144能够影响菌丝PH-1孢子萌发和菌丝生长。
表2 菌株YB-144对PH-1孢子萌发的抑制作用
Tab.2 Inhibitory effect of strain YB-144 on spore germination of PH-1 %
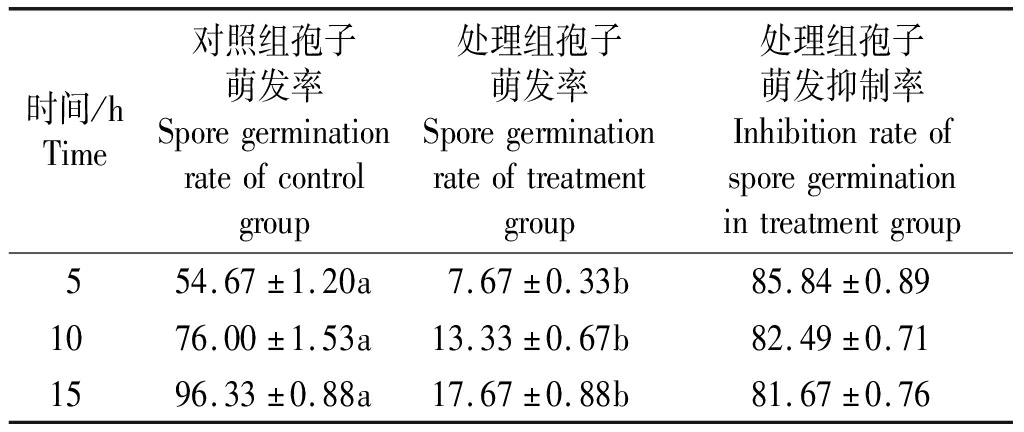
时间/hTime对照组孢子萌发率Sporegerminationrateofcontrolgroup处理组孢子萌发率Sporegerminationrateoftreatmentgroup处理组孢子萌发抑制率Inhibitionrateofsporegerminationintreatmentgroup554.67±1.20a7.67±0.33b85.84±0.891076.00±1.53a13.33±0.67b82.49±0.711596.33±0.88a17.67±0.88b81.67±0.76
注:同行数据后小写字母表示差异显著(P<0.05)。
Note:Lowercase letters after peer data indicate significant differences(P<0.05).
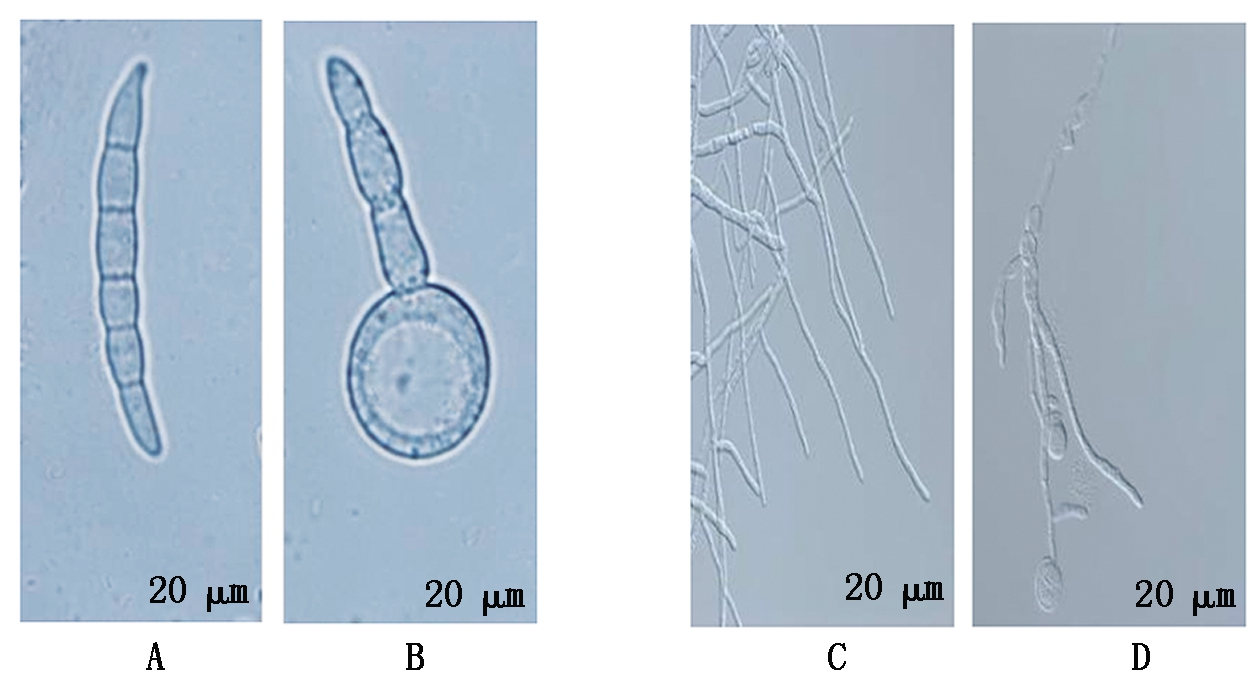
A,C.对照;B,D.处理。
A,C.Control;B,D.Treatment.
图3 菌株YB-144对菌株PH-1孢子、菌丝的影响
Fig.3 Effects of strain YB-144 on spores,hyphae of strain PH-1
2.3 菌株YB-144的鉴定
将复筛效果较好的菌株YB-144接种于LB平板中,于28 ℃下培养1 d,观察其菌落形态和颜色。菌株YB-144在LB培养基上生长良好,菌落呈乳白色,未见有色素产生,菌落形态不规则,表面有隆起,且形成不规则的褶皱。培养24 h后产生轻微腥臭气味,挑起时菌落成一团且有黏液。
如表3所示,菌株YB-144为革兰氏阳性菌,V-P试验、过氧化氢酶、淀粉水解、明胶水解等生理生化试验呈阳性,柠檬酸盐利用、吲哚试验、甲基红试验等生理生化试验呈阴性。
表3 菌株YB-144的生理生化特征
Tab.3 Physiological and biochemical characteristics of strain YB-144
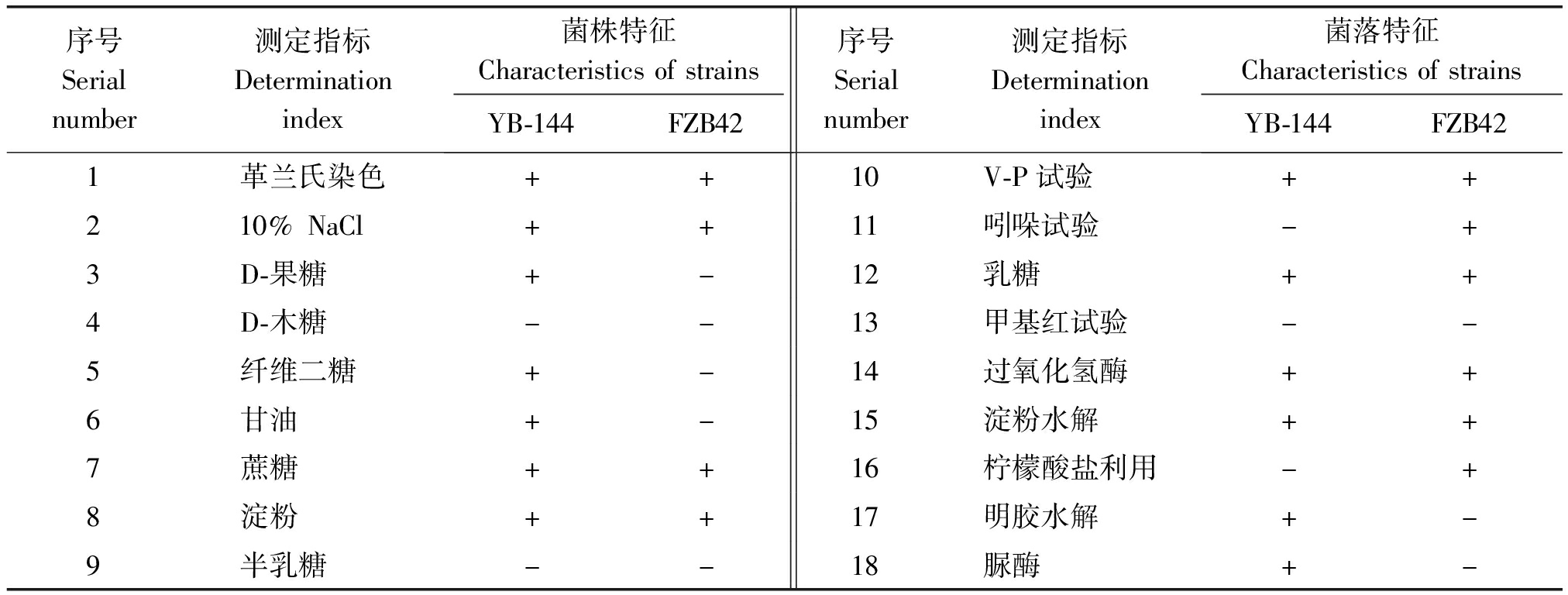
序号Serialnumber测定指标Determinationindex菌株特征CharacteristicsofstrainsYB-144FZB42序号Serialnumber测定指标Determinationindex菌落特征CharacteristicsofstrainsYB-144FZB421革兰氏染色++10V-P试验++210%NaCl++11吲哚试验-+3D-果糖+-12乳糖++4D-木糖--13甲基红试验--5纤维二糖+-14过氧化氢酶++6甘油+-15淀粉水解++7蔗糖++16柠檬酸盐利用-+8淀粉++17明胶水解+-9半乳糖--18脲酶+-
注:+.阳性反应;-.阴性反应;-.未见报道
Note: +.Positive reaction;-.Negative reaction;-.No reports.
将菌株YB-144序列与GenBank数据库中相关序列进行Blast分析, 结果显示,有130个与该序列匹配的同源序列,选取同源性较高且具有代表性菌株的16S rDNA 序列构建系统发育树, 如图4所示,菌株YB-144与贝莱斯芽孢杆菌(FZB42)处于进化树中的同一分支。综合上述形态学、生理生化特征以及菌株YB-144和相关菌株16S rDNA序列同源性分析结果, 将菌株YB-144初步鉴定为贝莱斯芽孢杆菌。
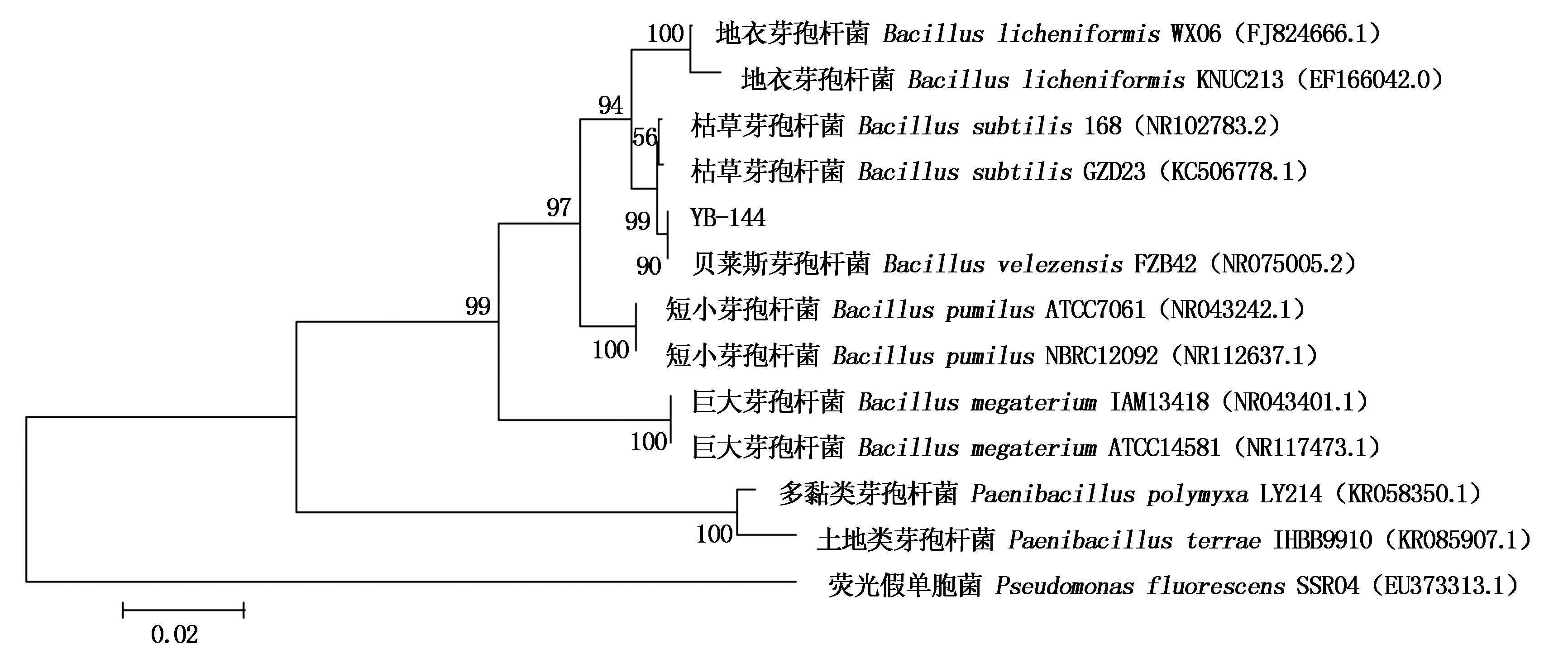
图4 菌株YB-144依据16S rDNA基因序列的系统发育树
Fig.4 Phylogenetic tree of strain YB-144 based on 16S rDNA gene sequence
2.4 菌株YB-144对菌株PH-1DON产毒能力及其产毒基因表达的影响
菌株PH-1在和YB-144共培养3 d之后,其DON含量要显著低于菌株PH-1单独培养(图5-A),单独培养的菌株PH-1 DON含量达到118.3 μg/mL,而当菌株PH-1与菌株YB-144共培养之后的DON含量显著降低,只有39.5 μg/mL,与对照组相比DON含量下降了66.6%。此外,当菌株PH-1与菌株YB-144共培养之后其DON合成相关基因Tri3、Tri5、Tri8的相对表达量水平显著低于PH-1单独处理(图5-B),相对表达量下降幅度最大的是Tri5基因,表现出5.0倍的下调,Tri3、Tri8基因也表现出不同程度的下降,分别表现出1.6,1.2倍的下调。Tri5是编码DON合成酶的关键基因,Tri5基因编码单端孢霉二烯合酶是DON生物合成途径的第一步反应,Tri5基因的缺失会减弱小麦赤霉菌的毒性和降低其致病力。这表明,在共培养期间菌株YB-144可以降低这些与DON生物合成相关基因的表达,而DON生物合成相关基因表达的降低可能是菌株PH-1共培养中DON积累减少的原因。
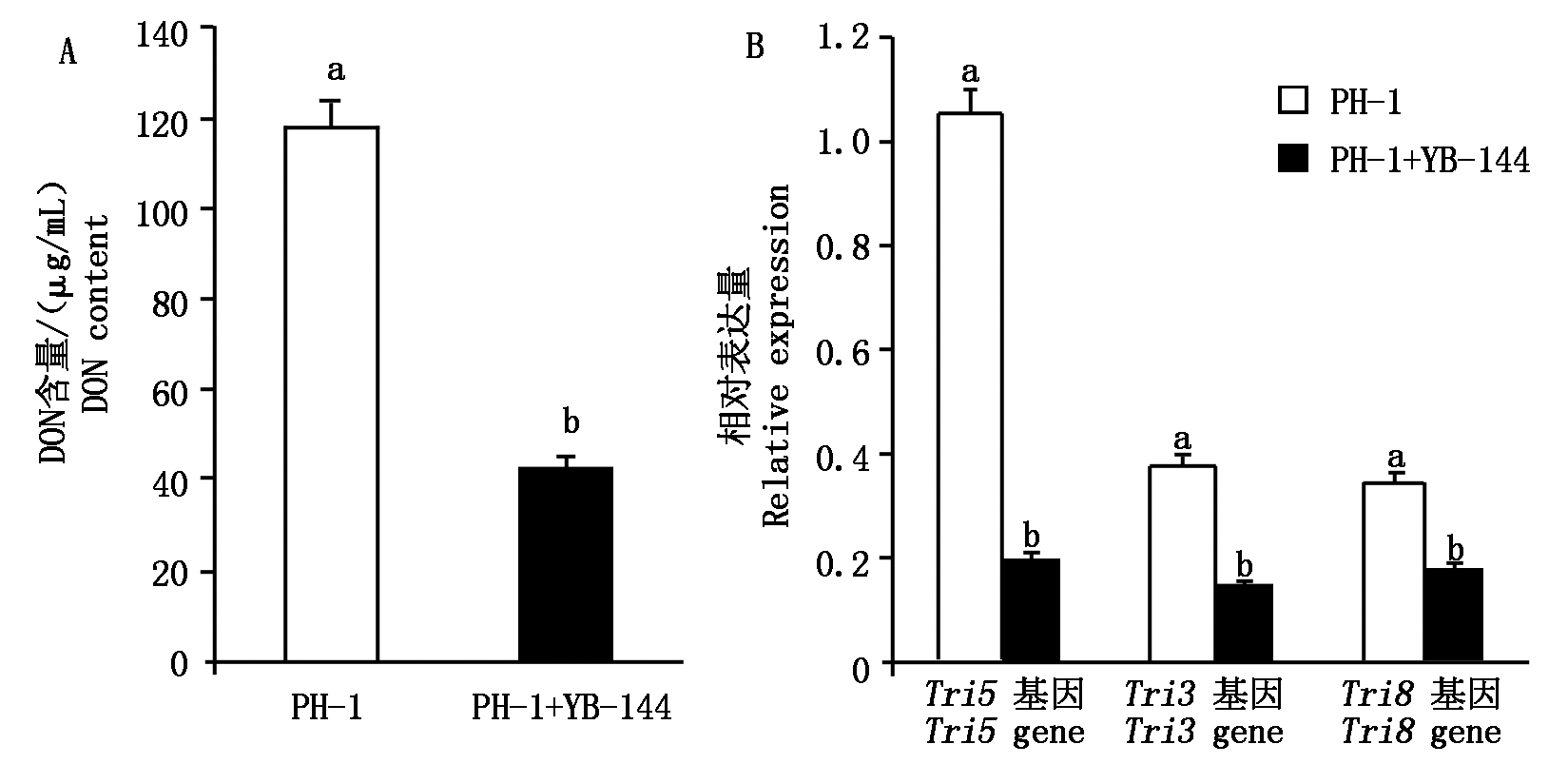
图5 菌株YB-144对菌株PH-1 DON含量(A)和DON合成基因(B)的影响
Fig.5 The effects of strain YB-144 on PH-1 DON content(A)and DON synthesis gene(B)
3 结论与讨论
近年来,微生物农药的特性和发展趋势与人类生态环境、食品安全和生物多样性具有良好的相融性,加上现代微生物工业化生产技术体系日趋完善,微生物农药的研究开发引起了广泛的关注和重视[21-22]。从各种农作物中分离得到多株对禾谷镰孢等病原真菌具有拮抗作用的菌株,其中以生防细菌最多,而生防细菌中又以芽孢杆菌、放线菌和假单胞菌研究的最为深入[23],如枯草芽孢杆菌和解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。1945年,Johnson等[24]最早发现枯草芽孢杆菌能够产生抑制禾谷镰孢菌生长的抗菌物质。此后, 萎缩芽孢杆菌(Bacillus atrophaeus)、解淀粉芽孢杆菌、蜡状芽孢杆菌(Bacillus cereus)、地衣芽孢杆菌(Bacillus licheniformis)和短小芽孢杆菌(Bacillus pumilis)等多种芽孢杆菌均被相继发现对禾谷镰孢具有拮抗作用[25]。由于芽孢杆菌体积大,繁殖速度快,抵抗外界有害因子能力强,广泛应用于田间[26]。本研究以小麦赤霉病发病较重的河南邓州市采集的小麦穗部样品中筛选得到的256个菌株为基础,通过平板对峙法筛选得到1个对菌株PH-1具有良好的抑制效果的YB-144,通过形态特征、生理生化特征和分子生物学鉴定为贝莱斯芽孢杆菌。并且选择9种病原菌鉴定了其抑菌谱,发现不仅对禾谷镰孢菌有良好的抑制效果,对小麦纹枯病菌、根腐病菌等也有良好的拮抗特性。说明菌株YB-144具有广谱的抑菌效果,可作为生防资源应用在多种病害的防治工作中。
除此之外,禾谷镰孢菌产生的真菌毒素也引起人们的广泛关注,镰孢菌侵染作物后可产生多种真菌毒素,主要为DON和玉米赤霉烯酮(ZEN)。其中DON是粮食作物中危害较严重、最常见的真菌毒素。研究表明,禾谷镰孢侵染不仅造成作物品质和产量的降低,更为严重的是产生DON毒素危害人畜健康。He等[27]通过室内筛选得到2 株多黏类芽孢杆菌(Paenibacillus polymyxa)W1-14-3 和 C1-8-b,2株菌株均分离自麦穗且适应麦穗中的生长条件,在温室试验中2个菌株均高效抑制赤霉病侵染和毒素的产生,抑制率分别为56.5%,55.4%,对DON 的抑制率分别为84.8%,89.4%,百粒质量的增长率分别为56.5%,66.9%。Schisler等[28]分离得到1株枯草芽孢杆菌AS43.3,该菌株在不同小麦品种中均可抑制赤霉病发病,温室试验中抑制率最高达90%以上。国内也有较多相关报道,刘伟成等[29]从小麦植株上分离筛选到8株拮抗性芽孢杆菌,其中7株是枯草芽孢杆菌,抑菌活性最强的菌株B08对禾谷镰孢菌的防治效果达到65%以上,周苗苗等[30]从离体的麦穗上分离得到的1株细极链格孢菌KMN-1,该菌株的发酵产物对小麦赤霉病的保护和治疗作用防治效果分别为78.13%,76.52%,与多菌灵的防效相当,具有广泛的应用前景。
本研究报道的贝莱斯芽孢杆菌YB-144对小麦赤霉病菌的拮抗特性较好,处理组菌株YB-144与菌株PH-1共培养15 h之后孢子萌发抑制率达到81.67%,与PH-1单独培养相比明显降低,抑制孢子的萌发也可做到赤霉病的早期防治。在菌株YB-144与PH-1共培72 h之后其DON含量和PH-1单独培养相比显著下降,只有39.5 μg/mL,而PH-1单独培养DON含量达到118.3 μg/mL。表明菌株YB-144能显著降低禾谷镰孢菌中DON的积累,并且通过RT-PCR显示,菌株PH-1在与YB-144共培养之后,其与DON合成相关基因Tri3、Tri5、Tri8的相对表达量与PH-1单独培养相比也有下降,其中Tri5基因的相对表达量差别最大,与PH-1单独培养相比有5.0倍的下调。芽孢杆菌的生物活性与其次生代谢物有密切联系,其中的抗菌肽、脂肽类抗生素以及水解酶类对许多植物病原体有防控作用,芽孢杆菌对植物病原菌的防控作用与其抑菌肽合成基因(bmy B、fen D、itu C、srf A和bac A)有关[31],胡晓丹等[32]采用硫酸铵法沉淀拮抗菌枯草芽孢杆菌AF0907拮抗蛋白后,用DEAE-52离子交换层析分离纯化拮抗蛋白,得到对小麦赤霉病菌具有抑制作用的纯蛋白。本研究获得的拮抗内生菌YB-144是否通过分泌上述某些活性物质对禾谷镰孢菌的孢子、菌丝和DON起到抑制作用,也需进一步验证查明。在未来的生防菌研究与应用中,这种直接作用、时间短、效果明显的菌株有较大的发展潜力。
[1] McMullen M, Jones R, Gallenberg D.Scab of wheat and barley: A re-emerging disease of devastating impact[J].Plant disease, 1997, 81(12): 1340-1348.doi:10.1094/PDIS.1997.81.12.1340.
[2] Kang Z S, Buchenuer H, Huang L L, Han Q M, Zhang H C.Cytological and immunocyto-chemical studies on responses of wheat spikes of the resistant Chinese cv.Sumai 3 and the susceptible cv.Xiaoyan 22 to infection by Fusarium graminearum[J].European Journal of Plant Pathology, 2007, 120(4): 383-396.doi:10.1007/s10658-007-9230-9.
[3] Jiang C, Zhang C K, Wu C L, Sun P P, Hou R, Liu H Q, Wang C F, Xu J R.TRI6 and TRI10 play different roles in the regulation of deoxynivalenol(DON)production by cAMP signalling in Fusarium graminearum[J].Environmental Microbiology, 2016, 18(11): 3689-3701.doi:10.1111/1462-2920.13279.
[4] Tralamazza S M, Bemvenuti R H, Zorzete P, Garcia F S, Corrêa B.Fungal diversity and natural occurrence of deoxynivalenol and zearalenone in freshly harvested wheat grains from Brazil[J].Food Chemistry, 2016, 196:445-450.doi:10.1016/j.foodchem.2015.09.063.
[5] Zhang J B, Wang J H, Gong A D, Chen F F, Song B, Li X, Li H P, Peng C H, Liao Y C.Natural occurrence of Fusarium head blight, mycotoxins and mycotoxin-producing isolates of Fusarium in commercial fields of wheat in Hubei[J].Plant Pathology, 2013, 62(1): 92-102.doi:10.1111/j.1365-3059.2012.02639.x.
[6] 程志伟.小麦赤霉病防治误区及综合防控技术[J].种业导刊, 2017(3): 24-25.doi:10.3969/j.issn.1003-4749.2017.03.010.
Cheng Z W.Misunderstanding and integrated control technology of wheat scab[J].Seed Industry Guide, 2017(3): 24-25.
[7] 杜晓昱.禾谷镰孢产毒分析及其毒素检测方法的研究[D].福州:福建农林大学, 2005.doi:10.7666/d.y775052.
Du X Y.Study on analysis of Fusarium graminearum toxin production and detection method of its toxin[D].Fuzhou: Fujian Agriculture and Forestry University, 2005.
[8] Bai G H, Gregory S.Management and resistance in wheat and barley to Fusarium head blight[J].Annual Review of Phytopathology, 2004, 42(1): 135-161.doi:10.1146/annurev.phyto.42.040803.140340.
[9] Xiong K H, Hu W, Wang M J, Wei H, Chen B C.A survey on contamination of deoxynivalenol and zearalenol in maize and wheat from Anhui and Henan Province[J].Food Science, 2009, 30(20): 265-268.doi:10.7506/spkx1002-6300-200920056.
[10] 何慧慧, 李力, 韩小贤, 郑学玲, 卞科.河南省市售小麦粉微生物及真菌毒素污染状况研究[J].粮食与油脂, 2015, 28(12): 64-66.doi:10.3969/j.issn.1008-9578.2015.12.018.
He H H, Li L, Han X X, Zheng X L, Bian K.Study on microorganism and mycotoxins contamination situation of commercial wheat flour in Henan Province[J].Cereals and Oils, 2015, 28(12): 64-66.
[11] Miedaner T, Korzun V.Marker-assisted selection for disease resistance in wheat and barley breeding[J].Phytopathology, 2012, 102(6): 560-566.doi:10.1094/PHYTO-05-11-0157.
[12] 刘昆昂, 黄亚丽, 贾振华, 马宏, 宋水山.拮抗灰霉病菌的芽孢杆菌筛选、鉴定及其代谢产物抑菌效果研究[J].华北农学报, 2020, 35(3): 200-207.doi:10.7668/hbnxb.20190756.
Liu K A, Huang Y L, Jia Z H, Ma H, Song S S.Screening and identification of Bacillus sp.and its metabolites inhibitory effect against Botrytis cinerea[J].Acta Agriculturae Boreali-Sinica, 2020, 35(3): 200-207.
[13] 邹文欣,谭仁祥.植物内生菌研究新进展[J].植物学报,2001,43(9):881-892.doi:10.3321/j.issn:1672-9072.2001.09.001.
Zou W X, Tan R X.Recent advances on endophyte research[J].Acta Botanica Sinica, 2001,43(9):881-892.
[14] 周清, 舒宪, 王钰婷, 李明浩, 汤才国, 倪军, 赵薇薇, 黄胜威, 吴丽芳.一株小麦赤霉病拮抗菌的筛选鉴定及防治效果分析[J].生态科学, 2019, 38(3): 64-70.doi:10.14108/j.cnki.1008-8873.2019.03.008.
Zhou Q, Shu X, Wang Y T, Li M H, Tang C G, Ni J, Zhao W W, Huang S W, Wu L F.Screening of antagonistic strain against Fusarium head blight and its inhibition efficiency[J].Ecological Science, 2019, 38(3): 64-70.
[15] 杨凤, 张玲利, 王东梅, 刘燕, 周敏, 张国林, 代玉梅, 罗应刚.小麦内生菌Pedobacter chitinilyticus CM134L-2T的次级代谢产物分离与鉴定[J].应用与环境生物学报, 2020, 26(4): 1-7.doi:10.19675/j.cnki.1006-687x.2019.10017.
Yang F, Zhang L L, Wang D M, Liu Y, Zhou M, Zhang G L, Dai Y M, Luo Y G.Isolation and identification of secondary metabolites of endophytic bacteria Pedobacter chitinilyticus CM134L-2T from wheat[J].Journal of Applied and Environmental Biology, 2020, 26(4): 1-7.
[16] R E布坎南, N E吉本斯.伯杰氏细菌鉴定手册[M].第8版.北京: 科学出版社,1984.
Buchanan R E, Gibbons N E.Berger′s handbook of bacterial identification[M].8th ed.Beijing: Science Press, 1984.
[17] Yang L R, Xie L H, Xue B G, Goodwin P H, Quan X, Zheng C L, Liu T G, Lei Z S, Yang X J, Chao Y E, Wu C.Comparative transcriptom profiling of the early infection of wheat roots by Gaeumannomyces graminis var.tritici[J].PLoS One, 2015, 10(4): 1245-1264.doi:10.1371/journal.pone.0120691.
[18] 王亚君, 翟焕趁, 张帅兵, 刘新影, 蔡静平.小麦赤霉病菌FgRab7调控Tri基因表达及DON毒素合成[J].河南工业大学学报(自然科学版), 2017, 38(2): 57-62, 68.doi:10.16433/j.cnki.issn1673-2383.2017.02.010.
Wang Y J, Zhai H C, Zhang S B, Liu X Y, Cai J P.Regulation of Tri gene expression and don toxin synthesis by FgRab7 of Fusarium graminearum[J].Journal of Henan University of Technology(Natural Science Edition), 2017, 38(2): 57-62, 68.
[19] Jiang C, Zhang S J, Zhang Q, Tao Y, Wang C F, Xu J R.FgSKN7 and FgATF1 have overlapping functions in ascosporogenesis, pathogenesis and stress responses in Fusarium graminearum[J].Environmental Microbiology, 2015, 17(4):1245-1260.doi:10.1111/1462-2920.12561.
[20] Livak K J, Schmittgen T D.Analysis of relative gene expression data using Real-time quantitative PCR[J].Methods, 2002, 25(4):402-408.doi:10.1006/meth.2001.1262.
[21] Tian Y, Tan Y L, Liu N, Liao Y C, Sun C P, Wang S X, Wu A B.Functional agents to biologically control deoxynivalenol contamination in cereal grains[J].Frontiers in Microbiology, 2016(7): 387-395.doi:10.3389/fmicb.2016.00395.
[22] Palazzini J M, Ramirez M L, Torres A M, Chulze S N.Potential biocontrol agents for Fusarium head blight and deoxynivalenol production in wheat[J].Crop Protection, 2007, 26(11): 1702-1710.doi:10.1016/j.cropro.2007.03.004.
[23] Wang L Y, Xie Y S, Cui Y Y, Xu J J, He W, Chen H G, Guo J H.Conjunctively screening of biocontrol agents(BCAs)against Fusarium root rot and Fusarium head blight caused by Fusarium graminearum[J].Microbiological Research, 2015, 177: 34-42.doi:10.1016/j.micres.2015.05.005.
[24] Johnson B A, Anker H, Meleney F L.Bacitracin: A new antibiotic produced by a member of the B.subtilis group[J].Science, 1945, 102(2650): 376-377.doi:10.1126/science.102.2650.376.
[25] Shi C J, Yan P S, Li J F, Wu H Q, Li Q W, Guan S S.Biocontrol of Fusarium graminearum growth and deoxynivalenol production in wheat kernels with bacterial antagonists[J].International Journal of Environmental Research and Public Health, 2014, 11(1): 1094-1105.doi:10.3390/ijerph110101094.
[26] 王瑶, 赵月菊, 邢福国, 王龑, 刘阳.禾谷镰孢拮抗菌株的筛选及鉴定[J].核农学报, 2017, 31(6): 1128-1136.doi:10.11869/j.issn.100-8551.2017.06.1128.
Wang Y,Zhao Y J, Xing F G, Wang Y, Liu Y.Screening and identification of Bacillus spp.strains with biocontrol activity against Fusarium graminearum[J].Journal of Nuclear Agricultural Sciences, 2017, 31(6): 1128-1136.
[27] He J, Boland G J, Zhou T.Concurrent selection for microbial suppression of Fusarium graminearum, Fusarium head blight and deoxynivalenol in wheat[J].Journal of Applied Microbiology,2009,106(6):1805-1817.doi:10.1111/j.1365-2672.2009.04147.x.
[28] Schisler D A, Khan N I, Boehm M J, Slininger P J.Greenhouse and field evaluation of biological control of Fusarium head blight on durum wheat[J].Plant Disease, 2002, 86(12):1350-1356.doi:10.1094/PDIS.2002.86.12.1350.
[29] 刘伟成, 潘洪玉, 席景会, 李宏宇, 郭永来, 王旭明.小麦赤霉病拮抗性芽孢杆菌生防作用的研究[J].麦类作物学报, 2005,25(4): 95-100.10.3969/j.issn.1009-1041.2005.04.020.
Liu W C, Pan H Y, Xi J H, Li H Y, Guo Y L, Wang X M.Biocontrol effects of some antifungal strains from Bucillus against pathogens of wheat head blight[J].Journal of Wheat Crops, 2005,25(4): 95-100.
[30] 周苗苗, 刘振林, 唐丽霖, 杨艺华, 杨继芝, 张敏, 陈华保, 杨春平.小麦赤霉病菌拮抗内生菌的抑菌活性及鉴定[J].核农学报, 2016, 30(3): 460-467.doi:10.11869/j.issn.100-8551.2016.03.0460.
Zhou M M, Liu Z L, Tang L L, Yang Y H, Yang J Z, Zhang M, Chen H B, Yang C P.Antifungal activity and identification of antagonistic endophytic on Fusarium graminearum[J].Journal of Nuclear Agricultural Sciences, 2016, 30(3): 460-467.
[31] González-Sánchez M  ,Pérez-Jiménez R M,Pliego C,Ramos C,De Vicente A,Cazorla F M.Biocontrol bacteria selected by a direct plant protection strategy against avocado white root rot show antagonism as a prevalent trait[J].Journal of Applied Microbiology, 2010, 109(1): 65-78.doi:10.1111/j.1365-2672.2009.04628.x.
,Pérez-Jiménez R M,Pliego C,Ramos C,De Vicente A,Cazorla F M.Biocontrol bacteria selected by a direct plant protection strategy against avocado white root rot show antagonism as a prevalent trait[J].Journal of Applied Microbiology, 2010, 109(1): 65-78.doi:10.1111/j.1365-2672.2009.04628.x.
[32] 胡晓丹, 王建伟, 李孝敬, 祭芳, 史建荣, 徐剑宏.赤霉病菌拮抗菌Bacillus subtilis AF0907抗菌物质研究[J].中国生物防治学报, 2015, 31(3): 378-385.doi:10.16409/j.cnki.2095-039x.2015.03.013.
Hu X D, Wang J W, Li X J, Ji F, Shi J R, Xu J H.Study of antagonistic substance from Bacillus subtilis AF0907 against Fusarium graminearum[J].Chinese Journal of Biological Control, 2015, 31(3): 378-385.