盐害是造成世界范围内农作物产量损失、影响植物地理分布、限制全球农业生产、严重威胁粮食安全的主要非生物胁迫因子[1]。盐害影响了我国相当比例的耕地,已成为华北、西北、东北及滨海滩涂等干旱、半干旱地区农业发展的瓶颈因子之一[2]。植物在高盐胁迫下,尤其是高浓度的Na+,会直接导致离子毒害和高渗胁迫,并间接引起氧化损伤等次级胁迫,致使生理生化代谢紊乱,最终形态建成被改变、生长发育被抑制[3-4]。
研究表明,外源激素对于提高植物抗逆性具有重要作用[5]。油菜素内酯(Brassinosteroids,BRs)作为第六大植物激素,在植物体内具有含量极低、生理活性极高的特点,能够促进蛋白质和DNA、RNA的合成,具有调控植物生长发育、提高酶系统活性、延缓植物衰老、增强植物抗性的作用[6]。目前,BRs在植物体内的信号转导途径,及其在诱导植物抗盐性的作用已成为研究热点[7-9],并广泛应用于农业生产上[10]。
紫花苜蓿(Medicago sativa)具有高产、优质、分布广、抗逆性强等特点,是目前我国栽培面积最大的豆科牧草,由于不合理的农业措施和极端天气的频现,导致我国苜蓿主产区的土壤盐渍化面积不断增加,严重限制了优质、高产苜蓿草产业的发展。研究表明,盐胁迫下,添加外源EBR能够提高紫花苜蓿种子的萌发率并促进幼苗生长[11],并能提高幼苗的根系活力[12]、光合能力[13]和光系统Ⅱ功能[14],有效维持幼苗体内的离子稳态平衡[13-14]。本试验在NaCl胁迫下,研究外源EBR对紫花苜蓿幼苗株高、地上生物量、抗氧化能力和渗透调节能力的影响,旨在明确外源BRs在调控紫花苜蓿苗期耐盐性中的作用和机理。
供试品种为中苜3号(M. sativa cv.Zhongmu No.3)和陇中苜蓿(M. sativa cv.Longzhong),其中,中苜3号为耐盐品种,适于以NaCl为主的盐碱地种植,陇中苜蓿为不耐盐品种。试验设4个处理,CK处理:对照,添加蒸馏水;NaCl处理:添加150 mmol/L NaCl;EBR处理:喷施0.1 μmol/L EBR;NaCl+EBR处理:添加150 mmol/L NaCl,同时喷施0.1 μmol/L EBR,每处理4次重复。将供试苜蓿种子用HgCl2溶液(浓度0.1%)消毒后,播种在装有蛭石的培养钵(上口径15 cm,下口径10 cm,深度15 cm)中,待种子萌发出苗后,每个培养钵中定植10株,然后置于光照培养室进行培养,幼苗培养期间,每隔2 d浇灌1次1/2 Hoagland营养液。
幼苗生长第35天,将苜蓿幼苗移到试验用水培盆中预培养3 d开始试验。整个试验期间,每隔2 d更换1次处理液,同时在各个处理液中,间歇性通入空气。试验期间,每天早晨8:00在EBR和EBR+NaCl处理的苜蓿幼苗叶片正反面均匀喷施0.1 μmol/L EBR溶液,同时在CK和NaCl处理的苜蓿幼苗叶片正反面均匀喷施蒸馏水,喷到有液滴为止。
处理第10天时,测定每个处理苜蓿幼苗的株高和地上生物量,并取叶片样品测定渗透调节物质含量、抗氧化能力及活性氧水平。其中,可溶性蛋白、可溶性糖和游离脯氨酸含量参考邹琦[15]的方法测定,SOD、APX、GPX、GR和CAT活性参考寇江涛等[12]的方法测定,GSH含量采用DTNB显色法测定[16],AsA含量采用BP显色法测![]() 和MDA含量参考寇江涛等[17]的方法测定。
和MDA含量参考寇江涛等[17]的方法测定。
试验数据采用Excel 2003进行统计,采用SPSS 19.0软件进行显著性分析,P<0.05表示差异显著。
由图1可知,和CK相比较,NaCl处理第10 天时,紫花苜蓿幼苗的生长明显被抑制,2个品种苜蓿幼苗的株高、地上生物量显著下降(P<0.05),中苜3号幼苗的株高、地上生物量分别下降34.14%和38.72%,陇中苜蓿幼苗的株高、地上生物量分别下降38.69%和36.96%。
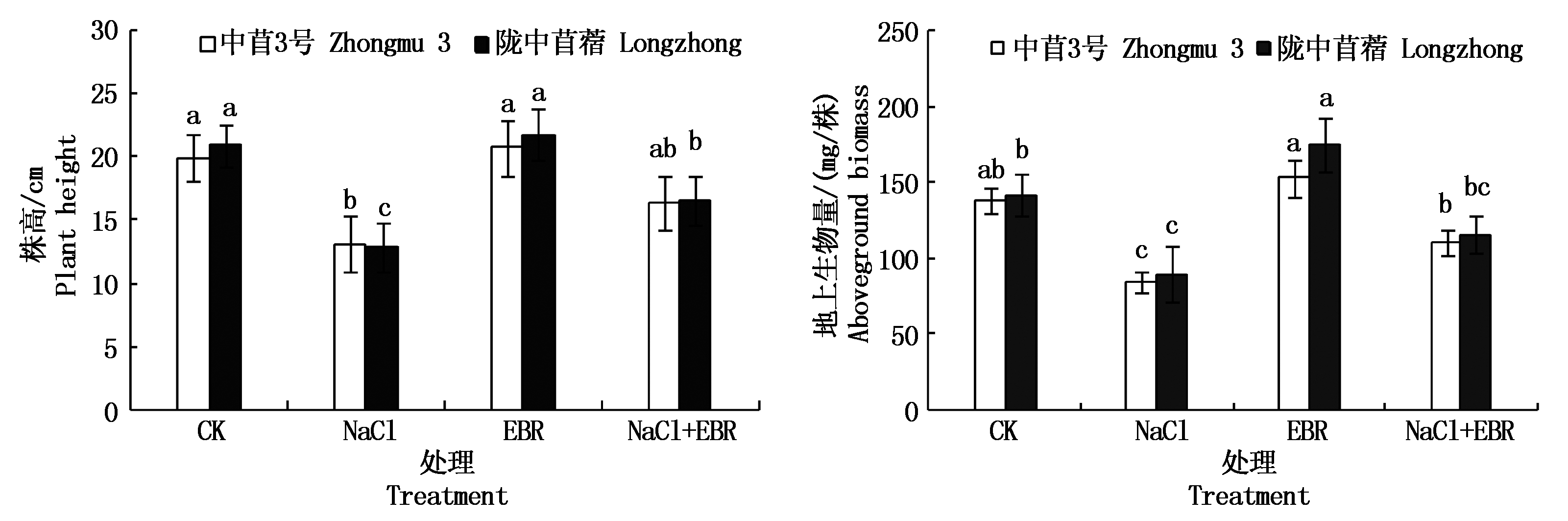
不同字母表示差异达5%显著水平。图2-3同。
The difference of different letters is 5% significant.The same as Fig.2-3.
图1 NaCl胁迫下添加外源EBR对苜蓿幼苗株高和地上生物量的影响
Fig.1 Effects of exogenous EBR on plant height and aboveground biomass of alfalfa seedlings under NaCl stress
和CK相比较,喷施外源EBR对2个品种苜蓿幼苗的株高和中苜3号幼苗的地上生物量无显著影响(P>0.05),但显著提高了陇中苜蓿幼苗的地上生物量(P<0.05)。NaCl胁迫下,喷施外源EBR后,NaCl胁迫对紫花苜蓿幼苗生长所产生的抑制程度明显减轻,陇中苜蓿幼苗的株高和中苜3号幼苗的地上生物量显著提高(P<0.05)。和NaCl胁迫相比较,中苜3号幼苗的株高、地上生物量分别提高24.31%和30.32%,陇中苜蓿幼苗的株高、地上生物量分别提高29.18%和29.19%。
由表1可知,和CK相比较,NaCl处理第10天时,苜蓿幼苗体内产生了渗透胁迫,2个品种苜蓿幼苗叶片中的可溶性蛋白含量显著降低(P<0.05),可溶性糖和游离脯氨酸含量显著升高(P<0.05),中苜3号幼苗叶片中的可溶性蛋白含量下降46.75%,可溶性糖、游离脯氨酸含量分别提高108.23%和205.40%,陇中苜蓿幼苗叶片中的可溶性蛋白含量下降49.79%,可溶性糖、游离脯氨酸含量分别提高136.76%和168.29%。
表1 NaCl胁迫下添加外源EBR对苜蓿幼苗体内渗透调节能力的影响
Tab.1 Effects of exogenous EBR on osmotic regulation of alfalfa seedlings under NaCl stress
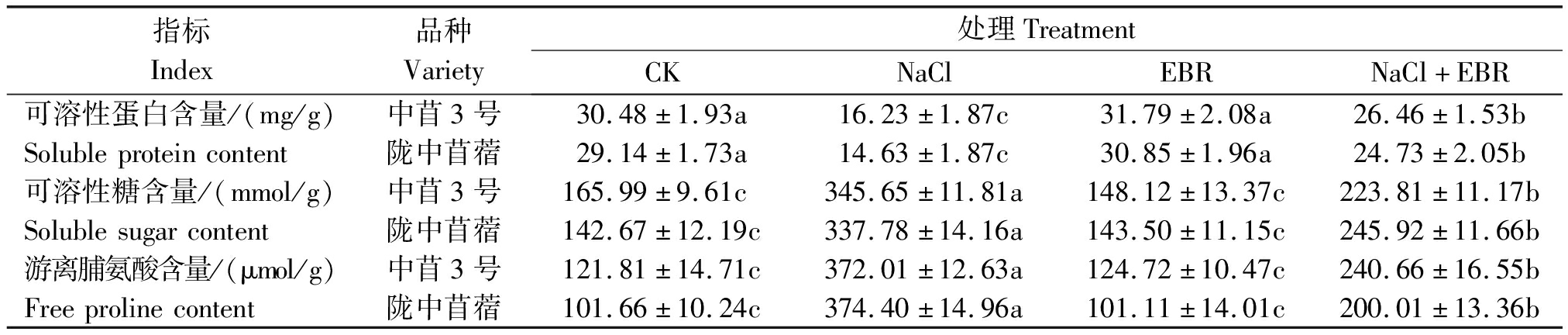
指标Index品种Variety处理TreatmentCKNaClEBRNaCl+EBR可溶性蛋白含量/(mg/g)中苜3号30.48±1.93a16.23±1.87c31.79±2.08a26.46±1.53bSolubleproteincontent陇中苜蓿29.14±1.73a14.63±1.87c30.85±1.96a24.73±2.05b可溶性糖含量/(mmol/g)中苜3号165.99±9.61c345.65±11.81a148.12±13.37c223.81±11.17bSolublesugarcontent陇中苜蓿142.67±12.19c337.78±14.16a143.50±11.15c245.92±11.66b游离脯氨酸含量/(μmol/g)中苜3号121.81±14.71c372.01±12.63a124.72±10.47c240.66±16.55bFreeprolinecontent陇中苜蓿101.66±10.24c374.40±14.96a101.11±14.01c200.01±13.36b
注:不同字母表示差异达5%显著水平。
Note:The difference of different letters is 5% significant.
和CK相比较,喷施外源EBR对2个品种苜蓿幼苗体内的渗透能力无显著影响(P>0.05)。NaCl胁迫下,喷施外源EBR后,NaCl胁迫对苜蓿幼苗造成的渗透胁迫程度明显降低,2个品种苜蓿幼苗叶片中的可溶性蛋白含量显著提高(P<0.05),可溶性糖和游离脯氨酸含量显著下降(P<0.05)。和NaCl胁迫相比较,中苜3号幼苗叶片中的可溶性蛋白含量提高63.03%,可溶性糖、游离脯氨酸含量分别下降35.24%和35.31%,陇中苜蓿幼苗叶片中的可溶性蛋白含量提高69.04%,可溶性糖、游离脯氨酸含量分别下降 27.20%和46.58%。
由图2可知,和CK相比较,NaCl处理第10天时,苜蓿幼苗的抗氧化能力显著增强,2个品种苜蓿幼苗叶片中的非酶抗氧化物质(AsA、GSH)含量和抗氧化酶(SOD、GPX、APX、GR)活性显著提高(P<0.05),但CAT活性显著降低(P<0.05)。中苜3号幼苗叶片中的AsA、GSH含量分别提高67.83%和58.22%,SOD、GPX、APX、GR活性分别提高22.31%, 46.78%, 46.08%, 44.76%,CAT活性下降45.06%,陇中苜蓿幼苗叶片中的AsA、GSH含量分别提高28.24%和52.55%,SOD、GPX、APX、GR活性分别提高20.56%, 61.78%, 40.94%, 40.91%,CAT活性下降47.23%。
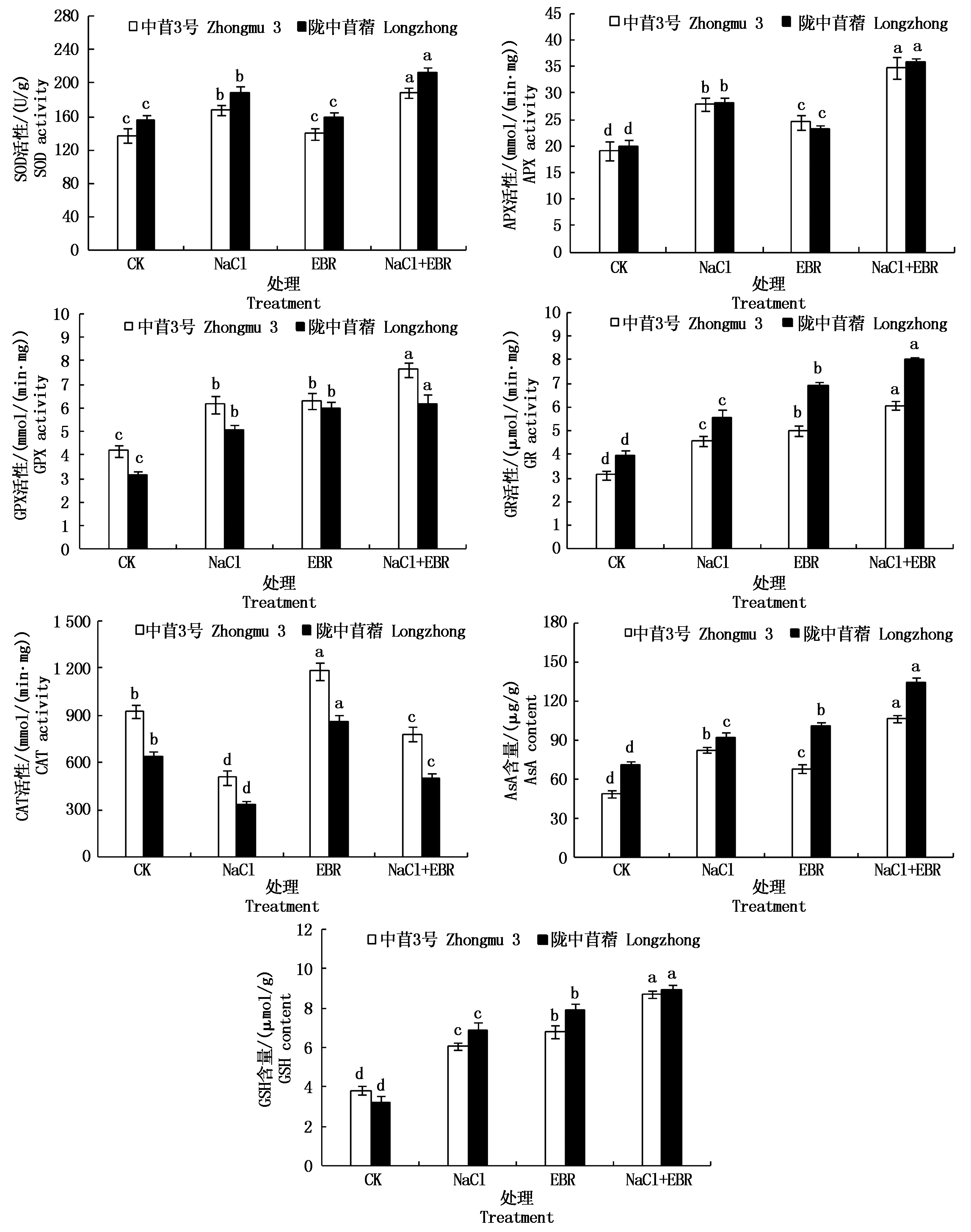
图2 NaCl胁迫下添加外源EBR对苜蓿幼苗抗氧化能力的影响
Fig.2 Effects of exogenous EBR on antioxidant capacity of alfalfa seedlings under NaCl stress
和CK相比较,喷施外源EBR对2个品种苜蓿幼苗叶片中的SOD活性无显著影响(P>0.05),但显著提高了APX、GPX、GR、CAT活性和AsA、GSH含量(P<0.05)。NaCl胁迫下,喷施外源EBR进一步提高了苜蓿幼苗酶促抗氧化系统和非酶抗氧化系统活性,2个品种苜蓿幼苗叶片中的非酶抗氧化物质(AsA、GSH)含量和抗氧化酶(SOD、GPX、APX、GR、CAT)活性均显著提高(P<0.05)。和NaCl胁迫相比较,中苜3号幼苗叶片中的AsA、GSH含量分别提高28.75%和43.73%,SOD、GPX、APX、GR、CAT活性分别提高12.34%, 24.23%, 24.21%, 32.89%, 54.07%,陇中苜蓿幼苗叶片中的AsA、GSH含量分别提高46.31%和30.07%,SOD、GPX、APX、GR、CAT活性分别提高13.30%, 22.05%, 26.33%, 43.19%, 50.02%。
由图3可知,和CK相比较,NaCl胁迫第10 天时,苜蓿幼苗叶片中活性氧大量积累,2个品种苜蓿幼苗叶片中的![]() 和MDA含量显著增加(P<0.05),中苜3号幼苗叶片中的
和MDA含量显著增加(P<0.05),中苜3号幼苗叶片中的![]() 含量分别提高62.39%, 62.38%, 43.97%, 82.90%,陇中苜蓿幼苗叶片中的
含量分别提高62.39%, 62.38%, 43.97%, 82.90%,陇中苜蓿幼苗叶片中的![]() 含量分别提高57.42%, 89.80%, 44.63%, 81.07%。
含量分别提高57.42%, 89.80%, 44.63%, 81.07%。

图3 外源EBR对NaCl胁迫下苜蓿幼苗叶片中![]() 和MDA含量的影响
和MDA含量的影响
Fig.3 Effects of exogenous EBR on the level of ![]() and MDA content of alfalfa seedlings under NaCl stress
and MDA content of alfalfa seedlings under NaCl stress
和CK相比较,喷施外源EBR对2个品种苜蓿幼苗叶片中的OH·含量无显著影响(P>0.05),但显著降低了![]() 和MDA含量(P<0.05)。NaCl胁迫下,喷施外源EBR显著降低了苜蓿幼苗叶片中活性氧水平,2个品种苜蓿幼苗叶片中的
和MDA含量(P<0.05)。NaCl胁迫下,喷施外源EBR显著降低了苜蓿幼苗叶片中活性氧水平,2个品种苜蓿幼苗叶片中的![]() 和MDA含量显著下降(P<0.05)。和NaCl胁迫相比较,中苜3号幼苗叶片中的
和MDA含量显著下降(P<0.05)。和NaCl胁迫相比较,中苜3号幼苗叶片中的![]() 含量分别降低20.53%, 23.16%, 17.14%, 14.88%,陇中苜蓿幼苗叶片中的
含量分别降低20.53%, 23.16%, 17.14%, 14.88%,陇中苜蓿幼苗叶片中的![]() 含量分别降低22.54%, 27.49%, 13.97%, 27.52%。
含量分别降低22.54%, 27.49%, 13.97%, 27.52%。
外部形态和生长状况是盐胁迫对植物伤害的最直观表现[18]。盐胁迫对植物生长发育的影响主要表现为具有明显的抑制效应,最终表现为生物量的积累下降[18]。本试验中,NaCl处理对苜蓿幼苗的生长具有显著的抑制作用,降低了2个品种苜蓿幼苗的株高和地上生物量,喷施外源EBR明显减轻了NaCl胁迫所产生的抑制作用,显著提高了2个品种苜蓿幼苗的株高和地上生物量,这与BRs调控燕麦(Avena sativa L.)[7]、番茄(Solanum lycopersicum)[19]耐盐性的研究结果一致。
渗透调节是植物响应盐胁迫的主要表征之一[20]。可溶性蛋白、游离脯氨酸和可溶性糖等小分子物质作为植物体内逆境胁迫诱导积累的关键信号物质,在植物的抗盐性中发挥着重要作用[21-23]。本试验中,NaCl处理破坏了2个品种苜蓿幼苗体内原生蛋白质的生化代谢途径,抑制了蛋白质的合成代谢,使得蛋白质的水解代谢加快,可溶性蛋白在蛋白水解酶的作用下水解能够产生游离氨基酸,从而导致2个品种苜蓿幼苗叶片中游离脯氨酸含量升高。游离氨基酸的大量积累,有助于缓解渗透胁迫,游离脯氨酸和可溶性糖的大量积累,也能够在一定程度上维持苜蓿幼苗体内的渗透势,进一步说明游离脯氨酸和可溶性糖的积累是植物响应盐胁迫的一种防御性行为[24]。NaCl胁迫下,喷施外源EBR能够明显促进紫花苜蓿幼苗体内蛋白质的生物合成,显著降低游离脯氨酸和可溶性糖的积累量,这与李硕等[19]、王舒甜等[25]在番茄、香樟(Cinnamomum camphora(Linn)Presl)耐盐性上的研究结果一致,说明外源EBR可能参与了盐胁迫下苜蓿幼苗C、N代谢的调控,同时可溶性蛋白含量的增加还有利于酶活性的发挥,但其调控机理有待进一步研究。
酶促系统和非酶促系统共同组成了植物体内的抗氧化系统,在二者的协同作用下,ROS水平处于动态平衡状态[26]。逆境条件下,植物体内的ROS代谢平衡被打破,抗氧化系统活性下降,ROS大量产生并积累,导致细胞膜系统受损,膜脂过氧化程度加剧,产生氧化胁迫伤害[27]。本试验中,NaCl处理下,2个品种苜蓿幼苗体内的![]() 水平和MDA含量显著增加,这也是苜蓿幼苗生长受到抑制的主要原因。同时,SOD、GPX、APX和GR活性显著升高,AsA和GSH含量也显著增加,说明苜蓿幼苗在NaCl胁迫下能够通过Halliwell-Asada途径和AsA-GSH循环来协同清除ROS[28-29],即酶促系统和非酶促系统在苜蓿幼苗的抗氧化胁迫中具有协同作用,但H2O2在苜蓿幼苗体内大量积累会抑制CAT活性[30],导致CAT活性下降。NaCl胁迫下,喷施外源EBR后,苜蓿幼苗体内的抗氧化酶SOD、GPX、APX和GR活性显著升高,非酶抗氧化物质AsA和GSH含量显著增加,CAT活性也显著升高,说明添加外源EBR能够提高NaCl胁迫下苜蓿幼苗体内抗氧化系统的活性,有效缓解NaCl胁迫对苜蓿幼苗所产生的氧化损伤,因此
水平和MDA含量显著增加,这也是苜蓿幼苗生长受到抑制的主要原因。同时,SOD、GPX、APX和GR活性显著升高,AsA和GSH含量也显著增加,说明苜蓿幼苗在NaCl胁迫下能够通过Halliwell-Asada途径和AsA-GSH循环来协同清除ROS[28-29],即酶促系统和非酶促系统在苜蓿幼苗的抗氧化胁迫中具有协同作用,但H2O2在苜蓿幼苗体内大量积累会抑制CAT活性[30],导致CAT活性下降。NaCl胁迫下,喷施外源EBR后,苜蓿幼苗体内的抗氧化酶SOD、GPX、APX和GR活性显著升高,非酶抗氧化物质AsA和GSH含量显著增加,CAT活性也显著升高,说明添加外源EBR能够提高NaCl胁迫下苜蓿幼苗体内抗氧化系统的活性,有效缓解NaCl胁迫对苜蓿幼苗所产生的氧化损伤,因此![]() 水平和MDA含量显著下降,这与BRs调控茄子(Solanum melongena L.)[31]、多年生黑麦草(Lolium perenne L.)[32]、黄瓜(Cucumis sativus L.)[33]、番茄[34]和玉米(Zea mays L.)[35]等植物盐性上的研究结果一致,也进一步说明外源EBR在提高苜蓿幼苗耐盐性上具有积极作用。植物个体发育的不同阶段,其耐盐性差异很大,BRs参与植物逆境生理调控的能力也和自身浓度、胁迫因子、处理时间有关。因此,外源EBR在诱导紫花苜蓿幼苗耐盐性上的作用及其机制还有待于进一步研究。
水平和MDA含量显著下降,这与BRs调控茄子(Solanum melongena L.)[31]、多年生黑麦草(Lolium perenne L.)[32]、黄瓜(Cucumis sativus L.)[33]、番茄[34]和玉米(Zea mays L.)[35]等植物盐性上的研究结果一致,也进一步说明外源EBR在提高苜蓿幼苗耐盐性上具有积极作用。植物个体发育的不同阶段,其耐盐性差异很大,BRs参与植物逆境生理调控的能力也和自身浓度、胁迫因子、处理时间有关。因此,外源EBR在诱导紫花苜蓿幼苗耐盐性上的作用及其机制还有待于进一步研究。
综上所述,NaCl处理下,2个品种苜蓿幼苗的株高和地上生物量、CAT活性及可溶性蛋白含量显著降低,MDA含量和![]() 积累量显著增加。NaCl胁迫下,喷施外源EBR能够显著提高中苜3号和陇中苜蓿幼苗的渗透调节能力及抗氧化系统活性,显著降低MDA含量和
积累量显著增加。NaCl胁迫下,喷施外源EBR能够显著提高中苜3号和陇中苜蓿幼苗的渗透调节能力及抗氧化系统活性,显著降低MDA含量和![]() 在苜蓿幼苗体内的积累量,降低苜蓿幼苗在NaCl胁迫下所产生的氧化损伤程度,增强苜蓿幼苗的耐盐性。
在苜蓿幼苗体内的积累量,降低苜蓿幼苗在NaCl胁迫下所产生的氧化损伤程度,增强苜蓿幼苗的耐盐性。
[1] Zhu J K.Abiotic stress signaling and responses in plants[J].Cell, 2016, 167(2): 313-324.doi:10.1016/j.cell.2016.08.029.
[2] 寇江涛.外源EBR对NaCl胁迫下燕麦幼苗无机离子吸收、运输和分配的影响[J].生态学杂志, 2020, 39(3): 855-864.doi:10.13292/j.1000-4890.202003.033.
Kou J T.Effects of exogenous 2,4-epibrassinolide on the absorption, transportation and allocation of inorganic ion of Avena sativa L.seedlings under NaCl stress[J].Chinese Journal of Ecology, 2020, 39(3): 855-864.
[3] Zhu J K.Salt and drought stress signal transduction in plants[J].Annual Review of Plant Biology, 2002, 53(1):247-273.doi:10.1146/annurev.arplant.53.091401.143329.
[4] 张金林, 李惠茹, 郭姝媛, 王锁民, 施华中, 韩庆庆, 包爱科, 马清.高等植物适应盐逆境研究进展[J].草业学报, 2015, 24(12): 220-236.doi:10.11686/cyxb2015233.
Zhang J L, Li H R, Guo S Y, Wang S M, Shi H Z, Han Q Q, Bao A K, Ma Q.Research advances in higher plant adaptation to salt stress[J].Acta Prataculturae Sinica, 2015, 24(12): 220-236.
[5] 王若梦,董宽虎,李钰莹, 李晨, 杨静芳.外源植物激素对NaCl胁迫下苦马豆苗期脯氨酸代谢的影响[J].草业学报, 2014, 23(2): 189-195.doi:10.11686/cyxb20140223.
Wang R M, Dong K H, Li Y Y, Li C, Yang J F.Effects of applying exogenous plant hormone on praline metabolism of Swainsonia salsula seedlings under NaCl stress[J].Acta Prataculturae Sinica, 2014, 23(2): 189-195.
[6] 孙玉珺, 吴玥, 马德志, 吕金莹, 贺韵涵, 宫磊, 刘哲, 高丽丹, 李娜, 闫冬, 朱晶桓, 杨德光.外源油菜素内酯对低温胁迫下玉米发芽及幼苗生理特性的影响[J].华北农学报, 2019, 34(3): 119-128.doi:10.7668/hbnxb.201751362.
Sun Y J, Wu Y, Ma D Z, Lü J Y, He Y H, Gong L, Liu Z, Gao L D, Li N, Yan D, Zhu J H, Yang D G.Effects of brassinolide on seed germination and seedling physiology of maize under low temperature stress[J].Acta Agriculturae Boreali-Sinica, 2019, 34(3): 119-128.
[7] 寇江涛.外源2,4-表油菜素内酯对NaCl胁迫下燕麦种子萌发和生理的影响[J].草地学报, 2019, 27(6): 1562-1568.doi:10.11733/j.issn.1007-0435.2019.06.013.
Kou J T.Effects of 2,4-epibrassinolide on germination and physiological characteristics of Avena sativa L.seeds under NaCl stress[J].Acta Agrestia Sinica, 2019, 27(6): 1562-1568.
[8] 李彩凤, 刘丹, 邹春雷, 刘磊,武沛然,杨芳芳,王彬,王玉波.盐碱胁迫下喷施BR对甜菜光系统Ⅱ和氮代谢关键酶的影响[J].东北农业大学学报, 2018, 49(8): 39-47.doi:10.3969/j.issn.1005-9369.2018.08.005.
Li C F, Liu D, Zou C L, Liu L, Wu P R, Yang F F, Wang B, Wang Y B.Effect of spraying brassinolide(BR)on PS Ⅱ and key enzymes of nitrogen metabolism in sugar beet under saline-alkali stress[J].Journal of Northeast Agricultural University, 2018, 49(8): 39-47.
[9] 寇江涛.外源2,4-表油菜素内酯对NaCl胁迫下燕麦幼苗光合特性的影响[J].华北农学报, 2020, 35(2):79-87.doi:10.7668/hbnxb.20190663.
Kou J T.Effects of exogenous 2,4-epibrassinolide on photosynthetic characteristics of oat seedlings under NaCl stress[J].Acta Agriculturae Boreali-Sinica, 2020, 35(2): 79-87.
[10] 王庆燕, 管大海, 潘海波, 李建民, 段留生, 张明才, 李召虎.油菜素内酯对春玉米灌浆期叶片光合功能与产量的调控效应[J].作物学报, 2015, 41(10): 1557-1563.doi:10.3724/SP.J.1006.2015.01557.
Wang Q Y, Guan D H, Pan H B, Li J M, Duan L S, Zhang M C, Li Z H.Effect of brassinolide on leaf photosynthetic function and yield in spring maize filling stage[J].Acta Agronomica Sinica, 2015, 41(10): 1557-1563.
[11] 寇江涛, 师尚礼.2,4-表油菜素内酯对盐胁迫下紫花苜蓿种子萌发及幼苗生长的影响[J].草原与草坪, 2015, 35(1): 1-8, 19.doi:10.3969/j.issn.1009-5500.2015.01.001.
Kou J T, Shi S L.Effect of 2,4-epibrassinolide on seed germination and seedling growth of Medicago sativa under salt stress[J].Grassland and Turf, 2015, 35(1): 1-8, 19.
[12] 寇江涛, 师尚礼.2,4-表油菜素内酯对NaCl胁迫下紫花苜蓿幼苗根系生长抑制及氧化损伤的缓解效应[J].中国生态农业学报, 2015, 23(8): 1010-1019.doi:10.13930/j.cnki.cjea.150411.
Kou J T, Shi S L.2,4-Epibrassinolide protection against root growth inhibition and oxidative damage of Medicago sativa L.seedling under NaCl stress[J].Chinese Journal of Eco-Agriculture, 2015, 23(8): 1010-1019.
[13] 寇江涛, 康文娟, 苗阳阳, 师尚礼.外源2,4-表油菜素内酯对NaCl胁迫下紫花苜蓿幼苗光合特性及离子吸收、运输和分配的影响[J].草业学报, 2016, 25(4): 91-103.doi:10.11686/cyxb2015289.
Kou J T, Kang W J, Miao Y Y, Shi S L.Effect of exogenous 2,4-epibrassinolide on the uptake, transport, and disputation of ions, and photosynthetic characteristics of Medicago sativa seedlings under NaCl stress[J].Acta Prataculturae Sinica, 2016, 25(4): 91-103.
[14] 寇江涛, 康文娟, 苗阳阳, 师尚礼.外源EBR对NaCl胁迫下紫花苜蓿幼苗微量元素吸收及叶绿素荧光动力学参数的影响[J].中国生态农业学报, 2016, 24(3): 345-355.doi:10.13930/j.cnki.cjea.151028.
Kou J T, Kang W J, Miao Y Y, Shi S L.Effect of exogenous 2,4-epibrassinolide on trace element absorption and chlorophyll fluorescence of Medicago sativa under NaCl stress[J].Chinese Journal of Eco-Agriculture, 2016, 24(3): 345-355.
[15] 邹琦.植物生理学实验指导[M].北京: 中国农业出版社, 2000.
Zou Q.Plant physiology experiment guidance[M].Beijing: China Agriculture Press, 2000.
[16] 寇江涛, 师尚礼, 胡桂馨.牛角花齿蓟马为害对紫花苜蓿AsA、GSH含量及相关代谢酶活性的影响[J].应用昆虫学报, 2013, 50(6): 1600-1607.doi:10.7679/j.issn.2095-1353.2013.220.
Kou J T, Shi S L, Hu G X.The effect of Odontothrips loti damage to AsA, GSH content and metabolic enzymes activity in alfalfa plants[J].Chinese Journal of Applied Entomology, 2013, 50(6): 1600-1607.
[17] 寇江涛, 师尚礼, 胡桂馨, 周万海.牛角花齿蓟马为害对紫花苜蓿活性氧代谢的影响[J].核农学报, 2013, 27(12): 1948-1954.doi:10.11869/hnxb.2013.12.1948.
Kou J T, Shi S L, Hu G X, Zhou W H.Effect of Odontothrips loti on reactive oxygen metabolism of Medicago sativa[J].Journal of Nuclear Agricultural Sciences, 2013, 27(12): 1948-1954.
[18] 王佺珍, 刘倩, 高娅妮, 柳旭.植物对盐碱胁迫的响应机制研究进展[J].生态学报, 2017, 37(16): 5565-5577.doi: 10.5846/stxb201605160941.
Wang Q Z, Liu Q, Gao Y N, Liu X.Review on the mechanisms of the response to salinity-alkalinity stress in plants[J].Acta Ecologica Sinica, 2017, 37(16): 5565-5577.
[19] 李硕, 张毅, 姚棋, 白龙强, 侯雷平, 石玉.等渗盐胁迫下BR对番茄生长及渗透调节特性的影响[J].西北农林科技大学学报(自然科学版), 2020, 48(4): 130-136, 145.doi:10.13207/j.cnki.jnwafu.2020.04.017.
Li S, Zhang Y, Yao Q, Bai L Q, Hou L P, Shi Y.Effects of brassinolide on seedling growth and osmotic regulation characteristics of tomato under iso-osmotic salt stress[J].Journal of Northwest A&F University(Natural Science Edition), 2020, 48(4): 130-136, 145.
[20] Deinlein U, Stephan A B, Horie T, Luo W, Xu G H,Schroeder J I.Plant salt-tolerance mechanisms[J].Trends in Plant Science, 2014, 19(6): 371-379.doi:10.1016/j.tplants.2014.02.001.
[21] Cernusak L A, Aranda J, Marshall J D, Winter K.Large variation in whole-plant water-use efficiency among tropical tree species[J].New Phytologist, 2007, 173(2): 294-305.doi:10.1111/j.1469-8137.2006.01913.x.
[22] Poustini K, Siosemardeh A, Ranjbar M.Proline accumulation as a response to salt stress in 30 wheat(Triticum aestivum L.)cultivars differing in salt tolerance[J].Genetic Resources and Crop Evolution, 2007, 54(5): 925-934.doi:10.1007/s10722-006-9165-6.
[23] Sadeghipour O, Monem R, Tajal A A.Production of mungbean(Vigna radiata L.)as affected by nitrogen and phosphorus fertilizer application[J].Journal of Applied Sciences, 2010, 10(10): 843-847.doi:10.3923/jas.2010.843.847.
[24] Wang X Z, Wang H, Wu F Z, Liu B.Effects of cinnamic acid on the physiological characteristics of cucumber seedlings under salt stress[J].Frontiers of Agriculture in China, 2007,1(1):58-61.doi:10.1007/s11703-007-0010-2.
[25] 王舒甜, 王金平, 张金池, 岳健敏.油菜素内酯对盐胁迫下香樟幼苗叶片抗氧化酶活性的影响[J].浙江大学学报(农业与生命科学版), 2017, 43(4): 476-482.doi:10.3785/j.issn.1008-9209.2016.09.101.
Wang S T, Wang J P, Zhang J C, Yue J M.Effects of exogenous 2,4-epibrassinolide on antioxidant enzyme activities of camphor seedlings under salt stress[J].Journal of Zhejiang University(Agriculture and Life Sciences), 2017, 43(4): 476-482.
[26] 周万海, 师尚礼, 寇江涛.外源水杨酸对苜蓿幼苗盐胁迫的缓解效应[J].草业学报, 2012, 21(3): 171-176.doi:10.11686/cyxb20120322.
Zhou W H, Shi S L, Kou J T.Exogenous salicylic acid on alleviating salt stress in alfalfa seedlings[J].Acta Prataculturae Sinica, 2012, 21(3): 171-176.
[27] Lu S Y, Zhuo C L, Wang X H, Guo Z F.Nitrate reductase(NR)-dependent NO production mediates ABA-and H2O2-induced antioxidant enzymes[J].Plant Physiology and Biochemistry, 2014, 74(1): 9-15.doi:10.1016/j.plaphy.2013.10.030.
[28] Asada K.Production and scavenging of reactive oxygen species in chloroplasts and their function[J].Plant Physiology, 2006, 141(2): 391-396.doi:10.1104/pp.106.082040.
[29] 陈坤明, 宫海军, 王锁民.植物谷胱甘肽代谢与环境胁迫[J].西北植物学报, 2004, 24(6): 1119-1130.doi:10.3321/j.issn:1000-4025.2004.06.032.
Chen K M, Gong H J, Wang S M.Glutathione metabolism and environmental stresses in plants[J].Acta Botanica Boreali-Occidentalia Sinica, 2004, 24(6): 1119-1130.
[30] Horváth E, Szalai G, Janda T.Induction of abiotic stress tolerance by salicylic acid signaling[J].Journal of Plant Growth Regulation, 2007, 26(3): 290-300.doi:10.1007/s00344-007-9017-4.
[31] 吴雪霞, 查丁石, 朱宗文, 李贤.外源24-表油菜素内酯对盐胁迫下茄子种子萌发和幼苗生理特性的影响[J].植物生理学报, 2011, 47(6): 607-612.
Wu X X, Zha D S, Zhu Z W, Li X.Effects of exogenous 24-epibrassinolide on seed germination, physiological characteristics of eggplant seedlings under NaCl stress[J].Plant Physiology Journal, 2011, 47(6): 607-612.
[32] 孙珊珊, 安勐颍, 韩烈宝, 许立新.外源24-表油菜素内酯对多年生黑麦草幼苗耐盐性的影响[J].草地学报, 2014, 22(5): 1045-1050.doi:10.11733/j.issn.1007-0435.2014.05.020.
Sun S S, An M Y, Han L B, Xu L X.Effects of exogenously applied 24-epibrassinolide on the seedlings of perennial ryegrass under NaCl stress[J].Acta Agrestia Sinica, 2014, 22(5): 1045-1050.
[33] 陆晓民, 杨威.油菜素内醋对氯化钠胁迫下黄瓜幼苗的缓解效应[J].应用生态学报, 2013, 24(5): 1409-1414.doi: 10.13287/j.1001-9332.2013.0307.
Lu X M, Yang W.Alleviation effects of brassinolide on cucumber seedlings under NaCl stress[J].Chinese Journal of Applied Ecology, 2013, 24(5): 1409-1414.
[34] 李硕,张毅,姚棋,张渊博,侯雷平,石玉.外源BR对不同盐胁迫下番茄幼苗生长及生理抗性的影响[J].山东农业科学, 2019, 51(10): 50-54.doi:10.14083/j.issn.1001-4942.2019.10.010.
Li S,Zhang Y,Yao Q,Zhang Y B,Hou L P,Shi Y.Effects of exogenous BR on growth and physiological resistance of tomato seedlings under different salt stresses[J].Shandong Agricultural Sciences, 2019, 51(10): 50-54.
[35] 魏湜, 吉彪, 李赞, 顾万荣.盐胁迫下油菜素内酯对玉米幼苗生理特性的影响[J].东北农业大学学报, 2018, 49(5): 9-16.doi: 10.3969/j.issn.1005-9369.2018.05.002.
Wei T, Ji B, Li Z, Gu W R.Effect of brassinolide on physiological characteristics of maize seedlings under salt stress[J].Journal of Northeast Agricultural University, 2018, 49(5): 9-16.