欧李(Cerasus humilis Bge.)又名钙果,为蔷薇科(Rosaceae)樱属(Cerasus)多年生落叶小灌木,是从我国野生欧李中选育出的一种新型果树[1],经济价值高,用途非常广泛。其中,果实中的糖、蛋白质、矿物质、维生素和氨基酸等营养物质含量很高,特别是钙的含量最高,为0.60 mg/g,是苹果的6.7倍,因此被称为“钙果之王”[2]。种子可入药,具有利尿、通便、消肿等功效,可治疗肠胃停滞、消化不良、便秘等疾病[3]。叶色浓绿、花色鲜艳、具有极强的观赏价值。另外,欧李具有耐旱、耐寒、耐瘠薄、抗病虫害等能力,其根系十分庞大,基生枝多,对自然条件适应性强,是防风固沙、绿化荒山、改善脆弱环境的生态优势树种,具有极其广阔的发展前景[4]。现在随着经济的快速发展和栽培技术的成熟,利用山地资源优势发展欧李,对发展水果产业、促进农村经济发展等具有重要的意义。目前,山西农业大学已筛选出农大3号、农大4号、农大5号、农大6号和农大7号,并被广泛引种栽培[5]。
光合作用是植物生长发育的基础,为植物生长发育提供所需的物质和能量[6]。对果树来说,光合作用的强弱不仅反映出果树对环境变化的应对能力,而且在一定程度上反映出果树产量的高低和品质的优劣[7],所以了解不同欧李品种的光合特性,对品种的筛选及制定合理的栽培措施具有重要的科学意义。尹赜鹏等[8]对干旱胁迫下欧李光合及叶绿素荧光进行了研究;褚建民等[9]研究了土壤水分胁迫对欧李幼苗光合及叶绿素荧光特性的影响;张世军等[5]对5个欧李品种的光合特性进行了研究;卫娇娇等[10]研究了栽植密度对引种欧李光合特性的影响。目前,对在修剪条件下不同欧李品种光合特性差异的研究还未见报道,本研究对未修剪和修剪的4个欧李品种的季节光合生理进行了比较研究,了解修剪对欧李品种光合作用的影响,及不同欧李品种光合生理生态差异,为改善栽培措施等提供理论依据,从而为欧李的高产稳产提供一定的指导。
1 材料和方法
1.1 研究区概况
试验在甘肃民勤治沙综合试验站试验田中进行,该地区属典型的温带大陆性干旱荒漠气候(102°58′E、38°34′N,海拔1 378 m),气候干燥,空气干燥度5.1,最高达18.7,相对湿度47%;年均降雨量113.2 mm,年均蒸发量2 604.3 mm。极端低温-30.8 ℃,极端高温40 ℃,年平均气温7.6 ℃;全年较多风沙,多集中在2-5月;土壤为碱性沙土,pH值8.3,盐含量0.146%,有机质为0.197 5%,全氮0.007 9%,全磷0.116%。
1.2 样地情况
2017年3月从山西农业大学园艺学院欧李培育基地引种农大5号、农大6号、农大7号,为一年生实生苗,株高均在50~70 cm,平均冠幅(东西×南北)为:88.6 cm×87.2 cm。以民勤沙生植物园种植的野生欧李生态苗作为对照,所谓生态苗,就是民勤沙生植物园为生态建设而使用的绿化苗木,为一年生实生苗,株高在40~50 cm,平均冠幅(东西×南北)为:66.5 cm×61.4 cm。在试验地各栽植500株,每个品种对250株进行枝条修剪,另外250株不进行修剪。修剪包括短剪、疏枝和摘心。保留1~2个基生枝,多余的枝条在刚萌发时剪除。
1.3 测定方法
1.3.1 光合参数测定 于2019年6,7,8,9月选择晴朗天气,分别从未修剪和修剪的4个欧李品种中选取5株长势一致的植株,对植株叶片采用 Li-6400 XT 便携式光合仪(LI-COR,USA)进行净光合速率、胞间CO2浓度、气孔导度、蒸腾速率等参数的测定。测定选用自然光源,透明叶室,从7:00-19:00每2 h测定1 次,每次连续测定3 d,每株测定3片叶子,每个叶片重复记录5组数据,取平均值。
1.3.2 数据处理 采用 Excel对所测数据进行整理分析。所有数据采用 Prisim 5.0软件进行分析,采用单因素方差分析(One-way ANOVA)、Tukey法检验和多重比较,试验数据用平均值±标准误差表示。
2 结果与分析
2.1 不同未修剪欧李品种光合作用日进程
由图1可以看出,不同欧李品种光合特性有一定的差异,4个未修剪欧李品种在6,7月净光合速率(Pn)日进程均呈“双峰”曲线,农大5号、农大6号和农大7号第1峰出现在11:00,在13:00降幅较大,有明显的“午休”现象,第2峰出现在15:00,比第1峰值小。生态苗6月第1峰出现在9:00,第2峰出现在13:00,第2峰比第1峰小,在11:00左右出现“午休”现象,7月第1峰出现在13:00,第2峰出现在17:00,在15:00左右出现“午休”现象。8,9月,4个未修剪欧李品种光合作用日进程均呈“单峰”曲线,上午Pn随着光强的增加而升高,下午随着光强的减弱而降低,8月农大5号、农大6号和生态苗在11:00达到最大值,农大7号在13:00达到最大值;9月农大5号、农大6号和农大7号在11:00达到最大值,生态苗在13:00达到最大值。Pn与温度和光照强度等因素有关,有研究表明,欧李“午休”是由于光照强度过高引起植物叶片大量失水,造成气孔关闭,进而使光合速率下降[11]。
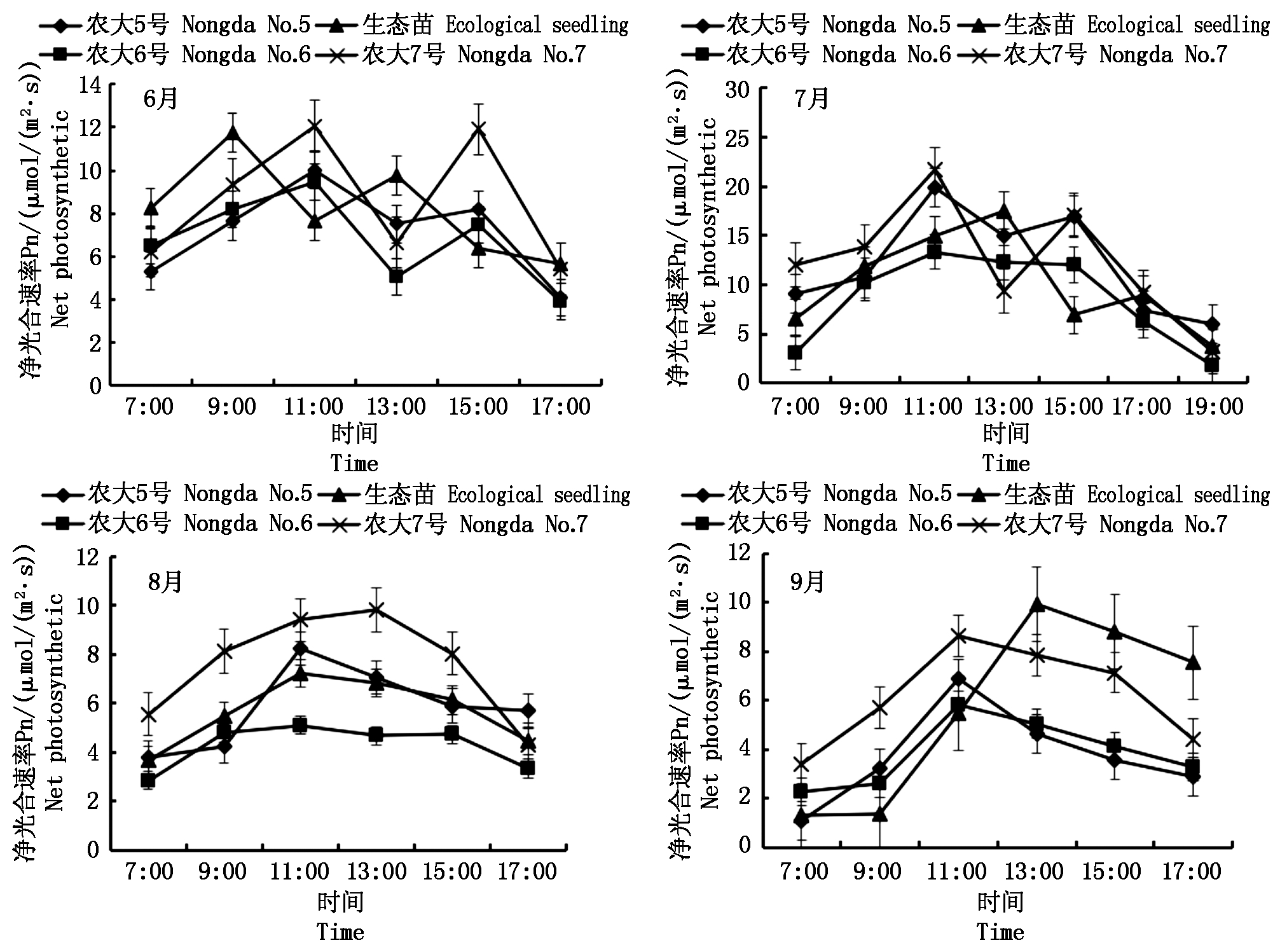
图1 不同未修剪欧李品种净光合速率(Pn)日进程季节性变化
Fig.1 Seasonal change in daily process of net photosynthetic rate of different varieties of unprun Cerasus humilis
气孔导度(Gs)代表气孔开张的程度,植物可以通过气孔的开张或闭合来调节水气的扩散[12]。4个未修剪欧李品种在不同月份的Gs日变化(图2)与Pn日变化基本一致,农大5号和农大7号在6,7月均为“双峰”曲线,二者在6,7月均分别在11:00和15:00出现峰值,农大6号和生态苗均在6月为“双峰”曲线,峰值分别为11:00和15:00及9:00和13:00,在7月均为“单峰”曲线,峰值均出现在11:00。
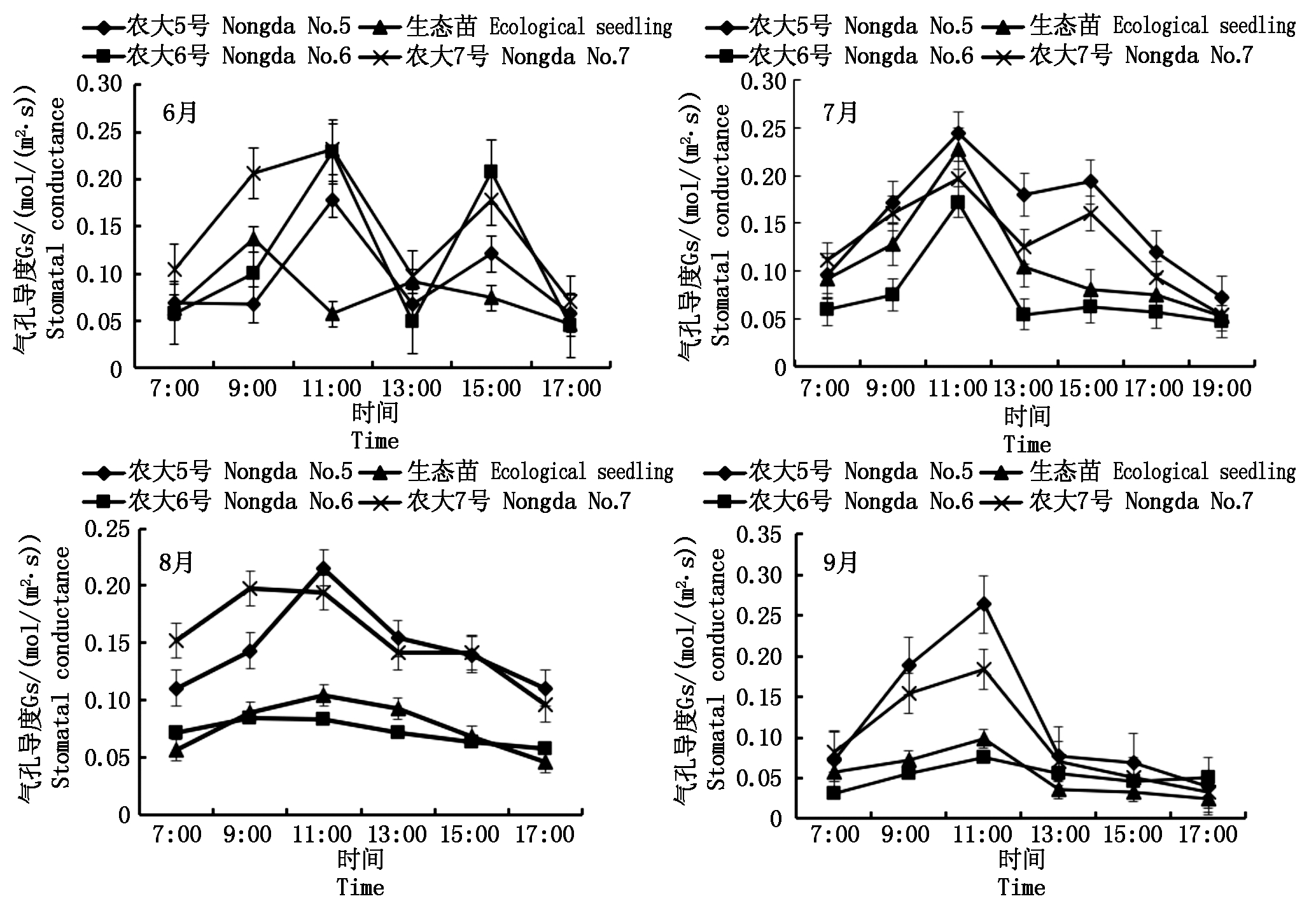
图2 不同未修剪欧李品种气孔导度(Gs)日进程季节性变化
Fig.2 Seasonal change in daily process of stomatal conductance of different varieties of unprun Cerasus humilis
胞间二氧化碳浓度(Ci)是外界CO2在进入植物叶肉细胞的过程中所受各种阻力和驱动力以及叶片内部光合作用和呼吸作用的最终平衡结果[13]。4个未修剪欧李品种在不同月份的Ci日变化与Pn日变化相反。6月农大5号、农大7号和生态苗均呈“W”字形,农大5号、农大7号在11:00和15:00出现最小值,生态苗在9:00和13:00出现最小值,农大6号Ci呈现“V”字形,先随光强的增强而降低,在11:00出现最小值,然后随光强的减弱而逐渐升高。7月,农大5号和农大6号呈不规则“W”字形,均于11:00出现最小值,生态苗和农大7号呈现不规则“V”字形,生态苗在9:00出现最小值,农大7号在13:00出现最小值。8月,4个欧李品种均呈不规则“V”字形,其中,农大5号和农大7号最小值出现在13:00,农大6号和生态苗最小值分别在15:00和9:00出现。9月,4个欧李品种均呈不规则“V”字形,最小值均出现在11:00(图3)。
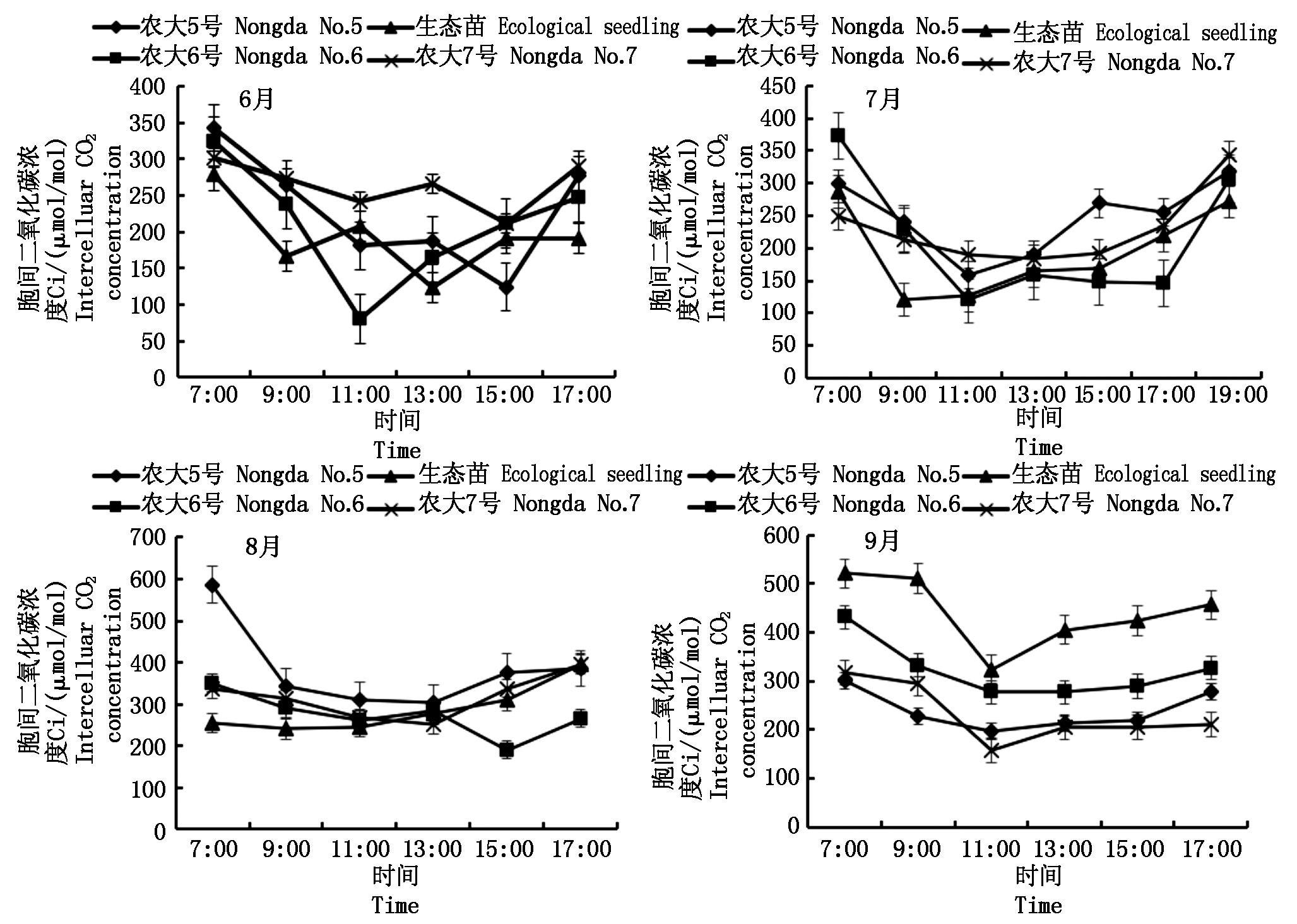
图3 不同未修剪欧李品种胞间CO2浓度(Ci)日进程季节性变化
Fig.3 Seasonal change in daily process of intercellular CO2 concentration of different varieties of unprun Cerasus humilis
蒸腾在增加无机离子的吸收和运输及增加植物水分吸收过程中起到重要的作用[14]。4个未修剪欧李品种在不同月份的蒸腾速率(Tr)日变化均呈“单峰”曲线,上午随着光强增大,温度逐渐升高,欧李叶片的水汽压差也随之增大,Tr不断升高。6月农大5号、农大6号和农大7号在11:00出现峰值,生态苗在9:00出现峰值;7月农大7号在11:00出现峰值,农大5号和农大6号在15:00出现峰值,生态苗在13:00出现峰值;8月农大7号和农大5号,随光强的增强逐渐升高,在15:00出现最大值,农大6号和生态苗在11:00出现最大值;9月4个品种均呈“双峰”曲线,均在9:00出现第1峰值(图4)。
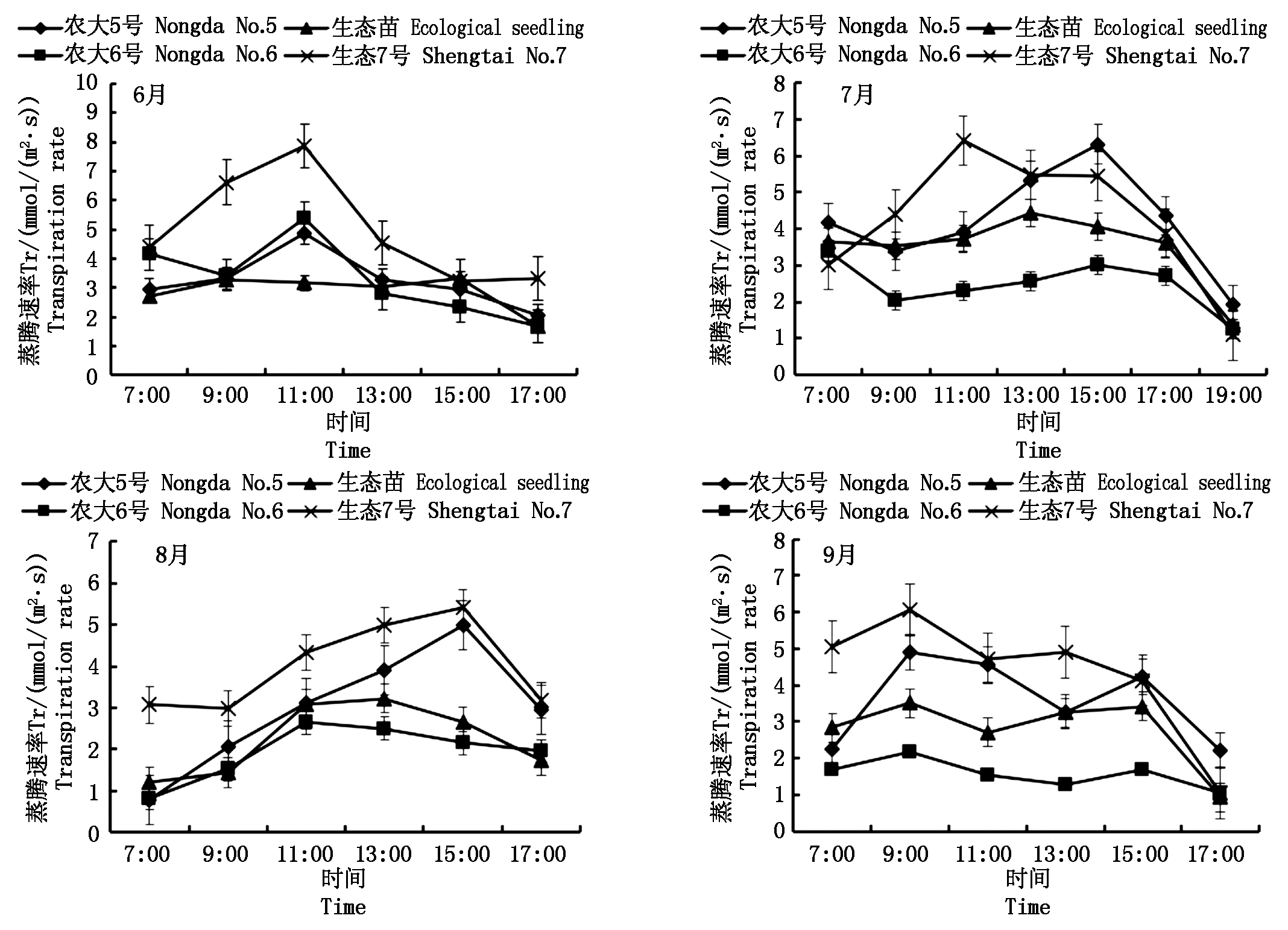
图4 不同未修剪欧李品种蒸腾速率(Tr)日进程季节性变化
Fig.4 Seasonal change in daily process of transpiration rate of different varieties of unprun Cerasus humilis
2.2 不同未修剪欧李品种光合参数比较
由表1可知不同月份中,日均Pn均表现为农大7号>农大5号>生态苗>农大6号,其中,6,7月农大5号和农大7号无显著性差异(P>0.05),但均显著高于农大6号和生态苗(P<0.05),8月农大7号显著高于其他品种(P<0.05),农大6号和生态苗之间无显著性差异(P>0.05);4个欧李品种日均Pn均为7月>6月>8月>9月,其中,农大5号各月份之间均有显著性差异(P<0.05),农大6号、生态苗和农大7号均为7月显著高于其他月份(P<0.05),6月和8月之间均无显著性差异(P>0.05)。不同月份中,4个品种日均Gs表现为农大7号>农大5号>生态苗>农大6号,农大5号和农大7号之间,以及农大6号和生态苗之间均无显著性差异(P>0.05),农大7号均显著高于农大6号(P<0.05);4个欧李品种日均Gs均为7月>6月>8月>9月,且6月和7月之间均无显著性差异(P>0.05),除农大6号外,其他3个品种6,7月均显著高于9月(P<0.05)。7,8月,4个品种的日均Ci表现为农大6号>生态苗>农大5号>农大7号,6月为生态苗>农大6号>农大5号>农大7号,9月为:农大6号>农大5号>农大7号>生态苗,除6月外农大6号均显著高于其他品种(P<0.05);农大5号和农大6号日均Ci表现为8月>9月>7月>6月。4个品种的日均Tr表现为农大7号>农大5号>生态苗>农大6号,除9月外,其他3个月中农大7号均显著高于生态苗(P<0.05),与农大5号之间无显著性差异(P>0.05);4个欧李品种中,7月日均Tr最大,6月和8月日均Tr之间无显著性差异(P>0.05)。
表1 不同未修剪欧李品种日均净光合速率、胞间 CO2浓度、气孔导度、蒸腾速率季节性变化
Tab.1 Seasonal change in daily mean values of net photosynthetic rate, intercellular CO2concentration, stomatal conductance, transpiration rate of Cerasus humilis
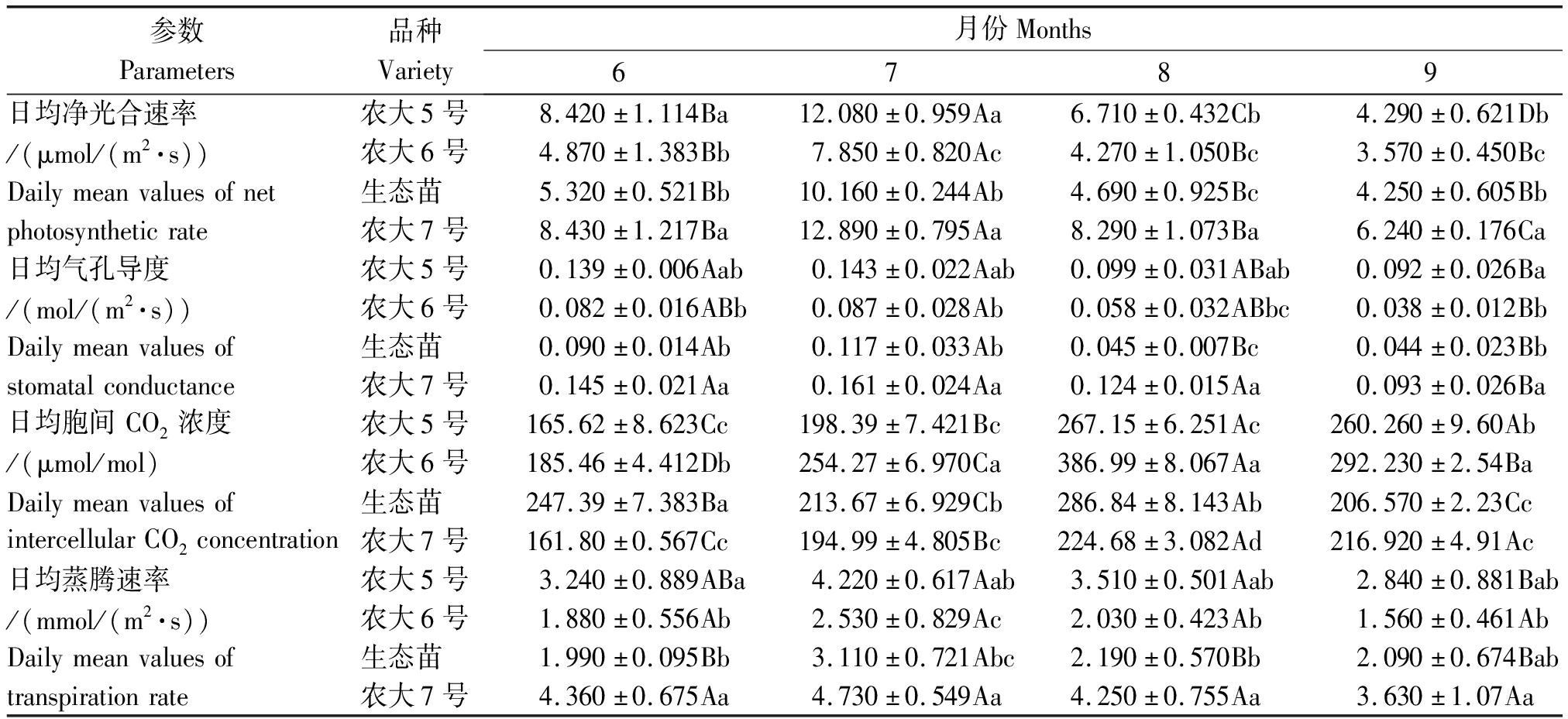
参数Parameters品种Variety月份Months6789日均净光合速率农大5号8.420±1.114Ba12.080±0.959Aa6.710±0.432Cb4.290±0.621Db/(μmol/(m2·s))农大6号4.870±1.383Bb7.850±0.820Ac4.270±1.050Bc3.570±0.450BcDailymeanvaluesofnet生态苗5.320±0.521Bb10.160±0.244Ab4.690±0.925Bc4.250±0.605Bbphotosyntheticrate农大7号8.430±1.217Ba12.890±0.795Aa8.290±1.073Ba6.240±0.176Ca日均气孔导度农大5号0.139±0.006Aab0.143±0.022Aab0.099±0.031ABab0.092±0.026Ba/(mol/(m2·s))农大6号0.082±0.016ABb0.087±0.028Ab0.058±0.032ABbc0.038±0.012BbDailymeanvaluesof生态苗0.090±0.014Ab0.117±0.033Ab0.045±0.007Bc0.044±0.023Bbstomatalconductance农大7号0.145±0.021Aa0.161±0.024Aa0.124±0.015Aa0.093±0.026Ba日均胞间CO2浓度农大5号165.62±8.623Cc198.39±7.421Bc267.15±6.251Ac260.260±9.60Ab/(μmol/mol)农大6号185.46±4.412Db254.27±6.970Ca386.99±8.067Aa292.230±2.54BaDailymeanvaluesof生态苗247.39±7.383Ba213.67±6.929Cb286.84±8.143Ab206.570±2.23CcintercellularCO2concentration农大7号161.80±0.567Cc194.99±4.805Bc224.68±3.082Ad216.920±4.91Ac日均蒸腾速率农大5号3.240±0.889ABa4.220±0.617Aab3.510±0.501Aab2.840±0.881Bab/(mmol/(m2·s))农大6号1.880±0.556Ab2.530±0.829Ac2.030±0.423Ab1.560±0.461AbDailymeanvaluesof生态苗1.990±0.095Bb3.110±0.721Abc2.190±0.570Bb2.090±0.674Babtranspirationrate农大7号4.360±0.675Aa4.730±0.549Aa4.250±0.755Aa3.630±1.07Aa
注:数据为平均数±标准误差。不同小写字母表示同一列差异显著(P<0.05),不同大写字母表示同一行差异显著(P<0.05)。
Note: The datas are mean ± standard.Different lowercase letters indicate significant difference in the same column(P<0.05), while different uppercase letters indicate significant difference in the same row(P<0.05).
2.3 修剪对欧李品种光合作用日进程的影响
修剪在果树生产中具有十分重要的意义和作用,它能使幼树形成牢固、合理的树体骨架,改善树体的通风透光条件,提高负载能力[15]。为探讨修剪对欧李品种光合作用的影响,选择7月修剪和未修剪的欧李品种光合日变化进行比较,结果如图5所示。在7月干燥、高温的环境下,修剪的4个欧李品种Pn日变化趋势与未修剪的基本一致,均呈典型的“双峰”曲线,除生态苗外,修剪的欧李峰值出现的时间与未修剪的一致,但修剪的峰值高于未修剪的。农大5号、农大6号和农大7号修剪后日均Pn分别为13.42,11.40,13.80 μmol/(m2·s),均高于未修剪的(12.08,7.85,12.89 μmol/(m2·s))。与未修剪的相比,生态苗修剪后的第1峰值发生了变化,时间由未修剪的13:00变化到11:00,第2峰值与未修剪的一致,其日均Pn为9.69 μmol/(m2·s)低于未修剪的日均Pn(10.16 μmol/(m2·s)),两者相差0.47 μmol/(m2·s)。由此可见,对于引种的3个品种来说修剪减少了树枝量,从而提高了树冠内膛的光照条件,使树冠中的叶片接收到更充足的阳光辐射,随着光照强度的增加,净光合速率上升加快。
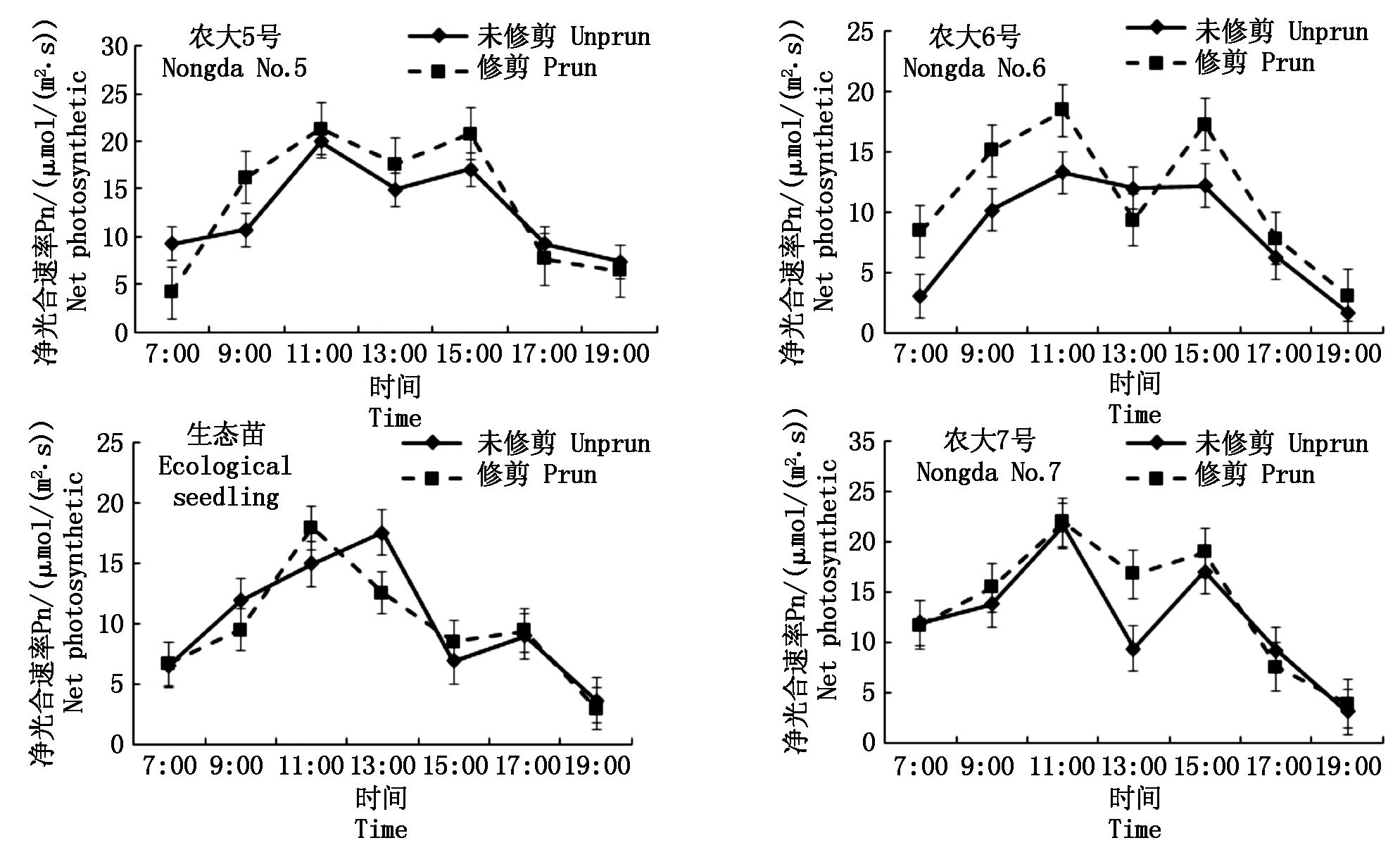
图5 修剪和未修剪的欧李品种净光合速率(Pn)日进程比较
Fig.5 Comparison of the diurnal processes of the net photosynthetic rate(Pn)of prun and unprun Cerasus humilis
修剪的4个欧李品种Gs日变化趋势与未修剪的一致,农大5号和农大7号呈“双峰”曲线,峰值分别出现在11:00和15:00,农大6号和生态苗呈“单峰”曲线,峰值出现在11:00。与未修剪的相比,修剪的4个欧李品种的Gs,尤其是日出到15:00之间Gs明显高于未修剪的(图6)。与未修剪的相比,修剪的4个欧李品种Ci在上午下降幅度较大,在11:00达到最小值,最小值分别为122.41,121.70,115.14,186.07 μmol/mol,均小于未修剪的最小值(159.02,121.92,120.84,190.58 μmol/mol),然后下午修剪的Ci上升速度比未修剪的缓慢(图7)。说明经修剪后,树冠中部叶片的细胞间隙CO2 浓度的下降幅度增加,这是因为将多余的枝叶剪掉,提高了树冠内部的通风条件,叶片细胞间隙 CO2 浓度随着光强的升高其下降速度也越快。农大5号、农大6号和生态苗Tr日变化曲线出现峰值比未修剪的提前1~2 h,且峰值(6.82,5.75,4.78 mmol/(m2·s))均大于未修剪的(6.31,3.01,4.42 mmol/(m2·s)),农大7号修剪的Tr日变化曲线与未修剪的基本接近(图8)。说明修剪枝条提高了树冠内部的通风透光条件,使得树冠内部叶片蒸腾速率的上升幅度得到了提高。
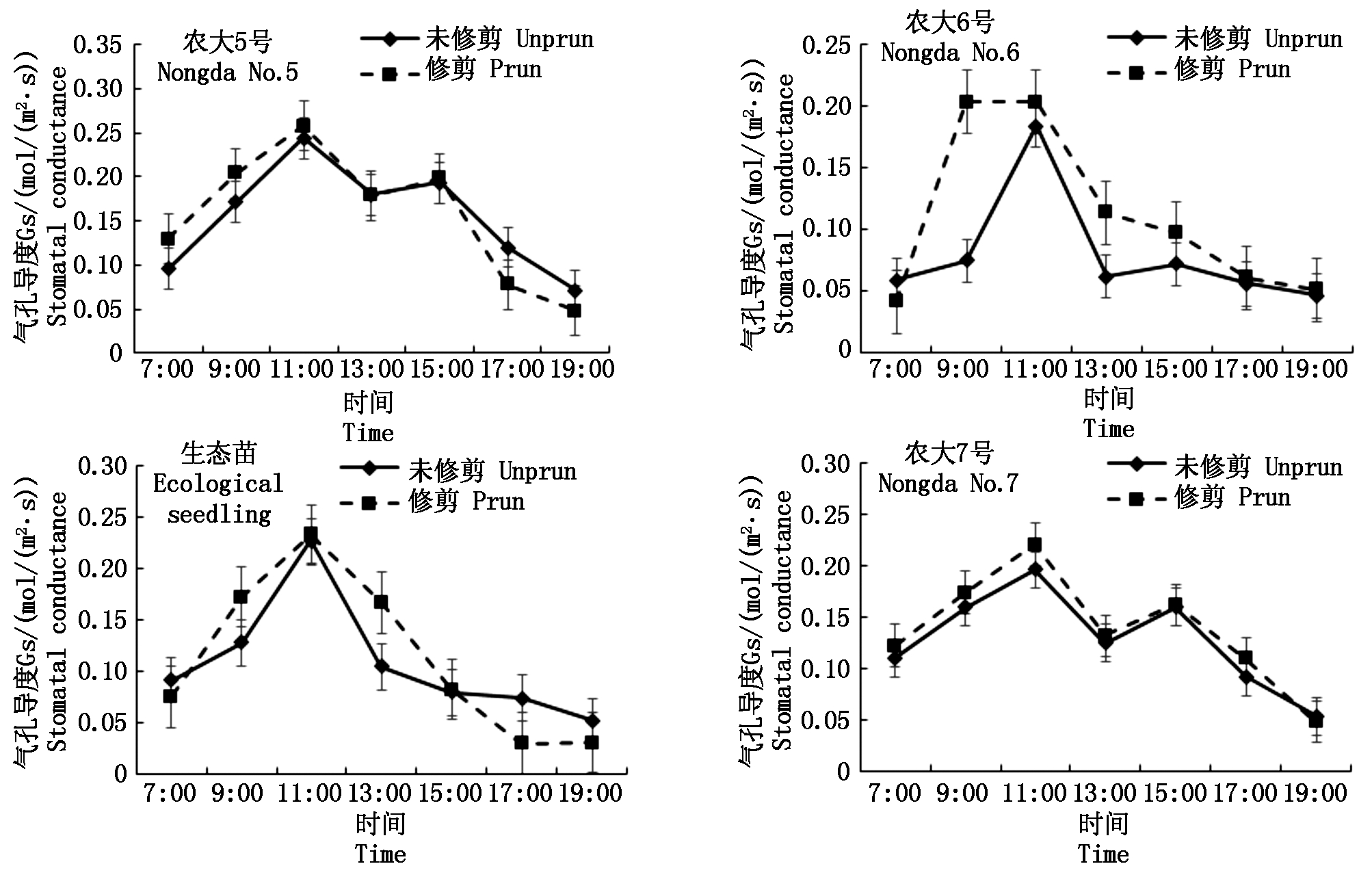
图6 修剪和未修剪的欧李品种气孔导度(Gs)日进程比较
Fig.6 Comparison of the diurnal processes of stomatal conductance(Gs)of prun and unprun Cerasus humilis
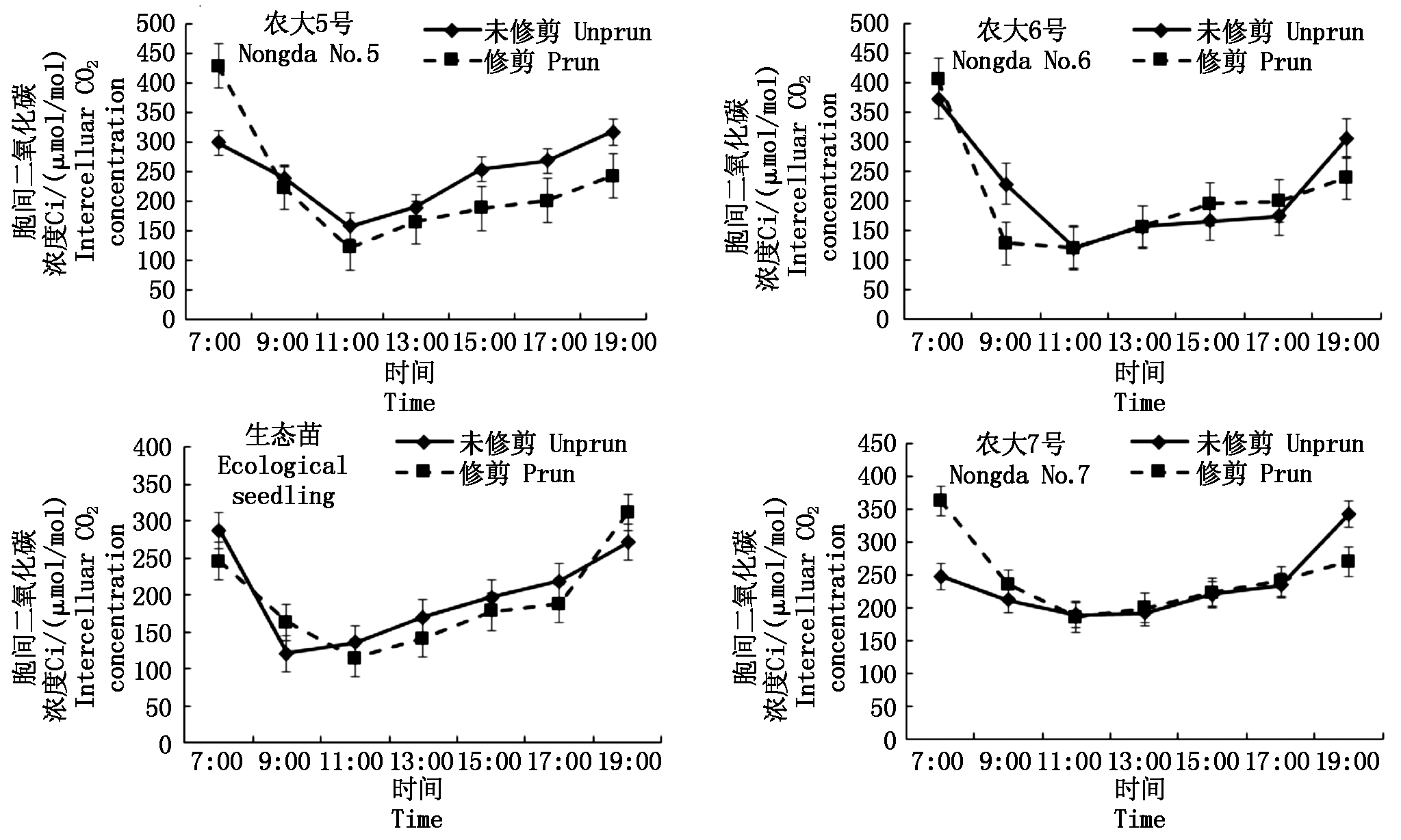
图7 修剪和未修剪的欧李品种胞间CO2浓度(Ci)日进程比较
Fig.7 Comparison of the diurnal processes of the intercellular CO2 concentration(Ci)of prun and unprun Cerasus humilis
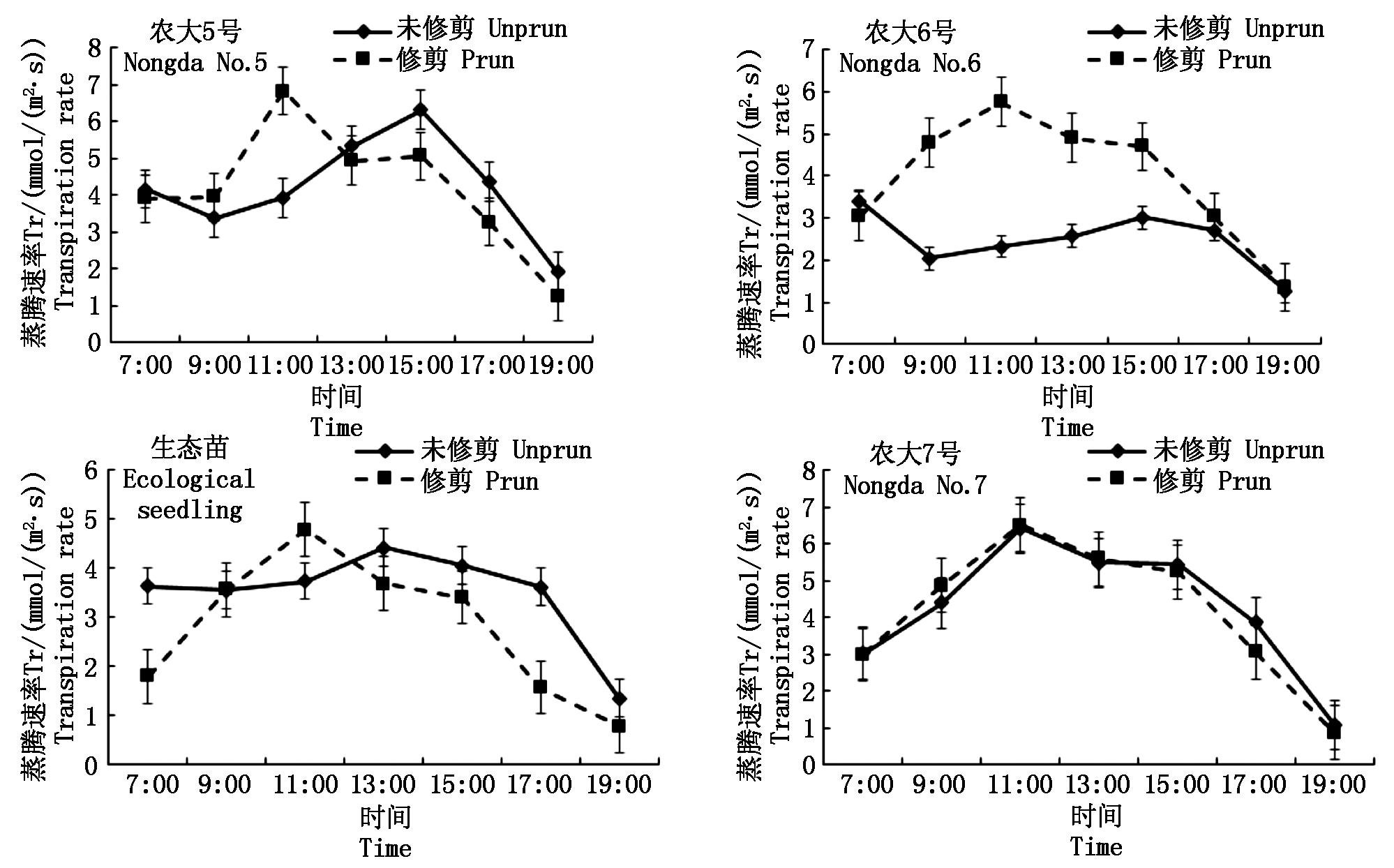
图8 修剪和未修剪的欧李品种蒸腾速率(Tr)日进程比较
Fig.8 Comparison of the diurnal processes of the transpiration rate(Tr)of prun and unprun Cerasus humilis
2.4 修剪与未修剪欧李品种光合参数比较
为了进一步研究修剪对欧李光合作用的影响,分别将未修剪和修剪了的4个欧李品种每个月得到的光合参数进行平均,如图9所示。由图9可以看出,在未修剪条件下,各欧李品种月均Pn、Gs和Tr均表现为农大7号>农大5号>生态苗>农大6号,月均Ci为农大6号>生态苗>农大5号>农大7号。对欧李品种进行修剪后,各品种月均Pn、Gs均表现为农大5号>农大7号>农大6号>生态苗,月均Tr为农大7号>农大5号>农大6号>生态苗,月均Ci为生态苗>农大6号>农大7号>农大5号。另外,除生态苗外,3个引种的欧李品种修剪后的月均Pn、Gs和Tr显著高于未修剪的(P<0.05)。由此可见,修剪枝条对生态苗的光合作用影响不大,对3个引种的欧李品种的光合影响较大,尤其对农大6号的光合作用影响最大。
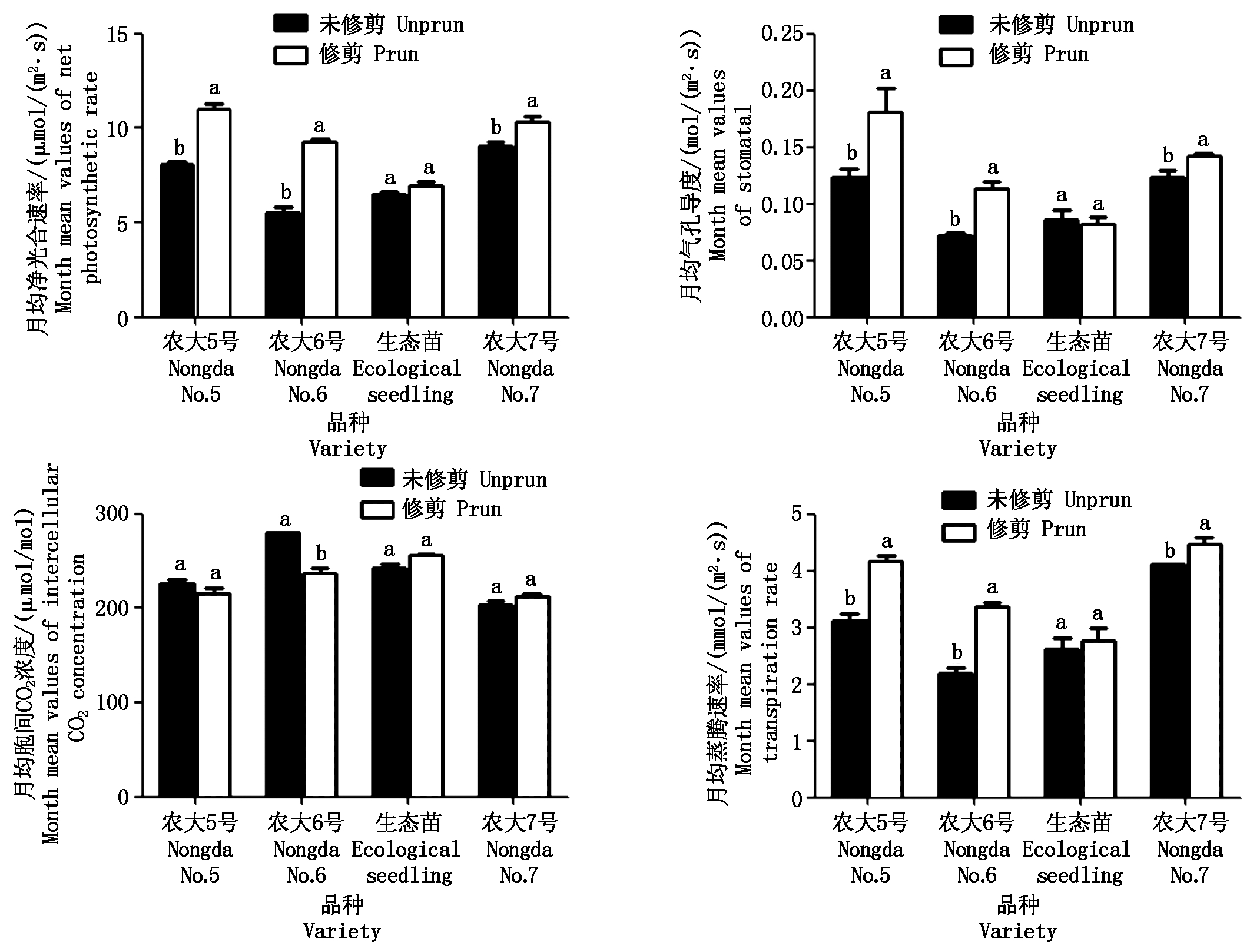
图9 不同修剪与未修剪欧李品种月均净光合速率、胞间 CO2浓度、气孔导度、蒸腾速率比较
Fig.9 Comparison of the mean monthly values of net photosynthetic rate, intercellular CO2 concentration, stomatal conductance, transpiration rate of different varieties of prun and unprun Cerasus humilis
3 讨论与结论
3.1 不同欧李品种光合作用日进程
光合作用属于酶促反应,植物所处的环境在一定程度上决定了光合能力的大小[15]。6,7月,4个欧李品种Pn日变化均基本为“双峰”曲线,出现明显的 “午休” 现象。这是因为6,7月的温度和光强都很高,特别是中午12:00左右,6月光照强度为1 688 μmol/(m2·s),最高温度达到35 ℃,7月光照强度为1 773 μmol/(m2·s),最高温度达到38 ℃,而此时由于叶片蒸腾速率大,为了减小水分的散失,气孔关闭,阻断与外界气体的交换,使得 Ci大幅度降低,光合作用所需要的CO2原料不足,导致Pn降低。8,9月,4个欧李品种Pn日变化均为“单峰”曲线,这是因为到了8,9月,温度和光强都开始降低,中午12:00左右,光强分别为1 470,1 256 μmol/(m2·s),最高温度均为30 ℃,因此没有出现“午休”现象。从本研究结果来看,同一试验地不同欧李品种Pn日变化曲线存在一定的差异,6,7月,农大5号、农大6号和农大7号第1峰出现在11:00,第2峰出现在15:00,生态苗峰值6月分别出现在9:00和13:00,而7月分别出现在13:00和17:00,8月农大5号、农大6号和生态苗在11:00达到最大值,农大7号在13:00达到最大值,9月农大5号、农大6号和农大7号在11:00达到最大值,生态苗在13:00达到最大值。这是因为不同欧李品种的生长发育程度不同,已有研究表明,不同欧李品种的物候期并不完全相同,各个品种中,最早展叶的是在2月20日,最迟展叶的是在3月8日,两者相差15 d左右[1]。另外,光合差异性还与外界环境条件有关。
在自然条件下,光合有效辐射、气孔导度、蒸腾速率、胞间 CO2 浓度等因素在一定程度上决定了植物的光合特征[16],净光合速率变化规律在一定范围内与气孔导度、蒸腾速率变化是一致的[2]。从本研究结果可以看出,4个欧李品种在不同月份的Pn、Gs、Tr变化趋势基本一致。蒸腾速率的大小和空气相对湿度及大气温度有很大的关系, 12:00-14:00的时段,气温最高、光照最强,此时叶温快速升高, 叶片内外蒸气压梯度增加, 蒸腾速率增大,保卫细胞和表皮细胞通过向大气蒸腾水分,导致整个叶片水势下降,气孔阻力增大[17]。4个欧李品种Tr呈单峰变化趋势,单峰值出现的时间存在品种间差异。气孔导度是植物气孔传导 CO2 和水汽的能力,植物通过改变气孔的开张等方式来控制与外界的 CO2 和水汽交换,进而调节光合速率和蒸腾速率,以适应不同的环境条件[18]。欧李Ci变化趋势与Pn相反,呈凹峰形曲线。通常光合速率的降低有两方面的原因:气孔限制和非气孔限制,根据Farquhar等[19]的研究结果,如果 Pn和Ci 变化方向相同,并且Gs降低时Pn的降低是气孔因素造成的,如果 Pn和Ci变化方向相反,并且Gs增大,则Pn的下降主要是由非气孔限制,即叶肉细胞同化能力的降低引起的。因此,6,7月农大5号和农大7号光合“午休”现象是非气孔因素造成的。
3.2 不同欧李品种光合参数
光是影响植物光合作用的重要因子,不同月份下光强的变化对欧李品种光合特性有较大的影响[15]。本研究中,不同月份,不同品种的光合参数变化较大,4个欧李品种在7月均表现出较强的光合作用能力,7月日均Pn均最高,均显著高于9月份,田间物候观测表明,民勤引种欧李3月初开始展叶,5月始果,6,7月果实成熟,8月花期结束,9月种子成熟,可见叶片光合速率降低同营养生长减弱基本是一致的。4个月份中,农大7号的日均Pn均最高,农大7号和农大5号之间无显著性差异,但均显著高于农大6号,生态苗高于农大6号。由此可以看出,农大7号和农大5号光合作用性能较好,光合生理具有一定的可塑性,该品种能够充分的利用当地的光照条件,这一结果与张世军等[5]的研究结果基本一致。
3.3 修剪对欧李品种光合作用的影响
果树的光合能力是果实品质形成的基础[20]。修剪是调整树形结构和树冠光照条件的重要部分,重剪可以改善树冠内部光照条件,增加光合能力,提高果实品质[21]。张文等[22]研究发现,在生长季通过修剪根系可以提高叶片的净光合速率。崔春梅等[23]研究了短截程度对果树光合能力的影响,随着短截程度加重,富士苹果的光合能力增强。王开良等[24]的研究表明,油茶树在经过修剪后,其光合速率得到提升,且修剪范围越大,光合速率提升的幅度越高。李美美等[25]通过对核桃树进行重回缩与拉枝发现,树冠中部叶片的 Pn、Tr 和Gs上升,Ci下降。魏树伟等[26]的研究结果表明,棚架形丰水梨由于主干高,通风透光好,具有更高的光合能力。在本研究中,尽管修剪的4个欧李品种Pn、Gs、Ci日变化趋势与未修剪的基本一致,但峰值均高于未修剪,且引种的3个欧李品种月均光合参数修剪后的显著高于未修剪的,这与上述研究结果一致。但对生态苗而言,修剪的与未修剪的月均光合参数之间无显著性差异,这可能是因为生态苗株高较小,冠幅也较小,修剪后其树冠中部的透光及通风性改善不明显,而经过人工培育的欧李品种其株高较大,冠幅也较大,经修剪后,受光照比较均匀,通风透光好。由此可见,良好的光照条件有利于其进行光合作用,因此,在栽植培育过程中,要尽可能地改善树冠内部的光照条件。
综上所述,农大5号和农大7号光合性能好,通过科学的整形修剪,合理利用光能,有望增加果实产量,提高果品质量,可以大力推广种植,从而达到丰产、高效、优质栽培的目的。
[1] 罗亚红,李志琴,周正邦,李志芳,欧珍贵.4个钙果品种北种南引的适应性鉴选[J].贵州农业科学,2011,39(11):42-44.doi:10.3969/j.issn.1001-3601.2011.11.013.
Luo Y H, Li Z Q, Zhou Z B, Li Z F, Ou Z G.Adaptability of four Cerasus humilis varieties introduced from the North[J].Guizhou Agricultural Sciences,2011,39(11):42-44.
[2] 周文才,巢军,孙颖,左继林,黄文印.不同钙果品系引种试验[J].南方林业科学,2017,45(1):14-17.doi:10.16259/j.cnki.36-1342/s.2017.01.004.
Zhou W C,Chao J,Sun Y, Zuo J L, Huang W Y.Introduction experiment of different Cerasus humilis[J].South China Forestry Science,2017,45(1):14-17.
[3] 马敏.钙果在大同地区的种植栽培及发展前景[J].农业科学,2018,38(3):25-26.doi:10.11974/nyyjs.20180329011.
Ma M.Cultivation and development prospect of Cerasus humilis in datong area[J].Agricultural Science,2018, 38(3):25-26.
[4] 郭永红,魏校峰.钙果开发利用价值及栽培[J].特种经济动植物,2009,12(4):49-50.doi:10.3969/j.issn.1001-4713.2009.04.035.
Guo Y H,Wei X F.Cultivation and utilization value of Cerasus humilis[J].Special Economic Animal and Plant,2009,12(4):49-50.
[5] 张世军,母冰洁,薛东,卜芳侠,薛安明,王露宁.五个欧李品种叶片光合作用与水分利用效率比较研究[J].陕西林业科技,2018,46(1): 10-13.doi:10.3969/j.issn.1001-2117.2018.01.003.
Zhang S J,Mu B J,Xue D, Bo F X, Xue A M, Wang L N.Comparison of leaf photosynthetic process with water consumption of five varieties of Cerasus humilis[J].Shaanxi Forest Science and Technology,2018,46(1):10-13.
[6] 杨志晓,丁燕芳,张小全,薛刚,王轶,任学良,任周营,杨铁钊.赤星病胁迫对不同抗性烟草品种光合作用和叶绿素荧光特性的影响[J].生态学报,2015,35(12):4146-4154.doi:10.5846/stxb201308212124.
Yang Z X,Ding Y F, Zhang X Q, Xue G, Wang Y, Ren X L, Ren Z Y, Yang T Z.Impacts of Alternaria alternata stress on characteristics of photosynthesis and chlorophyll fluorescence in two tobacco cultivars with different resistances[J].Acta Ecologica Sinica,2015, 35(12):4146-4154.
[7] 周朝彬,宋于洋,王炳举,李荣,李明艳,李园园.干旱胁迫对胡杨光合和叶绿素荧光参数的影响[J].西北林学院学报,2009,24(4): 5-9.
Zhou C B,Song Y Y,Wang B J, Li R, Li M Y, Li Y Y.Effects of drought stress on photosynthesis and chlorophyll fluorescence parameters of Populus euphratica[J].Journal of Northwest Forestry University,2009,24(4):5-9.
[8] 尹赜鹏,刘雪梅,尚志伟,任静,宋兴舜.不同干旱胁迫下欧李光合及叶绿素荧光参数的响应[J].植物生理学报,2011, 47(5):452-458.
Yin Z P, Liu X M, Shang Z W, Ren J,Song X S.Response of photosynthesis and chlorophy Ⅱ fluorescence parameters to different drought stress in Cerasus humilis Bunge[J].Plant Physiology Journal,2011,47(5):452-458.
[9] 褚建民,孟平,张劲松,高峻.土壤水分胁迫对欧李幼苗光合及叶绿素荧光特性的影响[J].林业科学研究,2008, 21(3):295-300.doi:10.3321/j.issn:1001-1498.2008.03.003.
Chu J M,Meng P,Zhang J S, Gao J.Effects of soil water stress on the photosynthesis characteristics and chlorophyll fluorescence parameters of Cerasus humilis seedling[J].Forest Research,2008,21(3):295-300.
[10] 卫娇娇,周兰英,李仲彬,杜澜.不同栽植密度对引种欧李光合特性的影响[J].华北农学报, 2017, 32(S1):195-200.doi:10.7668/hbnxb.2017.S1.034.
Wei J J,Zhou L Y,Li Z B, Du L.Effect of different planting densities on photosynthetic characteristics of introduced Cerasus humilis[J].Acta Agriculturae Boreali-Sinica,2017, 32(S1):195-200.
[11] 许大全.光合作用气孔限制分析中的一些问题[J].植物生理学通讯,1997, 33(4):241-244.
Xu D Q.Some problem in stomatal limitation analysis of photosynthesis[J].Plant Physiology Communications, 1997, 33(4):241-244.
[12] 孙龙,彭祚登,王冲,杨腾.干旱胁迫对两种沙地灌木能源树种光合特性的影响[J].南京林业大学学报(自然科学版), 2014,38(2):99-104.doi:10.3969/j.issn.1000-2006.2014.02.019.
Sun L, Peng Z D, Wang C, Yang T.Effect of drought stress on photosynthetic characteristics of two energy resource sandy shrubs[J].Journal of Nanjing Forestry University(Natural Sciences Edition),2014,38(2):99-104.
[13] 李怡,刘发民,宋耀选,李毅.柽柳叶片光合速率日变化特征的研究[J].安徽农业科学,2008,36(18):7559-7560,7563.doi:10.3969/j.issn.0517-6611.2008.18.026.
Li Y,Liu F M,Song Y X, Li Y.Study on the daily variations of photosynthesis rate in leaves of Tamarix ramosissima[J].Journal of Anhui Agri Sci,2008,36(18):7559-7560,7563.
[14] 张世军,母冰洁,褚翔,薛东,薛安明,王乃江,王露宁.欧李新品系“农大3号”光合特性研究[J].陕西林业科技,2017(4):10-13.doi:10.3969/j.issn.1001-2117.2017.04.004.
Zhang S J,Mu B J,Chu X, Xue D,Xue A M,Wang N J,Wang L N.Photosynthesis of new variety of Cerasus humilis-Nongda 3[J].Shaanxi Forest Science and Technology, 2017(4):10-13.
[15] 王强,金则新,郭水良,管铭,王兴龙.濒危植物长叶榧的光合生理生态特性[J].生态学报, 2014, 34(22):6460-6470.doi:10.5846/stxb201302260307.
Wang Q, Jin Z X, Guo S L, Guan M,Wang X L.Photosynthetic traits of the endangered plant species Torreya jackii[J].Acta Ecologica Sinica,2014,34(22):6460-6470.
[16] 马玉坤,贾永芳,马静芳,王旺田.不同砧木对红地球葡萄光合日变化的影响[J].江苏农业学报,2012,28(3):638-642.doi:10.3969/j.issn.1000-4440.2012.03.034.
Ma Y K, Jia Y F, Ma J F, Wang W T.Effects of different rootstocks on diurnal variation of photosynthesis of Red Globe grape[J].Jiangsu Journal of Agricultural Sciences,2012,28(3):638-642.
[17] 贾杨,廖康,牛莹莹,马微,江振斌,骆强伟,伍国红.不同葡萄品种在吐鲁番的光合特性及荧光参数差异分析[J].新疆农业大学学报, 2015,38(1):12-17.doi:10.3969/j.issn.1007-8614.2015.01.002.
Jia Y,Liao K,Niu Y Y, Ma W, Jiang Z B, Luo Q W,Wu G H.Analysis on difference of photosynthetic characteristics and fluorescence parameters of different grape varieties in Turpan Area[J].Journal of Xinjiang Agricultural University,2015,38(1):12-17.
[18] 何军,许兴,李树华,张源沛,米海莉,李明轩.不同时期牛心朴子和甘草光合蒸腾日变化的研究[J].西北植物学报,2003,23(10): 1676-1681.doi:10.3321/j.issn:1000-4025.2003.10.004.
He J,Xu X, Li S H, Zhang Y P, Mi H L, Li M X.Study on diurnal changes of photosynthesis and transpiration of Cynanchum komarovii and Glycyrrhiza uralensis in different stage[J].Acta Bot Boreal-Occident Sin,2003,23(10):1676-1681.
[19] Farquhar S P, Sharkey T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology, 1982,33(1):317-345.doi:10.1146/annurev.pp.33.060182.001533.
[20] 李培环,吴军帅,董晓颖,王金政,薛晓敏,路超.苹果密闭园不同间伐方式对光照、光合和生长结果的影响[J].中国农业科学, 2012,45(11):2217-2223.doi:10.3864/j.issn.0578-1752.2012.11.010.
Li P H,Wu J S, Dong X Y, Wang J Z, Xue X M, Lu C.Effects of different thinning methods on illumination, photosynthetic,growth and fruiting in airtight apple orchard[J].Scientia Agricultura Sinica,2012,45(11):2217-2223.
[21] 宋凯,魏钦平,岳玉苓,王小伟,张继祥.不同修剪方式对红富士苹果密植园树冠光分布特征与产量品质的影响[J].应用生态学报,2010, 21(5):1224-1230.
Song K, Wei Q P, Yue Y L, Wang X W,Zhang J X.Effects of different pruning modes on the light distribution characters and fruit yield and quality in densely planted Red Fuji apple orchard[J].Chinese Journal of Applied Ecology,2010, 21(5):1224-1230.
[22] 张文,朱雪荣,周克友,范崇辉.根系修剪对苹果树光合特性及果实品质的影响[J].西北林学院学报,2013,28(6): 42-45,62.doi:10.3969/j.issn.1001-7461.2013.06.08.
Zhang W, Zhu X R, Zhou K Y, Fan C H.Effects of roots system pruning on photosynthetic characteristics and fruit quality of apple tree[J].Journal of Northwest Forestry University,2013,28(6):42-45,62.
[23] 崔春梅,莫伟平,邢思年,王博茜,张蕾,刘国杰.不同短截程度对苹果枝条修剪反应及新稍叶片光合特性的影响[J].中国农业大学学报,2015,20(5):119-125.
Cui C M,Mo W P,Xing S N, Wang B X,Zhang L,Liu G J.Effects of various cutting back degree on pruning and photosynthetic characteristics of new shoot leaves in apple trees[J].Journal of China Agricultural University, 2015, 20(5): 119-125.
[24] 王开良,姚小华,申巍,龙伟,王毅.修剪施肥对油茶叶绿素含量及光合速率的影响[J].山东农业大学学报(自然科学版), 2015,46(5):666-670.doi:10.3969/j.issn.1000-2324.2015.05.005.
Wang K L,Yao X H,Shen W, Long W,Wang Y.Effect of pruning and fertilization on chlorophyll photosynthetic rate of Camellia oleifera[J].Journal of Shandong Agricultural University(Natural Science Edition),2015,46(5):666-670.
[25] 李美美,马华冰,赵爽,齐国辉,李保国,陈利英.不同修剪方式对成龄绿岭核桃光合作用的影响[J].林业科技开发,2014,28(5): 104-108.doi:10.13360/j.issn.1000-8101.2014.05.026.
Li M M, Ma H B, Zhao S, Qi G H, Li B G, Chen L Y.Heavy cutting-back and bending branch influence on photosynthesis of adult Lüling walnut[J].China Forestry Science and Technology, 2014, 28(5):104-108.
[26] 魏树伟,王宏伟,张勇,王少敏.不同树形对丰水梨光合特性的影响[J].山东农业科学,2012,44(4):53-55.doi:10.3969/j.issn.1001-4942.2012.04.014.
Wei S W, Wang H W, Zhang Y, Wang S M.Effects of different tree shapes on photosynthesis characteristics of Hosui Pear[J].Shandong Agricultural Sciences,2012,44(4):53-55.