卵型家族蛋白(Ovate family proteins, OFPs)是植物特异性转录因子家族[1],参与调控植物的生长和发育的多个方面,该蛋白家族的特征是具有保守的OVATE结构域,在OVATE蛋白质的羧基末端包含一个由70个氨基酸组成的保守结构域,OVATE基因首先在番茄中被鉴定为果实形状的关键调控因子[2]。该蛋白质在拟南芥(Arabidopsis thaliana)[3]、番茄(Solanum lycopersicum)[1]和水稻(Oryza sativa)[4]中均是保守的。在拟南芥卵形家族蛋白(AtOFPs)具有多种生物学功能,如AtOFP1作为一种转录阻遏物,可通过控制赤霉素生物合成酶AtGA20ox1的表达来调节细胞的伸长[5];AtOFP4与KNAT7的相互作用可以调节拟南芥中次生细胞壁的形成[6];AtOFP15和AtOFP16参与调控拟南芥荚果的形态发育[7]。
东北农业大学生命科学学院常缨教授课题组的前期研究发现,Columbia野生型拟南芥(Col)的表皮蜡质分布比Atofp8-1突变体更多,并且低于35S∶HA-AtOFP8的植株,说明AtOFP8能够增加拟南芥表皮蜡质的积累[8],植物表皮蜡质具有限制水分蒸腾的作用,进而保护植物体内水分散失[9]。在干旱条件处理拟南芥发现,AtOFP8的转录水平明显上升,推测AtOFP8可能参与抵抗干旱胁迫的生物过程[10-11] 。
有研究报道,水稻OsOFP6的过表达会引起失水速度和H2O2积累降低,而RNAi植物的失水速度和H2O2含量积累更快,表明OsOFP6可以提高水稻的抗旱性[12]。因此,本研究以AtOFP8作为研究对象,从拟南芥种子萌发率及幼苗生长、质膜稳定性、抗氧化酶活性和渗透调节能力及干旱应答基因表达水平的角度,探索转录因子AtOFP8在拟南芥应对干旱胁迫中的作用,以期为利用该基因提高拟南芥的抗旱性奠定基础。
1 材料和方法
1.1 试验材料
本试验应用Columbia野生型(Col)、Atofp8-1突变体和35S∶HA-AtOFP8拟南芥为试验材料,试验材料由东北师范大学王树才教授提供。拟南芥的生长培养条件:温度23 ℃,光周期为16 h/8 h(光照/黑暗)。
1.2 试验方法
1.2.1 AtOFP8基因突变体及过表达体的鉴定 根据已知的AtOFP8基因(At5g19650)设计引物,AtOFP8基因的正向引物和反向引物分别为5′-TT CTTTGCTCATACGGTCA-3′和5′-GGAGAGAACAAG GTGGCATAAA-3′, 以拟南芥中ACTIN2为内参基因,正向引物和反向引物分别为5′-CTCGTTGTCCT CCTCACTT-3′和5′-TTCTTTGCTCATACGGTCA-3′,应用PCR技术对Atofp8-1突变体和35S∶HA-AtOFP8植株进行鉴定。
1.2.2 干旱胁迫下拟南芥植株表型观察及生理指标分析 将Col、Atofp8-1和35S∶HA-AtOFP8拟南芥种子分别种在甘露醇浓度为0,200,300 mmol/L的1/2 MS培养基中,每个平板中播50粒拟南芥种子,观察分析种子的萌发状况及子叶变绿状况,以胚根突破种皮 1 mm即视为萌发,子叶完全变绿才计为绿叶。
拟南芥植株培养21 d时,对照组生长环境不变,干旱试验的植株停止浇水,拍照记录植株变化。分别在干旱试验开始后的第5,10,15天取对照组和试验组植株的叶片,液氮速冻用于测定生理指标。丙二醛(MDA)含量测定采用硫代巴比妥酸法[13] ;超氧化物歧化酶(SOD)活性采用氮蓝四唑法测定[14];过氧化物酶(POD)活性采用愈创木酚法测定[15];脯氨酸(Pro)含量采用茚三酮比色法测定[16];可溶性蛋白含量测定采用考马斯亮蓝染色法[17]。
1.2.3 荧光定量PCR(qRT-PCR)试验 实时荧光定量PCR反应系统为Mx-3000p Real-time PCR Systerm。根据AtADH1基因(AT1G77120)设计的正向引物和反向引物分别为5′-TGTGACCGAGTGTGTGAACCC-3′和5′-GATGAGTCTTGAAGGCATCGTCT-3′,AtRD26基因(AT4G27410)的正向引物和反向引物分别为5′-TGG AAAGCAACGGGTACTGAC-3′和5′-TCCAGATGTTTT CTTGTAAATTCGAC-3′,AtRDUF2基因(AT5G59550)的正向引物和反向引物分别为5′-GATTCGCCGTA GGGAGGTTTA-3′和5′-GAACCTGAGCCAGTACCGT TAC-3′,AtERD7基因(AT2G17840)的正向引物和反向引物分别为5′-AAGCGAAGGAAGCAGGTGAAA-3′和5′-TCCCCAAATAAGCCTATCCATAGTC-3′,AtOFP8基因(At5g19650)的正向引物和反向引物分别为5′-CCCACCAAACCCTTTCTACGA-3′和5′-GGGTCAGAA CCAAACTGCGAT-3′,以拟南芥中ACTIN2为内参基因,正向引物和反向引物分别为5′-TGGGTTTTTACT TACGTCTGCG-3′和5′-GGGAACAAAAGGAATAAAGA GGC-3′。取3次生物学重复的平均值,用软件SPSS分析对照组与试验组的数据显著性。
2 结果与分析
2.1 AtOFP8基因突变体及过表达植株的鉴定
如图1所示,与Col植株相比,35S∶HA-AtOFP8过表达拟南芥中植株AtOFP8基因的转录水平增加,Atofp8-1突变体植株中未检测到AtOFP8基因的转录。
2.2 AtOFP8对干旱拟南芥种子萌发率及幼苗生长的影响
2.2.1 种子萌发率 在对照组中,Col、Atofp8-1和35S∶HA-AtOFP8植株种子萌发率无显著差异,且在第4天时,萌发率为100%(图2-A);在200 mmol/L甘露醇处理5 d时,35S∶HA-AtOFP8和Col植株种子萌发率为100%,Atofp8-1植株种子萌发率为88%,在7 d时,Atofp8-1植株萌发率为100%(图2-B);在300 mmol/L甘露醇处理7 d时,Col 和35S∶HA-AtOFP8植株种子萌发率为100%,而Atofp8-1植株种子萌发率仅为76%(图2-C),表明干旱胁迫严重抑制了Atofp8-1植株种子萌发率。
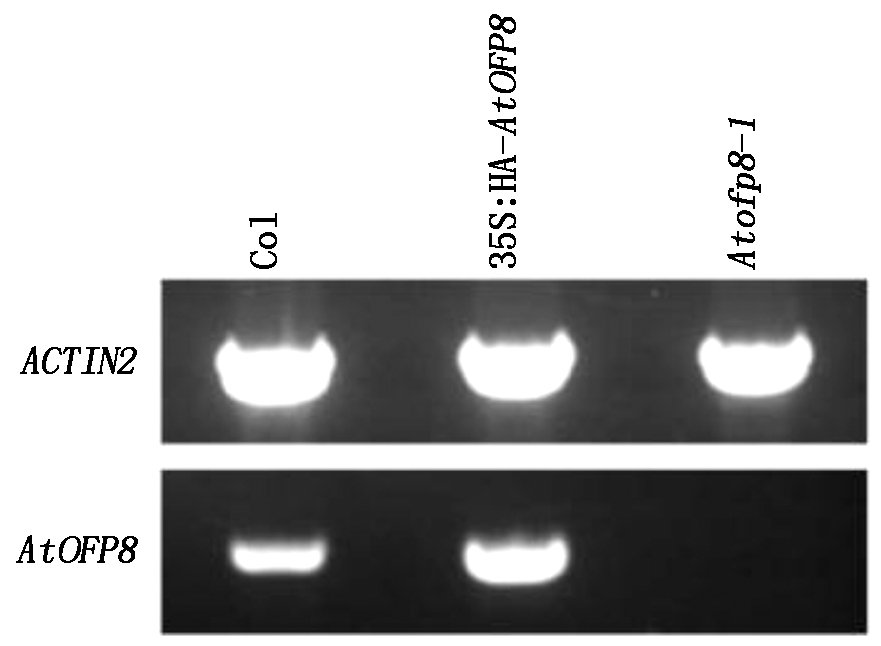
图1 Atofp8-1和35S∶HA-AtOFP8植株的鉴定
Fig.1 Molecular identification of the Atofp8-1 mutant and 35S∶HA-AtOFP8 transgenic plants
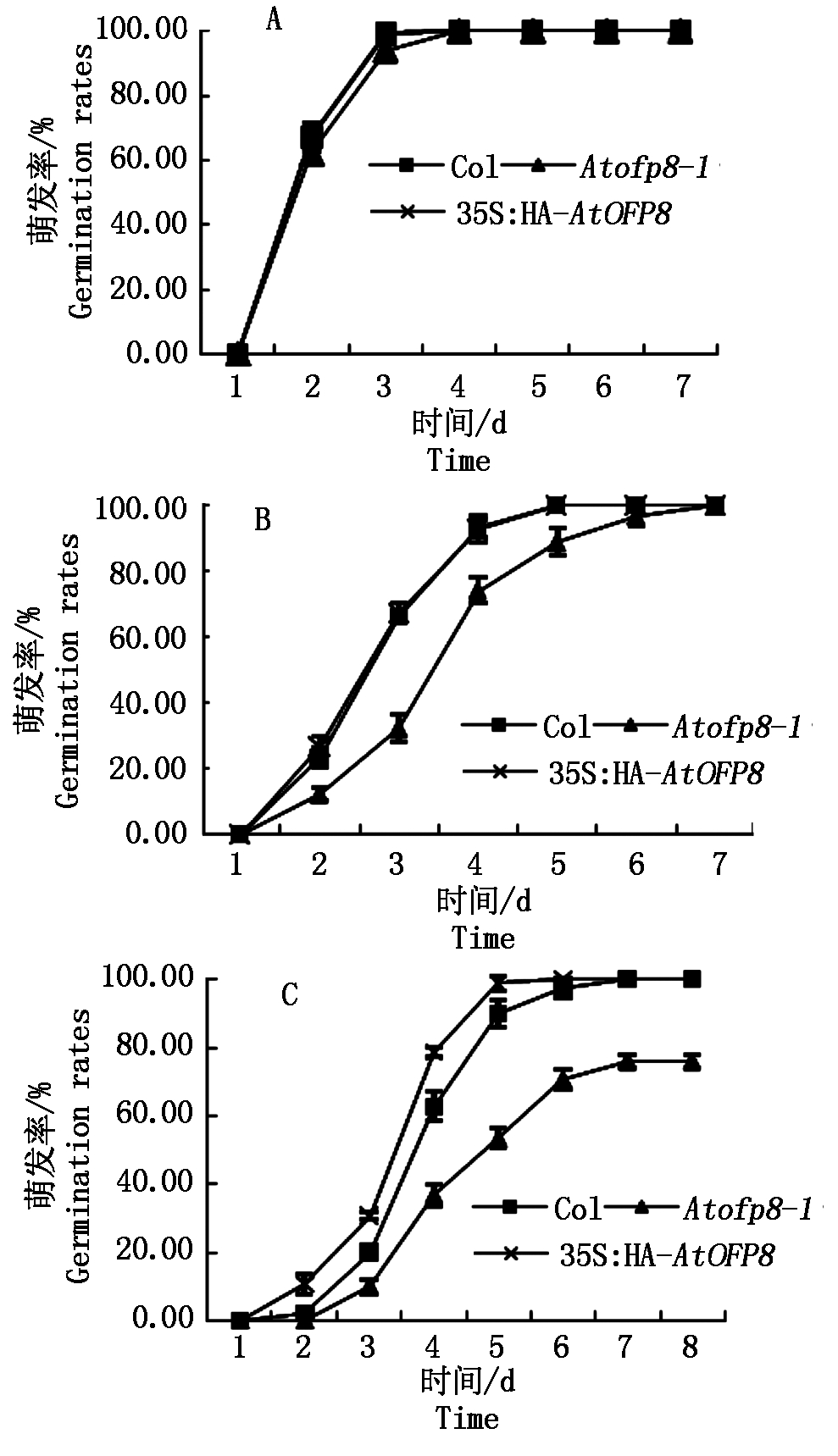
A.对照组;B.200 mmol/L甘露醇试验组; C.300 mmol/L甘露醇试验组。图3同。 A.Control group; B.200 mmol/L mannitol experimental group; C.300 mmol/L mannitol experimental group.The same as Fig.3.
图2 Col、Atofp8-1和35S∶HA-AtOFP8植株在 不同浓度甘露醇处理下的种子萌发率
Fig.2 Seed germination rate of Col, Atofp8-1 and 35S∶HA-AtOFP8 plant under different concentrations of mannitol
2.2.2 绿叶率 植物叶片对干旱胁迫十分敏感,轻度干旱胁迫就会使植株叶片发生性状变化。在对照组中,Col、Atofp8-1和35S∶HA-AtOFP8植株绿叶率无显著差异,且在7 d时绿叶率均为100%(图3-A);在200 mmol/L甘露醇处理9 d时,35S∶HA-AtOFP8和Col植株绿叶率均为100%,Atofp8-1植株绿叶率为84%(图3-B);在300 mmol/L甘露醇处理11 d时,35S∶HA-AtOFP8植株绿叶率为54%,Col植株绿叶率为24%,但Atofp8-1植株绿叶率只有12%(图3-C)。

图3 Col、Atofp8-1和35S∶HA-AtOFP8 植株在不同浓度甘露醇处理下的绿叶率
Fig.3 Green leaf rate of Col, Atofp8-1 and 35S∶HA-AtOFP8 plant treated with different concentrations of mannitol
2.2.3 表型 当植物遭受干旱胁迫时,叶片会出现下垂的表型,抗旱性较强的植株,叶片下垂程度较轻,叶片中相对含水量更高。对Col、Atofp8-1和35S∶HA-AtOFP8植株同时停止浇水18 d,观察植株在干旱胁迫下的变化(图4),3种拟南芥植株的表型差异十分明显,其中,Atofp8-1植株叶片萎蔫十分严重,而且部分植株干枯,叶片发黄细小;Col植株叶片也出现萎蔫的性状,多数叶片发生卷曲,但少量叶片黄化;35S∶HA-AtOFP8植株叶片只有轻度萎蔫,少数叶片发生卷曲,叶片黄化程度低于Col植株。说明35S∶HA-AtOFP8植株的抗干旱能力最强。
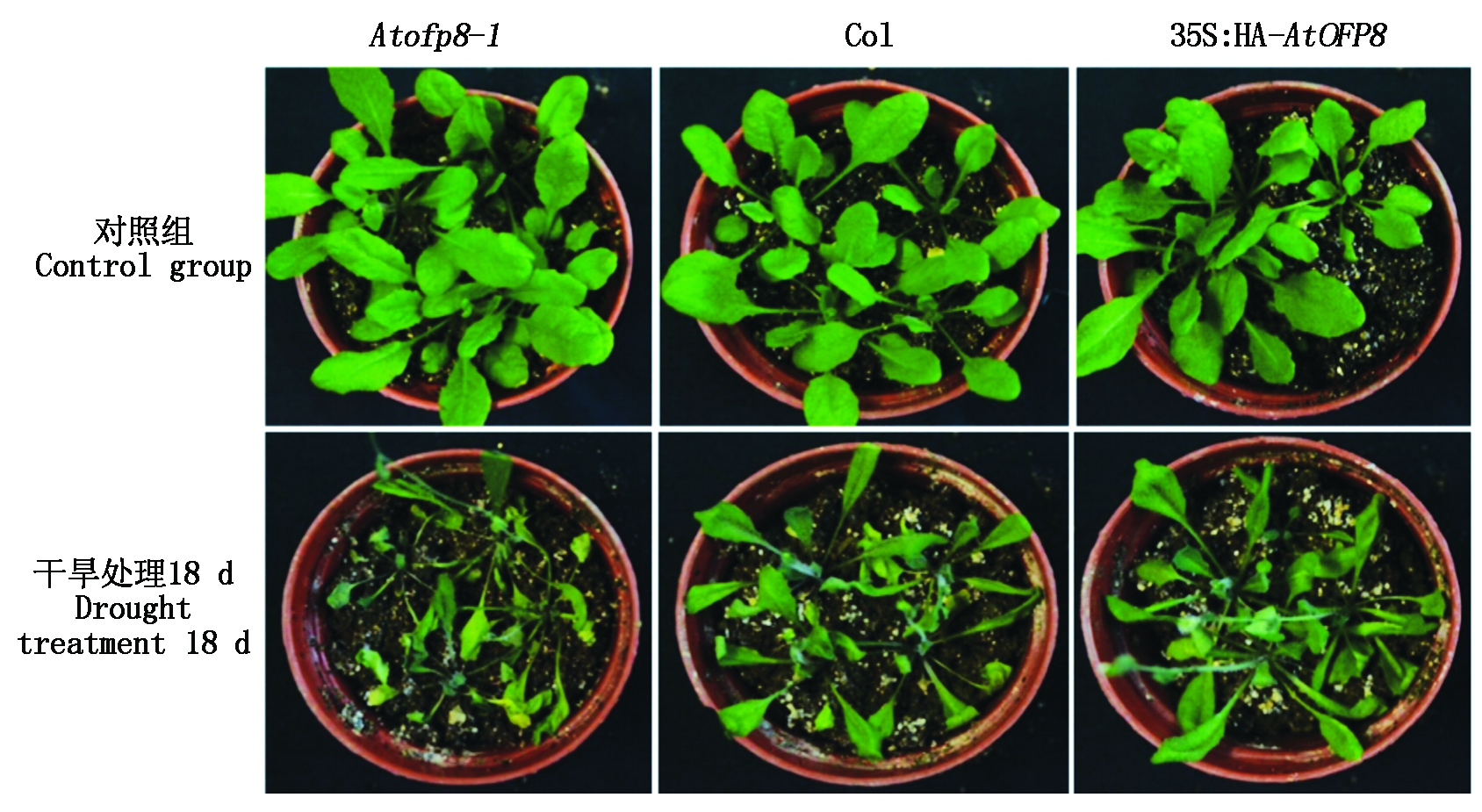
图4 Col、Atofp8-1和35S∶HA-AtOFP8植株在干旱胁迫下生长情况
Fig.4 Growth of Col, Atofp8-1 and 35S∶HA-AtOFP8 plant under drought stress
2.3 AtOFP8对干旱胁迫下植株MDA含量的影响
植物在受到干旱胁迫时,植株体内的活性氧(Reactive oxygen species,ROS)含量会上升,使细胞脂膜受到过氧化作用而形成MDA,破坏细胞膜结构,因此,经常用MDA的含量代表脂膜的过氧化程度[18]。如图5所示,干旱处理5 d时,与对照组相比,Atofp8-1植株叶片中MDA的含量(以鲜质量计)显著增加了60.3%,而Col和35S∶HA-AtOFP8植株叶片中的MDA含量与对照组中的MDA含量无显著差异,说明此时干旱胁迫还未对Col和35S∶HA-AtOFP8植株的细胞脂膜造成过氧化伤害。干旱处理10 d时,Atofp8-1、Col和35S∶HA-AtOFP8植株叶片中MDA的含量分别较对照显著升高了103.4%,67.8%和36.9%,说明此时干旱胁迫对植株细胞膜脂产生过氧化伤害,与Col植株相比,Atofp8-1植株的细胞膜受损更严重,35S∶HA-AtOFP8植株受损最小,但Col、Atofp8-1、35S∶HA-AtOFP8之间差异均未达显著水平。干旱胁迫15 d时,Atofp8-1、Col和35S∶HA-AtOFP8植株叶片中MDA的含量分别较对照显著升高了229.8%,130.4%和71.1%,且35S∶HA-AtOFP8与Col和Atofp8-1差异显著,表明过表达AtOFP8基因能够减轻干旱胁迫对拟南芥植株造成的过氧化损伤。
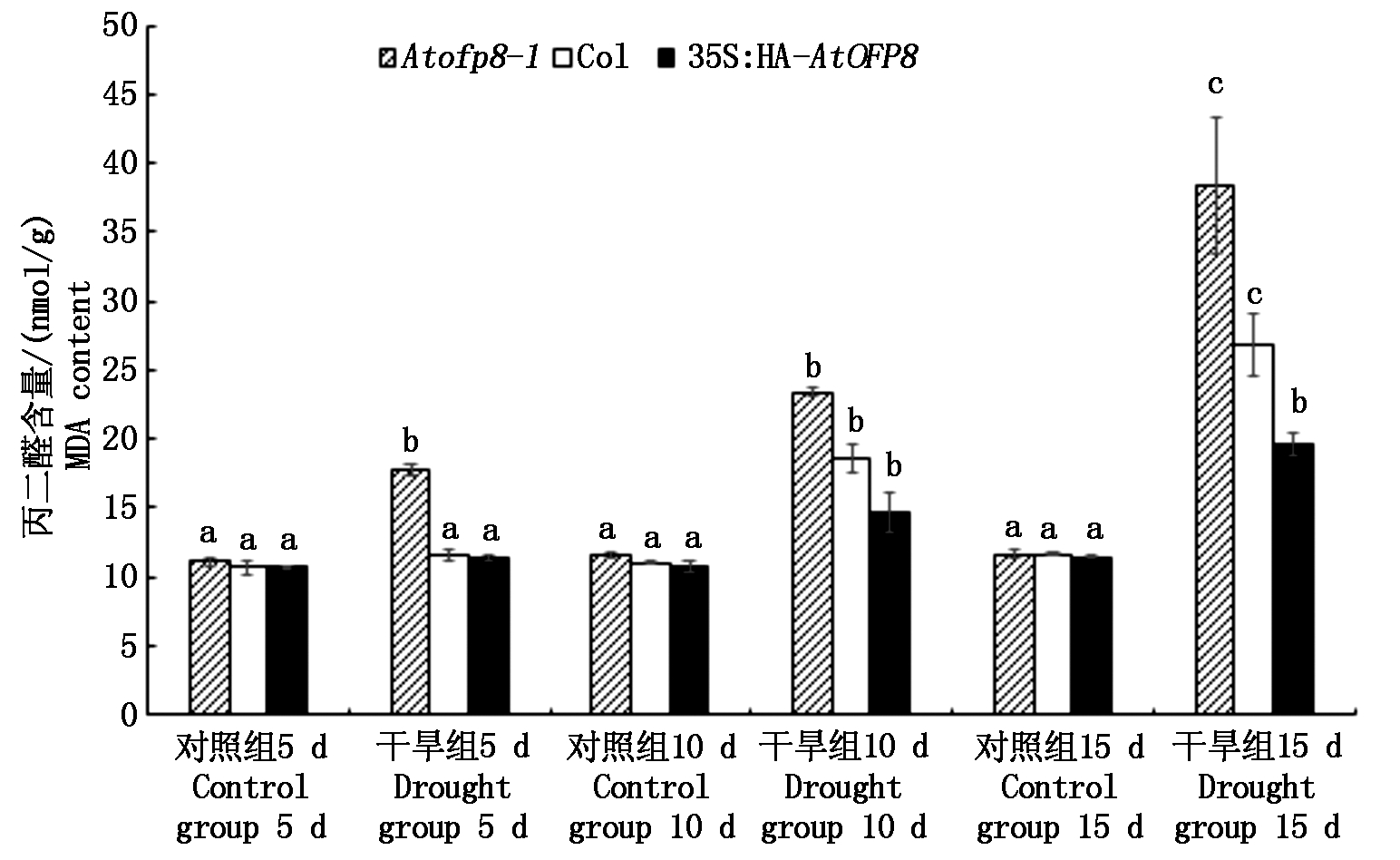
相同字母表示不具有显著差异(P>0.05);不同字母表示具有显著差异(P<0.05)。图6-10同。 The same letters indicate no significant difference(P>0.05);Different letters indicate significant difference(P<0.05).The same as Fig.6-10.
图5 Col、Atofp8-1和35S∶HA-AtOFP8植株在干旱胁迫下的MDA含量
Fig.5 MDA content of Col, Atofp8-1 and 35S∶HA-AtOFP8 plant under drought stress
2.4 AtOFP8对干旱胁迫下植株抗氧化酶活性的影响
2.4.1 SOD活性 植物体内的抗氧化酶系统,能够保护植物细胞脂膜免受过氧化作用的伤害,植物体中的抗氧化酶包括SOD和POD。SOD 是植物细胞中广泛分布的一类金属酶,它组成了植物细胞内第一条抗氧化系统的防线, 在干旱胁迫下植物细胞内SOD 活性与其抗氧化能力呈正相关[19]。如图6所示,干旱胁迫5 d时,Atofp8-1、Col和35S∶HA-AtOFP8植株叶片中SOD的含量(以鲜质量计)分别较对照升高了10.9%,21.4%和27.6%;干旱胁迫10 d时,Atofp8-1、Col和35S∶HA-AtOFP8植株叶片中SOD的含量分别较对照升高了19.6%,62.5%和76.4%;干旱胁迫15 d时,Atofp8-1突变体、Col和35S∶HA-AtOFP8植株叶片中SOD的含量分别较对照升高了16.3%,47.0%和67.3%。
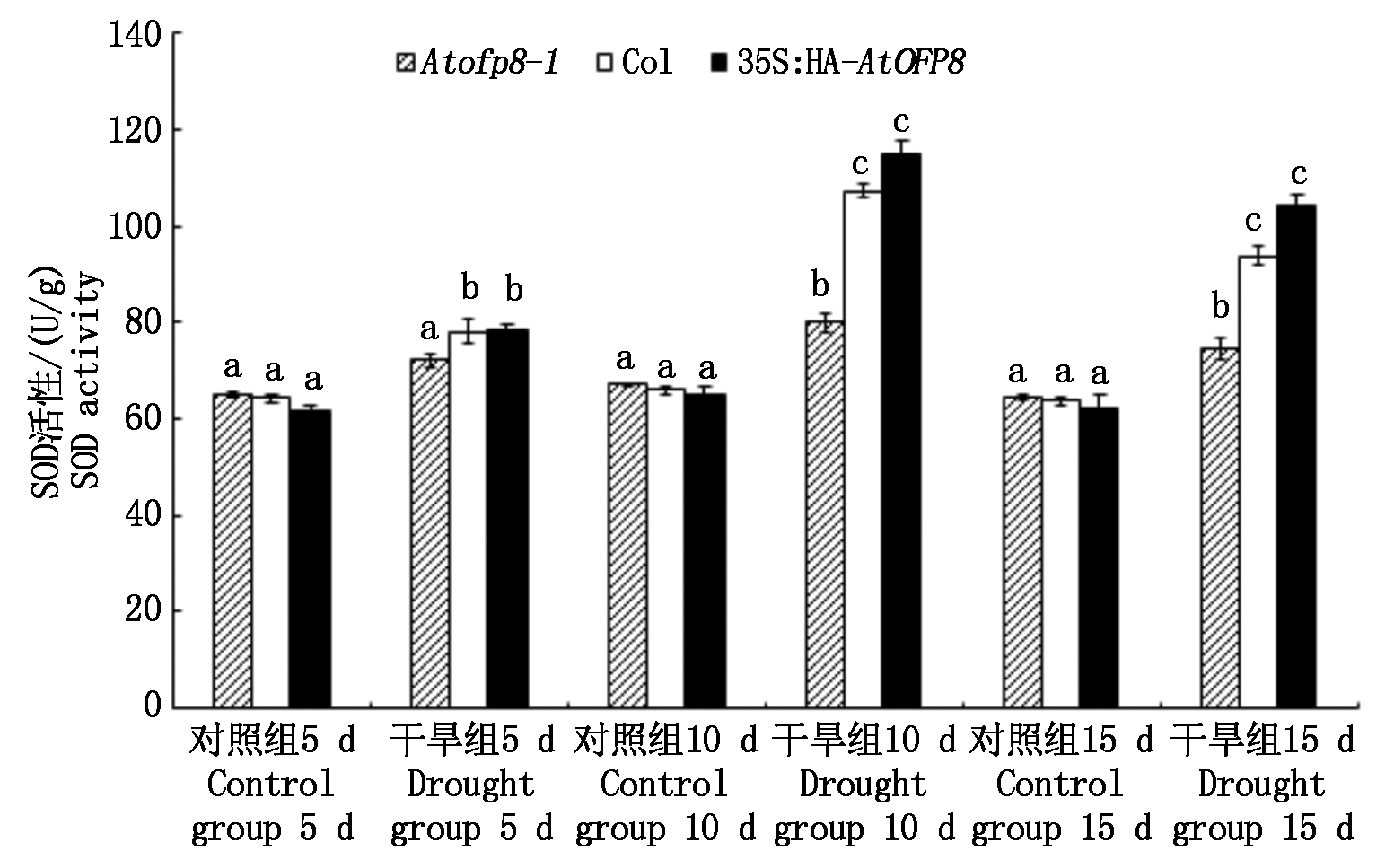
图6 Col、Atofp8-1和35S∶HA-AtOFP8植株在干旱胁迫下的SOD活性
Fig.6 SOD activity of Col, Atofp8-1 and 35S∶HA-AtOFP8 plant under drought stress
2.4.2 POD活性 POD在植物正常生长和应激反应中发挥着重要作用,是植物体内重要的保护酶类。如图7所示,干旱胁迫5 d时,Atofp8-1、Col和35S∶HA-AtOFP8植株叶片中POD的含量(以鲜质量计)分别较对照升高了18.5%,32.5%和38.3%; 干旱处理10 d时,Atofp8-1、Col和35S∶HA-AtOFP8植株叶片中POD的含量分别较对照升高了48.5%,79.5%和181.1%; 干旱处理15 d时,Atofp8-1、Col和35S∶HA-AtOFP8植株叶片中POD的含量分别较对照升高了30.1%,44.0%和86.2%。
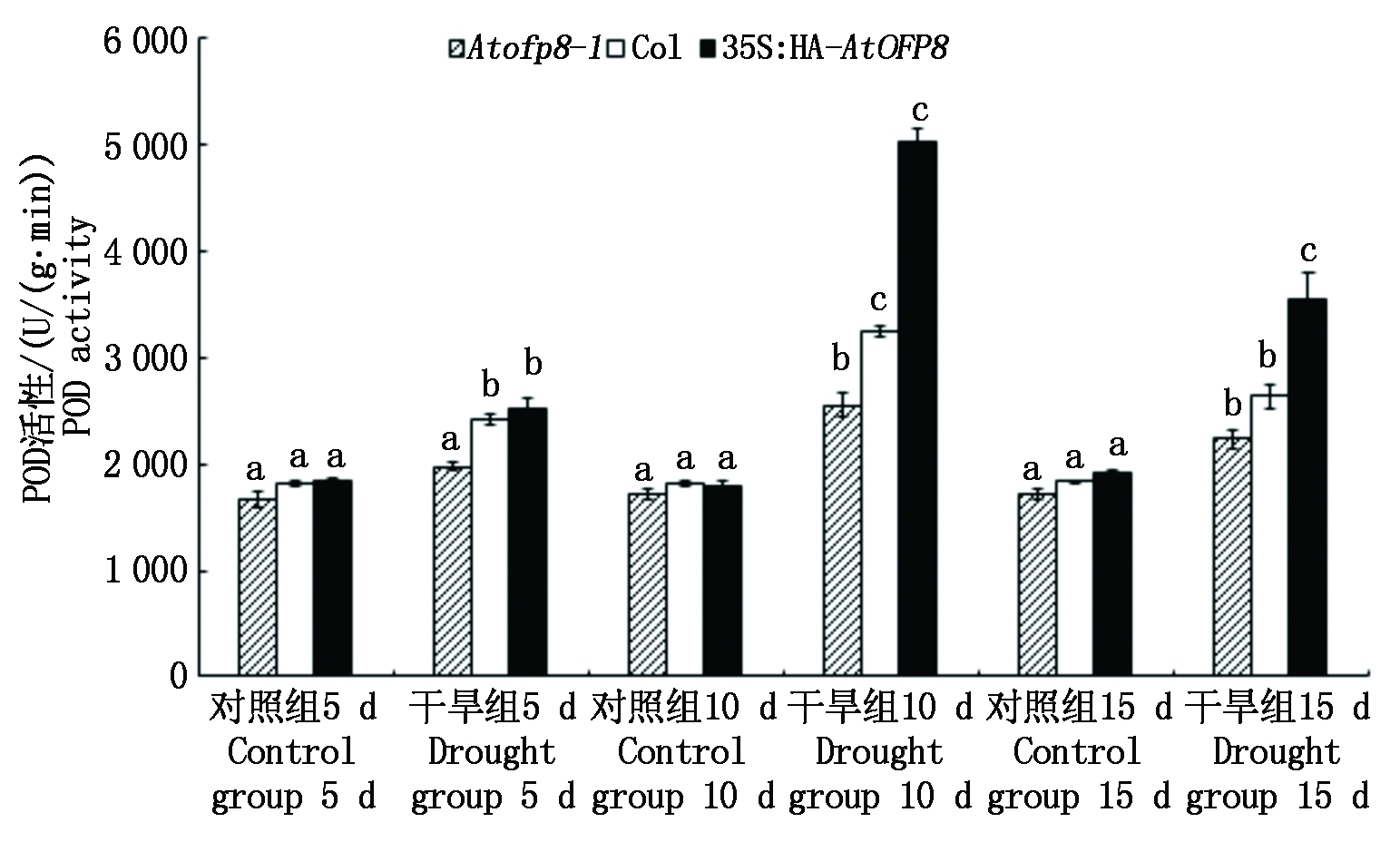
图7 Col、Atofp8-1和35S∶HA-AtOFP8植株在干旱胁迫下的POD活性
Fig.7 POD activity of Col, Atofp8-1 and 35S∶HA-AtOFP8 plant under drought stress
2.5 AtOFP8对干旱胁迫下植株渗透调节物质含量的影响
2.5.1 脯氨酸含量 渗透调节是植物适应干旱胁迫的重要生理机制,干旱胁迫会引起植物脱水造成渗透胁迫,植物通过大量合成和积累渗透保护剂来缓解干旱胁迫,降低水分的流失,大量研究表明,可溶性蛋白和脯氨酸是重要的渗透调节物质[20]。如图8所示,在对照组中,Col、Atofp8-1和35S∶HA-AtOFP8植株叶片中脯氨酸含量(以鲜质量计)无显著差异;干旱处理10 d时,Atofp8-1、Col和35S∶HA-AtOFP8植株叶片中脯氨酸的含量分别较对照升高40.0%,87.8%和242.6%,且35S∶HA-AtOFP8与Col和Atofp8-1差异显著,表明AtOFP8能增加干旱胁迫下的拟南芥叶片中游离脯氨酸的积累,降低水分的流失。
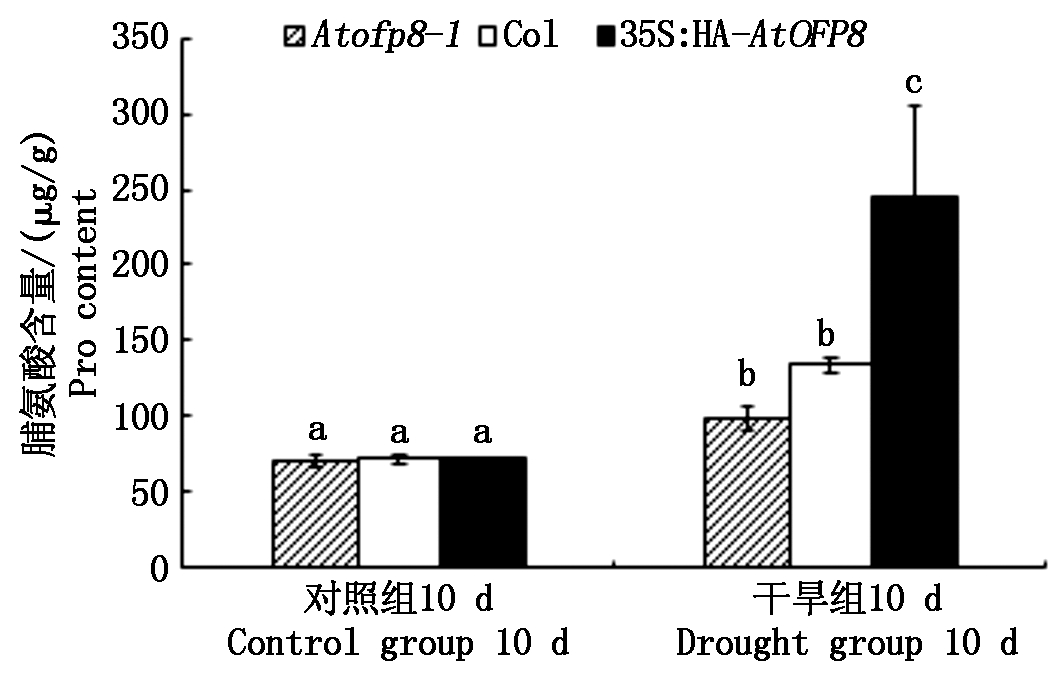
图8 Col、Atofp8-1和35S∶HA-AtOFP8植株 在干旱胁迫下的脯氨酸含量
Fig.8 Proline content of Col, Atofp8-1 and 35S∶HA-AtOFP8 plant under drought stress
2.5.2 可溶性蛋白含量 如图9所示,干旱处理10 d时, Atofp8-1、Col和35S∶HA-AtOFP8植株叶片中可溶性蛋白的含量(以鲜质量计)分别较对照升高了29.6%,40.1%和67.4%,且35S∶HA-AtOFP8与Col和Atofp8-1差异显著,表明35S∶HA-AtOFP8植株在受到渗透胁迫时,其应变能力要强于Atofp8-1和Col植株。
2.6 AtOFP8植株体内干旱应答基因表达的影响
对Col、Atofp8-1和35S∶HA-AtOFP8植株干旱应答基因的表达量进行检测,如图10所示,在对照组中,与Col植株相比,35S∶HA-AtOFP8植株中的AtRD26和AtRDUF2基因的表达量均显著升高,但在Atofp8-1植株中的AtADH1和AtERD7基因的表达量显著降低。在干旱处理10 d时,与对照组处理10 d时的植株相比,Col和35S∶HA-AtOFP8植株叶片中AtADH1、AtRD26、AtRDUF2、AtERD7基因的表达量均显著升高,在Atofp8-1植株叶片中只有AtADH1、AtRD26、AtERD7基因的表达量显著升高,且在35S∶HA-AtOFP8植株叶片中的AtADH1、AtRD26、AtRDUF2基因的表达量最高,在Atofp8-1植株叶片中的AtADH1、AtRD26、AtRDUF2、AtERD7基因的表达量均最低。
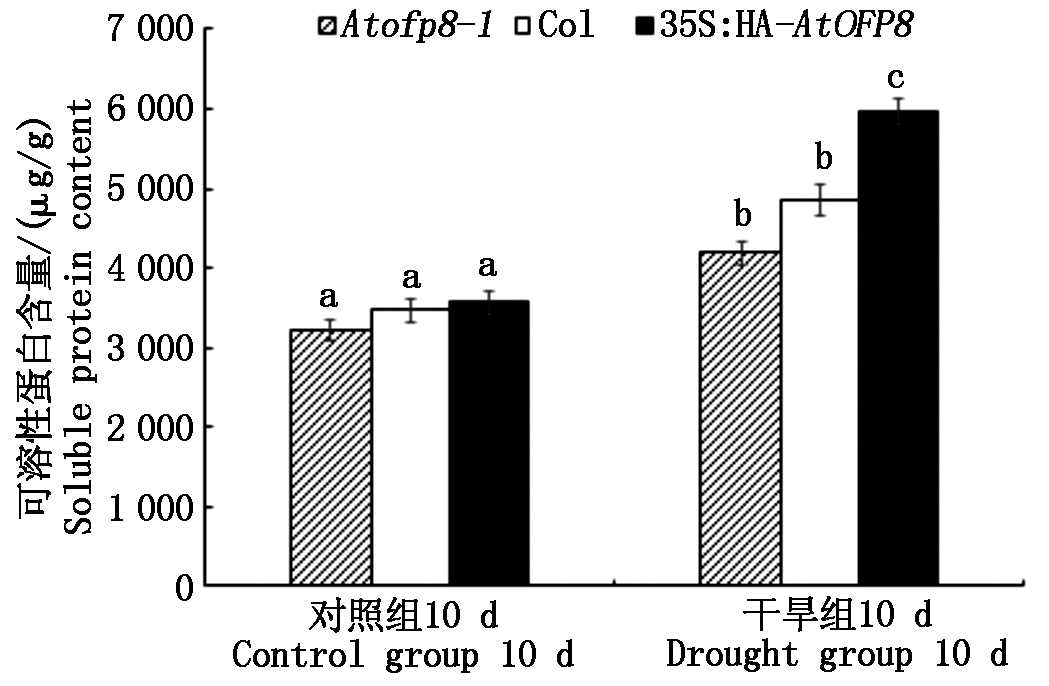
图9 Col、Atofp8-1和35S∶HA-AtOFP8植株 在干旱处理下可溶性蛋白含量
Fig.9 Soluble protein content of Col, Atofp8-1 and 35S∶HA-AtOFP8 plant under drought stress
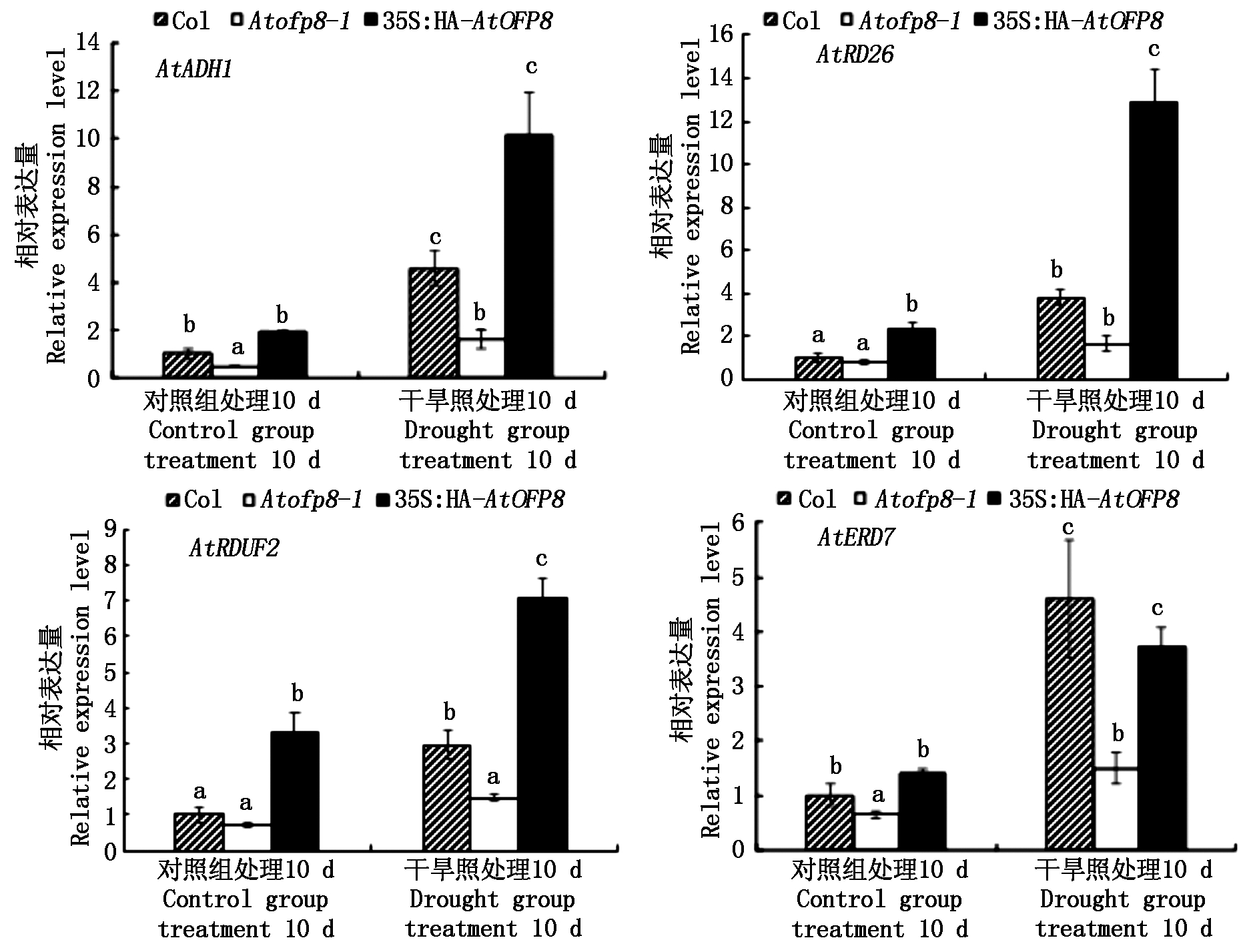
图10 Col、Atofp8-1和35S∶HA-AtOFP8植株体内干旱应答基因的表达
Fig.10 Expression of drought response genes in Col, Atofp8-1 and 35S∶HA-AtOFP8 plant
3 讨论
当植物遭受干旱胁迫时,首先植株的外部性状会发生变化。干旱胁迫也能对植物的种子萌发产生抑制[21]。研究表明,高质量分数的聚乙二醇会降低黄秋葵(Abelmoschus esculentus)的种子萌发率,并且黄秋葵种子萌发率会随聚乙二醇质量分数的升高而降低[22]。干旱对小麦(Triticum aestivum)种子萌发也具有显著的抑制作用[23]。本试验结果发现,随着甘露醇浓度的升高和干旱处理时间的延长,拟南芥植株的萌发率均越来越低,这与前人的研究结果一致[23],但在干旱胁迫条件下拟南芥植株的萌发率始终是35S∶HA-AtOFP8>Col>Atofp8-1,说明过表达AtOFP8可以提高干旱条件下拟南芥的萌发率。植物叶片是对干旱胁迫十分敏感的器官,干旱胁迫下植物生理生化的变化必然会引起叶片形态的变化,因此,叶片性状的变化能体现植物对干旱环境的抵抗能力。干旱胁迫使小麦叶片含水量下降,叶片发生卷曲,影响光合作用,干物质分配比例发生变化,植株变矮[24]。在本试验中,Atofp8-1植株叶片表面蜡质分布比Col植株少,叶片蒸腾速率更快,体内水分散失严重,35S∶HA-AtOFP8的表皮蜡质分布比Col植株更多,具有较强的储水能力,降低蒸腾速率[8];拟南芥植株的绿叶率为35S∶HA-AtOFP8>Col>Atofp8-1,Atofp8-1植株叶片比Col植株更早地表现出萎蔫症状,说明35S∶HA-AtOFP8表现出较强的抗旱性。
干旱胁迫可造成植物体内ROS的产生和积累,ROS的产生可能是植物细胞在非生物胁迫下最早的反应之一[25-26]。干旱胁迫引起的植物伤害与ROS伤害有关,而植物体往往通过提高自身SOD、POD抗氧化酶的活性来清除因逆境胁迫而产生的大量自由基,以增强其抗逆性[27]。植物在逆境胁迫中生成的MDA是细胞膜脂过氧化作用的产物之一 [18]。渗透调节是植物适应干旱胁迫的重要调节机制,植物通过主动积累渗透调节物质,如脯氨酸和可溶性蛋白来缓解干旱胁迫[28]。综合分析比较本试验中拟南芥植株在干旱胁迫下叶片MDA含量、抗氧化酶活性(SOD和POD)、渗透调节物质(脯氨酸和可溶性蛋白)含量,35S∶HA-AtOFP8植株对干旱胁迫的适应性最强。首先,在同一时间和相同浓度的甘露醇处理条件下,35S∶HA-AtOFP8植株在干旱胁迫下叶片MDA含量最低,说明35S∶HA-AtOFP8植株细胞膜透性损伤最小,并且在35S∶HA-AtOFP8植株叶片中抗氧化酶(SOD和POD)活性积累最高,抗旱性强的植物具有较高的抗氧化酶活性,进一步研究发现,在35S∶HA-AtOFP8植株叶片中渗透调节物质(脯氨酸和可溶性蛋白)含量最高,脯氨酸和可溶性蛋白作为渗透调节物质,可以提高细胞液浓度,使细胞液与膜外环境渗透平衡。在相同干旱处理条件下,与Col植株相比,Atofp8-1植株叶片中的MDA含量更高,抗氧化酶活性(SOD和POD)、渗透调节物质(脯氨酸和可溶性蛋白)含量积累更少,说明Atofp8-1植株对干旱的适应性更低。
植物体内的转录因子在转录水平调控胁迫相关基因的表达进而参与调控植物的抗逆反应[29]。拟南芥乙醇脱氢酶基因(AtADH1),参与干旱、盐胁迫和低温胁迫的过程,干旱胁迫诱导AtADH1基因的表达从而提高拟南芥的抗旱性 [30]。AtRD26 基因cDNA编码一个 NAC转录因子,转AtRD26基因的烟草能够提高对干旱和盐胁迫的耐受性[31]。和野生型拟南芥相比,AtRDUF2的突变体表现出对ABA途径敏感性降低的表型,并且显著降低了对干旱胁迫的耐受性[32]。在拟南芥中,早期脱水胁迫可强烈诱导AtERD7基因的表达 [33]。本试验研究发现,在对照组和干旱处理组中,在拟南芥中过量表达AtOFP8基因均能使干旱应答基因的表达量显著上升。
综上所述,随着甘露醇浓度的增加以及干旱处理时间的延长,Col、Atofp8-1和35S∶HA-AtOFP8 3种拟南芥植株受到不同程度的干旱胁迫损伤。35S∶HA-AtOFP8植株在生理调控方面具有较强的协调能力以及较强的保水能力,具体表现在MDA含量最低、抗酶活性(SOD、POD)最高、渗透调节物质(脯氨酸和可溶性蛋白)含量最多,显著促进干旱应答基因(AtADH1、AtRD26、AtRDUF2、AtERD7)的表达,Atofp8-1植株则表现相反。由此可见,过量表达AtOFP8使拟南芥对干旱的适应性提高,可为拟南芥抗旱培养提供一定的依据。
[1] Hackbusch J, Richter K, Müller J, Salamini F, Uhrig J F. A central role of Arabidopsis thaliana ovate family proteins in networking and subcellular localization of 3-aa loop extension homeodomain proteins[J]. Proceedings of the National Academy of Sciences, 2005, 102(13): 4908-4912.doi:10.1073/pnas.0501181102.
[2] Liu J P, Van Eck J, Cong B, Tanksley S D. A new class of regulatory genes underlying the cause of pear-shaped tomato fruit[J]. Proceedings of the National Academy of Sciences, 2002, 99(20): 13302-13306.doi:10.1073/pnas.162485999.
[3] Liu D, Sun W, Yuan Y W, Zhang N, Hayward A, Liu Y L, Wang Y. Phylogenetic analyses provide the first insights into the evolution of ovate family proteins in land plants[J]. Annals of Botany, 2014, 113(7): 1219-1233.doi:10.1093/aob/mcu061.
[4] Schmitz A J, Begcy K, Sarath G, Walia H. Rice Ovate family protein 2(OFP2) alters hormonal homeostasis and vasculature development[J]. Plant Science, 2015, 241:177-188.doi:10.1016/j.plantsci.2015.10.011.
[5] Wang S C, Chang Y, Guo J J, Chen J G.Arabidopsis ovate family protein 1 is a transcriptional repressor that suppresses cell elongation[J]. The Plant Journal, 2007,50(5): 858-872.doi:10.1111/j.1365-313x.2007.03096.x.
[6] Li E Y, Wang S C, Liu Y Y, Chen J G, Douglas C J. OVATE FAMILY PROTEIN4(OFP4) interaction with KNAT7 regulates secondary cell wall formation in Arabidopsis thaliana[J].The Plant Journal,2011, 67(2):328-341.doi:10.1111/j.1365-313x.2011.04595.x.
[7] 杨丽.Ⅲ型卵形蛋白家族转录因子AtOFP16调控拟南芥荚果形态的机制[D].长春:东北师范大学, 2017.
Yang L. Regulation of siliques morphology by AtOFP16, A member of the class Ⅲ OVATE family proteins in Arabidopsis[D].Changchun:Northeast Normal University, 2017.
[8] Tang Y, Zhang W, Yin Y L, Feng P, Li H L, Chang Y. Expression of ovate family protein 8 affects epicuticular waxes accumulation in Arabidopsis thaliana[J]. Botanical Studies, 2018, 59(1):12.doi:10.1186/s40529-018-0228-8.
[9] Hatterman-valenti H, Pitty A, Owen M. Environmental effects on velvetleaf(Abutilon theophrasti) epicuticular wax deposition and herbicide absorption[J]. Weed Science, 2011, 59(1):14-21.doi:10.1614/WS-D-10-00061.
[10] 唐尧, 张微, 尹艳莉, 冯鹏, 陈宇峰, 常缨. 拟南芥AtOFP8的生物信息学分析及表达分析[J].北方园艺,2018,417(18):35-41.
Tang Y, Zhang W, Yin Y L, Feng P, Chen Y F, Chang Y. Bioinformatics analysis and expression analysis of AtOFP8 in Arabidopsis thaliana [J]. Northern Horticulture,2018,417(18):35-41.
[11] 唐尧.拟南芥转录因子AtOFP8在干旱胁迫下的功能分析[D].哈尔滨:东北农业大学, 2018.
Tang Y. Functional analysis of Arabidopsis transcriptional factor AtOFP8 under drought stress[D].Harbin:Northeast Agricultural University,2018.
[12] Ma Y M, Yang C, He Y, Tian Z H, Liu J X. Rice OVATE family protein 6 regulates plant development and confers resistance to drought and cold stresses[J]. Journal of Experimental Botany, 2017, 68(17): 4885-4898.doi:10.1093/jxb/erx309.
[13] Madhava Rao K V, Sresty T V S. Antioxidative parameters in the seedlings of pigeonpea(Cajanus cajan(L.) Millspaugh) in response to Zn and Ni stresses[J]. Plant Science, 2000, 157(1): 113-128.doi:10.1016/s0168-9452(00)00273-9.
[14] Wang Y, Wu W H. Plant sensing and signaling in response to K+-deficiency[J]. Molecular Plant, 2010, 3(2): 280-287.doi:10.1093/mp/ssq006.
[15] Giannopolitis C N, Ries S K. Superoxide dismutases, 1.Occurrence in higher plants[J]. Plant Physiology, 1977,59(2):309-314.doi:10.1104/pp.59.2.309.
[16] Wang F B, Tong W J, Zhu H, Kong W L, Peng R H, Liu Q C, Yao Q H. A novel Cys2/His2 zinc finger protein gene from sweetpotato, IbZFP1, is involved in salt and drought tolerance in transgenic Arabidopsis[J].Planta, 2016, 243(3):783-797.doi:10.1007/s00425-015-2443-9.
[17] 王孝平,刑树礼.考马斯亮蓝法测定蛋白质含量的研究[J].天津化工,2009,23(3):40-42.doi:10.3969/j.issn.1008-1267.2009.03.016.
Wang X P, Xing S L. Determination of protein quantitation using the method of coomassie brilliant blue[J]. Tianjin Chemical Industry, 2009,23(3):40-42.
[18] 杨晓娟, 居辉, 王治世, 郭安廷,杨佑明. 花后高温和干旱对冬小麦光合、抗氧化特性及粒重的影响[J]. 麦类作物学报, 2015, 35(7): 958-963.doi:10.7606/j.issn.1009-1041.2015.07.11.
Yang X J, Ju H, Wang Z S, Guo A T, Yang Y M. Effects of high temperature and drought after anthesis on photosynthesis, antioxidant properties and grain weight of winter wheat[J]. Journal of Triticeae Crops, 2015, 35(7): 958-963.
[19] 闫成仕. 水分胁迫下植物叶片抗氧化系统的响应研究进展[J]. 烟台师范学院学报(自然科学版), 2002, 18(3): 220-225.doi:10.3969/j.issn.1673-8020.2002.03.015.
Yan C S. Advances responses to water stress in plant leaves[J]. Yantai Normal University Journal(Natural Science Edition), 2002,18(3):220-225.
[20] 张强, 杨玉珍, 彭方仁. 干旱胁迫下不同种源香椿可溶性蛋白的动态变化[J].安徽农业科学, 2009,37(1):65-66,71.doi:10.3969/j.issn.0517-6611.2009.01.030.
Zhang Q, Yang Y Z, Peng F R. Dynamic changes of soluble protein in different provenances of Toona sinensis under drought stress[J]. Journal of Anhui Agricultural Sciences, 2009,37(1):65-66,71.
[21] 任磊, 赵夏陆, 许靖, 张宏毅, 郭彦宏, 郭福龙, 张春来, 吕晋慧.4种茶菊对干旱胁迫的形态和生理响应[J].生态学报, 2015, 35(15): 5131-5139.doi:10.5846/stxb201401220164.
Ren L, Zhao X L, Xu J, Zhang H Y, Guo Y H, Guo F L, Zhang C L, Lü J H. Varied morphological and physiological responses to drought stress among four tea Chrysanthemum cultivars[J]. Acta Ecologica Sinica, 2015, 35(15): 5131-5139.
[22] 付咪咪, 李鲜花, 李强. 干旱胁迫对黄秋葵种子萌发的影响[J].山西农业科学, 2018,46(3):350-353.doi:10.3969/j.issn.1002-2481.2018.03.10.
Fu M M, Li X H, Li Q. Effect of drought stress on the germination of okra seed[J]. Journal of Shanxi Agricultural Sciences, 2018,46(3):350-353.
[23] Liu Y, Xu H, Wen X X, Liao Y C. Effect of polyamine on seed germination of wheat under drought stress is related to changes in hormones and carbohydrates[J]. Journal of Integrative Agriculture, 2016, 15(12): 2759-2774. doi:10.1016/S2095-3119(16)61366-7.
[24] 王纪华, 赵春江, 黄文江, 郭晓维, 李鸿祥. 土壤水分对小麦叶片含量水量及生理功能的影响[J].麦类作物学报, 2001, 21(4):42-47.
Wang J H, Zhao C J, Huang W J, Guo X W, Li H X. Effects of soil water content on the wheat leaf water content and the physiological function[J]. Journal of Triticeae Crops, 2001, 21(4): 42-47.
[25] Jajic I,Sarna T,Strzalka K. Senescence, stress, and reactive oxygen species[J]. Plants, 2015, 4(3): 393-411.doi:10.3390/plants4030393.
[26] Lee S, Seo P J, Lee H J, Park C M. A NAC transcription factor NTL4 promotes reactive oxygen species production during drought-induced leaf senescence in Arabidopsis[J].The Plant Journal,2012,70(5): 831-844. doi:10.1111/j.1365-313X.2012.04932.x.
[27] 孙存华,李扬,圆鸿雁,孙东旭,杜伟,郑曦.藜对干旱胁迫的生理生化反应[J].生态学报,2005,25(10):2556-2561.doi:10.3321/j.issn:1000-0933.2005.10.014.
Sun C H, Li Y, He H Y, Sun D X, Du W, Zhang X. Physiological and biochemical responses of Chenopodium album to drought stresses[J]. Acta Ecologica Sinica, 2005, 25(10): 2556-2561.
[28] Thomashow M F. Plant cold acclimation: freezing tolerance genes and regulatory mechanisms[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1999, 50: 571-599.doi:10.1146/annurev.arplant.50.1.571.
[29] 柳展基, 邵凤霞, 唐桂英. 植物NAC转录因子的结构功能及其表达调控研究进展[J]. 西北植物学报, 2007, 27(9): 1915-1920.doi:10.3321/j.issn:1000-4025.2007.09.035.
Liu Z J, Shao F X , Tang G Y. The research progress of structure,function and regulation of plant NAC transcription factors[J]. Acta Botanica Boreali-Occidentalia Sinica, 2007, 27(9): 1915-1920.
[30] Bruxelles G L D , Peacock W J, Dennis E S, Dolferus R. Abscisic acid induces the alcohol dehydrogenase gene in Arabidopsis[J]. Plant Physiology, 1996, 111(2): 381-391.doi:10.1104/PP.111.2.381.
[31] Fujita M, Fujita Y, Maruyama K, Seki M,Hiratsu K, Ohme-Takagi M, Tran L, Yamaguchi-Shinozaki K, Shinozaki K. A dehydration-induced NAC protein, RD26, is involved in a novel ABA-dependent stress-signaling pathway[J]. The Plant Journal, 2004, 39(6): 863-876.doi:10.1111/j.1365-313x.2004.02171.x.
[32] Kim S J, Ryu M Y, Kim W T. Suppression of Arabidopsis RING-DUF1117 E3 ubiquitin ligases, AtRDUF1 and AtRDUF2, reduces tolerance to ABA-mediated drought stress[J]. Biochemical and Biophysical Research Communications, 2012, 420(1):141-147.doi:10.1016/j.bbrc.2012.02.131.
[33] Kiyosue T, Shinozaki K Y, Shinozaki K. Cloning of cDNAs for genes that are early-responsive to dehydration stress(ERDs) in Arabidopsis thaliana L.: identification of three ERDs as HSP cognate genes[J]. Plant Molecular Biology, 1994, 25: 791-798.doi:10.1007/BF00028874.
