植物细胞质雄性不育是高等植物中不能产生有功能花粉的一种母性遗传性状,是雄蕊退化、花粉败育或功能不育等原因造成的雄蕊不能正常授粉而雌蕊功能正常的现象。利用雄性不育系育种是作物杂种优势利用的重要途径。
Capitani等[1]研究发现,植株的雄性不育系花药在发育过程中,有氧呼吸途径相关酶的活性普遍降低,认为植物雄性不育花药败育过程与能量代谢异常密切相关。关于能量代谢异常导致作物雄性不育在玉米、水稻、小麦等作物上均有研究报道。大量研究已表明,植物雄性不育的发生与植物体内能量的代谢异常有一定的相关性[2-4]。
在生物体的正常代谢过程中,线粒体通过呼吸作用,为植物体的正常发育提供能量。研究表明,在雄性不育花药中以呼吸底物降解的糖酵解-三羧酸循环(TCA)途径为主[5]。线粒体中的糖经过糖酵解途径形成丙酮酸,丙酮酸再转化为乙酰辅酶A进入三羧酸循环进行能量代谢,丙酮酸脱氢酶起到关键作用,其可以将丙酮酸脱羧氧化成乙酰辅酶A,进而影响三羧酸循环。丙酮酸脱氢酶磷酸酶(Pyruvate dehydrogenase phosphatase,PDP)属于蛋白磷酸酶M家族(Protein phosphatase M,PPM),是位于线粒体上的丝氨酸/苏氨酸磷酸酶,是丙酮酸脱氢酶活性的正调控因子,在线粒体中通过水解PDC-E1α亚基丝氨酸上的磷酸基团而恢复PDC活性,以保证代谢的正常进行。通过对棉花雄性不育系的丙酮酸脱氢酶磷酸酶的研究,可以揭示CMS机制,为更好地利用杂种优势提供可靠的理论依据和实践意义。
山西农业大学农学院棉花育种实验室前期已从棉花晋A不育系中克隆出GhPDP基因,并成功将其构建到pMD-19T载体上[6]。本研究以pMD-19T-GhPDP质粒为模板,PCR扩增GhPDP基因的cDNA编码区,构建原核表达载体pET-22b-GhPDP,诱导重组蛋白表达,并对表达条件进行单因素和正交试验优化,以提高GhPDP可溶性表达量,为进一步研究GhPDP在棉花雄性不育过程中能量调控方面的功能提供理论基础。
1 材料和方法
1.1 试验材料
1.1.1 菌株与质粒 大肠杆菌Trans1-T1、Transetta(DE3)均购自北京全式金生物技术有限公司;原核表达载体pET-22b、pMD-19T-GhPDP重组质粒均由山西农业大学农学院棉花育种实验室保存。
1.1.2 主要试剂 胶回收试剂盒购自OMEGA公司;质粒提取试剂盒购自北京全式金生物技术有限公司;引物由苏州金唯智公司合成;甘氨酸、SDS、异丙基硫代半乳糖苷(IPTG)、丙烯酰胺、甲叉丙烯酰胺、TEMED购自美国Amresco公司;2×Pfu PCR MasterMix购自天根生化科技(北京)有限公司;PrimeSTAR GXL DNA Polymerase购自TaKaRa公司;Tris购自北京索莱宝科技有限公司。
1.2 试验方法
1.2.1 重组表达载体的构建与鉴定 通过Over-lap PCR将目的基因GhPDP连接到pET-22b载体上,引物序列列于表1。使用PDP-F1/R1和PDP-F2/R2分别扩增基因和载体,扩增产物经1%的琼脂糖凝胶电泳检测并回收;将回收的基因片段和载体片段按摩尔比1∶1进行PCR扩增,用琼脂糖凝胶电泳检测其结果。
表1 PCR扩增引物序列
Tab.1 PCR primer sequences
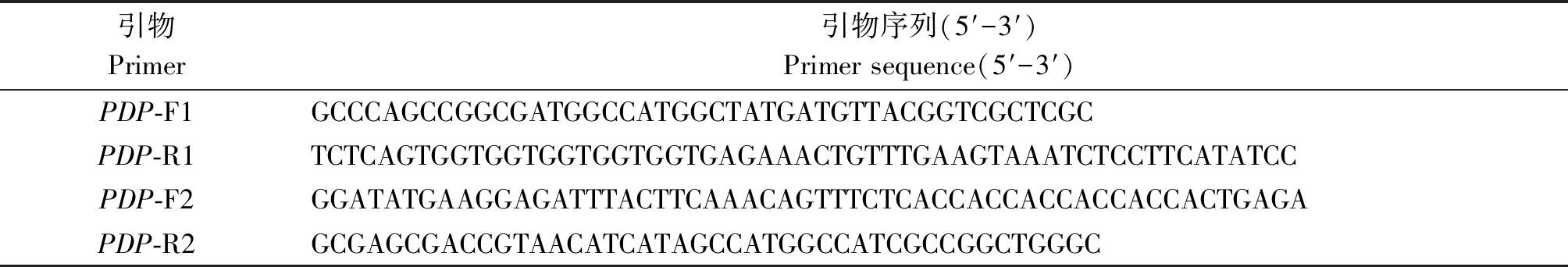
引物Primer 引物序列(5′-3′)Primer sequence(5′-3′)PDP-F1GCCCAGCCGGCGATGGCCATGGCTATGATGTTACGGTCGCTCGCPDP-R1TCTCAGTGGTGGTGGTGGTGGTGAGAAACTGTTTGAAGTAAATCTCCTTCATATCCPDP-F2GGATATGAAGGAGATTTACTTCAAACAGTTTCTCACCACCACCACCACCACTGAGAPDP-R2GCGAGCGACCGTAACATCATAGCCATGGCCATCGCCGGCTGGGC
将PCR产物转化Trans1-T1感受态细胞,筛选阳性克隆送至苏州金唯智公司进行测序,并提取其质粒转化大肠杆菌Transetta(DE3)。
1.2.2 GhPDP蛋白表达条件的优化 为获得较多可溶性目的蛋白,设计单因素试验和正交试验对目的蛋白进行优化表达,并采用Bradford方法[7]进行蛋白定量,即不同诱导温度、时间、IPTG终浓度和菌体密度OD600对目的蛋白表达量的影响。
1.2.2.1 诱导温度 将转化菌株接种于含Amp的LB液体培养基中,37 ℃过夜培养,第2天转接至新的培养基中,继续培养至OD600为0.8时加入IPTG至终浓度为0.1 mmol/L,分别在16,20,24 ℃诱导5 h后离心收集菌体,超声波破碎菌体,收集上清与沉淀,加入4×蛋白上样缓冲液,沸水浴10 min,离心后经13% SDS-PAGE鉴定。
1.2.2.2 诱导时间 细菌培养方法同1.2.2.1,培养至OD600为0.8时加入IPTG至终浓度为0.1 mmol/L,在20 ℃分别培养3,5,7,10 h后收集菌体,超声波破碎菌体,收集上清与沉淀,经13% SDS-PAGE电泳。
1.2.2.3 IPTG终浓度 细菌培养方法同1.2.2.1,培养至OD600为0.8,分别加入终浓度为0.05,0.10,0.15 mmol/L的IPTG,在20 ℃诱导5 h后收集菌体,超声波破碎菌体,收集上清与沉淀,经13% SDS-PAGE电泳。
1.2.2.4 菌体密度OD600 细菌培养方法同1.2.2.1,继续培养至OD600分别为0.5,0.8,1.0时,加入IPTG至终浓度为0.10 mmol/L,20 ℃诱导5 h,菌体经超声波破碎、离心,收集上清与沉淀,经13% SDS-PAGE电泳。
1.2.2.5 正交试验设计 在单因素试验的基础上设计4因素3水平的正交试验,具体组合列于表2。
表2 正交试验设计
Tab.2 Orthogonal experiment design

水平Level因素Factor诱导温度(A)/℃Induction temperature诱导时间(B)/hInduction timeIPTG终浓度(C)/(mmol/L)IPTG final concentrationsOD600值(D)OD600 value 11630.050.522050.100.832470.151.0
1.2.2.6 正交试验数据分析 按照已设计的正交试验进行目的蛋白的诱导表达,经13% SDS-PAGE电泳,电泳结果经GeneTools凝胶分析软件进行目的蛋白定量,得出最佳诱导条件。
2 结果与分析
2.1 重组表达载体的鉴定
GhPDP基因与pET-22b载体扩增后经1%琼脂糖凝胶电泳检测,结果如图1所示,扩增的基因片段和载体片段大小分别约为1 152,5 493 bp,与预期的理论大小相符,没有非特异扩增存在。将2个片段切胶回收按摩尔比1∶1进行GhPDP基因与pET-22b载体的连接,结果如图2所示,重组表达载体以多聚体的形式产生,同时因分子量过大而积存于琼脂糖凝胶的上样孔中。将多聚体通过热激转化Trans1-T1感受态细胞,挑取单克隆进行菌液PCR验证,结果扩增出与理论基因大小相符合的片段(图3)。将阳性克隆测序,通过DNAMAN序列比对结果正确,表明pET-22b-GhPDP重组表达载体构建成功。
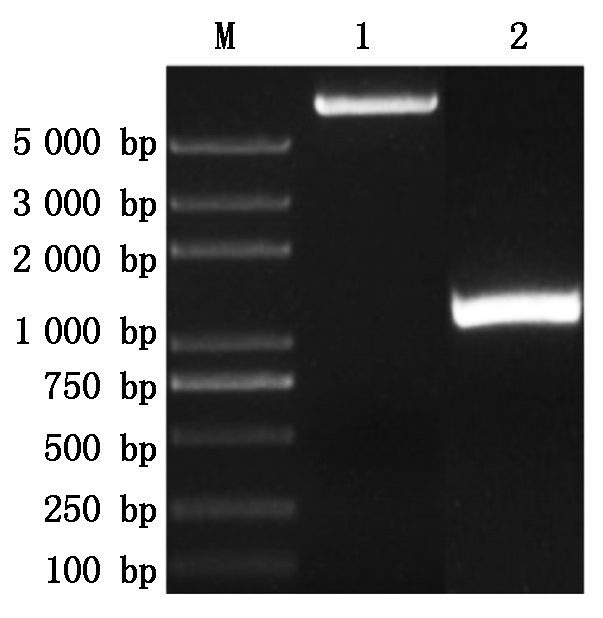
M. Trans2K Plus DNA Marker;1. pET-22b载体 的扩增结果;2. GhPDP基因的扩增结果。 M. Trans2K Plus DNA Marker; 1. Amplification results of pET-22b vector; 2. Amplification results of GhPDP gene.
图1 基因与载体的扩增结果
Fig.1 Amplification results of genes and vectors results
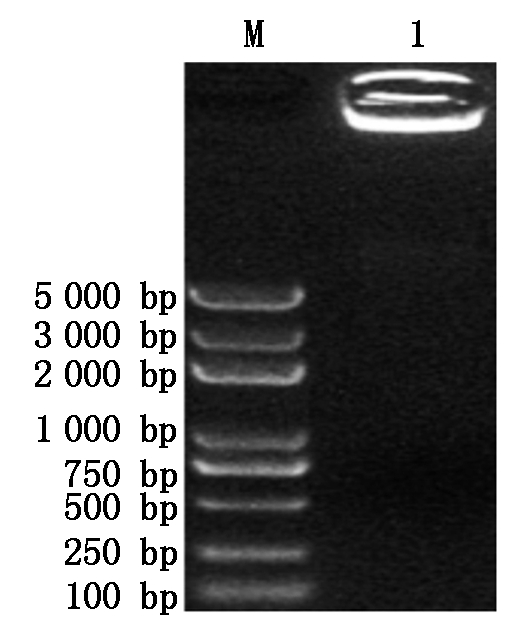
M. Trans2K Plus DNA Marker;1. 多聚体。 M. Trans2K Plus DNA Marker; 1. Multimer.
图2 基因与载体的连接
Fig.2 Ligation of genes and vectors
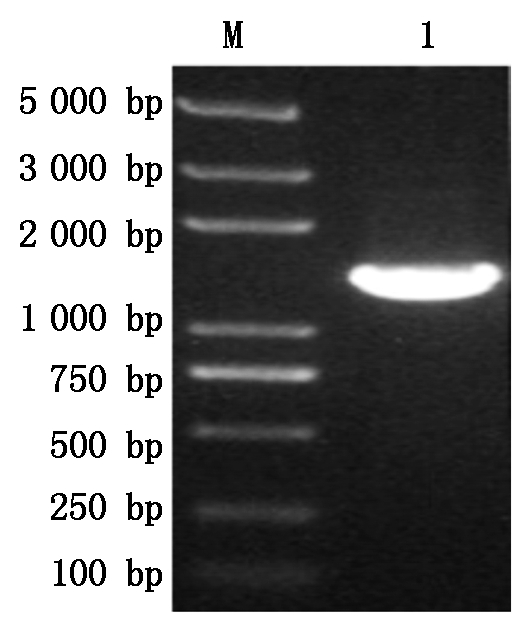
M. Trans2K Plus DNA Marker;1. PCR验证结果。 M. Trans2K Plus DNA Marker; 1. PCR verification results.
图3 pET-22b-GhPDP菌液PCR验证结果
Fig.3 PCR verification of pET-22b-GhPDP bacterial solution
2.2 目的蛋白表达形式的确定
将含重组质粒pET-22b-GhPDP的Transetta(DE3)接种在具有Amp抗性的LB液体培养基中,通过IPTG诱导表达以及13%的SDS-PAGE检测,结果显示,与空载转化菌相比,在48 ku处有一条特异的蛋白表达条带,分子量与预期目的蛋白大小相当,表明目的蛋白在Transetta(DE3)中表达,其中,大部分以包涵体的形式存在于沉淀中,很少一部分形成可溶性蛋白(图4)。

M.蛋白质分子量标准;1.空载表达后的上清;2.重组蛋白在Transetta(DE3)中表达后的上清;3.空载表达后的沉淀;4.重组蛋白在Transetta(DE3)中表达后的沉淀。
M. Protein molecular weight standard; 1.Supernatant after no-load expression; 2.Recombinant protein after expression in Transetta(DE3) supernatant; 3.Precipitation after no-load expression; 4.Precipitation after expression of recombinant protein in Transetta(DE3).
图4 pET-22b-GhPDP在大肠杆菌Transetta(DE3)中的表达
Fig.4 Expression of pET-22b-GhPDP in Escherichia coli Transetta(DE3)
2.3 重组蛋白表达条件优化
2.3.1 不同诱导温度对目的蛋白表达量的影响 在OD600为0.8,IPTG终浓度为0.10 mmol/L以及诱导温度分别为16,20,24 ℃条件下,诱导5 h离心收集菌体进行超声波破碎,获得上清与沉淀,经13%的SDS-PAGE检测,结果显示,随着温度的升高,可溶性目的蛋白的表达量呈先增加后降低的趋势;在诱导温度为20 ℃的条件下,GhPDP蛋白的可溶性表达量最高(图5),通过GeneTools凝胶分析软件测定,其占上清总蛋白含量的6.98%。

M.蛋白质分子量标准; 1. pET-22b-GhPDP未诱导;2-4. 16,20,24 ℃条件下IPTG诱导5 h后的上清;5-7. 16,20,24 ℃条件下IPTG诱导5 h后的沉淀。
M. Protein molecular weight standard; 1.Uninduced of pET-22b-GhPDP; 2-4. Supernatant induced by IPTG at 16, 20, 24 ℃ for 5 h; 5-7. Precipitation induced by IPTG at 16, 20, 24 ℃ for 5 h.
图5 不同诱导温度对目的蛋白表达量的影响
Fig.5 Effect of different induction temperatures on the expression of target protein
2.3.2 不同诱导时间对目的蛋白表达量的影响 在OD600为0.8、诱导温度为20 ℃、IPTG终浓度为0.10 mmol/L条件下,分别诱导3,5,7,10 h进行超声波破碎,经13% SDS-PAGE检测,结果显示,诱导5 h时,目的蛋白可溶性表达量最高(图6),其占上清总蛋白含量的6.65%。

M.蛋白质分子量标准;1. pET-22b-GhPDP未诱导;2-5. 20 ℃条件下IPTG的诱导3,5,7,10 h后的上清;6-9. 20 ℃条件下IPTG分别诱导3,5,7,10 h后的沉淀。
M. Protein molecular weight standard; 1. Uninduced of pET-22b-GhPDP; 2-5. Supernatant after IPTG induction at 20 ℃for 3, 5, 7, 10 h; 6-9. Precipitation after IPTG induction at 20 ℃ for 3, 5, 7, 10 h.
图6 不同诱导时间对目的蛋白表达量的影响
Fig.6 Effect of different induction time on the expression of target protein
2.3.3 不同IPTG终浓度对目的蛋白表达量的影响 在OD600为0.8、诱导温度为20 ℃条件下,分别加入IPTG至终浓度为0.05,0.10,0.15 mmol/L,诱导5 h,离心收集菌体沉淀进行超声波破碎,取上清与沉淀进行13%的SDS-PAGE检测,结果如图7所示,在IPTG终浓度为0.10 mmol/L时,可溶性目的蛋白表达量最高,其占上清总蛋白含量的7.30%。

M.蛋白质分子量标准; 1. pET-22b-GhPDP未诱导;2-4. 20 ℃条件下终浓度分别为0.05,0.10,0.15 mmol/L IPTG诱导5 h后的上清;5-7. 20 ℃条件下终浓度分别为0.05,0.10,0.15 mmol/L的IPTG诱导5 h后的沉淀。
M. Protein molecular weight standard; 1. Uninduced of pET-22b-GhPDP; 2-4. Supernatant induced by 0.05, 0.10, 0.15 mmol/L IPTG at 20 ℃ for 5 h; 5-7. Precipitation induced by 0.05, 0.10, 0.15 mmol/L IPTG at 20 ℃ for 5 h.
图7 不同IPTG终浓度对目的蛋白表达量的影响
Fig.7 Effect of different final IPTG concentrations on the expression of target protein
2.3.4 不同菌体密度OD600对目的蛋白表达量的影响 分别在菌体密度OD600为0.5,0.8,1.0时,加入0.10 mmol/L的IPTG,20 ℃诱导5 h,取上清与沉淀进行SDS-PAGE检测,结果显示,随着菌体密度逐渐增加,可溶性目的蛋白表达量呈现先增加后降低的趋势(图8);当OD600达到0.8时,IPTG诱导产生的可溶性目的蛋白含量最多,其占上清总蛋白含量的8.65%。
综合以上单因素试验可知,可溶性目的蛋白表达的最优条件为:在20 ℃条件下,当菌体密度OD600达到0.8时,加入终浓度0.10 mmol/L的IPTG诱导5 h。在此诱导条件下,可溶性目的蛋白表达量最高。

M.蛋白质分子量标准; 1. pET-22b-GhPDP未诱导;2-4. 分别在OD600为0.5,0.8,1.0开始诱导5 h后的上清;5-7. 分别在OD600为0.5,0.8,1.0开始诱导5 h后的沉淀。
M. Protein molecular weight standard; 1. Uninduced of pET-22b-GhPDP; 2-4. Supernatant after induction for 5 h at OD600 of 0.5, 0.8,1.0, respectively; 5-7.Start to induce precipitation after 5 h at OD600 of 0.5, 0.8, 1.0.
图8 不同菌体密度OD600对目的蛋白表达量的影响
Fig.8 Effect of different cell density OD600 on the expression of target protein
2.3.5 GhPDP蛋白诱导优化条件正交试验 按照已设计的正交试验(表2)进行目的蛋白诱导表达,经13% SDS-PAGE电泳(图9),可以清晰地看出,GhPDP基因在不同条件下的表达量有明显的差异。在上清的SDS-PAGE结果中发现泳道5的目的蛋白表达量最高。
2.3.6 正交试验数据分析 通过GeneTools凝胶分析软件定量可溶性目的蛋白浓度,对各因素数据进行极差分析,结果如表3所示,各因素极差大小分别为3.44,2.76,3.21,1.73,通过R值确定诱导条件的各因素影响主次为诱导温度>IPTG终浓度>诱导时间>OD600,正交试验最佳组合是,诱导温度为20 ℃、诱导剂IPTG终浓度为0.15 mmol/L、诱导时间为5 h、菌体密度OD600为0.5,在此诱导条件下,可溶性目的蛋白表达量最大,达到8.96%。为进一步验证上述结果的可靠性和稳定性,按正交设计优化的最佳条件重复进行了3次诱导,结果发现,目的蛋白表达量均稳定地占上清总蛋白含量的8.96%左右。

M.蛋白质分子量标准; 1-9. 对应表3各正交试验组的上清; 10-18. 对应表3各正交试验组的沉淀。 M. Protein molecular weight standard; 1-9. Corresponding to the supernatant of each orthogonal experimental group of Tab.3; 10-18. Corresponding to the precipitation of each orthogonal experimental group of Tab.3.
图9 正交试验13% SDS-PAGE电泳结果
Fig.9 Orthogonal test 13% SDS-PAGE electrophoresis results
表3 正交试验设计及其结果
Tab.3 Design table and results of orthogonal test
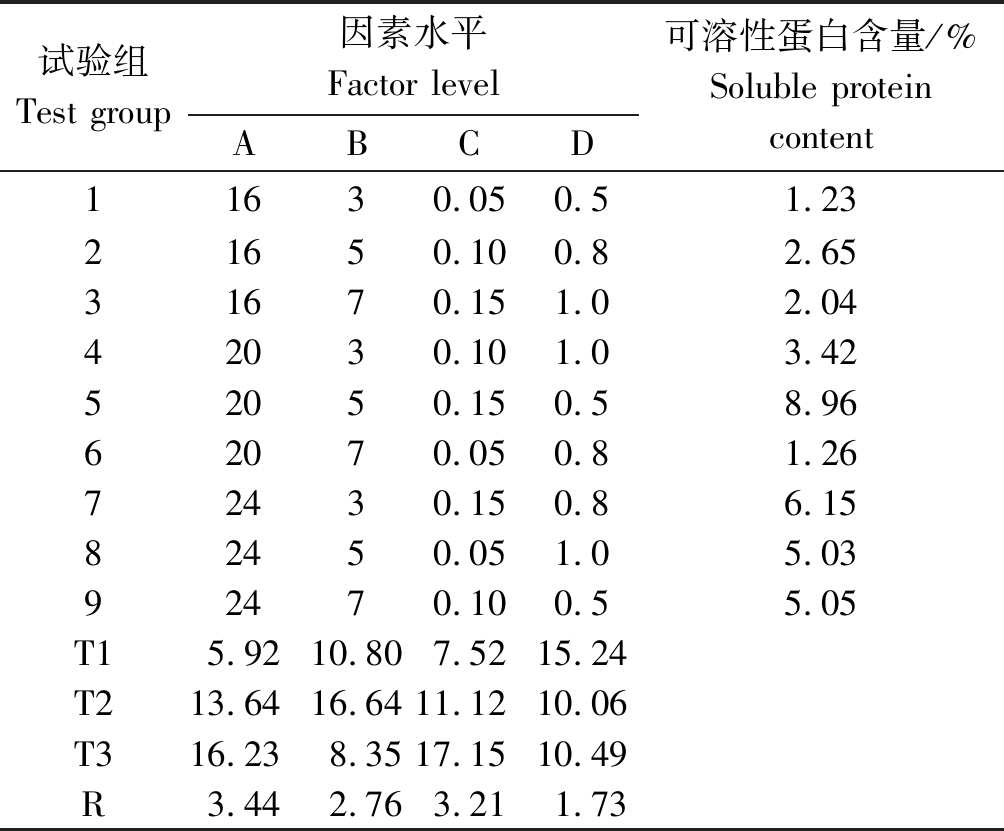
试验组Test group因素水平Factor levelABCD可溶性蛋白含量/%Soluble proteincontent11630.050.51.2321650.100.82.6531670.151.02.0442030.101.03.4252050.150.58.9662070.050.81.2672430.150.86.1582450.051.05.0392470.100.55.05T15.9210.807.5215.24T213.6416.6411.1210.06T316.238.3517.1510.49R3.442.763.211.73
3 结论与讨论
植物雄性不育的研究是杂种优势利用理论研究的重要内容,大量研究证明,能量代谢失衡与植物雄性不育存在一定关系[1],而线粒体是为机体提供能量的动力工厂。细胞存亡与物质能量代谢调节契合于丙酮酸,糖类经过初步酵解后形成丙酮酸,丙酮酸被运输到线粒体内经过氧化脱羧形成乙酰辅酶A进入三羧酸循环(TCA),最后经过氧化磷酸化形成大量的ATP。线粒体丙酮酸脱氢酶复合体(mtPDC)调控丙酮酸进入TCA循环并且催化的反应不可逆,2种调节酶PDK/PDP通过对PDC-E1a亚基的磷酸化和去磷酸化使PDC失活或复活,PDP作为PDC的调控酶,对能量代谢具有极其重要的作用。
3.1 GhPDP原核表达载体的构建与表达
许多外源蛋白表达主要以无活性、不溶性的包涵体形式产生[8]。其中,包涵体的形成原因很多,外源基因的快速高效表达是其中的原因之一[9]。外源基因在大肠杆菌中能否高效表达受很多因素影响,如大肠杆菌菌株、诱导温度、诱导剂IPTG的终浓度和诱导时间[10]。潘滨等[11]在大肠杆菌Rosetta(DE3)、BL21(DE3) pLysS和Rs21菌株诱导Rep蛋白表达,研究发现当选用表达菌株BL21(DE3) pLysS和Rs21菌株时,Rep蛋白表达量很低;当选用表达菌株Rosetta(DE3)时,Rep蛋白表达明显,且在IPTG诱导后表达量显著增加。
本试验采用目前广泛应用的大肠杆菌表达系统表达外源蛋白棉花丙酮酸脱氢酶磷酸酶GhPDP,选用表达载体为pET-22b,其能够编码6个组氨酸残基、并与目的蛋白的C末端形成融合蛋白,可以直接用于后续目的蛋白的纯化[12-14],且由于组氨酸标签非常小,对目的蛋白的结构和性质造成影响较小,因此,不需要将其从目的蛋白中切除;pET-22b表达载体上的T7启动子在加入诱导剂IPTG时能与大肠杆菌Transetta(DE3)菌株内的T7 RNA聚合酶特异性结合,从而实现下游靶基因的表达。本试验成功构建pET-22b-GhPDP重组表达载体,并在大肠杆菌Transetta(DE3)内表达,表达形式多为包涵体,少量为可溶性蛋白。
3.2 诱导温度对目的蛋白表达量的影响
诱导温度是影响原核蛋白表达的重要因素之一[15]。高温诱导时,大肠杆菌的生长速度快,表达蛋白的速度也随之加快,导致表达的目的蛋白没有足够的时间进行正确的折叠,从而容易形成包涵体。因此,降低温度有利于目的蛋白的可溶性表达。本试验中,目的蛋白在16,20,24 ℃表达时均有包涵体形成,但在20 ℃时目的蛋白可溶性表达量最高。
3.3 IPTG浓度对目的蛋白表达量的影响
IPTG终浓度对大肠杆菌生长和蛋白表达也有一定的影响[16],IPTG 是一种十分有效的乳糖操纵子的诱导剂,合理的浓度可提高表达量,在缩短表达周期的同时可降低成本;而浓度过高会增加原核表达系统的负载,抑制细菌的生长,甚至对细胞具有一定的杀伤作用[17]。因此,本试验采用低终浓度的IPTG进行诱导,当IPTG终浓度为0.10 mmol/L时,诱导的可溶性目的蛋白相对较多。
3.4 诱导时间对目的蛋白表达量的影响
不同的蛋白诱导时间也不同,有些蛋白对细胞有毒害作用[18-20]。因此,需要对诱导时间进行优化。在本试验中,随着诱导时间的增加,目的蛋白的可溶性表达量呈现先增加后降低的趋势;在5 h时可溶性蛋白表达相对较多,5 h后达重组菌的生长平衡期,此时融合蛋白的表达量已无明显增加;若继续培养可则能会由于菌体老化分解导致表达量反而下降。
3.5 菌体密度OD600对目的蛋白表达量的影响
原核表达中诱导时机也很重要,诱导时机过早会导致目的蛋白产量降低;而诱导时机过晚会影响工程菌的稳定性和活性,进而影响目的蛋白的表达量。在本试验中,随着菌体密度逐渐增加,可溶性目的蛋白的量呈现先增加后降低的趋势,在菌体密度OD600为0.8时,可溶性目的蛋白相对较多,重组菌进入对数生长期初期,重组质粒拷贝数大量扩增,细菌浓度较低,加入 IPTG 诱导后外源营养物质将主要用于融合蛋白表达,而外源蛋白合成将和细菌自身的生长繁殖竞争营养物质,从而抑制重组菌的生长。
3.6 原核表达的最佳诱导条件
正交试验充分考虑交互作用和全面性,选取部分具有代表性的试验点,对试验因素及条件进行优化组合,从而使试验效率提高[21]。本试验通过对诱导温度、诱导时间、IPTG终浓度和菌体浓度OD600进行正交试验,对其结果分析得出,诱导条件的各因素影响主次为诱导温度>IPTG终浓度>诱导时间>OD600;综合所有因素得出诱导最佳条件:菌体密度OD600为0.8、诱导温度为20 ℃、IPTG终浓度为0.10 mmol/L、诱导时间为5 h,此条件下,可溶性目的蛋白可达8.96%。
[1] Capitani G, Hohenester E, Feng L, Storici P, Kirsch J F,Jansonius J N. Structure of 1-aminocyclopropane-1-carboxylate synthase, a key enzyme in the biosynthesis of the plant hormone ethylene[J].Journal of Molecular Biology,1999,294(3):745-756.doi:10.1006/jmbi.1999.3255.
[2] 王俊生,袁蕾,张明珠,张改生,牛娜,马守才,李红霞.化学杂交剂SQ-1诱导小麦泛素/26S蛋白酶体途径的表达[J].农业生物技术学报,2010,18(4):695-701.doi:10.3969/j.issn.1674-7968.2010.04.011.
Wang J S,Yuan L,Zhang M Z,Zhang G S,Niu N,Ma S C,Li H X. Expression of Ubiquitin-26S proteasome pathway in physiological male sterility of wheat induced by chemical hybrid agents SQ-1[J].Journal of Agricultural Biotechnology, 2010,18(4):695-701.
[3] 马蓉丽,成妍,吴海涛,焦彦生,乔宁.洋葱T型细胞质雄性不育与花蕾ATP含量的关系[J].中国蔬菜,2016(2):32-35.doi:10.3969/j.issn.1000-6346.2016.02.007.
Ma R L,Cheng Y,Wu H T,Jiao Y S, Qiao N.Relationship between ATP contents of buds and T-type cytoplasmic male sterility in onion[J].Chinese Vegetables,2016(2):32-35.
[4] 陈蕊红,叶景秀,张改生,王俊生,牛娜,马守才,赵继新,朱建楚.小麦质核互作型雄性不育系及其保持系花药差异蛋白质组学分析[J].生物化学与生物物理进展,2009,36(4): 431-440.doi:10.3724/SP.J.1206.2008.00515.
Chen R H,Ye J X, Zhang G S,Wang J S,Niu N,Ma S C,Zhao J X, Zhu J C.Differential proteomic analysis of anther proteins between cytoplasmic-nuclear male sterility line and its maintainer in wheat(Triticum aestivum L.)[J].Progress in Biochemistry and Biophysics,2009,36(4):431-440.
[5] 田长恩,段俊,梁承邺.乙烯对水稻CMS系及其保持系蛋白质、核酸和活性氧代谢的影响[J].中国农业科学,1999,32(5):36-42.doi:10.3321/j.issn:0578-1752.1999.05.006.
Tian C E,Duan J,Liang C Y.Effects of ethylene on metabolism of protein, RNA,DNA and actived oxygen in the panicles of CMS and its maintainer[J].Scientia Agricultura Sinica,1999, 32(5):36-42.
[6] 康娜娜.棉花GhPDC-E1α克隆及调控基因表达模式研究[D].太谷:山西农业大学,2018.
Kang N N.GhPDC-E1α Cloning and regulation of gene expression patterns in cotton[D].Taigu:Shanxi Agricultural University,2018.
[7] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding[J].Biochem,1976,72(1-2):248-258. doi:10.1016/0003-2697(76) 90527-90523.
[8] 张付凯,乔亚奇,王磊,兰丽平,潘家荣.抗对硫磷基因工程四价抗体在大肠杆菌中高效表达与鉴定[J].核农学报,2012,26(1):118-122,175.doi:10.11869/hnxb.2012.01.0118.
Zhang F K,Qiao Y Q,Wang L,Lan L P,Pan J R.High level expression of genetically engineered tetravalent antibodies against parathion in E.coli and its identification[J].Journal of Nuclear Agricultural Sciences,2012,26(1):118-122,175.
[9] 张军杰,周会,胡育峰,田孟良,刘汉梅,黄玉碧.玉米基因sbe1 cDNA的克隆与原核表达[J].核农学报,2009,23(1):70-74.
Zhang J J,Zhou H,Hu Y F,Tian M L,Liu H M,Huang Y B.Cloning and expression of sbe1 cDNA from maize in E.coli[J].Journal of Nuclear Agricultural Sciences,2009, 23(1):70-74.
[10] 倪志勇,李波,范玲.棉花肉桂醇脱氢酶基因GhCAD3的克隆及原核表达[J].核农学报,2010, 24(5): 910-916,921.
Ni Z Y,Li B,Fan L.Cloning and prokaryotic expression of GhCAD3 gene from Gossypium hirsuturm[J].Journal of Nuclear Agricultural Sciences,2010,24(5):910-916,921.
[11] 潘滨,吴建祥,李桂新,周雪平.烟草曲茎病毒复制相关蛋白基因原核表达条件优化[J].浙江大学学报(农业与生命科学版),2007,33(1):24-28.doi:10.3321/j.issn:1008-9209.2007.01.005.
Pan B,Wu J X,Li G X,Zhou X P. Optimization of prokaryotic expression conditions of Tobacco curly virus replication-associated protein gene[J].Journal of Zhejiang University(Agriculture and Life Sciences), 2007,33(1):24-28.
[12] Bonner G,Lafer E M,Sousa R.Characterization of a set of T7 RNA polymerase active site mutants[J].Journal of Biological Chemistry,1994,269(40):25120-25128.
[13] Chamberlin M, Mcgrath J, Waskell L.New RNA polymerase from Escherichia coli infected with bacteriophage T7[J].Nature,1970, 228:227-231.doi:10.1038/228227a0.
[14] Dyke M W V,Sirito M,Sawadogo M. Single-step purification of bacterially expressed polypeptides containing an oligo-histidine domain[J].Gene,1992,111(1):99-104.doi:10.1016/0378-1119(92)90608-R.
[15] 黄传臻,刘香利,曹汝菲,赵惠贤.小麦CWI-B1的原核表达、纯化与多克隆抗体制备[J].农业生物技术学报, 2017,25(7):1102-1110.doi:10.3969/j.issn.1674-7968.2017.07.007.
Huang C Z,Liu X L,Cao R F,Zhao H X. Prokaryotic expression,purification and preparation of polyclonal antibody wheat (Triticum aestivum) CWI-B1[J].Journal of Agricultural Biotechnology, 2017,25(7):1102-1110.
[16] 常国栋,李壮林,秦加阳,马翠卿,罗永章,许平.重组人血管内皮抑制素(rh-Endostatin)大肠杆菌表达体系发酵条件的优化[J].生物工程学报,2005,21(4):662-666.
Chang G D, Li Z L, Qin J Y, Ma C Q, Luo Y Z, Xu P. Optimization of fermentation of recombinant human endostatin(rh-endostatin) expression in Escherichia coli[J].Chinese Journal of Biotechnology,2005,21(4):662-666.
[17] Xu Y C,Xue F S,Luo M P,Yang Q Y,Liao X,Liu Y,Zhang Y M. Median effective dose of remifentanil for awake laryngoscopy and intubation[J].Chinese Medical Journal, 2009,122(13):1507-1512. doi:10. 3760/cma.j.issn.0366-6999.2009.13.006.
[18] Majumder A, Basak S, Raha T, Chowdhury S P, Chattopadhyay D,Roy S.Effect of osmolytes and chaperone-like action of P-protein on folding of nucleocapsid protein of Chandipura virus[J].Journal of Biological Chemistry,2001,276(33):30948-30955.doi:10.1074/jbc.M011705200.
[19] 赵思婷,王贵华,张瑞华,金梅林,陈焕春.鸭源H9N2亚型流感病毒NS基因的克隆及表达[J].中国兽医科技,2004,34(5):23-26.doi:10.16656/j.issn.1673-4696.2004.05.007.
Zhao S T,Wang G H,Zhang R H,Jin M L,Chen H C.Cloning and expression of NS gene of Avian influenza virus type H9N2 from ducks[J].China Journal of Veterinary Science and Technology,2004,34(5):23-26.
[20] 杨婉华,汪蕊,陈睿,马湘一,王世宣,卢运萍,马丁.可溶性VEGF受体-3原核表达载体的构建与蛋白表达[J].中国现代医学杂志,2005,15(23):3547-3550.doi:10.3969/j.issn.1005-8982.2005.23.007.
Yang W H,Wang R,Chen R,Ma X Y,Wang S X,Lu Y P,Ma D.Gene cloning of soluble VEGF receptor-3 and expression in procaryotic system[J].China Journal of Modern Medicine,2005,15(23): 3547-3550.
[21] Bunger M K,Cargile B J,Sevinsky J R,Deyanova E,Yates N A,Hendrickson R C,Stephenson J L. Detection and validation of non-synonymous coding SNPs from orthogonal analysis of shotgun proteomics data[J].Journal of Proteome Research,2007,6(6):2331-2340.doi:10.1021/pr0700908.
