马铃薯(Solanum tuberosum L.)块茎的形成经过匍匐茎发生、匍匐茎伸长、匍匐茎纵向生长停止、匍匐茎顶端辐射生长、块茎发生和膨大过程[1-2]。一般情况下,适当生理年龄的植株在短日照和低温条件下容易诱导块茎。在此过程中植株叶片、匍匐茎及块茎中会出现激素表达量的变化,引起与光周期相关基因、激素相关基因及块茎形成相关基因等一系列基因的表达与关闭,引起干物质积累与蔗糖的合成运输量的变化[3-6]。在马铃薯块茎形成和发育不同阶段,一些转录因子如POTM1[7]、POTH[8]、StBELS[9]和拟南芥CONSTANS(AtCO)蛋白的同源序列单独或与其他因子共同调节马铃薯块茎发育[10]。FT-like基因StSP6A的高表达促进马铃薯植株形成较多数量的块茎[11]。最近研究表明,适当酸处理可增加马铃薯试管薯和无土栽培微型薯的数量[12-13]。经酸处理的马铃薯植株,可增加其叶片的蔗糖含量,增强蔗糖合成酶及淀粉合成相关的腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)的活性及SOD、POD、CAT活性,从而增加马铃薯块茎数量[12,14],但酸处理对块茎形成相关基因表达量的变化研究鲜有报道。因此,本研究通过酸处理植株不同时期的匍匐茎为试材,测定了其匍匐茎中光周期、激素以及块茎形成相关基因表达量的变化,解析了酸处理促进块茎形成的机理,为胁迫条件下块茎形成的研究奠定理论基础。
1 材料和方法
1.1 材料与地点
供试材料为马铃薯东农303的脱毒组培苗。试验于2017年3-9月在延边大学农学院玻璃温室内采用珍珠岩基质无土栽培的方式进行。
1.2 试验方法
1.2.1 组培脱毒苗移栽及营养液 马铃薯组培苗单叶节茎段继代于MS(含20 g/L蔗糖)液体培养基中,在25 ℃,30 μmol/s2光照下培养20 d,用清水洗净组培苗的根,之后按照行距8 cm和株距6 cm的距离栽植于浇透水的珍珠岩基质,栽植时只露出组培苗顶芽。首先供应1~2 d清水,并驯化植株,之后采用韩国“高试园”马铃薯营养液[15],进行无土基质营养液栽培。
1.2.2 无土基质营养液栽培及处理方法 马铃薯植株栽培分为诱导匍匐茎(出苗至生长第45 天)和诱导块茎(生长第46~80天)的2个时期,每天6:00,12:00,18:00浇灌相应韩国“高试园”马铃薯营养液(酸处理期间除外)。
酸处理及结薯数量调查:植株出苗至生长第40,45,50,55,60 天,利用 pH值4的磷酸水溶液分别处理植物根3 d,之后诱导块茎。植株培养80 d,调查每株平均结薯数量,每处理5个植株,重复3次。
试验材料收集:植株出苗生长的第45天,轻轻拔出植株,并标记不同发育阶段的匍匐茎的茎尖弯钩形成之前(Ⅰ)、弯勾时期(Ⅱ)、膨大初期(Ⅲ)、初具块茎形态时期(Ⅳ,直径大小为0.2~0.3 cm),之后重新栽植于蛭石中。利用 pH值4的磷酸水溶液处理植物根3 d,以不进行酸处理植株为对照,每处理10株,3次重复。处理3 d后,收集标记的不同生长时期的匍匐茎作为基因表达量差异分析的试验材料。
1.2.3 基因表达量的测定 采用OMEGA公司的试剂盒提取RNA,利用Premier 6.0 设计引物(表1),按照 TransScript Tip Green qPCR Su-perMix 试剂盒说明书进行各基因的相对表达量测定,以Actin为内参基因,采用2-ΔΔCT法对数据进行相对定量分析。
表1 马铃薯块茎形成相关基因的特异性引物
Tab.1 The specific primers of gene related to potato tuber formation

目的基因Target genes引物序列(5′-3′)Primer sequencesStActinF: CCTTGTATGCTAGTGGTCGR: GCTCATACTCAAGAGCCACStAGPaseF: AATCTACACCCAACCTCGR: CTTCACATTGTCCCCTATStHXKF: GGAAGAGATACGCCTAAGCR: AGAAGAGCAGCACCAATGStSUSY4F: GTGTGATGTGACGGTGTTR: ATGAGGAATGGAATGGTAGAGStSSSF: GCGGAATGGACTATCACAR: GGTGAGAAAGTGGCTCGTStSP6AF: GACGATCTTCGCAACTTTTACAR: CCTCAAGTTAGGGTCGCTTGStHd3aF: GGAAAAGCTTGCCTATGTGGR: CTGCTCCTGGCAGTTTCAAStGAF: AGGCACAGAGTGATCGCAGATR: TGGTGGCCCTCCAAAGTAAAStABAF: AATAATCTCAGAGGCAACAR: ACCTGCTACTGTACCTAStPIN1F: CGTGTTCGGTGGCAATGATR: CTCCATCGGATCGACCTGATStAGL8F: AGCAAAACAACCAGCTTTCCAAR: TGATCCCACTGATTTTGCTGTGStCOL1F: CACCATGTTGAAAAAAGAGAAGAGTGR: GAATGAAGGGACAATTCCATAACStFDF: GGAGACGGAAGTGGCACATTR: TAACTGCAGCTAAGCGTAACTGTTG
1.3 统计分析
采用IBM SPSS 19.0进行数据整理,利用T检验进行匍匐茎相同发育阶段酸处理和对照间基因表达量的差异显著性分析,采用Duncan′s 多重比较法进行植株不同生长时期酸处理对结薯数量的差异显著性分析;图片采用Graphpad prism 7软件绘制。
2 结果与分析
2.1 马铃薯植株不同生长时期的酸处理对块茎形成的影响
为探讨马铃薯匍匐茎的茎端不同发育时期酸处理对块茎形成的影响,根据匍匐茎的茎端形态特征将其发育时期分为茎尖弯钩形成之前(Ⅰ)、弯勾时期(Ⅱ)、膨大初期(Ⅲ)、初具块茎形态时期(Ⅳ)等4个发育时期(图1)。马铃薯植株匍匐茎的茎端观察表明,植株出苗后生长第40天时,匍匐茎茎端的形态特征以Ⅱ时期所占比例较大,其次是Ⅰ时期;植株出苗后生长第45,50天时,以Ⅱ时期所占比例最大,其次是Ⅲ时期;而生长第55,60天时以Ⅳ时期所占的比例最大。
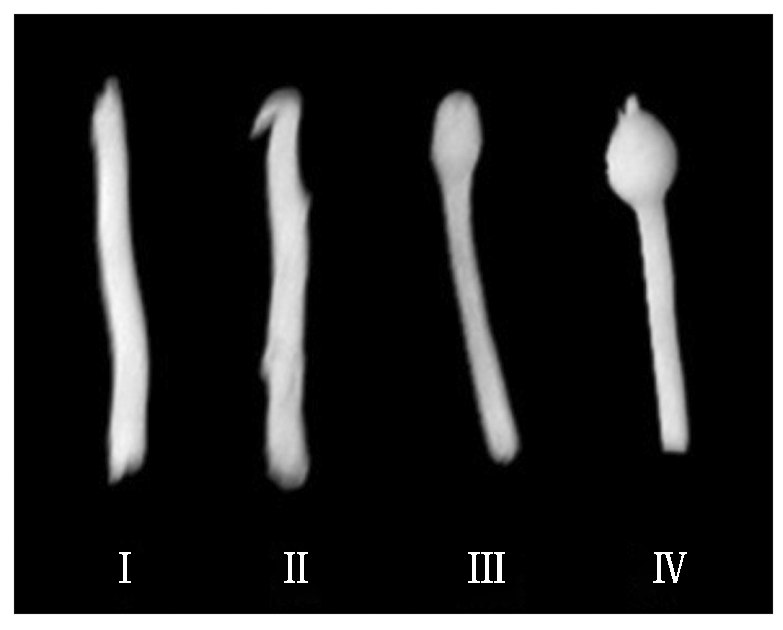
Ⅰ.茎尖弯钩形成之前;Ⅱ.弯勾时期; Ⅲ.膨大初期;Ⅳ.初具块茎形态时期。 Ⅰ.The stolon tip before hooked;Ⅱ.Hooked stolon tip; Ⅲ.The swelling tips;Ⅳ.Initial tuber formation.
图1 马铃薯匍匐茎的茎顶端不同发育状态
Fig.1 Stolons of different development stages
利用pH值4酸溶液处理不同生长天数的马铃薯植株根,之后诱导块茎35 d后调查结薯数量。结果表明(图2),植株出苗后生长45,50 d植株的单株结薯数量均显著高于55, 60 d,其中,生长45 d酸处理植株的结薯量最高,比55, 60 d的分别多53.2%,74.5%。
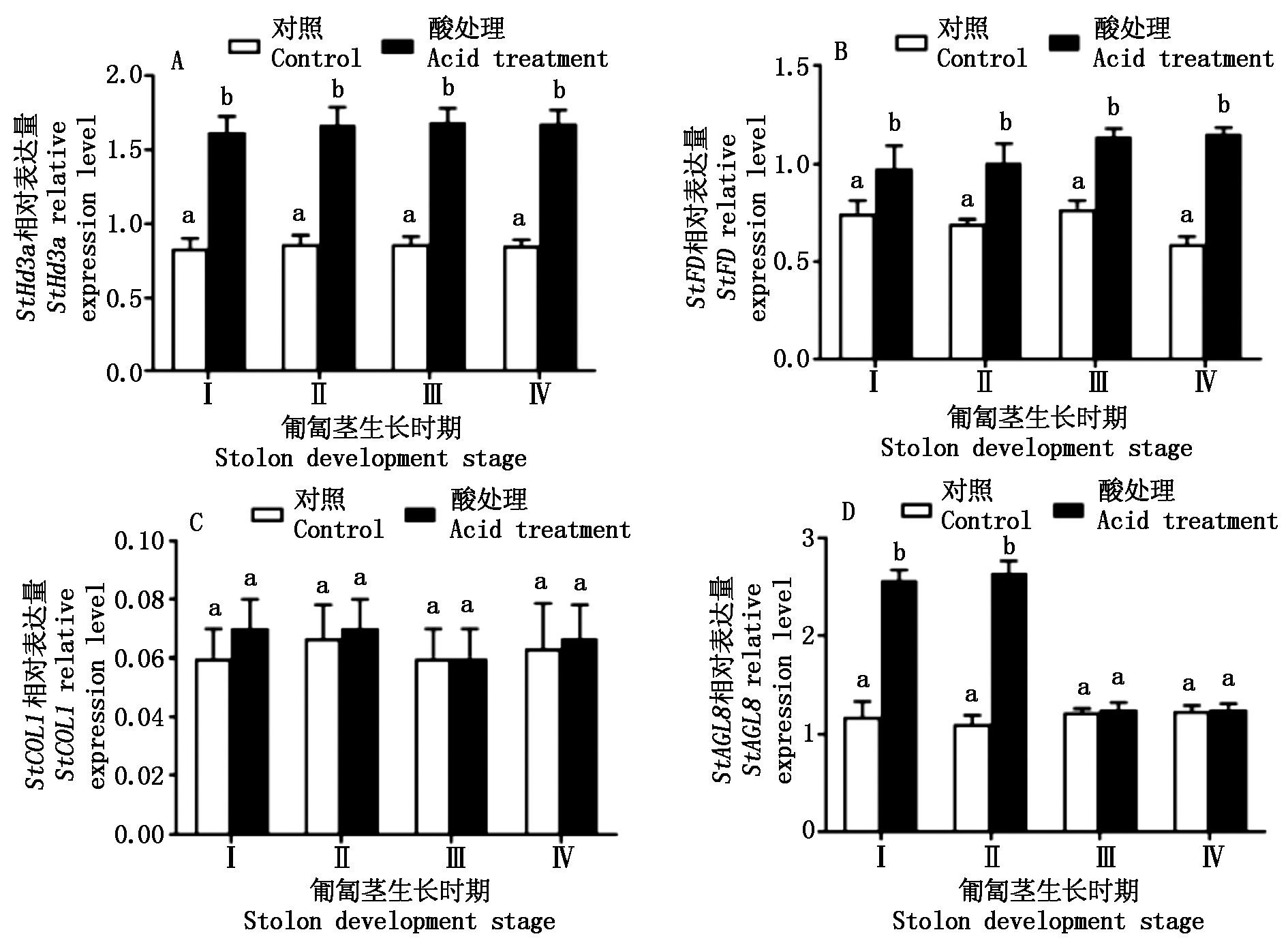
2.2 酸处理对光周期相关基因表达量的影响
图3表示匍匐茎不同发育时期的酸处理对StHd3a、StAGL8、StCOL1和StFD等与光周期相关基因表达量的变化。酸处理植株匍匐茎Ⅰ、Ⅱ、Ⅲ、Ⅳ时期, StHd3a表达量显著高于对照(P<0.05),分别比对照高94.7%,94.2%,94.9%,98.4%(图3-A);StFD表达量显著高于对照(P<0.05),分别比对照增加30.4%,45.9%,48.1%,96.2%(图3-B);StCOL1表达量与对照无显著性差异(P>0.05),说明酸处理对StCOL1表达影响不显著(图3-C);另外,匍匐茎的Ⅰ、Ⅱ时期,酸处理植株StAGL8表达量显著高于对照(P<0.05),比对照分别增加了119.7%,140.1%,而匍匐茎Ⅲ、Ⅳ时期的StAGL8表达量在酸处理与对照间无显著性差异(P>0.05)(图3-D)。

不同字母表示在0.05水平上差异显著。 Different letters indicate significant difference at the 0.05 level.
图2 马铃薯植株不同生长时期的酸处理 对微型薯形成的影响
Fig.2 Effects of acid treatment on potato minituber formation at different growth stages of plant
2.3 酸处理对糖代谢相关基因表达量的影响
图4表示匍匐茎不同发育时期的酸处理对StSUSY4、StAGPase、StHXK、StSSS等与糖代谢相关基因表达量变化。从图4-A中可以看出,酸处理植株的匍匐茎Ⅰ、Ⅱ、Ⅲ、Ⅳ时期均增强了StSUSY4表达量,比对照分别增加了29.6%,54.9%,31.7%,8.4%;酸处理植株Ⅳ时期的基因表达量分别是Ⅰ、Ⅱ、Ⅲ时期的2.6,1.9,3.7倍。从图4-B中可以看出,酸处理植株匍匐茎Ⅰ、Ⅱ时期StAGPase表达量显著降低(P<0.05),比对照分别下降了60.1%,41.7%;匍匐茎的Ⅲ时期,酸处理与对照StAGPase基因表达量无显著性差异(P>0.05),而在匍匐茎的Ⅳ时期,酸处理StAGPase表达量比对照显著高25.8%。从图4-C中可以看出,酸处理植株匍匐茎Ⅰ、Ⅱ、Ⅲ、Ⅳ时期的StHXK表达量显著高于对照(P<0.05),分别比对照增加了114.5%,133.5%,133.9%,369.4%,酸处理植株Ⅳ时期的表达量比Ⅰ、Ⅱ、Ⅲ时期增强了72.9%,80.2%,75.6%;对照植株匍匐茎Ⅰ、Ⅱ、Ⅲ、Ⅳ时期的基因表达量相对平稳。从图4-D中可以看出,酸处理植株匍匐茎Ⅰ、Ⅱ时期的StSSS的表达量均显著低于对照(P<0.05),其下降幅度分别为23.2%,21.6%;Ⅲ时期与对照无显著性差异(P>0.05);而Ⅳ时期其基因表达量显著高于对照(P<0.05),比对照高21.6%。
不同字母仅表示匍匐茎相同生长时期的酸处理和对照间差异显著(P<0.05)。图4-6同。 Different letters indicate significant differences in the same stolon development stage between acid treatment and control (P<0.05). The same as Fig.4-6.
图3 酸处理对光周期相关基因表达量的变化
Fig.3 Change of acid treatment on the expression levels of genes related to photoperiod
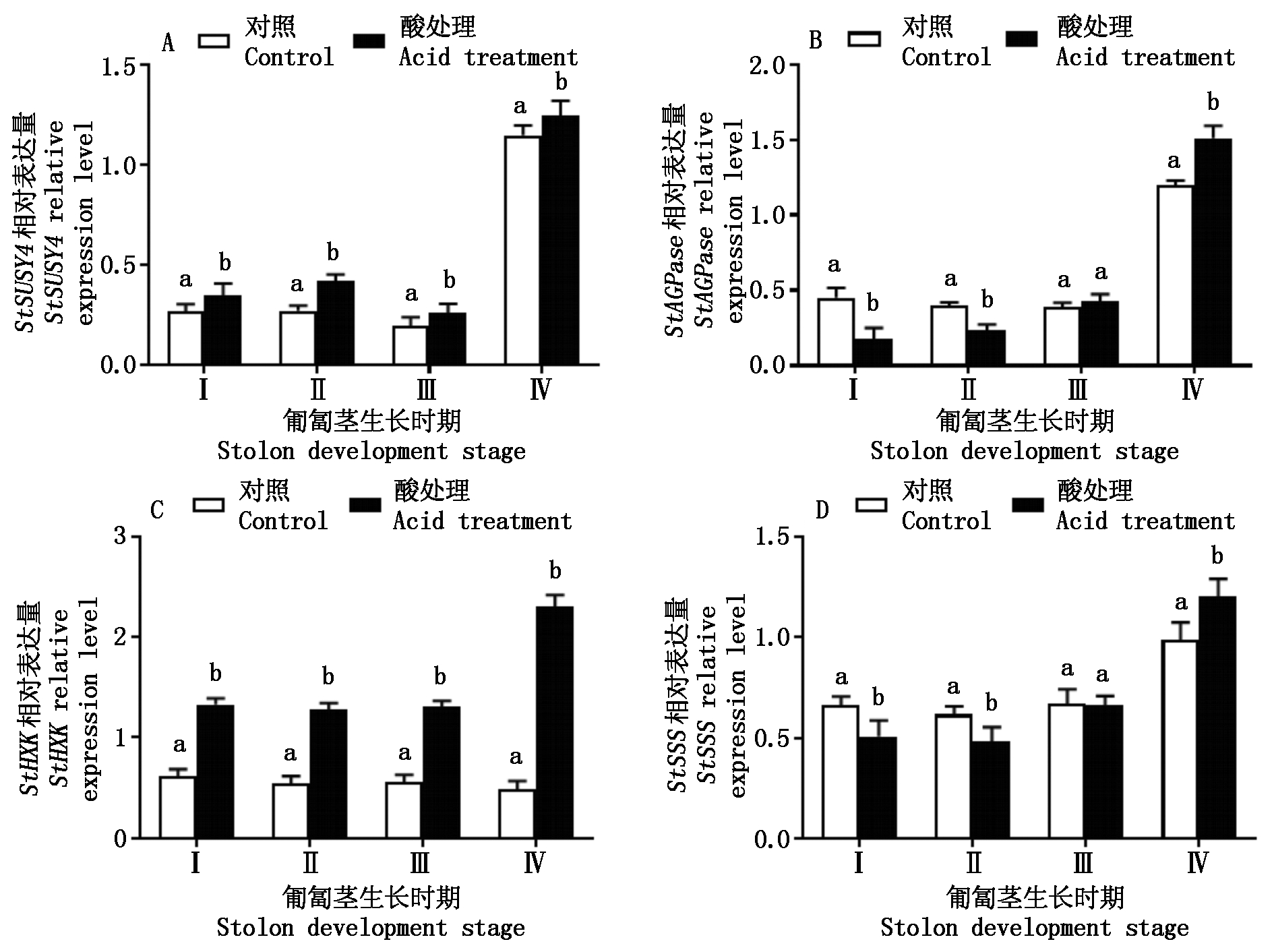
图4 酸处理对糖代谢相关基因表达量的变化
Fig.4 Change of acid treatment on the expression levels of genes related to carbohydrate metabolism
2.4 酸处理对激素相关基因表达量的影响
图5表示匍匐茎不同发育时期的酸处理对StPIN1、StGA、StABA等与激素相关基因表达量变化。从图5-A中可以看出,酸处理后植株生长素运输基因StPIN1在匍匐茎中的表达量均显著高于对照(P<0.05),Ⅰ、Ⅱ、Ⅲ、Ⅳ时期的该基因表达量分别比对照增加了17.1%,16.9%,44.8%,52.8%,说明块茎发育初期的酸处理诱导了大量的生长素转运基因并输送到块茎形成部位,从而促进了块茎的形成及膨大。从图5-B中可以看出,酸处理植株StGA表达量在匍匐茎的Ⅰ、Ⅱ时期均显著高于对照(P<0.05),分别比对照高49.4%,25.1%,而在Ⅲ时期与对照无显著性差异(P>0.05);在Ⅳ时期显著低于对照(P<0.05)。从图5-C中可以看出,酸处理显著增加匍匐茎StABA表达量,匍匐茎Ⅰ、Ⅱ、Ⅲ、Ⅳ时期酸处理植株StABA表达量比对照分别增加15.4%,53.3%,38.8%,42.3%,而对照植株StABA表达量变化较小,说明酸处理促进了植株体内ABA含量的积累,间接促进了马铃薯块茎的发育。
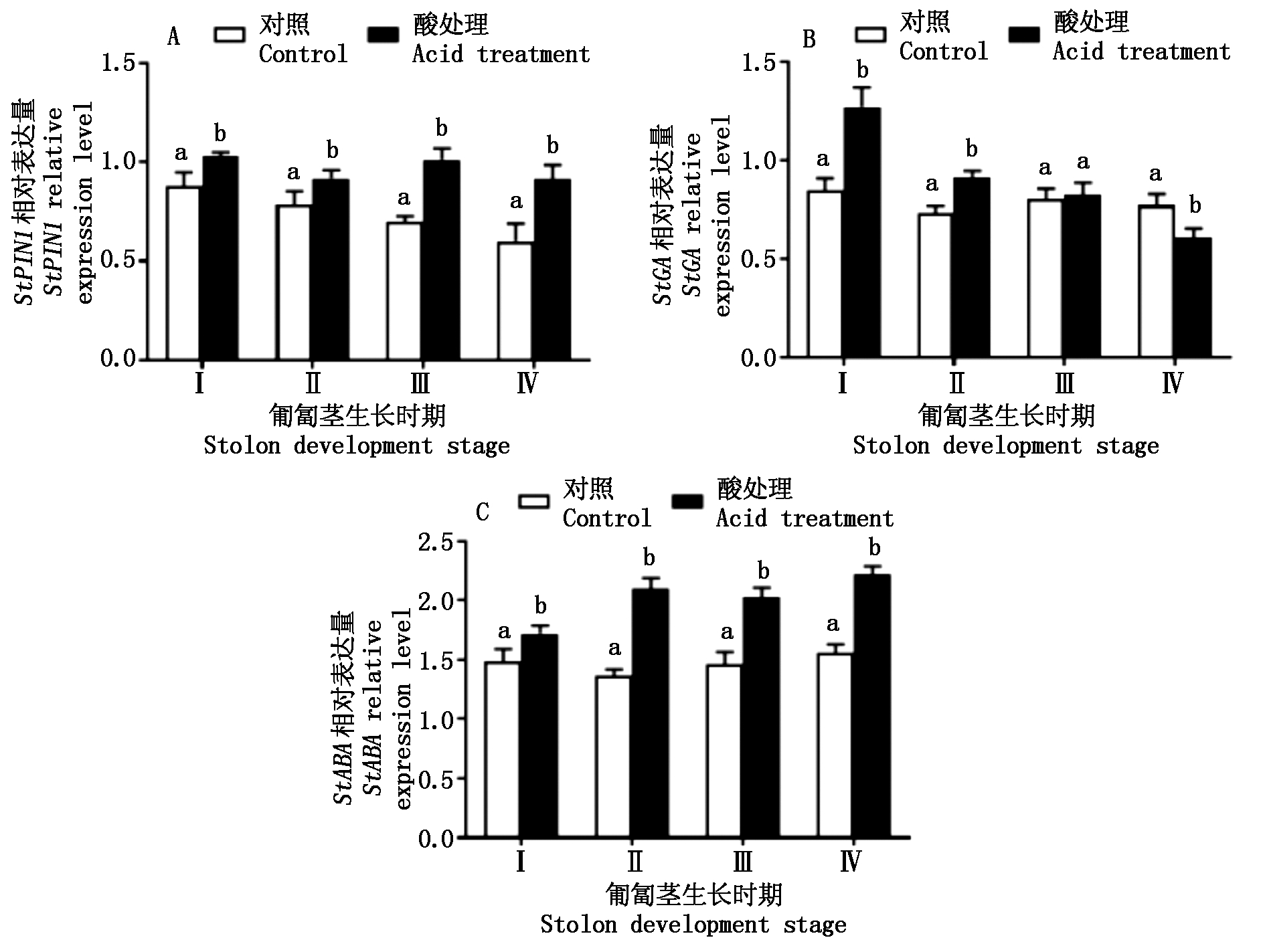
图5 酸处理对激素相关基因表达量的变化
Fig.5 Change of acid treatment on the expression levels of genes related to plant hormone
2.5 酸处理对StSP6A表达量的影响
图6表示匍匐茎不同发育时期的酸处理对StSP6A表达量的变化。从图6 中可以看出,匍匐茎Ⅰ、Ⅱ、Ⅲ、Ⅳ时期,酸处理植株StSP6A表达量显著高于对照(P<0.05),比对照分别增加了51.3%,41.9%,47.5%,55.6%,而对照植株中该基因表达较稳定。
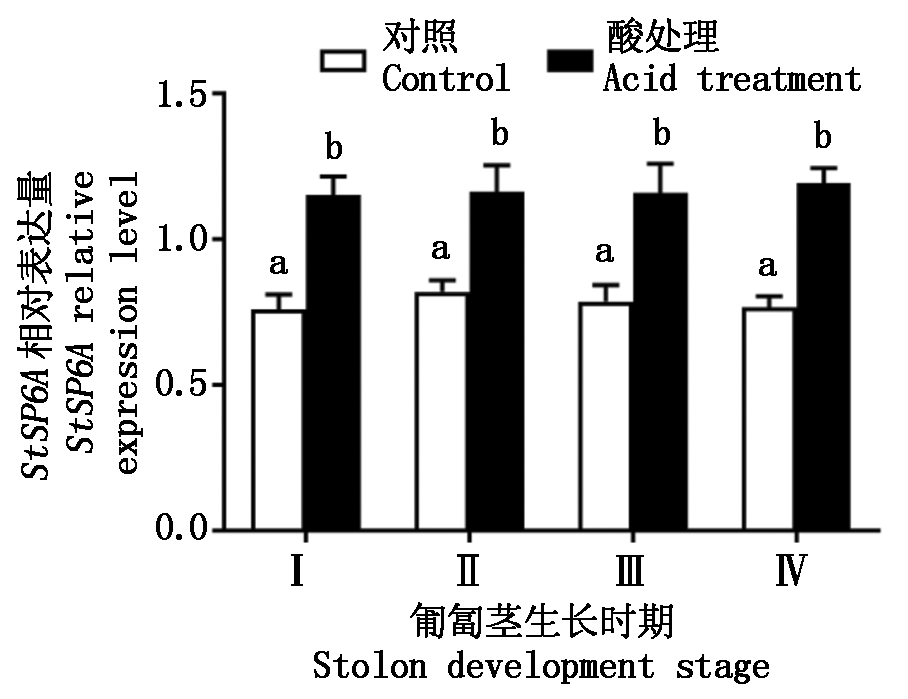
图6 酸处理对StSP6A基因表达量的变化
Fig.6 Change of acid treatment on StSP6A expression levels
3 结论与讨论
马铃薯匍匐茎发生是块茎形成的必要条件,但并不是所有的匍匐茎均能形成块茎[16]。一般情况下匍匐茎转变成块茎的比率为50%~70%,且随着匍匐茎形成数量的增多所形成的块茎数量也增多[17]。本研究对无土基质栽培下生长45 d的东农303植株根进行酸处理,并获得了大量的块茎;也有研究表明,对气雾培下移栽40 d的Norland品种[17]及移栽35 d的Van der Plank[13]进行酸处理时,其植株的结薯量较高,说明酸处理能够增加马铃薯品种的结薯数量,且进行酸处理时应考虑品种、植株生长势及栽培条件等多种因素。另外,本研究结合前人的研究结果和匍匐茎茎端形态特征及结薯数量相结合考虑,推测匍匐茎Ⅰ和Ⅱ时期的酸处理均可促进块茎的形成,尤其对匍匐茎Ⅱ时期的酸处理诱导块茎更加有效,因此,在实际生产上应用酸处理的方法诱导块茎,应掌握好植株生长时期。
研究表明,CONSTANS (CO)、FLOWERING LOCUS T (FT)、光敏色素转录因子、成花转换基因FD[18-19]、Constant-Like(COL)[20-21]、Hd3a[22]等对马铃薯块茎形成具有重要的作用;StAGL8、FRUITFULL等基因在分裂组织的分化及随后的心皮发育中起调控作用[23]。本研究中,StHd3a表达量在酸处理植株匍匐茎不同生长阶段始终保持着较高水平,从而保证块茎的膨大,该现象与短日照促进马铃薯块茎膨大的现象相似,且与水稻在短日照条件下增加Hd3a表达量的结果相符[22];同时StFD表达量在酸处理植株的Ⅳ时期增强幅度最大,该结果与Navarro等[11]FD基因高表达促进块茎形成的研究结果相一致;StAGL8表达量在酸处理植株匍匐茎的Ⅰ、Ⅱ时期显著高于对照,而在匍匐茎的Ⅲ、Ⅳ时期与对照无显著差异,该基因的表达趋势与40,45,50 d(Ⅰ、Ⅱ时期匍匐茎占多数)酸处理植株形成的微型薯数量显著高于55,60 d(Ⅲ、Ⅳ时期匍匐茎占多数)酸处理植株的试验结果相符,说明微型薯形成与StAGL8表达密切相关,该结果与StAGL8过量表达促进块茎形成的研究结果相一致[8];另外,酸处理增强了StHd3a、StFD表达量的同时促进了马铃薯块茎的形成及膨大,该现象与StHd3a、StFD过表达转基因马铃薯形成较多数量块茎的研究结果相一致[11];酸处理对StCOL1表达量无显著性影响,可能是因为StCOL1与其相似蛋白基因StCO一样通过调控光周期途径相关基因来影响块茎形成的原因[24]。
马铃薯植株叶片最终光合产物蔗糖可通过韧皮部输送到植株地下部块茎形成部位,之后SUSY分解蔗糖,并为淀粉合成提供底物[25]。AGPase作为淀粉合成过程中的限速酶,直接调控淀粉的合成,而己糖激酶(HXK)作为植物呼吸过程的关键酶对维持植物体内碳平衡及植物呼吸作用起着重要的作用[26]。Rolland等[27]研究发现,HXK在葡萄糖信号转导过程中,对植物的发育过程起到了一定的作用。本研究,酸处理植株匍匐茎的Ⅰ、Ⅱ、Ⅲ、Ⅳ时期均增强了StSUSY4的表达,说明酸处理增强了蔗糖的降解能力,从而为合成淀粉提供大量的底物,也可推测蔗糖从叶片大量输送到块茎发育部位,提高了其渗透压来抵御酸胁迫,该结果与Kramer和Boyer[28]、Crespi等[29]、Déjardin等[30]在其他非生物胁迫如干旱胁迫、低温胁迫以及脱水胁迫下植物体内的蔗糖含量会大量增加的结果相一致;酸处理植株匍匐茎的Ⅰ、Ⅱ时期均显著降低了StAGPase的表达量,而在匍匐茎的Ⅲ时期,酸处理与对照StAGPase的表达量无显著差异,推测酸处理初期植株原有的糖代谢平衡被打破,细胞生物体膜的选择透性遭到破坏,导致基质中的无机磷进入细胞内[31];在酸处理植株匍匐茎Ⅰ、Ⅱ、Ⅲ、Ⅳ时期的StHXK表达量均显著高于对照,这可能是由于在酸处理下植株自身对酸胁迫的适应性调节所导致的,这与韦克苏等[32]在高温胁迫下己糖激酶类的关键基因上调结果相一致;酸处理植株匍匐茎的Ⅰ、Ⅱ时期StSSS的表达量降低,而在Ⅳ时期高于对照,说明匍匐茎Ⅳ时期的酸处理有利于马铃薯块茎的膨大,推测酸处理促进StSSS大量表达,进而提高了SSS酶的活性[33-34],SSS酶活性的增强是加快马铃薯块茎膨大所需淀粉合成的原因。
生长素对马铃薯块茎的生长发育具有重要调控作用,生长素抑制马铃薯匍匐茎的伸长生长,但对块茎的形成和发育有促进作用[35];脱落酸对马铃薯块茎的形成具有重要调节作用,即内源 ABA 含量随块茎形成而增加[36]。本研究中,在酸处理植株匍匐茎的Ⅰ、Ⅱ、Ⅲ、Ⅳ时期StPIN1表达量显著高于对照,该研究结果与匍匐茎顶端膨大期和块茎形成初期,生长素含量较高的结果[37]以及生长素转运相关基因StPIN1在块茎发育初期均上调表达,使得块茎发育过程中生长素含量升高,有利于块茎形成[38]的研究结果相一致;酸处理植株匍匐茎的Ⅰ、Ⅱ时期StGA表达量显著高于对照,而Ⅳ显著低于对照,该结果符合块茎形成时内源GA3活性下降的观点[39];酸处理显著增加StABA表达,说明酸处理可促进植株体内ABA含量的积累,间接促进了马铃薯块茎的发育,该研究结果与ABA促进马铃薯块茎形成的研究结果相一致[40-41]。
StSP6A与植物开花重要信号分子 FT 同源,并在马铃薯块茎形成过程中起重要作用[11,42],StSP6A可通过长距离运输独立控制开花过程。Navarro等[11]研究表明,过量表达StSP6A植株促进块茎的形成,而且在短日照条件下StSP6A基因在叶片和匍匐茎中大量表达,该研究与本研究的酸处理促进块茎形成并高表达StSP6A的结果相一致。
综上所述,适当的非生物胁迫会促进植株某器官的生长和发育。本研究对生长一定程度的马铃薯植株进行了短暂的酸处理,有效提高了块茎的形成。另外,酸处理的植株StHd3a、StFD、StSUSY4、StHXK,StPIN1、StABA、StSP6A、StAGPase、StSSS、StGA、StAGL8等基因的表达水平或表达模式与对照组存在差异,说明酸处理通过调控多种代谢途径基因的表达而影响块茎形成。
[1] 冷冰, 袁继平, 胡成来, 陈兆贵, 黄学林.马铃薯块茎形成的研究进展[J]. 广东农业科学, 2010,37(6):27-29,32. doi:10.3969/j.issn.1004-874X.2010.06.012.
Leng B, Yuan J P, Hu C L,Chen Z G, Huang X L. Research progress on potato tuber formation[J]. Guangdong Agricultural Sciences,2010,37(6):27-29,32.
[2] 徐欣, 连勇.马铃薯块茎发育机理的研究[J]. 马铃薯杂志, 1997, 11(2):115-119.
Xu X, Lian Y.Study on the development mechanism of potato tuber[J]. Chinese Potato Journal, 1997, 11(2):115-119.
[3] Plantenga F D M, Bergonzi S, Bachem C W B, Visser R G F, Heuvelink E, Marcelis L F M.High light accelerates potato flowering independently of the FT-like flowering signal StSP3D[J].Environmental and Experimental Botany,2019,160:35-44.doi:10.1016/j.envexpbot.2019.01.004.
[4] 全锋, 张爱霞, 曹先维.植物激素在马铃薯块茎形成发育过程中的作用[J]. 中国马铃薯, 2002(1):29-32. doi:10.3969/j.issn.1672-3635.2002.01.011.
Quan F, Zhang A X, Cao X W. The effects of plant hormone on tuherization of potatoes[J]. Chinese Potato Journal, 2002(1):29-32.
[5] Shan J W, Song W, Zhou J , Wang X H, Xie C H, Gao X X, Xie T T, Liu J. Transcriptome analysis reveals novel genes potentially involved in photoperiodic tuberization in potato[J]. Genomics, 2013, 102(4):388-396. doi:10.1016/j.ygeno.2013.07.001.
[6] Lai Y C, Wang S Y, Gao H Y, Nguyen K M, Nguyen C H,Shih M C,Lin K H. Physicochemical properties of starches and expression and activity of starch biosynthesis-related genes in sweet potatoes[J]. Food Chemistry, 2016, 199:556-564. doi:10.1016/j.foodchem.2015.12.053.
[7] Kang S G,Hannapel D J. A novel MADS-box gene of potato (Solanum tuberosum L.) expressed during the early stages of tuberization[J]. Plant Molecular Biology, 1996, 31(2):379-386. doi:10.1007/BF00021798.
[8] Rosin F M, Hart J K,Horner H T, Davies P J, Hannapel D J. Overexpression of a Knotted-like homeobox gene of potato alters vegetative development by decreasing gibberellin accumulation[J]. Plant Physiology, 2003,132(1):106-117. doi:10.1104/PP.102.015560.
[9] Chen H, Banerjee A K, Hannapel D J. The tandem complex of BEL and KNOX partners is required for transcriptional repression of ga20ox1[J]. The Plant Journal, 2004, 38(2):276-284. doi:10.1111/j.1365-313X.2004.02048.x.
[10] Carrera E, Bou J, García-Martínez J L, Prat S. Changes in GA 20-oxidase gene expression strongly affect stem length, tuber induction and tuber yield of potato plants[J]. The Plant Journal, 2000, 22(3):247-256. doi:10.1046/j.1365-313x.2000.00736.x.
[11] Navarro C, Abelenda J A, Cruz-Oró E, Cuéllar C A,Tamaki S,Silva J,Shimamoto K,Prat S. Control of flowering and storage organ formation in potato by FLOWERING LOCUS T[J]. Nature, 2011, 478(7367):119-122. doi:10.1038/nature10431.
[12] 滕跃, 高玉亮, 张雁, 金美玉, 李葵花.酸胁迫对马铃薯脱毒试管苗结薯特性及其几种糖代谢的影响[J]. 作物杂志, 2017(1):140-143. doi:10.16035/j.issn.1001-7283.2017.01.025.
Teng Y, Gao Y L, Zhang Y, Jin M Y, Li K H.Effects of acid stress on microtuberization and some glycometabolism of potato in vitro plantlets[J]. Crops, 2017(1):140-143.
[13] Barnard R, Combrink N J J. Potato mini tuber production affected by a short-term calcium deficiency[J]. South African Journal of Plant and Soil, 2004,21(3):200-202. doi:10.1080/02571862.2004.10635049.
[14] 滕跃, 郭津廷, 高玉亮, 李葵花.气雾培下酸处理马铃薯植株结薯特点及其叶片生理指标变化研究[J]. 吉林农业大学学报,2020,42(1):26-33.doi:10.13327/j.jjlau.2020.4391.
Teng Y, Guo J T, Gao Y L, Li K H. Minituberization characteristics of potato plant and physiological and biochemical indexes in its leaf with acid treatment at aeroponics[J].Journal of Jilin Agricultural University,2020,42(1):26-33.
[15] 张雁, 高航, 金美玉, 李葵花.无土栽培营养液浓度对马铃薯植株生长和微型薯形成的影响[J]. 延边大学农学学报, 2016,38(2):117-121. doi:10.13478/j.cnki.jasyu.2016.02.005.
Zhang Y, Gao H, Jin M Y, Li K H. Effect of nutrition solution concentration on growth and minituberization of potato plants under hydroponics[J]. Agricultural Science Journal of Yanbian University, 2016,38(2):117-121.
[16] 刘克礼, 高聚林, 张宝林.马铃薯匍匐茎与块茎建成规律的研究[J]. 中国马铃薯, 2003, 17(3):151-156. doi:10.3969/j.issn.1672-3635.2003.03.005.
Liu K L, Gao J L, Zhang B L. The regular pattern of stolon and tuber formation in potato[J]. Chinese Potato Journal, 2003, 17(3):151-156.
[17] Waylen W Y, Cao W X, Tibbitts T W. Tuber initiation in hydroponically grown potatoes by alteration of solution pH[J]. HortScience, 1993, 29(6):621-623.doi:10.21273/HORTSCI.29.6.21.
[18] Abe M, Kobayashi Y, Yamamoto S, Daimon Y, Yamaguchi A, Ikeda Y, Ichinoki H, Notaguchi M, Goto K, Araki T. FD, a bZIP protein mediating signals from the floral pathway integrator FT at the shoot apex[J]. Science, 2005, 309(5737):1052-1056. doi:10.1126/science.1115983.
[19] Wigge P A, Kim M C, Jaeger K E, Busch W, Schmid M, Lohmann J U, Weigel D. Integration of spatial and temporal information during floral induction in Arabidopsis[J]. Science, 2005, 309(5737):1056-1059. doi:10.1126/science.1114358.
[20] Valverde F V. CONSTANS and the evolutionary origin of photoperiodic timing of flowering[J]. Journal of Experimental Botany 2011, 62(8):2453-2463. doi:10.1093/jxb/erq449.
[21] Gangappa S N, Botto J F. The BBX family of plant transcription factors[J]. Trends in Plant Science, 2014, 19(7):460-470. doi:10.1016/j.tplants.2014.01.010.
[22] Kojima S, Takahashi Y, Kobayasi Y, Monna L, Sasaki T, Araki T, Yano M. Hd3a, a rice ortholog of the Arabidopsis FT gene, promotes transition to flowering downstream of HD1 under short-day conditions[J]. Plant and Cell Physiology, 2002, 43(10):1096-1105. doi:10.1093/pcp/pcf156.
[23] 李冉阳, 秦玉涛, 张倩, 吴婧, 谢皓, 郭蓓.大豆 GmAGL8 基因的克隆及生物信息学分析[J]. 安徽农业科学,2015, 43(18):45-48. doi:10.3969/j.issn.0517-6611.2015.18.015.
Li R Y, Qin Y T, Zhang Q, Wu J, Xie H, Guo B.Cloning and bioinformatics analysis of gene GmAGL8 in soybean[J]. Journal of Anhui Agricultural Sciences, 2015, 43(18):45-48.
[24] González-Schain N D, Díaz-Mendoza M, ![]() urczak M, Suárez-López P.Potato CONSTANS is involved in photoperiodic tuberization in a graft-transmissible manner[J]. The Plant Journal, 2012, 70(4): 678-690. doi:10.1111/j.1365-313x.2012.04909.x.
urczak M, Suárez-López P.Potato CONSTANS is involved in photoperiodic tuberization in a graft-transmissible manner[J]. The Plant Journal, 2012, 70(4): 678-690. doi:10.1111/j.1365-313x.2012.04909.x.
[25] 成善汉, 苏振洪, 谢从华, 柳俊.淀粉-糖代谢酶活性变化对马铃薯块茎还原糖积累及加工品质的影响[J].中国农业科学, 2004,37(12):1904-1910. doi:10.3321/j.issn:0578-1752.2004.12.019.
Cheng S H, Su Z H, Xie C H, Liu J. Effects of variation in activities of starch-sugar metabolic enzymes on reducing sugar accumulation and processing quality of potato tubers[J]. Scientia Agricultura Sinica, 2004,37(12):1904-1910.
[26] Rucha K,Michael L,Annie V,Xia X X,Rauh B L,Moore B D.Evolutionary lineages and functional diversification of plant hexokinases[J]. Molecular Plant,2010,3(2):334-346.doi:10.1093/mp/ssq003.
[27] Rolland F, Moore B, Sheen J. Sugar sensing and signaling in plants[J]. The Plant Cell, 2001, 14(S):185-205.
[28] Kramer P J, Boyer J S. Water relations of plants and soils[J]. Journal of Plant and Physiology, 1997,150(4):493-494.doi:10.1016/S0176-1617(97)80106-X.
[29] Crespi M D, Zabaleta E J, Pontis H G,Salerno G L.Sucrose synthase expression during cold acclimation in wheat[J]. Plant Physiology, 1991, 96(3):887-891. doi:10.1104/pp.96.3.887.
[30] Déjardin A, Sokolov L N, Kleczkowski L A. Sugar/osmoticum levels modulate differential abscisic acid-independent expression of two stress-responsive sucrose synthase genes in Arabidopsis[J]. Biochemical Journal, 1999, 344(2):503-509. doi:10.1042/bj3440503.
[31] 解雅晶. 马铃薯低温糖化及其机理研究[D].北京:中国农业科学院, 2018.
Xie Y J. Mechanism of cold-induced sweetening in potato during postharvest storage[D]. Beijing:Chinese Academy of Agricultural Sciences, 2018.
[32] 韦克苏, 程方民, 董海涛, 张其芳, 刘奎刚, 曹珍珍.水稻胚乳贮藏物代谢相关基因响应花后高温胁迫的微阵列分析[J].中国农业科学, 2010,43(1):1-11. doi:10.3864/j.issn.0578-1752.2010.01.001.
Wei K S, Cheng F M, Dong H T,Zhang Q F, Liu K G,Cao Z Z. Microarray analysis of gene expression profile related to grain storage metabolism in rice endosperms as affected by high temperature at filling stage[J]. Scientia Agricultura Sinica, 2010,43(1):1-11.
[33] 谭彩霞, 封超年, 郭文善, 朱新开, 李春燕,彭永欣. 不同小麦品种籽粒淀粉合成酶基因的表达及其与淀粉积累的关系[J]. 麦类作物学报, 2011, 31(6):1063-1070.
Tan C X, Feng C N, Guo W S, Zhu X K, Li C Y, Peng Y X. Difference in expression of starch synthase gene and starch synthesis in the grains of different wheat cultivars[J].Journal of Triticeae Crops, 2011, 31(6):1063-1070.
[34] 潘飞龙, 田维强, 宋朝鹏, 郑明伟, 夏志林, 刘明宏, 芶剑渝, 李成刚.烤烟成熟期淀粉代谢关键酶活性与基因表达研究[J].西北农林科技大学学报(自然科学版), 2019, 47(9):33-43.doi:10.13207/j.cnki.jnwafu.2019.09.005.
Pan F L, Tian W Q, Song C P, Zheng M W, Xia Z L, Liu M H, Gou J Y, Li C G. Activities of key enzymes related with starch metabolism and gene expression in flue cured tobacco at maturity[J]. Journal of Northwest A&F University(Nat Sci Ed), 2019, 47(9):33-43.
[35] Struik P C, Vreugdenhil D, Haverkort A J, Bus C B, Dankert R. Possible mechanisms of size hierarchy among tubers on one stem of a potato (Solanum tuberosum L.) plant[J]. Potato Research, 1991, 34(2): 187-203. doi:10.1007/bf02358041.
[36] 刘梦芸, 蒙美莲, 门福义, 毛雪飞.GA3、IAA、CTK和ABA对马铃薯块茎形成调控作用的研究[J]. 内蒙古农牧学院学报, 1997,18(2):16-20.
Liu M Y, Meng M L,Men F Y, Mao X F. Studies on the control of GA3,ZAA,CTK and ABA on the tuberization of potato[J]. Journal of Inner Mongolia Institute of Agriculture and Animal Husbandary, 1997,18(2):16-20.
[37] Gukasyan I A, Golyanovskaya S A, Grishunina E V, Konstantinova T N, Aksenova N P, Romanov G A. Effect of Rol transgenes, IAA, and kinetin on starch content and the size of starch granules in tubers of in vitro potato plants[J]. Russian Journal of Plant Physiology, 2005, 52(6):809-813. doi:10.1007/s11183-005-0119-1.
[38] Kloosterman B, Koeyer D D, Griffiths R, Flinn B, Steuernagel B, Scholz U,Sonnewald S, Sonnewald U, Bryan G J, Prat S, Bánfalvi Z, Hammond J P, Geigenberger P, Nielsen K L, Visser R G F, Bachem C W B. Genes driving potato tuber initiation and growth: identification based on transcriptional changes using the POCI array[J]. Functional and Integrative Genomics, 2008, 8(4):329-340. doi:10.1007/s10142-008-0083-x.
[39] Jackson S D. Multiple signaling pathways control tuber induction in potato[J]. Plant Physiol,1999,119(1):1-8. doi:10.1104/pp.119.1.1.
[40] Kumar D, Wareing P F. Studies on tuberization in Solanum andigena:I.evidence for the existence and movement of a specific tuberization stimulus[J]. New Phytologist,1973, 72(2): 283-287. doi:10.1111/j.1469-8137.1973.tb02034.x.
[41] 蒙美莲,刘梦芸,门福义,张宏志.赤霉素和脱落酸对马铃薯块茎形成的影响[J]. 中国马铃薯, 1994, 8(3):134-137.
Meng M L, Liu M Y,Men F Y,Zhang H Z.Effect of GA3 and ABA on the formation[J].Chinese Potato Journal, 1994, 8(3):134-137.
[42] 谢婷婷, 柳俊.光周期诱导马铃薯块茎形成的分子机理研究进展[J]. 中国农业科学, 2013, 46(22):4657-4664. doi:10.3864/j.issn.0578-1752.2013.22.003.
Xie T T, Liu J. Molecular mechanism underlying photoperiodic-induced potato tuber formation of potato tuber[J]. Scientia Agricultura Sinica, 2013, 46(22):4657-4664.
