香鳞毛蕨(Dryopteris fragrans)属于鳞毛蕨科鳞毛蕨属落叶多年生药用草本植物,一般生长于树林下或岩石缝里,主要分布在黑龙江省五大连池市,受大陆季风性气候影响,该地区降水量多而集中,极端最低气温-41.0 ℃,极端最高气温36.5 ℃ [1],是研究植物抗逆(低温、高温和盐等)的珍贵材料。因此,开展香鳞毛蕨抗逆机制研究对于丰富植物抗逆的理论、推动黑龙江高寒地区药用植物资源栽培具有重要的理论和现实意义。TCP蛋白是植物特异性转录因子的一个小家族,通过调节细胞生长和增殖,在植物生长发育的多个过程以及对外界环境的响应中发挥着重要调节作用[2-5]。TCP蛋白具有TCP结构域的特点,该结构域是一个高度保守的N-端59个碱基螺旋环(bHLH)结构,与DNA结合、蛋白质-蛋白质相互作用和蛋白质核定位有关 [6]。根据TCP结构域的序列特征和同源性,将TCP家族成员分为2个亚家族:Ⅰ类(以PCF蛋白为代表)和Ⅱ类(以CYC和TB1为代表) [4,7],这2个亚家族之间最显著的区别是,Ⅰ类成员在TCP结构域的基本区域显示出4个氨基酸的缺失 [4],而Ⅱ类TCP成员根据其TCP域的不同进一步细分为2个子类(CIN和CYC/TB1),此外,一些Ⅱ类成员有一个具有未知功能的精氨酸基序(R结构域),这被假设与促进蛋白质相互作用有关 [3-4]。研究表明,TCP转录因子几乎参与调控所有植物生长发育的多个生理和生物学过程包括对逆境的响应,还参与植物激素信号转导过程,如赤霉素(GA)、脱落酸(ABA)、独脚金内酯(SL)、茉莉酸(JA)、生长素(IAA)和细胞分裂素(CTK)[8-12]。对于Ⅰ类TCP基因,通过减少水损失和活性氧,并上调与ABA、茉莉酸甲酯(MeJA)、乙烯、IAA和CTK信号途径相关的基因,水稻(Oryza sativa)OsTCP19的过表达提高了植物对NaCl和甘露醇胁迫的耐受性 [13-14]。对于Ⅱ类TCP基因,水稻OsTCP14和OsTCP21的过表达增加了植物对冷胁迫的敏感性[15]。在拟南芥(Arabidopsis thaliana)中TCP14与转录因子DOF6结合互作后阻止DOF6激活ABA生物合成基因ABA DEFICIENT 1(ABA1)和其他ABA相关的胁迫基因,拮抗了ABA信号传导而促进种子萌发[16-17]。迄今为止,在双子叶植物和单子叶植物中都发现了一些完整的TCP家族成员,它们通过参与植物激素信号转导途径来调控植物对非生物胁迫的响应,表明TCP家族可能在植物激素信号转导途径和非生物胁迫的响应这个庞大复杂的调控网络中扮演着至关重要的角色,如拟南芥[18]、西红柿(Solanum lycopersicum)[19]、苹果(Malus domestica)[20]、草莓(Fragaria ananassa)[21]和竹子(Phyllostachys edulis)[22]。近期研究结果表明,TCP转录因子表达受ABA、水杨酸(SA)、MeJA等激素及温度、高盐和干旱等非生物胁迫诱导,但在香鳞毛蕨中,有关DfTCP与抗逆的研究鲜有报道。本研究对香鳞毛蕨DfTCP基因进行生物信息学预测分析,同时通过实时荧光定量PCR测定其在逆境环境下的相对表达水平,进而探索TCP转录因子调控香鳞毛蕨抗逆性的机制,为丰富香鳞毛蕨抗逆理论和实现种植业的产业化提供理论依据。
1 材料和方法
1.1 试验材料
香鳞毛蕨长至幼苗期时,分别对其进行盐(200 mmol/L NaCl)、干旱(20% PEG)、高温(42 ℃)和低温(4 ℃)处理。分别在0,0.5,1,3,6,12,24,48 h取材,剪成1 cm小段,分别装袋,用液氮迅速冷冻后置-80 ℃冰箱备用。
当植株长至幼苗期时,分别对其叶片喷施100 μmol/L SA、100 μmol/L MeJA、10 μmol/L ABA和500 μmol/L Eth,喷施蒸馏水为对照。分别在0,0.5,1,3,6,12,24,48 h取材,剪成1 cm小段,分别装袋,用液氮迅速冷冻后置-80 ℃冰箱备用。
1.2 试验方法
1.2.1 RNA提取和实时荧光定量PCR分析 采用TRIzol方法提取叶片总RNA(购自全式金生物科技有限公司,北京)参照说明书进行,cDNA合成参照反转录试剂盒(购自全式金生物科技有限公司,北京)说明书进行。使用Primer Premier 5.0软件设计DfTCP的qRT-PCR特异引物,正向引物和反向引物序列分别为5′-GCTAACTACGGAGGCACAG-3′和5′-TCCCATCCACCTTCGTAT-3′。以Df18sRNA为内参基因,其扩增引物序列为5′-GCTTTCGCAGTAGTTCGTCTTTC-3′和5′-TGGTCCTATTATGTTGGTCTTCGG-3′。SYBR Premix Ex TaqTM(TaKaRa)为PCR反应试剂,实时荧光定量PCR反应系统为Mx-3000p Real-time PCR System。每个反应体系共20 μL,包含10 μL的SYBR Premix Ex TaqⅡ(10×),0.4 μL的PCR Forward Primer(10 μmol/L),0.4 μL的PCR Reverse Primer(10 μmol/L),1 μL的DNA模板和8.2 μL的灭菌水。反应程序:95 ℃预变性1 min;95 ℃变性30 s,60 ℃退火30 s,40个循环;72 ℃延伸30 s。每个样品重复3次,采取2-ΔΔCt法计算待测基因的相对表达量。3次生物学重复,数据显著性分析采用GraphPad Prism 8软件。
1.2.2 生物信息学分析 通过NCBI中的BlastP在线工具进行其他物种的同源氨基酸序列检索,使用ClustalX 1.8和DNAMAN进行氨基酸序列同源比对,上述获得物种序列经过Mega 6.0软件中的邻接法算法(Neighbor-Joining)构建系统进化树,设置参数为Bootstrap进行1 000次检验并去除支持率低于50%的节点,选取P-distance模型,Pairwise deletion处理数据缺失。TCP蛋白的理化性质由ExPASy-ProtParam tool在线软件分析(http://web.expasy.org/protparam/),利用SOPMA SECONDARY STRUCTURE PREDICTION METHOD(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsasopma.html)和SWISS-MODEL(http://swissmodel.expasy.org/)在线软件预测TCP蛋白质的二级和三级结构,蛋白质亚细胞定位预测(http://www.softberry.com/),蛋白质信号肽预测(http://www.cbs.dtu.dk/services/SignalP),蛋白质跨膜区域分析(http://www.cbs.dtu.dk/services/TMHMM/)。
2 结果与分析
2.1 DfTCP蛋白的理化性质
DfTCP基因含有一个1 431 bp开放阅读框并且编码477个氨基酸。经ExPASy-ProtParam tool在线预测分析,DfTCP蛋白的相对分子质量为51.74 ku,理论等电点(pI)为6.29,是弱酸性蛋白。DfTCP蛋白的不稳定系数(Instability index)为54.03,属于不稳定蛋白质(<40,蛋白质稳定);脂肪族系数(Aliphatic index)为64.26,总平均亲水系数(Grand average of hydropathicity)为-0.698,表明该蛋白是亲水蛋白,由20种氨基酸组成,分子式为C2246H3508N676O705S15;保守结构域预测显示,该蛋白属于TCP家族;SignalP和TMHMM Server v. 2.0表明,该蛋白无信号肽和跨膜结构域,属于非分泌蛋白;利用Softberry在线程序对DfTCP蛋白亚细胞定位预测结果显示,DfTCP定位于细胞外。
2.2 DfTCP蛋白质二级和三级结构预测
利用NPS@ server在线对TCP蛋白进行二级结构预测,结果显示,二级结构中有α-螺旋(H)69个、延伸片段(E)71个和无规则卷曲(C)337个,分别占总蛋白的14.47%,14.88%,70.65%。当H>45%、E<5%时该蛋白结构为all-alpha型;当H<5%、E>45%时为all-beta型;当H>30%、E>20%时为alpha-beta型;其他情况为mixed型。预测结果表明,TCP蛋白二级结构为mixed型。
为了进一步了解预测TCP的蛋白特性,使用同源建模在线预测SWISS-MODEL分析系统进行三维模型的构建,结果构建模板蛋白为5zkt.1.A,TCP与模板的氨基酸序列同源性为80%,GMQE (Global Model Quality Estimation)值为0.04,QSQE值为0.15。
2.3 DfTCP蛋白质多序列比对
经过DNAMAN(Version 7.0)软件进行多序列比对显示,DfTCP蛋白质与蒺藜苜蓿(Medicago truncatula)MtTCP20、克莱门柚(Citrus clementina)CcTCP20、西红柿(Solanum lycopersicum)SlTCP14和无油樟(Amborella trichopoda)AtrTCP20蛋白质相似性分别为59.48%,80.26%,54.36%,80.52%,在DfTCP蛋白质序列中79-138为典型的bHLH结构域,含有Basic、Helix 1、Loop、Helix Ⅱ和R-domain,本研究DfTCP属于Ⅱ类(以CYC和TB1为代表)(图1)。
2.4 DfTCP蛋白质系统进化树和Motif结构分析
如图2所示,利用Mega 6.0软件对DfTCP与蒺藜苜蓿(Medicago truncatula)MtTCP20、克莱门柚(Citrus clementina)CcTCP20、无油樟(Amborella trichopoda)AtrTCP20、野生油橄榄树(Olea europaea var. Sylvestris)OeTCP20、木豆(Cajanus cajan)CcaTCP20、葡萄(Vitis vinifera)VvTCP11、菠萝(Ananas comosus)AcTCP20、虎爪豆(Mucuna pruriens)MpTCP20、铁皮石斛(Dendrobium catenatum)DcTCP20、豇豆(Vigna unguiculate)VuTCP20、绿豆(Vigna radiata var. radiata)VrTCP20、蔓花生(Arachis duranensis)AdTCP20和AdTCP21、花生(Arachis hypogaea)AhTCP20、芝麻(Sesamum indicum)SiTCP7、蓖麻(Ricinus communis)RcTCP11、高粱(Sorghum bicolor)SbTCP20、谷子(Setaria italica)SitTCP20、大豆(Glycine max)GmTCP、拟南芥AtTCP4、玉米(Zea mays)ZmTCP和茶树(Camellia sinensis)CsTCP蛋白质序列进行分析,采用邻接法(Neighbor-Joining)的算法构建进化树,结果表明,DfTCP与AdTCP21、VvTCP11和RcTCP11聚到一组,而与其他植物的TCP聚类关系较远。
经在线分析软件MEME(http://meme.nbcr.net/meme/)对DfTCP蛋白质进行保守Motif预测,Motif序列如表1所示。TCP蛋白含有15个Motif,Motif的长度在10~50 aa。除大豆、茶树和拟南芥,其余植物的TCP蛋白均具有Motif1;除大豆、茶树、蔓花生AdTCP21和拟南芥,其余植物的TCP蛋白均具有Motif3。其中Motif1含有bHLH结构域。

下划线为bHLH结构域。 The underline is the bHLH domain.
图1 DfTCP蛋白质多序列比对
Fig.1 Multiple sequence alignment of DfTCP protein

图2 DfTCP蛋白质的系统发育进化树和保守Motif
Fig.2 Phylogenetic tree and conserved Motif of DfTCP protein
表1 Motif序列
Tab.1 Motif sequence

基序Motif 序列Sequence Motif1NKDRHTKVDGRGRRIRMPALCAARIFQLTRELGHKSDGETIZWLLQQAEPMotif2QMPGLELGLSQDGHIGVLNPQALSQIYMotif3SIIAATGTGTIPASALAAAGPMotif4HQHHHQQQQPPSKDDSZGSGQMotif5MGENKPSEVKDFQIVVSEKEEMotif6NATLGTESSNYLQKIGFPGFDMotif7KKQLAPKRSSMotif8NMGHMSFTSILGGMotif9SVSPQGASLSAGLHQKIDELGGSNSGSGSMotif10MDPKGSKQPPAQKQEMotif11PHVATGLWPPHVSGFGFQTSSMotif12RPHHHHPHHMWAPPAASAGFSSPAFLNSAMotif13MKFRTFEVTLLQSKRTGRTHHFPFSFLLILFSLLSLFPPHKMotif14KDGHSKVWTAKGPRDRRVRLSVHTAIQFYDLQDRLGFDRPRKAVEWLJKMotif15TTTATTTTTSTTAQQQQQLDPKDYQ
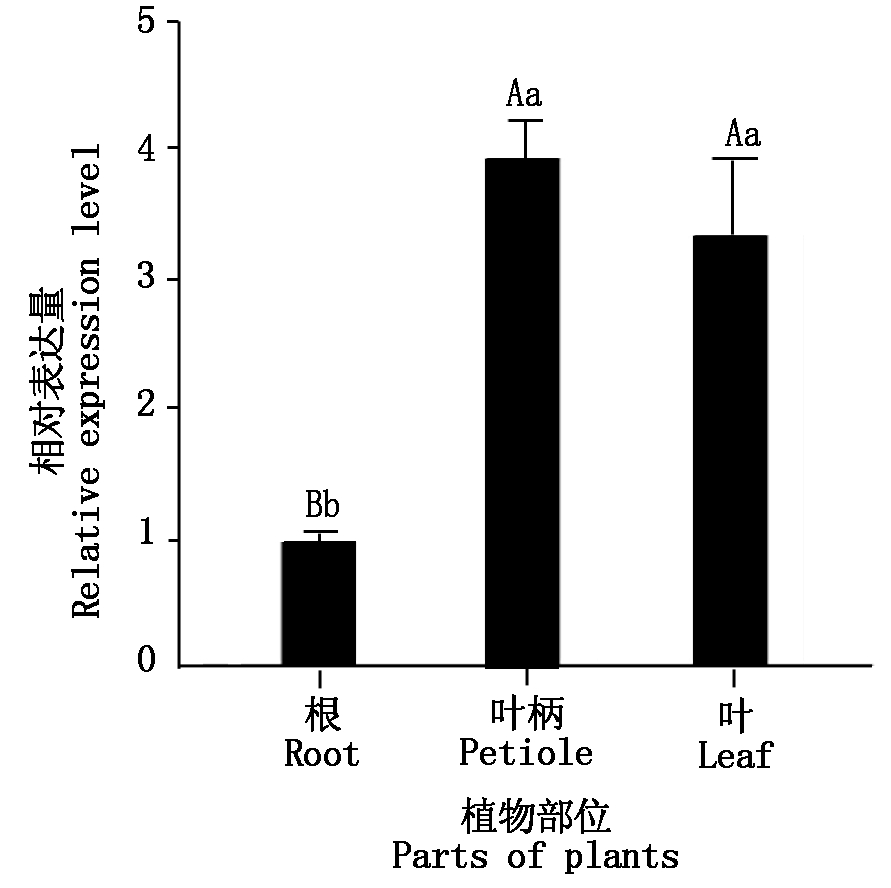
2.5 DfTCP基因在香鳞毛蕨中的组织表达特异性
如图3所示,香鳞毛蕨叶柄和叶片中DfTCP的相对表达量极显著高于根中(P<0.01),且叶柄>叶>根。
2.6 外源激素(SA、ABA、MeJA和Eth)对香鳞毛蕨叶片DfTCP基因表达模式的影响
qRT-PCR分析外源激素SA、ABA、MeJA和Eth诱导香鳞毛蕨叶片中DfTCP的表达模式,结果图4所示,在外源激素SA处理下,香鳞毛蕨叶片中DfTCP的相对表达量表现为明显的“升-降-升-降”趋势,在0.5,12 h达到峰值,并且极显著高于对照(P<0.01),但在3,24,48 h极显著低于对照(P<0.01),在1,6 h与对照组差异不显著(P>0.05);外源激素ABA处理下,DfTCP的相对表达量整体上调且呈现先升后降的趋势,与对照组相比,在1,3,6,12,24,48 h时,香鳞毛蕨叶片中DfTCP的相对表达量差异均达到极显著(P<0.01),而在0.5 h,香鳞毛蕨叶片中DfTCP的相对表达量差异不显著(P>0.05);外源激素MeJA和Eth处理下,香鳞毛蕨叶片中DfTCP的相对表达量均随处理时间的增长表现为“降-升-降”的趋势,分别在6,1 h达到峰值,除峰值极显著高于对照(P<0.01)外,MeJA处理下,0.5,1,3,12,24,48 h香鳞毛蕨叶片中DfTCP的相对表达量均极显著低于对照(P<0.01),Eth处理下,48 h香鳞毛蕨叶片中DfTCP的相对表达量显著低于对照(P<0.05),其他各时间点均极显著低于对照(P<0.05)。
不同大写字母表示差异达极显著水平(P<0.01);不同小写字母表示差异达显著水平(P<0.05)。图4-5同。
Different capital letters mean extremely significant difference at 0.01 level;Different small letters mean significant difference at 0.05 level. The same as Fig.4-5.
图3 香鳞毛蕨不同组织中DfTCP的相对表达量
Fig.3 Relative expression of DfTCP in different tissues of Dryopteris fragrans
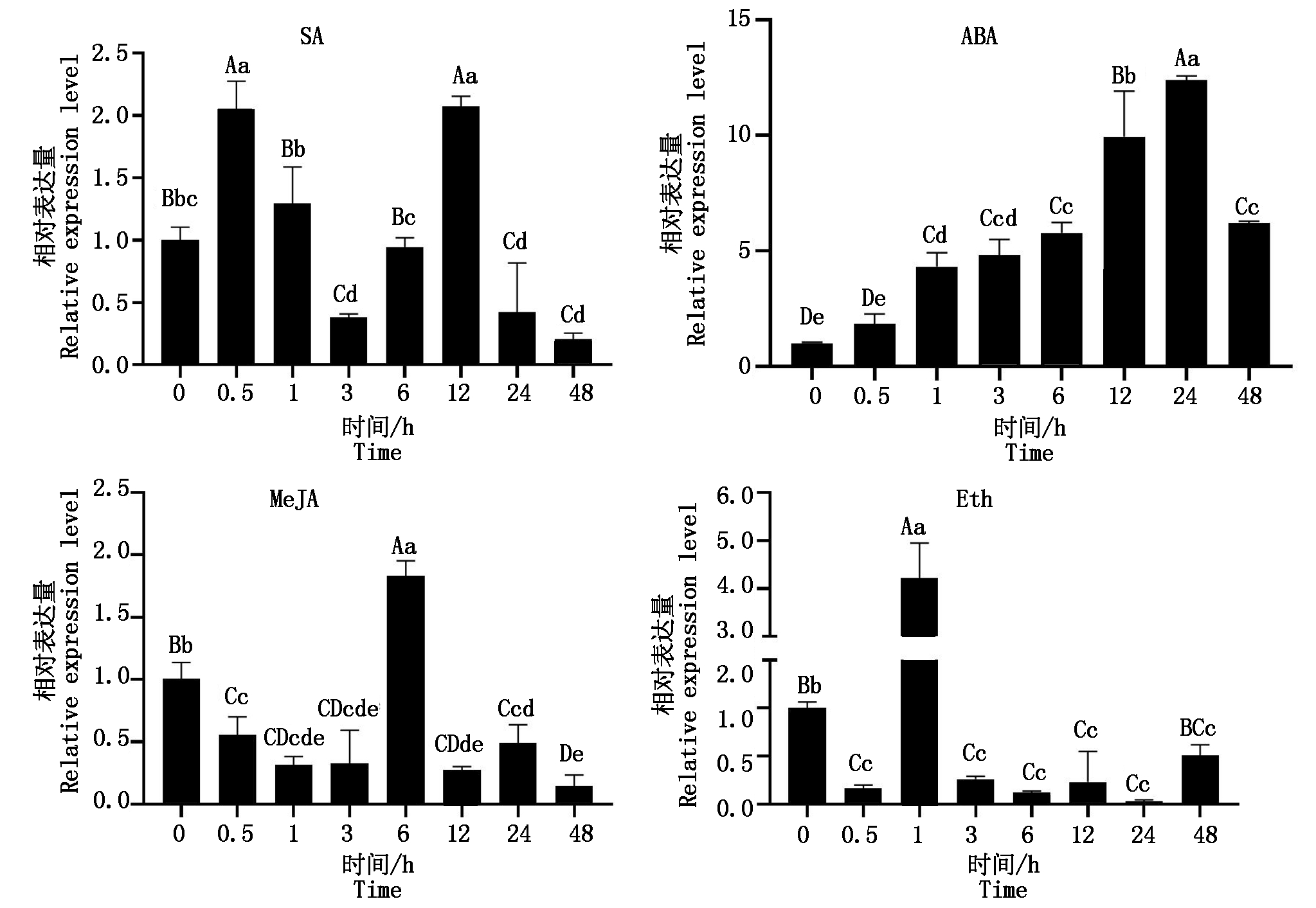
图4 不同时间下外源激素(SA、ABA、MeJA和Eth)对香鳞毛蕨叶片DfTCP相对表达量的影响
Fig.4 Effects of exogenous hormones(SA,ABA,MeJA and Eth) on the relative expression level of DfTCP in the leaves of Dryopteris fragrans under different times
2.7 非生物胁迫(干旱、盐、高温和低温)对香鳞毛蕨叶片DfTCP基因表达模式的影响
如图5所示,在PEG和NaCl处理条件下,香鳞毛蕨叶片DfTCP的相对表达量均随处理时间的延长呈现“降-升-降”的变化规律。PEG处理时,仅3,6 h DfTCP的相对表达量极显著高于对照(P<0.01),其余时间DfTCP的相对表达量与对照差异均不显著(P>0.05);NaCl处理时,在12 h DfTCP的相对表达量极显著高于对照组(P<0.01),且达到峰值,其他各时间点均与对照差异不显著(P>0.05)。
不同温度处理下,香鳞毛蕨叶片DfTCP的相对表达量均随着时间延长呈先增后降趋势。在高温42 °C处理过程中,0.5,1 h香鳞毛蕨叶片DfTCP的相对表达量极显著高于对照组(P<0.01),在0.5 h达到峰值,6,12,24,48 h香鳞毛蕨叶片DfTCP的相对表达量极显著低于对照组(P<0.01),3 h香鳞毛蕨叶片DfTCP的相对表达量与对照组相比差异不显著(P>0.05);低温4 ℃处理时,1,3 h香鳞毛蕨叶片DfTCP的相对表达量极显著高于对照(P<0.01),且3 h达到峰值,0.5 h时显著高于对照(P<0.05),6,12,24,48 h香鳞毛蕨叶片DfTCP的相对表达量与对照差异均不显著(P>0.05)。
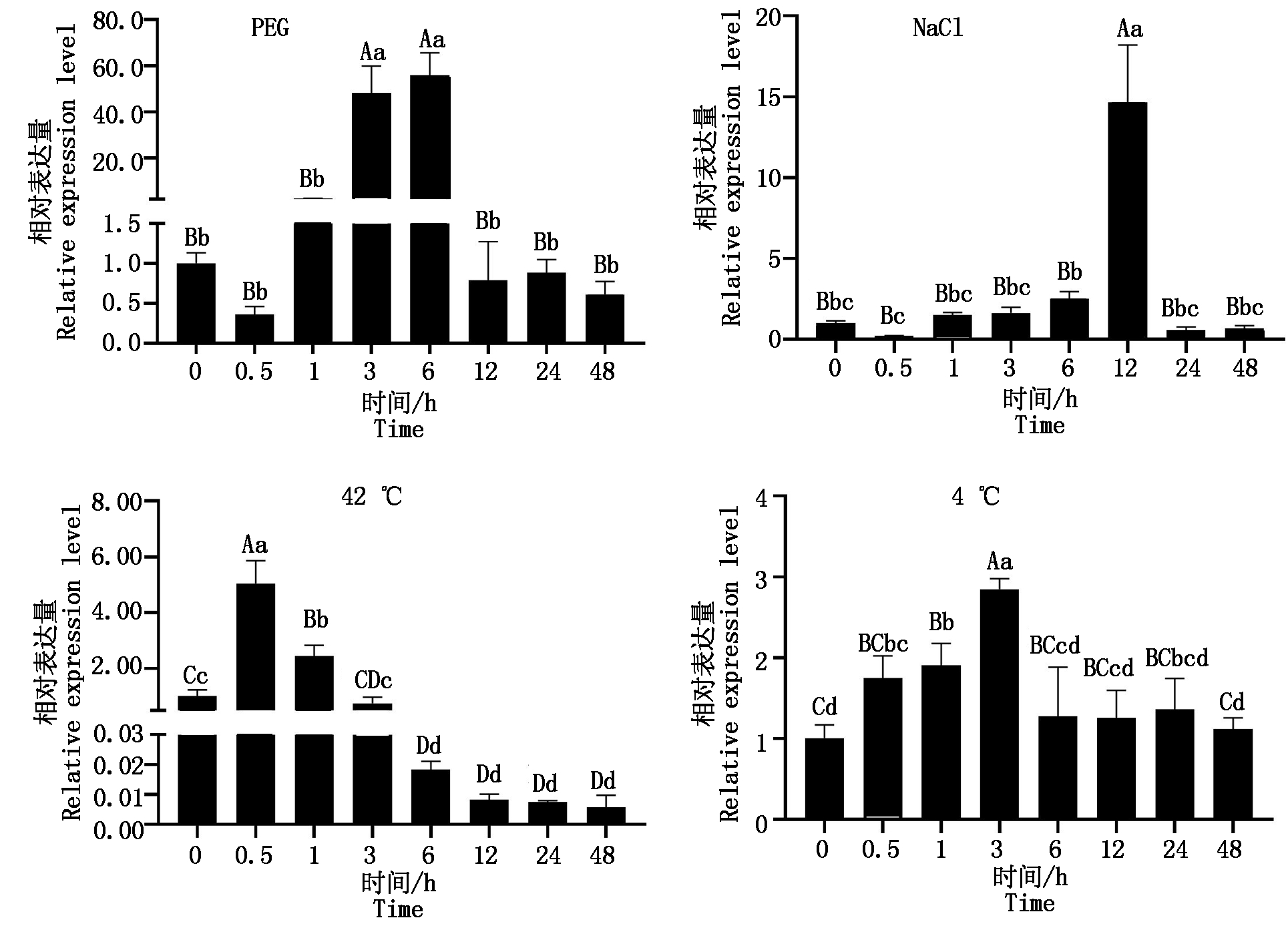
图5 不同时间下非生物胁迫(PEG、NaCl、高温和低温)对香鳞毛蕨叶片DfTCP相对表达量的影响
Fig.5 Effects of abiotic stress (PEG,NaCl,high temperature and low temperature) on the relative expression level of DfTCP in the leaves of Dryopteris fragrans under different times
3 结论与讨论
由多基因编码的植物特异性TCP转录因子已在茶树、大豆等植物中得到了全面鉴定[7,23-24]。然而,TCP基因在香鳞毛蕨中的生物学作用尚不清楚。TCP转录因子是一个具有保守的TCP结构域的植物特异性蛋白质家族。本研究发现DfTCP N端含有一个59个碱基螺旋环(bHLH)基序,是一个典型的TCP结构域,该结构域在DNA结合和蛋白质相互作用中起着重要的作用,而C端序列具有高度的变异性。TCP转录因子在不同组织中的表达模式在拟南芥[4]、玉米[25]、茶树[26]和白菜(Brassica pekinensis)[27]等植物中已有报道,但其在香鳞毛蕨中的组织表达特性研究较少。本研究通过对DfTCP基因的表达模式分析,结果表明,DfTCP基因的表达具有组织特异性,在香鳞毛蕨根中表达量较低,而在叶柄和叶片组织部位的相对表达量较高,这与茶树TCP组织表达特异性一致[26]。
作为植物特有的一类转录因子,TCP广泛参与植物生长发育进程,并在多种信号转导途径中发挥重要作用,例如乙烯、JA、SA和ABA等植物激素的合成和信号转导[28-30]。本研究结果表明,通过4种不同激素处理,发现DfTCP能够响应ABA信号,随着时间的延长,DfTCP的相对表达量逐渐升高,仅48 h的表达量有所下降,总体呈现上调表达。表明DfTCP转录因子在香鳞毛蕨生长发育及激素信号转导过程中发挥作用,推测其可能通过激素信号转导途径参与调节植物生长。在水稻和茶树中,TCP也参与影响植株对ABA信号的响应[26,31] 。研究报道TCP转录因子对JA、SA和其他脂肪酸的生物合成具有重要意义,在脂肪酸合成基因的启动子区域大量存在TCP结合位点[32]。TCP转录因子还可以调节SA的合成,SA是一种在调节免疫防御中的拮抗激素[33]。本试验表明,外源激素MeJA处理下,在6 h DfTCP的相对表达量上调,其余时间均下调表达;SA和Eth处理时,DfTCP的相对表达量均呈现不同的趋势,说明DfTCP可能参与调控香鳞毛蕨SA和Eth的信号转导途径。在茶树中也发现了类似情况[34]。
越来越多的研究表明,非生物胁迫(盐、干旱、高温和低温)阻碍了植物的最佳生理生化机制[35]。在动态生长条件下,植物抗逆性的一个关键因素是它们对生物和非生物环境信号的概念化、整合和调节能力,从而可能调节分子和生理代谢以维持其生存。这种非生物胁迫还激活TCP,并触发一个信号转导网络,以增强植物的胁迫耐受性[31]。研究表明,TCP家族在许多植物生长发育过程中都起着关键作用,例如水稻的发育和对非生物胁迫的表达模式[36]。本试验研究表明,盐、干旱、高温和低温处理后,香鳞毛蕨叶片中DfTCP基因表达普遍上调,表明DfTCP转录因子作为抗逆相关蛋白,在逆境胁迫下促进其表达。研究表明,水稻OsTCP19参与调节ROS机制,有助于产生应激反应,包括增强抗氧化酶(如SOD、POD、CAT和APX)的活性;也可以通过提高酶促或非酶促抗氧化剂的水平来保护其免受氧化损伤[36-37]。香鳞毛蕨TCP也可能参与调节ROS机制。
综上所述,TCP转录因子在香鳞毛蕨抗逆性的机制以及植物激素信号转导途径的响应这个庞大复杂的调控网络中扮演着至关重要的角色。但TCP转录因子在香鳞毛蕨生长发育及多种信号通路中发挥的具体作用机制,还需进一步深入研究。
[1] 陈忠. 温度和pH等对香鳞毛蕨孢子萌发及配子体发育过程的影响[D]. 北京:中国农业科学院,2014.
Chen Z. Temperature and pH Dryopteris fragrans spore germination and affect gametophyte development process[D]. Beijing:Chinese Academy of Agricultural Sciences,2014.
[2] Leng X P,Wei H R,Xu X Z,Ghuge S A,Jia D J,Liu G S,Wang Y Z,Yuan Y B. Genome-wide identification and transcript analysis of TCP transcription factors in grapevine[J]. BMC Genomics,2019,20(1):786. doi:10.1186/s12864-019-6159-2.
[3] Cubas P,Lauter N,Doebley J,Coen E. The TCP domain:a motif found in proteins regulating plant growth and development[J]. The Plant Journal, 1999,18(2):215-222. doi:10.1046/j.1365-313x.1999.00444.x.
[4] Martín-Trillo M,Cubas P. TCP genes:a family snapshot ten years later[J]. Trends Plant Sci,2010,15(1):31-39. doi:10.1016/j.tplants.2009.11.003.
[5] Lopez J A, Sun Y L, Blair P B, Mukhtar M S. TCP three-way handshake:Linking developmental processes with plant immunity[J]. Trends in Plant Science,2015,20(4):238-245. doi:10.1016/j.tplants.2015.01.005.
[6] Danisman S, van Dijk A D J, Bimbo A, van der Wal F, Hennig L, de Folter S, Angenent G C, Immink R G H. Analysis of functional redundancies within the Arabidopsis TCP transcription factor family[J]. Journal of Experimental Botany,2013,64(18):5673-5685. doi:10.1093/jxb/ert337.
[7] Navaud O, Dabos P, Carnus E, Tremousaygue D, Hervé C. TCP transcription factors predate the emergence of land plants[J]. Journal of Molecular Evolution,2007,65(1):23-33. doi:10.1007/s00239-006-0174-z.
[8] Guo Z X, Fujioka S, Blancaflor E B, Miao S, Gou X P, Li J. TCP1 modulates brassinosteroid biosynthesis by regulating the expression of the key biosynthetic gene DWARF4 in Arabidopsis thaliana[J]. The Plant Cell,2010,22(4):1161-1173. doi:10.1105/tpc.109.069203
[9] Li S T,Zachgo S. TCP3 interacts with R2R3-MYB proteins,promotes flavonoid biosynthesis and negatively regulates the auxin response in Arabidopsis thaliana[J]. The Plant Journal,2013,76(6):901-913. doi:10.1111/tpj.12348.
[10] Davière J M, Wild M, Regnault T, Baumberger N, Eisler H, Genschik P, Achard P.Class I TCP-DELLA interactions in inflorescence shoot apex determine plant height[J]. Current Biology,2014,24(16):1923-1928. doi:10.1016/j.cub.2014.07.012.
[11] Zhou M, Li D Y, Li Z G, Hu Q, Yang C H, Zhu L H, Luo H. Constitutive expression of a miR319 gene alters plant development and enhances salt and drought tolerance in transgenic creeping bentgrass[J]. Plant Physiol,2013,161(3):1375-1391. doi:10.1104/pp.112.208702.
[12] Lucero L E, Uberti-Manassero N G, Arce A L, Colombatti F, Alemano S G, Gonzalez D H. TCP15 modulates cytokinin and auxin responses during gynoecium development in Arabidopsis[J]. The Plant Journal,2015,84(2):267-282. doi:10.1111/tpj.12992.
[13] Feng Z J, Xu S C, Liu N, Zhang G W, Hu Q Z, Gong Y M. Soybean TCP transcription factors:evolution,classification,protein interaction and stress and hormone responsiveness[J]. Plant Physiology and Biochemistry,2018,127:129-142. doi:10.1016/j.plaphy.2018.03.020.
[14] Mukhopadhyay P,Tyagi A K. OsTCP19 influences developmental and abiotic stress signaling by modulating ABI4-mediated pathways[J]. Sci Rep,2015,5:9998-10008. doi:10.1038/srep09998.
[15] Wang S T, Sun X L, Hoshino Y, Yu Y, Jia B, Sun Z W, Sun M Z, Duan X B, Zhu Y M. MicroRNA319 positively regulates cold tolerance by targeting OsPCF6 and OsTCP21 in rice (Oryza sativa L.)[J]. PLoS One,2014,9(3):e91357. doi:10.1371/journal.pone.0091357.
[16] Tatematsu K, Nakabayashi K, Kamiya Y, Nambara E. Transcription factor AtTCP14 regulates embryonic growth potential during seed germination in Arabidopsis thaliana[J]. The Plant Journal,2008,53(1):42-52. doi:10.1111/j.1365-313X.2007.03308.x.
[17] Rueda-Romero P, Barrero-Sicilia C, Gómez-Cadenas A, Carbonero P, O ate-Sánchez L. Arabidopsis thaliana DOF6 negatively affects germination in non-after-ripened seeds and interacts with TCP14[J]. Journal of Experimental Botany,2012,63(5):1937-1949. doi:10.1093/jxb/err388.
ate-Sánchez L. Arabidopsis thaliana DOF6 negatively affects germination in non-after-ripened seeds and interacts with TCP14[J]. Journal of Experimental Botany,2012,63(5):1937-1949. doi:10.1093/jxb/err388.
[18] Riechmann J L, Heard J, Martin G, Reuber L, Jiang C Z, Keddie J, Adam L, Pineda O, Ratcliffe O J, Samaha R R, Creelman R, Pilgrim M, Broun P, Zhang J Z, Ghandehari D, Sherman B K, Yu G L. Arabidopsis transcription factors:Genome-wide comparative analysis among eukaryotes[J]. Science,2000,290(5499):2105-2110. doi:10.1126/science.290.5499.2105.
[19] Parapunova V, Busscher M, Busscher-Lange J, Lammers M, Karlova R, Bovy A G, Angenent G C, de Maagd R A. Identification,cloning and characterization of the tomato TCP transcription factor family[J]. BMC Plant Biology,2014,14(1):157. doi:10.1186/1471-2229-14-157.
[20] Xu R R, Sun P, Jia F J, Lu L T, Li Y Y, Zhang S Z, Huang J G. Genomewide analysis of TCP transcription factor gene family in Malus domestica[J]. Journal of Genetics,2014,93(3):733-746. doi:10.1007/s12041-014-0446-0.
[21] Wei W, Hu Y, Cui M Y, Han Y T, Gao K, Feng J Y. Identification and transcript analysis of the TCP transcription factors in the diploid woodland strawberry Fragaria vesca[J]. Front Plant Sci,2016,7:1937. doi:10.3389/fpls.2016.01937.
[22] Liu H L, Wu M, Li F, Gao Y M, Chen F, Xiang Y. TCP transcription factors in Moso bamboo (Phyllostachys edulis):Genome-wide identification and expression analysis[J]. Front Plant Sci,2018,9:1263. doi:10.3389/fpls.2018.01263.
[23] Mondragón-Palomino M, Trontin C. High time for a roll call:gene duplication and phylogenetic relationships of TCP-like genes in monocots[J]. Annals of Botany,2011,107(9):1533-1544. doi:10.1093/aob/mcr059.
[24] Citerne H L, Le Guilloux M, Sannier J, Nadot S, Damerval C. Combining phylogenetic and syntenic analyses for understanding the evolution of TCP ECE genes in eudicots[J]. PLoS One,2013,8(9):e74803. doi:10.1371/journal.pone.0074803.
[25] Chai W B, Jiang P F, Huang G Y, Jiang H Y, Li X Y. Identification and expression profiling analysis of TCP family genes involved in growth and development in maize[J]. Physiology and Molecular Biology of Plants,2017,23(4):779-791. doi:10.1007/s12298-017-0476-1.
[26] 温贝贝,罗勇,刘冬敏,张向娜,李娟,王英姿,王坤波,黄建安.茶树TCP转录因子的鉴定与表达分析[J]. 园艺学报,2019,7:1-14. doi:10.16420/j.issn.0513-353x.2019-0320.
Wen B B,Luo Y,Liu D M,Zhang X N,Li J,Wang Y Z,Wang K B,Huang J A. Identification and expression profiling analysis of TCP family genes involved in growth and development in Camellia sinensis[J]. Acta Horticulturae Sinica,2019,7:1-14.
[27] Liu Y, Guan X Y, Liu S N, Yang M, Ren J H, Guo M, Huang Z H, Zhang Y W. Genome-wide identification and analysis of TCP transcription factors involved in the formation of leafy head in Chinese cabbage[J]. International Journal of Molecular Sciences,2018,19(3):847-848. doi:10.3390/ijms19030847.
[28] Resentini F, Felipo-Benavent A, Colombo L, Blázquez M A, Alabadí D, Masiero S. TCP14 and TCP15 mediate the promotion of seed germination by gibberellins in Arabidopsis thaliana[J]. Molecular Plant,2014,8(3):482-485. doi:10.1016/j.molp.2014.11.018.
[29] Lucero L E, Manavella P A, Gras D E, Ariel F D, Gonzalez D H.Class Ⅰ and Class Ⅱ TCP transcription factors modulate SOC1-dependent flowering at multiple levels[J]. Molecular Plant,2017,10(12):1571-1574. doi:10.1016/j.molp.2017.09.001.
[30] Guo Z H,Shu W S,Cheng H Y,Wang G M,Qi K J,Zhang S L,Gu C. Expression analysis of TCP genes in peach reveals an involvement of PpTCP.A2 in ethylene biosynthesis during fruit ripening[J]. Plant Molecular Biology Reporter,2018,36(4):588-595. doi:10.1007/s11105-018-1105-z.
[31] 雷豆,吴雨,苏周,何卓远,韦小英,邹建,杨军. TCP转录因子与激素信号相互作用研究进展[J].分子植物育种,2019,17(9):2868-2875. doi:10.13271/j.mpb.017.002868.
Lei D,Wu Y,Su Z,He Z Y,Wei X Y,Zou J,Yang J. Research advances in the interaction between TCP transcription factors and hormone signals[J]. Molecular Plant Breeding,2019,17(9):2868-2875.
[32] Schommer C, Palatnik J F, Aggarwal P, Chételat A, Cubas P, Farmer E E, Nath U, Weigel D. Control of jasmonate biosynthesis and senescence by mir319 targets[J]. PLoS Biology,2008,6(9):e230. doi:10.1371/journal.pbio.0060230.
[33] Pieterse C M J, Van der Does D, Zamioudis C, Leon-Reyes A, Van Wees S C. Hormonal modulation of plant immunity[J]. Annu Rev Cell Dev Biol,2012,28(1):489-521. doi:10.1146/annurev-cellbio-092910-154055.
[34] Wu Z J,Wang W L,Zhuang J. TCP family genes control leaf development and its responses to hormonal stimuli in tea plant (Camellia sinensis (L.) O. Kuntze)[J]. Plant Growth Regulation,2017,83(1):43-53. doi:10.1007/s10725-017-0282-3.
[35] Joshi R, Wani S H, Singh B, Bohra A, Dar Z A, Lone A A, Pareek A, Singla-Pareek S L.Transcription factors and plants response to drought stress:Current understanding and future directions[J]. Frontiers in Plant Science,2016,7:1029. doi:10.3389/fpls.2016.01029.
[36] Mukhopadhyay P,Tyagi A K. OsTCP19 influences developmental and abiotic stress signaling by modulating ABI4-mediated pathways[J]. Sci Rep,2015,5:9998. doi:10.1038/srep09998.
[37] Slesak I, Libik M, Karpinska B, Karpinski S, Miszalski Z. The role of hydrogen peroxide in regulation of plant metabolism and cellular signalling in response to environmental stresses[J]. Acta Biochimica Polonica,2007,54(1):39-50. doi:10.18388/abp.2007_3267.
