动物体内的脂肪组织分为白色脂肪组织和棕色脂肪组织2种类型,白色的脂肪组织将多余的能量以甘油三酯的形式贮存在体内。棕色脂肪组织是一个产热的器官,其主要通过在低温寒冷时非颤抖产热和消化吸收食物过程中消耗能量产热2种方式调节能量代谢。脂肪细胞分化是一个复杂的过程,大量证据表明CCAAT/增强子结合蛋白(C/EBPs)和过氧化物酶体增殖物激活受体(PPARs)2个转录因子家族是脂肪细胞基因表达和分化的重要调节因子[1]。CCAAT/增强子结合蛋白(C/EBP)属于碱性亮氨酸拉链类转录因子,家族成员C末端都有一个碱性亮氨酸拉链结构域[2],能够作为二聚体与特定DNA序列结合,从而调节下游的靶基因表达[3]。截至目前,已发现C/EBP家族的6个成员,即C/EBPα、C/EBPβ、C/EBPγ、C/EBPδ、C/EBPε和C/EBPζ[4]。C/EBP家族成员在细胞的增殖分化、能量代谢和信号转导中发挥着重要作用,它们的C末端是亮氨酸拉链、中间DNA结合域、N末端为转录激活域[5]。其中C/EBPα、C/EBPβ、C/EBPδ在小鼠的脂肪组织中均有表达,预示这3个基因参与脂肪的生成[6]。
C/EBPα是C/EBPs家族中最早从大鼠肝脏克隆出的家族成员,位于人的19号染色体上[7],在包括前脂肪细胞、髓细胞、肝细胞、角质形成细胞和肺细胞等多细胞类型的有丝分裂和分化的调控中起着关键作用,并且在肝脏和脂肪中表达水平最高。通过选择性识别并结合增强子核心序列,从而诱导细胞周期并影响参与细胞分化调控的转录因子。在3T3-L1前体脂肪细胞中过表达C/EBPα后将会使细胞周期滞留在G0/G1期[8],另外C/EBPα过表达会导致3T3细胞转化为巨噬细胞[9]。有研究结果显示,过表达C/EBPα后B淋巴细胞会转化为巨噬细胞,从而拥有吞噬功能[10-11]。转录因子C/EBPβ最初由Akira等[12]发现并命名,在多种细胞的增殖分化过程中发挥着重要的作用。He等[13]指出,在3T3-L1前体脂肪细胞向成熟细胞分化过程中C/EBPβ通过调节PPARγ和C/EBPα的启动子上的核心序列,从而激活PPARγ和C/EBPα的转录,促进脂肪细胞分化。C/EBPδ可以调节几种重要的脂肪形成基因,如脂联素[14]、KLF15[15]以及C/EBPα[16]。在肝脏中过表达C/EBPδ后可以促进脂肪生成,并通过激活PPARG2的转录从而参与脂肪细胞的分化调控。
上述研究可以确定C/EBPα、C/EBPβ、C/EBPδ参与动物脂肪细胞分化,但在山羊中尚未见报道。因此,本研究利用RT-PCR技术克隆山羊C/EBPα、C/EBPβ和C/EBPδ基因序列,并利用qPCR技术构建其组织和细胞时序表达谱,阐明3个基因在山羊组织和肌内前体脂肪细胞中的表达特征,并利用一系列生物信息学软件分析其基因及蛋白序列,旨在为后续试验揭示3个基因在山羊脂肪分化过程中发挥的作用机制提供参考,为培育优良的肉用山羊新品种开辟新思路。
1 材料和方法
1.1 试验材料
试验材料采集 采集6只一周岁的简州大耳羊公羊的心、肝、脾、肺、肾、大肠、瘤胃、背最长肌和皮下脂肪等组织,于液氮中速冻带回实验室保存。
1.2 试验方法
1.2.1 总RNA的提取及cDNA合成 参照TRIzol的说明书提取各组织的总RNA通过NanoDrop 2000测定RNA的纯度和浓度,参考Thermo反转录试剂盒合成cDNA置于-20 ℃储存备用。
1.2.2 克隆引物设计 根据GenBank中登录的牛C/EBPα(NM-176784)、C/EBPβ(NM-176788)和C/EBPδ(NM-174267)基因预测序列,利用Primer Premier 5.0软件设计PCR扩增引物(表1),送公司合成。
1.2.3 山羊C/EBPα、C/EBPβ和C/EBPδ基因的PCR扩增 以简州大耳羊皮下脂肪组织cDNA为模板,进行PCR扩增,10 μL反应体系:模板1.0 μL, Master Mix 8 μL,上、下游引物各0.5 μL。反应条件:预变性94 ℃ 3 min;变性94 ℃ 20 s,Tm 退火温度见表1,60 s,延伸 72 ℃ 90 s,扩增35个循环;延伸72 ℃ 7 min PCR扩增产物通过天根DNA纯化回收试剂盒回收后克隆至pMD-19T载体,送公司测序。
表1 PCR引物序列
Tab.1 Primers for PCR

目的基因Target gene引物序列(5′-3′)Primer sequence退火温度/℃Tm产物长度/bpProduct lengthC/EBPαS: ATGGAGTCGGCCGACTTCTACG601 062A: TCACGCGCAGTTGCCCATGGCCC/EBPβS: ATGCAACGCCTGGTGGCCTGGG641 056A: CTAGCAGTGGCCGGAGGAGGCGC/EBPδS: ATGAGCGCTGCGCTCTTCAG60873A: TTAACTTAGGGTCCACGCGGCC/EBPαF: CCGTGGACAAGAACAGCAAC58142R: AGGCGGTCATTGTCACTGGTC/EBPβF: CAAGAAGACGGTGGACAAGC66204R: AACAAGTTCCGCAGGGTGC/EBPδF: GGAACCCGCTGCCTTCTAC60174R: AGGTCGGCGAAGAGCTCGTBPF:AACAGCCTCCCACCTTATGC60155R:TGCTGCTCCTCCAAAATAGACUXTF:GCAAGTGGATTTGGGCTGTAAC60180R:ATGGAGTCCTTGGTGAGGTTGTPPIBF:ACACCAACGGCTCCCAGT60143R:AGGCTTGTCCCGACCATC
注:S.正义链引物;A.反义链引物。
Note:S. Sense primer; A.Antisense primer.
1.2.4 序列分析 测序结果通过NCBI的Blast在线进行同源性比对;利用ProtParam分析推导蛋白质的理化性质;用MEGA 5.0软件构建系统进化树;通过TMHMM 2.0预测跨膜结构域;利用SignalP 4.1预测信号肽序列;采用Hopfield预测蛋白二级结构;通过SMART在线预测结构域;采用STRING交互式数据库搜索可能相互作用蛋白。
1.2.5 山羊C/EBPα、C/EBPβ和C/EBPδ基因的组织表达分析 以前期西南民族大学现代生物技术国家民委重点实验室筛选出的磷酸三丁酯基因(TBP)作为内参基因,根据克隆获得山羊C/EBPα、C/EBPβ和C/EBPδ基因CDS区序列设计定量引物(表 1)。利用实时荧光定量PCR(qPCR)技术检测3个目的基因在山羊组织中的表达模式,构建组织表达谱。20 μL qPCR反应体系:SYBR® Premix Ex Taq TM (2×) PCR 10 μL,正反引物各1 μL,cDNA模板 1 μL,ddH2O 7 μL。qPCR反应条件为95 ℃预变性15 s;95 ℃ 10 s,Tm 10 s,72 ℃ 15 s,38个循环。
1.2.6 山羊C/EBPα、C/EBPβ和C/EBPδ基因在肌内前体脂肪细胞中的时序表达分析 将本实验室前期试验收集诱导分化的0,1,2,3,4,5,6,7 d的山羊肌内前体脂肪细胞按照1.2.1方法提取RNA并进行反转录。选用泛素表达转录因子基因(UXT)和肽酰脯氨基顺反异构酶B基因(PPIB)作为内参基因[17],用qPCR技术检测3个基因在山羊肌内前体脂肪细胞中的表达水平,qPCR反应条件同1.2.5。
2 结果与分析
2.1 山羊C/EBPα、C/EBPβ和C/EBPδ基因克隆
克隆获得山羊C/EBPα、C/EBPβ和C/EBPδ基因序列信息及获得GenBank登录号见表2。
表2 克隆获得山羊C/EBPs序列信息
Tab.2 Sequence information of goat C/EBPs

基因Gene长度/bpLengthCDS区/bpCDS编码氨基酸数Number of amino acidsGenBank登录号Accession No.C/EBPα1 0621 062353MH593899C/EBPβ1 0561 056351MH780163C/EBPδ873771256MH780164
2.2 山羊C/EBPα、C/EBPβ和C/EBPδ基因序列分析
2.2.1 蛋白质基本理化性质预测 山羊C/EBPα蛋白化学式为C1639H2558N484O489S9,等电点7.25。带负电荷的氨基酸残基和带正电荷的氨基酸残基各有36个,蛋白质整体不带电。不稳定指数为64.18,平均亲水系数为-0.627,属于不稳定亲水碱性蛋白。
C/EBPβ蛋白化学式为C1626H2531N457O487S11,等电点8.56。带负电荷的氨基酸残基和带正电荷的氨基酸残基分别为35,39个,蛋白质整体带正电荷。不稳定指数为64.81,平均亲水系数为-0.525,属于不稳定亲水碱性蛋白。
C/EBPδ蛋白化学式为C1187H1884N362O358S6,等电点为9.14。含有带负电荷的氨基酸残基和带正电荷的氨基酸残基分别有31,35个,C/EBPδ蛋白整体带正电荷。不稳定指数为66.49,平均亲水系数为-0.647,属于不稳定亲水碱性蛋白。
2.2.2 蛋白质结构预测 C/EBPα蛋白二级结构预测显示,有63.17%的氨基酸形成无规则卷曲,29.75%的氨基酸形成α-螺旋,剩下7.08%的氨基酸形成延伸链(图1-A)。该蛋白无信号肽和跨膜结构域。STRING交互式数据库搜索结果显示该蛋白可能和C/EBPβ、C/EBPδ、RB1、MYC、JUN、EP300、FOS、PPARG、CDK2和RUNX1发生相互作用(图2-A)。
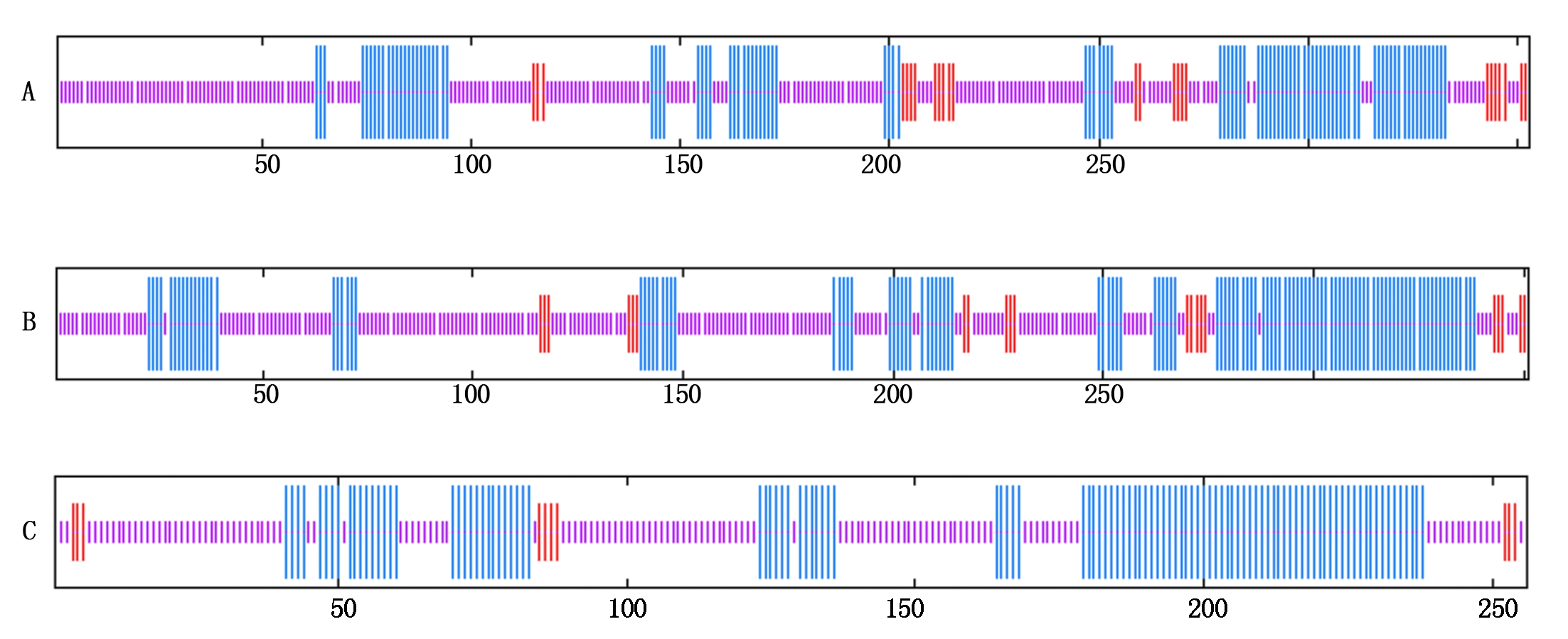
蓝色竖线.α螺旋;红色竖线.β折叠;紫色竖线.无规则卷曲。 α-helix, β-fold, random coil, are indicated, respectively, with the blue, the red, the purple.
图1 山羊C/EBPα (A)、C/EBPβ (B)和C/EBPδ (C)蛋白二级结构
Fig.1 Predicted secondary structure of the goat C/EBPα (A), C/EBPβ (B) and C/EBPδ (C) protein
C/EBPβ蛋白二级结构预测结果显示,有58.97%的氨基酸残基形成无规则卷曲,35.04%的氨基酸残基形成α-螺旋,剩下5.98%的氨基酸残基形成延伸链(图1-B)。C/EBPβ蛋白无跨膜结构域,无信号肽结构。蛋白相互作用预测结果显示,C/EBPβ蛋白可能和C/EBPα、C/EBPδ、KLF5、EP300和MYB等蛋白发生相互作用(图2-B)。
C/EBPδ蛋白二级结构预测显示,有53.52%的氨基酸形成无规则卷曲,42.58%的氨基酸形成α-螺旋,剩余3.91%的氨基酸可能形成延伸链(图1-C)。该蛋白无信号肽结构,无跨膜结构域。该蛋白可能和C/EBPα、C/EBPβ、PPARG、SP1和MYC等蛋白存在相互作用(图2-C)。

图2 山羊C/EBPα (A)、C/EBPβ (B)和C/EBPδ (C)蛋白相互作用
Fig.2 Prediction of proteins interacting with goat C/EBPα (A), C/EBPβ (B) and C/EBPδ (C) protein
2.2.3 氨基酸序列的同源性比对及构建进化树 利用NCBI中的Blast在线比对分析显示,山羊C/EBPα氨基酸序列与绵羊、牛和人的C/EBPα同源性分别为98%,100%,93%;山羊C/EBPβ氨基酸序列与绵羊、牛和人的氨基酸序列同源性分别为99%,96%和97%;山羊C/EBPδ氨基酸序列与绵羊、牛和人的同源性分别为100%,99%和88%。采用MEGA 5.0分别构建山羊C/EBPα、C/EBPβ和C/EBPδ氨基酸序列系统进化树,结果如图3所示,山羊C/EBPα与牛、白尾鹿和绵羊的亲缘关系较近(图3-A);山羊C/EBPβ与羊驼、绵羊、人和牛的亲缘关系较近(图3-B);山羊C/EBPδ与牛和猪具有较近的亲缘关系(图3-C),3种氨基酸序列均与原鸡的亲缘关系较远。
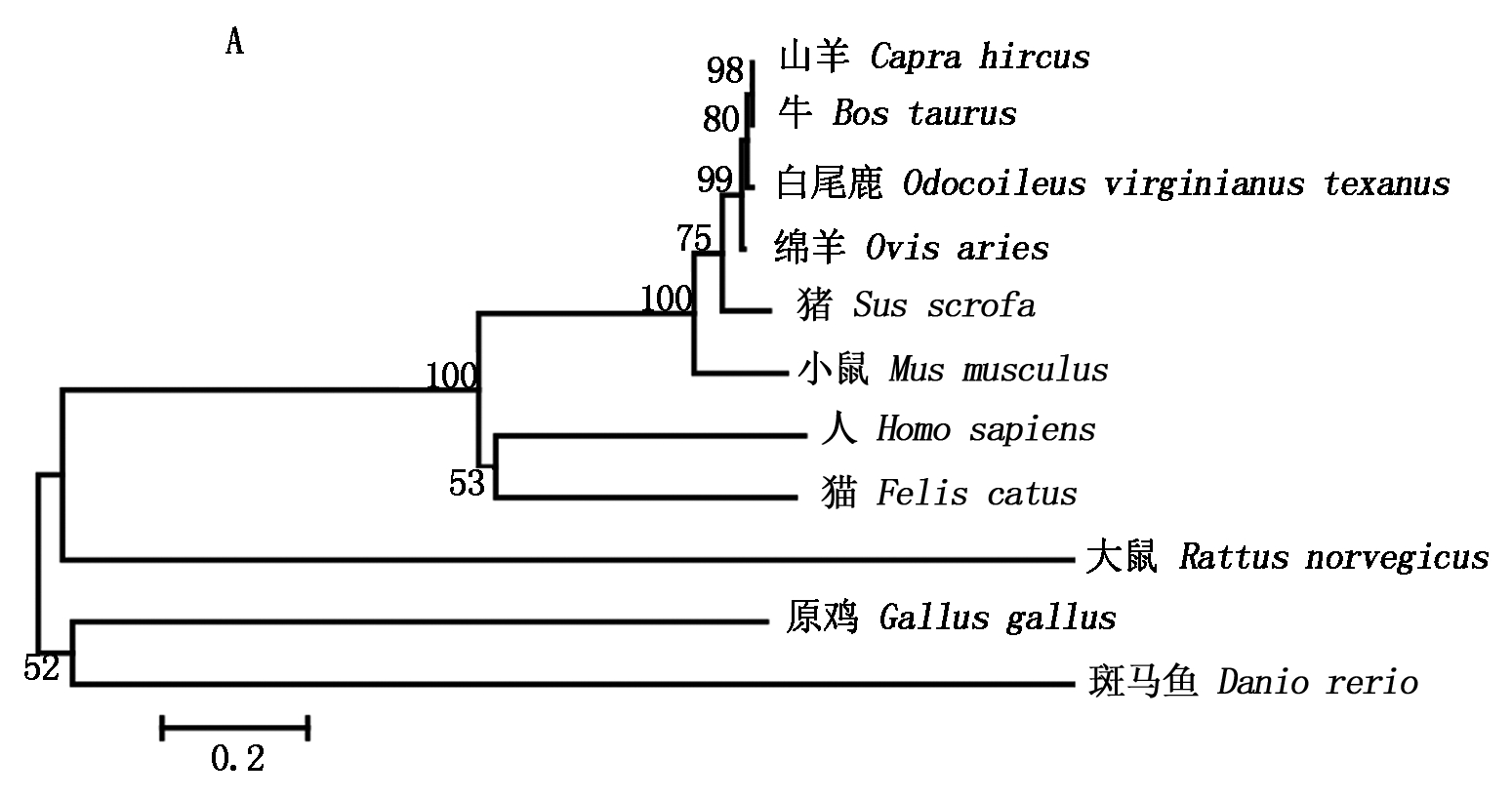
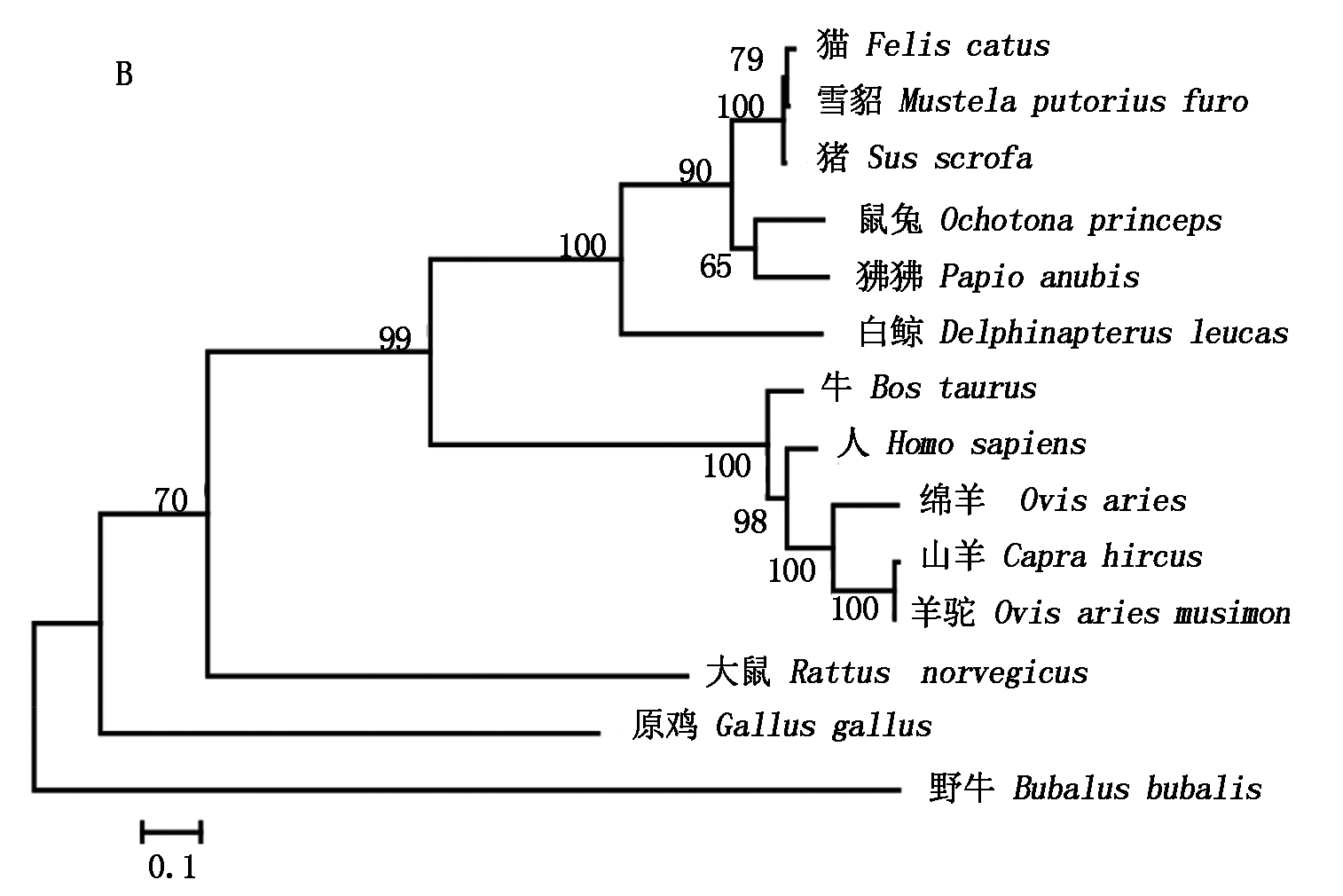
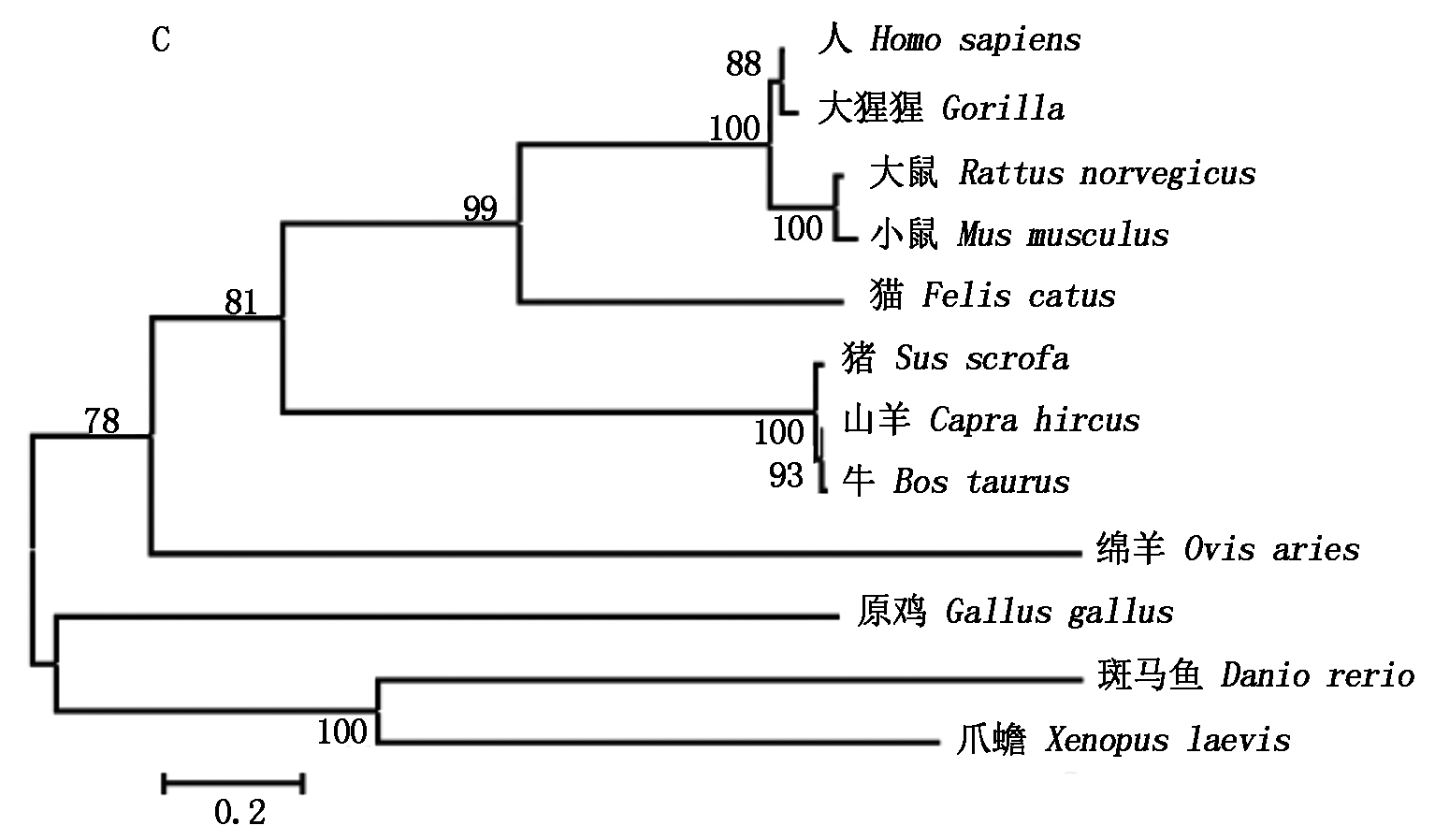
图3 采用MEGA 5.0法构建山羊C/EBPα(A)、C/EBPβ(B)和C/EBPδ(C)氨基酸序列系统进化树
Fig.3 Phylogenetic tree was constructed based on C/EBPα (A)、C/EBPβ (B)和 C/EBPδ (C) amino acid sequence using MEGA 5.0
2.3 C/EBPα、C/EBPβ和C/EBPδ基因在山羊肌内前体脂肪细胞分化过程中的表达模式
qPCR结果显示在山羊肌内前体脂肪细胞分化过程中C/EBPα和C/EBPδ表达模式相似,均在分化前表达水平最高,随着分化时间的增加表达水平呈现下降趋势;C/EBPβ在山羊肌内脂肪细胞中的表达随着诱导分化天数的增加而呈上升趋势(图4)。
2.4 山羊C/EBPα、C/EBPβ和C/EBPδ基因组织表达分析
以皮下脂肪组织作为对照,分别对C/EBPα、C/EBPβ和C/EBPδ 3个基因的定量数据进行分析并绘制组织表达谱(图5)。qPCR结果显示3个基因的mRNA组织表达较为广泛,其中C/EBPα基因在皮下脂肪中表达水平最高,其次在肝中也有较高水平的表达;C/EBPβ和C/EBPδ在山羊组织的表达模式相似,均在肺中表达水平最高。
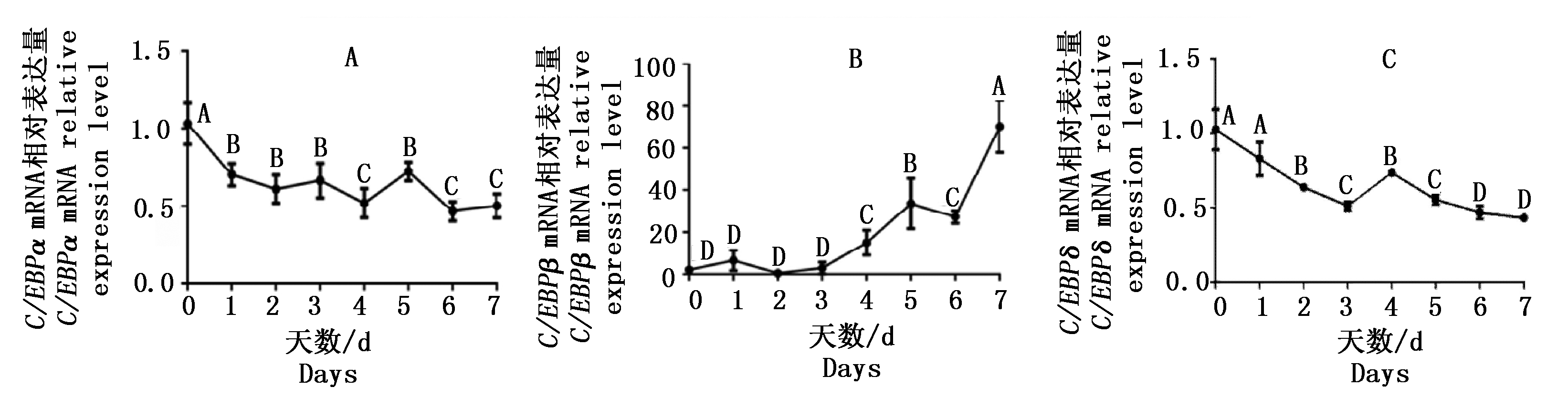
A. C/EBPα mRNA在山羊肌内前体脂肪细胞分化过程中的相对表达量;B. C/EBPβ mRNA在山羊肌内前体脂肪细胞分化过程中的相对表达量;C. C/EBPδ mRNA在山羊肌内前体脂肪细胞分化过程中的相对表达量。不同大写字母表示差异极显著(P<0.01)。
A. Relative expression of C/EBPα mRNA during goat intramuscular preadipocyte differentiation; B. Relative expression of C/EBPβ mRNA during goat intramuscular preadipocyte differentiation; C. Relative expression of C/EBPδ mRNA during goat intramuscular preadipocyte differentiation.Different capital letters mean extremely significant (P<0.01).
图4 C/EBPα、C/EBPβ和C/EBPδ基因在山羊肌内前体脂肪细胞分化过程中的相对表达量
Fig.4 Relative expression of C/EBPα, C/EBPβ and C/EBPδ during goat intramuscular adipocyte differentiation
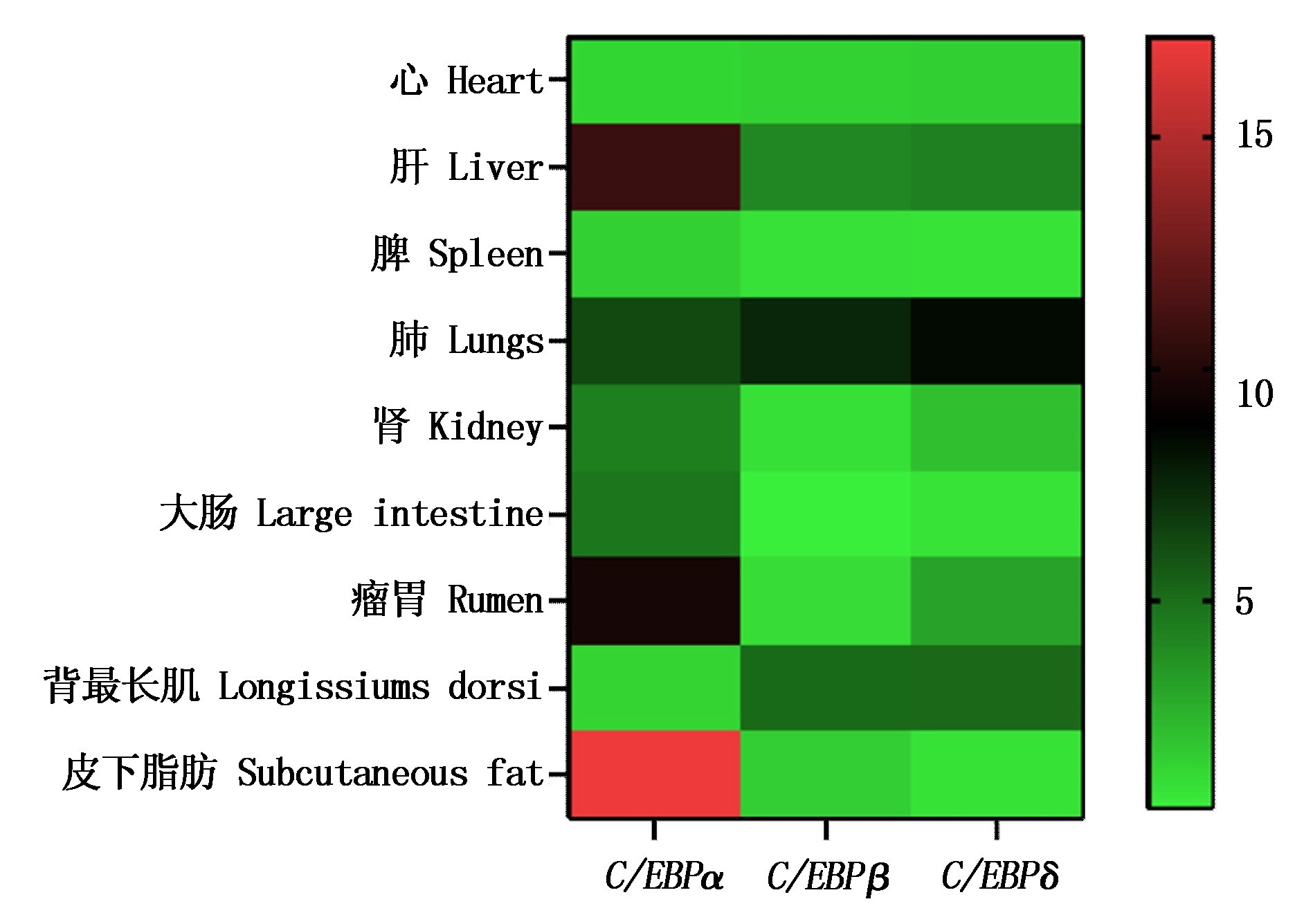
图5 C/EBPα、C/EBPβ和C/EBPδ基因 在山羊各组织中的相对表达
Fig.5 Relative expression of C/EBPα, C/EBPβ and C/EBPδ gene in tissues of goat
3 讨论
研究表明C/EBPα、C/EBPβ和C/EBPδ在小鼠的脂肪细胞中存在表达,并在小鼠脂肪细胞分化过程中发挥重要作用[6]。C/EBPα可以诱导脂肪细胞中某些特异性基因表达,从而加速脂肪细胞成熟。在3T3-L1细胞中当C/EBPα被干扰后参与脂肪生成的基因不表达,并且脂肪细胞不分化[18]。在脂肪生成早期阶段C/EBPβ在转录激活前直接结合到PPARγ启动子诱导PPARγ表达[19],C/EBPβ过表达后PPARγ表达量增加,肝脏中脂质积累增加[20]。作为前体脂肪细胞分化早期发挥作用的转录因子,C/EBPδ在3T3-L1前脂肪细胞中表达,可以诱导PPARγ和C/EBPα的表达,促进脂肪细胞分化[21]。在脂肪细胞分化早期过表达C/EBPδ后,C/EBPα和PPARγ的表达量也显著增加,加快了脂肪细胞分化的过程[22]。为了最终阐明C/EBPα、C/EBPβ和C/EBPδ在山羊脂肪细胞分化中的调控作用,本研究从获得基因序列、明确生物学特征及阐明组织细胞表达特性入手来进行一系列研究。
首先利用RT-PCR成功克隆得到山羊C/EBPα 1 062 bp、C/EBPβ 1 056 bp及 C/EBPδ 873 bp,所编码的蛋白无信号肽和跨膜结构域,均为不稳定亲水碱性蛋白。通过NCBI在线比对发现,山羊C/EBPα、C/EBPβ和C/EBPδ的氨基酸序列同其他哺乳动物的C/EBPα、C/EBPβ和C/EBPδ序列具有较高的同源性,系统进化树显示三者氨基酸与牛的亲缘关系比较近,与原鸡的亲缘关系较远,说明了3种蛋白在生物进化过程中高度保守,符合进化规律。这可能与三者在哺乳动物进化及生命活动过程中发挥的作用有关。
本研究组织表达发现C/EBP家族3个成员在山羊不同组织中均存在广泛表达,其中C/EBPα在皮下脂肪中表达水平最高,其次在肝脏中也有较高的表达水平;C/EBPβ和C/EBPδ具有相似的表达模式,均在肺中表达水平最高,其次在背最长肌中也存在较高水平的表达。推测3个基因可能参与调控山羊的生长发育。已有研究发现CCAAT/增强子结合蛋白主要表达在肝脏、脂肪和肠道组织中。C/EBPα在小鼠脂肪组织、肝脏、肠、肺、肾上腺和胎盘中以高水平表达[23-24],C/EBPβ的组成型在肝脏、肠道、肺脏、脂肪组织、脾脏、肾脏和骨髓单核细胞中表达特别高[25-26],而C/EBPδ的组成型主要表达在脂肪、肺和肠组织中[27],王万霞[21]在对鸭的研究中发现C/EBPα在腹脂和肺中表达水平最高,而C/EBPβ和C/EBPδ均在肺中表达最高。以上结果与本研究结果存在相似及不同之处,推测该家族基因表达可能具有物种特异性。
在山羊前体脂肪细胞分化过程中通过qPCR检测发现C/EBPα和C/EBPδ表达模式相似,均在前体脂肪细胞中的表达水平最高且随着分化时间的增加2个基因的mRNA表达水平逐渐下调,在分化6 d时表达水平趋于稳定,而C/EBPβ在山羊前体脂肪细胞分化前期表达水平较低,从3 d开始表达水平逐渐升高,在分化期间总体呈上升趋势。推测在山羊前体脂肪细胞分化过程中C/EBPα和C/EBPδ在分化前期发挥作用,而C/EBPβ在分化后期发挥作用。Cao等[28]发现C/EBPα在3T3-L1前体脂肪细胞诱导分化2 d检测到表达,随后表达逐渐升高,到达第6天表达量趋于稳定,C/EBPβ和C/EBPδ在分化的前2 d表达量达最大值,而当C/EBPα开始表达后C/EBPβ及C/EBPδ的表达水平开始下降。Rosen等[29]也报道在3T3-L1脂肪细胞开始分化后首先检测到C/EBPβ和C/EBPδ表达,一段时间后才检测到C/EBPα的表达。一致认为C/EBPβ在脂肪分化的前期发挥作用,并且指导有丝分裂的完成,而C/EBPα具有抗有丝分裂的作用,所以在脂肪分化的后期发挥作用[30]。这与本研究结果存在差异,推测可能是不同物种及检测细胞时间点不同造成的这种差异。同时本研究发现3个C/EBP家族成员在脂肪细胞分化过程中表现出表达先后顺序的现象,也反映出三者在调控脂肪细胞分化过程中可能存在相互作用和级联调控的关系,在对三者蛋白进行互作分析时也发现三者确实存在交互作用。
本研究成功克隆得到山羊C/EBPα 1 062 bp、C/EBPβ 1 056 bp及C/EBPδ 873 bp,三者所编码的蛋白均为不稳定亲水碱性蛋白,均无跨膜结构域和信号肽。C/EBPα在皮下脂肪组织中高水平表达,而C/EBPβ和C/EBPδ均在肺中高表达。在肌内前体脂肪细胞分化过程中,C/EBPα和C/EBPδ表达模式相似,均在分化0 d表达水平最高且随着分化时间的增加二者表达水平逐渐下调,在分化6 d时逐渐平稳表达,在山羊前体脂肪细胞分化前期C/EBPβ表达水平较低,从3 d开始表达水平逐渐升高,在分化期间总体呈上升趋势。研究结果表明,在山羊脂肪细胞分化过程中C/EBPα、C/EBPβ和C/EBPδ 3个基因发挥着重要作用。
[1] 盘道兴, 王振, 杨茂林, 廖乔平, 杨昌平, 吴宇萍, 王金洲, 刘若余. 不同品种猪PPARγ和C/EBPα基因表达规律与肌内脂肪含量的相关[J]. 中国农业科学, 2017, 50(1):171-182. doi:10.3864/j.issn.0578-1752.2017.01.015.
Pan D X, Wang Z, Yang M L, Liao Q P, Yang C P, Wu Y P, Wang J Z, Liu R Y. Association of the PPARγ and C/EBPα gene expression with intramuscular fat content in different varieties of pig[J].Scientia Agricultura Sinica,2017,50(1):171-182.
[2] Cirilli M, Bereshchenko O, Ermakova O, Nerlov C. Insights into specificity, redundancy and new cellular functions of C/EBPα and C/EBPb transcription factors through interactome network analysis[J]. Biochim et Biophysica Acta(BBA) General Subjects, 2017, 1861(2):467-476. doi: 10.1016/j.bbagen.2016.10.002.
[3] Marchwicka A, Marcinkowska E. Regulation of expression of CEBP genes by variably expressed vitamin D receptor and retinoic acid receptor α in human acute myeloid leukemia cell lines[J]. International Journal of Molecular Sciences, 2018, 19(7):1907-1918. doi:10.3390/ijms19071918.
[4] Friedman A D. C/EBPα in normal and malignant myelopoiesis[J]. International Journal of Hematology, 2015, 101(4): 330-341. doi:10.1007/s12185-015-1764-6.
[5] Tanaka S, Tanaka K, Magnusson F, Chung Y, Martinez G J, Wang Y H, Nurieva R I, Kurosaki T, Dong C. CCAAT/enhancer-binding protein α negatively regulates IFN-γ expression in T cells[J]. The Journal of Immunology, 2014, 193(12):6152-6160. doi:10.4049/jimmunol.1303422.
[6] Braissant O, Foufelle F, Scotto C, Dauça M, Wahli W. Differential expression of peroxisome proliferator-activated receptors (PPARs): tissue distribution of PPAR-α,-β, and-γ in the adult rat[J]. Endocrinology,1996,137(1):354-366.doi:10.1210/endo.137.1.8536636.
[7] Ng C W S, Kosmo B, Lee P L, Lee C K, Guo J X, Chen Z J, Chiu L, Lee H K, Ho S, Zhou J B, Lin M X, Tan K M L, Ban K H K, Tan T W, Chng W J, Yan B. CEBPA mutational analysis in acute myeloid leukaemia by a laboratory-developed next-generation sequencing assay[J]. Journal of Clinical Pathology, 2018, 71(6):522-531. doi:10.1136/jclinpath-2017-204825.
[8] Umek R M, Friedman A D, Mcknight S L. CCAAT-enhancer binding protein: a component of a differentiation switch[J]. Science, 1991, 251(4991):288-292. doi:10.1126/science.1987644.
[9] Feng R, Desbordes S C, Xie H F, Tillo E S, Pixley F, Stanley E R, Graf T. PU.1 and C/EBP α/β convert fibroblasts into macrophage-like cells[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(16):6057-6062. doi:10.1073/pnas.0711961105.
[10] Xie H F, Ye M, Feng R, Graf T. Stepwise reprogramming of B cells into macrophages[J]. Cell, 2004, 117(5):663-676. doi:10.1016/s0092-8674(04)00419-2.
[11] Rapino F, Robles E F, Richter-Larrea J A, Kallin E M, Martinez-Climent J A, Graf T. C/EBPα induces highly efficient macrophage transdifferentiation of B lymphoma and leukemia cell lines and impairs their tumorigenicity[J]. Cell Reports, 2013, 3(4):1153-1163. doi:10.1016/j.celrep.2013.03.003.
[12] Akira S, Isshiki H, Sugita T, Tanabe O, Kinoshita S, Nishio Y, Nakajima T, Hirano T, Kishimoto T. A nuclear factor for IL-6 expression (NF-IL6) is a member of a C/EBP family[J]. Embo Journal, 1990, 9(6):1897-1906. doi:10.1002/j.1460-2075.1990.tb08316.x.
[13] He Y F, Liu F Y, Zhang W X. Tangeritin inhibits adipogenesis by down-regulating C/EBPα, C/EBPβ, and PPARγ expression in 3T3-L1 fat cells[J]. Genetics & Molecular Research Gmr, 2015, 14(4):13642-13648. doi:10.4238/2015.October.28.26.
[14] Salma N, Xiao H, Imbalzano A N. Temporal recruitment of CCAAT/enhancer-binding proteins to early and late adipogenic promoters in vivo[J]. Journal of Molecular Endocrinology,2006, 36(1):139-151. doi:10.1677/jme.1.01918.
[15] Mori T, Sakaue H, Iguchi H, Gomi H, Okada Y, Takashima Y, Nakamura K, Nakamura T, Yamauchi T, Kubota N, Kadowaki T, Matsuki Y, Ogawa W, Hiramatsu R, Kasuga M. Role of Krüppel-like factor 15 (KLF15) in transcriptional regulation of adipogenesis[J]. Journal of Biological Chemistry, 2000, 44(11):12867-12875. doi:10.1074/jbc.M410515200.
[16] Yeh W C, Cao Z, Classon M, McKnight S L. Cascade regulation of terminal adipocyte differentiation by three members of the C/EBP family of leucine zipper proteins[J]. Genes & Development, 1995, 9(2):168-181. doi:10.1101/gad.9.2.168.
[17] 许晴,林森,朱江江,王永,林亚秋. 山羊肌内前体脂肪细胞诱导分化过程中内参基因的表达稳定性分析[J]. 畜牧兽医学报, 2018, 49(5):907-918. doi:10.11843/j.issn.0366-6964.2018.05.005.
Xu Q, Lin S, Zhu J J, Wang Y, Lin Y Q. The expression stability analysis of reference genes in the process of goat intramuscular preadipocytes differentiation in goat[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(5):907-918.
[18] Lee H, Kim H J, Lee Y J, Lee M Y, Choi H, Lee H, Kim J W. Krüppel-Like factor KLF8 plays a critical role in adipocyte differentiation[J]. PLoS One, 2012, 7(12):52474-52481. doi:10.1371/journal.pone.0052474.
[19] Zhang Q Y, Ramlee M K, Brunmeir R, Villanueva C J, Halperin D, Xu F. Dynamic and distinct histone modifications modulate the expression of key adipogenesis regulatory genes[J]. Cell Cycle, 2012, 11(23):4310-4322. doi:10.4161/cc.22224.
[20] Schroeder-Gloeckler J M, Rahman S M, Janssen R C, Qiao L P, Shao J H, Roper M, Fischer S J, Lowe E, Orlicky D J, McManaman J L, Palmer C, Gitomer W L, Huang W, O′Doherty R M, Becker T C, Klemm D J, Jensen D R, Pulawa L K, Eckel R H, Friedman J E.CCAAT/enhancer-binding protein β deletion reduces adiposity, hepatic steatosis, and diabetes in Leprdb/db mice[J]. Journal of Biological Chemistry, 2007, 282(21): 15717-15729. doi:10.1074/jbc.M701329200.
[21] 王万霞. 鸭C/EBPα, C/EBPβ和C/EBPδ基因的克隆及在脂肪组织中的发育性表达研究[D].成都:四川农业大学, 2012.
Wang W X. Cloning of duck C/EBPα, C/EBPβ, C/EBPδ genes and developmental expression in duck fat tissues[D]. Chengdu: Sichuan Agricultural University, 2012.
[22] 王娉. 鸡脂肪分化转录因子PPARγ和C/EBPα抗体制备及功能研究[D].乌鲁木齐:新疆大学, 2007.
Wang P. Ab preparation by chicken PPARγ and C/EBPα genes immunization and their function[D]. Urumqi: Xinjiang University, 2007.
[23] Moseti D, Regassa A, Kim W K. Molecular regulation of adipogenesis and potential anti-adipogenic bioactive molecules[J]. International Journal of Molecular Sciences, 2016, 17(1):124-147.doi: 10.3390/ijms17010124.
[24] Lekstrom-Himes J, Xanthopoulos K G. Biological role of the CCAAT/enhancer-binding protein family of transcription factors[J]. Journal of Biological Chemistry, 1998, 273(44):28545-28548. doi:10.1074/jbc.273.44.28545.
[25] Poli V, Mancini F P, Cortese R. IL-6DBP, a nuclear protein involved in interleukin-6 signal transduction, defines a new family of leucine zipper proteins related to C/EBP[J]. Cell, 1990, 63(3): 643-653. doi:10.1016/0092-8674(90)90459-r.
[26] Descombes P, Chojkier M, Lichtsteiner S, Falvey E, Schibler U. LAP, a novel member of the C/EBP gene family, encodes a liver-enriched transcriptional activator protein[J]. Genes Dev, 1990, 4(9):1541-1551. doi:10.1101/gad.4.9.1541.
[27] Kinoshita S, Akira S, Kishimoto T. A member of the C/EBP family, NF-IL6 beta, forms a heterodimer and transcriptionally synergizes with NF-IL6[J]. Proceedings of the National Academy of Sciences of the United States of America,1992,89(4):1473-1476. doi:10.1073/pnas.89.4.1473.
[28] Cao Z, Umek R M, Mcknight S L. Regulated expression of three C/EBP isoforms during adipose conversion of 3T3-L1 cells[J]. Genes Dev, 1991, 5(9):1538-1552. doi:10.1101/gad.5.9.1538.
[29] Rosen E D, Spiegelman B M. Molecular regulation of adipogenesis[J]. Annu Rev Cell Dev Biol, 2000, 16(4):145-171. doi:10.1146/annurev.cellbio.16.1.145.
[30] Liu Y, Peng W Q, Guo Y Y, Liu Y, Tang Q Q, Guo L. Krüppel-like factor 10 (KLF10) is transactivated by the transcription factor C/EBPβ and involved in early 3T3-L1 preadipocyte differentiation[J]. Journal of Biological Chemistry,2018,293(36):14012-14021. doi:10.1074/jbc.RA118.004401.
