禽腺病毒,属于腺病毒科[1],是一种外形呈立体对称的二十面体、无囊膜、直径为70~90 nm的双股DNA病毒。根据抗原性不同,禽腺病毒可分为禽腺病毒-Ⅰ群(Fowl adenovirus,FAdV)、Ⅱ群和Ⅲ群[2];根据分子特征和限制性内切酶分析,FAdV可分为A-E 5个种;根据血清交叉中和试验结果可分为12个血清型(即1-8a和8b-11)[3-4]。青岛农业大学病理实验室对近十年来临床FAdV分离株的Hexon基因测序分析结果显示,我国主要流行的FAdV为FAdV-4、FAdV-8a、FAdV-8b和FAdV-11,其中FAdV-8a、FAdV-8b和FAdV-11主要引起鸡包涵体肝炎,FAdV-4主要引起肝炎-心包积液综合征[5]。鸡包涵体肝炎的发病率高达60%~70%,被感染鸡出现突然死亡,死亡率为10%~30%;鸡肝炎-心包积液综合征主要由FAdV-4感染引起,主要感染3~6周龄肉鸡,致死率为20%~80%[6]。尤其是肝炎-心包积液综合征,从2014年开始在我国广泛流行,其对肉鸡的高感染率和高死亡率给养鸡业造成了严重的经济损失[7]。
FAdV的衣壳由3种主要的结构蛋白组成,分别为六邻体(Hexon)、五邻体(Penton)和纤维蛋白(Fiber)。其中FAdV-1、FAdV-4和FAdV-10具有不同的Fiber蛋白,即Fiber-1和Fiber-2,其余每种血清型毒株仅有一种Fiber蛋白。Fiber蛋白作为病毒与组织细胞接触最早的结构,可与病毒受体相结合,介导病毒入侵细胞[8];Hexon和Fiber都作为FAdV的主要结构蛋白,可作为亚单位疫苗诱导机体产生免疫反应,但研究发现Fiber-2作为免疫原免疫鸡群,对FAdV-4感染的保护率明显高于Hexon和Fiber-1,故认为Fiber-2具有病毒中和抗原表位,能诱导机体产生中和抗体[9];Fiber蛋白带有主要的型特异性抗原决定簇,可作为FAdV诊断的靶向蛋白,以Fiber-2蛋白为包被抗原建立的间接ELISA方法可以特异性地检测FAdV-4[10];Fiber蛋白在决定FAdV致病性方面起着重要的作用,通过反向遗传技术已证实Fiber-2蛋白是决定FAdV-4致病性的重要因素[11]。故Fiber蛋白成为近年来FAdV研究的重点。
本实验室对我国主要流行的4种血清型FAdV在LMH细胞上的交叉保护反应性进行研究,发现FAdV-4全病毒血清能够中和自身和FAdV-11的感染,但不能中和FAdV-8a和FAdV-8b的感染,FAdV-8a和FAdV-8b之间无交叉中和作用,FAdV-8b和FAdV-11能互相中和保护[12]。鉴于Fiber蛋白作为FAdV具有主要的型特异性中和表位和型特异性抗原决定簇的特点,本研究拟对我国主要流行的4种血清型FAdV的Fiber蛋白(FAdV-4为Fiber-2)进行原核表达,并制备相应抗血清,通过LMH细胞研究不同血清FAdV Fiber蛋白抗血清对其他血清型FAdV感染的交叉中和作用,为后期通用疫苗的研究或血清分型诊断方法的建立提供基础。
1 材料和方法
1.1 试验材料
1.1.1 毒株、质粒 FAdV-4(RZ-140718)、FAdV-8a(KD-150107)、FAdV-8b(JL-150226)、FAdV-11(YT-160809)毒株由本实验室分离、鉴定和保存,原核表达载体pCold TF由本实验室保存,LMH细胞购自ATCC生物资源中心,大肠杆菌DH5α、BL21(DE3)感受态细胞购自天根生化科技(北京)有限公司。
1.1.2 试剂 限制性内切酶Nde Ⅰ、Hind Ⅲ、EcoR Ⅰ、T4 DNA连接酶,购自宝生物工程有限公司,Gel Extraction Micro Kit 购自康为世纪生物科技有限公司,TIANprep Mini Plasmid Kit 购自天根生化科技有限公司,Gold View核酸染料、鼠源抗His标签单克隆抗体、HRP标记的兔抗鼠的IgG、DAB显色液等购自北京索莱宝科技有限公司;白油佐剂购自吉化江城油脂化工有限责任公司,Ni-NTA Fast Start蛋白纯化试剂盒购自QIAGEN公司,异丙基硫代β-D半乳糖苷(IPTG)和氨苄霉素(Amp+)购自Invitrogen公司。
1.2 试验方法
1.2.1 Fiber基因扩增 根据分离毒株FAdV-4(RZ-140718)、FAdV-8a(KD-1501070)、FAdV-8b(JL150226)、FAdV-11(YT-160809)序列,设计Fiber基因的上下游引物(FadV-4为Fiber-2)并分别在上下游插入酶切位点Nde Ⅰ、Hind Ⅲ(FAdV-11用Nde Ⅰ和EcoR Ⅰ)。分别以4个FAdV毒株DNA为模板,扩增Fiber基因,扩增产物进行琼脂糖凝胶电泳鉴定并回收。
1.2.2 重组表达载体的构建 将回收后的PCR产物进行酶切,用T4DNA连接酶16 ℃过夜连接,连接产物转化到DH5α,挑取单克隆进行PCR验证,阳性克隆进行测序(华大基因),将测序正确的阳性质粒转到BL21(DE3)感受态细胞。
1.2.3 重组蛋白的表达 挑取含阳性重组质粒和空质粒的单菌落,接种于LB液体培养基(Amp+,100 mg/L),37 ℃振荡培养,过夜,次日取千分之一的菌液接种到1 L的LB摇瓶里扩大培养,待OD600为0.4~0.6时,将摇瓶置于16 ℃静置30 min,后加入终浓度1 mmol/L的IPTG,200 r/min(16 ℃)振荡培养24 h,取200 μL 8 000 r/min离心15 min后,加40 μL无菌水和SDS上样缓冲液,煮沸10 min,进行SDS-PAGE蛋白电泳,考马斯亮蓝染色,观察结果。
收集剩余菌体沉淀用50 mL PBS重悬,然后进行超声裂解,取上清和沉淀,分别进行SDS-PAGE电泳,检测蛋白是否是可溶性表达。
1.2.4 重组蛋白的Western Blot鉴定 将上清进行SDS-PAGE电泳,后将蛋白胶转移至硝酸纤维素膜(NC膜)上,5%的脱脂奶粉封闭NC膜2 h,PBST洗涤3次,加鼠源抗His的一抗4 ℃孵育4 h,洗涤3次后加入HRP标记兔抗鼠IgG二抗室温孵育2 h,洗涤后加入DAB显色液显色5 min,进行结果观察。
1.2.5 重组蛋白的纯化 将破碎后收集的细菌上清经过0.22 μm的滤膜抽滤,然后平衡后缓慢经过镍柱,按照Ni-NTA Fast Start蛋白纯化试剂盒说明纯化目的蛋白。
1.2.6 抗血清制备 纯化后的重组蛋白与白油佐剂1∶3充分混匀,采用颈部皮下的免疫方式,免疫SPF鸡,免疫剂量为75 μg/只,每组免疫10只,免疫21 d后,开始翅静脉采集血液分离血清,以病毒为抗原,通过琼脂糖凝胶扩散试验测定抗体效价,待抗体效价达24后,大量采集血液,分离保存血清。
1.2.7 交叉中和试验 FAdV-4稀释到病毒TCID50,将4个FAdV的抗血清置于56 ℃的水浴锅灭活30 min,血清经过0.22 μm的滤器过滤除菌后按照2倍比稀释。将稀释好的病毒和血清充分混匀后加入到铺好的96孔板中,每个孔100 μL,每个梯度8个孔,于CO2细胞培养箱中37 ℃培养1 h后,将病毒和血清混合液倒出,用PBS清洗3遍,然后加入细胞维持液100 μL(1%的FBS),设立阴阳性对照(阴性对照只加血清,阳性对照加100 TCID50的病毒悬液),每天观察,记录细胞病变情况。其余3个血清型的FAdVs均按照相同的操作进行交叉中和试验。根据Reed-Meunch法计算血清中和效价。
2 结果与分析
2.1 目的基因扩增
根据4个血清型分离株的Fiber基因序列设计引物(表1),进行相应基因扩增,扩增的基因片段经1%的琼脂糖凝胶电泳分析(图1),可见4个血清型FAdV Fiber基因的目的条带,其中,FAdV-4为1 440 bp,FAdV-8a为1 575 bp,FAdV-8b为1 566 bp,FAdV-11为1 719 bp。
表1 4个血清型FAdV Fiber基因扩增引物
Tab.1 Primers of Fiber gene of fowl adenovirus with different serotypes

引物名称Primers name序列Sequence酶切位点Restriction sites产物大小/bpProduces sizeFAdV-4-FCGCCATATGATGCTCCGGGCCCCTAAAAGAAGACNde Ⅰ1 440FAdV-4-RTATAAGCTTTTACGGGAGGGAGGCCGCTGGACHind ⅢFAdV-8b-FCGCCATATGATGGCGACCTCGACTCCTCNde Ⅰ1 575FAdV-8b-RCCGCAAGCTTTTAAGGAGCGTTGGCGGTGCTCAAGHind ⅢFAdV-8a-FCCGCATATGATGGCGACCTCGACTCCTCACNde Ⅰ1 566FAdV-8a-RCCCAAGCTTTTATGACACGTCCGCAGTACTTAGGHind ⅢFAdV-11-FCCGCATATGATGGCGAAATCGACTCCTNde Ⅰ1 719FAdV-11-RCCGCGAATTCTTAGGGTTGTGTTAATTTGTTGGEcoR Ⅰ
2.2 重组质粒的酶切鉴定
各血清型FAdV Fiber基因PCR扩增产物经回收纯化后与pCold TF载体双酶切后连接,转化到DH5α感受态细胞,测序正确后提取质粒。FAdV-4、FAdV-8a、FAdV-8b用Nde Ⅰ和Hind Ⅲ内切酶进行双酶切鉴定重组质粒;FAdV-11用Nde Ⅰ和EcoR Ⅰ内切酶进行双酶切鉴定重组质粒,经1%琼脂糖凝胶电泳分析(图2)4个血清型FAdV Fiber基因双酶切结果与预期相符,表明pCold-FAdV-4-Fiber、pCold-FAdV-8a-Fiber、pCold-FAdV-8b-Fiber和pCold-FAdV-11-Fiber重组表达质粒构建正确。
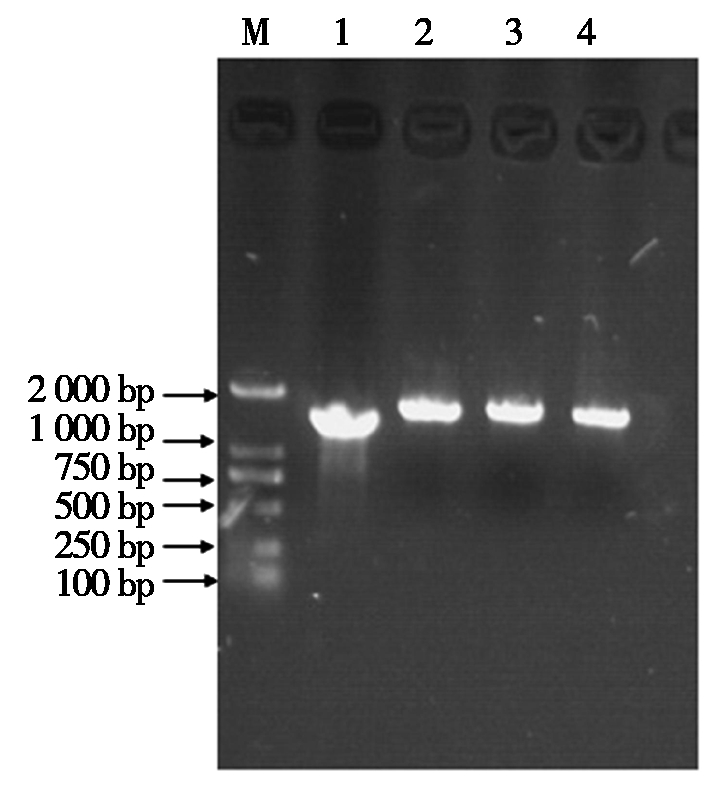
M.Marker 2000;1.FAdV-4 Fiber-2; 2.FAdV-8a Fiber;3.FAdV-8b Fiber;4.FAdV-11 Fiber。
图1 4个血清型FAdV Fiber基因扩增结果
Fig.1 Amplification results of Fiber genes of fowl adenovirus with different serotypes
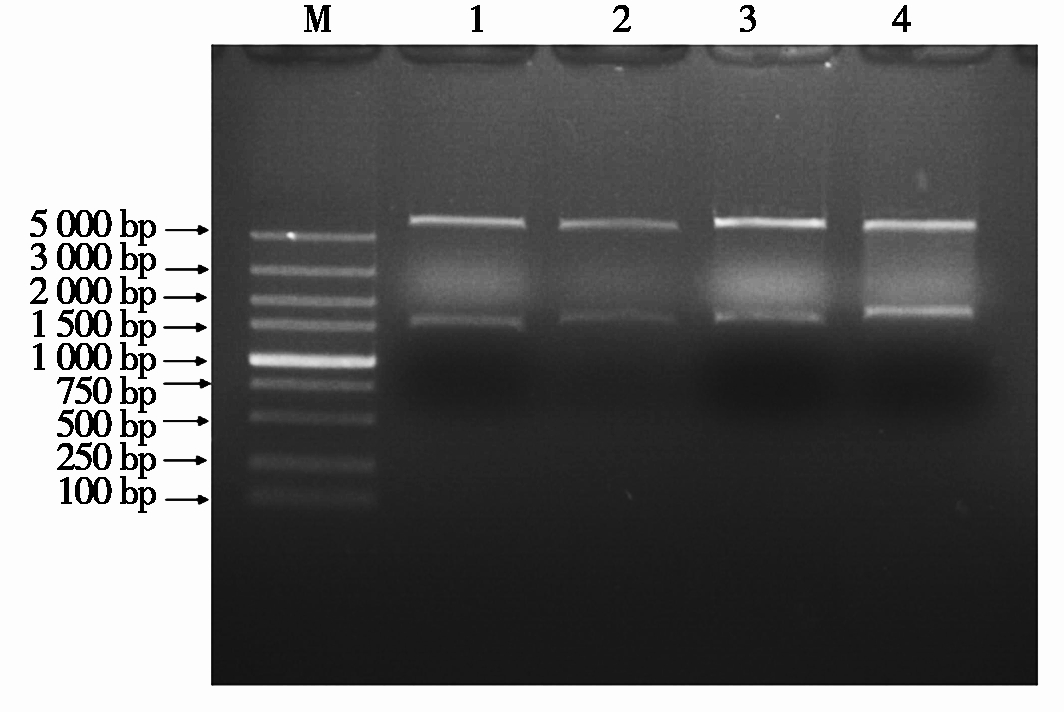
M.Marker 5000;1.pCold-FAdV-4-Fiber;2.pCold-FAdV-8a-Fiber; 3.pCold-FAdV-8b-Fiber;4.pCold-FAdV-11-Fiber。
图2 4个血清型FAdV Fiber蛋白重组质粒双酶切结果
Fig.2 Results of double digestion of recombinant plasmids about Fiber protein of fowl adenovirus with different serotype
2.3 重组蛋白表达最佳诱导时间确定
挑取阳性pCold-FAdV-Fiber重组质粒(以FAdV-4为例)接种于LB液体培养基(Amp+,100 mg/L),16 ℃振荡培养过夜,分别诱导4,8,12,16,24 h,诱导后产物进行SDS-PAGE检测,其检测结果见图3。结果表明,重组蛋白在1 mmol/L的IPTG诱导24 h的情况下表达效果最佳。
2.4 Western Blot鉴定结果
纯化的FAdV-4 Fiber-2、FAdV-8a Fiber、 FAdV-8b Fiber、FAdV-11 Fiber蛋白和诱导后pCold TF空载体与鼠源抗His的一抗进行孵育,鼠源抗His抗体与上述4个表达蛋白大约分别在102,107,107,112 ku处发生反应,而空载体与鼠源抗His抗体大约在60 ku处发生反应,结果表明,这4种重组蛋白全部正确表达(图4)。
2.5 交叉中和试验结果
FAdV-4 Fiber-2、FAdV-8a Fiber、FAdV-8b Fiber和FAdV-11 Fiber的抗血清与不同血清型FAdV在LMH细胞进行交叉中和反应研究,结果显示,FAdV-4、FAdV-8b和FAdV-11 Fiber蛋白的抗血清与本血清型病毒孵育LMH细胞后,细胞培养到第4天无明显病变,且中和效价分别为1∶100,1∶177和1∶79,而与其他血清型病毒孵育后细胞均于第3天出现特征性病变;FAdV-8a Fiber蛋白的抗血清与各血清型病毒孵育LMH细胞后,细胞培养到第3天出现特征性细胞病变;此外,不同血清型FAdV单独孵育LMH细胞在3~4 d均出现特征性病变,而阴性对照组细胞均未出现病变(表2)。结果表明,FAdV-4 Fiber-2、FAdV-8b Fiber和FAdV-11 Fiber的抗血清仅可阻止本血清型病毒的感染,而FAdV-8a Fiber的抗血清对本血清型病毒的感染也无保护作用。
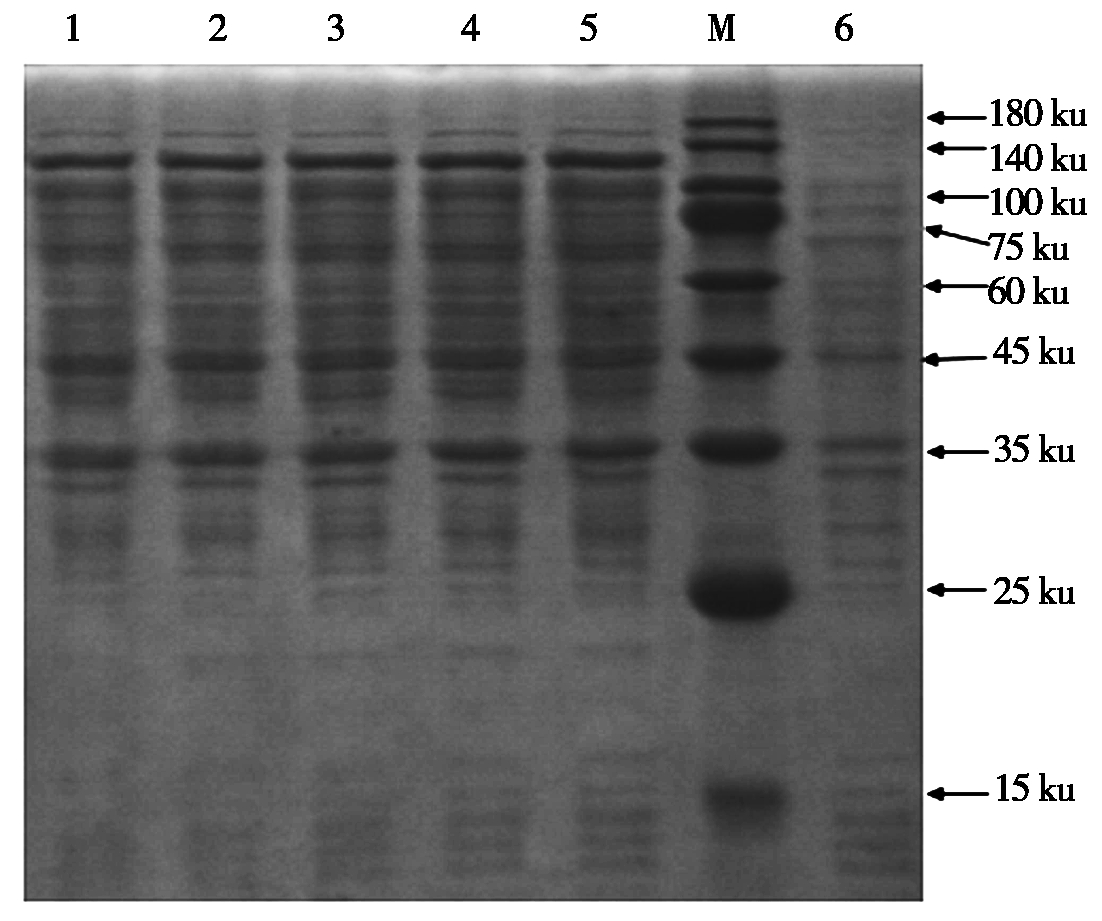
1-5.分别为16 ℃ pCold-FAdV-4-Fiber诱导4,8,12,16,24 h;M.蛋白分子量标准;6.诱导前。
1-5.pCold-FAdV-4-Fiber recombinant plasmids were induced to express at 16 ℃ for 4,8,12,16,24 h;M. Standard protein molecular;6. Before induction.
图3 FAdV-4 Fiber-2重组蛋白最佳诱导时间确定
Fig.3 Induction time of expression for FAdV-4 Fiber-2 recombinant protein
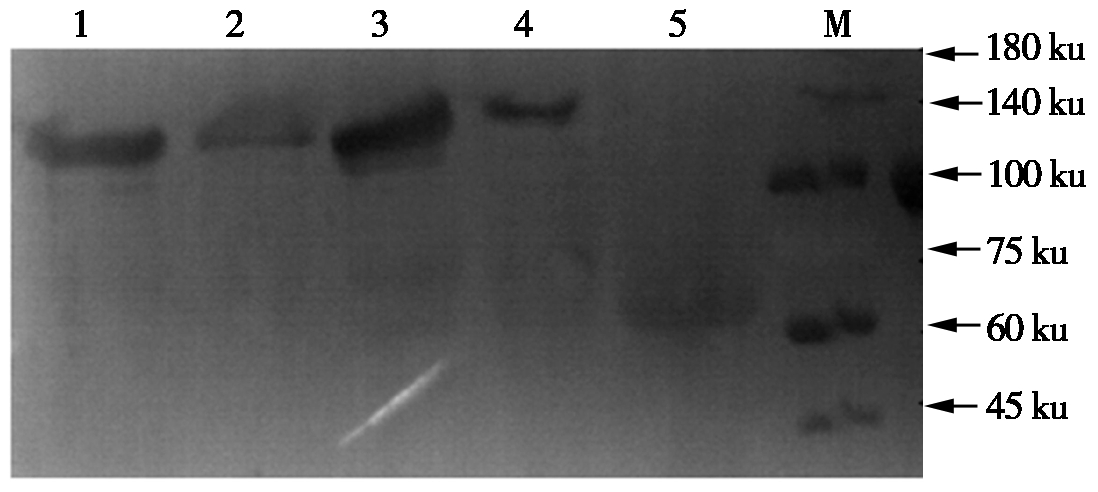
1.FAdV-4 Fiber-2;2.FAdV-8a Fiber;3.FAdV-8b Fiber; 4.FAdV-11 Fiber;5.空载体;6.蛋白分子量标准。 1.FAdV-4 Fiber-2;2.FAdV-8a Fiber;3.FAdV-8b Fiber; 4.FAdV-11 Fiber;5.Empty plasmid;6.Standard protein molecular.
图4 纯化的4个Fiber蛋白Western Blot鉴定结果
Fig.4 Identification of four Fiber proteins by Western Blot
3 讨论
鸡包涵体肝炎于1986年首次在我国报道,随后一直零星有临床病例的报道,但从2009年以来呈现明显增加的趋势;鸡肝炎-心包积液综合征于2014年6月开始在我国流行,到2015年在全国肉鸡养殖省份开始大规模爆发,且蔓延迅速,范围逐步扩散至全国,给我国养禽业造成了巨大的损失[13]。本实验室对我国近十多年来FAdV流行情况调查结果表明, 2014年前我国FAdV感染呈地方性流行,并以包涵体肝炎为主要临床症状,其中FAdV-11为优势血清型,FAdV-8a和FAdV-8b零星出现;2014-2017年主要流行FAdV-4,临床以肝炎-心包积液为主要病理特征;2017-2018年,FAdV-8b的流行有所增加,且致病性较之前有所改变[14]。鉴于我国流行多种FAdV血清型、不同血清型FAdV对鸡的致病性不同,且对养鸡业造成巨大的经济损失,故建立特异性强、敏感性高的血清分型诊断方法和研制高效、安全的疫苗是有效防控FAdV感染的重要方法。
表2 4个血清型FAdV Fiber蛋白抗血清对不同血清型FAdV感染的中和作用
Tab.2 Neutralization results of antisera against four kind Fiber protein to the infection of fowl adenovirus with different fowl adenovirus
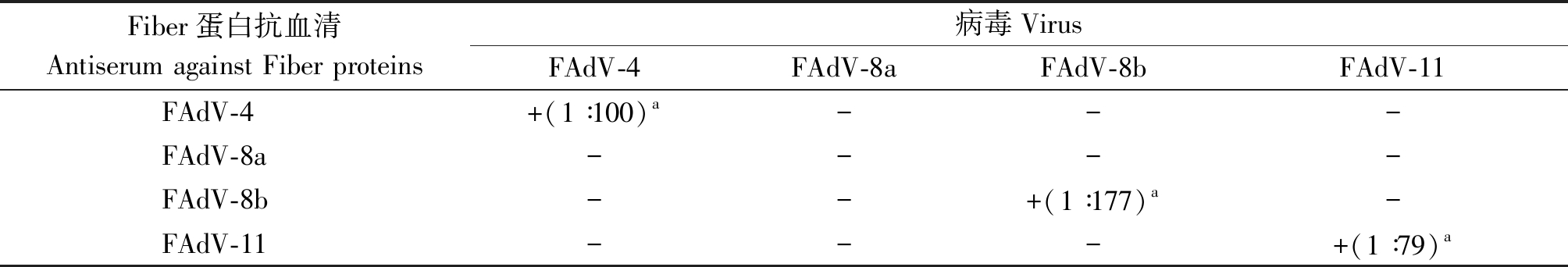
Fiber蛋白抗血清Antiserum against Fiber proteins 病毒VirusFAdV-4FAdV-8aFAdV-8bFAdV-11FAdV-4+(1∶100)a---FAdV-8a----FAdV-8b--+(1∶177)a-FAdV-11---+(1∶79)a
注:+.能够产生中和作用;-.不能产生中和作用;a.中和效价。
Note:+. It can produce neutralization;-.It cannot produce neutralization;a.Neutralization potency.
FAdVs的血清型较多,不同血清型间病毒存在一定程度的交叉保护。研究认为FAdV-8b和FAdV-11二价弱毒苗和灭活苗免疫鸡后可明显产生免疫保护作用,且对加拿大流行毒株(FAdV-2、FAdV-7、FAdV-8a、FAdV-8b和FAdV-11)都具有很好的保护作用[15-16];Kim 等[17]报道鸡免疫FAdV-4灭活油乳剂疫苗后可产生对FAdV-5、FAdV-8a、FAdV-8b和FAdV-11感染的交叉保护;Steer-Cope等[18]研究表明,FAdV-8a和FAdV-8b及FAdV-8a和FAdV-11之间能交叉保护,FAdV-8b和FAdV-11之间无交叉保护;Xia等[19]报道FAdV-4的灭活疫苗可保护FAdV-8b的感染。以上不同血清型FAdV交叉保护结果并不一致,这可能与不同国家或地域同一血清型流行毒株之间存在差异有关。本实验室在LMH细胞水平进行的FAdV交叉保护试验,结果表明,FAdV-4全病毒血清可中和FAdV-11的感染,FAdV-8b和FAdV-11之间存在交叉中和保护作用[12]。那么,这3种血清型FAdV间存在的交叉保护作用是由哪个结构蛋白决定的,该类蛋白的确定将为后续多种血清型FAdV通用亚单位疫苗的研究奠定基础。
Fiber蛋白作为FAdV中和抗原表位和型特异性抗原决定簇的携带者,是目前FAdV亚单位疫苗研制和血清学诊断方法建立的重要靶向蛋白,尤其在FAdV-4的研究较多。Wang等[20]用大肠杆菌表达FAdV-4的衣壳蛋白,然后比较了不同接种剂量对鸡的免疫保护效果,通过比较死亡数和组织器官损伤程度,发现Fiber-2的保护效果明显优于Hexon和Fiber-1,是FAdV-4的亚单位疫苗最佳选择。Schachner等[9]利用杆状病毒系统表达了FAdV-4的Fiber-1、Fiber-2和Hexon loop-1蛋白,对各种表达蛋白的免疫保护性进行评价,结果发现Fiber-2蛋白能产生更强的免疫应答。通过不同的表达系统,都表明Fiber-2对FAdV-4的感染具有较强的免疫保护性。基于Fiber-2制备的单克隆抗体建立ELISA诊断方法,可用于FAdV-4的特异性诊断;而用Fiber-2整个基因表达和纯化后的蛋白作为包被抗原,所建立的ELISA检测方法可特异性检测FAdV-4 的抗体[10,21]。故本研究通过原核表达不同血清型FAdV Fiber蛋白,并制备相应Fiber蛋白的抗血清,对其在LMH细胞上进行交叉中和试验,以确定不同血清型FAdV Fiber蛋白在细胞上是否存在交叉中和作用。研究结果发现,FAdV-4的Fiber-2抗血清并不能中和FAdV-11的感染,且FAdV-8b和FAdV-11的Fiber蛋白抗血清也不能相互中和另一血清型病毒的感染,表明这3个血清型FAdV全病毒间存在的交叉中和位点并不存在于Fiber蛋白上。
本实验室前期进行的FAdV全病毒交叉中和试验研究结果证明,FAdV-8a与其他血清型毒株之间无交叉保护反应,但FAdV-8a全病毒抗血清可中和本血清型病毒的感染[12];而本研究中发现,FAdV-8a Fiber蛋白抗血清在细胞水平上不仅不能中和其他血清型FAdV的感染,而且也不能中和本血清型FAdV的感染。这一现象有待于进一步研究。
本研究成功表达了4种我国主要流行血清型FAdV的可溶性Fiber蛋白,LMH细胞水平进行的交叉中和结果表明,FAdV-4、FAdV-8b和FAdV-11 Fiber蛋白抗血清对其他血清型病毒的感染无交叉中和作用,证明在细胞水平上这3种血清型FAdV全病毒间的交叉中和反应与Fiber蛋白无关,这一研究结果为后续血清学分型诊断方法的建立提供了理论依据和重要素材。
[1] Zhao J,Zhong Q,Zhao Y,Hu Y X,Zhang G Z. Pathogenicity and complete genome characterization of fowl adenoviruses isolated from chickens associated with inclusion body hepatitis and hydropericardium syndrome in China[J].PLoS One,2015,10(7):e0133073.doi:10.1371/journal.pone.0133073.
[2] Hess M.Detection and differentiation of avian adenoviruses:a review[J]. Avian Pathol,2000,29(3):195-206.doi:10.1080/03079450050045440.
[3] Zsák L,Kisary J. Characterisation of adenoviruses isolated from geese[J]. Avian Pathol,1984,13(2):253-264.doi:10.1080/03079458408418529.
[4] Schachner A,Matos M,Gsrafl B,Hess M. Fowl adenoirus-induced diseases and strategies for their control-a review on the current global situation[J]. Avian Pathol,2018,47(2):111-126.doi:10.1080/03079457.2017.1385724.
[5] Li C J,Li H Y,Wang D D,Wang J J,Wang Y M,Wang S C,Li J D,Liu P,Wang J L,Xu S Z,Cui S J,Zhang Y,Yin Y B. Characterization of fowl adenoviruses isolated between 2007 and 2014 in China[J].Veterinary Microbiology,2016,197:62-67.doi:10.1016/j.vetmic.2016.11.005.
[6] Steer-Cope P,Sandy J,O′Rourke D,Scott P,Browning G,Noormohammadi A. Chronologic analysis of gross and histologic lesions induced by field strains of FAdV-1,FAdV-8b,and FAdV-11 in six-week-old chickens[J]. Avian Diseases,2017,61(4):512-519.doi:10.1637/11718-072317-Reg.1.
[7] Chen L,Yin L J,Zhou Q F,Li Q H,Luo Y Y,Xu Z C,Zhang Y,Xue C Y,Cao Y C. Immunogenicity and protective efficacy of recombinant fiber-2 protein in protecting SPF chickens against fowl adenovirus 4[J]. Vaccine,2018,36(9):1203-1208.doi:10.1016/j.vaccine.2018.01.028.
[8] Norrby E. The relationship between the soluble antigens and the virion of adenovirus type 3. IV. Immunological complexity of soluble components[J].Virology,1969,37(4):565-576.doi:10.1016/0042-6822(69)90274-8.
[9] Schachner A,Marek A,Jaskulska B,Bilic I,Hess M. Recombinant FAdV-4 fiber-2 protein protects chickens against hepatitis-hydropericardium syndrome (HHS)[J]. Vaccine,2014,32(9): 1086-1092.doi:10.1016/j.vaccine.2013.12.056.
[10] He Z R,Ruan S F,Zhao J,Yang H M,Zhang G Z. Recombinant Fiber-2 protein-basted indirect ELISA for antibody detection of fowl adenovirus serotype 4[J]. Avian Disease,2018,62(1):73-78.doi:10.1637/11758-100917-Reg.1.
[11] Zhang Y H,Liu R X,Tian K Y,Wang Z,Yang X,Gao D S,Zhang Y M,Fu J,Wang H L,Zhao J. Fiber2 and hexon genes are closely associated with the virulence of the emerging and highly pathogenic fowl adenovirus 4[J]. Emerging Microbe & Infections,2018,7(1):1-10.doi:10.1038/s41426-018-0203-1.
[12] Wang J L,Wang S C,Zou K Y,Zhang Y,Xu S Z,Yin Y B. Variant serotypes of Fowl adenovirus isolated from commercial poultry between 2007 and 2017 in some regions of China[J]. Avian Disease,2018,62(2):171-176.doi:10.1637/11794-010618-Reg.1.
[13] Li H X,Wang J,Qiu L Y,Han Z X,Liu S W. Fowl adenovirus species C serotype 4 is attributed to the emergence of hepatitis-hydropericardium syndrome in chickens in China[J]. Infection,Genetics and Evolution,2016,45:230-241.doi:10.1016/j.meegid.2016.09.006.
[14] 尹燕博.我国Ⅰ群禽腺病毒主要流行血清型及其防控[J]. 中国家禽,2018,40(3):1-5.doi:10.16372/j.issn.1004-6364.2018.03.001.
Yin Y B. Investigation on dominat circulating serotypes of Group Ⅰ fowl adenovirus in China and the control[J]. China Poultry,2018,40(3):1-5.
[15] Popowich S,Gupta A,Chow-Lockerbie B,Ayalew L,Ambrose N,Ojkic D,Guanawardana T,Kurukulasuriya S,Willson P,Tikoo S K,Gomis S. Broad spectrum protection of broiler chickens against inclusion body hepatitis by immunizing their broiler breeder parents with a bivalent live fowl adenovirus vaccine[J].Research in Veterinary Science,2018,118:262-269.doi:10.1016/j.rvsc.2018.03.003.
[16] Gupta A,Popowich S,Ojkic D,Kurukulasuriya S,Chow-Lockerbie B,Gunawardana T,Goonewardene K,Karunarachna R,Ayalew L E,Ahmed K A,Tikoo S K,Willison P,Gomis S. Inavtivated and liver fowl adenovirus (FAdV8b + FAdV11) breeder vaccines provide brod-spectrum protection in chicks against inclusion body hepatitis(IBH)[J].Vaccine,2018,36(5):744-750.doi:10.1016/j.vaccine.2017.12.047.
[17] Kim M S,Lim T H,Lee D H,Youn H N,Yuk S S,Kim B Y,Choi S W,Jung C H,Han J H,Song C S. An inactivated oil-emulsion fowl adenovirus serotype 4 vaccine provides broad cross-protection against various serotypes of fowl adenovirus[J]. Vaccine,2014,32 (28):3564-3568.doi:10.1016/j.vaccine.2014.03.015.
[18] Steer-Cope P A,Sandy J R,O′Rourke D,Scott P C,Browning G F,Noormohammadi A H. Vaccination with FadV-8a induces protection against inclusion body hepatitis caused by homologous and heterologous strains[J].Avian Pathology,2019,48(5):396-405.doi:10.1080/03079457.2019.1612032.
[19] Xia J,Yao K C,Liu Y Y,You G J,Li S Y,Liu P,Zhao Q,Wen Y P,Wu R,Huang X B,Cao S J,Han X F,Huang Y. Isolation and molecular characterization of prevalent Fowl adenovirus strains in southwestern China during 2015-2016 for the development of a control strategy[J]. Emerging Microbes & Infections,2017,6 (1):1-9.doi:10.1038/emi.2017.91.
[20] Wang X L,Tang Q X,Chu Z L,Wang P X,Luo C,Zhang Y J,Fang X Y,Qiu L,Dang R Y,Yang Z Q. Immune protection efficacy of FAdV-4 surface proteins Fiber-1,Fiber-2,hexon and penton base[J].Virus Research,2018,245:1-6.doi:10.1016/j.virusres.2017.12.003.
[21] Shao H S,Wang P,Wang W K,Zhang J J,Li T F,Liang G C,Gao W,Qin A J,Ye J Q. A novel monoclonal antibodies-based sandwich ELISA for detection of serotype 4 fowl adenovirus[J].Avian Pathol,2019,48(3):204-208.doi:10.1080/03079457.2019.1566595.
