土壤真菌是土壤微生物的主要组成部分,对土壤矿物质的分解、养分循环与能量流动具有重要的作用[1],其多样性既是评价土壤生态系统平衡的重要指标[2-3],也是评价土壤肥力高低的敏感性指标,影响着地上植物的生长、农田生态系统功能的调节及土壤健康[4-5]。真菌对环境具有敏感性[6],有研究发现,土壤真菌多样性与生境如土壤条件(温度、湿度、容重、土壤养分、pH值等)、植物种类、耕作方式等密切相关。Yang等[7]研究发现,影响我国黄土高原土壤真菌多样性的关键因素是土壤有机碳和植物丰富度,而影响青藏高原天然草地土壤真菌多样性的主要因子是植物多样性[8]。Li等[9]研究发现,在可耕地土壤中,真菌群落结构受到有效磷、有机碳和容重的显著影响。丁建莉[10]研究发现,黑土中速效钾、硝态氮和速效磷是改变黑土土壤真菌群落结构的主要环境因子。Wang等[11]研究发现,在采用免耕的系统中,真菌多样性增加。Dong等[12] 研究发现,真菌多样性无变化。可见,不同的土壤条件、土地利用强度和持续时间、气候条件、植物覆盖或其他因素均可能造成土壤真菌多样性的差异。
矿区复垦土壤通常具有土壤有机质含量低、团聚体少、微生物活性差的特征[13-15],已有众多学者对不同植物种植下矿区复垦土壤理化特性、微生物区系进行了研究。金志南等[16]研究发现,在矿区种植豆科绿肥牧草相较于粮食作物更有利于提高复垦土壤有机质、全氮、速效磷、有效钾含量,加速生土熟化,改善生态环境。洪坚平等[17]对煤矸石风化物进行复垦种植试验后发现,种植绿肥牧草,有助于提高煤矸石风化物中氮、磷、钾等养分含量,增加复垦土壤微生物数量。王尚义等[18]研究发现,紫穗槐-高羊茅-紫花苜蓿模式有利于矸石山土壤碱解氮的积累;高羊茅-紫花苜蓿模式对土壤速效钾和有机质的改良效果最佳;紫花苜蓿盖度与土壤中的碱解氮、速效钾和有机质含量呈显著正相关。但是目前,煤矸石填埋区复垦土壤真菌多样性对不同植物的响应机制如何目前尚不明确。
本研究主要以山西省古交市屯兰矿区煤矸石填埋区为研究对象,利用高通量测序技术分析复垦土壤真菌多样性对不同植物的响应特征,以期为未来的矿区复垦与生态重建工作提供理论基础。
1 材料和方法
1.1 试验区概况
试验区位于山西省古交市屯兰矿区。该区于2014年复垦为农田,年平均气温约9.5 ℃;年平均降水量约460 mm,降水量大多集中在7,8月;无霜期约105 d,为温带大陆性气候。2018年5月在试验区种植不同乡土作物与绿肥植物,分别为玉米(Maize, M)、大豆(Soybean, S)、毛苕子(Hair-vetch, H)、苜蓿(Alfalfa,A)及自然恢复(Natural restoration,NR)。依据复垦区域面积,种植大豆、苜蓿各0.033 hm2,毛苕子0.066 hm2,玉米0.20 hm2,自然恢复区0.20 hm2,种植前所有种植区均进行有机无机肥配施,有机肥中有机质含量为53.48%,氮含量为2.2%,无机肥中养分含量为N∶P2O5∶K2O=18%∶12%∶10%,有机肥与无机肥均按照等氮量75 kg/hm2人工撒播施入;株距×行距为30 cm×55 cm;苜蓿、毛苕子均按照地垄撒播。
1.2 试验材料
供试玉米品种为金苹618,大豆品种为晋豆21。
1.3 土样采集
于2018年9月26日在作物收获后,利用土钻按照对角线法采集不同植物种植下0~20 cm的复垦土壤样品。每个处理3次重复,将采集的土样混合均匀,放入灭菌袋,密封后(4 ℃保温箱)带回室内进行养分与微生物试验;同时,未能及时进行微生物培养试验的土样放在-80 ℃冰箱冷冻保存。
1.4 测定项目及方法
土壤有机质、全氮、全磷、碱解氮、速效磷和有效钾含量,参照文献[19]进行测定。高通量测序是由上海派森诺生物公司对矿区复垦土壤进行微生物组DNA提取,目标片段PCR扩增、产物回收纯化、荧光定量等,利用MiSeq测序仪对不同植物种植下矿区复垦土壤真菌的可操作分类单元(Operational Taxonomic Unit, OTU)进行测定。
1.5 数据处理
采用SPSS 23.0对土壤养分、Alpha多样性指数进行方差分析;利用Canoco 5.0软件对土壤真菌属与养分进行RDA冗余分析;利用R软件对土壤真菌群落进行Lefse分析。
2 结果与分析
2.1 不同植物种植下复垦土壤真菌OTU单元分析
从图1可以看出,不同植物种植下复垦土壤中共有的OTU单元数量为67个;特有的OTU单元,大豆地最多,为227个;苜蓿地最少,为136个。 种植植物后土壤中OTU单元数量为514~732个,其中种植大豆后复垦土壤中OTU单元总量最多,为732个;而自然恢复下最少,仅为439个。
2.2 不同植物种植下土壤真菌门、属特征分析
从图2 可以看出,煤矸石填埋区复垦土壤中真菌门主要有子囊菌门(Ascomycota)、接合菌门(Zygomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、丝足虫类(Cercozoa)、纤毛门(Ciliophora)、球囊菌门 (Glomeromycota)、隐真菌门(Rozellomycota)和Anthophyta。其中,相对丰度大于5%的真菌门主要有子囊菌门(Ascomycota)、接合菌门(Zygomycota)和担子菌门(Basidiomycota)。不同复垦区土壤中,子囊菌门在自然恢复下相对丰度最小,为36%,而在种植玉米、大豆、苜蓿和毛苕子后其相对丰度均在65%以上,且以种植毛苕子处理增幅最大;接合菌门在自然恢复下相对丰度最大,种植植物后降低了接合菌门的相对丰度,且以种植毛苕子后降幅最大,种植玉米降幅最小;种植毛苕子后土壤中担子菌门相对丰度最小。
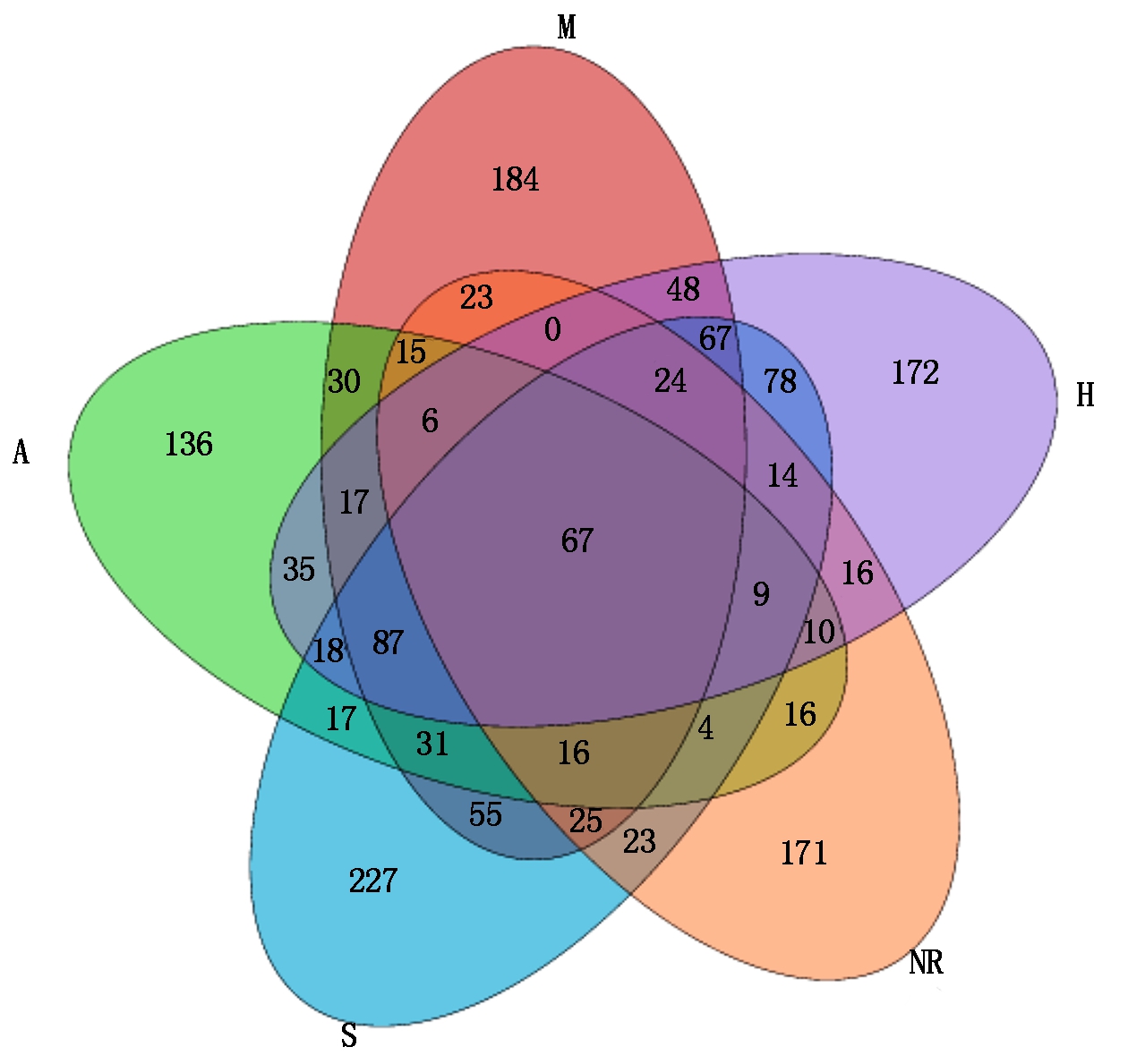
图1 不同植物种植下复垦土壤真菌OTU单元关系
Fig.1 Relation of OTU in reclaimed soil fungi under different plants
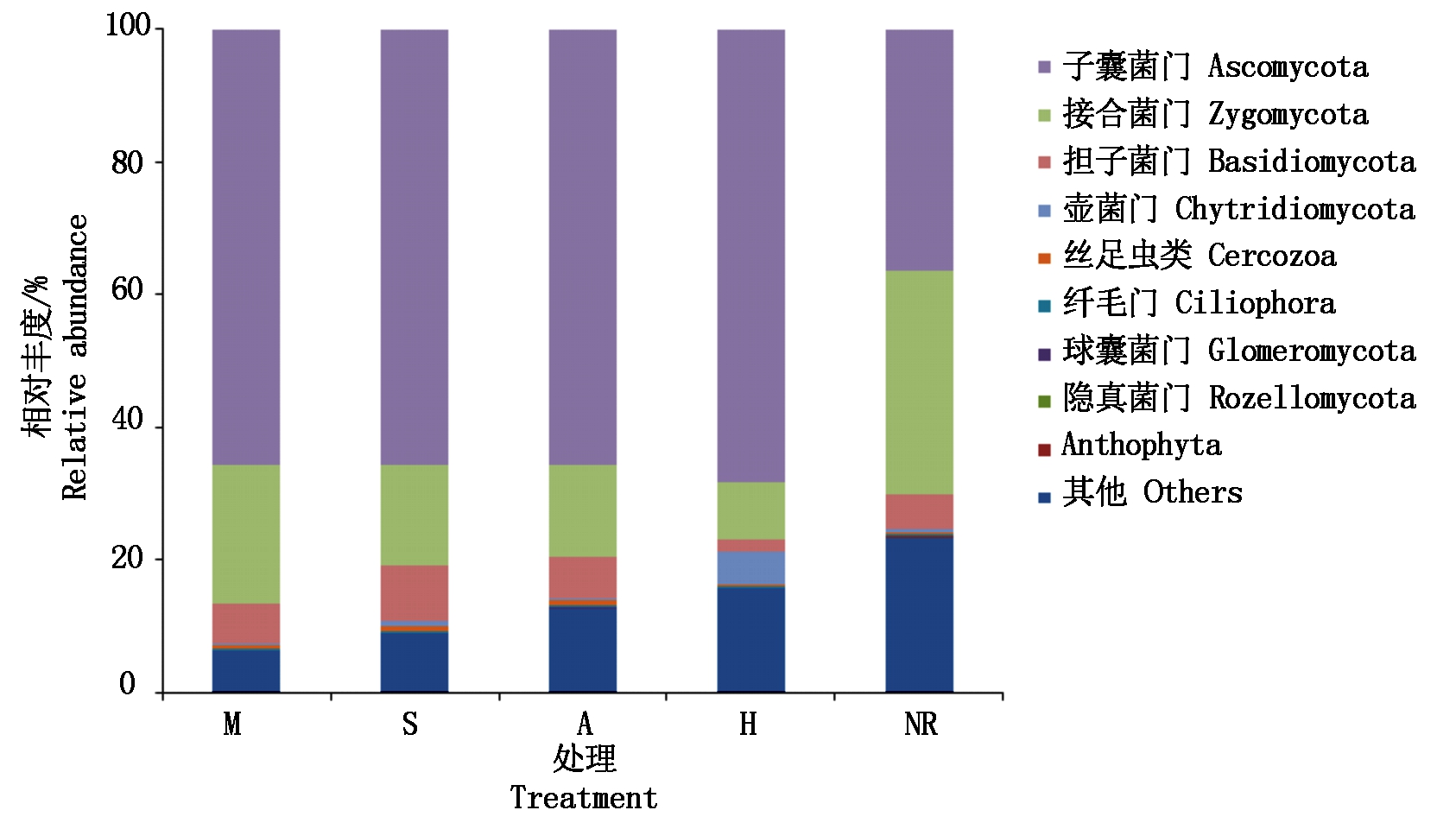
图2 不同植物种植下复垦土壤真菌门特征
Fig.2 Characteristics of fungi phylum in reclaimed soil under different plant cultivation
从图3 可以看出,煤矸石填埋区复垦土壤中相对丰度较高的前20种属分别为被孢霉属(Mortierella)、角单菌属(Ceratobasiduim)、赤霉属(Gibberella)、腐质霉属(Humicola)、短梗霉属(Aureobasidium)、漆斑菌属(Myrothecium)、镰孢菌属(Fusarium)、假裸囊菌属(Pseudogymnoascus)、念珠菌属(Candida)、枝顶孢霉属(Acremonium)、根霉属(Rhizopus)、毛壳属(Chaetomium)、布勒掷孢酵母属(Bullera)、Olpidiaster属、曲霉菌属(Aspergillus)、青霉菌属(Penicillium)、光黑壳属(Preussia)、块菌属(Tuber)、囊根壶菌属(Rhizophlyctis)、Knufia。其中,被孢霉属的相对丰度均大于8%,且自然恢复下其相对丰度最大,为33.6%。人工种植植物降低了其丰度值,种植玉米相对丰度为20.9%,相对于自然恢复降幅最小,苜蓿相对丰度为8.38%,降幅最大。
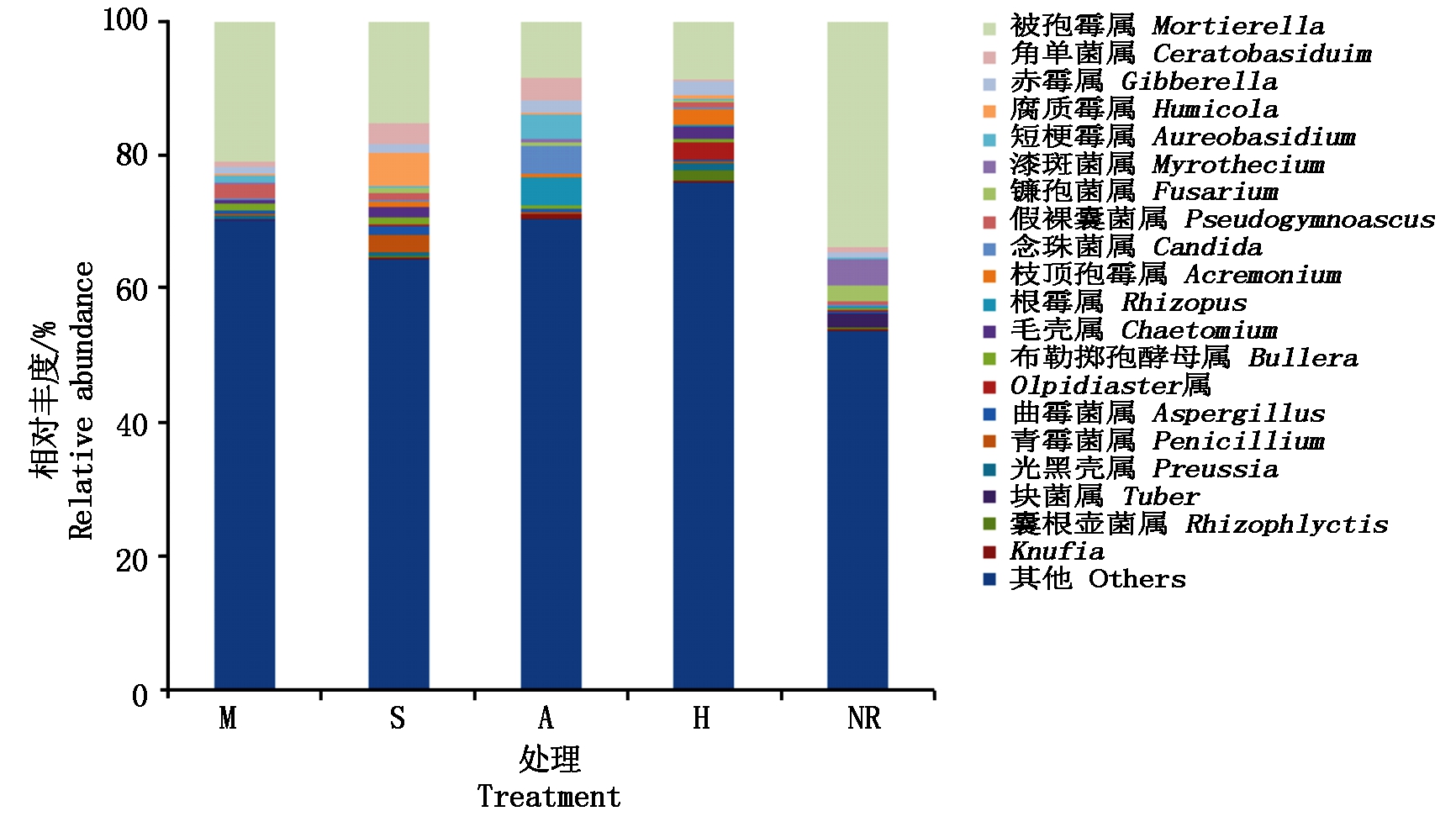
图3 不同植物种植下复垦土壤真菌属特征
Fig.3 Characteristics of fungi genera in reclaimed soil under different plant cultivation
2.3 不同植物种植下土壤真菌Alpha多样性分析
从表1可以看出,不同植物种植下土壤真菌多样性指标Simpson指数、Shannon指数、ACE指数与Chao1指数均值均大于自然恢复。对于Simpson指数,种植大豆后最大,且自然恢复与不同植物种植间差异显著(P<0.05);Shannon指数在种植大豆和玉米后较大,二者差异不显著,但均显著高于自然恢复(P<0.05);Chao1指数与ACE指数均为种植毛苕子后最大,与种植玉米和大豆处理不显著,但均显著高于自然恢复(P<0.05)。说明相对于自然恢复,种植植物可以增加煤矸石填埋区复垦土壤中的真菌多样性。
表1 不同植物种植下复垦土壤中真菌多样性指数分析
Tab.1 α-diversity index of fungi in reclaimed soil under different plant cultivation
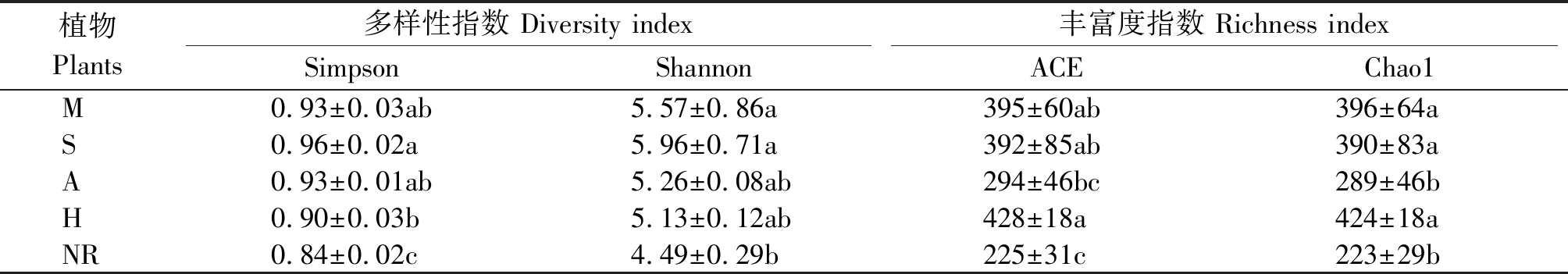
植物Plants多样性指数 Diversity index丰富度指数 Richness indexSimpsonShannonACEChao1M0.93±0.03ab5.57±0.86a395±60ab396±64aS0.96±0.02a5.96±0.71a392±85ab390±83aA0.93±0.01ab5.26±0.08ab294±46bc289±46bH0.90±0.03b5.13±0.12ab428±18a424±18aNR0.84±0.02c4.49±0.29b225±31c223±29b
注:同列数值后不同小写字母表示处理间差异达显著水平(P<0.05)。
Note:Values followed by different letters in a row are significant among treatments at the 0.05 level.
2.4 不同植物种植下土壤真菌Beta多样性分析
本研究采用NMDS分析(Nonmetric Multidimensional Scaling)不同植物种植下土壤真菌Beta多样性。NMDS是通过降维处理简化数据结构,在新的低维坐标系中对样本重新排序,从而在特定距离尺度下描述样本的分布特征。该分析不受样本距离数值的影响,仅考虑彼此之间的大小关系,排序结果稳定。
从图4可以看出,NMDS1、NMDS2将自然恢复与植物种植相分离,自然恢复位于第1象限,玉米与大豆位于第2象限,毛苕子位于第3象限,苜蓿位于第4象限。说明4种不同植物种植中,种植大豆与玉米间差异不显著,但与毛苕子、苜蓿间差异显著;自然恢复与植物种植对煤矸石填埋区复垦土壤真菌组成及多样性影响达显著水平。
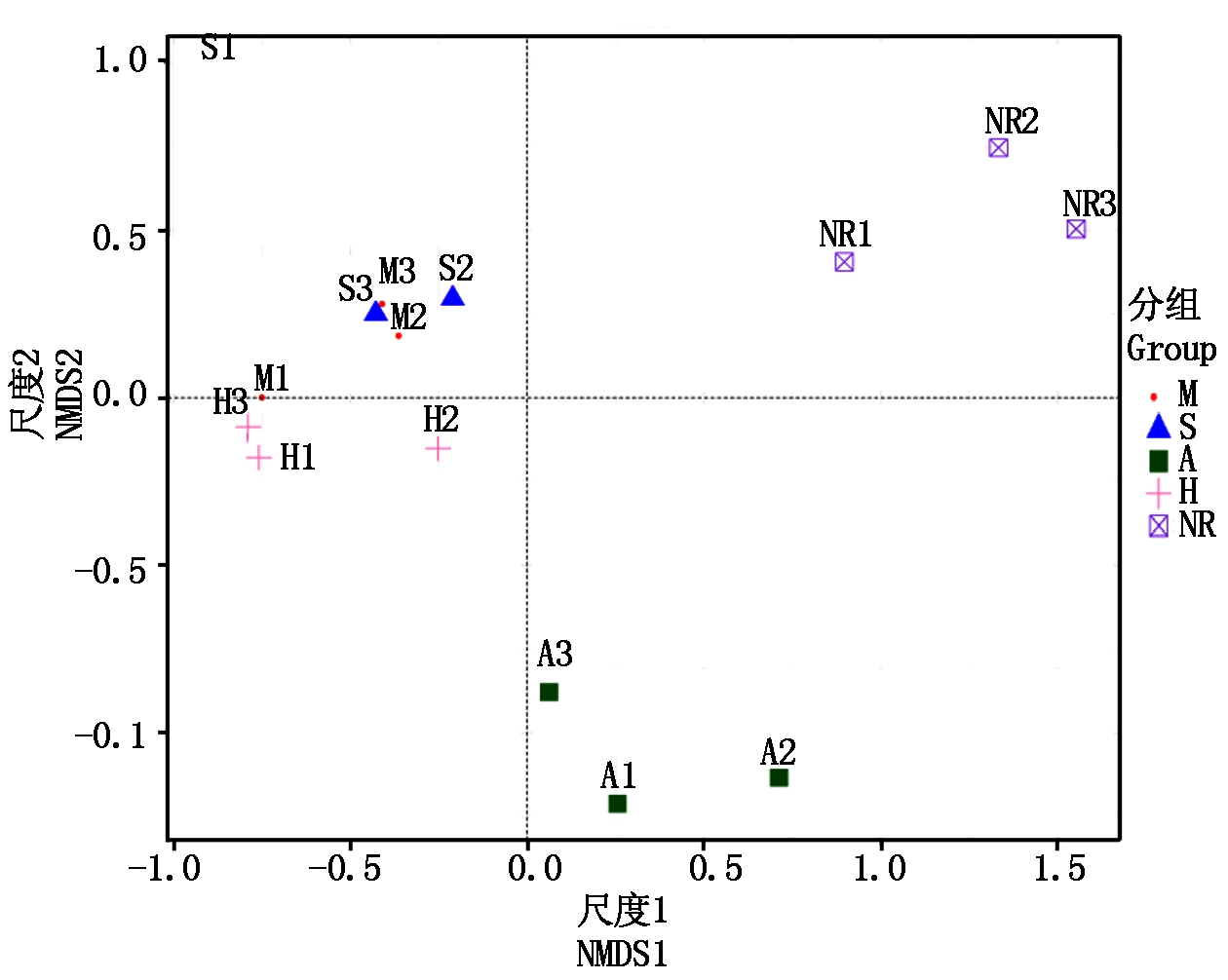
图4 不同植物种植下复垦土壤真菌NMDS分析
Fig.4 NMDS analysis of fungi in reclaimed soil under different plant cultivation
2.5 不同植物种植下土壤真菌多样性Lefse差异分析
从图5可以看出,不同植物种植下土壤中差异显著的真菌26种,包括1个纲,7个目,11个科,7个属;其中,差异显著的纲为子囊菌纲(Sordariomycetes),存在于种植大豆后复垦土壤中;差异显著的属在自然恢复土壤中包括被孢霉属(Mortierella)、漆斑菌属(Myrothecium)、埋核盘菌属(Pyrenopeziza) 3种,种植大豆后土壤中包括腐质霉属(Humicola)和粪盘菌属(Ascobolus)2种,种植玉米后土壤中有假裸囊菌属(Pseudogymnoascus) 1种,种植苜蓿后土壤中有支顶孢霉属(Acremonium)1种。
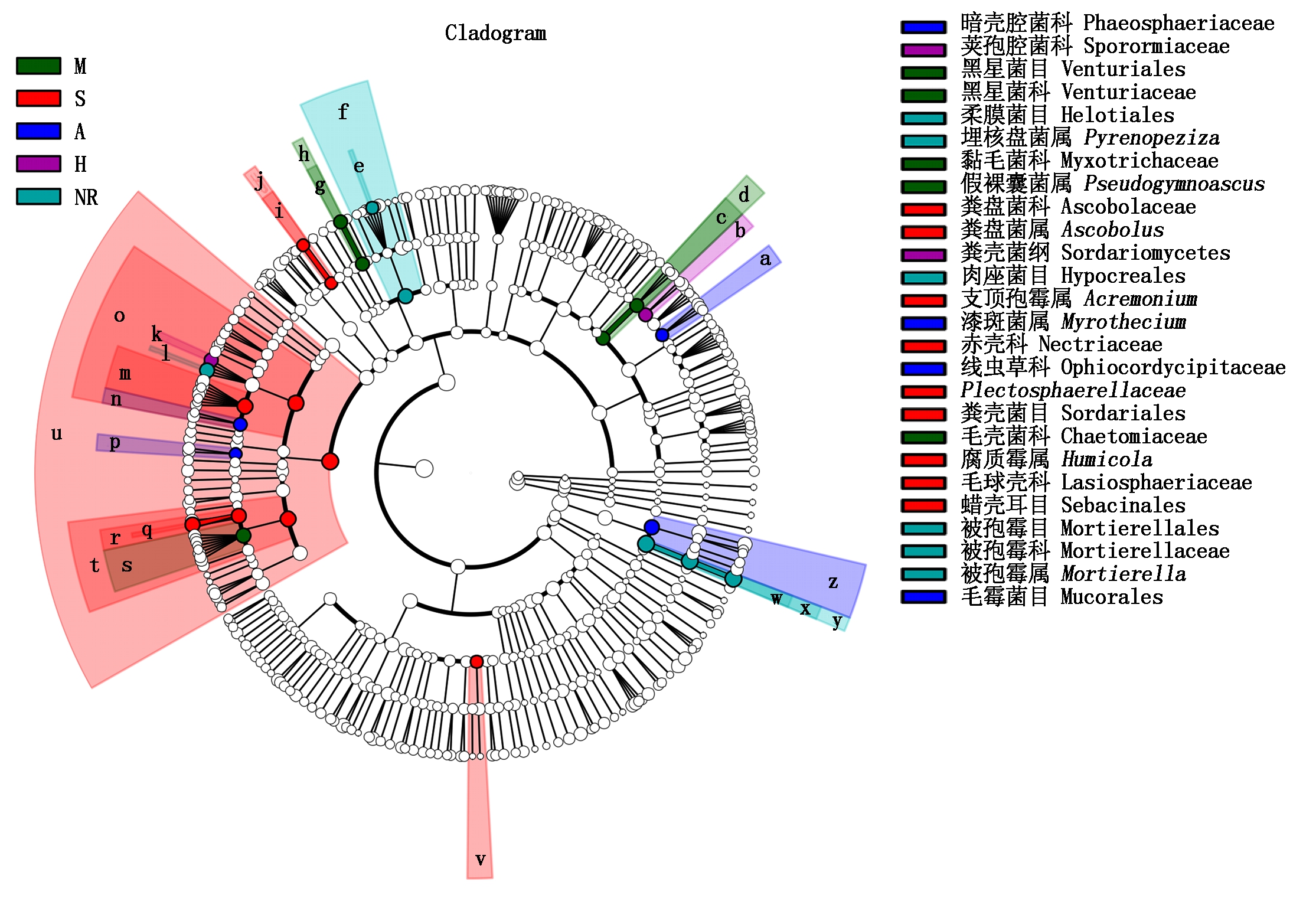
图5 不同植物种植下复垦土壤真菌分类单元差异
Fig.5 Difference of fungal taxa in reclaimed soil under different plant cultivation
2.6 土壤真菌丰度与土壤养分含量RDA分析
从表2可以看出,不同植物种植下复垦土壤养分含量不同,除全钾、全磷外,土壤中养分均为自然恢复最低;不同植物种植下土壤中全氮、有机质和碱解氮含量间存在显著差异(P<0.05),均为自然恢复最低,毛苕子下最高。
表2 不同植物种植下复垦土壤养分
Tab.2 Nutrients of reclaimed soil under different plant cultivation
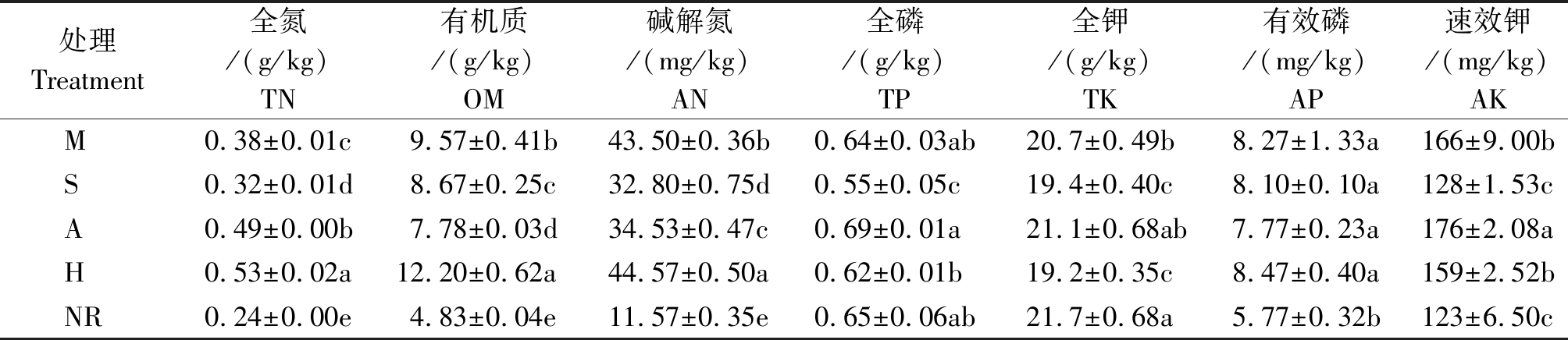
处理Treatment全氮/(g/kg)TN有机质/(g/kg) OM碱解氮/(mg/kg)AN全磷/(g/kg)TP全钾/(g/kg)TK有效磷/(mg/kg) AP速效钾/(mg/kg) AKM0.38±0.01c9.57±0.41b43.50±0.36b0.64±0.03ab20.7±0.49b8.27±1.33a166±9.00bS0.32±0.01d8.67±0.25c32.80±0.75d0.55±0.05c19.4±0.40c8.10±0.10a128±1.53cA0.49±0.00b7.78±0.03d34.53±0.47c0.69±0.01a21.1±0.68ab7.77±0.23a176±2.08aH0.53±0.02a12.20±0.62a44.57±0.50a0.62±0.01b19.2±0.35c8.47±0.40a159±2.52bNR0.24±0.00e4.83±0.04e11.57±0.35e0.65±0.06ab21.7±0.68a5.77±0.32b123±6.50c
利用Canoco软件对土壤中前50种真菌属丰度与土壤养分含量进行RDA分析。从图6、表3可以看出,RDA1与RDA2分别可以解释33.7%,9.54%,土壤真菌属的相对丰度受到土壤中全氮、碱解氮和全磷的影响显著,全氮、碱解氮和全磷的贡献率分别为38.6%,17.9%,14.6%。
表3 真菌属丰度与土壤养分含量的RDA分析结果
Tab.3 RDA results of fungi abundance and soil nutrient content
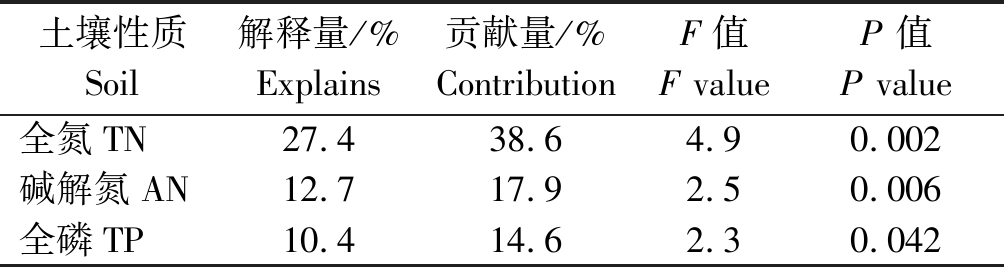
土壤性质Soil解释量/%Explains贡献量/%ContributionF值F valueP 值P value全氮TN27.438.64.90.002碱解氮AN12.717.92.50.006全磷TP10.414.62.30.042
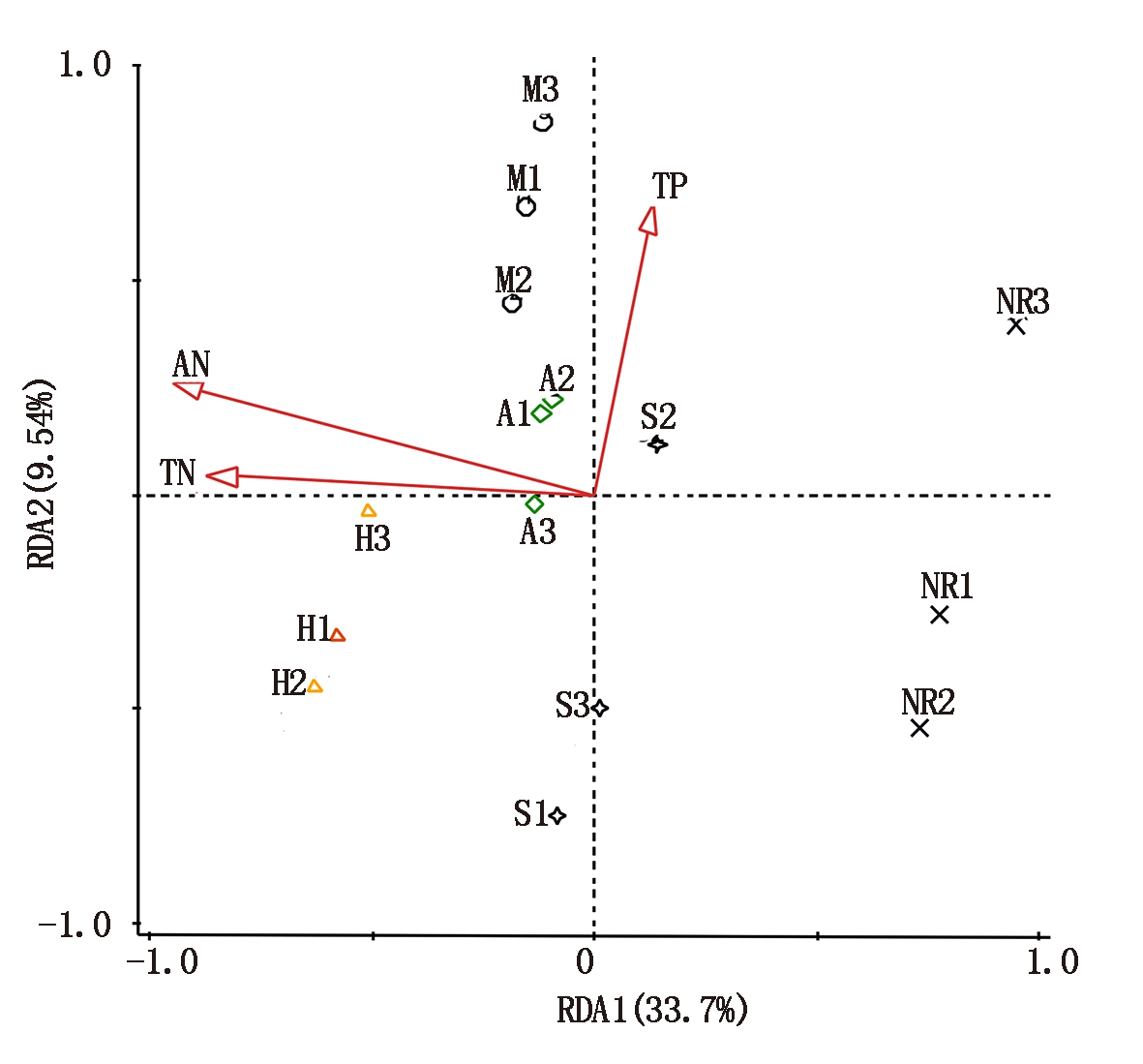
图6 不同植物种植下复垦土壤真菌RDA分析
Fig.6 RDA of reclaimed soil under different plant cultivation
3 结论与讨论
3.1 讨论
3.1.1 种植植物影响复垦土壤真菌多样性分析 土壤真菌数量巨大,种类繁多,是评价土壤质量变化、土壤生态系统等功能方面有着重要作用[20]。微生物多样性指数是评价土壤微生物群落多样性的有效方法,多样性指数高表明微生物群落多样性就高[21]。刘淑霞等[22]研究表明,土壤扰动和施肥能降低土壤真菌的多样性。而本研究发现,自然恢复下土壤真菌多样性指数最低,种植不同作物下的土壤真菌多样性较高,说明种植植物可以促进复垦土壤真菌的生长,有利于改善复垦土壤真菌多样性。同时,结果也表明,种植毛苕子下的Chao1指数与ACE指数较高,大豆下的Shannon指数与Simpson指数较高,该结果与Liu等[23]的研究结果类似。 原因可能是由于不同作物的根系分泌物不同[24-27],从而引起其土壤真菌微生物的物种多样性与丰富度指数产生差异,导致土壤真菌群落结构不同,真菌功能多样性发生变化。
3.1.2 植物种类影响复垦土壤群落结构分析 真菌群落结构对土壤生态系统平衡有重要作用。土壤特性和作物根系分泌物等对真菌群落结构及多样性的影响较大。本研究表明,不同植物种植下复垦土壤中的真菌差异显著的真菌纲、目、科、属共有26种,可能是由于禾本科植物与豆科植物根系不同的分泌物会促生或抑制土壤中某些真菌微生物,进而使不同植物下土壤中的微生物产生差异。子囊菌门大多为腐生菌,是土壤中重要的分解者[28],可分解难降解的有机质,在养分循环方面起着重要作用[29]。本研究结果表明,复垦土壤中子囊菌门相对丰度最大,为优势真菌门,在植物种植下占比均达65%以上,远高于自然恢复下的36%,说明种植植物相较于自然恢复有利于有益真菌门(子囊菌门)的增加。本研究中,被孢霉属的含量均大于8%,为该复垦土壤中的优势属。被孢霉属是一种具有较强分解纤维素能力的真菌,且接合菌门类下的被孢霉属为对土壤有益的微生物[30]。本研究中,被孢霉属均来自接合菌门,且被孢霉属在自然恢复土壤中占比最大,为33.6%,种植植物后土壤中被孢霉属丰度降低,种植玉米后土壤中被孢霉属占20.9%,降幅最小,说明种植植物会抑制该复垦土壤中被孢霉属的生长。
3.1.3 复垦土壤养分与真菌群落多样性的关系 土壤养分与真菌群落结构和多样性有着密切联系。Hazard等[31]研究表明,土壤有机质等对土壤真菌群落结构会产生重要影响。Bastian 等[32]研究认为,土壤有机质是影响农田土壤真菌群落主要的驱动者。高玉峰等[33]研究表明,土壤碱解氮含量的高低会影响土壤真菌的种类和数量。 milauer等[34]研究认为,土壤磷与真菌群落结构或多样性相关性不大。由此可见,不同学者在不同研究区研究得出的结论有所差异。而本研究通过RDA分析,结果表明,全氮、全磷、碱解氮对复垦土壤真菌群落结构的影响显著。这可能与试验区所在地理位置、土壤、气候等因素有关,具体原因还有待进一步深入研究。
milauer等[34]研究认为,土壤磷与真菌群落结构或多样性相关性不大。由此可见,不同学者在不同研究区研究得出的结论有所差异。而本研究通过RDA分析,结果表明,全氮、全磷、碱解氮对复垦土壤真菌群落结构的影响显著。这可能与试验区所在地理位置、土壤、气候等因素有关,具体原因还有待进一步深入研究。
3.2 结论
综上,煤矸石填埋区复垦土壤真菌多样性在植物种植与自然恢复间差异较大,植物种植下土壤多样性指数、丰富度指数均高于自然恢复,植物种植相较于自然恢复提高了土壤中子囊菌门的相对丰度,但降低了被孢霉属的相对丰度,且不同植物种植下土壤中有不同的优势真菌属,土壤中全氮、全磷和碱解氮含量是导致煤矸石填埋区土壤真菌群落结构和多样性变化的主要驱动因素。
[1] Altieri M A. The ecological role of biodiversity in agroecosystems[J]. Agriculture Ecosystem Environment, 1999, 74(1-3):19-31.doi:10.1016/S0167-8809(99)00028-6.
[2] 赵吉, 廖仰南. 羊草草原分解者亚系统的特性及作用[J]. 生态学报, 1995,15(4): 359-364.
Zhao J, Liao Y N. Characteristics and function of decomposer subsystem in Leymus chinesis steppe[J]. Acta Ecologica Sinica, 1995,15(4): 359-364.
[3] 王芳, 图力古尔. 土壤真菌多样性研究进展[J]. 菌物研究, 2014, 12(3): 178-186. doi:10.13341/j.jfr.2014.0034.
Wang F, Bau T. Research advances in the diversity of soil fungi[J]. Journal of Fungal Research, 2014,12(3):178-186.
[4] Duponnois R, Colombet A, Hien V, Thioulouse J.The mycorrhizal fungus Glomus intraradices and rock phosphate amendment influence plant growth and microbial activity in the rhizosphere of Acacia holosericea[J]. Soil Biol Biochem, 2005,37(8):1460-1468.doi:10.1016/j.soilbio.2004.09.016.
[5] Nadeem S M, Ahmad M, Zahir Z A, Javaid A, Ashraf M. The role of mycorrhizae and plant growth promoting rhizobacteria (PGPR) in improving crop productivity under stressful environments[J]. Biotechnol Adv, 2014,32(2):429-448.doi:10.1016/j.biotechadv.2013.12.005.
[6] Ciccolini V, Bonari E, Pellegrino E. Land-use intensity and soil properties shape the composition of fungal communities in Mediterranean peaty soils drained for agricultural purposes[J]. Biology and Fertility of Soils, 2015, 51(6): 719-731. doi:10.1007/s00374-015-1013-4.
[7] Yang Y, Dou Y X, Huang Y M, An S S. Links between soil fungal diversity and plant and soil properties on the Loess Plateau[J]. Frontiers in Microbiology, 2017,8: 2198.doi:10.3389/fmicb.2017.02198.
[8] Yang T, Adams J M, Shi Y, He J S, Jing X, Chen L T, Tedersoo L, Chu H Y. Soil fungal diversity in natural grasslands of the Tibetan Plateau: associations with plant diversity and productivity[J].New Phytol,2017,215(2):756-765.doi:10.1111/nph.14606.
[9] Li P, Li Y C, Zheng X Q, Ding L N, Ming F, Pan A H, Lü W G, Tang X M. Rice straw decomposition affects diversity and dynamics of soil fungal community, but not bacteria[J]. Journal of Soils Sediments, 2018,18:248-258. doi:10.1007/s11368-017-1749-6.
[10] 丁建莉.长期施肥对黑土微生物群落结构及其碳代谢的影响[D].北京:中国农业科学院, 2017.
Ding J L.Black soil microbial community structure and carbon metabolism in response to long-term fertilization[D].Beijing: Chinese Academy of Agricultural Sciences,2017.
[11] Wang Y, Xu J, Shen J H, Luo Y M, Scheu S, Ke X. Tillage, residue burning and crop rotation alter soil fungal community and water-stable aggregation in arable fields[J].Soil and Tillage Research, 2010,107(2):71-79. doi:10.1016/j.still.2010.02.008.
[12] Dong W Y, Liu E K, Yan C R, Zhang H H, Zhang Y Q. Changes in the composition and diversity of topsoil bacterial, archaeal and fungal communities after 22 years conventional and no-tillage managements in Northern China[J].Archives of Agronomy and Soil Science, 2017, 63(10): 1369-1381. doi:10.1080/03650340.2017.1281392.
[13] 范继香,郜春花,卢朝东,张强,靳东升,李建华.矿区土壤微生物多样性研究概述[J].山西农业科学,2010,38(3):55-58.doi:10.3969/j.issn.1002-2481.2010.03.17.
Fan J X, Gao C H,Lu C D,Zhang Q,Jin D S,Li J H. Review on mine soil microorganism diversity research[J]. Journal of Shanxi Agricultural Sciences,2010,38(3):55-58.
[14] 李建华,李华,郜春花,张强,靳东升,卢晋晶.长期施肥对晋东南矿区复垦土壤团聚体稳定性及有机碳分布的影响[J].华北农学报,2018,33(5):188-194. doi:10.7668/hbnxb.2018.05.026.
Li J H, Li H, Gao C H, Zhang Q, Jin D S, Lu J J. Effects of long-term fertilization on reclaimed soil aggregate stability and distribution of carbon in the Southeastern Shanxi mining area[J]. Acta Agriculturae Boreali-Sinica,2018,33(5):188-194.
[15] 魏俊杰,洪坚平.无机有机肥配施生物炭对复垦土壤酶活性以及磷形态的影响[J].华北农学报,2019,34(6):170-176.doi:10.7668/hbnxb.20190240.
Wei J J, Hong J P. Effect of inorganic organic fertilizer combined with biochar on enzyme activity and phosphorus forms in reclaimed soil[J]. Acta Agriculturae Boreali-Sinica,2019,34(6):170-176.
[16] 金志南,吕能慧,冯金生,李德中,洪坚平.种草在复垦种植系统工程中的效益[J].山西农业大学学报,1990(2):143-146,186.doi:10.13842/j.cnki.issn1671-8151.1990.02.009.
Jin Z N, Lü N H, Feng J S, Li D Z, Hong J P. Role of growing grasses in reclamation system engineering[J].Journal of Shanxi Agricultural University,1990(2):143-146,186.
[17] 洪坚平,谢英荷,林大仪,金志南,赵景逵.绿肥牧草对矸石山生态环境的改善[J].农村生态环境,1996,12(4):55-57,62.
Hong J P, Xie Y H, Lin D Y, Jin Z N, Zhao J K. The roles of green manure forage grass in the improvement of ecological environment of coal gangue hills[J]. Rural Eco-Environment,1996,12(4):55-57,62.
[18] 王尚义,石瑛,牛俊杰,樊兰英.煤矸石山不同植被恢复模式对土壤养分的影响:以山西省河东矿区1号煤矸石山为例[J].地理学报,2013,68(3):372-379. doi:10.11821/xb201303008.
Wang S Y, Shi Y, Niu J J, Fan L Y. Influence of vegetation restoration models on soil nutrient of coal gangue pile: a case study of No.1 coal gangue pile in Hedong, Shanxi[J]. Acta Geographica Sinica,2013,68(3):372-379.
[19] 鲍士旦.土壤农化分析[M].北京:中国农业出版社,2000.
Bao S D.Soil analysis in agricultural chemistry[M].Beijing:China Agriculture Press,2000.
[20] 任玉连,范方喜,彭淑娴,陆梅.纳帕海沼泽化草甸不同季节土壤真菌群落结构与理化性质的关系[J].中国农学通报,2018,34(29):69-75.doi:10.11924/j.issn.1000-6850.casb17080110.
Ren Y L, Fan F X, Peng S X, Lu M. Relationship between soil fungal community structure and physical and chemical properties of different seasons swamp meadow in Napahai Wetland[J]. Chinese Agricultural Science Bulletin,2018,34(29):69-75.
[21] 徐雪雪,王东,秦舒浩,张俊莲,贾丽琴.沟垄覆膜连作马铃薯根际土壤真菌多样性分析[J].水土保持学报,2015,29(6):301-306,310. doi:10.13870/j.cnki.stbcxb.2015.06.053.
Xu X X, Wang D,Qin S H,Zhang J L, Jia L Q. Diversity analysis of fungal communities in potato continuous cropping soil under different patterns of ridge-furrow film mulching[J].Journal of Soil and Water Conservation,2015,29(6):301-306,310.
[22] 刘淑霞,周平,赵兰坡,史铭儡,李玉,秦治家. 吉林黑土区玉米田土壤真菌的多样性[J]. 东北林业大学学报,2008,36(7):42-46.doi:10.3969/j.issn.1000-5382.2008.07.017.
Liu S X, Zhou P, Zhao L P,Shi M L, Li Y, Qin Z J. Diversity of soil fungi in black soil planted with corn in Jilin Province[J].Journal of Northeast forestry University, 2008,36(7):42-46.
[23] Liu X Y, Lindemann W C, Whitfords W G, Steiner R L. Microbial diversity and activity of disturbed soil in the Northern Chihuahuan Desert[J]. Biology and Fertility of Soils,2000,32(3):243-249.doi:10.1007/s003740000242.
[24] Chen M N, Li X, Yang Q L, Chi X Y, Pan L J, Chen N, Yang Z, Wang T, Wang M, Yu S L. Dynamic succession of soil bacterial community during continuous cropping of peanut (Arachis hypogaea L.)[J]. PLoS One, 2014,9:e101355. doi:10.1371/journal.pone.0101355.
[25] Nayyar A, Hamel C, Lafond G, Gossen B D, Hanson K, Germida J. Soil microbial quality associated with yield reduction in continuous-pea[J].Appl Soil Ecol, 2009,43(1): 115-121.doi:10.1016/j.apsoil.2009.06.008.
[26] Harch B D, Correll R L, Meech W, Kirkby C A, Pankhurst C E. Using the Gini coefficient with Biolog substrate utilization data to provide an alternative quantitative measure for comparing bacterial soil communities[J]. Journal of Microbiological Methods,1997,30(1):91-101.doi:10.1016/S0167-7012(97)00048-1.
[27] 张恩平, 田悦悦, 李猛, 时毛,蒋雨含,任如冰,张淑红. 长期不同施肥对番茄根际土壤微生物功能多样性的影响[J]. 生态学报,2018,38(14):5027-5036. doi:10.5846/stxb201705030816.
Zhang E P,Tian Y Y, Li M, Shi M, Jiang Y H, Ren R B, Zhang S H. Effects of various long-term fertilization regimes on soil microbial functional diversity in tomato rhizosphere soil[J].Acta Ecologica Sinica,2018,38(14): 5027-5036.
[28] Yelle D J, Ralph J, Lu F C, Hammel K E. Evidence for cleavage of lignin by a brown rot basidiomycete[J].Environmental Microbiology,2008,10(7):1844-1849. doi:10.1111/j.1462-2920.2008.01605.x.
[29] Beimforde C, Feldberg K, Nylinder S, Rikkinen J, Tuovila H, Dörfelt H, Gube M, Jacksen D J, Reitner J, Seyfullah L J, Schmidt A R. Estimating the phanerozoic history of the ascomycota lineages: combining fossil and molecular data[J]. Molecular Phylogenetics and Evolution, 2014, 78: 386-398. doi:10.1016/j.ympev.2014.04.024.
[30] Goto B T, Maia L C. Glomerospores: a new denomination for the spores of glomeromycota,a group molecularly distinct from the Zygomycota[J]. Mycotaxon,2006,96:129-132.doi:10.1007/S11046-005-0224-x.
[31] Hazard C, Gosling P, van der Gast C, Mitchell D T, Doohan F M, Bending G D. The role of local environment and geographical distance in determining community composition of arbuscular mycorrhizal fungi at the landscape scale[J]. The ISME Journal, 2013, 7(3): 498-508. doi:10.1038/ismej.2012.127.
[32] Bastian F, Bouziri L, Nicolardot B, Ranjard L. Impact of wheat straw decomposition on successional patterns of soil microbial community structure[J].Soil Biol Biochem,2009,41(2): 262-275. doi:10.1016/j.soilbio.2008.10.024.
[33] 高玉峰,贺字典. 影响土壤真菌多样性的土壤因素[J].中国农学通报,2010, 26(10): 177-181.
Gao Y F, He Z D. Study on soils effect factors to fungi diversity in Hebei Province[J]. Chinese Agricultural Science Bulletin,2010, 26(10): 177-181.
[34]  milauer P. Communities of arbuscular mycorrhizal fungi in grassland: seasonal variability and effects of environment and host plants[J]. Folia Geobotanica, 2001, 36(3): 243-263.doi:10.1007/BF02803179.
milauer P. Communities of arbuscular mycorrhizal fungi in grassland: seasonal variability and effects of environment and host plants[J]. Folia Geobotanica, 2001, 36(3): 243-263.doi:10.1007/BF02803179.
