土壤盐渍化是严重影响农业生产的一个全球性的问题,直接影响农作物的产量和质量[1-2]。黄瓜(Cucumis sativus L.)作为主要的设施蔬菜之一,其对盐胁迫抗性较弱,发芽期和幼苗期对盐胁迫尤其敏感,盐会导致其产生渗透胁迫和离子毒害,引起养分亏缺、氧化胁迫、光合作用抑制及关键酶活性和基因表达变化、生物膜的正常结构和功能变化等一系列次生胁迫[3-5],最终抑制其种子萌发及植株生长。研究黄瓜耐盐机制对提高农作物的耐盐性具有重要的参考价值。
硫化氢(H2S)是一种植物内源性气体信号分子,其与植物激素及信号分子相互作用,在植物生长发育的调控及非生物胁迫的响应中发挥着重要作用[6]。信号分子H2S对植物盐胁迫的伤害具有缓解作用,在抵御植物盐害中发挥着重要作用[7-9]。外源H2S能有效缓解加工番茄种子萌发过程中盐胁迫的抑制作用,促进种子的萌发[10]。外源H2S能够通过提高盐胁迫下茶树和水稻的抗氧化水平来降低活性氧(Reactive oxygen species, ROS)的积累,减轻膜脂过氧化程度,从而缓解盐胁迫引起的氧化损伤[11-12]。外源H2S可能与一氧化氮(Nitric oxide,NO)相互作用减少氧化损伤来增强苜蓿种子萌发过程中抵御盐胁迫的能力[13]。外源H2S和过氧化氢(Hydrogen peroxide,H2O2)协同作用可以诱导增强NaCl胁迫下加工番茄幼苗植株渗透调节能力、提高清除ROS的酶促系统的防御能力,从而减弱加工番茄细胞内ROS自由基对质膜的伤害,进而提高加工番茄幼苗对盐胁迫的适应[14]。在前期研究中发现外源H2S能够通过提高黄瓜光合作用和蒸腾作用,有效改善光系统Ⅱ参数和气孔参数;增强抗氧化系统,降低活性氧的积累和膜质过氧化作用,调节细胞内Na+和K+的平衡稳定状态,从而有效缓解盐胁迫对黄瓜幼苗造成的生长抑制[15];然后利用蛋白质组学技术研究了外源H2S对高盐胁迫下黄瓜叶片蛋白质表达的影响,发现差异表达蛋白的分子功能主要以蛋白质结合和水解酶活性为主,生物学过程主要以应激反应、有机物代谢、胁迫响应和细胞分化过程等为主[16]。根系是浇灌胁迫作物最先感受逆境胁迫的器官,当根区受到胁迫时,根系首先感受到并发出信号。因此,本研究以春夏秋王黄瓜根系为试材,用NaCl、NaCl+H2S处理,采用高通量测序技术对其根系进行转录组学测序分析,以期探讨外源H2S调控黄瓜幼苗响应盐胁迫的机理,为H2S调控植物代谢,缓解高盐逆境障碍提供理论依据。
1 材料和方法
1.1 试验材料和处理
试验材料选用春夏秋王黄瓜种子(山东省宁阳县鲁明种子有限公司),处理方法参考蒋景龙等[17],待所有幼苗第1片真叶完全展开时,选取长势一致的幼苗分成3组,每组8个平行对照,分别用Hoagland营养液(CK)、200 mmol/L NaCl(T)和200 mmol/L NaCl+15 μmol/L NaHS(S)浇灌处理7 d。选取根系用液氮速冻,转移到-80 ℃冰箱内保存。
1.2 黄瓜根系总RNA提取及文库构建
黄瓜根系总RNA提取方法参照TRIzol Reagent方法进行。采用RNA专用琼脂糖电泳检测RNA的浓度和纯度。通过Oligo(dT)磁珠富集总RNA中带有polyA结构的mRNA,采用离子打断将RNA打断到200~300 bp。文库构建完成后,采用PCR扩增进行文库片段富集,文库大小在300~400 bp。通过Agilent 2100 Bioanalyzer检测文库大小,荧光定量检测文库总浓度。
1.3 转录组测序及分析
由上海派森诺公司完成测序,测序平台为Illumina HiSeq。样品上机测序获得的原始数据经进一步过滤,去除一些带接头、低质量的序列从而获得高质量序列。比对参考基因、基因表达差异分析、GO富集分析和KEGG富集分析参考文献[18]。
2 结果与分析
2.1 原始数据整理
如表1 所示,9个样本cDNA测序共获得原始序列365.35 Mb,原始序列经质控过滤后得到高质量序列 360.63 Mb,高质量序列碱基数共53.05 Gb,比对上参考基因组的序列总数为315.74 Mb,比例为86.27%~88.64%。Q30在87.65%以上,表明测序结果可靠,可用于后续的分析。
2.2 基因表达差异分析
通过DESeq对3组的差异表达基因分析结果用火山图(图1)展示。图中越靠近左边或右边的点表达差异越显著。结果显示,CK-T比较组共2 244个差异表达基因,其中上调表达基因有1 168个,下调表达基因有1 076个;T-S比较组共653个差异表达基因,其中上调表达基因有435个,下调表达基因有218个;CK-S比较组共1 696个差异表达基因,其中上调表达基因有757个,下调表达基因有939个。
表1 数据过滤和RNA-Seq Map统计
Tab.1 Data filtering and statistics of RNA-Seq Map
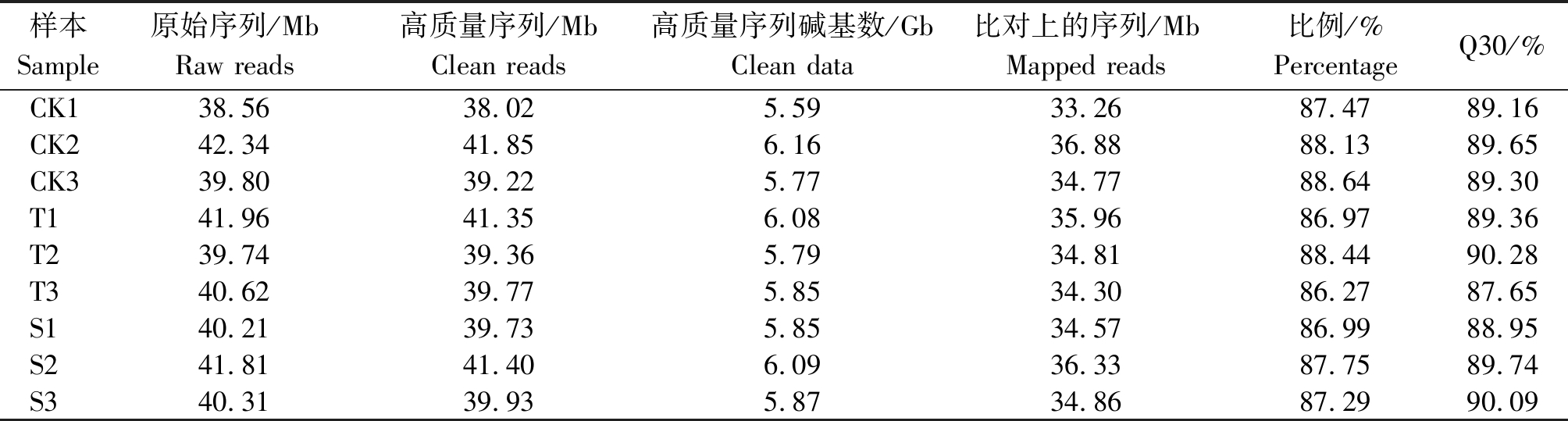
样本Sample原始序列/MbRaw reads高质量序列/MbClean reads高质量序列碱基数/GbClean data比对上的序列/MbMapped reads比例/%PercentageQ30/%CK138.56 38.02 5.59 33.26 87.4789.16CK242.34 41.85 6.16 36.88 88.1389.65CK339.80 39.22 5.77 34.77 88.6489.30T141.96 41.35 6.08 35.96 86.9789.36T239.74 39.36 5.79 34.81 88.4490.28T340.62 39.77 5.85 34.30 86.2787.65S140.21 39.73 5.85 34.57 86.9988.95S241.81 41.40 6.09 36.33 87.7589.74S340.31 39.93 5.87 34.86 87.2990.09
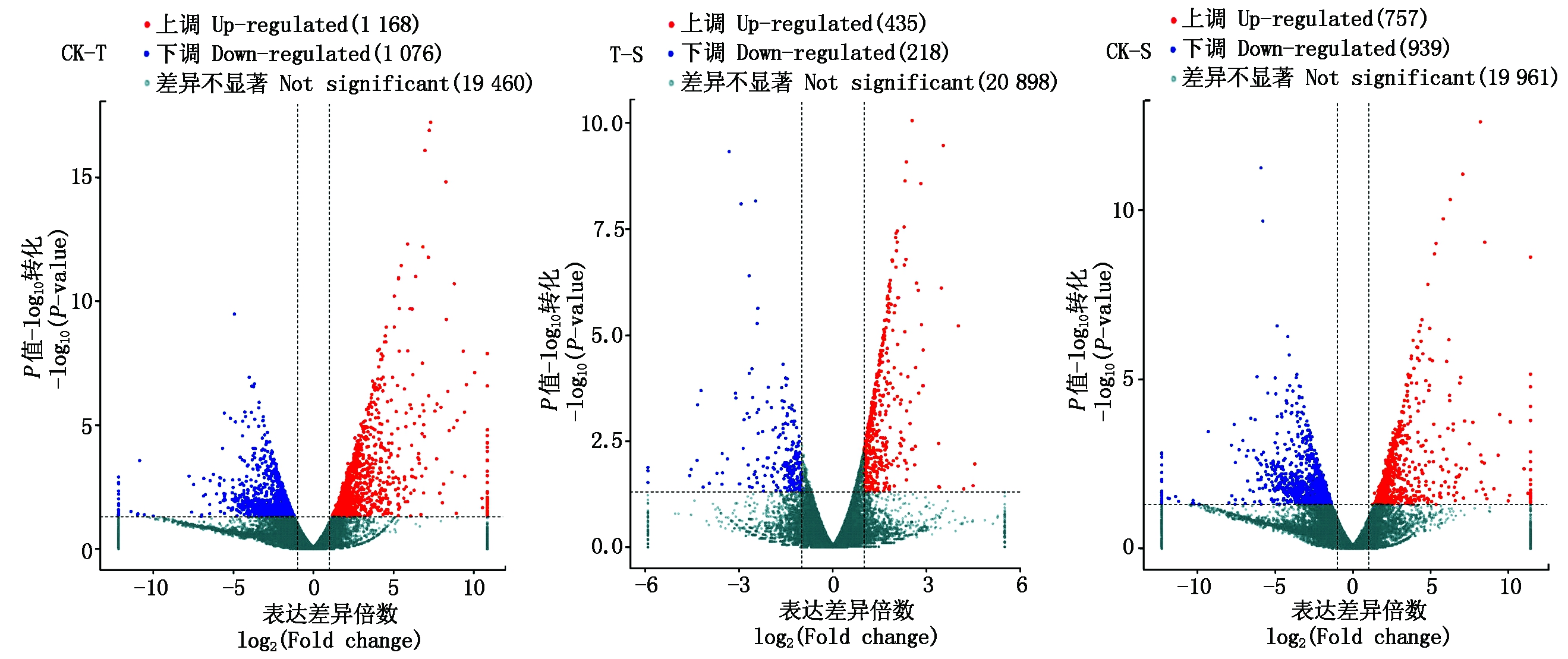
图1 黄瓜根系差异表达基因的火山图分析
Fig.1 Volcano gram analysis of differentially expressed genes in cucumber roots
将3个组差异表达基因绘制维恩图,寻找特有的和共有的差异表达基因。如图2所示,3个比较组一共有3 073个差异表达基因,其中CK-T、T-S和CK-S比较组特有的差异表达基因数分别为836,415,331个,共有的差异表达基因有29个,CK-T和T-S组共有的差异表达基因有155个。CK-T、T-S组共有的差异表达基因极有可能与H2S调控黄瓜响应盐胁迫的分子机制有关。筛选CK-T和T-S比较组共有差异表达基因中差异最显著的10个基因,由表2可见,在CK-T比较组中除了Csa_1G303700上调,其他均为下调,而在T-S比较组中均为上调。

图2 黄瓜根系差异表达基因的维恩图
Fig.2 Venn diagram of differentially expressed genes in cucumber roots
表2 CK-T和T-S组共有差异表达基因中Top10基因
Tab.2 CK-T and T-S groups share the 10 most significant differentially expressed genes
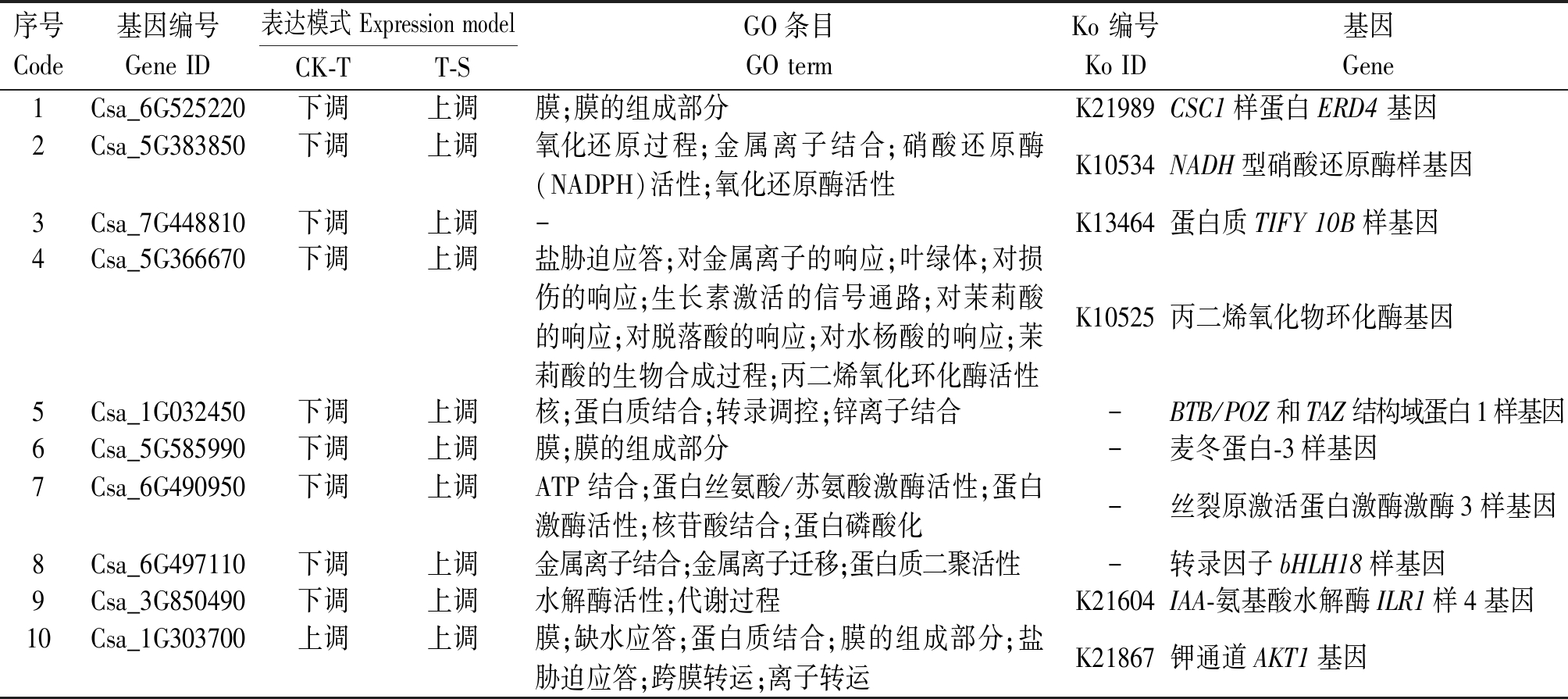
序号Code基因编号Gene ID表达模式 Expression modelCK-TT-SGO条目GO termKo 编号 Ko ID基因Gene1Csa_6G525220下调上调膜;膜的组成部分K21989CSC1样蛋白ERD4 基因2Csa_5G383850下调上调氧化还原过程;金属离子结合;硝酸还原酶(NADPH)活性;氧化还原酶活性K10534NADH型硝酸还原酶样基因3Csa_7G448810下调上调-K13464蛋白质TIFY 10B样基因4Csa_5G366670下调上调盐胁迫应答;对金属离子的响应;叶绿体;对损伤的响应;生长素激活的信号通路;对茉莉酸的响应;对脱落酸的响应;对水杨酸的响应;茉莉酸的生物合成过程;丙二烯氧化环化酶活性K10525丙二烯氧化物环化酶基因5Csa_1G032450下调上调核;蛋白质结合;转录调控;锌离子结合-BTB/POZ和TAZ结构域蛋白1样基因6Csa_5G585990下调上调膜;膜的组成部分-麦冬蛋白-3样基因7Csa_6G490950下调上调ATP结合;蛋白丝氨酸/苏氨酸激酶活性;蛋白激酶活性;核苷酸结合;蛋白磷酸化-丝裂原激活蛋白激酶激酶3样基因8Csa_6G497110下调上调金属离子结合;金属离子迁移;蛋白质二聚活性-转录因子bHLH18样基因9Csa_3G850490下调上调水解酶活性;代谢过程K21604IAA-氨基酸水解酶ILR1样4基因10Csa_1G303700上调上调膜;缺水应答;蛋白质结合;膜的组成部分;盐胁迫应答;跨膜转运;离子转运K21867钾通道AKT1基因
注:-.该基因没有获取到对应的GO、KEGG注释。
Note:-.The gene did not obtain the corresponding GO and KEGG annotation.
2.3 差异表达基因GO富集分析
对筛选到的差异表达基因进行GO富集分析,可分为生物过程、细胞组分和分子功能3个一级分类,每一类又分别进一步划分为1 117,155和409个二级分类。图3展示了3个比较组差异表达基因GO富集程度最高的前20个分类。差异表达基因在3个一级分类中均有分布,主要富集在分子功能类中的结合(Binding)和催化活性(Catalytic activity)类,生物过程类中的代谢过程(Metabolic process)、细胞过程(Cellular process)和单一生物过程(Single-organism process)类及细胞组分类中的膜(Membrane)和膜组分(Membrane part)类中。表2统计了CK-T和T-S比较组共有差异表达基因中差异最显著的10个基因富集的功能类;Csa_6G525220、Csa_5G585990、Csa_1G303700都富集在细胞组分类中的膜(Membrane)和膜的组成部分(Integral component of membrane)类。
2.4 差异表达基因KEGG富集分析
对差异表达基因进行KEGG通路富集分析(表3)。差异表达基因共归为4大类,CK-T比较组的2 244个差异表达基因归为20个亚类、139个代谢通路,T-S比较组的653个差异表达基因归为16个亚类、75个代谢通路,CK-S比较组的1 696个差异表达基因归为20个亚类、127个代谢通路。
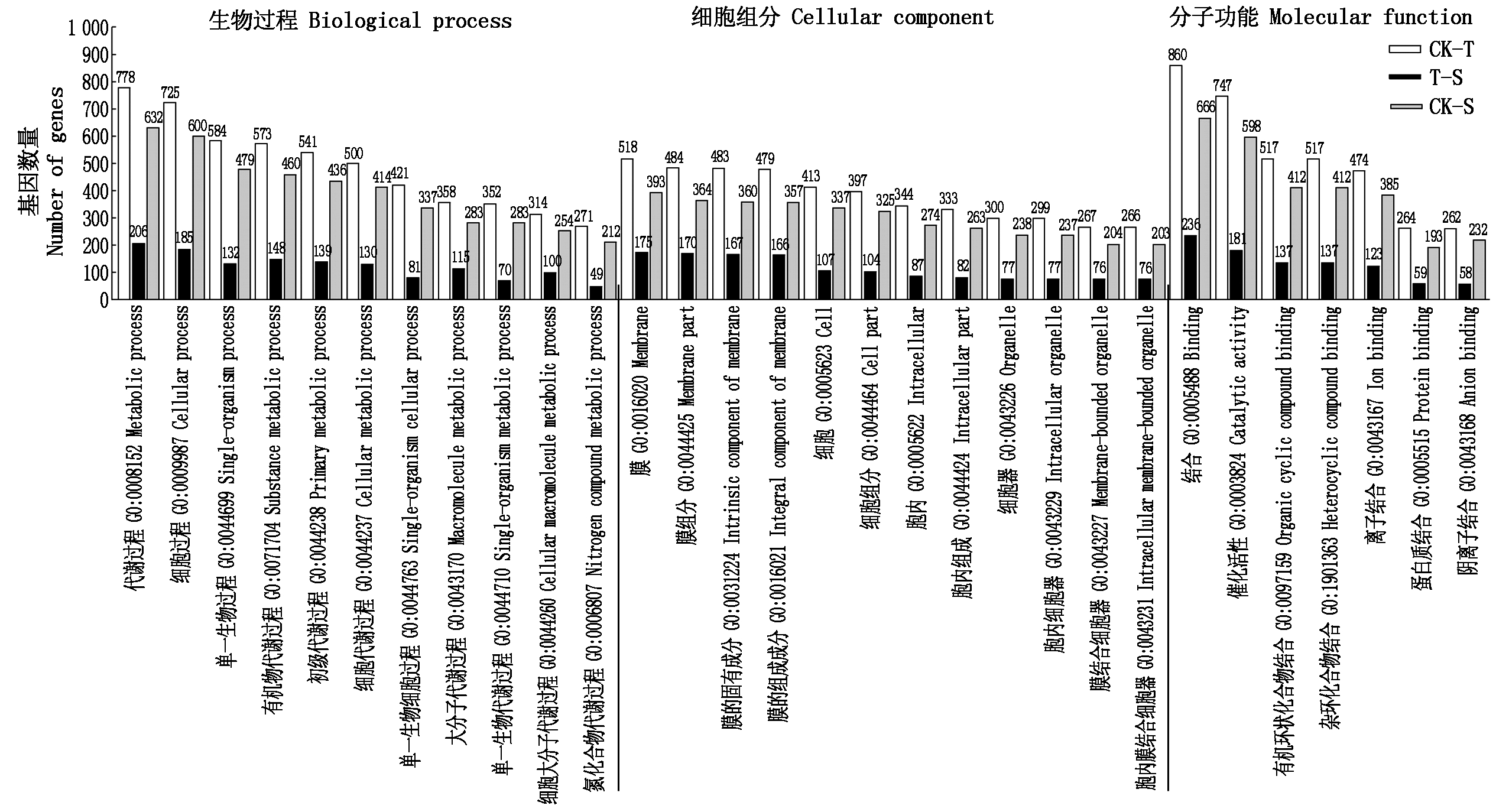
图3 黄瓜根系差异表达基因GO富集分析柱状图
Fig.3 Histogram of GO enrichment analysis of differentially expressed genes in cucumber roots
对KEGG富集分析中排名前20的代谢通路做散点图。由图4-5可见,CK-T比较组的差异表达基因主要富集在植物激素信号转导(Plant hormone signal transduction)、碳代谢(Carbon metabolism)、淀粉和蔗糖代谢(Starch and sucrose metabolism)、苯丙烷生物合成(Phenylpropanoid biosynthesis)、氨基酸的生物合成(Biosynthesis of amino acids)、细胞周期(Cell cycle)、氨基糖和核苷酸糖代谢(Amino sugar and nucleotide sugar metabolism)通路中;T-S比较组的差异表达基因主要集中在植物激素信号转导(Plant hormone signal transduction)、内质网中的蛋白质加工(Protein processing in endoplasmic reticulum)和光合作用(Photosynthesis)通路中。经基因的相似性比对和同源性分析,从不同处理的黄瓜根转录组数据中发掘出与NaCl和H2S处理相关的基因,如表2所示,CK-T和T-S比较组差异表达基因主要富集在植物激素信号转导、钙渗透应力门控阳离子通道、氮代谢、α-亚麻酸代谢、茉莉单酰-L-氨基酸水解酶和钾通道代谢通路。
表3 差异表达基因KEGG富集分析
Tab.3 KEGG enrichment analysis of differentially expressed genes
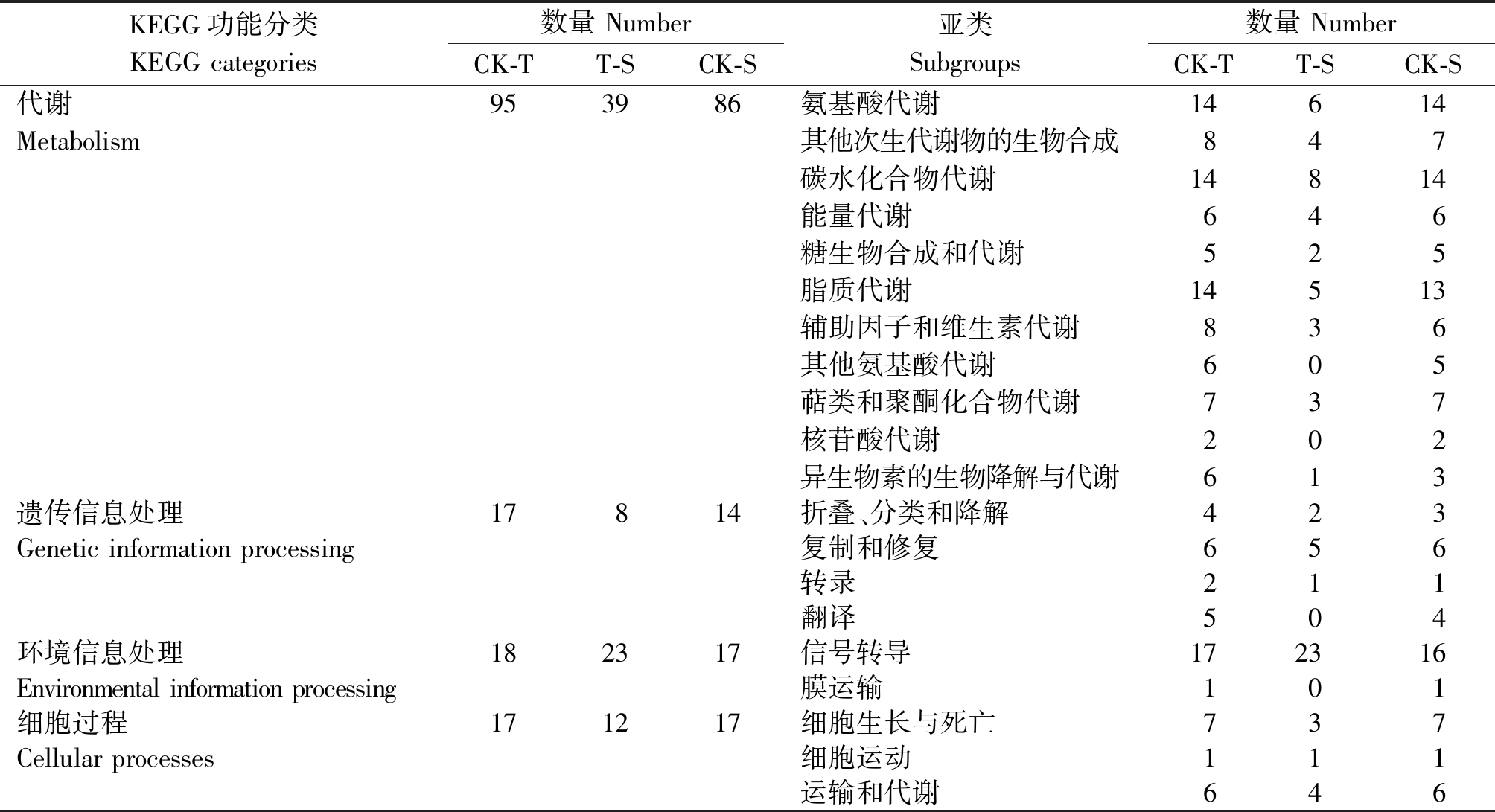
KEGG功能分类KEGG categories数量 NumberCK-TT-SCK-S亚类 Subgroups数量 NumberCK-TT-SCK-S代谢953986氨基酸代谢14614Metabolism其他次生代谢物的生物合成847碳水化合物代谢14814能量代谢646糖生物合成和代谢 525脂质代谢14513辅助因子和维生素代谢836其他氨基酸代谢 605萜类和聚酮化合物代谢 737核苷酸代谢 202异生物素的生物降解与代谢613遗传信息处理17814折叠、分类和降解423Genetic information processing复制和修复 656转录211翻译504环境信息处理182317信号转导172316Environmental information processing膜运输101细胞过程171217细胞生长与死亡737Cellular processes细胞运动 111运输和代谢64 6
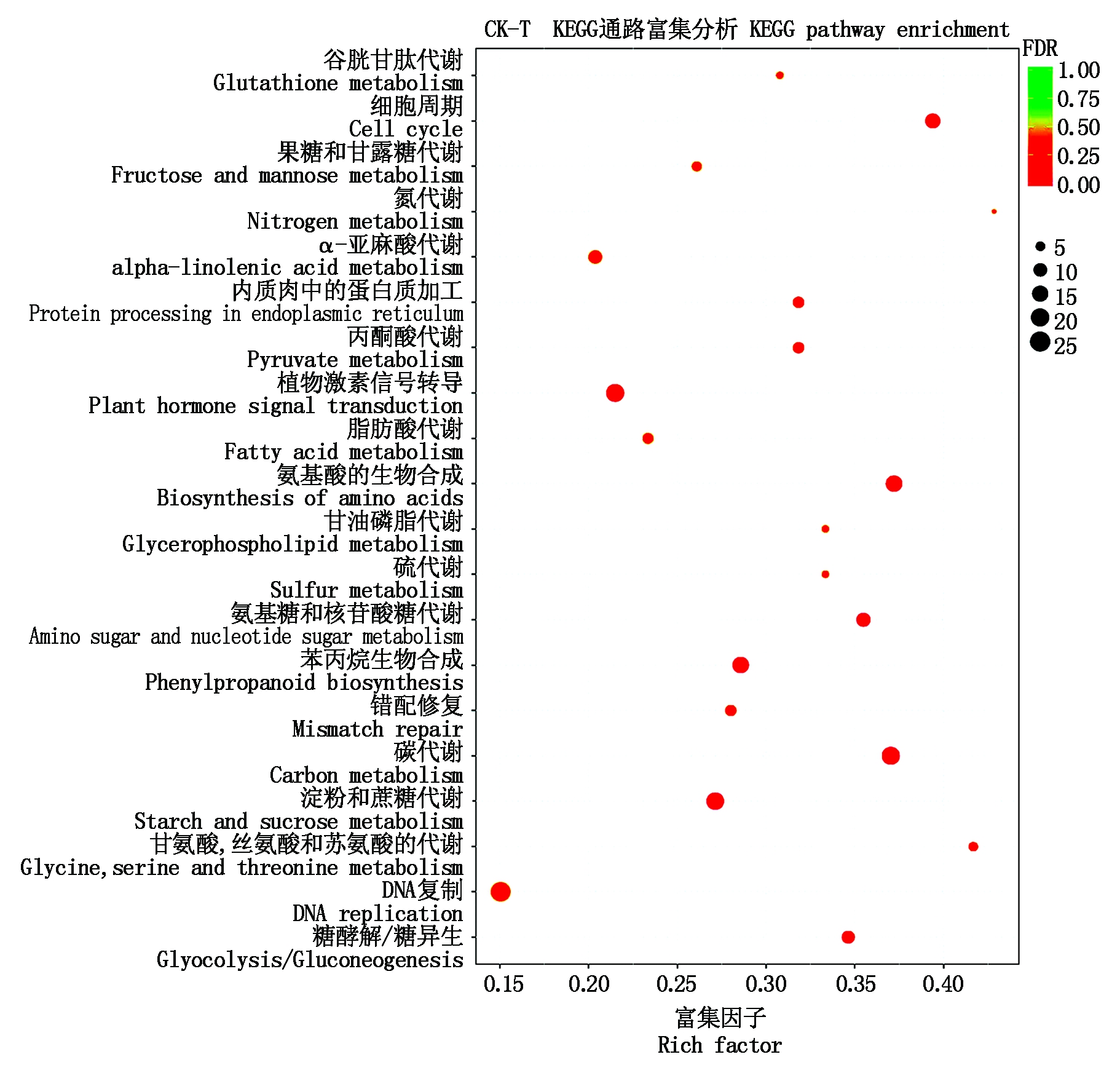
颜色表示显著性P值的大小,P值越小颜色越接近红色;每个通路下包含的差异基因的多少用点的大小来表示。图5同。 The size of P-value is represented by the color of dots, the smaller the P-value, the closer the color is to red; The number of differential genes contained in each pathway is represented by the size of dots. The same as Fig.5.
图4 CK-T组差异表达基因KEGG富集分析散点图
Fig.4 KEGG pathways enrichment analysis of differentially expressed genes of group CK-T
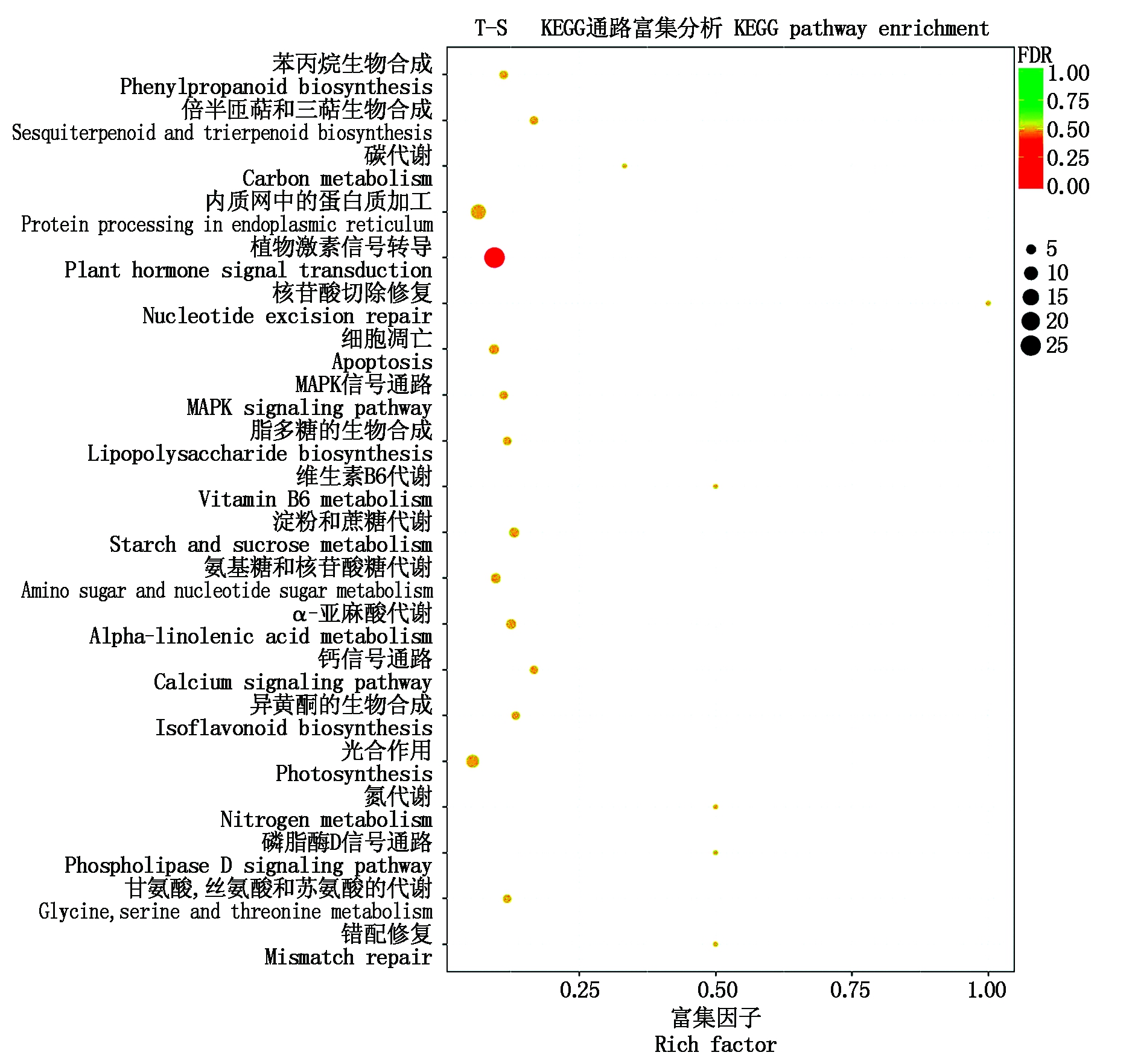
图5 T-S组差异表达基因KEGG富集分析散点图
Fig.5 KEGG pathways enrichment analysis of differentially expressed genes of group T-S
3 讨论
盐度是一种多组分非生物胁迫,盐度过高通常会导致植物发生细胞脱水和膜系统损伤等破坏[19],通过渗透胁迫、离子毒害和氧化胁迫等对植物造成巨大伤害[20]。本研究结果中GO富集分析表明,CK-T比较组和T-S比较组共有差异表达基因富集较多的分类为膜和膜的组成部分等。已有报道H2S通过上调杨树根系胞质膜Na+/H+逆向转运体系,促进Na+和H+逆向跨膜转运,而且H+泵通过抑制去极化激活的离子通道来限制盐诱导的K+外流,从而调节盐胁迫下杨树根系K+/Na+的平衡[21]。这说明H2S能够通过调节盐胁迫下植物组织细胞离子平衡及氧化还原过程,减轻膜损伤,调节相关基因和蛋白从而缓解盐胁迫引起的损伤。
遭遇渗透胁迫时,植物会通过一系列信号转导途径来减少蒸腾失水,从而维持体内水分代谢的相对平衡[22]。目前,盐超敏感信号转导途径(Salt overly sensitive,SOS)、钙依赖型蛋白激酶(Calcium-dependent protein kinase,CDPK)信号转导级联反应途径、脱落酸(Abscisic acid,ABA)信号转导途径和丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)级联反应途径等是植物应答盐胁迫相关的主要信号转导途径[23]。植物体内的H2S主要是通过L-/D-半胱氨酸脱氢酶(L-/D-cysteine desulfhydrase,L-/D-CDes)途径合成,H2S位于SOS上游,参与盐胁迫、茉莉酸(Jasmonic acid,JA)、ABA等诱导的气孔关闭过程[24-26]。本研究结果中KEGG富集分析表明,CK-T和T-S比较组差异表达基因主要富集在植物激素信号转导、钙渗透应力门控阳离子通道、氮代谢、α-亚麻酸代谢、茉莉单酰-L-氨基酸水解酶和钾通道代谢通路。和CK组相比,NaCl处理组CSC1样蛋白ERD4基因、NADH型硝酸还原酶样基因、蛋白质TIFY 10B样基因、丙二烯氧化物环化酶基因(Allene oxide cyclase,AOC)、BTB/POZ和TAZ结构域蛋白1样基因、麦冬蛋白-3样基因、丝裂原激活蛋白激酶激酶3样基因、转录因子bHLH18样基因和IAA-氨基酸水解酶ILR1样4基因下调,而H2S处理后上述基因上调,钾通道AKT1基因在NaCl胁迫和H2S处理后均上调表达。研究表明AOC基因参与对盐胁迫、金属离子、损伤、JA、ABA及水杨酸(Salicylic acid,SA)的响应等,是JA生物合成途径中一个关键酶,在植物抗逆境反应中发挥着重要作用[27]。SA信号途径和JA信号途径被认为是相互拮抗的2条信号转导途径[28];CSC1样蛋白ERD4基因参与膜和膜的组成,具有ERD4的转基因拟南芥植物生长旺盛,产量高,并且对盐和渗透胁迫具有耐受性[29];NADH型硝酸还原酶基因的表达与高浓度盐胁迫下,盐敏感荞麦品种叶片NADH型硝酸还原酶活性显著降低研究一致[30];TIFY蛋白质构成植物特有的超家族,它们参与调节许多植物过程,例如发育、防御和胁迫反应[31];MAPK在植物的应激反应和发育中起着重要作用[32];AKT表达与植物的Na+选择性密切相关[33]。植物耐盐性是由植物体内一系列因素共同作用的结果,同时受外界环境因子的影响和制约。盐胁迫后,黄瓜在一系列代谢的信号转导相关基因的调控下,维持机体代谢相对平衡,并适应盐胁迫环境。研究盐胁迫相关基因及其功能分析为下一步筛选耐盐关键基因提供了信息。
[1] 张昆,李明娜, 曹世豪, 孙彦. 植物盐胁迫下应激调控分子机制研究进展[J]. 草地学报, 2017, 25(2): 226-235. doi:10.11733/j.issn.1007-0435.2017.02.002.
Zhang K, Li M N, Cao S H, Sun Y. The research advances of molecular mechanisms of plant in responding to salt stress[J]. Acta Agrestia Sinica, 2017, 25(2): 226-235.
[2] 厉书豪, 李曼, 张文东, 李仪曼, 艾希珍, 刘彬彬, 李清明. CO2加富对盐胁迫下黄瓜幼苗叶片光合特性及活性氧代谢的影响[J]. 生态学报, 2019, 39(6): 2122-2130. doi:10.5846/stxb201712212296.
Li S H, Li M, Zhang W D, Li Y M, Ai X Z, Liu B B, Li Q M. Effects of CO2 enrichment on photosynthetic characteristics and reactive oxygen species metabolism in leaves of cucumber seedlings under salt stress[J]. Acta Ecologica Sinica, 2019, 39(6): 2122-2130.
[3] 孙超, 单楠, 王慧娟, 章颖佳, 王振雨, 张振贤, 眭晓蕾. 盐胁迫对黄瓜幼苗光合作用及其关键酶基因表达特性的影响[J]. 中国蔬菜, 2016(8): 29-34. doi:10.3969/j.issn.1000-6346.2016.08.007.
Sun C, Shan N, Wang H J, Zhang Y J, Wang Z Y, Zhang Z X, Sui X L. Effect of salt stress on photosynthetic characteristic and relevant gene expression of cucumber seedling[J]. China Vegetables, 2016(8): 29-34.
[4] 沈季雪, 蒋景龙. 不同浓度NaCl处理对6种黄瓜种子萌发的影响[J]. 江苏农业科学, 2017, 45(7): 111-115. doi:10.15889/j.issn.1002-1302.2017.07.029.
Shen J X, Jiang J L. Effects of different NaCl treatment on germination of 6 cucumber seeds[J]. Jiangsu Agricultural Sciences, 2017, 45(7): 111-115.
[5] Naliwajski M R, Sk odowska M. The relationship between carbon and nitrogen metabolism in cucumber leaves acclimated to salt stress[J]. Peer J, 2018, 6(12): 1-26. doi:10.7717/peerj. 6043.
odowska M. The relationship between carbon and nitrogen metabolism in cucumber leaves acclimated to salt stress[J]. Peer J, 2018, 6(12): 1-26. doi:10.7717/peerj. 6043.
[6] 田雲, 蒋景龙, 李丽, 余妙, 任绪明. 信号分子硫化氢调控植物抗逆性研究进展[J]. 核农学报, 2017, 31(11): 2279-2287. doi:10.11869/j.issn.100-8551.2017.11.2279.
Tian Y, Jiang J L, Li L, Yu M, Ren X M. Research advances in plant stress resistance regulated by signal molecule hydrogen sulfide[J]. Journal of Nuclear Agricultural Sciences, 2017, 31(11): 2279-2287.
[7] 鲍敬, 丁同楼, 贾文娟, 王灵燕, 王宝山. 外源H2S对盐胁迫下小麦种子萌发的影响[J]. 现代农业科技, 2011(20): 40-42.doi:10.3969/j.issn.1007-5739.2011.20.018.
Bao J, Ding T L, Jia W J, Wang L Y, Wang B S. Effect of exogenous hydrogen sulfiocde on wheat seed germination under salt stress[J]. Xiandai Nongye Keji, 2011(20): 40-42.
[8] 何庆元, 向仕华, 吴萍, 李正鹏, 王松华, 祝嫦巍, 张晓红. 硫化氢对盐胁迫条件下大豆抗氧化酶活性的影响[J]. 大豆科学, 2015, 34(3): 427-431. doi:10.11861/j.issn.1000-9841.2015.03.0427.
He Q Y, Xiang S H, Wu P, Li Z P, Wang S H, Zhu C W, Zhang X H. Effects of hydrogen sulfide alleviates salt stress in soybean (Glycine max) antioxidative system[J]. Soybean Science, 2015, 34(3): 427-431.
[9] 董靖, 李红丽, 董智, 白文华. H2S对NaCl胁迫下草木犀幼苗生理指标及抗氧化酶活性的影响[J]. 草业科学, 2018, 35(10): 2430-2437. doi:10.11829/j.issn.1001-0629.2017-0678.
Dong J, Li H L, Dong Z, Bai W H. Effect of H2S on physiological indexes and antioxidant activity of sweet clover seedlings under NaCl stress[J]. Pratacultural Science, 2018, 35(10): 2430-2437.
[10] 郑州元, 林海荣, 崔辉梅. 外源硫化氢对加工番茄种子耐盐性及抗氧化酶的影响[J]. 干旱地区农业研究, 2017, 35(5): 236-241,262.
Zheng Z Y, Lin H R, Cui H M. Effects of exogenous hydrogen sulfide on salt tolerance and antioxidant enzymes of processing tomato seeds[J]. Agricultural Research in the Arid Areas, 2017, 35(5): 236-241,262.
[11] 黄菡, 郭莎莎, 陈良超, 肖斌. 外源硫化氢对盐胁迫下茶树抗氧化特性的影响[J]. 植物生理学报, 2017, 53(3): 497-504.doi:10.13592/j.cnki.ppj.2016.0501.
Huang H, Guo S S, Chen L C, Xiao B. Effects of exogenous hydrogen sulfide on the antioxidant characteristics of tea plant (Camellia sinensis) under salt stress[J]. Plant Physiology Journal, 2017, 53(3): 497-504.
[12] 谢平凡, 邱冬冬, 陈珍. 外源硫化氢缓解水稻盐胁迫的作用机理[J]. 贵州农业科学, 2017, 45(3): 8-13. doi:10.3969/j.issn.1001-3601.2017.03.003.
Xie P F, Qiu D D, Chen Z. Functional mechanism of exogenous H2S to relieve salt stress in rice[J]. Guizhou Agricultural Sciences, 2017, 45(3): 8-13.
[13] Wang Y Q, Li L, Cui W T, Xu S, Shen W B, Wang R. Hydrogen sulfide enhances alfalfa (Medicago sativa)tolerance against salinity during seed germinationby nitric oxide pathway[J]. Plant Soil, 2012, 351(1-2): 107-119. doi:10.1007/s11104-011-0936-2.
[14] 蔺亚平, 林海荣, 崔辉梅. 外源H2S和H2O2对NaCl胁迫下加工番茄幼苗生理特性的影响[J]. 华北农学报, 2018, 33(3): 159-166.doi:10.7668/hbnxb.2018.03.024.
Lin Y P, Lin H R, Cui H M. Effect of exogenous H2S and H2O2 on the physiological characteristics of processing tomato seedlings under NaCl stress[J]. Acta Agriculturae Boreali-Sinica, 2018, 33(3): 159-166.
[15] Jiang J L, Tian Y, Li L, Yu M, Hou R P, Ren X M. H2S alleviates salinity stress in cucumber by maintaining the Na+/K+ balance and regulating H2S metabolism and oxidative stress response[J]. Frontiers in Plant Science, 2019, 10(678): 1-17. doi:10.3389/fpls.2019.00678.
[16] 任绪明, 蒋景龙, 孙旺, 李丽. 外源H2S影响黄瓜幼苗响应高盐胁迫的蛋白质组学分析[J]. 西北植物学报, 2018, 38(12):2236-2248.doi:10.7606/j.issn.1000-4025.2018.12.2236.
Ren X M, Jiang J L, Sun W, Li L. Proteomic analysis of cucumber seedling response to high salt stress by exogenous H2S[J]. Acta Bot Boreal-Occident Sin, 2018, 38(12):2236-2248.
[17] 蒋景龙, 沈季雪, 李丽. 外源H2O2对盐胁迫下黄瓜幼苗氧化胁迫及抗氧化系统的影响[J]. 西北农业学报, 2019, 28(6): 998-1007. doi:10.7606/j.issn.1004-1389.2019.06.017.
Jiang J L, Shen J X, Li L. Effects of exogenous hydrogen peroxide on oxidative stress and antioxidant system in Cucumis sativus L.seedlings under salt stress[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2019, 28(6): 998-1007.
[18] 陈哲, 黄静, 赵佳, 梁宏. 草莓应答炭疽菌侵染的转录组分析[J]. 植物保护, 2020, 46(3): 138-146. doi:10.16688/j.zwbh.2019096.
Chen Z, Huang J, Zhao J, Liang H. Transcriptomics analysis of strawberry response to colletotrichum theobromicola infection[J]. Journal of Plant Protection, 2020, 46(3): 138-146.
[19] Wang J Y, Qiao Q, Tao J H. The physiological response of three Narcissus pseudonarcissus under NaCl stress[J]. American Journal of Plant Sciences, 2019, 10(3): 447-461. doi:10.4236/ajps.2019.103032.
[20] Ma Y, Wang P, Chen Z J, Gu Z X, Yang R Q. NaCl stress on physio-biochemical metabolism and antioxidant capacity in germinated hulless barley (Hordeum vulgare L.)[J]. Journal of the Science of Food and Agriculture, 2019, 99(4): 1755-1764. doi:10.1002/jsfa.9365.
[21] 朱会朋, 孙健, 赵楠, 马旭君, 张玉红, 沈昕, 陈少良. 盐胁迫下硫化氢调控杨树根系的离子流[J]. 植物生理学报, 2013, 49(6): 561-567.
Zhu H P, Sun J, Zhao N, Ma X J, Zhang Y H, Shen X, Chen S L. Hydrogen sulfide mediates ion fluxes in root of poplars under NaCl stress[J]. Plant Physiology Journal, 2013, 49(6): 561-567.
[22] 安国勇, 李保珠, 武桂丽, 宋纯鹏. H2O2作为根源信号介导盐胁迫诱导的蚕豆气孔关闭反应[J]. 植物生理学报, 2012, 48(3): 265-271.
An G Y, Li B Z, Wu G L, Song C P. H2O2 could act as root source signal to mediate stomatal closure induced by salt stress of Vicia faba L.[J]. Plant Physiology Journal, 2012, 48(3): 265-271.
[23] 陈莎莎, 贺转转, 姜生秀, 李晓荣, 邢佳佳, 吕秀云, 兰海燕.藜Ca MAPKK2 的表达分析及盐胁迫信号通路互作组分的筛选[J]. 中国农业科学, 2013, 46(5): 889-897.doi:10.3864/j.issn.0578-1752.2013.05.003.
Chen S S, He Z Z, Jiang S X, Li X R, Xing J J, Lü X Y, Lan H Y. The expression analysis and screening of interaction protein of mitogen-activated protein kinase (Ca MAPKK2) in salt-stress signal pathways of Chenopodium album[J]. Scientia Agricultura Sinica, 2013, 46(5): 889-897.
[24] García-Mata C, Lamattina L. Hydrogen sulphide, a novel gasotransmitter involved in guard cell signalling[J]. New Phytologist, 2010, 188(4): 977-984. doi:10. 1111/j.1469-8137.2010.03465.x.
[25] 侯智慧, 刘菁, 侯丽霞, 李希东, 刘新. H2S可能作为H2O2的下游信号介导茉莉酸诱导的蚕豆气孔关闭[J]. 植物学报, 2011, 46 (4): 396-406.doi:10.3724/SP.J.1259.2011.00396.
Hou Z H, Liu J, Hou L X, Li X D, Liu X. H2S may function downstream of H2O2 in jasmonic acid-induced stomatal closure in Vicia faba[J]. Chinese Bulletin of Botany, 2011, 46 (4): 396-406.
[26] 车永梅, 邹雪, 王兰香, 张丹丹, 刘新. H2S位于SOS上游参与盐胁迫诱导的拟南芥气孔关闭[J]. 植物生理学报, 2012, 48 (11): 1098-1104.
Che Y M, Zou X, Wang L X, Zhang D D, Liu X. H2S signals salt-induced stomatal closure in Arabidopsis thaliana by SOS pathway[J]. Plant Physiology Journal, 2012, 48 (11): 1098-1104.
[27] 曹晏彬, 柏素花, 戴洪义. 苹果丙二烯氧化物环化酶基因 MdAOC1的克隆与表达分析[J]. 林业科学, 2013, 49(12): 73-80. doi:10.11707/j.1001-7488.20131211.
Cao Y B, Bai S H, Dai H Y. Cloning and expression analysis of allene oxide cyclase gene MdAOC1 from Malus domestica[J]. Scientia Silvae Sinicae, 2013, 49(12): 73-80.
[28] Naor N, Gurung F B, Ozalvo R, Bucki P, Sanadhya P, Miyara S B. Tight regulation of allene oxide synthase (AOS) and allene oxide cyclase-3 (AOC3) promote Arabidopsis susceptibility to the root-knot nematode Meloidogyne javanica[J]. Eur J Plant Patho, 2018, 150(1): 149-165. doi:10.1007/s10658-017-1261-2.
[29] Rai A N, Tamirisa S, Rao K V, Kumar V, Suprasanna P. Brassica RNA binding protein ERD4 is involved in conferring salt, drought tolerance and enhancing plant growth in Arabidopsis[J]. Plant Molecular Biology, 2016, 90: 375-387. doi:10. 1007/s11103-015-0423-x.
[30] 杨洪兵. 渗透胁迫和盐胁迫对荞麦硝酸还原酶及亚硝酸还原酶活性的影响[J]. 作物杂志, 2013(3): 53-55. doi:10.16035/j.issn.1001-7283.2013.03.016.
Yang H B. Effects of osmotic and salt stress on nitrate reductase and nitrite reductase activities of buckwheat[J]. Crops, 2013(3): 53-55.
[31] Ebel C, BenFeki A, Hanin M, Solano R, Chini A. Characterization of wheat (Triticum aestivum) TIFY family and role of Triticum durum TdTIFY11a in salt stress tolerance[J]. PLoS One, 2018, 13(7): e0200566. doi:10.1371/journal.pone.0200566.
[32] Sun W, Chen H, Wang J, Sun H W, Yang S K, Sang Y L, Lu X B, Xu X H. Expression analysis of genes encoding mitogen-activated protein kinases in maize provides a key link between abiotic stress signaling and plant reproduction[J]. Funct Integr Genomics, 2015, 15(1): 107-120. doi:10.1007/s10142-014-0410-3.
[33] Golldack D, Quigley F, Michalowski C B, Kamasani U R, Bohnert H J. Salinity stress-tolerant and-sensitive rice (Oryza sativa L.) regulate AKT1-type potassium channel transcripts differently[J]. Plant Molecular Biology, 2003, 51(1): 71-81. doi:10.1023/A:1020763218045.
