甲烷是重要的温室气体之一,其产生的温室效应贡献率仅次于二氧化碳,达到20%[1-3]。稻田产生排放的甲烷约占全球排放总量的12%,仅次于畜牧业,是大气甲烷的主要来源[4]。我国是世界上种植水稻最多的国家之一,水稻种植面积占世界稻田总面积的22%[5]。稻田甲烷的排放过程由3个部分组成,甲烷的产生、氧化和输送过程。在水稻生长过程中,大部分甲烷被水稻根系所吸收,经过水稻植株的通气组织输送排放到大气中。根系通过分泌作用影响周围根系环境,产生根际效应,导致水稻的根际土壤环境复杂。研究水稻根系生物特性、根际土壤酶活性与甲烷排放之间的关系,具有重要的现实意义。
根系特性是影响水稻温室气体排放的重要因素[6]。夏仕明[7]通过对4个甲烷排放量差异较大的水稻品种为研究对象,探索根系形态生理特征的差异,结果表明,不同水稻品种间的甲烷排放和孕穗期的根系指标均存在显著差异;水稻根系活力强、根系生物量大、根系分泌物苹果酸浓度高有利于降低稻田甲烷排放。而钟娟等[8]通过对水稻植株甲烷传输能力与根系特性做相关性分析,结果表明,根系活力较低、根质量大的早稻品种甲烷传输能力较弱。刘依依[9]研究了根系通气组织、泌氧能力与甲烷排放的相关性,得出水稻根系通气组织越发达,根系泌氧能力越强,稻田甲烷排放通量越低。肖志祥等[10]研究结果表明,双季稻的甲烷排放通量与根冠比、根孔隙度关系密切,具有一定的相关性。综述,不同的水稻品种甲烷排放量不同,且与根系生物特性间存在一定关联性,而根际土壤酶活性与稻田甲烷排放的鲜有报道。为此,本研究从不同甲烷排放的水稻品种出发,研究水稻根系特性、根际土壤酶活性与甲烷排放之间的相关性,探讨影响早晚稻甲烷排放的关键根际特性,旨在为今后的稻田甲烷减排研究提供基础理论依据。
1 材料和方法
1.1 试验地概况
本试验在浏阳市沿溪镇湖南农业大学教学实习基地开展。该地区经度113.8°E,纬度28.3°N,属于亚热带季风性湿润气候,年平均降雨量1 457~2 247 mm,年平均气温16.7~18.2 ℃,全年活动积温(≥10 ℃)5 030~5 353 ℃。土壤类型为第四纪红壤发育的红黄泥水稻土。试验地土壤理化性状:有机质26.00 g/kg、pH值5.07、全氮1.97 g/kg、全钾5.86 g/kg、全磷0.64 g/kg、碱解氮137.55 mg/kg、有效磷52.78 mg/kg、速效钾90.67 mg/kg。
1.2 试验设计
本试验的供试早晚稻品种各3个,均为2016-2017年试验中低、中、高早晚稻品种,如表1列出。大田试验区早稻于2018年4月7日播种,7月15日收获;晚稻6月22日播种,10月30日收获。试验采用随机区组设计,3个品种处理,3次重复,共9个小区,小区面积40 m2(5 m×8 m),小区间不用田埂隔开。所有供试品种的施肥、灌溉等田间管理方式一致。氮肥:基肥50%、蘖肥30%、穗肥20%。磷肥:基肥一次性施入。钾肥:基肥50%、蘖肥50%。早稻:尿素261 kg/hm2、过磷酸钙750 kg/hm2、氯化钾201 kg/hm2。晚稻:尿素330 kg/hm2、过磷酸钙750 kg/hm2、氯化钾201 kg/hm2。
表1 供试早晚稻品种
Tab.1 Testing early and late rice varieties

甲烷排放类型Types of methane emissions早稻品种Early rice varieties生育期/dGrowth period晚稻品种Late rice varieties生育期/dGrowth period低 Low 株两优819110Y两优1号110中 Among陆两优996110泰优390114高 High湘早籼24号109湘晚籼17号117
1.3 观测指标与方法
温室气体的采集与测定采用静态暗箱-气相色谱法。采样时间为移栽后第10天开始,之后每隔7 d取样一次,如遇降雨,下雨停后第2天取气,每次取气时间为早上9:00-11:00,分别在放置采样箱后的第10,20,30 min取气,取气时用注射器从箱体一侧连接三通阀的小孔内抽取气体,之后转移到真空玻璃管中,样品送至湖南省农科院土肥所完成检测,检测器FID,检测温度200 ℃,柱温50 ℃,标准气体由国家标准物质中心提供[11]。
根系及根际土壤取样在水稻的分蘖盛期、孕穗期、齐穗期、乳熟期4个主要时期进行。每个小区取3穴生长一致的稻株,将水稻植株连同根系土壤一起用铁铲挖出,抖落掉根系外围土层,用无菌手套采取距根际较近的土层(约1~2 cm)作为土样,将采取的土样和植株带回实验室,捡出小石子等杂质后,土样装入自封袋中,自然条件下晾干,然后按照所需筛目数进行过筛(1 mm),用于酶活性的监测。植株放入网袋中用流水冲洗干净带回实验室,观测根体积、根孔隙度和根冠比。根系活力采用茎伤流法测定,伤流液的收集参照彭廷和陈浩等[12]的方法。根际土壤蔗糖酶活性以24 h后1 g干土中葡萄糖的毫克数表示,脲酶活性以24 h后1 g干土中NH4-N的毫克数表示。
稻田温室气体排放通量计算公式如下:
F=ρ·273/(273+T)·h·dc/dt
式中:F为排放通量,mg/(m2·h);ρ为标准大气压下的 CH4密度,为 0.714 kg/m3;T为采样过程中采样箱内的平均温度,℃;h为采样箱的箱罩的净高度,m;dc/dt为采样箱内温室气体浓度的变化率;273为气态方程常数。
1.4 数据处理
运用Microsoft Excel 2010对数据进行整理和作图,SPSS Statistics 17.0作相关显著性检验(P<0.05)及相关性分析,多重比较采用Duncan法。
2 结果与分析
2.1 不同水稻品种甲烷排放通量变化
由图1可知,早晚稻甲烷排放通量在生育期内有显著差异,整体趋势表现为先升高后降低,生育前期(分蘖期)为甲烷排放最多的时期,出现峰值,随着早稻生育进程的推进,生育末期几乎没有甲烷排放。3个早稻品种中,整个生育期甲烷排放通量极差为24.46 mg/(m2·h);甲烷排放通量最大值为分蘖期的湘早籼24号(24.51 mg/(m2·h)),显著大于陆两优996(15.33 mg/(m2·h))和株两优819(14.76 mg/(m2·h));在齐穗期,陆两优996显著高于湘早籼24号和株两优819,差值分别为2.98,2.97 mg/(m2·h)。3个晚稻品种中,甲烷排放通量极差为88.59 mg/(m2·h);在分蘖期,湘晚籼17号(89.66 mg/(m2·h))的甲烷排放通量显著大于泰优390(40.36 mg/(m2·h))和Y两优1号(35.49 mg/(m2·h)),差值分别为49.3,54.17 mg/(m2·h)。
2.2 不同水稻品种根系特性差异比较
2.2.1 根冠比根系 根冠比根系是植株的重要部分,其生长状况好坏直接影响着植株的生长和代谢。水稻植株的地下部分与地上部分的鲜质量比值为根冠比,反映了地上和地下部分的相关性。从图2可知,早稻3个品种的根冠比在齐穗期表现为陆两优996显著大于株两优819,而在其余3个生育时期上表现为湘早籼24号>陆两优996>株两优819,但差异未达显著水平。根冠比在3个早稻品种间的变化趋势与甲烷排放通量基本一致,说明根冠比小、根系生物量小的早稻品种,其甲烷排放量也较少。3个晚稻品种间的根冠比在分蘖盛期和孕穗期差异不显著,在齐穗期湘晚籼17号显著低于泰优390和Y两优1号,差值分别为0.10,0.12,乳熟期Y两优1号显著高于湘晚籼17号,差值为0.06;就整个生育期而言,根冠比随生育时期先降低后升高,各品种均至齐穗期达到最小值,晚稻品种中根冠比最大值和最小值都为湘晚籼17号,分别为0.43和0.08,极差为0.35。

不同的小写字母表示不同供试品种间差异显著(P<0.05)。图2-7同。 Different lowercase letters indicate significant differences between the different tested varieties (P<0.05).The same as Fig.2-7.
图1 早晚稻品种CH4排放通量变化(2018)
Fig.1 Variation of CH4 emission flux in different early and late rice varieties

图2 早晚稻不同生育时期根冠比比较
Fig.2 Comparison of root-shoot ratio in different growth stages of early late rice
2.2.2 根体积 根体积反映了根系的生长状况。如图3所示,3个早稻品种的根体积在分蘖盛期表现为湘早籼24号显著大于陆两优996和株两优819,孕穗期陆两优996显著大于湘早籼24号和株两优819;陆两优996和株两优819根体积随着生育期呈现出先升高后降低的趋势,分别在孕穗期和齐穗期达到最大值,而湘早籼24号表现为逐渐降低的趋势,在分蘖盛期根体积最大,与同时期甲烷排放通量和根冠比表现一致;根体积最大值为孕穗期的陆两优996,为37.11 mL/株,最小值为乳熟期的株两优819(20.56 mL/株)。晚稻的根体积均随生育期呈现出先升高后降低的趋势;在齐穗期,Y两优1号根体积最大,为60.5 mL/株,显著高于湘晚籼17号和泰优390,差值分别为19.68,15.13 mL/株,而在分蘖盛期、孕穗期和乳熟期3个晚稻品种间的根体积亦均为Y两优1号根体积最大,但差异未达显著水平。
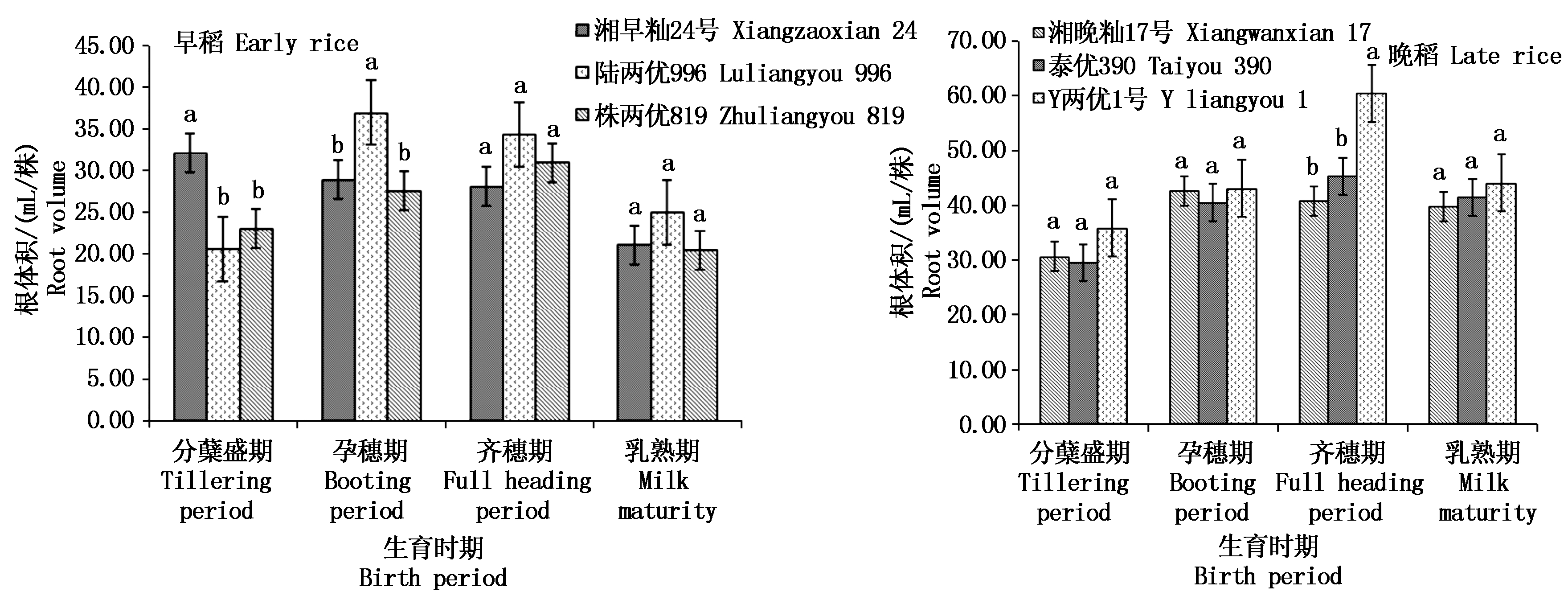
图3 早晚稻不同生育时期根体积比较
Fig.3 Comparison of root volume in different growth stages of early and late rice
2.2.3 根系伤流量 根系伤流量表征根系活力,如图4所示,早稻3个品种中,在分蘖盛期和孕穗期表现为株两优819最大,齐穗期和乳熟期陆两优996最大,且分蘖盛期株两优819显著大于湘早籼24号和陆两优996,乳熟期陆两优996显著大于湘早籼24号和株两优819;根系伤流量最大值为乳熟期的陆两优996(值为1.45 g/h),湘早籼24号在4个生育时期的根系伤流量均较低,表明湘早籼24号的根系活力较弱;湘早籼24号和陆两优996的根系伤流量随生育期表现为逐渐增大的趋势,而株两优819根系伤流量先降低后上升。根系伤流量在晚稻中表现为分蘖盛期泰优390(1.55 g/h)显著大于湘晚籼17号(1.23 g/h)和Y两优1号(1.14 g/h),孕穗期、齐穗期和乳熟期品种间差异均不显著;生育前期(分蘖盛期)和中期(孕穗期、齐穗期)根系伤流量较大,生育末期(乳熟期)较小,表现为随着生育期进程,根系活力逐渐减弱。
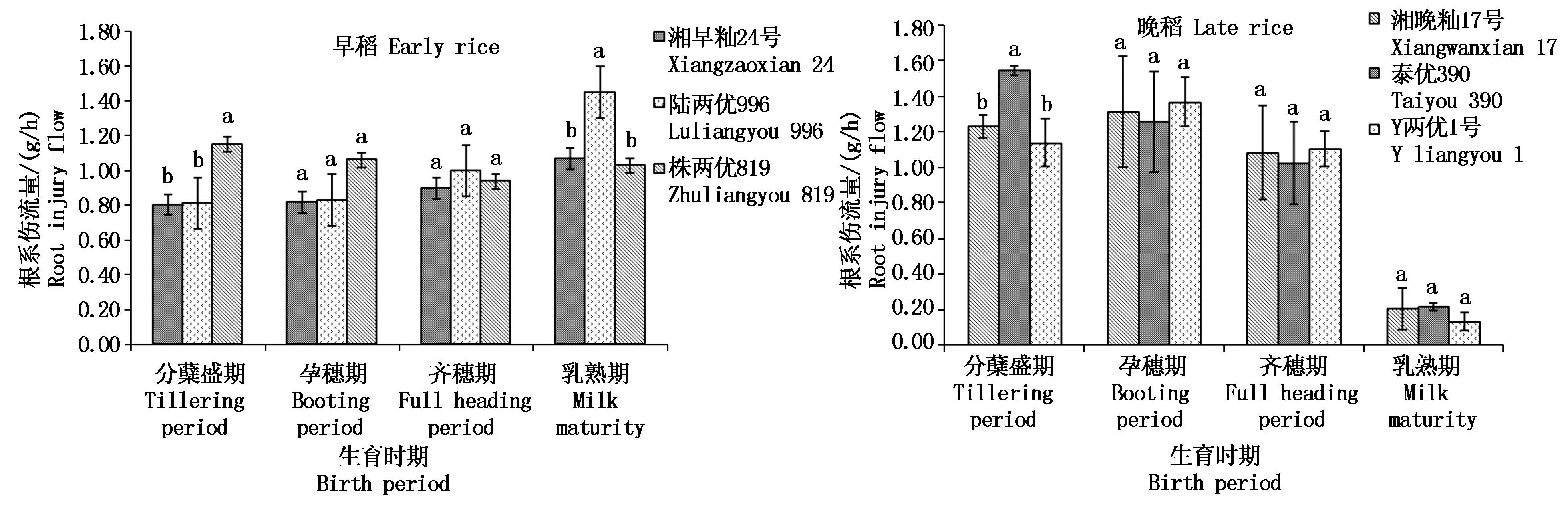
图4 早晚稻不同生育时期根系伤流量比较
Fig.4 Comparison of root injury flows in different growth stages of early and late rice
2.2.4 根孔隙度 如图5所示,早稻品种分蘖盛期陆两优996的根孔隙度显著小于株两优819和湘早籼24号,孕穗期表现为株两优819>陆两优996>湘早籼24号,品种间差异均显著,而在齐穗期和乳熟期均以湘早籼24号根系孔隙度最大,但品种间差异均不显著;从整个生育时期而言,生育前期(分蘖盛期和孕穗期)的根孔隙度大于生育后期(齐穗期和乳熟期),表明生育前期根系生长快,孔隙度大,甲烷排放量多。3个晚稻品种根孔隙度随着生育期表现为逐渐降低的趋势,根孔隙度在分蘖盛期最高,其中湘晚籼17号的根孔隙度与甲烷排放通量基本一致;在整个晚稻生育时期均表现为湘晚籼17号>泰优390>Y两优1号,湘晚籼17号均显著大于泰优390和Y两优1号。

图5 早晚稻不同生育时期根孔隙度比较
Fig.5 Comparison of root porosity in different growth stages of early and late rice
2.3 不同水稻品种根际土壤特性差异比较
2.3.1 根际土壤蔗糖酶活性 如图6所示,在分蘖盛期、孕穗期和齐穗期3个早稻品种根际土壤蔗糖酶活性差异均不显著,在乳熟期陆两优996的蔗糖酶活性显著大于株两优819;随着早稻生长发育,株两优819的根际土壤蔗糖酶活性逐渐升高,而湘早籼24号和陆两优996呈现分蘖盛期至孕穗期升高,齐穗期降低,乳熟期又升高的趋势,整个生育期根际土壤的蔗糖酶活性最大值为乳熟期的陆两优996(5.79 mg)。晚稻不同品种的蔗糖酶活性在分蘖盛期湘晚籼17号显著大于泰优390和Y两优1号,差值分别为0.31,0.43 mg;齐穗期湘晚籼17号(6.21 mg)和Y两优1号(6.43 mg)显著大于泰优390(5.30 mg);乳熟期湘晚籼17号显著大于泰优390,差值为0.38 mg;孕穗期表现为湘晚籼17号(6.38 mg)>泰优390(6.17 mg)>Y两优1号(5.74 mg),但品种之间无显著性差异。
2.3.2 根际土壤脲酶活性 脲酶是土壤中一种重要的酶,如图7所示,3个早稻品种的脲酶活性均先升高后降低,在分蘖盛期、孕穗期和乳熟期品种间差异不显著,齐穗期湘早籼24号显著大于株两优819;脲酶活性最大值为2.79 mg(齐穗期湘早籼24号),最小为1.38 mg(乳熟期株两优819),极差为1.41 mg。在晚稻的根际土壤脲酶活性中,3个品种在孕穗期脲酶活性最大的是泰优390,为2.34 mg,其次是湘晚籼17号,Y两优1号最小,但品种间差异不显著;在分蘖盛期湘晚籼17号显著大于Y两优1号,齐穗期Y两优1号显著大于另外2个品种,乳熟期湘晚籼17号显著大于Y两优1号和泰优390;全生育期内的晚稻根际土壤脲酶活性极差为0.72 mg。
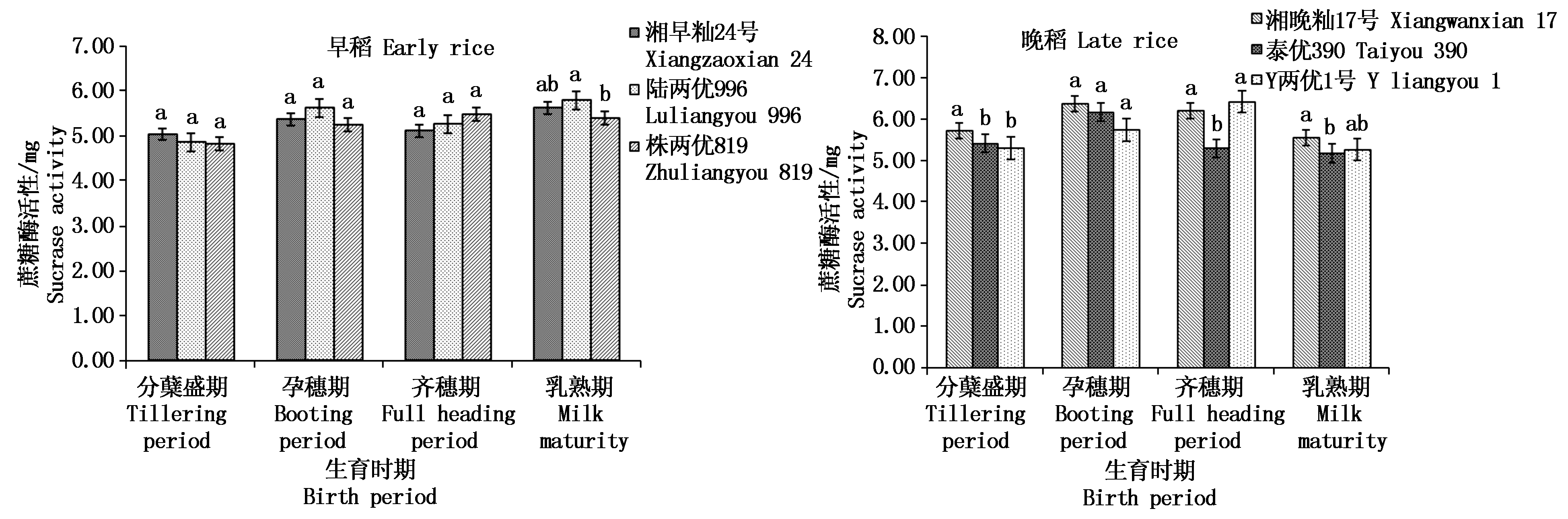
图6 早晚稻不同生育时期根际土壤蔗糖酶活性比较
Fig.6 Comparison of sucrose activity in rhizosphere soil of different growth stages in early and late rice
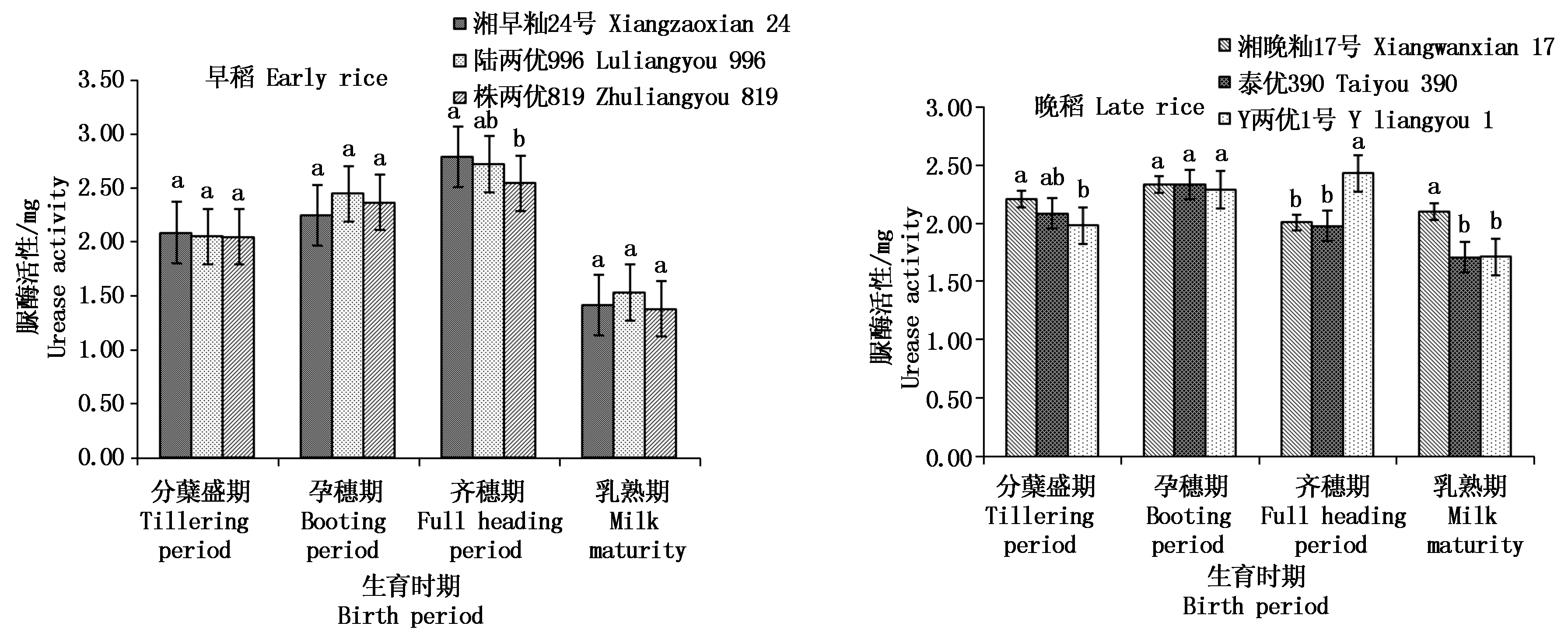
图7 晚稻不同生育时期根际土壤脲酶活性比较
Fig.7 Comparison of urease activity in rhizosphere soil of different growth stages in early and late rice
2.4 甲烷排放通量与各指标的相关系数
由表2可知,早稻的甲烷排放通量与根冠比呈极显著正相关关系(P<0.01),与根际土壤蔗糖酶活性呈极显著负相关关系(P<0.01),根冠比与根际土壤蔗糖酶活性呈极显著负相关关系(P<0.01),表明早稻的根冠比越大,根际土壤蔗糖酶活性越低,其甲烷排放量就越多;早稻的根体积与根际土壤脲酶活性呈极显著正相关关系(P<0.01),表明根体积越大,根际土壤脲酶活性越高。晚稻的甲烷排放通量与根冠比、根孔隙度呈极显著正相关关系(P<0.01),与根系伤流量呈显著正相关关系(P<0.05),与根体积呈极显著负相关关系(P<0.01),表明晚稻的根体积越小,根冠比、根孔隙度越大,根系活力越强,会促进甲烷的排放;根冠比与根体积呈极显著负相关关系(P<0.01),与根孔隙度呈极显著正相关关系(P<0.01);根体积与根孔隙度呈极显著负相关关系(P<0.01),与根际土壤蔗糖酶活性呈显著正相关关系(P<0.05);根系伤流量与根际土壤蔗糖酶活性、脲酶活性呈显著正相关关系(P<0.05),而根际土壤蔗糖酶活性与脲酶活性呈极显著正相关关系(P<0.01)(表3)。
3 讨论与结论
3.1 影响水稻品种甲烷排放的根系特性
稻田中的大部分甲烷通过水稻植株的通气组织运输到大气中。根系是水稻重要的运输途径和通气组织之一,成熟发达的通气组织,其对甲烷的传输能力也会相应提高,甲烷向大气的运输量随之增多,而通气组织的节间组织结构大小是影响水稻植株传输能力的一个重要方面[13]。黄剑冰[14]的研究结果表明,水稻品种间的根孔隙度存在差异,且根孔隙度越大的品种,其生长发育状态越好。有研究报道,根系的孔隙度与通气组织的发达程度呈正相关,根孔隙度越大,通气组织越发达,对甲烷的吸收、运输能力越高[15]。也有研究结果表示,根孔隙度高的水稻品种,根系泌氧率高,则根系越长的水稻品种可以更好地抑制甲烷排放[14]。不同的研究表现出不同的结果,而在本研究结果中,早稻和晚稻的根孔隙度均与甲烷排放量呈正相关关系。
表2 早稻甲烷排放通量与各指标的相关系数
Tab.2 Correlation coefficient between methane emission flux of early rice and various indicators
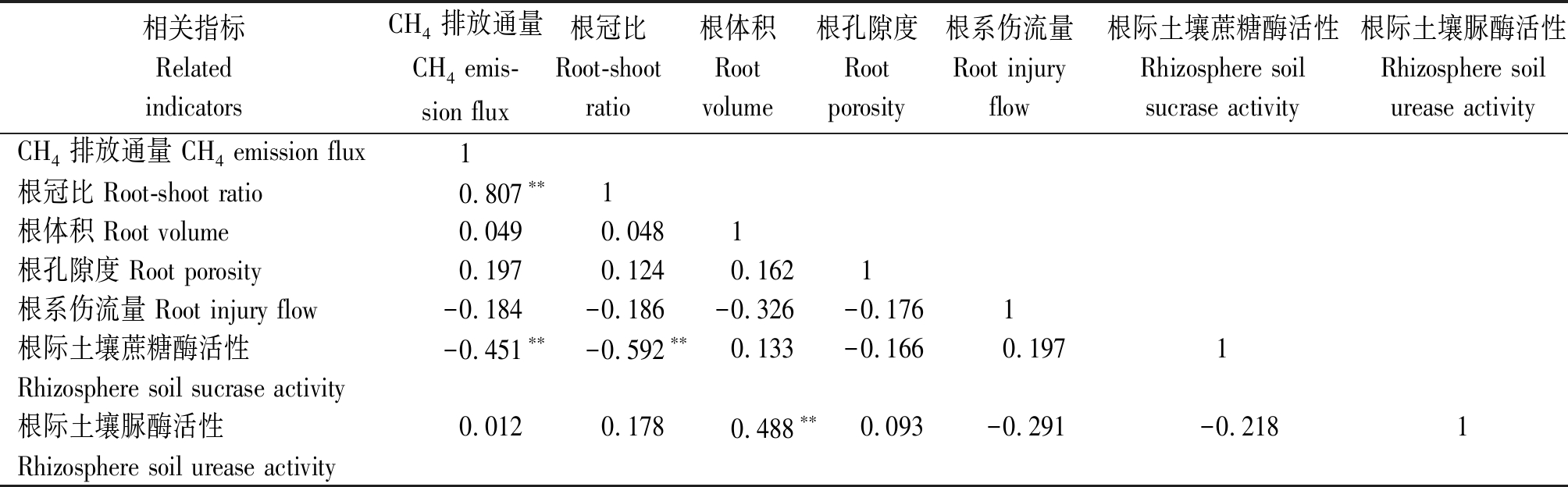
相关指标RelatedindicatorsCH4排放通量CH4 emis-sion flux根冠比Root-shootratio根体积Root volume根孔隙度Root porosity根系伤流量Root injury flow根际土壤蔗糖酶活性Rhizosphere soilsucrase activity根际土壤脲酶活性Rhizosphere soilurease activityCH4排放通量 CH4 emission flux1根冠比 Root-shoot ratio0.807∗∗1根体积 Root volume0.0490.0481根孔隙度 Root porosity0.1970.1240.1621根系伤流量 Root injury flow-0.184-0.186-0.326-0.1761根际土壤蔗糖酶活性-0.451∗∗-0.592∗∗0.133-0.166 0.1971Rhizosphere soil sucrase activity根际土壤脲酶活性0.0120.1780.488∗∗0.093-0.291-0.2181Rhizosphere soil urease activity
注:**.在0.01水平上显著相关;*.在0.05水平上显著相关。样本容量n=36。表3同。
Note: **.Significant correlation at the 0.01 level; *.Significant correlation at the 0.05 level. Sample size n =36.The same as Tab.3.
表3 晚稻甲烷排放通量与各指标的相关系数
Tab.3 Correlation coefficient between methane emission flux of late rice and various indicators
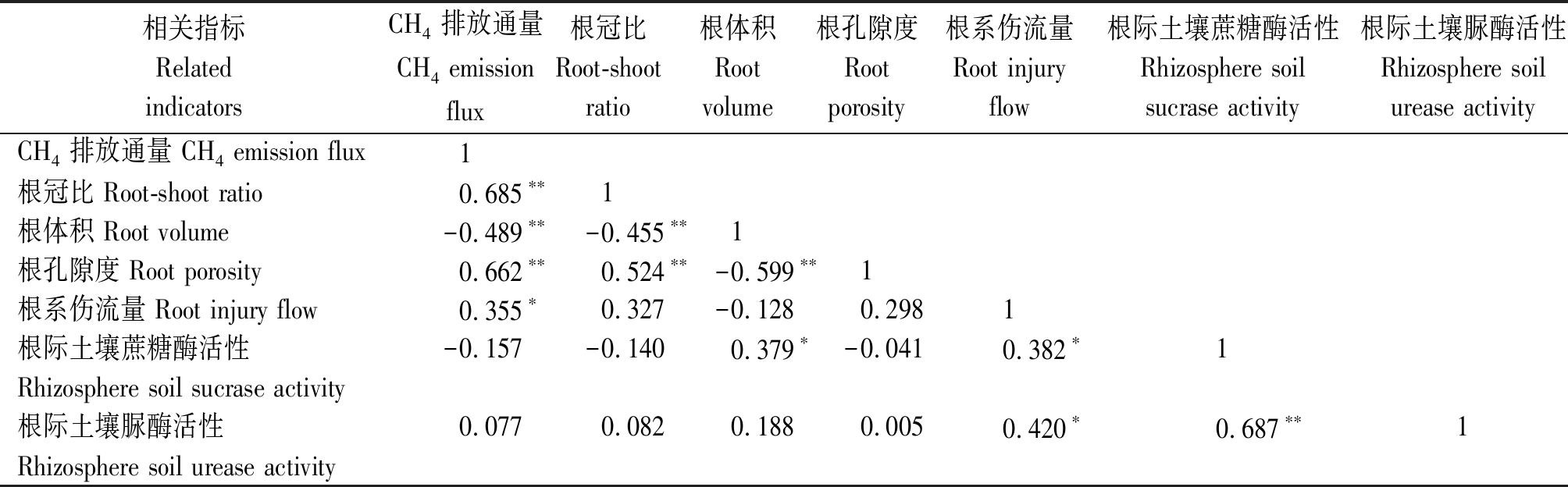
相关指标RelatedindicatorsCH4排放通量CH4 emission flux根冠比Root-shootratio根体积Root volume根孔隙度Root porosity根系伤流量Root injury flow根际土壤蔗糖酶活性Rhizosphere soilsucrase activity根际土壤脲酶活性Rhizosphere soilurease activityCH4排放通量 CH4 emission flux1根冠比 Root-shoot ratio0.685∗∗1根体积 Root volume-0.489∗∗-0.455∗∗1根孔隙度 Root porosity0.662∗∗ 0.524∗∗ -0.599∗∗1根系伤流量 Root injury flow0.355∗0.327-0.1280.2981根际土壤蔗糖酶活性-0.157-0.1400.379∗-0.0410.382∗1Rhizosphere soil sucrase activity根际土壤脲酶活性0.0770.0820.188 0.0050.420∗0.687∗∗1Rhizosphere soil urease activity
有研究结果表明,不同的水稻品种,对稻田甲烷排放通量的影响也不同,水稻根系大小是决定品种间甲烷排放通量产生差异的主要原因,为达到稻田甲烷减排的效果,应选择根系小、经济系数高的低甲烷排放通量的水稻品种[16]。肖志祥等[10]研究结果也表明降低早稻品种的根冠比可减少甲烷的排放,与本研究结果一致。
有研究者认为选择根系大活力强,增产效果较好的品种可以有效减少甲烷的排放[17],更多的研究结果较倾向于根系活力强的水稻品种对甲烷的产生和排放具有抑制作用,本研究结果中早稻甲烷排放通量与根系伤流量呈不显著的负相关关系,表明早稻甲烷排放量高,根系活力较低,与前人研究结果基本一致[17-18]。钟娟等[8]的研究结果表明,早稻甲烷传输能力与水稻根系活力有显著正相关关系,与本试验研究结果不一致,原因可能在于早稻的品种不一样,且生长环境也不一样,与各方面因素存在联系。而晚稻则呈相反的结果,晚稻的甲烷排放通量与根系伤流量呈显著的正相关关系,根系活力强,甲烷排放多,与王增远等[16]的研究结果一致。傅志强等[6]研究结果表明,晚稻的甲烷排放量与根系伤流量呈极显著负相关关系,而与本研究结果相反,原因可能在于晚稻品种不一样所致。
根体积在一定程度上表征了根系活力状况,环境条件的水分、养分、温度等都会影响根系的生长,在现有根系领域研究中,较少用到根体积,仅作为一个辅助性指标来观测,而根系形态特征对稻田甲烷排放的影响研究也较少。Singh等[19]发现稻田甲烷季节排放量与根体积和根孔隙度正相关。Das等[20]也得出甲烷排放通量与根体积和根长呈正相关。本研究中,早晚稻的甲烷排放量均随生育时期逐渐减少,根冠比也基本呈逐渐降低趋势,根体积先增后减,相关性分析结果中早稻和晚稻几乎相反,早稻的根冠比和根体积正相关,甲烷排放通量随根冠比和根体积的增大而增大,晚稻的根冠比和根体积呈极显著负相关,甲烷排放通量随根冠比的增加、根体积的减小而增加,原因可能是早稻的根体积在整个生育时期变化幅度较小,而晚稻的根体积在齐穗期出现峰值,与根冠比趋势不一致,导致相关性分析结果中早稻和晚稻的不同。有研究表明,在不同水氮处理下水稻根体积在齐穗期达最大值,根系生长旺盛,需水需肥较多[21]。在根体积对稻田甲烷排放的影响上仍需更系统的研究。
3.2 影响水稻品种甲烷排放的根际土壤特性
甲烷的产生主要是产甲烷菌利用土壤中的碳水化合物进行代谢的产物而生成[22]。水稻田长期处于淹水状态下,为产甲烷菌提供了厌氧环境。产甲烷菌作为一种重要的微生物,其活性和种类与土壤酶息息相关,且土壤酶还可反映土壤微生物的活性。其次,土壤酶也可以作为评价土壤肥力和土壤质量的重要指标[23]。微生物和植物根系是土壤酶的主要来源,少量土壤酶来自于动植物残体[24]。土壤微生物通过自身增殖、死亡后细胞裂解而释放出酶,并以吸附态的形式在土壤中积累[25]。从生物体脱离的酶,其唯一来源是微生物,许多微生物可以产生胞外酶[26]。土壤酶与土壤微生物相互反应,促进土壤中的生化反应过程,在有机物转化过程中发挥重要作用。目前,土壤酶被研究较多的几类有水解酶类、转移酶类和氧化还原酶类[23]。其中蔗糖酶和脲酶是水解酶中被研究较多的2种酶。从本研究结果可知,早晚稻的甲烷排放通量与根际土壤蔗糖酶活性呈负相关关系,且晚稻的根际土壤蔗糖酶活性在全生育期内变化趋势不明显。在甲烷排放与根际土壤酶活性方面的研究甚少,有学者对稻蟹共作模式做了土壤酶活性的相关研究,结果显示,稻蟹共作模式对土壤酶活性有一定的提高作用,促进了土壤酶活性的增强[27]。土壤酶活性一直是土壤研究方面的热点,受到许多研究人员的关注,如Bt水稻种植及秸秆还田对土壤酶活性的影响[23]、禾草灵对水稻生长和土壤酶活性的影响[28]、稻田土壤微生物和酶活性对碳元素变化的机制研究[29]、施加生物肥对稻田微生物和土壤酶活性的影响[30]等,关于甲烷排放和土壤酶活性的关系还有待研究。
不同早晚稻品种的甲烷排放通量变化趋势均表现为,分蘖期最高,且随着生育期进程甲烷排放量逐渐减少。不同的水稻品种,其根系、根际土壤特性存在显著差异,且与甲烷排放通量之间有一定的相关性。影响早稻甲烷排放的主要因素是根冠比、根际土壤蔗糖酶活性,晚稻是根冠比、根孔隙度、根体积和根系伤流量。在本试验研究结果中,对于早晚稻而言,降低植株根冠比在一定程度上可减排甲烷。
[1] Lai R,Follett R F,Stewart B A, Kimble J M. Soil carbon sequestration to mitigate climate change and advance food security[J].Soil Science,2007,172(12):943-956. doi:10.1097/ss.0b013e31815cc498.
[2] 韩广轩, 朱波, 高美荣, 张中杰. 中国稻田甲烷排放研究进展[J]. 西南农业学报, 2003, 16(S1):49-54. doi:10.16213/j.cnki.scjas.2003.s1.011.
Han G X, Zhu B, Gao M R, Zhang Z J. Research progress on methane emission from rice field in China[J]. Southwest China Journal of Agricultural Sciences, 2003, 16(S1):49-54.
[3] Baggs E M, Blum H. CH4 oxidation and emissions of CH4and N2O from Lolium perenne swards under elevatedatmospheric CO2[J]. Soil Biology and Biochemistry,2004,36(4):713-723. doi:10.1016/j.soilbio.2004.01.008.
[4] 王玲, 魏朝富, 谢德体. 稻田甲烷排放的研究进展[J]. 土壤与环境, 2002, 11(2):158-162. doi:10.3969/j.issn.1674-5906.2002.02.011.
Wang L, Wei C F, Xie D T. Research advances on methane emission from rice fields[J]. Soil and Environment Sciences, 2002, 11(2):158-162.
[5] 赵凌, 赵春芳, 周丽慧, 王才林. 中国水稻生产现状与发展趋势[J]. 江苏农业科学, 2015, 43(10):105-107. doi:10.15889/j.issn.1002-1302.2015.10.032.
Zhao L, Zhao C F, Zhou L H, Wang C L. Current status and development trend of rice production in China[J]. Jiangsu Agricultural Sciences, 2015, 43(10):105-107.
[6] 傅志强, 朱华武, 陈灿, 黄璜. 水稻根系生物特性与稻田温室气体排放相关性研究[J]. 农业环境科学学报, 2012, 30(12):2416-2421.
Fu Z Q, Zhu H W, Chen C, Huang H. Research on the correlation between the greenhouse gasese mission from paddy fields and the biological characteristics of rice root system[J]. Journal of Agro-Environment Science, 2012, 30(12):2416-2421.
[7] 夏仕明. 水稻根系形态生理与稻田甲烷排放的关系研究[D].扬州:扬州大学, 2018.
Xia S M. Relationship between morphological physiology of rice roots and methane emission from rice fields[D]. Yangzhou:Yangzhou University, 2018.
[8] 钟娟, 傅志强, 刘莉, 祝志娟, 郑华斌. 水稻植株甲烷传输能力与根系特性的相关性分析[J]. 作物杂志, 2017(4):105-112. doi:10.16035/j.issn.1001-7283.2017.04.018.
Zhong J, Fu Z Q, Liu L, Zhu Z J, Zheng H B. Correlation analysis of methane transport capacity and root characteristics in rice[J]. Crops, 2017(4):105-112.
[9] 刘依依. 水稻根系泌氧能力与根系特征及甲烷排放的相关性研究[D]. 长沙:湖南农业大学, 2015.
Liu Y Y. Correlation between oxygen secretion capacity, root characteristics and methane emission in rice roots[D]. Changsha: Hunan Agricultural University, 2015.
[10] 肖志祥,傅志强,徐华勤,苏珊,郭昱,张浪,唐剑武.双季稻品种根际特征与甲烷排放差异及其关系[J].环境科学,2019,40(2):904-914. doi:10.13227/j.hjkx.201805126.
Xiao Z X, Fu Z Q, Xu H Q, Su S, Guo Y, Zhang L, Tang J W. Differences and relationship between rhizosphere characteristics and methane emissions of double-cropping rice variety[J]. Environmental Science, 2019, 40(2):904-914.
[11] Bhullar G S, Iravani M, Edwards P J, OldeVenterink H. Methane transport and emissions from soil as affected by water table and vascular plants[J].BMC Ecology, 2013, 13(1):32. doi:10.1186/1472-6785-13-32.
[12] 彭廷, 陈浩, 陆云, 赵锦慧, 炎会敏, 李俊周, 杜彦修, 张静, 孙红正, 辛泽毓, 赵全志.水稻伤流强度与根系形态和生理指标的关系研究[J].河南农业大学学报,2016,50(3):299-303. doi:10.16445/j.cnki.1000-2340.2016.03.002.
Peng T, Chen H, Lu Y, Zhao J H, Yan H M, Li J Z, Du Y X, Zhang J, Sun H Z, Xin Z Y, Zhao Q Z. Study on the relationship between bleeding intensity and root morphology, root activity in rice[J]. Journal of Henan Agricultural University, 2016, 50(3):299-303.
[13] 傅志强, 黄璜, 何保良, 谢伟, 廖晓兰. 水稻植株通气系统与稻田CH4排放相关性研究[J]. 作物学报, 2007, 33(9):1458-1467. doi:10.3321/j.issn:0496-3490.2007.09.011.
Fu Z Q, Huang H, He B L, Xie W, Liao X L. Correlation between rice plant aerenchyma system and methane emission from paddy field[J]. Acta Agronomica Sinica,2007,33(9):1458-1467.
[14] 黄剑冰. 铁肥和水稻品种对稻田甲烷排放的影响[D]. 海口:海南大学, 2016.
Huang J B. Effects of iron fertilizer and rice varieties on methane emissions from paddy fields[D]. Haikou: Hainan Univeristy, 2016.
[15] 邓泓, 叶志鸿, 黄铭洪. 湿地植物根系泌氧的特征[J]. 华东师范大学学报(自然科学版), 2007(6):69-76. doi:10.3969/j.issn.1000-5641.2007.06.009.
Deng H, Ye Z H, Huang M H. Characteristics of radial oxygen loss from root of wetland plants[J]. Journal of East China Normal University(Natural Science),2007(6):69-76.
[16] 王增远, 徐雨昌, 李震, 王步军, 过益先, 丁玉萍, 王占珍. 水稻品种对稻田甲烷排放的影响[J]. 作物学报, 1999, 25(4):441-446. doi:10.3321/j.issn:0496-3490.1999.04.007.
Wang Z Y, Xu Y C, Li Z, Wang B J, Guo Y X, Ding Y P, Wang Z Z. Effect of rice cultivars on methane emissions from rice field[J]. Acta Agronomica Sinica, 1999, 25(4):441-446.
[17] 葛会敏, 陈璐, 于一帆, 陈云, 刘立军. 稻田甲烷排放与减排的研究进展[J]. 中国农学通报, 2015, 31(3):160-166.
Ge H M, Chen L, Yu Y F, Chen Y, Liu L J. Advances in methane emission and emission reduction in rice field[J]. Chinese Agricultural Science Bulletin, 2015, 31(3):160-166.
[18] 曹云英, 朱庆森, 郎有忠, 杨建昌, 王志琴,薛大忠. 水稻品种及栽培措施对稻田甲烷排放的影响[J]. 江苏农业研究, 2000, 21(3):22-27. doi:10.3969/j.issn.1671-4652.2000.03.005.
Cao Y Y, Zhu Q S, Lang Y Z, Yang J C, Wang Z Q,Xue D Z. Effect of rice varieties and cultivation approach on methane emission from paddy rice[J]. Jiangsu Agricultural Research, 2000, 21(3):22-27.
[19] Singh S, Singh J S, Kashyap A K. Methane flux from irrigated rice fields in relation to crop growth and N-fertilization[J]. Soil Biology and Biochemistry, 1993, 31(9):1219-1228. doi:10.1016/S0038-0717(99)00027-9.
[20] Das K, Baruah K K. Methane emission associated with anatomical and morphophysiological characteristics of rice(Oryza sativa)plant[J]. Physiologia Plantarum, 2008, 134(2):303-312. doi:10.1111/j.1399-3054.2008.01137.x.
[21] 梁天锋, 陈雷, 唐茂艳, 王强, 张晓丽, 吕荣华. 不同水氮处理对水稻根系生长及其产量的影响[J]. 南方农业学报, 2015, 46(7):1184-1189. doi:10.3969/j:issn.2095-1191.2015.7.1184.
Liang T F, Chen L, Tang M Y, Wang Q, Zhang X L, Lü R H. Effects of different water and nitrogen treatments on root growth and yield of rice[J]. Journal of Southern Agriculture, 2015,46(7):1184-1189.
[22] 保琼莉,王凤花,保万魁,黄益宗.稻秸添加对两种水稻土产甲烷古菌及细菌的影响[J].环境科学,2019,40(9):4202-4212.doi:10.13227/j.hjkx.201901195.
Bao Q L, Wang F H, Bao W K, Huang Y Z. Effects of rice straw addition on methanogenic archaea and bacteria in two paddy soils[J].Environmental Science,2019,40(9):4202-4212.
[23] 董斌. Bt水稻种植及秸秆还田对土壤酶、呼吸活性及土壤微生物功能和结构多样性的影响[D]. 杭州:浙江大学, 2011.
Dong B. Effects of vegetation of transgenic Btrice and its straw amendment on soil enzymes, respiration,functional and structural diversity of soil microorganisms under field conditions[D]. Hangzhou: Zhejiang University, 2011.
[24] 关松荫. 土壤酶及其研究法[M]. 北京:农业出版社,1986.
Guan S Y. Soil enzyme and its research method[M]. Beijing: Agricultural Publishing House, 1986.
[25] 谢伟. 不同水分条件下砷污染对土壤酶活性影响及机理研究[D]. 杨凌:西北农林科技大学, 2015.
Xie W. Effect of arsenic pollution on soil enzyme activity and mechanism under different water conditions[D]. Yangling: Northwest A&F University, 2015.
[26] 夏雪. 不同有机肥条件下施氮水平对土壤水解酶活性影响的研究[D]. 杨凌:西北农林科技大学, 2010.
Xia X. Effects of nitrogen application rate on soil hydrolase activity under different organic fertilizer conditions[D]. Yangling: Northwest A&F University, 2010.
[27] 王昂, 戴丹超, 马旭洲, 牟群, 于永清,吕为群. 稻蟹共作模式对土壤微生物量氮和酶活性的影响[J]. 江苏农业学报, 2019,35(1):76-84. doi:10.3969/j.issn.1000-4440.2019.01.011.
Wang A, Dai D C, Ma X Z, Mou Q, Yu Y Q,Lü W Q. Effects of rice-crab culture system on soil microbial biomass nitrogen and soil enzymes activities[J]. Jiangsu Journal of Agricultural Sciences,2019,35(1):76-84.
[28] 范晓季, 宋昊, 孙立伟, 钱海丰. 禾灵草对水稻生长和典型土壤酶活性的影响[J]. 生态毒理学报, 2017, 12(6):164-170. doi:10.7524/AJE.1673-5897.20160723001.
Fan X J, Song H, Sun L W, Qian H F. The effects of Diclofop-methyl on rice growth and typical soil enzyme activities[J]. Asian Journal of Ecotoxicology, 2017, 12(6):164-170.
[29] 李忠和. 吉林西部稻田土壤微生物及酶活性对碳变化响应机制研究[D]. 长春:吉林大学, 2014.
Li Z H. Response mechanism of soil microbes and enzyme activities to carbon changes in paddy fields in western Jilin Province[D]. Changchun: Jilin University, 2014.
[30] 荆瑞勇, 王彦杰, 王丽艳, 高亚梅, 孙冬梅,林志伟,宁德利,王伟东. 生物肥和氯嘧磺隆对水稻土壤微生物和土壤酶活性的影响[J]. 黑龙江八一农垦大学学报, 2009, 21(4):20-24. doi:10.3969/j.issn.1002-2090.2009.04.006.
Jing R Y, Wang Y J, Wang L Y, Gao Y M, Sun D M,Lin Z W, Ning D L,Wang W D. Influence of soil microorganism and enzyme activity with biological fertilizer and Chlorimuron-ethyl in paddy rice[J]. Journal of Heilongjiang August First Land Reclamation University,2009,21(4):20-24.
