磷(P)在植物生长发育过程中必不可少,在植物细胞中,磷以磷酸盐的形式存在,或与有机化合物结合,形成核苷酸、磷酸化代谢产物、磷脂等。拟南芥质体内膜上的磷酸转运蛋白(pPT:Plastic Phosphate translocator),是以无机磷酸盐(Pi)或磷酸化的C3、C5、C6化合物作为底物的逆向转运蛋白。通过利用pPT-cDNA序列进行同源比对,在拟南芥中找到了大量磷酸转运蛋白同源基因(PTh),这些相关磷酸转运蛋白(PTs:Phosphate translocators)对于维持细胞质基质中Pi的稳态,并严格完成Pi与磷酸化中间体交换的反应至关重要[1-2]。根据pPT蛋白的底物特异性和序列同源性,可将其分为4个不同的亚家族,分别是TPT(Triose phosphate/phosphate translocator)[3]、XPT(Xylulose 5-phosphate/phosphate translocator)[4]、GPT(Glucose 6-phosphate/phosphate translocator)[5]和PPT(Phosphoenolpyruvate/phosphate translocator/PT)[6],其中TPT介导以磷酸三糖和3-磷酸甘油酸酯(3-PGA)形式的固定碳从叶绿体到细胞质的输出。TPT也是第一个在分子水平上鉴定到的质体转运蛋白。Takemoto 等[7]对磷酸三糖/磷酸盐转运体(TPT)进行了一系列全原子分子动力学模拟,发现该转运体将叶绿体基质中的有机磷酸盐严格地与无机磷酸盐进行反向交换。
细胞壁是植物区分于动物的主要结构之一,对植物不仅具有保护和支持作用,还与植物细胞的物质运输、信号传导等生理功能有关。细胞壁的组成结构和成分复杂多样,主要由各类多糖物质组成。大多数细胞壁非纤维素多糖分子的合成部位是高尔基体,合成所用底物是核苷酸单糖,而核苷酸单糖主要产生于细胞质溶胶,之后再被运输至高尔基体用于合成各类非纤维素多糖分子。核苷酸糖转运蛋白(Nucleotide sugar transportors,NSTs)则扮演着将核苷酸单糖从细胞质溶胶运输到高尔基体中的重要角色[8-9]。NSTs目前在部分真核生物中有所发现。因为NSTs将核苷酸单糖跨膜转运到高尔基体中的同时从高尔基体中输出核苷一磷酸,因此它们也属于逆向转运蛋白。
pPT、PTh与NSTs都属于DMT(Drug/metabolite transportor,药物/代谢物转运蛋白)超家族,且pPT、PTh蛋白与NSTs蛋白的结构具有较高的相似性,在多个氨基酸残基部位具有较高的保守性,所以将pPT、PTh与NSTs蛋白统称为TPT/NST家族蛋白[2]。目前,拟南芥基因组被预测至少编码50个TPT/NST家族成员,而水稻基因组至少编码53个TPT/NST家族成员[8,10]。这些家族中的大部分成员功能未知,但也有部分成员的功能已被揭示。拟南芥中的AtNST-KT1蛋白被证实特异性转运UDP-半乳糖,而不转运其他形式的核苷酸单糖[10]。Bakker等[11]利用UDP-半乳糖转运缺陷的中国仓鼠卵巢细胞进行功能互补试验,在拟南芥中发现并克隆了2个能够转运UDP-半乳糖的基因UDP-GalT1和UDP-GalT2。Norambuena等[12]在烟草和酿酒酵母中证实拟南芥AtUTr2蛋白可以特异性地转运UDP-半乳糖,并且定位于高尔基体,推测其可能在拟南芥半乳糖的糖缀合物合成中起重要作用。Norambuena等[13]克隆了拟南芥中的AtUTr1基因,该基因编码一种类似于核苷酸单糖转运蛋白的跨膜疏水蛋白,并在酿酒酵母中被验证能够转运UDP-半乳糖和UDP-葡萄糖。Reyes等[14]发现拟南芥的内质网主要通过AtUTr1和AtUTr3蛋白吸收UDP-葡萄糖,并且当细胞积累错误折叠蛋白的时候,AtUTr1和AtUTr3蛋白参与向内质网中运输UDP-葡萄糖。当同时敲除AtUTr1和AtUTr3基因时,拟南芥的雄配子和雌配子均发育异常。拟南芥AtUTr7蛋白定位于高尔基体,在烟草和酵母表达系统中,AtUTr7蛋白被证实可以转运UDP-葡萄糖和UDP-半乳糖,而不转运其他形式的核苷酸单糖。在高浓度蔗糖培养条件下,AtUTr7基因缺失的拟南芥突变体植株表现出侧根的早期增殖以及根毛变形。此外,与野生型相比,突变体的侧向根尖中低甲酯化的半乳糖醛酸聚糖的分布有差异[15]。拟南芥GONST1基因编码核苷酸单糖转运蛋白,利用酵母缺失突变体证实GONST1蛋白具有转运GDP-甘露糖的活性,并且定位于高尔基体[16]。除GONST1外,拟南芥中还鉴定了多个GONST同源基因,包括GONST2、GONST3、GONST4、GONST5。利用酵母缺失突变体,证实GONST2与GONST1具有相似的转运GDP-甘露糖的活性,而GONST3、CONST4、CONST5转运GDP-甘露糖的活性较弱[17]。后来经Rautengarten等[18]的研究发现,GONST4能够特异性的转运GDP-岩藻糖,而非GDP-甘露糖,并将它重新命名为GDP-fucose transporter 1 (GFT1)。Ebert等[19]在拟南芥中鉴定了3个定位于高尔基体的UDP-木糖转运蛋白UXT1~UXT3,UXT1除定位于高尔基体外,还定位于内质网,UXT1基因的突变将导致拟南芥茎秆细胞壁的木糖含量比野生型减少30%。Seino等[20]通过同源比对,发现在水稻中具有多个编码UDP-半乳糖转运蛋白的基因序列,并克隆了其中4个成员,分别命名为OsUGT1、OsUGT2、OsUGT3、OsUGT4。利用UDP-半乳糖转运蛋白活性不足的Lec8细胞系,发现表达OsUGT1、OsUGT2、OsUGT3能够恢复Lec8细胞的缺陷表型,而表达OsUGT4不能恢复其表型;利用酵母表达系统证实OsUGT4是UDP-葡萄糖转运蛋白,而不是UDP-半乳糖转运蛋白。水稻OsNST1蛋白在酵母缺失突变体中被证实具有转运UDP-葡萄糖的功能,定位于高尔基体,OsNST1基因的突变导致水稻茎秆纤维素含量下降、细胞壁结构改变,从而造成植株机械强度减弱,研究表明,OsNST1蛋白为形成基质多糖提供糖基底物,从而调节纤维素的生物合成[21]。Rautengarten等[8]在拟南芥中识别和表征了6个双功能UDP-L-鼠李糖(Rha)/UDP-D-半乳糖(Gal)转运蛋白,命名为URGT(AtURGT1~AtURGT6),2019年Parra-Rojas等[22]发现AtURGT2基因与拟南芥种子表皮黏液的形成有关。另外,有研究发现NSTs还可以转运核苷硫酸盐[23]。
基于核苷酸单糖转运蛋白(NST)在植物中的重要性,本研究利用6个拟南芥UDP-鼠李糖/UDP-半乳糖转运蛋白序列(AtURGT1~AtURGT6),在水稻中比对到1个具有相同结构域的基因(LOC_Os02g40090),其与拟南芥中的AtURGT5(At4G09810)和AtURGT6(At1G34020)基因高度同源[8],将其命名为OsURGT1。OsURGT1基因编码的蛋白OsURGT1含有TPT/NST结构域。本研究通过生物信息学技术对OsURGT1基因的结构、启动子顺式作用元件、编码蛋白的氨基酸组成、亲/疏水性、跨膜结构域、高级结构、进化关系进行分析;通过激素处理和非生物胁迫处理水稻幼苗,探索OsURGT1基因在多种激素和逆境处理条件下的响应表达情况,从而推测其可能参与的生物学功能。
1 材料和方法
1.1 试验材料及试剂
本试验所用的水稻材料为籼型常规水稻T98B,种植于湖南农业大学生命科学楼。提取水稻RNA的试剂分别为TRIzol(Thermo Scientific公司)、无水乙醇、异丙醇和三氯甲烷(国药集团)、DEPC水(生工生物公司);反转录试剂盒为Maxima H Minus First Strand cDNA Synthesis Kit with dsDNase(Thermo Scientific公司);qPCR试剂盒为MonAmpTMSYBR®Green qPCR Mix(High ROX)(莫纳生物科技有限公司);处理的激素有ABA、GA、SA、Eth、MeJA、2,4-D(Sigma公司);非生物胁迫处理所需试剂有PEG4000、CdCl2、NaCl、H2O2和硝酸钙(国药集团);水稻幼苗水培试剂为霍格兰营养液固体粉末(Coolaber公司)。
1.2 水稻水培营养液配制
取霍格兰固体粉末1.26 g,溶解于1 000 mL的蒸馏水中,另外加入0.945 g硝酸钙共同溶解,高温高压灭菌后备用。
1.3 TRIzol法提取水稻RNA,并反转录成cDNA
取水稻组织样品50 mg,在预冷研钵中用液氮迅速研磨成粉。打冰备用,将研磨完的组织粉末分别各加入1 mL的TRIzol,旋涡振荡后置于冰上静置5 min,低温(4 ℃)离心(10 000 r/min)10 min后,吸取上清至新的1.5 mL离心管中,并加入三氯甲烷,混匀后冰上静置5 min,低温(4 ℃)离心(12 000 r/min)10 min后,吸取上清至新的1.5 mL离心管中,并加入异丙醇,轻缓混匀后冰上静置5 min,低温(4 ℃)离心(10 000 r/min)10 min后,倒掉上清,加入500 μL 75%乙醇,混匀后,低温(4 ℃)离心(10 000 r/min)5 min,倒掉上清,室温放置2 min,加入DEPC水于55 ℃溶解RNA,溶解3 min后保存于-80 ℃冰箱备用。
反转录前先配置DNA消化反应体系。在干净的PCR管中加入1 μg的RNA、1 μL的dsDNase和1 μL的10×dsDNase Buffer,并加DEPC水补充到10 μL体积,之后37 ℃温育2 min,加入1 μL 10 mmol/L DTT。然后进行反转录合成cDNA第一链。在以上消化好的11 μL RNA模板中分别加入1 μL的100 μmol/L Oligo(dT)18Primer、1 μL的10 mmol/L dNTP Mix、4 μL 5×RT Buffer和1 μL的Maxima H Miuns Enzyme Mix,最后补充2 μL 的DEPC水,混匀于50 ℃温育30 min,85 ℃温育5 min。
1.4 qRT-PCR反应
设计特异性良好的qRT-PCR引物,扩增产物长度控制在80~200 bp,引物长度为18~25 bp。qRT-PCR反应体系构建,在干净的PCR管中加10 μL MonAmpTMSYBR®Green qPCR Mix,0.4 μL的上引(下引),cDNA模板为2 μL(cDNA原液稀释10倍),最后加DEPC水补充到20 μL。
1.5 生物信息学分析
利用ExPASy-ProtParam工具(https://web.expasy.org/protparam/)分析OsURGT1蛋白的氨基酸组成及理化性质;利用ExPASy-ProtScale工具(https://web.expasy.org/protscale/)分析OsURGT1蛋白的亲/疏水性。利用软件TMHMM Server v.2.0对OsURGT1蛋白进行跨膜结构域预测。使用软件GOR4、Phyre2预测OsURGT1蛋白的二级结构和三级结构。在NCBI数据库中通过同源比对,选择16个与OsURGT1蛋白高度同源的物种蛋白,运用Mega 6.06软件对这些蛋白以临近法构建系统进化树并进行分析。运用在线网站Exon-Intron Graphic Maker(http://www.wormweb.org/exonintron)对OsURGT1基因进行内含子和外显子分析。利用 Plant CARE 在线网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/)对OsURGT1基因的启动子序列进行顺式作用元件分析。
1.6 OsURGT1基因在水稻中的转录表达谱分析
取三叶期水稻的根、叶片,成熟期的根、茎、叶、叶鞘、穗,用于OsURGT1基因的组织转录表达谱分析。将三叶期水稻幼苗在20% PEG4000(干旱)、100 mmol/L H2O2(氧化)、42 ℃(高温)、4 ℃(低温)、0.15 mol/L NaCl(盐)、0.3 mmol/L CdCl2(镉)等逆境条件下处理,处理不同时间段后,取地上部分组织样品,提取RNA并进行反转录,之后进行qRT-PCR反应,检测OsURGT1基因对于各非生物胁迫处理的响应转录表达谱。将三叶期水稻幼苗分别用ABA(脱落酸)、GA(赤霉素)、SA(水杨酸)、MeJA(茉莉酸甲酯)等激素进行处理(所有激素的终浓度为0.1 mmol/L),处理不同时间段后,取地上部分组织样品,抽提RNA并进行反转录,之后进行qRT-PCR反应,检测OsURGT1基因对于激素诱导处理的响应表达谱。用于qRT-PCR反应的引物序列见表1。以水稻泛素基因Ubiquitin (LOC_Os03g13170)为内参基因。
表1 水稻OsURGT1基因表达量分析相关引物
Tab.1 Primers for gene expression analysis of OsURGT1 in rice
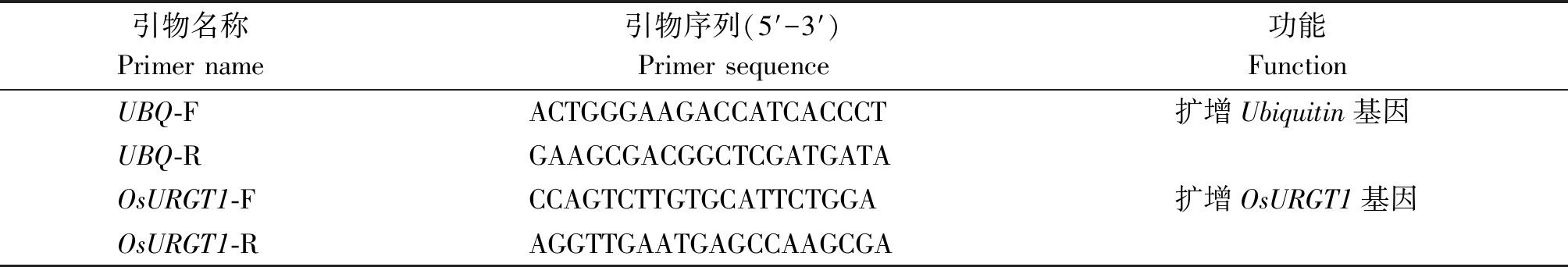
引物名称 Primer name 引物序列(5′-3′)Primer sequence功能FunctionUBQ-FACTGGGAAGACCATCACCCT扩增Ubiquitin基因UBQ-RGAAGCGACGGCTCGATGATAOsURGT1-FCCAGTCTTGTGCATTCTGGA扩增OsURGT1基因OsURGT1-RAGGTTGAATGAGCCAAGCGA
2 结果与分析
2.1 OsURGT1基因的获得
通过序列同源比对,最终从水稻基因组数据库(http://rice.plantbiology.msu.edu/)中找到OsURGT1基因,全长为3 421 bp,外显子和内含子分析结果见图1,共有5个外显子。基因全长CDS为996 bp,编码331个氨基酸长度的蛋白质(图2)。该基因长度符合NST蛋白的特征,具有300~400个氨基酸残基。
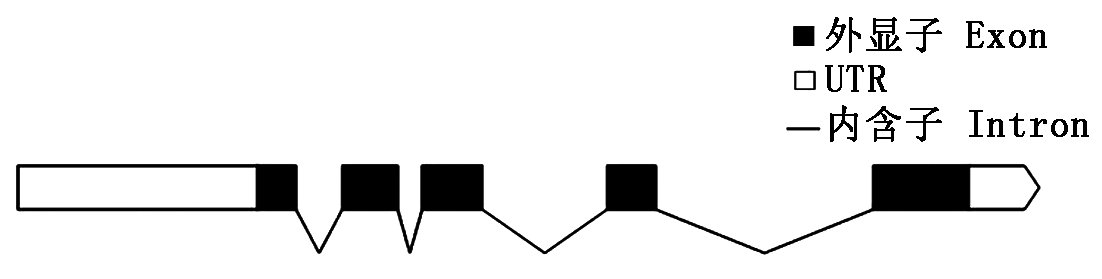
图1 水稻OsURGT1基因的结构
Fig.1 Gene structure of OsURGT1 in Oryza sativa
2.2 生物信息学分析
2.2.1 OsURGT1基因编码蛋白的氨基酸组成分析 OsURGT1基因编码蛋白OsURGT1的相对分子质量为36 397.18 ku,其分子式为C1685H2654N420O441S17,等电点为9.57,其中带负电荷的氨基酸残基个数有13个(Asp、Glu),带正电荷的氨基酸残基个数有25个(Arg、Lys),亲水性的总平均值为0.618。如图3结果所示,OsURGT1蛋白氨基酸组成中,亮氨酸(Leu)的含量最高,其次是缬氨酸(Val),含量最低的是色氨酸(Trp)、半胱氨酸(Cys)和天冬氨酸(Asp),氨基酸含量在5%以上的有9种氨基酸。
2.2.2 OsURGT1蛋白的亲/疏水性分析 利用ProtScale工具对OsURGT1蛋白进行亲/疏水性分析。如图4所示,OsURGT1蛋白的氨基酸分布于0以上的阈值大于分布于0以下的阈值,推测OsURGT1蛋白为疏水性蛋白,疏水性最大值为3.367,位于第139个氨基酸,最小值为-2.500,位于第306个氨基酸。

图2 水稻OsURGT1基因的全长CDS及对应的氨基酸序列
Fig.2 Full-length CDS and deduced amino acid sequence of OsURGT1 gene in Oryza sativa
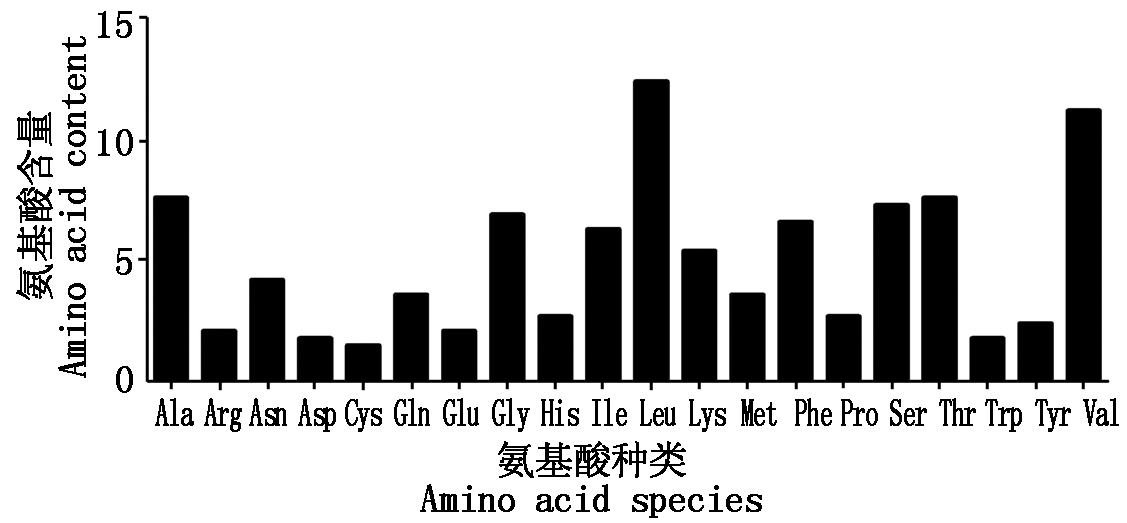
Val.缬氨酸;Tyr.酪氨酸;Trp.色氨酸;Thr.苏氨酸;Ser.丝氨酸;Pro.脯氨酸;Phe.苯丙氨酸;Met.甲硫氨酸;Lys.赖氨酸;Leu.亮氨酸;Ile.异亮氨酸;His.组氨酸;Gly.甘氨酸;Glu.谷氨酸;Cys.半胱氨酸;Gln.谷氨酰胺;Asp.天冬氨酸;Asn. 天冬酰胺;Arg.精氨酸;Ala.丙氨酸。
Val.Valine;Tyr.Tyrosine;Trp.Tryptophan;Thr.Threonine;Ser.Serine;Pro.Proline;Phe.Phenylalanine;Met.Methionine;Lys.Lysine;Leu.Leucine;Ile.Isoleucine;His.Histidine;Gly.Glycine;Glu.Glutamic;Cys.Cysteine;Gln.Glutamine;Asp.Aspartic;Asn.Asparagine;Arg.Arginine;Ala.Alanine.
图3 OsURGT1蛋白的氨基酸组成
Fig.3 Amino acid composition of OsURGT1
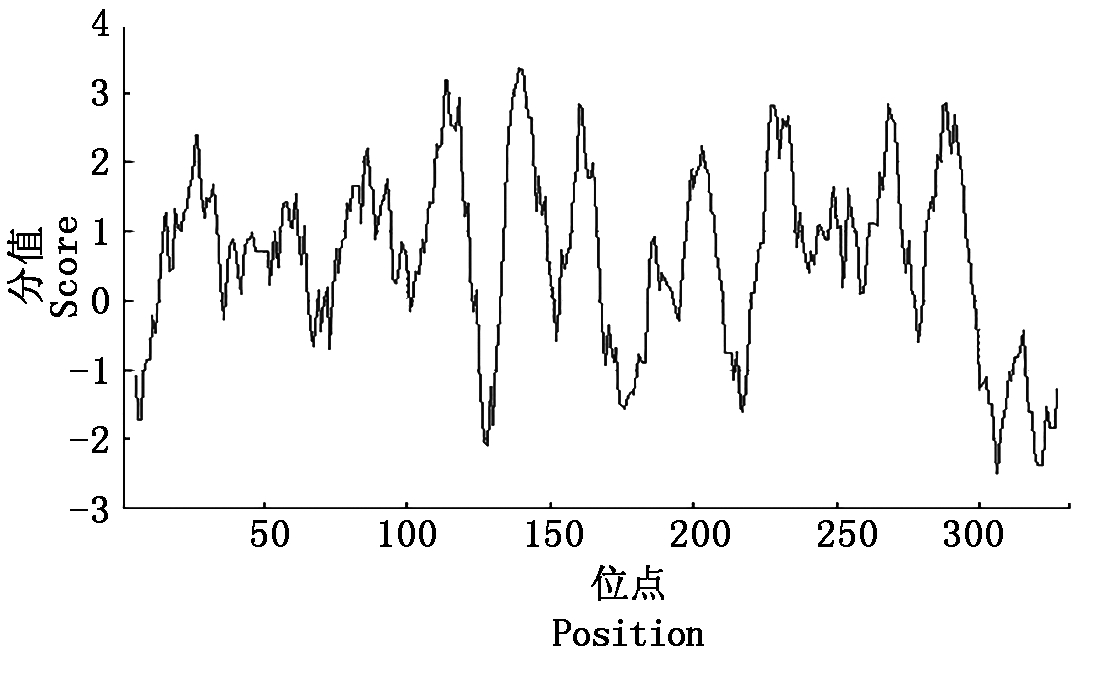
图4 OsURGT1蛋白的亲/疏水性分析
Fig.4 Hydrophilici/hydrophobic analysis of OsURGT1 protein
2.2.3 OsURGT1蛋白的跨膜结构域分析 如图5所示,OsURGT1蛋白有9个跨膜结构域,推测其是一个膜蛋白。
2.2.4 OsURGT1蛋白的高级结构分析 如图6-A、B所示,OsURGT1蛋白预测的二级结构中α螺旋有59个,占比17.82%;延伸链有119个,占比35.95%;无规则卷曲有153个,占比46.22%。对OsURGT1蛋白进行三级结构建模预测(图6-C),结果显示,依据一个与其匹配度最高的模板蛋白,以100%的置信度对OsURGT1蛋白的291个氨基酸(覆盖率达88%)进行了建模,模板蛋白是一个膜蛋白,并且是一个GDP-甘露糖转运蛋白,即NST蛋白。这表明OsURGT1蛋白不但在一级结构上符合NST的特征,在高级结构上亦具有NST的特征。
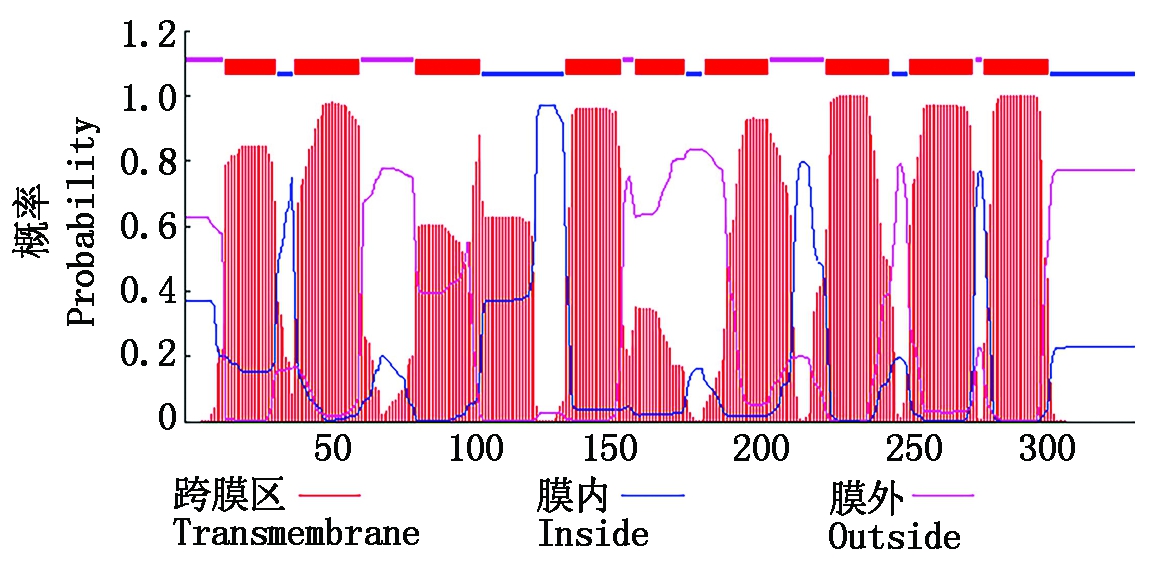
图5 OsURGT1蛋白的跨膜结构域分析
Fig.5 Transmembrane domain analysis of OsURGT1 protein
2.2.5 OsURGT1蛋白的进化树分析 在NCBI数据库中,通过蛋白序列比对,选取16个物种中与水稻OsURGT1同源性较高的蛋白,即山茶CsURGT(Camellia sinensis,XP_028106522)、油棕EgURGT(Elaeis guineensis, XP_010906037)、短花药野生稻ObURGT(Oryza brachyantha, XP_006647512)、哈氏黍PhURGT(Panicum hallii, XP_025814183)、猪粟PmURGT(Panicum miliaceum,RLM80742)、毛果杨PtURGT(Populus trichocarpa,XP_002307514)、高粱SbURGT(Sorghum bicolor,XP_021310114)、小米SiURGT(Setaria italica, XP_004953102)、玉米ZmURGT(Zea mays, PWZ39018)、二穗短柄草BdURGT(Brachypodium distachyon, XP_003575354)、铁皮石斛DcURGT(Dendrobium catenatum,XP_020688249)、陆地棉GhURGT(Gossypium hirsutum,XP_016732973)、三裂叶薯ItURGT(Ipomoea triloba,XP_031117650.)、核桃JeURGT(Juglans regia, XP_018846584)、荷花NnURGT(Nelumbo nucifera,XP_010242229)、可可TcURGT(Theobroma cacao, XP_007048167)。运用Mega 6.06软件对这17个同源性较高的蛋白进行进化树分析,由图7结果可知,进化树总共分成了两大分支,在第一分支上OsURGT1蛋白与短花药野生稻中的ObURGT亲缘关系最近,而与第二分支上的物种蛋白(可可、山茶、三裂叶薯、荷花、陆地棉、核桃、毛果杨)亲缘关系较远。
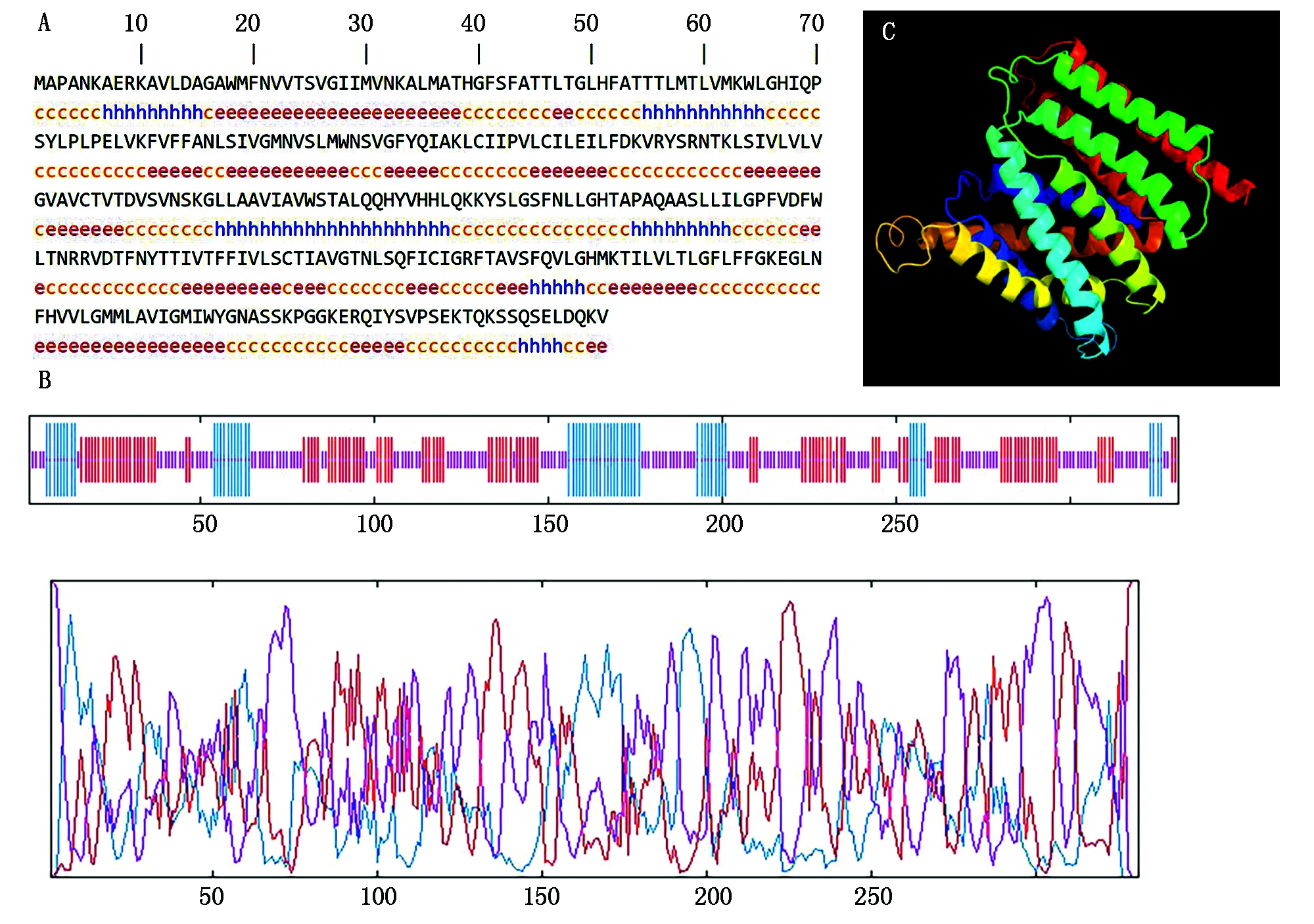
A.OsURGT1蛋白的二级结构,不同的字母代表不同的二级结构(h.α螺旋;e.延伸链;c.无规则卷曲);B.OsURGT1蛋白的二级结构的评分结构(蓝色.α 螺旋;紫色.无规则卷曲;红色.延伸链);C.OsURGT1蛋白的三级结构预测。
A.Secondary structure prediction results of OsURGT protein;Different letters represent different types of secondary structures (h.Alpha helix;e.Extended strand;c. Random coil);B.The scoring results of the secondary structures in OsURGT protein (Blue.Alpha helix;Purple.Random coil;Red.Extended strand);C.A predicted tertiary structure of OsURGT1 protein.
图6 OsURGT1蛋白的高级结构分析
Fig.6 Advanced structure analysis of OsURGT1 protein
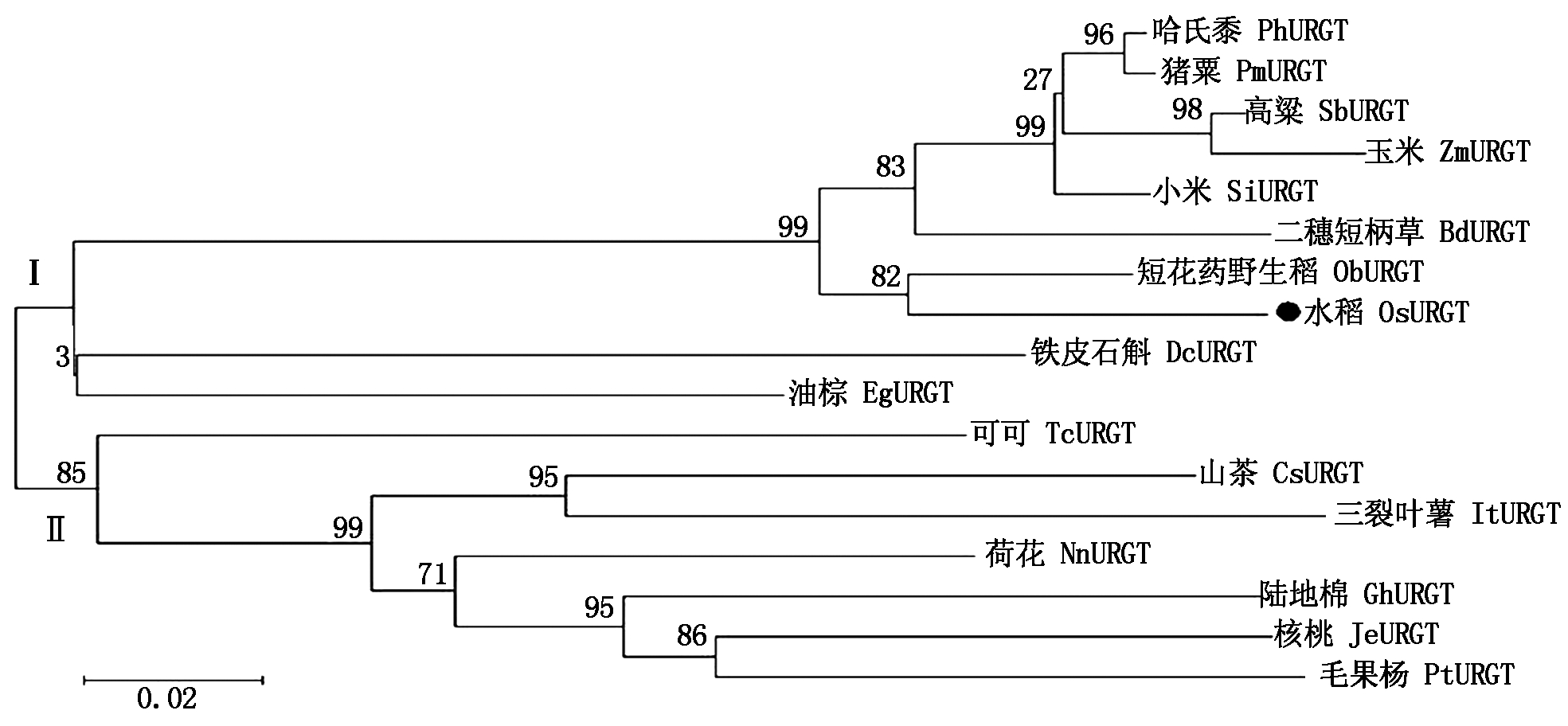
图7 OsURGT1相关蛋白的进化树分析
Fig.7 Phylogenetic tree analysis for OsURGT1 related proteins
2.2.6 OsURGT1基因启动子的顺式作用元件分析 截取OsURGT1基因起始密码子ATG前2 000 bp的序列作为基因启动子序列,运用在线工具Plant CARE对OsURGT1基因启动子序列进行顺式作用元件分析(表2)。除部分未知功能顺式元件外,预测发现启动子区域含有参与激素调控的顺式作用元件,如ABA(脱落酸)、MeJA(茉莉酸钾酯)、GA(赤霉素),还有参与光响应调控和胁迫诱导调控的顺式作用元件,从而推测OsURGT1基因可能参与部分激素调控与逆境胁迫响应。
2.3 水稻OsURGT1基因的表达谱分析
2.3.1 组织表达谱 取三叶期水稻幼苗的根和叶,孕穗期水稻的根、茎、叶、穗、叶鞘分别进行OsURGT1基因的转录表达谱分析。从图8可以看出,在三叶期时,OsURGT1基因在叶中的表达量显著高于根中表达量。孕穗期时,在叶中的表达量最高,其次是叶鞘,表达量最低的是根。从以上结果可知,OsURGT1基因在植株的整个生长发育期都有表达,说明该基因参与水稻植株的生长发育过程。
表2 OsURGT1基因的启动子顺势作用元件
Tab.2 Cis-acting elements prediction for the promoter sequence of OsURGT1 gene
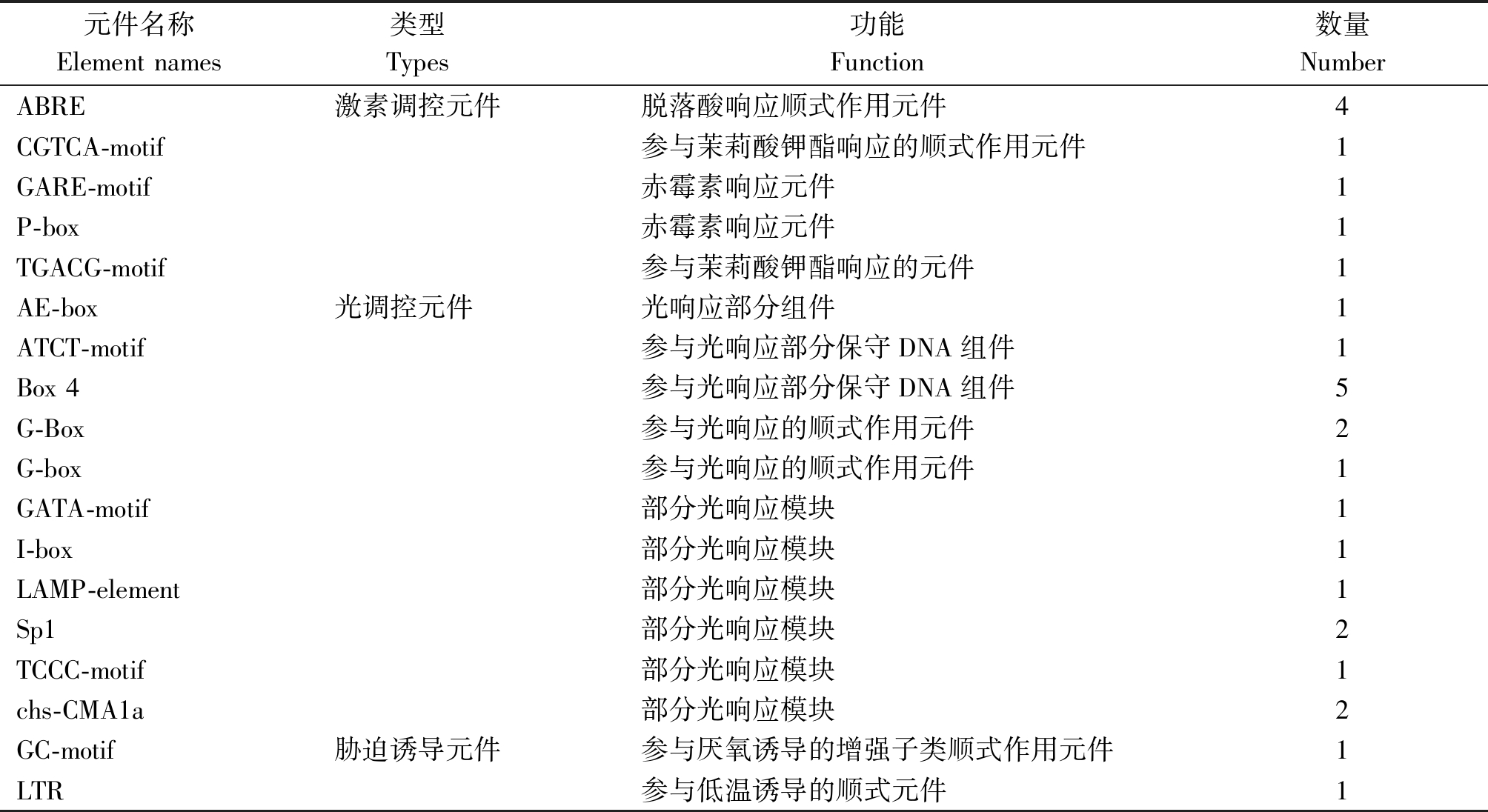
元件名称Element names类型Types功能Function数量NumberABRE激素调控元件脱落酸响应顺式作用元件4CGTCA-motif参与茉莉酸钾酯响应的顺式作用元件1GARE-motif赤霉素响应元件1P-box赤霉素响应元件1TGACG-motif参与茉莉酸钾酯响应的元件1AE-box光调控元件光响应部分组件1ATCT-motif参与光响应部分保守DNA组件1Box 4参与光响应部分保守DNA组件5G-Box参与光响应的顺式作用元件2G-box参与光响应的顺式作用元件1GATA-motif部分光响应模块1I-box部分光响应模块1LAMP-element部分光响应模块1Sp1部分光响应模块2TCCC-motif部分光响应模块1chs-CMA1a部分光响应模块2GC-motif胁迫诱导元件参与厌氧诱导的增强子类顺式作用元件1LTR参与低温诱导的顺式元件1
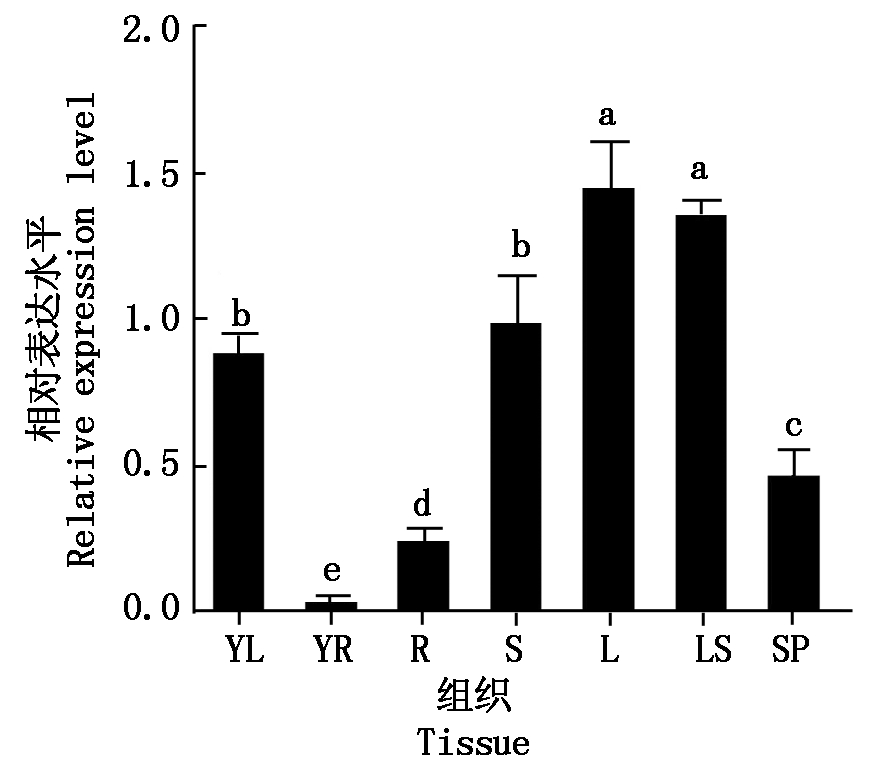
YR.三叶期的根;YL.三叶期的叶;R.孕穗期的根;S.孕穗期的茎;L.孕穗期的叶;LS.孕穗期的叶鞘;SP.穗。柱形图上方的不同小写字母表示OsURGT1基因在不同组织中表达量的显著性差异(P<0.05)。图9-10同。
YR.Root at seedling stage with three fully expanded leaves;YL. Leaves at seedling stage with three fully expanded leaves;R.Root at booting stage;S.Stem at booting stage;L.Leaf at booting stage;LS. Leaf sheath at booting stage;SP.Spike at booting stage. The different lowercase letters on the histogram indicate significant differences in the expression of OsURGT1 gene in different tissues at 0.05 level.The same as Fig.9-10.
图8 OsURGT1基因的组织表达谱分析
Fig.8 The expression profile analysis of OsURGT1 gene in different tissues of rice
2.3.2 激素诱导表达谱 为了解水稻OsURGT1基因是否参与激素调控途径,将三叶期水稻幼苗用6种激素处理,分别是ABA(脱落酸)、GA(赤霉素)、SA(水杨酸)、Eth(乙烯)、2,4-D(植物生长调节剂)、MeJA(茉莉酸钾酯),在处理不同时间段后(0,1,3,6,12,24 h)分别取地上部分组织样品,抽提RNA,反转录后进行OsURGT1基因表达量检测。从图9可知,在2,4-D处理后,OsURGT1基因表达量在处理1 h后急剧上升,之后一直保持在一个相对较高的水平;在ABA处理后,OsURGT1基因的表达量总体呈现一个波动上升的过程,在0~3 h逐渐上升,6 h下降,之后逐渐缓慢上升,在处理24 h达到最大值;在Eth处理后,OsURGT1基因的表达量在处理1 h急剧上升,3 h下降之后呈逐渐上升趋势,在处理24 h表达量达最大值;在SA和GA处理后,OsURGT1基因表达量总体呈上升趋势,但前期上升相对缓慢,在处理12~24 h过程中上升幅度较大;而在MeJA处理后,OsURGT1基因的表达量在处理1 h降低,但在3 h显著升高后快速降低至0 h水平,之后又持续升高。经过表达量的差异显著性分析结果可看出,经2,4-D、ABA、Eth激素处理后OsURGT1基因在处理1~24 h的表达量与在处理0 h的表达量差异显著;经GA和SA处理后OsURGT1基因在处理3~24 h的表达量与在处理0~1 h的表达量差异显著;经MeJA处理后OsURGT1基因在处理1,3,12,24 h的表达量与在处理0,6 h的表达量差异显著。根据以上结果推测,OsURGT1基因可能直接或间接参与了ABA、GA、SA、Eth、2,4-D、MeJA这几种激素的相关调控过程。
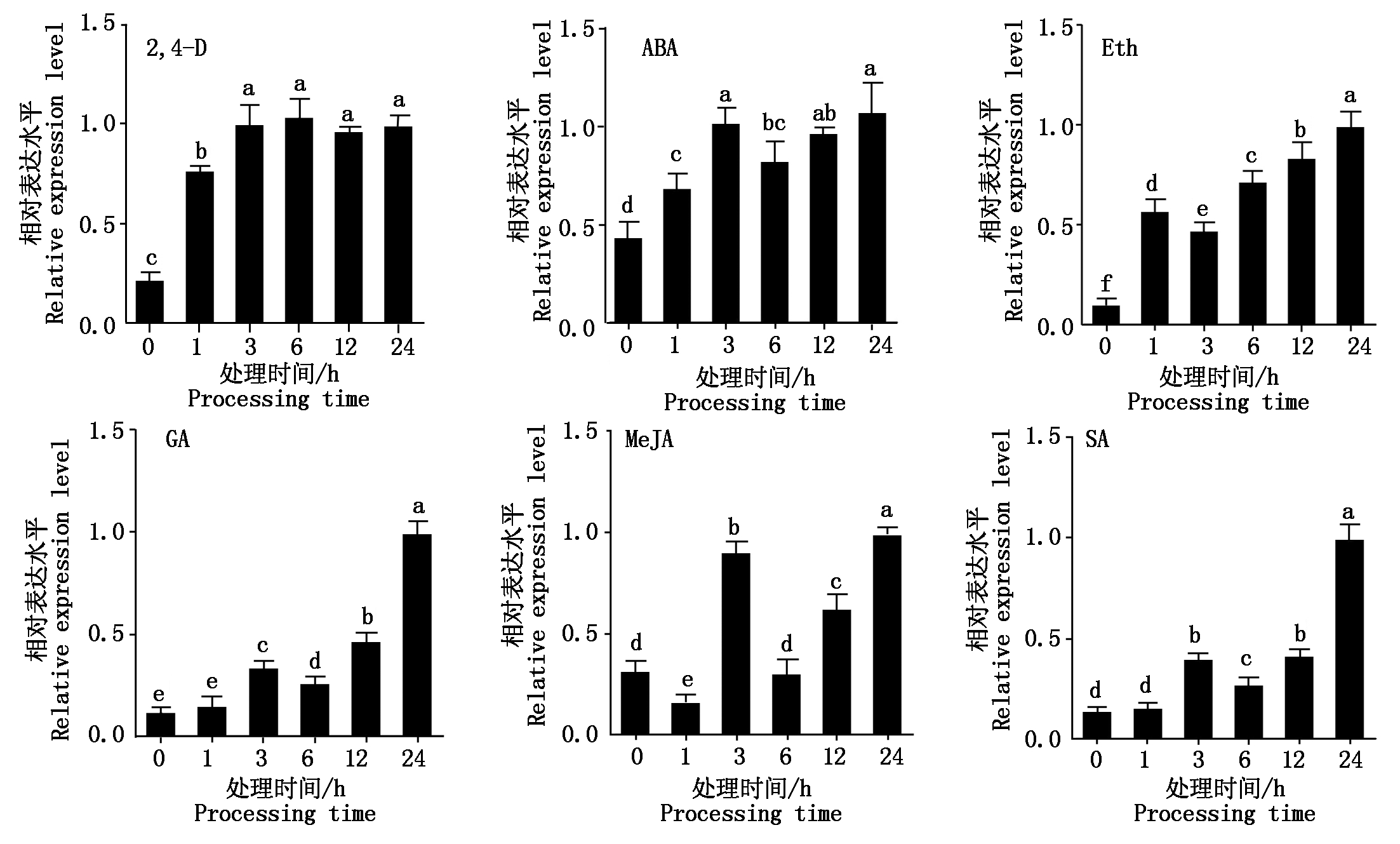
图9 水稻OsURGT1基因的激素处理诱导表达谱分析
Fig.9 The induced expression profile analysis of gene OsURGT1 after treated by hormones
2.3.3 非生物胁迫处理诱导表达谱 为了解水稻OsURGT1基因是否参与多种非生物胁迫的功能调控,将三叶期水稻幼苗分别用6种非生物胁迫处理,分别是PEG4000(干旱)、H2O2(氧化)、42 ℃(高温)、4 ℃(低温)、NaCl(盐)、CdCl2(镉),在处理不同时间段后(0,1,3,6,12,24 h)分别取地上部分组织样品,抽提RNA,反转录后进行OsURGT1基因的表达量检测。从图10可知,OsURGT1基因在42 ℃高温条件处理下,表达量在处理1 h急剧上升,又在处理3 h急剧降低至比处理0 h还低的水平,之后再缓慢上升至第2高的表达水平;在CdCl2条件处理下,OsURGT1基因的表达量在处理1 h显著升高,3 h急剧降低后又缓慢上升至0 h水平,24 h时又显著降低;在4 ℃低温条件处理下,OsURGT1基因的表达量先缓慢上升,在处理6 h急剧上升至相对最大值,之后有一定程度的降低,在处理1~24 h的表达量均比0 h的表达量高;在PEG4000干旱条件处理下,OsURGT1基因的表达量在1 h上升,之后呈现一个波动下降的趋势,且在处理3~24 h表达量均显著低于0 h;在NaCl盐条件处理下,OsURGT1基因的表达量在处理1 h达到最大值,之后急剧下降,在处理6 h达到最小值,之后有一定程度的上升; 在H2O2条件处理下,OsURGT1基因的表达量总体呈现一个波动下降的趋势,在1 h降低,3 h升高,6 h降低,12 h有所升高,之后又降低。通过表达量的差异显著性分析结果可看出,经高温、镉、低温、干旱、盐处理后,OsURGT1基因的表达量在处理0~24 h的整个过程中的变化差异较显著;经氧化处理后,OsURGT1基因的表达量在处理0,3 h、1,12 h、6,24 h 3组的组内两两之间无显著性差异,3组的相互之间存在显著性差异,但是从处理的整个过程看表达量变化幅度不大。根据以上结果可知,OsURGT1基因对干旱、氧化、高温、低温、盐、重金属镉这些逆境胁迫都有不同程度的响应,说明OsURGT1基因极有可能在水稻中参与了这些逆境胁迫的功能调控过程。
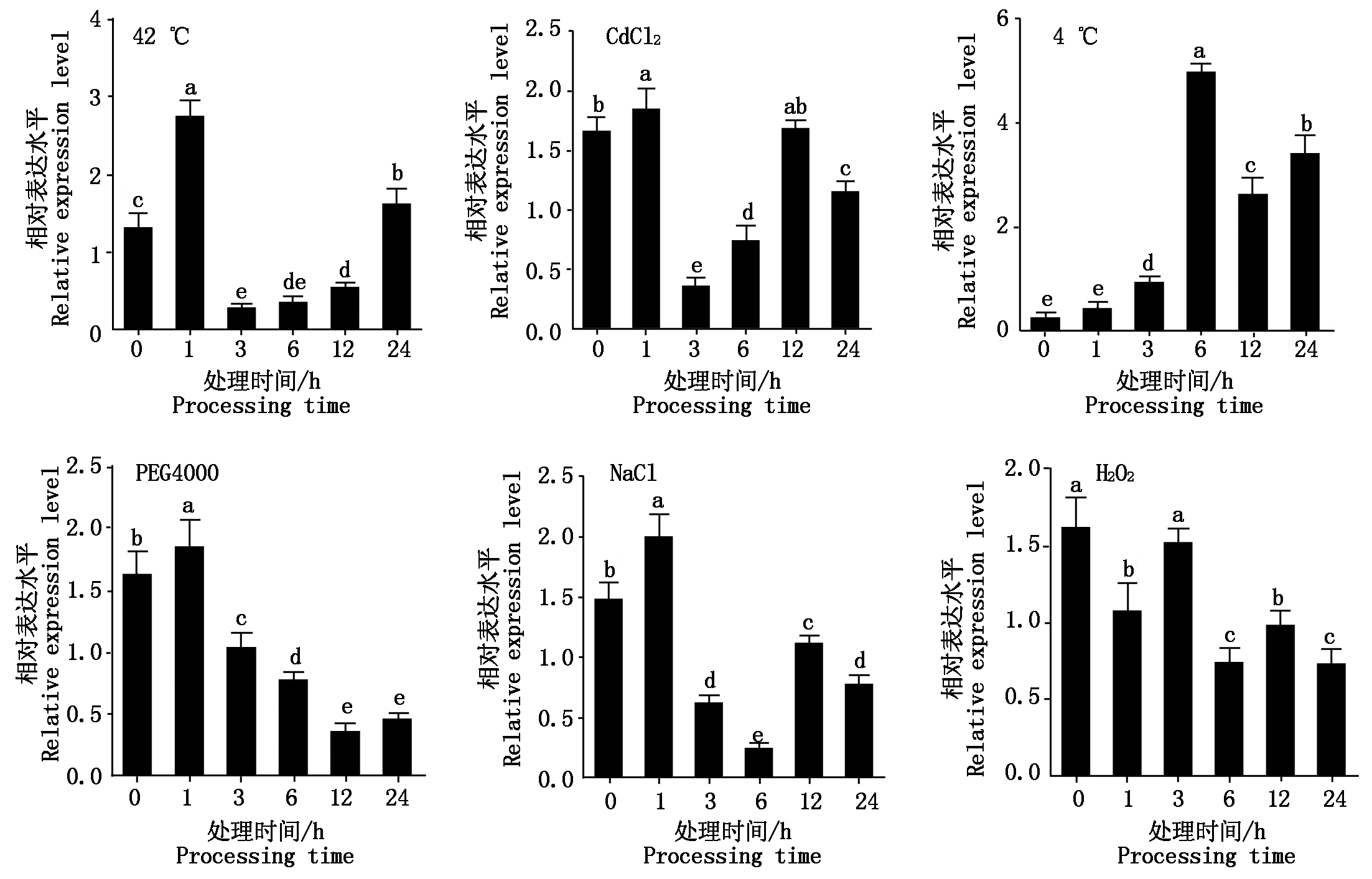
图10 非生物胁迫处理后OsURGT1基因的诱导表达谱分析
Fig.10 The inducted expression profile analysis of gene OsURGT1 after treated by abiotic stresses
3 讨论
植物生长发育需要各种糖基化合物,包括各类多糖、糖蛋白、蛋白多糖、糖脂和其他一些次生代谢产物等。核苷酸单糖则是形成这些糖基化合物的基础小分子化合物[24]。大多数核苷酸单糖在细胞质溶胶中产生后,由高尔基体膜或内质网膜上的NSTs蛋白将这些核苷酸单糖反向转运至高尔基体或者内质网中,再经高尔基体或内质网膜上的糖基转移酶(GTs)将各种各样的UDP-或GDP-糖残基用于各种多糖分子的生物合成[25-26],因此,NSTs蛋白大多都定位于高尔基体[15-17],部分定位于内质网[20],或者同时定位于高尔基体和内质网[14,19]。除此之外,NSTs蛋白还具有一些相似的特点,如一般由300~400个氨基酸组成,拥有6~10个跨膜结构域,催化位点面向细胞器的内腔,一般为疏水性蛋白等[27-29]。本研究利用拟南芥AtURGT基因序列进行同源比对,获得了水稻OsURGT1基因,其全长为3 421 bp,CDS全长为996 bp,含有5个外显子,编码331个氨基酸长度的蛋白质;预测结果表明,OsURGT1蛋白含有9个跨膜结构域,是一个膜蛋白;蛋白亲/疏水性预测结果显示,OsURGT1蛋白为疏水性蛋白;蛋白的三级结构建模结果显示,OsURGT1蛋白与一个NST蛋白模板高度相似,88%的氨基酸残基建模置信度达到100%。以上结果皆表明,OsURGT1基因编码蛋白的序列及结构特点符合NST家族蛋白的特点,OsURGT1蛋白极有可能在水稻中发挥NST蛋白功能,至于其具体转运哪种类型的核苷酸单糖,有待进一步试验证实。
组织转录表达谱检测结果显示,OsURGT1基因在水稻苗期及孕穗期的各个组织中都有表达,在叶和茎中的表达量相对较高,在根和穗中表达量相对较低,尤其是在根中的表达量相对最低,说明OsURGT1基因在水稻的整个生长发育过程中应该发挥一定的作用,且在叶的生长发育过程中可能发挥相对更重要的作用。
通过对OsURGT1基因的启动子序列进行顺式作用元件分析,发现OsURGT1基因的启动子区域含有参与激素调控(ABA-脱落酸、MeJA-茉莉酸钾酯、GA-赤霉素)、光响应和胁迫诱导调控(低温诱导和厌氧)的顺式作用元件;不同激素及非生物胁迫处理响应表达水平检测结果表明,OsURGT1基因对于各种激素(ABA-脱落酸、GA-赤霉素、SA-水杨酸、Eth-乙烯、2,4-D-植物生长调节剂、MeJA-茉莉酸钾酯)处理皆有较强的转录表达水平的变化;对于非生物胁迫处理中的高低温、PEG4000、CdCl2、NaCl也有一定程度的响应表达。综上,OsURGT1基因极有可能参与水稻以上相关调控途径,但其具体的调控功能及机理有待进一步深入探索。
[1] Fabiańska I, Bucher M, Häusler R E. Intracellular phosphate homeostasis-A short way from metabolism to signaling[J]. Plant Science,2019,286:57-67. doi:10.1016/j.plantsci.2019.05.018.
[2] Knappe S,Flügge U I,Fischer K. Analysis of the plastidic phosphate translocator gene family in Arabidopsis and identification of new phosphate translocator-homologous transporters,classified by their putative substrate-binding site[J]. Plant Physiology,2003,131(3):1178-1190. doi:10.1104/pp.016519.
[3] Lee Y C,Nishizawa T,Takemoto M,Kumazaki K,Yamashita K,Hirata K,Minoda A,Nagatoishi S,Tsumoto K,Ishitani R,Nureki O. Structure of the triose-phosphate/phosphate translocator reveals the basis of substrate specificity[J]. Nature Plants,2017,3(10):825-832. doi:10.1038/s41477-017-0022-8.
[4] Hilgers E J A,Schöttler M A,Mettler-Altmann T,Krueger S,Dörmann P,Eicks M,Flügge U I,Häusler R E. The combined loss of triose phosphate and xylulose 5-phosphate/phosphate translocators leads to severe growth retardation and impaired photosynthesis in Arabidopsis thaliana tpt/xpt double mutants[J]. Plant Science,2018,9,1331. doi:10.3389/fpls.2018.01331.
[5] Kammerer B,Fischer K,Hilpert B,Schubert S,Gutensohn M,Weber A,Flügge U I. Molecular characterization of a carbon transporter in plastids from heterotrophic tissues:The glucose 6-phosphate/phosphate antiporter[J]. The Plant Cell,1998,10(1):105-117. doi:10.1105/tpc.10.1.105.
[6] Fischer K,Kammerer B,Gutensohn M,Arbinger B,Weber A,Häusler R E,Flügge U I. A new class of plastidic phosphate translocators:A putative link between primary and secondary metabolism by the phosphoenolpyruvate/phosphate antiporter[J]. The Plant Cell,1997,9(3):453-462. doi:10.1105/tpc.9.3.453.
[7] Takemoto M,Lee Y C,Ishitani R,Nureki O. Free energy landscape for the entire transport cycle of triose-phosphate/phosphate translocator[J]. Structure,2018,26(9):1284-1296. doi:10.1016/j.str.2018.05.012.
[8] Rautengarten C,Ebert B,Moreno I,Temple H,Herter T,Link B,Do as-Cofré D,Moreno A,Saéz-Aguayo S,Blanco F,Mortimer J C,Schultink A,Reiter W D,Dupree P,Pauly M,Heazlewood J L,Scheller H V,Orellanac A. The golgi localized bifunctional UDP-rhamnose/UDP-galactose transporter family of Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America,2014,111(31):11563-11568. doi:10.1073/pnas.1406073111.
as-Cofré D,Moreno A,Saéz-Aguayo S,Blanco F,Mortimer J C,Schultink A,Reiter W D,Dupree P,Pauly M,Heazlewood J L,Scheller H V,Orellanac A. The golgi localized bifunctional UDP-rhamnose/UDP-galactose transporter family of Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America,2014,111(31):11563-11568. doi:10.1073/pnas.1406073111.
[9] Rautengarten C,Birdseye D,Pattathil S,McFarlane H E,Saez-Aguayo S,Orellana A,Persson S,Hahn M G,Scheller H V,Heazlewood J L,Ebert B. The elaborate route for UDP-arabinose delivery into the golgi of plants[J]. Proceedings of the National Academy of Sciences of the United States of America,2017,114(16):4261-4266. doi:10.1073/pnas.1701894114.
[10] Rollwitz I,Santaella M,Hille D,Flügge U I,Fischer K. Characterization of AtNST-KT1,a novel UDP-galactose transporter from Arabidopsis thaliana[J]. Febs Letters,2006,580(17):4246-4251. doi:10.1016/j.febslet.2006.06.082.
[11] Bakker H,Routier F,Oelmann S,Jordi W,Lommen A,Gerardy-Schahn R,Bosch D. Molecular cloning of two Arabidopsis UDP-galactose transporters by complementation of a deficient Chinese hamster ovary cell line[J]. Glycobiology,2005,15(2):193-201. doi:10.1093/glycob/cwh159.
[12] Norambuena L,Nilo R,Handford M,Reyes F,Meise L,Orellana A. AtUTr2 is an Arabidopsis thaliana nucleotide sugar transporter located in the Golgi apparatus capable of transporting UDP-galactose[J]. Planta,2005,222(3):521-529. doi:10.1007/s00425-005-1557-x.
[13] Norambuena L,Marchant L,Berninsone P,Hirschberg C B,Silva H,Orellana A. Transport of UDP-galactose in Plants. Identification and functional characterization of AtUTr1,an Arabidopsis thaliana UDP-GALACTOSE/UDP-GLUCOSE transporter[J].Journal of Biological Chemistry,2002,277(36):32923-32929. doi:10.1074/jbc.M204081200.
[14] Reyes F,León G,Donoso M,Brandizz F,Weber A P M,Orellana A. The nucleotide sugar transporters AtUTr1 and AtUTr3 are required for the incorporation of UDP-glucose into the endoplasmic reticulum,are essential for pollen development and are needed for embryo sac progress in Arabidopsis thaliana[J]. The Plant Journal,2010,61(3):423-435. doi:10.1111/j.1365-313x.2009.04066.x.
[15] Handford M,Rodríguez-Furl n C,Marchant L,Segura M,Gómez D,Alvarez-Buylla E,Xiong G Y,Paulyg M,Orellana A. Arabidopsis thaliana AtUTr7 encodes a Golgi-localized UDP-glucose/UDP-galactose transporter that affects lateral root emergence[J]. Molecular Plant,2012,5(6):1263-1280. doi:10.1093/mp/sss074.
n C,Marchant L,Segura M,Gómez D,Alvarez-Buylla E,Xiong G Y,Paulyg M,Orellana A. Arabidopsis thaliana AtUTr7 encodes a Golgi-localized UDP-glucose/UDP-galactose transporter that affects lateral root emergence[J]. Molecular Plant,2012,5(6):1263-1280. doi:10.1093/mp/sss074.
[16] Baldwin T C,Handford M G,Yuseff M I,Orellana A,Dupree P. Identification and characterization of GONST1,a Golgi-localized GDP-mannose transporter in Arabidopsis[J]. The Plant Cell,2001,13(10):2283-2295. doi:10.2307/3871508.
[17] Handford M G,Sicilia F,Brandizzi F,Chung J H,Dupree P. Arabidopsis thaliana expresses multiple Golgi-localised nucleotide-sugar transporters related to GONST1[J]. Molecular Genetics and Genomics,2004,272(4):397-410. doi:10.1007/s00438-004-1071-z.
[18] Rautengarten C,Ebert B,Liu L F,Stonebloom S,Smith-Moritz A M,Pauly M,Orellana A,Scheller H V,Heazlewood J L. The Arabidopsis Golgi-localized GDP-L-fucose transporter is required for plant development[J]. Nature Communications,2016,7:12119. doi:10.1038/ncomms12119.
[19] Ebert B,Rautengarten C,Guo X Y,Xiong G Y,Stonebloom S,Smith-Moritz A M,Herter T,Chan L G J,Adams P D,Petzold C J,Pauly M,Willats W J T,Heazlewood J L,Scheller H V. Identification and characterization of a Golgi-localized UDP-xylose transporter family from Arabidopsis[J]. The Plant Cell,2015,27(4):1218-1227. doi:10.1105/tpc.114.133827.
[20] Seino J,Ishii K,Nakano T,Ishida N,Tsujimoto M,Hashimoto Y,Takashima S. Characterization of rice nucleotide sugar transporters capable of transporting UDP-galactose and UDP-glucose[J].The Journal of Biochemistry,2010,148(1):35-46. doi:10.1093/jb/mvq031.
[21] Zhang B C,Liu X L,Qian Q,Liu L F,Dong G J,Xiong G Y,Zeng D L,Zhou Y H. Golgi nucleotide sugar transporter modulates cell wall biosynthesis and plant growth in rice[J]. Proceedings of the National Academy of Sciences of the United States of America,2011,108(12):5110-5115. doi:10.1073/pnas.1016144108.
[22] Parra-Rojas J P,Largo-Gosens A,Carrasco T,Celiz-Balboa J,Arenas-Morales V,Sepülveda-Orellana P,Temple H,Sanhueza D,Reyes F C,Meneses C,Saez-Aguayo S,Orellana A. New steps in mucilage biosynthesis revealed by analysis of the transcriptome of the UDP-rhamnose/UDP-galactose transporter 2 mutant[J]. Journal of Experimental Botany,2019,70(19):5071-5088. doi:10.1093/jxb/erz262.
[23] Orellana A,Moraga C,Araya M,Moreno A. Overview of nucleotide sugar transporter gene family functions across multiple species[J]. Journal of Molecular Biology,2016,428(16):3150-3165. doi:10.1016/j.jmb.2016.05.021.
[24] Bar-Peled M,O′Neill M A. Plant nucleotide sugar formation,interconversion,and salvage by sugar recycling[J]. Annual Review of Plant Biology,2011,62:127-155. doi:10.1146/annurev-arplant-042110-103918.
[25] Saez-Aguayo S,Rautengarten C,Temple H,Sanhueza D,Ejsmentewicz T,Sandoval-Iba ez O,Do
ez O,Do as D,Parra-Rojas J P,Ebert B,Lehner A,Mollet J C,Dupree P,Scheller H V,Heazlewood J L,Reyes F C,Orellana A. UUAT1 is a Golgi-localized UDP-uronic acid transporter that modulates the polysaccharide composition of Arabidopsis seed mucilage[J]. The Plant Cell,2017,29(1):129-143.doi:10.1105/tpc.16.00465.
as D,Parra-Rojas J P,Ebert B,Lehner A,Mollet J C,Dupree P,Scheller H V,Heazlewood J L,Reyes F C,Orellana A. UUAT1 is a Golgi-localized UDP-uronic acid transporter that modulates the polysaccharide composition of Arabidopsis seed mucilage[J]. The Plant Cell,2017,29(1):129-143.doi:10.1105/tpc.16.00465.
[26] Parker J L,Newstead S. Gateway to the Golgi:Molecular mechanisms of nucleotide sugar transporters[J]. Current Opinion in Structural Biology,2019,57:127-134. doi:10.1016/j.sbi.2019.03.019.
[27] Handford M,Rodriguez-Furlán C,Orellana A. Nucleotide-sugar transporters:Structure,function and roles in vivo[J]. Brazilian Journal of Medical and Biological Research,2006,39(9):1149-1158. doi:10.1590/S0100-879X2006000900002.
[28] Temple H,Saez-Aguayo S,Reyes F C,Orellan A. The inside and outside:Topological issues in plant cell wall biosynthesis and the roles of nucleotide sugar transporters[J]. Glycobiology,2016,26(9):913-925. doi:10.1093/glycob/cww054.
[29] Reyes F,Orellana A. Golgi transporters:Opening the gate to cell wall polysaccharide biosynthesis[J]. Current Opinion in Plant Biology,2008,11(3):244-251. doi:10.1016/j.pbi.2008.03.008.
