盐胁迫是目前制约农作物生产的主要逆境因素之一[1],全世界盐碱地面积约有10亿hm2,我国的盐碱土地面积约有0.99亿hm2,占世界盐碱地的1/10[2]。而且,全球盐碱地以每年(1.0~1.5)×106 hm2速度增长[3]。除了通过水土管理和化学、生物改良可以减轻盐胁迫危害之外,挖掘盐胁迫相关基因,利用基因工程手段选育耐盐作物品种将是解决盐渍化土地生产的根本途径。目前,植物对盐胁迫响应的信号转导可分为Ca2+依赖型和Ca2+非依赖型,前者如盐过敏感(Salt overly sensitive,SOS)转导途径等,后者如丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)级联反应转导途径等[4]。各种胁迫诱导信号彼此交叉, 构成复杂的网络共同调控植物的耐盐生理响应。
环核苷酸门控钙离子通道是传导信号的常规成分途径[5],是阳离子非选择性通道,可转运钾、钠、钙等,但透过率有所差别[6-7], Ca2+是一种普遍的第二信使,参与多种真核信号通路[8]。在植物中,Ca2+信号由多种环境信号转导并参与激素反应、生长、光信号、盐胁迫等重要机制[9-10]。在遭受盐胁迫时,植物运用钙依赖蛋白激酶途径(SOS途径)介导盐胁迫信号和Na+的耐受性[11-12]。研究显示在拟南芥等植物中CNGC2参与Ca2+转运,高浓度Ca2+与钙结合蛋白SOS3结合,进而激活质膜 Na+/H+转运体[12],使Na+排出到土壤溶液中及装载Na+进入木质部中进行长距离运输。即植物依靠Ca2+信号激活SOS途径从而降低盐胁迫危害[13]。该通道在动物系统中作为重要信使通道被广泛地研究,但在植物耐盐途径中未见详细报道。
蓖麻(Ricinus communis L.)为大戟科蓖麻属双子叶一年生或多年生草本植物,世界十大油料作物之一[14]。蓖麻油广泛应用于工业生产的各个领域,同时具有很高的生态价值和经济价值。蓖麻具有耐瘠薄、耐干旱、耐盐碱、适应性强的特点,可以在贫瘠的边际土地上生长,不与粮争地,并能作为土壤改良作物,有效解决我国现阶段耕地面积不足和土壤盐碱化等问题[15-17]。近年来,蓖麻产油方面的研究取得了一定进展,但在抵御非生物胁迫方面研究较少,对环核苷酸门控离子通道的研究还未见报道。本研究基于蓖麻转录组信息,克隆蓖麻环核苷酸门控离子通道基因RcCNGC2,并对其理化性质、蛋白结构、盐处理下表达量进行分析,构建蓖麻RcCNGC2基因双元表达载体,为研究蓖麻RcCNGC2基因的生物学功能提供理论依据,对探索蓖麻抵御非生物胁迫的机制具有一定借鉴意义。
1 材料和方法
1.1 试验材料及处理
供试材料为蓖麻通蓖5号,该品种是通辽市农业科学研究院蓖麻研究所育成的高产抗病优良品种。将种子置于腐殖质土壤待长至二叶期用300 mmol/L NaCl处理0,2,6,8,12,24 h后,分别取根茎叶置于液氮中速冻,-80 ℃超低温冰箱保存。
1.2 RNA提取与RcCNGC2基因克隆
蓖麻总RNA的提取与反转录分别采用RNAiso Plus试剂盒与PrimeScriptTM Ⅱ Reverse Transcriptase试剂盒,按说明书操作,购自大连宝生生物工程有限公司。通过对蓖麻转录组数据库检索,获得候选RcCNGC2全长序列,根据其开放阅读框序列设计特异性引物RcCNGC2-F、RcGNGC2-R,并加入表达载体酶切位点(表1),由北京六合华大基因公司合成。PCR扩增获得CDS序列。参照购自北京康为世纪生物科技有限公司2×Es Taq MasterMix说明书进行PCR扩增反应体系:cDNA 1.0 μL,Master Mix 12.5 μL,ddH2O 10.5 μL,上下游引物各0.5 μL。PCR扩增反应程序:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 3 min,30个循环;72 ℃ 15 min。利用购自北京索莱宝科技有限公司的0.1%琼脂糖凝胶电泳检测、琼脂糖凝胶DNA回收试剂盒回收目的条带,连接至pMD19-T Simple Vector,转化到大肠杆菌Top10感受态中,涂于蓝白斑筛选培养基后挑取单菌落,PCR检测阳性菌送至北京六合华大基因公司测序。
1.3 生物信息学分析
使用DNAMAN软件获得RcCNGC2 CDS序列所对应的氨基酸序列。在NCBI进行蛋白保守结构域预测(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi);通过DNAMAN软件对该蛋白基本理化性质进行分析;SOMPA在线工具分析该蛋白二级结构(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.plpage=/NPSA/npsa_sopma.html);结合Smart-Blast在线搜索与RcCNGC2相似度较高的其他蛋白序列,并利用DNAMAN软件进行序列相似性比对(http://smart.emblheidel.berg.de)。TMHMM Server v. 2.0 软件预测RcCNGC2蛋白是否存在跨膜结构域(http://www.cbs.dtu.dk/services/TMHMM/)并于SMART生成图例(http://smart.embl-heidelberg.de/)。
1.4 植物表达载体构建
提取阳性菌重组质粒与PCG-3300进行双酶切。酶切体系:重组质粒 6 μL,Sma Ⅰ 1 μL,XbaⅠ 1 μL ,10×T Buffer 2 μL,0.1% BSA 2 μL,ddH2O 8 μL。反应条件为37 ℃ 8 h。0.1%琼脂糖凝胶电泳检测、回收目的条带,并连接。连接体系:回收的大片段(载体)5 μL,小片段(目的基因)5 μL,10×T4 Ligase Buffer 2 μL,T4 Ligase 2 μL,ddH2O 6 μL。反应条件为16 ℃ 12 h。用热激法将10 μL连接产物转入大肠杆菌Top10感受态中,涂板培养15 h后挑取单菌落,37 ℃ 180 r/min振荡培养2 h,菌液PCR阳性菌进行双酶切鉴定。
1.5 qRT-PCR分析
根据测序获得的RcCNGC2碱基序列,应用Primer 5软件设计特异性引物qRcCNGC2(表1)。以蓖麻RcSKIP和RcEFIB基因为内参,检测蓖麻根、茎、叶中RcCNGC2在不同时长盐胁迫下的表达量,分别为0,2,6,8,12,24 h。反应条件95 ℃ 30 s;95 ℃ 5 s,55 ℃ 30 s,72 ℃ 30 s,40个循环。每个样品3次重复,用2-ΔΔCT方法计算基因相对表达量[18]。并应用SPSS软件进行差异性分析。
表1 引物序列
Tab.1 Sequences of primers
2 结果与分析
2.1 蓖麻RcCNGC2的全长获得与序列分析
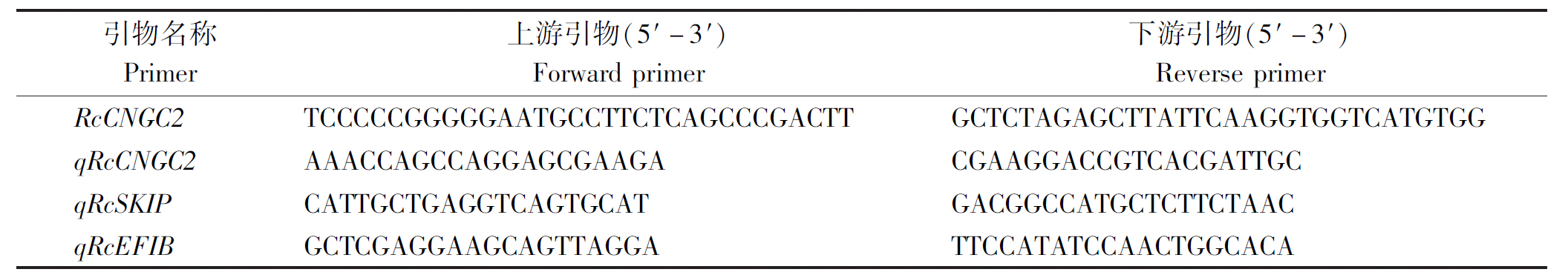
以通蓖5号蓖麻叶片cDNA为模板,PCR扩增并测序后获得2 148 bp的CDS序列(图1),编码715 个ORF氨基酸(图2)。结合NCBI-Blast分析发现,该蛋白具有环核苷酸结构域、cAMP结合域或cAMP依赖性蛋白激酶的调节亚单位以及电压依赖性钾离子通道,确定该序列为环核苷酸门控离子通道家族基因(图3)。结合DNAMAN软件对6个一致性较高的CNGC2氨基酸序列进行比对分析(图4),蓖麻(Ricinus communis L.)RcCNGC2氨基酸序列与毛果杨(Populus trichocarpa)、胡杨(Populus euphratica)、麻疯树(Jatropha curcas)、巴西橡胶树(Hevea brasiliensis)、木薯(Manihot esculenta)、新疆野核桃(Juqlans regia)的CNGC2氨基酸序列一致性均在85%以上,其中与巴西橡胶树一致性最高,为89.15%。将该序列命名为RcCNGC2,GenBank 登录号为MN605521。
M.DL2000 DNA Marker;1-2.PCR结果。
M.DL2000 DNA Marker;1-2. PCR results.
图1 蓖麻RcCNGC2基因PCR扩增产物
Fig.1 PCR products of RcCNGC2 gene in Ricinus communis L.

图2 RcCNGC2基因CDS序列推导的氨基酸序列
Fig.2 RcCNGC2 CDS sequence and its deduced amino acid sequence
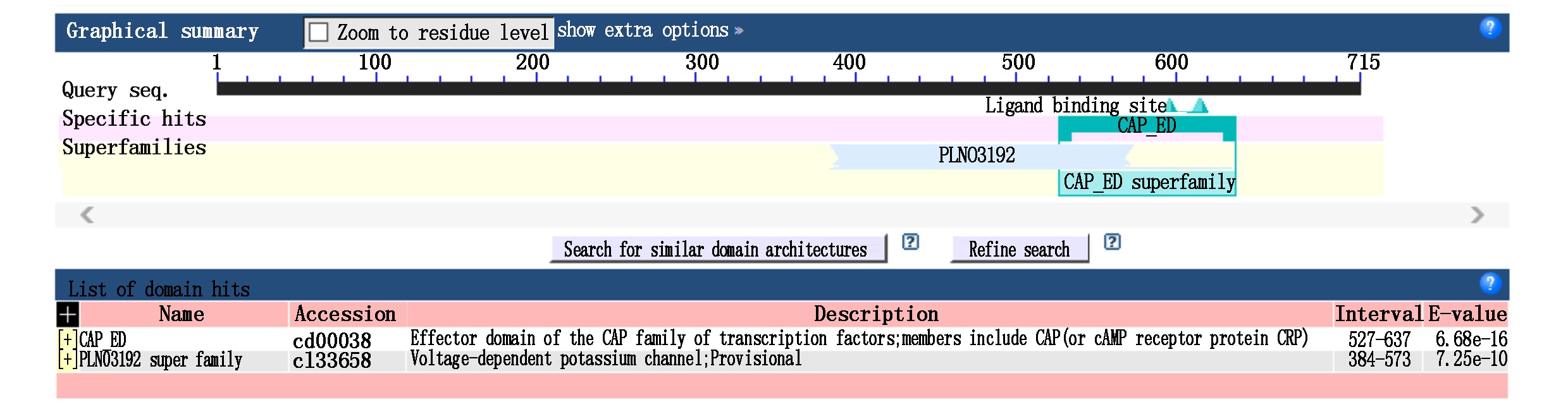
CAP-ED.转录因子CAP家族效应域;成员包括CAP(或cAMP、受体蛋白CRP)。
PLN03192超级家族.电压相关的钾离子通道;暂定。
CAP-ED.Effector domain of the CAP family of transcription factors;members include CAP(or cAMP,receptor protein CRP).
PLN03192 super family.Voltage-dependent potassium channel;Provisional.
图3 RcCNGC2蛋白保守区预测
Fig.3 Prediction of RcCNGC2 conserved domains

RcCNGC2.蓖麻(XP_002532894.1);PtCNGC2.毛果杨(XP_006373345.1);PeCNGC2.胡杨(XP_011035830.1);JcCNGC2.麻疯树(KDP27204.1);HbCNGC2.巴西橡胶树(XP_021682288.1);MeCNGC2.木薯(OAY56863.1);JrCNGC2.新疆野核桃(XP_01885867.1)。
RcCNGC2.Ricinus communis(XP_002532894.1);PtCNGC2.Populus trichocarpa(XP_006373345.1);PeCNGC2.Populus euphratica(XP_011035830.1);JcCNGC2.Jatropha curcas(KDP27204.1);HbCNGC2.Hevea brasiliensis(XP_021682288.1);MeCNGC2.Manihot esculenta(OAY56863.1);JrCNGC2.Juqlans regia(XP_01885867.1).
图4 蓖麻与其他植物CNGC2序列一致性对比
Fig.4 Identity comparison of CNGC2 sequences between ricinus and other plants
2.2 RcCNGC2理化性质和蛋白结构分析
对RcCNGC2进行理化性质预测分析,编码的蛋白总分子量34.15 ku,等电点9.96。该蛋白由350个α-螺旋、30个β-转角、249个无规则卷曲以及77个延伸链构成,α-螺旋在该蛋白中起重要作用(图5)。经TMHMM在线软件预测分析RcCNGC2存在5个跨膜结构域,是典型的跨膜蛋白,并具有cNMP结构域(图6),与环核苷酸门控离子通道基因家族中基因的特性相一致[19]。
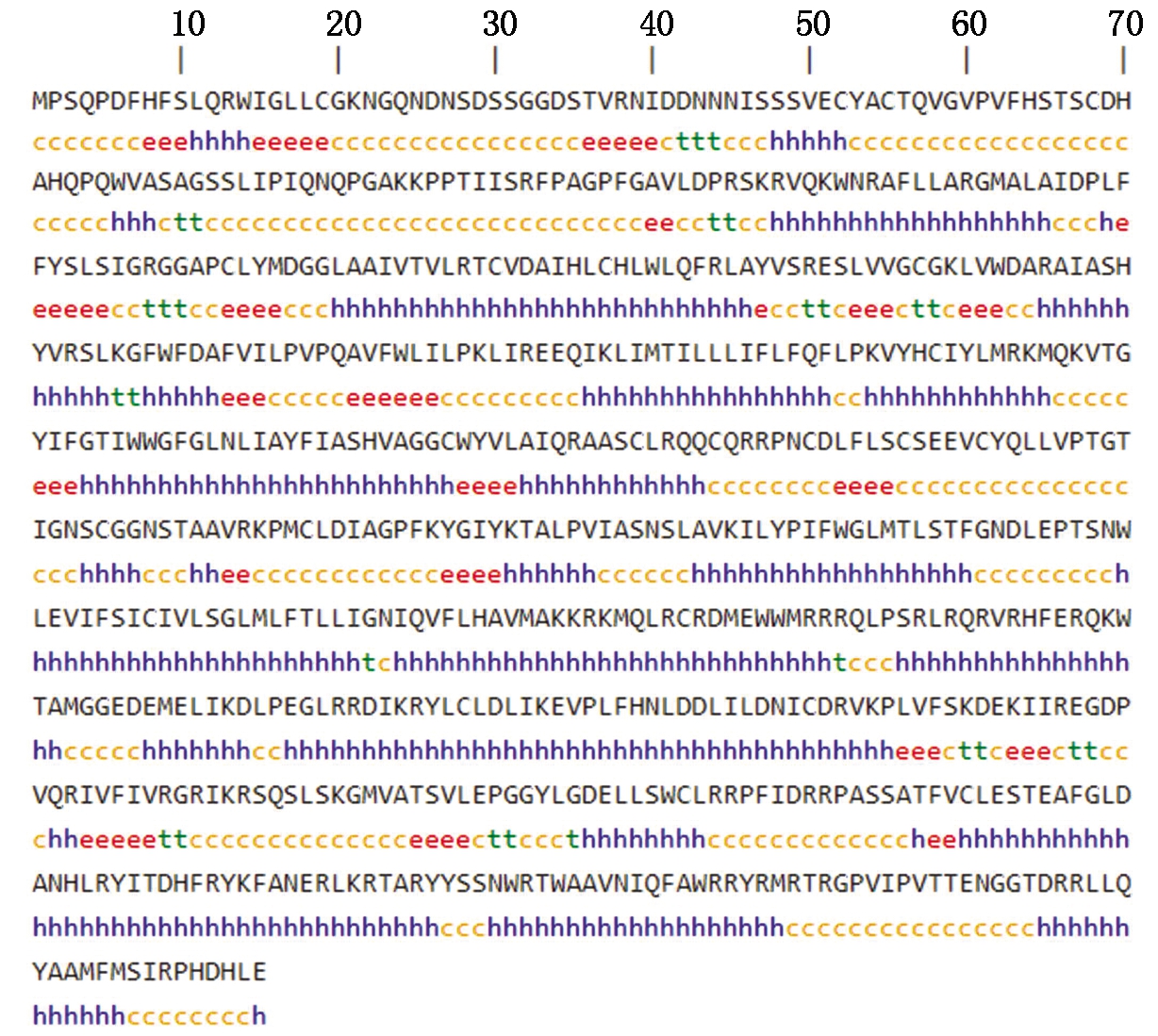
h.ɑ-螺旋;e.延伸链;t.β-转角;c.无规则卷曲。
h.Alpha helix;e.Extended strand;t.Beta turn;c.Random coil.
图5 RcCNGC2蛋白结构预测
Fig.5 Secondary structure prediction of RcCNGC2
图6 RcCNGC2跨膜结构预测
Fig.6 Prediction of RcCNGC2 transmembrane
2.3 RcCNGC2双元表达载体构建及鉴定
经测序为阳性菌液扩摇,提取质粒后,应用限制性内切酶SmaⅠ和XbaⅠ将该质粒与表达载体pCG-3300进行双酶切,T4连接酶连接酶切产物,转化到大肠杆菌感受态Top10细胞中,通过Kan抗性筛选阳性菌,扩摇后提质粒,进行重组质粒PCR鉴定和双酶切鉴定,琼脂糖凝胶电泳结果(图7)显示,重组质粒约为108 681 bp且明显大于酶切后表达载体电泳条带,酶切后目的片段大小与RcCNGC2序列大小一致,植物表达载体构建成功。
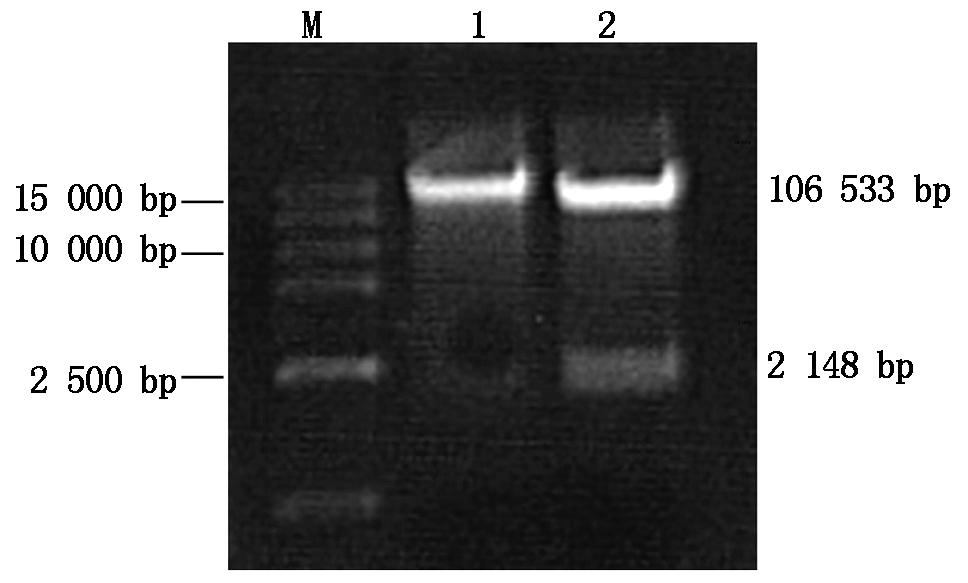
M.DL15000 DNA Ladder; 1.表达载体重组质粒检测;
2.表达载体双酶切鉴定。
M.DL15000 DNA Ladder;1.Expression vector recombinant plasmid assay;
2.Expression vector double digestion detection identification.
图7 表达载体重组质粒检测与双酶切鉴定 Fig.7 Expression vector recombinant plasmid assay
and double digestion detection identification
2.4 RcCNGC2在不同组织和不同胁迫时间的表达分析
对蓖麻根、茎、叶进行多时间点组织特异性分析,由图8可以看出,NaCl处理后RcCNGC2主要在根中表达,0 h几乎不表达,后随NaCl处理时间延长表达量增加,且NaCl处理8 h后与0 h表达量比较差异显著;NaCl处理后茎、叶表达量与0 h相比减少,且差异显著。表明RcCNGC2在蓖麻根组织中是盐诱导型表达基因,而NaCl处理抑RcCNGC2在茎、叶中的表达。结合前人研究成果推测在Na+含量升高后,环核苷酸门控离子通道打开,转运离子信号,植物体响应盐胁迫。

小写字母a、b、c、d表示不同样本之间
存在显著差异(P<0.05)。
a, b, c and d showed significant difference
between different samples (P<0.05).
图8 RcCNGC2在蓖麻根、茎、叶中不同处理时间的表达量测定
Fig.8 Relative expression level of RcCNGC2 gene in different processing time of roots,stems and leaves
3 结论与讨论
CNGC2是环核苷酸门控离子通道家族(CNGs)重要成员,环核苷酸门控离子通道广泛存在于动物和植物中,Schuurink等[20]在大麦(Hordeum vlgare) 糊粉层表达文库中筛选钙调蛋白(CaM)时,首次克隆到植物CNGCs家族基因HvCBT1(Hordeum vulgare CaM-binding transporter),随后在拟南芥(Arabidopsis thaliana)、烟草(Nicotiana tabacum)、水稻(Oryza sativa)、山葡萄(Vitis amurensis)等植物中发现CNGC家族基因[21]。
本研究以蓖麻5号叶片为材料,克隆RcCNGC2基因,从序列一致性比对分析来看,RcCNGC2氨基酸序列与橡胶树一致性最高;蛋白跨膜结构域分析发现RcCNGC2含有5个跨膜结构,与前人研究的CNGC家族基因结构特征一致[19];保守结构域分析发现该基因具有完整的CAP/cAMP序列。CNGCs具有CAM结合域,CAM作为Ca2+传感器负性调节CNGCs[22]。本研究结果表明,蓖麻RcCNGC2是CNGC家族的重要成员,可能具有类似的生物学功能。
CNGCs家族多基因参与盐胁迫[23],本研究克隆得到的RcCNGC2基因编码的部分蛋白被暂定为电压依赖性K+通道结构域。K+在多种酶促反应、蛋白合成中起重要作用,可溶性Na+过多的进入细胞会竞争性抑制K+吸收[24-25],转运K+进入细胞,可提高Na+/K+比,维持胞内离子平衡,从而降低NaCl对植物的影响[26]。异源表达发现,AtCNGC10参与K+的转运,可互补大肠杆菌 (LB650)~I酵母(CY162)的K+吸收缺陷菌株的表型[27],可见AtCNGC10对K+有一定的选择性,参与植物的K+稳态;Leng等[19]研究发现,AtCNGC2在酵母K+吸收缺陷突变体中表达时,抑制酵母菌株的生长,利用膜片钳技术研究其在非洲爪蟾卵母细胞中的表达时,发现AtCNGC2是一种内整流K+选择性通道。本研究明确RcCNGC2为CNGC家族基因,通过蛋白结构域分析其具有K+转运功能域,与前人研究结果一致。
拟南芥AtCNGC2在叶片中表达时,介导初始Ca2+从胞质体流入胞质溶胶,在根中会影响Ca2+稳态[28]。CNGCs的异源表达显示其对Ca2+有渗透性,是Ca2+ 吸收类型通道[29]。Ca2+在植物应对非生物胁迫中起重要作用,在应对盐胁迫时植物运用钙依赖蛋白途径(SOS途径)介导盐胁迫信号和Na+耐受性[30-31]。表达量分析结果显示,RcCNGC2主要在根组织中表达且受盐诱导,在盐处理2 h后表达量明显升高,推测高Na+离子浓度可诱导CNGC2转运Ca2+,Ca2+与SOS3结合,从而激活SOS途径应对盐胁迫[4]。以上结果说明,CNGCs家族成员在盐胁迫中直接参与相关离子转运,本研究结果显示,RcCNGC2为CNGC基因家族成员响应盐胁迫并作为重要离子信号内流途径。然而,植物抵御盐胁迫是一个复杂的过程,可能由多种信号共同调控,RcCNGC2蛋白具有转运K+、Ca2+的功能域,但其是否激活SOS通路还需进一步研究,后期研究将过表达RcCNGC2并结合SOS通路中各基因表达量情况,通过明确基因间的联系更深入揭示RcCNGC2在抵御盐胁迫中的作用。
本研究在蓖麻转录组数据基础上,克隆RcCNGC2基因,构建双元表达载体,分析该基因理化性质,对其编码的蛋白进行蛋白二级结构分析、保守结构域预测等,并与相似度较高的其他蛋白序列进行序列比对,明确该基因为CNGC家族成员,并含有Ca2+、K+转运结构域。通过qRT-PCR分析发现RcCNGC2主要在根中表达且受盐诱导,可能作为受盐胁迫诱导的胞质钙信号参与蓖麻耐盐调控。本研究为进一步明确蓖麻耐盐调控机制奠定基础。
[1] 王俊斌,王海凤,刘海学. 水杨酸促进盐胁迫条件下水稻种子萌发的机理研究[J]. 华北农学报,2012,27(4):223-227. doi:10.3969/j.issn.1000-7091.2012.04.043.
Wang J B,Wang H F,Liu H X. Study on mechanism of salicylic acid on the promotion of rice seeds germination under salt stress[J]. Acta Agriculturae Boreali-Sinica,2012,27(4):223-227.
[2] 王杰,刘晓威,王长娜, 武海雯. 我国盐碱地区观赏植物应用分析[J]. 北方园艺,2019,43(18):73-78. doi:10.11937/bfyy.20190168.
Wang J,Liu X W,Wang C N,Wu H W. Research on application in saline-alkali areas of ornamental plants in China[J]. Northern Horticulture,2019,43(18):73-78.
[3] 张树文,杨久春,李颖,张养贞,常丽萍. 1950s中期以来东北地区盐碱地时空变化及成因分析[J]. 自然资源学报,2010,25(3):435-442. doi:10.11849/zrzyxb.2010.03.009.
Zhang S W,Yang J C,Li Y,Zhang Y Z,Chang L P. Changes of saline-alkali land in Northeast China and its causes since the mid-1950s[J]. Journal of Natural Resources,2010,25(3):435-442.
[4] 陈莎莎,兰海燕. 植物对盐胁迫响应的信号转导途径[J]. 植物生理学报,2011,47(2):119-128.
Chen S S,Lan H Y. Signal transduction pathways in response to salt stress in plants[J]. Plant Physiology Journal, 2011,47(2):119-128.
[5] Saand M A,Xu Y P,Munyampundu J P,Li W,Zhang X R,Cai X Z. Phylogeny and evolution of plant cyclic nucleotide-gated ion channel (CNGC) gene family and functional analyses of tomato CNGCs[J]. DNA Res,2015,22(6):471-483. doi:10.1093/dnares/dsv029.
[6] Mäser P,Thomine S,Schroeder J I,Ward J M,Hirschi K,Sze H,Talke I N,Amtmann A,Maathuis F J M,Sanders D,Harper J F,Tchieu J,Gribskov M,Persans M W,Salt D E,Kim S A,Guerinot M L.Phylogenetic relationships within cation transporter families of Arabidopsis[J]. Plant Physiol,2001,126(4):1646-1667. doi:10.1104/pp.126.4.1646.
[7] Hua B G,Mercier R W,Leng Q,Berkowitz G A. Plants do it differently. A new basis for potassium/sodium selectivity in the pore of an ion channel[J]. Plant Physiology,2003,132(3):1353-1361. doi:10.1104/pp.103.020560.
[8] Wu M,Li Y,Chen D M,Liu H L,Zhu D Y,Xiang Y. Genome-wide identification and expression analysis of the IQD gene family in moso bamboo (Phyllostachys edulis)[J]. Scientific Reports,2016,6:24520. doi:10.1038/srep24520.
[9] Taká![]() I,
I, amajová O,
amajová O, amaj J. Comparative proteomic study of Arabidopsis mutants mpk4 and mpk6[J]. Scientific Reports,2016,9:28306. doi:10.1038/srep28306.
amaj J. Comparative proteomic study of Arabidopsis mutants mpk4 and mpk6[J]. Scientific Reports,2016,9:28306. doi:10.1038/srep28306.
[10] DeFalco T A,Marshall C B,Munro K,Kang H G,Moeder W,Ikura M ,Snedden W A ,Yoshioka K . Multiple calmodulin-binding sites positively and negatively regulate Arabidopsis CYCLIC NUCLEOTIDE-GATED CHANNEL12[J]. The Plant Cell,2016,28(7):1738-1751.doi:10.1105/tpc.15.00870.
[11] Zhu J K. Salt and drought stress signal transduction in plants[J]. Aunual Review of Plant Biol,2002,53:247-273. doi:10.1146/annurev.arplant.53.091401.143329.
[12] Quan R D,Lin H X,Mendoza I,Zhang Y G,Cao W H,Yang Y Q,Shang M,Chen S Y,Pardo J M, Guo Y. SCABP8/CBL10 a putative calcium sensor,interacts with the protein kinase SOS2 to protect Arabidopsis shoots from salt stress[J]. The Plant Cell,2007,19(4):1415-1431. doi:10.1105/tpc.106.042291.
[13] 罗倩萍, 陈佳洁, 黄晓红, 王正朝. 心脏中超极化环核苷酸门控离子通道的研究进展[J]. 动物医学进展,2012,33(3):101-104. doi:10.16437/j.cnki.1007-5038.2012.03.019.
Luo Q P,Chen J J,Huang X H,Wang Z C. Progress on hyperpolarization-Activated cyclic nucleotide-gated(HCN)channels animal heart[J]. Progcss in Veterinary Medicine,2012,33(3):101-104.
[14] 高彩婷, 宝力高, 刘涛. 蓖麻研究概况[J]. 内蒙古民族大学学报(自然科学版),2010,25(2):178-181. doi:3969/j.issn.1671-0185.2010.02.021.
Gao C T,Bao L G,Liu T. Research station of castor[J]. Journal of Inner Mongolia University for Nationalities(Natural Sciences),2010,25(2):178-181.
[15] 丛娇娇, 王晓宇, 李平, 李惠根, 张丽雪, 张继星.蓖麻耐盐基因HKT的克隆及表达载体构建[J]. 分子植物育种,2018,16(14):186-195. doi:10.13271/j.mpb.016.004648.
Cong J J, Wang X Y, Li P, Li H G, Zhang L X, Zhang J X. Cloning and expression vector construction of salt tolerant gene HKT in Ricinus communis L.[J]. Molecular Plant Breeding,2018,16(14):186-195.
[16] 严兴初, 王力军. 蓖麻作为能源开发的现状与前景[J]. 安徽农业科学,2007,35(34):11165,11167. doi:10.3969/j.issn.0517-6611.2007.34.101.
Yan X C,Wang L J. The status in quo and foreground of exploiting castor-oil plant as energy sources[J]. Journal of Anhui Agricultural Sciences,2007,35(34):11165,11167.
[17] 王沛琦, 刘旭云, 胡学礼, 胡尊红, 杨谨, 郭丽芬, 李文昌. 蓖麻对重金属污染土壤治理的研究进展[J]. 分子植物育种,2019,17(6):2048-2054. doi:10.13271/j.mpb.017.002048.
Wang P Q,Liu X Y,Hu X L,Hu Z H,Yang J,Guo L F,Li W C. Advances and the effects of castor for curing heavy metal contamination in soil[J]. Molecular Plant Breeding,2019,17(6):2048-2054.
[18] 冯紫洲.蓖麻RcNHX1基因的功能分析[D].通辽:内蒙古民族大学,2017.
Feng Z Z. Functional analysis of RcNHX1 gene in castor(Ricinus communis L.)[D]. Tongliao:Inner Mongolia University for Nationalities,2017.
[19] Leng Q,Mercier R W Z,Yao W Z,Berkowitz G A. Cloning and first functional characterization of a plant cyclic nucleotide-gated cation channel[J]. Plant Physiology,1999,121(3):753-761. doi:10.1104/pp.121.3.753.
[20] Schuurink R C,Shartzer S F,Fath A,Jones R L. Characterization of acalmodulin-binding transporter from the plasma membrane of barley aleurone[J]. Proc Natl Acad Sci USA,1998,95(4):1944-1949. doi:10.1073/pnas.95.4.1944.
[21] 王文颖, 柴薇薇, 马清, 王锁民. 植物环核苷酸门控离子通道的研究进展[J]. 植物生理学报,2015,51(11):1799-1808. doi:10.13592/j.cnki.ppj.2015.0392.
Wang W Y, Chai W W, Ma Q, Wang S M.Research advances in cyclic nucleotide-gated channels in plant[J]. Plant Physiology Journal,2015,51(11):1799-1808.
[22] 刘亚琪, 王文颖, 崔彦农, 郭欢, 李孟湛, 王锁民.霸王环核苷酸门控通道基因ZxCNGC5的克隆及表达模式分析[J]. 植物生理报,2018,54(1):157-164. doi:10.13592/j.cnki.ppj.2017.0457.
Liu Y Q, Wang W Y, Cui Y N, Guo H, Li M Z, Wang S M. Cloning and expression analysis of cyclic nucleotide-gated channels gene ZxCNGC5 from Zygophyllum xanthoxylum[J]. Plant Physiology Journal,2018,54(1):157-164.
[23] Gobert A,Park G,Amtmann A,Sanders D,Maathuis` F J M. Arabidopsis thaliana cyclic nucleotide gated channel 3 forms a non-selective ion transporter involved in germination and cation transport[J]. Exp Bot,2006,57(4):791-800. doi:10.1093/jxb/erj064.
[24] 王毅, 武维华. 植物钾营养高效分子遗传机制[J]. 植物学通报,2009,44(1):27-36. doi:10.3969/j.issn.1674-3466.2009.01.003.
Wang Y,Wu W H. Molecular genetic mechanism of high efficient potassium uptake in plants[J].Chinese Bulletin of Botany,2009,44(1):27-36.
[25] 曲平治, 刘贯山, 刘好宝, 司丛丛, 刘朝科, 胡晓明, 冯祥国, 张守厚, 赵静. 烟草钾离子通道研究进展[J]. 中国烟草科学,2009,30(2):74-80. doi:10.3969/j.issn.1007-5119.2009.02.015.
Qu P Z, Liu G S, Liu H B, Si C C, Liu C K, Hu X M, Feng X G, Zhang S H, Zhao J. Research advances in tobacco potassium ion channel[J]. Chinese Tobacco Science,2009,30(2):74-80.
[26] 高媛嫒, 张保龙, 杨郁文, 沈新莲, 倪万潮.海蓬子中高亲和钾离子转运SbHKT1基因的克隆、表达及生物信息学分析[J].基因组学与应用生物学,2010,29(4):646-652. doi:10.3969/gab.029.000646.
Gao Y Y, Zhang B L, Yang Y W, Shen X L, Ni W C. Cloning expression pattern and bioinformatic analysis of high-affinity potassium transporter gene SbHKT1 from halophyte Salicornia bigelovii[J]. Genomics and Applied Biology,2010,29(4):646-652.
[27] Li X L,Borsics T,Harrington H M,Christopher D A. Arabidopsis AtCNGC10 rescues potassium channel mutants of E.coli,yeast and Arabidopsis and is regulatedby calcium/calmodulin and cyclic GMP in E.coli[J]. Funct Plant Biol,2005,32(7):643-653. doi:10.1071/FP04233.
[28] Wang Y,Kang Y,Ma C L,Miao R Y,Wu C L,Long Y,Ge T,Wu Z N,Hou X Y,Zhang J X,Qi Z. CNGC2 is a Ca2+ influx channel that prevents accumulation of apoplastic Ca2+ in the leaf[J]. Plant Physiology,2017,173(2):1342-1354. doi:10.1104/pp.16.01222.
[29] Spalding E P,Harper J F. The ins and outs of cellular Ca2+transport[J]. Curr Opin Plant Biol,2011,14(6):715-720. doi:10.1016/j.pbi.2011.08.001.
[30] S nchez-Barrena M J,Martínez-Ripoll M, Zhu J K, Albert A. The structure of the Arabidopsis thaliana SOS3:molecular mechanism of sensing calcium for salt stress response[J]. Journal of Molecular Biology,2005,345(5):1253-1264. doi:10.1016/j.jmb.2004.11.025.
nchez-Barrena M J,Martínez-Ripoll M, Zhu J K, Albert A. The structure of the Arabidopsis thaliana SOS3:molecular mechanism of sensing calcium for salt stress response[J]. Journal of Molecular Biology,2005,345(5):1253-1264. doi:10.1016/j.jmb.2004.11.025.
[31] 聂惠,于海峰,刘浩明. 向日葵对盐胁迫的反应及其抗盐机理的研究进展[J]. 北方农业学报,2008(6):17-19. doi:10.3969/j.issn.1007-0907.2008.06.009.
Nie H,Yu H F,Liu H M. Response of sunflower to salt stress and its salt resistance mechanism[J]. Journal of Northern Agriculture,2008(6):17-19.
