细胞分裂素是一类重要的植物激素,在细胞分裂、芽的分化、叶绿素合成、叶片衰老、种子发育等生长发育过程[1-6]和应对盐渍、干旱、冷胁迫、营养胁迫等非生物胁迫的过程中[7-12],均发挥着重要作用。
组氨酸磷酸转运蛋白(Histidine phosphotransfer proteins, HPs)是细胞分裂素信号转导通路的重要组成部分。HP上保守的组氨酸位点接受来自细胞分裂素受体(Histidine kinases, HKs)的磷酸基团后,从细胞质进入细胞核,随后将磷酸基团转移到定位于细胞核的反应调节因子(Response regulators, RRs)上,从而激活下游基因的表达以完成信号传递[4,13-15]。
拟南芥中有5个含有保守组氨酸位点的AHP,单突变体和双突变体在细胞分裂素的响应上没有缺陷,然而,ahp1,2,3在根的生长、叶绿素合成、下胚轴伸长等方面对细胞分裂素不敏感,表明AHP是细胞分裂素信号转导途径的正调节因子,并且AHP之间存在功能冗余现象[16]。ahp1,2,3,4,5则展现出主根变短、育性降低、种子增大等表型[16]。此外,研究表明,ahp2,3,5具有很强的耐盐性和抗旱性,暗示拟南芥AHP2、AHP3、AHP5作为重要的负调节因子参与了植物对盐和干旱胁迫的应激反应[17]。
水稻中只有2个含有保守组氨酸位点的组氨酸磷酸转运蛋白,OsAHP1和OsAHP2[18-20]。分子细胞生物学教育部重点实验室前期通过RNA干扰的方法同时降低了转基因植株中OsAHP1和OsAHP2的表达,OsAHP-RNAi植株表现出细胞分裂素信号转导缺陷表型,包括矮化、侧根生长增加、叶片提早衰老、分蘖数减少和育性下降等,并对外源细胞分裂素不敏感[21]。此外,OsAHP-RNAi幼苗对盐胁迫处理表现超敏感表型,但是对干旱胁迫表现出抗逆表型[21]。这些结果表明,OsAHP在细胞分裂素信号转导中起着正调节因子的作用,并且在水稻盐和干旱胁迫中发挥着不同的作用。
本研究构建了2个OsAHP2原核表达载体,通过比较筛选出融合蛋白表达量较高的pET-32a-OsAHP2进行后续试验,优化了蛋白表达条件并对表达的融合蛋白进行了分离纯化,为后续研究OsAHP2与细胞分裂素信号转导通路中其他蛋白的相互作用和磷酸化分析奠定了基础。
1 材料和方法
1.1 试验材料
大肠杆菌(Escherichia coli)菌株DH5α、Rosseta、XA90、水稻日本晴(Oryza sativa ssp. Japonica)、表达载体pET-32a、pGEX-4T-1为河北师范大学生命科学学院分子细胞生物学教育部重点实验室保存;质粒提取试剂盒和DNA胶回收试剂盒购自生工生物工程(上海)有限公司;RNA提取试剂购自Invitrogen公司;RNA反转录试剂盒、PCR所用Taq酶、限制性核酸内切酶、T4 DNA连接酶购自TaKaRa公司;His纯化基质购自Sigma公司。
1.2 试验方法
1.2.1 OsAHP2基因的克隆及原核表达载体的构建 利用TRIzol提取10 d水稻叶片总RNA,以1 μg RNA为模板,按照RNA PCR Kit(AMV)Ver.3.0试剂盒说明书反转录合成cDNA。根据NCBI数据库公布的基因序列(Os09g39400),设计OsAHP2基因特异引物,上游引物OsAHP2-F: 5′-CGGAATTCATGGCGGCCGCCGCTCTCCG-3′,下游引物OsAHP2-R:5′-CCCTCGAGTGCACACGCGCACACACTCT-3′,以水稻cDNA为模板进行PCR扩增,将PCR产物进行琼脂糖凝胶电泳后胶回收。将PCR产物与空载体pET-32a和pGEX-4T-1分别进行EcoRⅠ和XhoⅠ酶切连接后转化大肠杆菌DH5α,重组子经菌体PCR和酶切鉴定正确后,送生工生物工程(上海)有限公司测序。将测序正确的重组质粒pET-32a-OsAHP2转化大肠杆菌表达菌株Rosseta,pGEX-4T-1-OsAHP2转化大肠杆菌表达菌株XA90。
1.2.2 诱导表达时间的优化 将重组菌pET-32a-OsAHP2(Rosseta)和pGEX-4T-1-OsAHP2(XA90)分别接种于LB培养基(100 mg/L Amp),37 ℃ 220 r/min振荡培养12 h,按1∶50比例扩培后培养至OD600为0.6~0.8,加入IPTG(终浓度0.5 mmol/L),30 ℃诱导0,1,3,5 h,分别离心收集菌体,进行SDS-PAGE电泳分析。
1.2.3 融合蛋白的可溶性分析 按方法1.2.2优化的结果,将重组菌pET-32a-OsAHP2(Rosseta)30 ℃ 220 r/min诱导3 h,离心收集菌体,用1/10体积的溶菌液(25 mmol/L Tris(pH值8.0),300 mmol/L NaCl,1 mmol/L DTT,1 g/L溶菌酶,0.2 mmol/L PMSF)重悬菌体,冰上静置40 min后超声破碎至溶液清亮。4 ℃ 12 000 r/min离心30 min收集上清和沉淀,进行SDS-PAGE电泳分析。
1.2.4 融合蛋白的纯化 按方法1.2.3中所述,收集超声后上清,用0.45 μm滤膜过滤,用3倍体积的平衡液(25 mmol/L Tris(pH 值8.0),300 mmol/L NaCl,10 mmol/L咪唑)平衡His纯化基质,将过滤后的上清与His纯化基质于50 mL离心管中4 ℃混匀1 h。用洗涤缓冲液(25 mmol/L Tris(pH值 8.0),300 mmol/L NaCl,40 mmol/L咪唑)冲洗4次,用洗脱缓冲液(25 mmol/L Tris(pH值8.0),300 mmol/L NaCl,200 mmol/L咪唑)洗脱3次,SDS-PAGE电泳检测融合蛋白纯化效果。
2 结果与分析
2.1 OsAHP2基因的克隆及原核表达载体的构建
利用OsAHP2基因上下游特异引物PCR扩增获得557 bp(包括ORF 450 bp,编码149个氨基酸)的OsAHP2全长基因(图1-A)。为了探索不同表达载体对蛋白表达的影响,分别将OsAHP2基因连接原核表达载体pET-32a和pGEX-4T-1,转化DH5α。利用载体上游引物和基因下游引物进行菌体PCR鉴定(图1-B),阳性克隆摇菌提取质粒后进行酶切鉴定(图1-C),均可得到557 bp的条带。质粒送公司测序,正确的重组质粒分别命名为pET-32a-OsAHP2和pGEX-4T-1-OsAHP2。
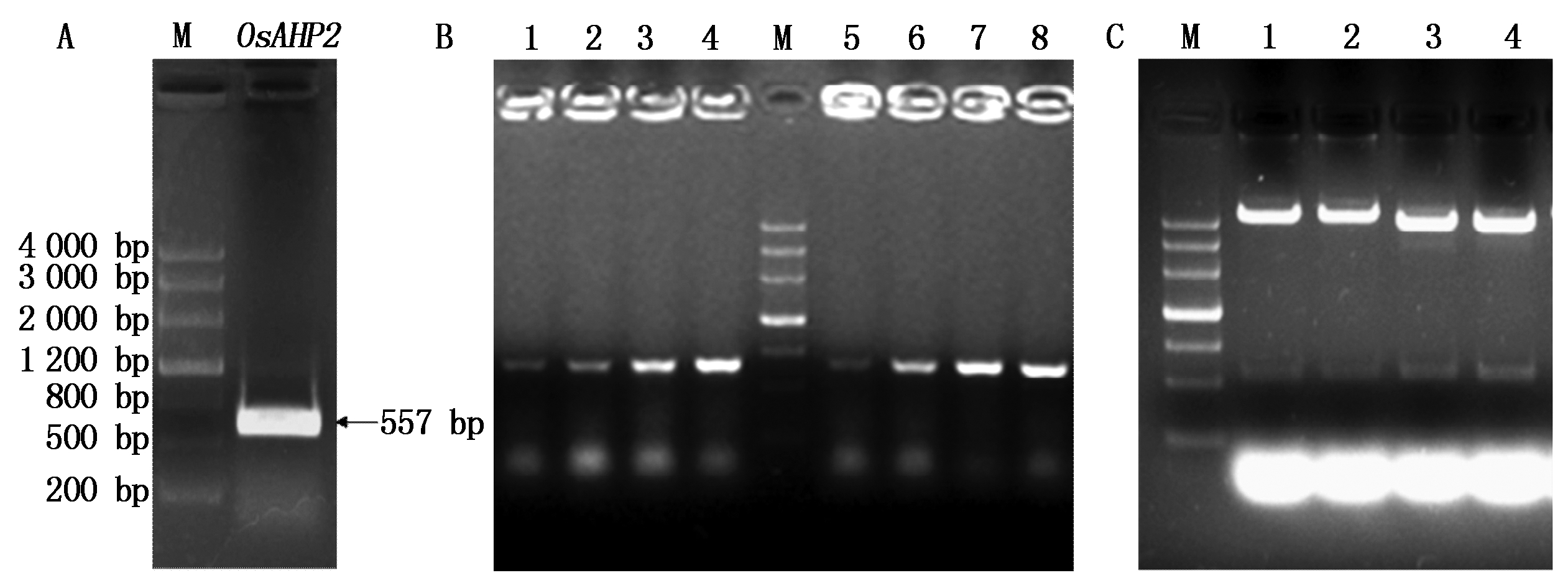
A.OsAHP2的PCR扩增:M.Marker Ⅲ分子量标准;OsAHP2.OsAHP2基因;B. OsAHP2原核表达载体的菌体PCR鉴定:1-4. pET-32a-OsAHP2菌体PCR产物;M.Marker Ⅲ分子量标准;5-8.pGEX-4T-1-OsAHP2菌体PCR产物;C. OsAHP2原核表达载体的酶切鉴定:M. Marker Ⅲ分子量标准;1-2.pET-32a-OsAHP2重组质粒EcoRⅠ+ XhoⅠ双酶切;3-4.pGEX-4T-1-OsAHP2重组质粒EcoRⅠ+ XhoⅠ双酶切。
A. PCR amplification of OsAHP2 gene: M. Marker Ⅲ DNA Marker; OsAHP2. OsAHP2 gene; B. Identification of the prokaryotic expression vector of OsAHP2 gene by PCR:1-4. Different pET-32a-OsAHP2 colonies; M. Marker Ⅲ DNA Marker; 5-8. Different pGEX-4T-1-OsAHP2 colonies; C. Identification of the prokaryotic expression vector of OsAHP2 gene by restriction enzyme digestion: M. Marker Ⅲ DNA Marker; 1-2. pET-32a-OsAHP2 recombinant plasmid digested by EcoRⅠ and XhoⅠ;3-4.pGEX-4T-1-OsAHP2 recombinant plasmid digested by EcoRⅠ and XhoⅠ.
图1 OsAHP2原核表达载体的构建
Fig.1 Construction of the prokaryotic expression vector of OsAHP2 gene
2.2 不同原核表达载体和IPTG诱导时间对融合蛋白表达量的影响
将pET-32a-OsAHP2转化大肠杆菌表达菌株Rosseta,pGEX-4T-1-OsAHP2转化大肠杆菌表达菌株XA90,分别用0.5 mmol/L IPTG诱导1,3,5 h后取样;pET-32a空载体和pGEX-4T-1空载体则分别用0.5 mmol/L IPTG诱导5 h取样。SDS-PAGE结果表明,pET-32a空载体经IPTG诱导在21 ku处产生诱导条带,为载体上的Trx+His+S标签;以未诱导和空载体为对照,pET-32a-OsAHP2重组菌株在35 ku处诱导表达出融合蛋白,并且融合蛋白的表达量3 h最高(图2-A)。pGEX-4T-1空载体经IPTG诱导在28 ku处产生诱导条带,为载体上的GST标签;以未诱导和空载体为对照,pGEX-4T-1-OsAHP2重组菌株在42 ku处诱导表达出融合蛋白,并且融合蛋白的表达量均随着时间的增加而增多(图2-B)。
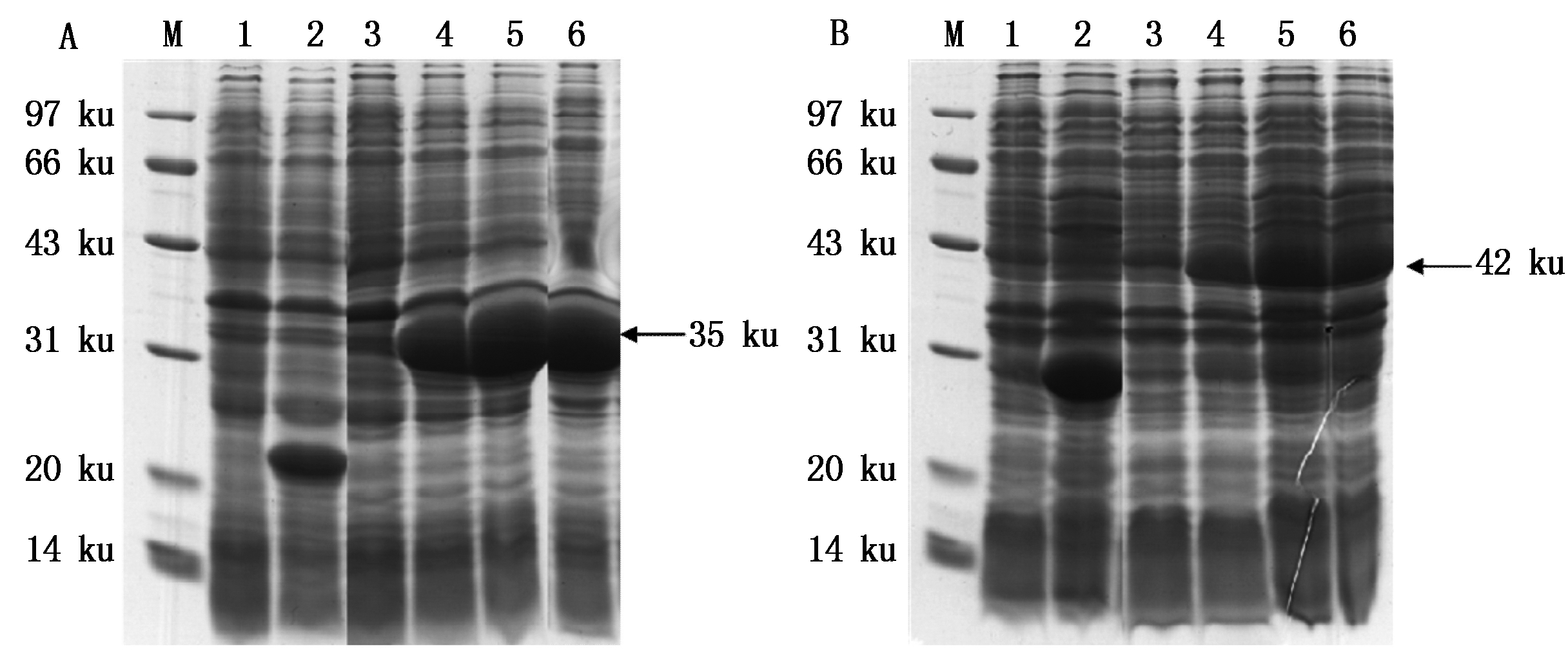
A.IPTG诱导时间与pET-32a-OsAHP2融合蛋白表达量的关系:M.蛋白分子量标准;1.pET-32a空载体未诱导;2.pET-32a空载体IPTG诱导5 h;3.pET-32a-OsAHP2融合蛋白未诱导;4-6.pET-32a-OsAHP2融合蛋白IPTG诱导1,3,5 h;B.IPTG诱导时间与pGEX-4T-1-OsAHP2融合蛋白表达量的关系:M.蛋白分子量标准;1.pGEX-4T-1空载体未诱导;2.pGEX-4T-1空载体IPTG诱导5 h;3.pGEX-4T-1-OsAHP2融合蛋白未诱导;4-6.pGEX-4T-1-OsAHP2融合蛋白IPTG诱导1,3,5 h。
A.Relationship between induction time of IPTG and the expression of pET-32a-OsAHP2 fusion protein: M.Protein Marker; 1.pET-32a without IPTG induction; 2.pET-32a with 5 h IPTG induction; 3.pET-32a-OsAHP2 without IPTG induction; 4-6.pET-32a-OsAHP2 with 1,3,5 h IPTG induction; B.Relationship between induction time of IPTG and the expression of pGEX-4T-1-OsAHP2 fusion protein: M. Protein Marker; 1.pGEX-4T-1 without IPTG induction;2.pGEX-4T-1 with 5 h IPTG induction; 3.pGEX-4T-1-OsAHP2 without IPTG induction; 4-6.pGEX-4T-1-OsAHP2 with 1, 3, 5 h IPTG induction.
图2 不同原核表达载体和IPTG诱导时间对融合蛋白表达量的影响
Fig.2 SDS-PAGE analysis of effect of vector and induction time of IPTG on fusion protein expression
虽然pET-32a-OsAHP2和pGEX-4T-1-OsAHP2均能表达出融合蛋白,但pET-32a-OsAHP2融合蛋白的表达量整体高于pGEX-4T-1-OsAHP2。因此,选择pET-32a-OsAHP2重组菌株IPTG诱导3 h进行后续蛋白纯化。
2.3 pET-32a-OsAHP2融合蛋白的可溶性分析
将pET-32a-OsAHP2重组菌株IPTG诱导3 h的菌体进行超声波破碎,离心收集上清和沉淀进行SDS-PAGE分析。结果表明,OsAHP2融合蛋白主要以可溶性蛋白的形式存在于菌液裂解后的上清中,包涵体中也有一定量的表达(图3)。由于可溶性蛋白具有活性、纯化简单等优点,因此,选择从可溶性蛋白中进行后续蛋白纯化。
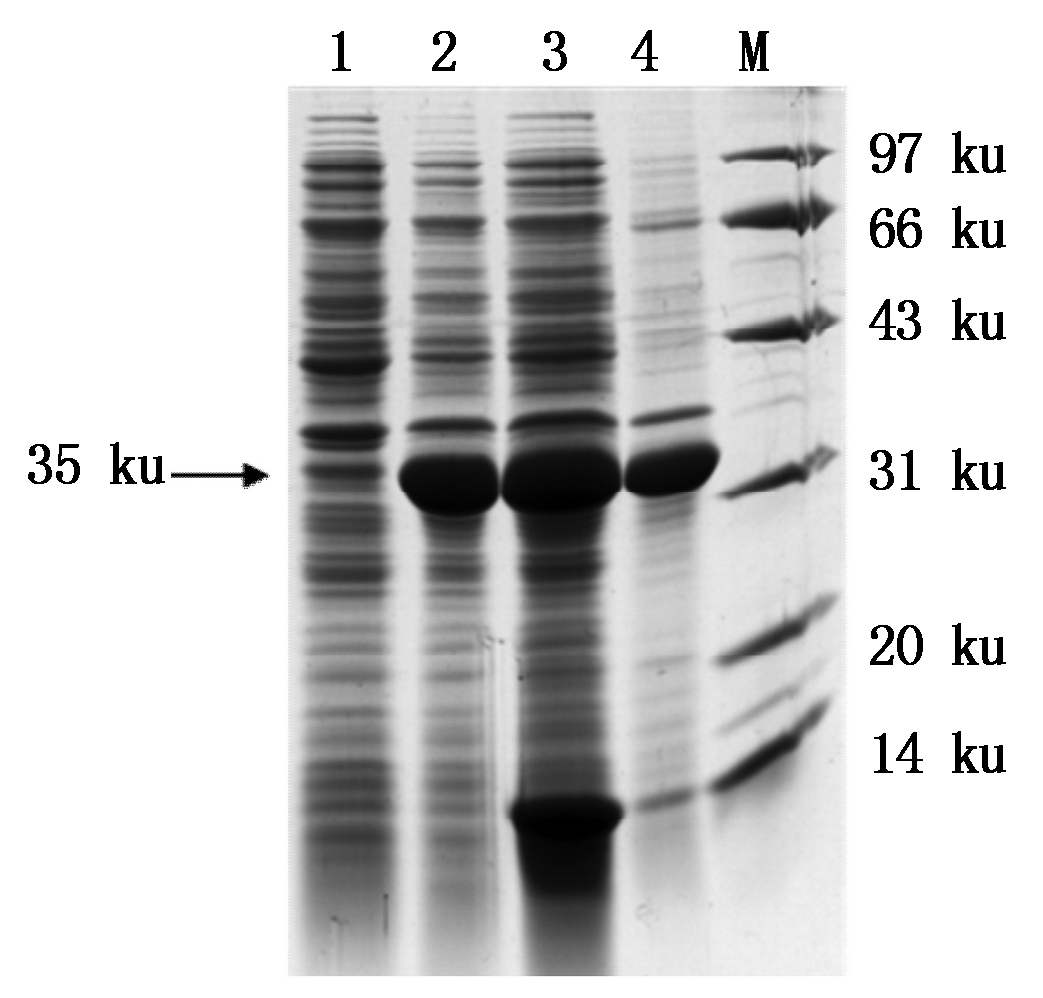
1.未诱导;2.诱导后全蛋白;3.诱导后裂解上清;
4.诱导后裂解沉淀;M.蛋白分子量标准。
1.Total protein without IPTG induction; 2.Total protein with IPTG induction;
3.Supernatant of lysate; 4.Precipitation of lysate; M.Protein Marker.
图3 pET-32a-OsAHP2融合蛋白的可溶性分析
Fig.3 Solubility analysis of pET-32a-OsAHP2 protein
2.4 pET-32a-OsAHP2融合蛋白的纯化
将pET-32a-OsAHP2重组菌株IPTG诱导3 h的菌体进行超声波破碎,离心后的上清用His镍离子亲和层析柱进行蛋白纯化,通过4次洗涤和3次洗脱,获得了大量大小约为35 ku的纯度较好的OsAHP2融合蛋白(图4)。
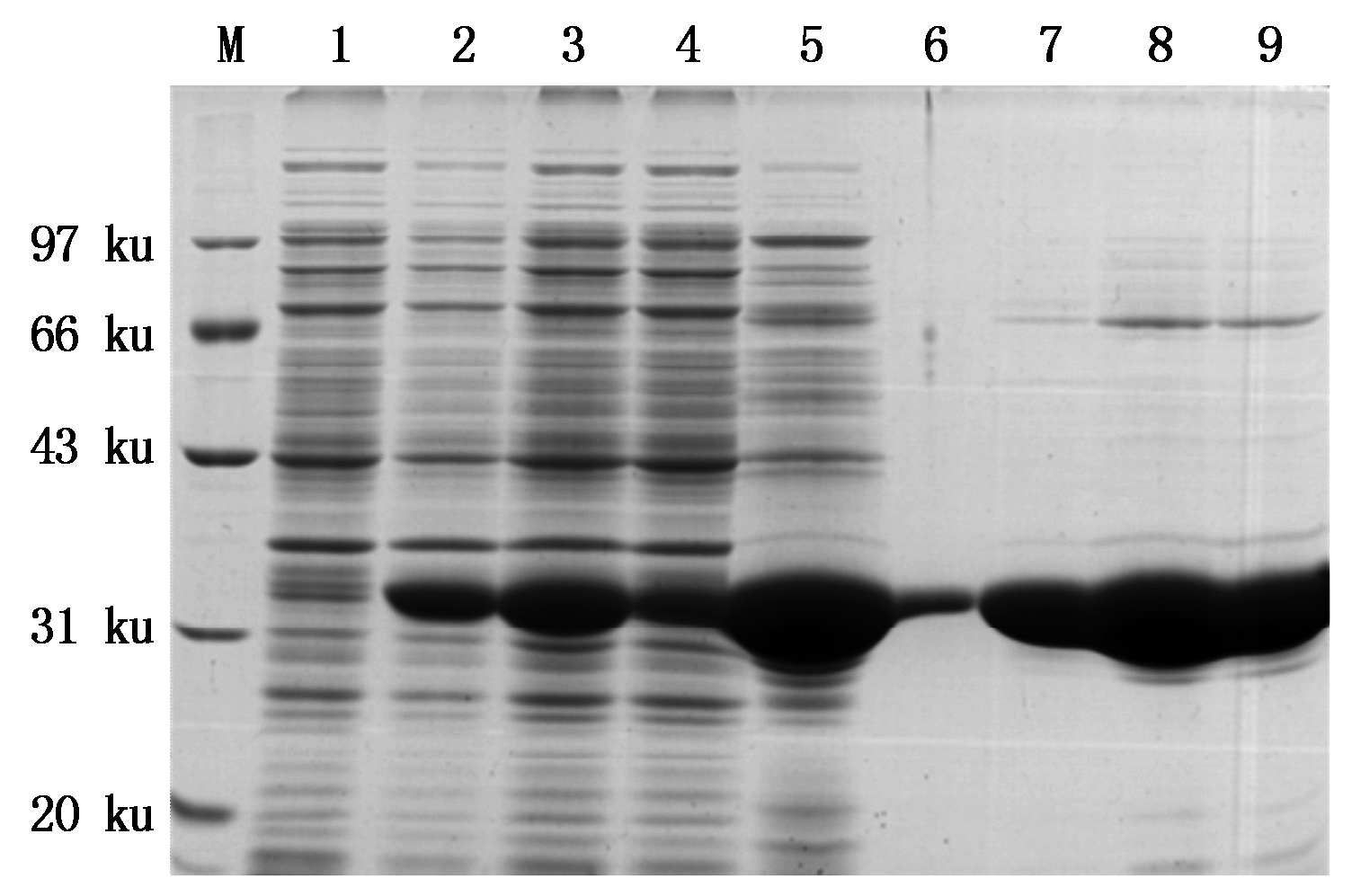
M.蛋白分子量标准;1.未诱导;2.诱导后全蛋白;3.上柱液;4.流出液;5.第1次洗涤液;6.第4次洗涤液;7-9.洗脱液E1~E3。
M.Protein Marker; 1.Total protein without IPTG induction; 2.Total protein with IPTG induction ; 3.Input; 4.Flow through; 5.The 1st volume of washing Buffer; 6. The 4th volume of washing Buffer; 7-9.Elution buffer E1-E3.
图4 pET-32a-OsAHP2融合蛋白的纯化
Fig.4 Purification of pET-32a-OsAHP2 protein
3 结论与讨论
组氨酸磷酸转运蛋白是细胞分裂素信号转导通路的重要组成部分,负责将细胞分裂素受体的磷酸基团转移到下游的反应调节因子上,从而激活下游基因的表达。水稻中HP家族由2个OsAHP(Authentic His-containing phosphotransfer protein)和3个OsPHP(Pseudo His-containing phosphotransfer proteins)组成[18-20]。OsAHP具有信号转导过程中用于进行磷酸基团传递的保守的His位点;而OsPHP中保守的His位点被Glu替代,因无法进行信号传递而被称为假磷酸转运蛋白。本实验室前期研究结果表明,OsAHP参与了水稻细胞分裂素信号转导途径,并且在盐和干旱胁迫中也发挥着重要作用[21]。为了进一步研究OsAHP2与细胞分裂素信号转导通路中其他蛋白的相互作用和磷酸化分析,本研究构建了OsAHP2原核表达载体,优化了蛋白表达条件并对表达的融合蛋白进行了分离纯化。
大肠杆菌表达系统具有培养周期短、遗传背景清楚、目的基因表达水平高等优点[22-24]。然而,外源基因能否在大肠杆菌中高效表达受许多因素影响,包括目标蛋白自身编码基因、表达载体、表达宿主菌和诱导表达的条件等[25-27]。常用的原核表达载体有pET系列载体(His标签)和pGEX系列载体(GST标签)[28-30]。为了研究不同表达载体对OsAHP2蛋白表达的影响,本研究将OsAHP2基因分别连入pET-32a和pGEX-4T-1载体,分别转化大肠杆菌表达菌株Rosseta和XA90,SDS-PAGE结果显示,0.5 mmol/L IPTG诱导不同时间,pET-32a-OsAHP2中融合蛋白的表达量均高于pGEX-4T-1-OsAHP2。因此,选择pET-32a-OsAHP2重组菌株进行后续试验。可溶性分析显示,OsAHP2融合蛋白在上清和包涵体中均有一定量的表达,因为包涵体中多肽链往往由于折叠错误而使蛋白失去活性,需要经过复杂的变性复性过程才能得到有活性的蛋白,所以本研究采取了从可溶性蛋白中纯化OsAHP2融合蛋白的策略。
OsAHP2开放阅读框全长450 bp,编码149个氨基酸,为了设计引物的匹配性,本研究设计了OsAHP2基因上下游特异引物,PCR扩增获得557 bp(包括开放阅读框450 bp及终止密码子下游的107 bp)的OsAHP2全长基因。本研究选取的原核表达载体pET-32a和pGEX-4T-1上的融合蛋白标签均位于目的基因5′端,并且由于目的基因3′端包含了终止密码子,因此,多扩增出的107 bp不会表达出蛋白,从而保证了融合蛋白的正确性。pET-32a-OsAHP2在Rosseta中诱导表达的融合蛋白约为35 ku,与理论值基本一致。
本研究构建了2个OsAHP2原核表达载体,通过His镍离子亲和层析柱从融合蛋白表达量较高的pET-32a-OsAHP2重组菌中纯化到了大量纯度较高的OsAHP2融合蛋白,为后续研究OsAHP2与细胞分裂素信号转导通路中其他蛋白的相互作用和磷酸化分析奠定了基础。
[1] Schaller G E, Bishopp A, Kieber J J. The yin-yang of hormones: cytokinin and auxin interactions in plant development[J]. The Plant Cell, 2015, 27(1): 44-63. doi:10.1105/tpc.114.133595.
[2] Brandizzi F. Divide, expand, differentiate-new insights on plant organ growth through cytokinin signaling[J]. The Plant Journal, 2019, 97(5): 803-804. doi:10.1111/tpj.14261.
[3] Aki S S, Mikami T, Naramoto S, Nishihama R, Ishizaki K, Kojima M, Takebayashi Y, Sakakibara H, Kyozuka J, Kohchi T, Umeda M. Cytokinin signaling is essential for organ formation in Marchantia polymorpha[J]. Plant & Cell Physiology, 2019, 60(8): 1842-1854. doi:10.1093/pcp/pcz100.
[4] Kieber J J, Schaller G E. Cytokinin signaling in plant development[J]. Development, 2018, 145(4):149344. doi:10.1242/dev.149344.
[5] Wang L, Chong K. The essential role of cytokinin signaling in root apical meristem formation during somatic embryogenesis[J]. Frontiers in Plant Science, 2016, 6: 1196. doi:10.3389/fpls.2015.01196.
[6] Wybouw B, De Rybel B. Cytokinin-A developing story[J]. Trends in Plant Sience, 2019, 24(2): 177-185. doi:10.1016/j.tplants.2018.10.012.
[7] Bielach A, Hrtyan M, Tognetti V B. Plants under stress: involvement of auxin and cytokinin[J]. International Journal of Molecular Sciences, 2017, 18(7): 1427. doi:10.3390/ijms18071427.
[8] Huang X Z, Hou L Y, Meng J J, You H W, Li Z, Gong Z Z, Yang S H, Shi Y T. The antagonistic action of abscisic acid and cytokinin signaling mediates drought stress response in Arabidopsis[J]. Molecular Plant, 2018, 11(7): 970-982. doi:10.1016/j.molp.2018.05.001.
[9] Li W Q, Herrera-Estrella L, Tran L P. Do cytokinins and strigolactones crosstalk during drought adaptation?[J]. Trends in Plant Science, 2019, 24(8): 669-672. doi:10.1016/j.tplants.2019.06.007.
[10] Wang W C, Lin T C, Kieber J, Tsai Y C. Response regulator 9 and 10 negatively regulate salinity tolerance in rice[J]. Plant & Cell Physiology, 2019, 60(11):2549-2563.doi:10.1093/pcp/pcz149.
[11] Cortleven A, Leuendorf J E, Frank M, Pezzetta D, Bolt S, Schmülling T. Cytokinin action in response to abiotic and biotic stresses in plants[J]. Plant, Cell & Environment, 2019, 42(3): 998-1018. doi:10.1111/pce.13494.
[12] ![]() J, Novák J, Koukalová V, Luklová M, Brzobohat
J, Novák J, Koukalová V, Luklová M, Brzobohat B,
B, ![]()
 M. Cytokinin at the crossroads of abiotic stress signalling pathways[J]. International Journal of Molecular Sciences, 2018, 19(8): 2450. doi:10.3390/ijms19082450.
M. Cytokinin at the crossroads of abiotic stress signalling pathways[J]. International Journal of Molecular Sciences, 2018, 19(8): 2450. doi:10.3390/ijms19082450.
[13] Heyl A, Schmülling T. Cytokinin signal perception and transduction[J]. Current Opinion in Plant Biology, 2003, 6(5): 480-488. doi:10.1016/S1369-5266(03)00087-6.
[14] To J P C, Kieber J J. Cytokinin signaling: two-components and more[J]. Trends in Plant Science, 2008, 13(2): 85-92. doi:10.1016/j.tplants.2007.11.005.
[15] Zürcher E, Müller B. Cytokinin synthesis, signaling, and function-advances and new insights[J]. International Review of Cell and Molecular Biology, 2016, 324: 1-38. doi:10.1016/bs.ircmb.2016.01.001.
[16] Hutchison C E, Li J, Argueso C, Gonzalez M, Lee E, Lewis M W, Maxwell B B, Perdue T D, Schaller G E, Alonso J M, Ecker J R, Kieber J J. The Arabidopsis histidine phosphotransfer proteins are redundant positive regulators of cytokinin signaling[J]. The Plant Cell, 2006, 18(11): 3073-3087. doi:10.1105/tpc.106.045674.
[17] Nishiyama R, Watanabe Y, Leyva-Gonzalez M A, Van Ha C, Fujita Y, Tanaka M, Seki M, Yamaguchi-Shinozaki K, Shinozaki K, Herrera-Estrella L, Phan Tran L S. Arabidopsis AHP2, AHP3, and AHP5 histidine phosphotransfer proteins function as redundant negative regulators of drought stress response[J]. Proceedings of the National Academy of Sciences, 2013, 110(12): 4840-4845. doi:10.1073/pnas.1302265110.
[18] Du L M, Jiao F C, Chu J, Jin G L, Chen M, Wu P. The two-component signal system in rice (Oryza sativa L.): a genome-wide study of cytokinin signal perception and transduction[J]. Genomics, 2007, 89(6): 697-707. doi:10.1016/j.ygeno.2007.02.001.
[19] Schaller G E, Doi K, Hwang I, Kieber J J, Khurana J P, Kurata N, Mizuno T, Pareek A, Shiu S H, Wu P, Yip W K. Nomenclature for two-component signaling elements of rice[J]. Plant Physiology, 2007, 143(2): 555-557. doi:10.1104/pp.106.093666.
[20] Tsai Y C, Weir N R, Hill K, Zhang W J, Kim H J, Shiu S H, Schaller G E, Kieber J J. Characterization of genes involved in cytokinin signaling and metabolism from rice[J]. Plant Physiology, 2012, 158(4): 1666-1684. doi:10.1104/pp.111.192765.
[21] Sun L J, Zhang Q, Wu J X, Zhang L Q, Jiao W W, Zhang S W, Zhang Z G, Sun D Y, Lu T G, Sun Y. Two rice authentic histidine phosphotransfer proteins, OsAHP1 and OsAHP2, mediate cytokinin signaling and stress responses in rice[J]. Plant Physiology, 2014, 165(1): 335-345. doi:10.1104/pp.113.232629.
[22] 苏文强, 胡鑫宇, 王秋霞, 欧长波, 郭爱疆, 李辉, 骆学农, 余燕, 张艳红, 姜金庆, 刘兴友, 马金友, 王松, 才学鹏. 猪囊尾蚴API基因原核表达条件的优化[J]. 西北农林科技大学学报(自然科学版), 2017, 45(8): 1-6. doi:10.13207/j.cnki.jnwafu.2017.08.001.
Su W Q, Hu X Y, Wang Q X, Ou C B, Guo A J, Li H, Luo X N, Yu Y, Zhang Y H, Jiang J Q, Liu X Y, Ma J Y, Wang S, Cai X P. Optimization of prokaryotic expression conditions for apoptosis protease inhibitor gene from Cysticercus cellulosae[J]. Journal of Northwest A & F University(Natural Science Edition), 2017, 45(8): 1-6.
[23] 毛明光, 温施慧, 姜志强, 蒋洁兰, 孙航, 吕绘倩, 李幸. 太平洋鳕神经坏死病毒衣壳蛋白(CP)的原核表达及条件优化[J]. 大连海洋大学学报, 2016, 31(2): 117-123. doi:10.16535/j.cnki.dlhyxb.2016.02.001.
Mao M G, Wen S H, Jiang Z Q, Jiang J L, Sun H, Lü H Q, Li X. Prokaryotic expression and condition optimization of Nervous necrosis virus capsid protein(CP) in pacific cod Gadus macrocephalus[J]. Journal of Dalian Ocean University, 2016, 31(2): 117-123.
[24] 周泽军, 庞欢瑛, 丁燏, 简纪常, 吴灶和. 溶藻弧菌HY9901转运蛋白TolB的原核表达及条件优化和纯化[J]. 中国农学通报, 2013, 29(11): 55-59. doi:10.11924/j.issn.1000-6850.2012-3302.
Zhou Z J, Pang H Y, Ding Y, Jian J C, Wu Z H. Purification and optimization of prokaryotic expression of translocation protein TolB gene from Vibrio alginolyticus strain HY9901[J]. Chinese Agricultural Science Bulletin, 2013, 29(11): 55-59.
[25] 郝英辰, 龙月, 郭豪, 李宁, 张松杰, 赵棋, 张松涛. 烟草NtGCN2的原核表达、纯化及多克隆抗体制备[J]. 农业生物技术学报, 2019, 27(1): 170-179. doi:10.3969/j.issn.1674-7968.2019.01.018.
Hao Y C, Long Y, Guo H, Li N, Zhang S J, Zhao Q, Zhang S T. Prokaryotic expression, purification and polyclonal antibody preparation of tobacco(Nicotiana tabacum) NtGCN2[J]. Journal of Agricultural Biotechnology, 2019, 27(1): 170-179.
[26] 蒋琛茜, 瓮巧云, 樊锦涛, 王冠宇, 董丽萍, 邢继红, 董金皋. 拟南芥抗病相关基因T1N6_22的原核表达分析[J]. 华北农学报, 2015, 30(1): 73-76. doi:10.7668/hbnxb.2015.01.012.
Jiang C X, Weng Q Y, Fan J T, Wang G Y, Dong L P, Xing J H, Dong J G. Prokaryotic expression analysis of resistance-related gene T1N6_22 from Arabidopsis thaliana[J]. Acta Agriculturae Boreali-Sinica, 2015, 30(1): 73-76.
[27] Khow O, Suntrarachun S. Strategies for production of active eukaryotic proteins in bacterial expression system[J]. Asian Pacific Journal of Tropical Biomedicine, 2012, 2(2): 159-162. doi:10.1016/S2221-1691(11)60213-X.
[28] 杨雪, 武志海, 李艳丽, 杨美英. 二穗短柄草BdGPX4基因的克隆及酶学性质[J]. 中国农业大学学报, 2018, 23(10): 8-17. doi:10.11841/j.issn.1007-4333.2018.10.02.
Yang X, Wu Z H, Li Y L, Yang M Y. Cloning and characterization of glutathione peroxidase 4 from Brachypodium distachyon[J]. Journal of China Agricultural University, 2018, 23(10): 8-17.
[29] 刘超, 冯勇, 董笑笑, 张忠明, 朱辉. 百脉根泛素结合酶LjE2的表达及活性鉴定[J]. 华中农业大学学报, 2019, 38(1): 22-27. doi:10.13300/j.cnki.hnlkxb.2019.01.004.
Liu C, Feng Y, Dong X X, Zhang Z M, Zhu H. Expression and activity identification of ubiquitin-binding enzyme LjE2 of Lotus japonicus[J]. Journal of Huazhong Agricultural University, 2019, 38(1): 22-27.
[30] 陈伟杰, 付文强, 黄惜, 袁红梅. 橡胶树转录因子HbCBF2和HbCBF3的克隆和原核表达分析[J]. 分子植物育种, 2018, 16(13): 4194-4201. doi:10.13271/j.mpb.016.004194.
Chen W J, Fu W Q, Huang X, Yuan H M. Cloning and prokaryotic expression of transcription factor HbCBF2 and HbCBF3 in Hevea brasiliensis[J]. Molecular Plant Breeding, 2018, 16(13): 4194-4201.
