大豆是我国重要的油料作物,也是重要的植物油来源,其种子油脂含量和脂肪酸组分对大豆品质具有重要影响[1]。油酸和亚油酸是大豆种子油脂中对人体有益的不饱和脂肪酸,在预防高血压和心脏病等方面具有重要作用,而亚麻酸易于氧化,容易使油脂变质[2-3]。因此,在大豆品质育种中,提高大豆种子油脂含量尤其是油酸和亚油酸含量,同时降低亚麻酸含量已成为研究的热点。
三酰甘油(TAG)是油料作物油脂积累和储存的主要形式,对植物种子油脂的形成十分重要[4-8]。二酰甘油酰基转移酶(DGAT)是催化TAG生物合成的关键酶,在TAG的合成和积累过程中具有重要调控作用[9]。目前,已发现4种类型的DGAT,包括DGAT1、DGAT2、WS/DGAT和可溶性的DGAT[10],其中DGAT1研究得最为深入,已在旱金莲[11]、甘蓝型油菜[12]、大豆[13]、玉米[14]和烟草[15]等多个物种中被克隆和研究。研究表明,DGAT1是TAG积累的主要贡献者,在植物中主要影响种子的含油量[16-21]。例如,将旱金莲TmDGAT1基因分别转入拟南芥、油菜和高芥酸油菜,可使其干种子含油量提高3.5%~10%[11];在玉米中,过表达DGAT1不仅可以提高玉米种子的含油量,还改变了种子油脂的组成[14]。相反地,在拟南芥DGAT1突变体植株中,种子含油量下降20%~40%[22]。关于大豆DGAT的研究发现,大豆中共存在10个DGAT基因,其中包含3个DGAT1基因[23]。进一步将GmDGAT1A在拟南芥中进行过表达,可使转基因种子含油量提高15.4%~21.7%[24],表明大豆GmDGAT1A基因在提高植物种子含油量方面具有很大潜力。因此,研究大豆GmDGAT1A基因的表达调控,不仅有助于深入了解其表达调控的分子机制,也可为通过改变GmDGAT1A表达水平,提高大豆种子油脂含量提供一种新途径。
启动子是RNA聚合酶能够识别与结合,进而启动基因转录的一段DNA序列,对基因的表达调控至关重要,决定了基因的表达模式和强度[25-26]。另外,启动子区具有很多重要的调控元件,包括响应于非生物胁迫、植物激素和光照等,它们可以通过响应外界环境条件来调控下游基因的表达,增强植物对外界环境的适应性[26-28]。因此,研究基因的启动子,对于增强植物的抗逆性和对外界环境的适应性等也具有重要意义。GmDGAT1A是大豆油脂代谢过程中的一个关键基因,目前对于GmDGAT1A表达特性和功能已开展一些研究[13,29],但是关于该基因表达调控的分子机制还知之甚少。本研究对大豆GmDGAT1A启动子进行克隆,并对其顺式作用元件进行分析,另外,又进一步构建了含有报告基因GUS的植物表达载体pCAMBIA1381Z-pGmDGAT1A,并通过转化拟南芥和GUS组织化学染色来研究其功能,旨在探究油脂代谢基因表达调控的分子机制,并为通过基因工程提高大豆种子油脂含量提供理论依据。
1 材料和方法
1.1 供试材料
试验材料为大豆品种科丰1号,由南京农业大学国家大豆改良中心提供,用于GmDGAT1A启动子的克隆。
1.2 大豆基因组DNA的提取
以大豆叶片为试验材料,使用基因组DNA提取试剂盒(TIANGEN,DP321),按照试剂盒说明书操作步骤进行大豆基因组DNA的提取,并通过1%琼脂糖凝胶电泳检测DNA提取的质量。
1.3 GmDGAT1A启动子的扩增
根据GmDGAT1A启动子的序列信息,利用Primer 5.0设计特异性引物,引物序列:pGmDGAT1A-F1:GACCTAAACCGATAACCAAAGAA,pGmDGAT1A-R1:AACCTGACGGAAAATGGTGTC。PCR扩增反应体系包括25 μL 2 × Phanta Max Buffer (Mg2+ plus),1.0 μL dNTP Mix (10 mmol/L each),正、反向引物(10 μmol/L)各2 μL,1 μL Phanta Max Super-Fidelity DNA Polymerase(Vazyme,P505-d1),2.5 μL DNA 模板和16.5 μL ddH2O,共计50 μL。PCR扩增反应程序:95 ℃ 5 min;95 ℃ 15 s,58 ℃ 15 s,72 ℃ 3 min,34个循环;72 ℃ 10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测,确定为目的基因的PCR产物经胶回收试剂盒(Axygen,AP-GX-4)回收后送华大基因公司进行测序。
1.4 GmDGAT1A启动子序列分析
利用植物顺式作用元件数据库PlantCare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行GmDGAT1A启动子区顺式作用元件的预测。
1.5 GmDGAT1A启动子表达载体的构建
选用无启动子、含有GUS基因的pCAMBIA1381Z作为表达载体,利用双酶切方法构建融合表达载体pCAMBIA1381Z-pGmDGAT1A。首先根据启动子序列设计含有酶切位点和保护碱基的上下游引物,上游引物为pGmDGAT1A-F2:5′-CGCGGATCCGACCTAAACCGATAACCAAAGAA-3′,下划线为酶切位点BamH Ⅰ;下游引物为pGmDGAT1A-R2:5′-AAACTGCAGTGGAAAAGAAGACCGAGCG-3′,下划线为酶切位点为Pst Ⅰ。以测序正确的胶回收产物为模板进行PCR扩增,反应体系和扩增程序同上所述。使用BamH Ⅰ和Pst Ⅰ限制性内切酶对PCR产物和pCAMBIA1381Z空载体质粒分别进行酶切,电泳后的胶回收产物用T4连接酶进行连接,连接产物转化大肠杆菌DH5α,并涂布在含有卡那霉素的LB固体培养基上。挑选单克隆进行菌液PCR,阳性菌液提取质粒后进行酶切验证,含有目的基因片段的菌液送深圳华大基因公司进行测序。
1.6 农杆菌介导的转化及转基因植株的鉴定
采用农杆菌介导的蘸花法[30]将上述表达载体转化野生型拟南芥(Cloumbia-0),获得T0转基因种子。将T0种子种在含有潮霉素抗性的固体培养基上进行筛选,经抗性筛选长出的植株为T1植株,待其长出2片真叶后移栽到蛭石中,并置于光照培养箱(22 ℃,光16 h/暗8 h)中进行培养。于幼苗期取T1转基因植株的叶片,用于进一步的PCR检测,PCR检测所用引物序列:pGmDGAT1A-F3:5′-GACCTAAACCGATAACCAAAG-3′,pGmDGAT1A-R3:5′-TGGAAAAGAAGACCGAGCGAGC-3′。PCR检测为阳性的植株于成熟期收获T1种子。采用同样的方法继续对T1种子进行抗性筛选,收获的T2种子用于后续的GUS组织化学染色分析。
1.7 GUS组织化学染色
拟南芥幼苗和处于成熟期拟南芥植株的根系、叶片、茎和角果等组织的GUS染色参照Jefferson等[31]方法并略加修改。首先,取待染色的各组织,加入GUS染色液;接着,置于37 ℃温育24 h;然后,用70%乙醇进行脱色,直至底色完全消失;最后在体视镜(AXIO Zoom.V16,蔡司)下观察染色结果并拍照。
2 结果与分析
2.1 大豆GmDGAT1A启动子的克隆
用已克隆的GmDGAT1A基因ID号(Glyma.13G106100/Glyma13g16560)检索大豆基因组数据库,得到其ATG上游约2 000 bp的启动子序列。然后,在该启动子序列上下游约500 bp范围内设计1对特异性引物,并以大豆品种科丰1号DNA(图1-A)为模板,扩增大豆GmDGAT1A启动子。根据上下游引物的位置可知,扩增片段的理论大小为2 495 bp。由图1-B可以看到,PCR产物电泳检测结果与预期片段大小相符。PCR产物经测序后,与大豆基因组数据库参考序列进行Blast比对,结果表明,扩增片段包含GmDGAT1A基因ATG上游2 192 bp的启动子序列,且与大豆基因组参考序列一致,表明本研究已成功克隆GmDGAT1A的启动子pGmDGAT1A。
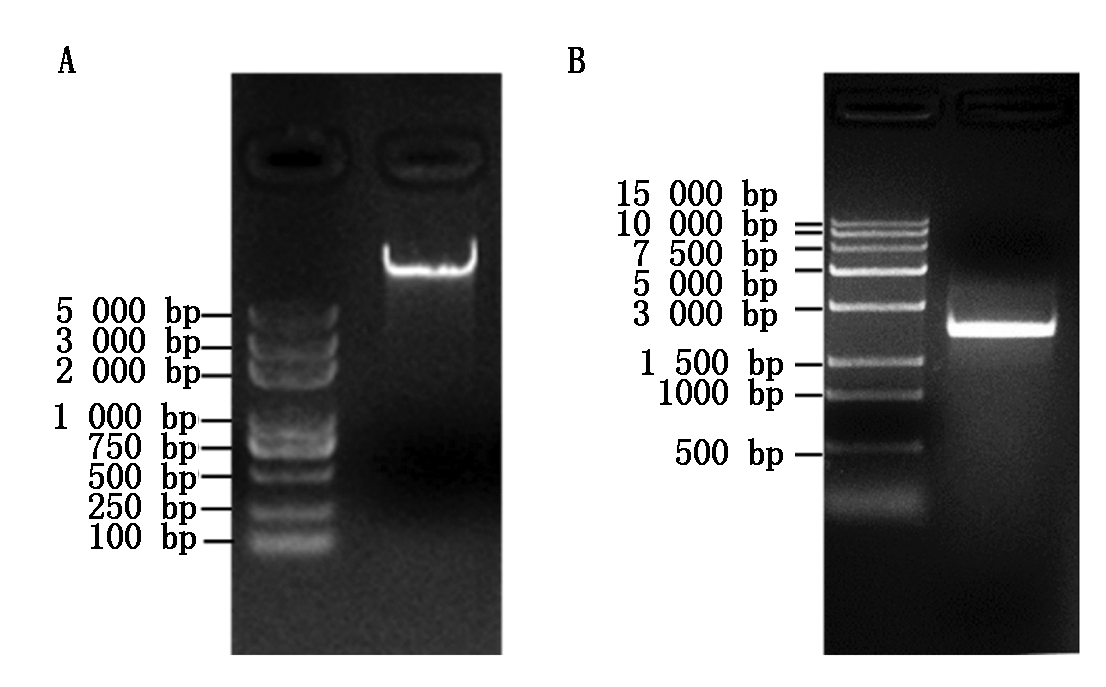
图1 大豆基因组DNA的提取(A)及GmDGAT1A启动子的扩增(B)
Fig.1 The extraction of genomic DNA (A) and PCR amplification of GmDGAT1A promoter (B) in soybean
2.2 大豆GmDGAT1A启动子的序列分析
对已克隆的pGmDGAT1A进行顺式作用元件预测分析发现,该启动子包含有TATA-box和CAAT-box等启动子所必需的基本顺式作用元件,另外还含有7个参与光响应的顺式作用元件(G-box、LAMP-element 、TCT-motif和Box 4),4个参与脱落酸响应顺式作用元件(ABRE),1个参与赤霉素响应的顺式作用元件(GARE-motif),以及一些像MYB、ERE、AAGAA-motif和Myc等功能未知的顺式作用元件(表1)。这些结果表明,GmDGAT1A的表达可能受光、赤霉素和脱落酸等多种环境条件的影响。
2.3 大豆GmDGAT1A启动子表达载体的构建
利用双酶切法将克隆的启动子片段pGmDGAT1A连接到植物表达载体pCAMBIA1381Z(有GUS,无启动子)上。将构建好的植物表达载体pCAMBIA1381Z-pGmDGAT1A转化大肠杆菌DH5α后挑选阳性克隆测序,序列比对结果正确。进一步利用限制性内切酶BamH Ⅰ和Pst Ⅰ进行酶切验证,结果表明,表达载体pCAMBIA1381Z-pGmDGAT1A可被切为2个片段,分别为2 192 bp的目标基因片段和载体片段,且载体片段与pCAMBIA1381Z空载体酶切片段的大小一致(图2),表明表达载体构建成功。
表1 大豆GmDGAT1A启动子区的顺式作用元件
Tab.1 Cis-acting elements in promoter of GmDGAT1A in soybean
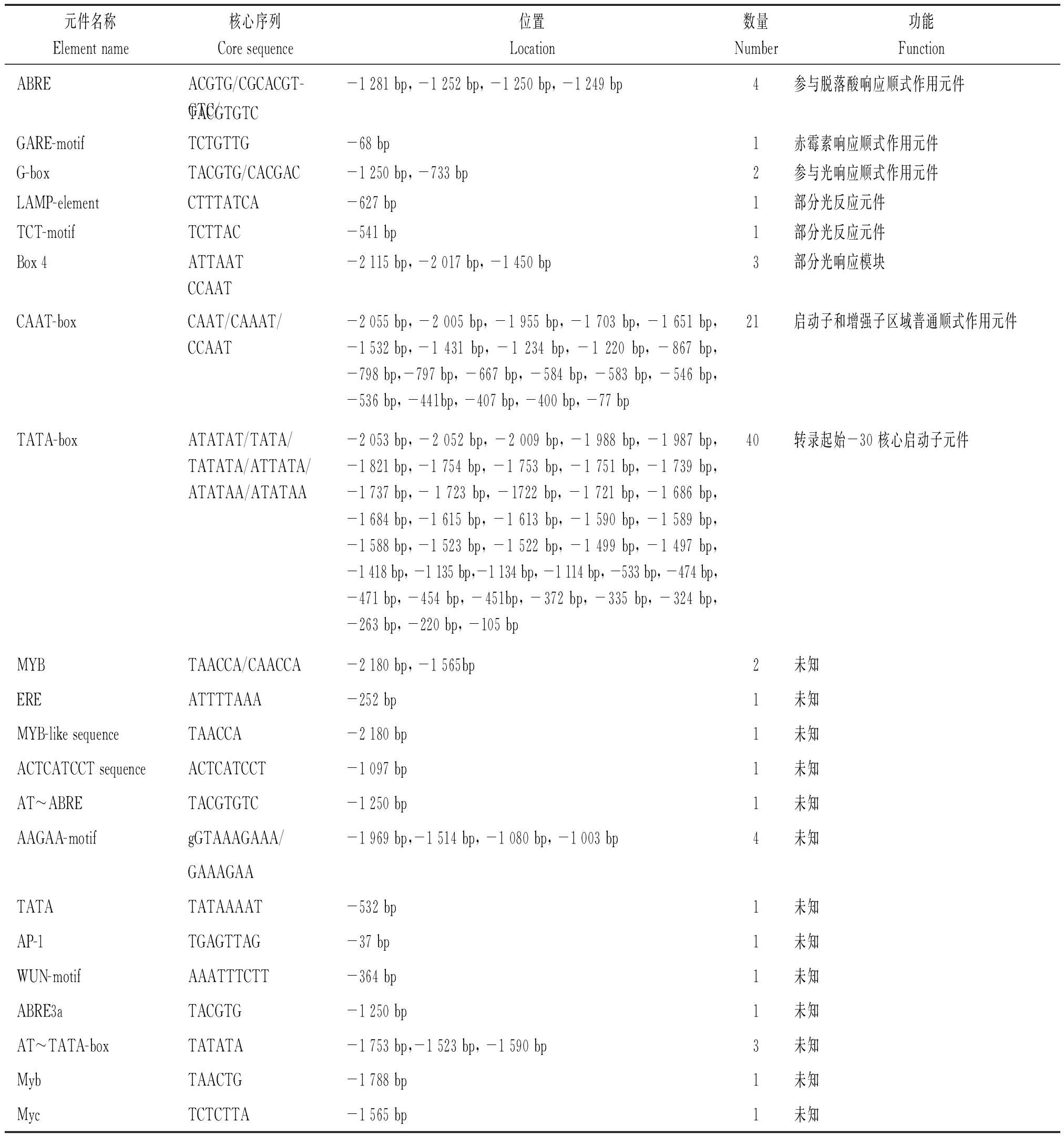
元件名称Element name核心序列Core sequence位置Location数量Number功能FunctionABREACGTG/CGCACGT-GTC/-1 281 bp, -1 252 bp, -1 250 bp, -1 249 bp4参与脱落酸响应顺式作用元件TACGTGTCGARE-motifTCTGTTG-68 bp1赤霉素响应顺式作用元件G-boxTACGTG/CACGAC-1 250 bp, -733 bp2参与光响应顺式作用元件LAMP-elementCTTTATCA-627 bp1部分光反应元件TCT-motifTCTTAC-541 bp1部分光反应元件Box 4ATTAATCCAAT-2 115 bp, -2 017 bp, -1 450 bp3部分光响应模块CAAT-boxCAAT/CAAAT/CCAAT-2 055 bp, -2 005 bp, -1 955 bp, -1 703 bp, -1 651 bp, -1 532 bp, -1 431 bp, -1 234 bp, -1 220 bp, -867 bp, -798 bp, -797 bp, -667 bp, -584 bp, -583 bp, -546 bp, -536 bp, -441bp, -407 bp, -400 bp, -77 bp21启动子和增强子区域普通顺式作用元件TATA-boxATATAT/TATA/TATATA/ATTATA/ATATAA/ATATAA-2 053 bp, -2 052 bp, -2 009 bp, -1 988 bp, -1 987 bp, -1 821 bp, -1 754 bp, -1 753 bp, -1 751 bp, -1 739 bp, -1 737 bp, - 1 723 bp, -1722 bp, -1 721 bp, -1 686 bp, -1 684 bp, -1 615 bp, -1 613 bp, -1 590 bp, -1 589 bp, -1 588 bp, -1 523 bp, -1 522 bp, -1 499 bp, -1 497 bp, -1 418 bp, -1 135 bp,-1 134 bp, -1 114 bp, -533 bp, -474 bp, -471 bp, -454 bp, -451bp, -372 bp, -335 bp, -324 bp, -263 bp, -220 bp, -105 bp40转录起始-30 核心启动子元件MYBTAACCA/CAACCA-2 180 bp, -1 565bp2未知EREATTTTAAA-252 bp1未知MYB-like sequenceTAACCA-2 180 bp1未知ACTCATCCT sequenceACTCATCCT-1 097 bp1未知AT~ABRETACGTGTC-1 250 bp1未知AAGAA-motifgGTAAAGAAA/-1 969 bp,-1 514 bp, -1 080 bp, -1 003 bp4未知GAAAGAATATATATAAAAT-532 bp1未知AP-1TGAGTTAG-37 bp1未知WUN-motifAAATTTCTT-364 bp1未知ABRE3aTACGTG-1 250 bp1未知AT~TATA-boxTATATA-1 753 bp,-1 523 bp, -1 590 bp3未知MybTAACTG-1 788 bp1未知MycTCTCTTA-1 565 bp1未知
注:核苷酸的+1位置指的是起始密码子ATG中A的位置。
Note:The nucleotide at position +1 is the ATG start codon.
2.4 转基因拟南芥阳性植株的鉴定
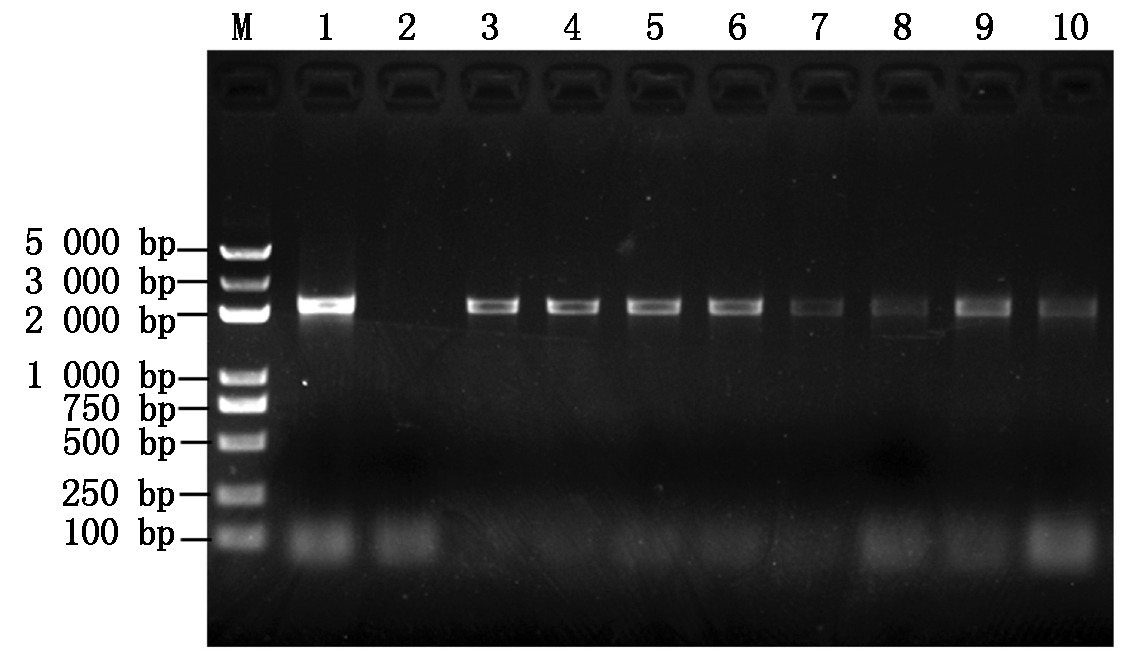
将pCAMBIA1381Z-pGmDGAT1A表达载体通过农杆菌介导法转化拟南芥,成熟后收获T0转基因种子。对T0转基因种子用含有潮霉素的MS培养基进行抗性筛选后,进一步对T1拟南芥幼苗进行基因组DNA提取和PCR检测。结果表明,T1转基因拟南芥幼苗和阳性对照(表达载体质粒)均能扩增到2 192 bp的GmDGAT1A启动子片段,而阴性对照(野生型拟南芥)扩增不到目标条带(图3),表明被检测的T1转基因拟南芥幼苗为阳性植株,成熟后收获T1转基因种子。T1转基因种子经潮霉素抗性筛选和PCR检测后,于成熟期收获T2种子,用于后续的功能分析。
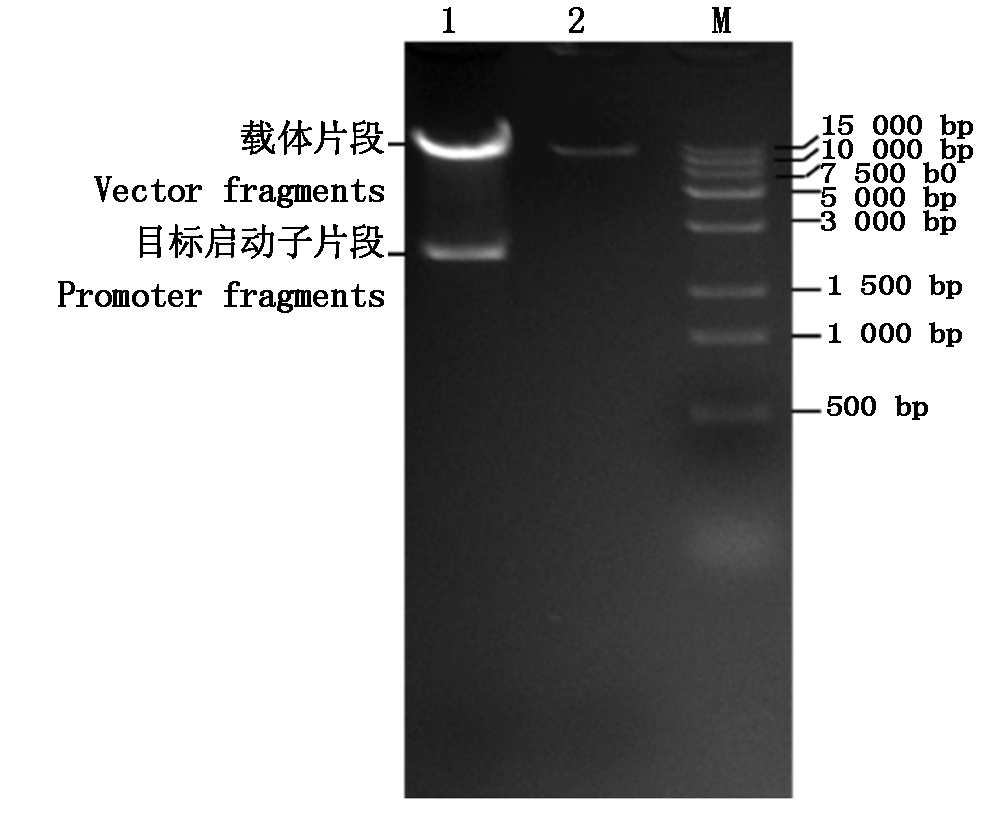
M.Marker;1.pCAMBIA1381Z-pGmDGAT1A
表达载体;2:空载体(pCAMBIA1381Z)。
M.Marker;1.pCAMBIA1381Z-pGmDGAT1A expression vector;
2.Empty vector(pCAMBIA1381Z).
图2 表达载体pCAMBIA1381Z-pGmDGAT1A的酶切鉴定
Fig.2 Restriction enzyme digestion of expression vector of pCAMBIA1381Z-pGmDGAT1A
2.5 大豆GmDGAT1A启动子的功能分析
对转pGmDGAT1A拟南芥植株各组织进行GUS组织化学染色,结果表明,pGmDGAT1A驱动的GUS主要在转基因拟南芥幼苗的叶脉(图4-A1-A2)和根(图4-A1、A3-A4)中表达,在主根和侧根的根尖部分(图4-A3-A4)不表达;在成熟期转基因拟南芥植株中,叶脉(图4-B1)、成熟的根(图4-B3-B4)、角果内的隔膜和珠柄(图4-B5-B9)GUS染色较深,而茎(图4-B2)和发育的种子(图4-B10-B12)未染色。这些结果表明,pGmDGAT1A驱动的GUS主要在拟南芥的根、叶脉以及角果内隔膜和珠柄中表达。
M.Marker;1.表达载体pCAMBIA1381Z-pGmDGAT1A质粒
(阳性对照);2.野生型拟南芥(阴性对照);3-10.转基因拟南芥。
M.Marker;1.Expression vector pCAMBIA1381Z-pGmDGAT1A(Positive
control);2.Wild Arabidopsis thaliana (Negative control);
3-10.Transgenic Arabidopsis thaliana.
图3 T1转基因拟南芥幼苗的PCR检测
Fig.3 PCR analysis of T1 generation transgenic Arabidopsis thaliana seedlings
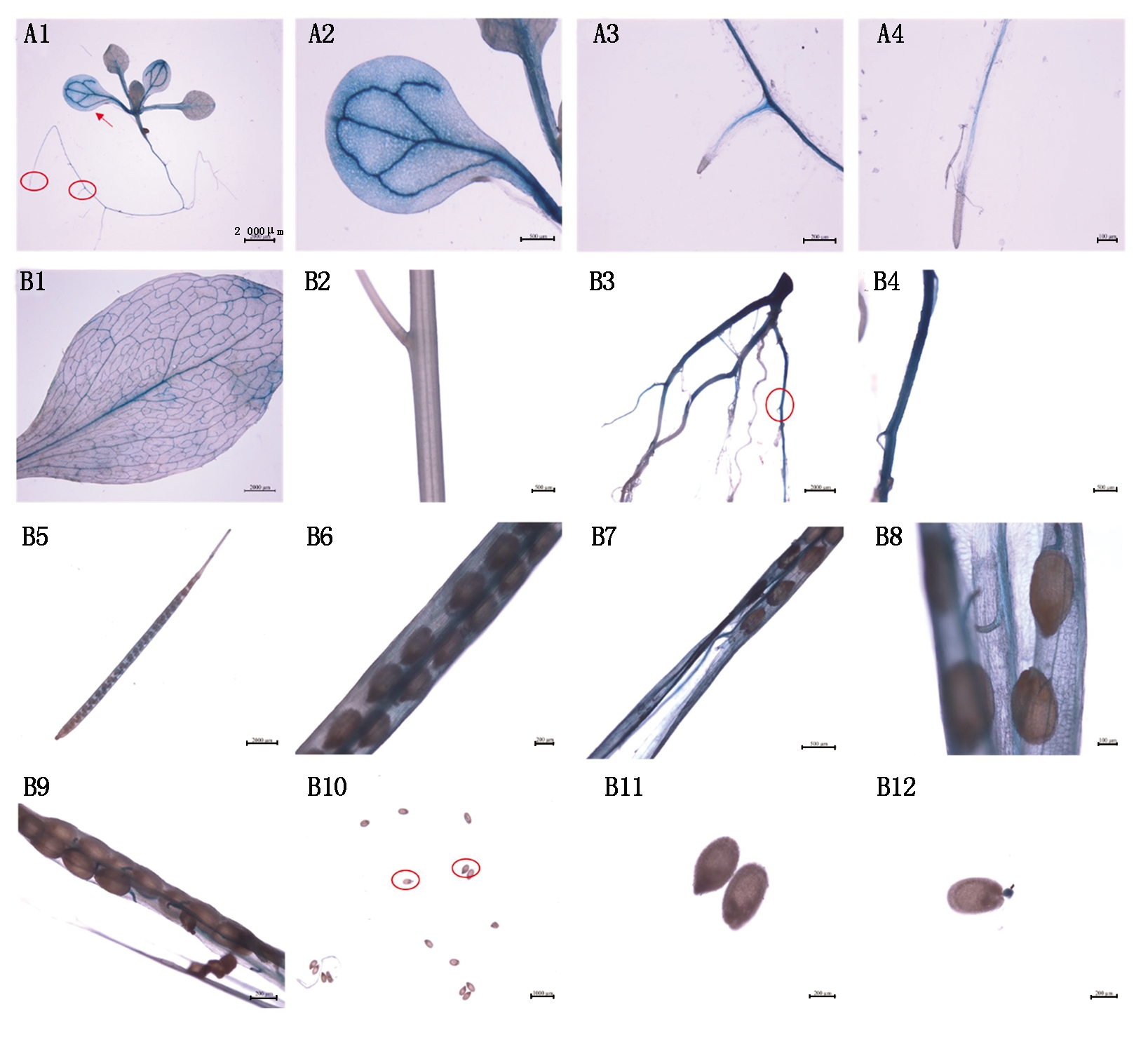
A1-A4.转pGmDGAT1A拟南芥幼苗(A1)及其叶片(A2)、侧根(A3)和主根(A4)对应位置放大图;B1-B12.成熟期转pGmDGAT1A
拟南芥植株的叶片(B1)、茎(B2)、根(B3)、根对应位置放大图(B4)、角果(B5-B9)、发育的种子(B10)和种子对应位置放大图(B11-B12)。
A1-A4.pGmDGAT1A transgenic Arabidopsis thaliana seedlings (A1) and enlarged view of its leaf (A2),lateral roots (A3) and main roots (A4);
B1-B12.The leaf (B1),stem (B2),roots (B3),enlarged view of roots (B4),silique (B5-B9),seeds (B10)
and enlarged view of seeds (B11-B12) in mature pGmDGAT1A Arabidopsis thaliana.
图4 转pGmDGAT1A拟南芥植株不同组织的GUS染色
Fig.4 GUS assay of different tissues of Arabidopsis thaliana harboring pGmDGAT1A
3 结论与讨论
植物种子中的油脂是人类重要的食用油来源,也是重要的工业原料。目前,关于油脂代谢的生化途径及相关基因的功能已比较清楚,但其调控机理尚不明确[32-33]。启动子作为基因表达调控的重要元件,在基因的表达调控中具有重要作用[34]。为了解大豆油脂代谢重要基因GmDGAT1A表达调控的分子机制,本研究对大豆油脂代谢基因GmDGAT1A启动子进行克隆和序列分析,结果发现,GmDGAT1A启动子区除具有基本的顺式作用元件外,主要还包括一些响应于光、脱落酸和赤霉素等顺式作用元件。许多研究表明,脱落酸是调控种子发育、成熟和休眠的重要内源激素[35],对于油籽脂肪酸含量和组分具有影响[36-38]。例如,在油菜中,喷施脱落酸可通过抑制脂肪酸碳链延长基因FAE1的表达,影响芥酸等超长链脂肪酸合成,进而促进不饱和脂肪酸含量的增加和蛋白质含量下降[38]。与脱落酸功能不一样的是,赤霉素具有促进种子萌发的作用[39]。由于种子在萌发过程中需要消耗油脂等营养物质来满足种子萌发和幼苗形态建成所需的能量,因此,赤霉素有利于种子油脂消耗而不利于油脂的积累[40]。进一步研究发现,赤霉素信号途径主要是通过抑制DELLA蛋白的表达,从而上调与种子脂肪分解相关的SFARs类GDSL脂酶基因的表达,最终抑制种子中油脂的积累[41]。在本研究中,大豆油脂合成的关键基因GmDGAT1A启动子区具有脱落酸和赤霉素响应元件,表明大豆种子油脂的积累可能与其他植物一样也受植物激素脱落酸和赤霉素的影响,它们可能通过启动子在转录水平调控油脂代谢相关基因的表达,从而影响大豆种子中油脂的合成与分解。有趣的是,与赤霉素响应元件相比,GmDGAT1A启动子区具有较多拷贝的脱落酸响应元件。一方面,脱落酸对于油籽种子中脂肪酸含量的积累有促进作用[36-39];另一方面,有研究表明,启动子区顺式作用元件的数目可能会影响基因表达的强度和诱导特性[42]。目前还不清楚脱落酸响应元件ABRE是如何调控下游基因GmDGAT1A表达和强度,以及脱落酸在大豆种子油脂合成中的作用。因此,在今后的研究中仍需通过启动子功能区的缺失分析等来进一步确定参与基因表达调控的重要元件及对基因表达强度的影响。
目前,关于DGAT1基因的组织表达特性研究已有较多报道,普遍认为DGAT1基因在植物的许多组织均有表达,且在不同植物中DGAT1基因的表达模式存在很大差异。例如,旱金莲DGAT1基因仅在种子中表达[11],蓖麻DGAT1基因在各个组织表达水平接近[43]。在大豆中,GmDGAT1A基因在种子中表达量最高,在根、叶、茎、花和荚等组织也有较高的表达,且在不同发育时期种子中的表达规律与油脂含量积累规律一致[13],暗示着其在大豆种子油脂积累中起着重要作用。先前研究表明,基因的表达模式主要受上游启动子的表达调控,为了探究GmDGAT1A的组织特异性表达模式是否由于其上游启动子的调控,本研究进一步通过拟南芥转化来探究大豆GmDGAT1A启动子的功能。对大豆GmDGAT1A启动子的功能进行研究发现,GmDGAT1A启动子驱动的GUS在拟南芥的根、叶片的叶脉中具有较高的表达,这与先前研究表明GmDGAT1A基因在根和叶中具有较高表达量的结果较为一致[13];而在拟南芥的角果中,GmDGAT1A启动子驱动的GUS主要在角果内的隔膜和珠柄中表达,在发育的种子中表达量很低。拟南芥角果内珠柄的主要功能是为拟南芥种子的发育提供营养通道[44],GmDGAT1A启动子驱动的GUS在拟南芥角果内的隔膜和珠柄中的高表达,表明转基因拟南芥种子中油脂的积累可能主要通过在其他地方合成并通过营养通道运输来完成。由于拟南芥角果的构造和发育规律与大豆荚果可能存在差异,因此,有必要在大豆中进一步通过GUS组织定位来探究GmDGAT1A启动子驱动的目标基因在荚果内的表达情况,从而为深入了解GmDGAT1A启动子的功能奠定基础。
[1] 李晓丹, 吴刚, 武玉花,肖玲,卢长明. 大豆种子发育过程中脂肪酸积累模式研究[J]. 大豆科学, 2007,26(4):506-510. doi:10.3969/j.issn.1000-9841.2007.04.011.
Li X D,Wu G,Wu Y H, Xiao L,Lu C M. The accumlation pattern of fatty acids dueing the development of soybean seeds[J]. Soybean Science,2007,26(4):506-510.
[2] 邹筱. 大豆脂肪和脂肪酸主要组分含量QTL定位[D]. 北京:中国农业科学院, 2014.
Zou X. Quantitative trait loci of oil and main fatty acid components in soybean[D]. Beijing:Chinese Academy of Agricultural Sciences,2014.
[3] 郑永战,盖钧镒,卢为国,李卫东, 周瑞宝, 田少君. 大豆脂肪及脂肪酸组分含量的QTL定位[J]. 作物学报,2006,32(12):1823-1830. doi:10.3321/j.issn:0496-3490.2006.12.008.
Zheng Y Z,Gai J Y,Lu W G,Li W D,Zhou R B,Tian S J. QTL mapping for fat and fatty acid composition contents in soybean[J]. Acta Agronomica Sinica,2006,32(12):1823-1830.
[4] Baud S,Lepiniec L. Physiological and developmental regulation of seed oil production[J]. Progress in Lipid Research,2010,49(3):235-249. doi:10.1016/j.plipres.2010.01.001.
[5] Lassner M W,Lardizabal K,Metz J G. A jojoba beta-Ketoacyl-CoA synthase cDNA complements the canola fatty acid elongation mutation in transgenic plants[J]. The Plant Cell,1996,8(2):281-292. doi:10.1105/tpc.8.2.281.
[6] Chapman K D,Ohlrogge J B. Compartmentation of triacylglycerol accumulation in plants[J]. Journal of Biological Chemistry,2012,287(4):2288-2294. doi:10.1074/jbc.R111.290072.
[7] Bates P D,Stymne S,Ohlrogge J. Biochemical pathways in seed oil synthesis[J]. Current Opinion in Plant Biology,2013,16(3):358-364. doi:10.1016/j.pbi.2013.02.015.
[8] Napier J A,Haslam R P,Beaudoin F, Cahoon E B. Understanding and manipulating plant lipid composition:Metabolic engineering leads the way[J]. Current Opinion in Plant Biology,2014,19(100):68-75. doi:10.1016/j.pbi.2014.04.001.
[9] Lung S C,Weselake R J. Diacylglycerol acyltransferase:A key mediator of plant triacylglycerol synthesis[J]. Lipids,2006,41(12):1073-1088. doi:10.1007/s11745-006-5057-y.
[10] 陶芬芳,邢蔓,岳宁燕, 邬贤梦. 植物三酰甘油合成相关基因研究进展[J]. 作物研究,2017,31(3):330-336. doi:10.16848/j.cnki.issn.1001-5280.2017.03.27.
Tao F F,Xing M,Yue N Y,Wu X M. Research advances of genes related to plant triacylglycerol synthesis[J]. Crop Research,2017,31(3):330-336.
[11] Xu J Y,Francis T,Mietkiewska E,Giblin E M,Barton D L,Zhang Y,Zhang M,Taylor D C. Cloning and characterization of an acyl-CoA-dependent diacylglycerol acyltransferase 1(DGAT1) gene from Tropaeolum majus,and a study of the functional motifs of the DGAT protein using site-directed mutagenesis to modify enzyme activity and oil content[J]. Plant Biotechnology Journal, 2008,6(8):799-818. doi:10.1111/j.1467-7652.2008.00358.x.
[12] 李欢, 赵翠珠, 李长圣, 刘明喆, 张文学, 李志西, 张猛. 甘蓝型油菜DGAT1重复基因的克隆与表达分析[J]. 西北农业学报, 2014,23(7):55-61. doi:10.7606/j.issn.1004-1389.2014.07.010.
Li H,Zhao C Z,Li C S,Liu M Z,Zhang W X,Li Z X,Zhang M. Molecular cloning and expression annlysis of Brassica napus DGAT1 duplicate genes[J]. Acta Agriculturae Boreali-Occidentalis Sinica,2014,23(7):55-61.
[13] Chen B B, Wang J J, Zhang G Y, Liu J Q, Manan S, Hu H H, Zhao J. Two types of soybean diacylglycerol acyltransferases are differentially involved in triacylglycerol biosynthesis and response to environmental stresses and hormones[J]. Scientific Reports,2016,6:28541. doi:10.1038/srep28541.
[14] Zheng P Z, Allen W B, Roesler K, Williams M E, Zhang S R, Li J M, Glassman K, Ranch J, Nubel D, Solawetz W, Bhattramakki D, Llaca V, Deschamps S, Zhong G Y, Tarczynski M C, Shen B. A phenylalanine in DGAT is a key determinant of oil content and composition in maize[J]. Nature Genetics,2008,40(3):367-372. doi:10.1038/ng.85.
[15] Bouvier-Navé P,Benveniste P,Oelkers P, Sturley S L,Schaller H. Expression in yeast and tobacco of plant cDNAs encoding acyl CoA:Diacylglycerol acyltransferase[J]. FEBS Journal,2010,267(1):85-96. doi:10.1046/j.1432-1327.2000.00961.x.
[16] Sanjaya,Miller R,Durrett T P,Kosma D K,Lydic T A,Muthan B,Koo A J K,Bukhman Y V,Reid G E,Howe G A,Ohlrogge J,Benning C. Altered lipid composition and enhanced nutritional value of Arabidopsis leaves following introduction of an algal diacylglycerol acyltransferase 2[J]. The Plant Cell,2013,25(2):677-693. doi:10.1105/tpc.112.104752.
[17] Liu Q,Siloto R M P,Lehner R,Stone S J,Weselake R J. Acyl-CoA:Diacylglycerol acyltransferase:molecular biology,biochemistry and biotechnology[J]. Progress in Lipid Research,2012,51(4):350-377. doi:10.1016/j.plipres.2012.06.001.
[18] Shockey J M,Gidda S K,Chapital D C,Kuan J C,Dhanoa P K,Bland J M,Rothstein S J,Mullen R T,Dyer J M. Tung tree DGAT1 and DGAT2 have nonredundant functions in triacylglycerol biosynthesis and are localized to different subdomains of the endoplasmic reticulum[J]. The Plant Cell,2006,18(9):2294-2313. doi:10.1105/tpc.106.043695.
[19] Banilas G,Karampelias M,Makariti I,Kourti A,Hatzopoulos P. The olive DGAT2 gene is developmentally regulated and shares overlapping but distinct expression patterns with DGAT1[J]. Journal of Experimental Botany,2011,62(2):521-532. doi:10.1093/jxb/erq286.
[20] Zou J T,Wei Y D,Jako C,Kumar A,Selvaraj G,Taylor D C. The Arabidopsis thaliana TAG1 mutant has a mutation in a diacylglycerol acyltransferase gene[J]. The Plant Journal,1999,19(6):645-653. doi:10.1046/j.1365-313x.1999.00555.x.
[21] Jako C,Kumar A,Wei Y D,Zou J T,Barton D L,Giblin E M,Covello P S,Taylor D C. Seed-specific over-expression of an Arabidopsis cDNA encoding adiacylglycerol acyltransferase enhances seed oil content and seed weight[J]. Plant Physiology,2001,126(2):861-874. doi:10.1104/pp.126.2.861.
[22] Zhang M,Fan J L,Taylor D C,Ohlrogge J B. DGAT1 and PDAT1 acyltransferases have overlapping functions in Arabidopsis triacylglycerol biosynthesis and are essential for normal pollen and seed development[J].The Plant Cell,2009,21(12):3885-3901. doi:10.1105/tpc.109.071795.
[23] 刘贵芹,邵群,黄荣峰,冯献忠. 大豆DGAT基因家族的鉴定和表达分析[J]. 中国农学通报,2013,29(12):55-61. doi:10.3969/j.issn.1000-6850.2013.12.011.
Liu G Q,Shao Q,Huang R F,Feng X Z. Characterization and expression analysis of DGAT gene family in soybean[J]. Chinese Agricultural Science Bulletin,2013,29(12):55-61.
[24] 赵江哲. 大豆磷脂酶基因GmPLD和脂合成酶基因GmDGAT,GmLPAT在调控拟南芥生长和种子油含量中的作用[D].南京: 南京农业大学,2013. doi: 10.7666/d.Y2528378.
Zhao J Z. Phospholipase GmPLD and lipid synthetase GmDGAT from soybean regulate growth and seed oil in transgenic Arabidopsis plants[D]. Nanjing:Nanjing Agricultural University,2013.
[25] Connors B J,Miller M,Maynard C A,Powell W A. Cloning and characterization of promoters from American chestnut capable of directing reporter gene expression in transgenic Arabidopsis plants[J]. Plant Science,2002,163(4):771-781. doi:10.1016/S0168-9452(02)00214-5.
[26] 文添龙,刘雪梅,冀亚萍,俞嘉宁. 高等植物胁迫诱导型启动子的研究进展[J]. 西北植物学报,2014,34(1):206-214. doi:10.7606/j.issn.1000-4025.2014.01.0206.
Wen T L,Liu X M,Ji Y P,Yu J N. Research progress of stress-induced promoter in higher plant[J]. Acta Botanica Boreali-Occidentalia Sinica,2014,34(1):206-214.
[27] 吕兆勇,赵春梅,薛仁镐. 葡萄逆境胁迫诱导启动子的克隆及表达分析[J].华北农学报, 2016, 31(1):77-82. doi: 10.7668/hbnxb.2016.01.013.
Lü Z Y,Zhao C M,Xue R G. Cloning and expression analysis of grape′s stress inducible promoter[J]. Acta Agriculturae Boreali-Sinica,2016, 31(1):77-82.
[28] 翟莹,张军,任巍巍,张闯,赵艳,张梅娟. 大豆低温诱导启动子GmERF9P的克隆及活性鉴定[J]. 华北农学报, 2017,32(5):13-18. doi:10.7668/hbnxb.2017.05.003.
Zhai Y,Zhang J,Ren W W,Zhang C,Zhao Y,Zhang M J.Cloning and activity analysis of cold induced GmERF9P promoter from soybean[J]. Acta Agriculturae Boreali-Sinica, 2017,32(5):13-18.
[29] Li R Z,Hatanaka T,Yu K S,Wu Y M,Fukushige H,Hildebrand D. Soybean oil biosynthesis:role of diacylglycerol acyltransferases[J]. Functional Integrative Genomics,2013,13(1):99-113. doi:10.1007/s10142-012-0306-z.
[30] Clough S J,Bent A F. Floral dip:a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana[J]. The Plant Journal,1998,16(6):735-743. doi:10.1046/j.1365-313x.1998.00343.x.
[31] Jefferson R A,Kavanagh T A,Bevan M W. GUS fusions:Beta-glucuronidase as a sensitive and versatile gene fusion marker in higher plants[J]. EMBO Journal,1987,6(13):3901-3907. doi:10.1002/j.1460-2075.1987.tb02730.x.
[32] 张江江,常丽,严江涛,赵立宁,李德芳.作物高油品种选育策略研究进展[J].河南农业科学,2019,48(6):1-7,13. doi:10.15933/j.cnki.1004-3268.2019.06.001.
Zhang J J,Chang L,Yan J T,Zhao L N,Li D F. Research progress of breeding strategy of high oil crop varieties[J]. Journal of Henan Agricultural Sciences,2019,48(6):1-7,13.
[33] 陈玉梅,李璐璐,陈锦玲,徐媛,李惠敏,秦新民.基于转录组测序的花生籽粒不同发育时期油脂合成相关基因差异表达分析[J].河南农业科学,2019,48(7):24-37. doi:10.15933/j.cnki.1004-3268.2019.07.005.
Chen Y M,Li L L,Chen J L,Xu Y,Li H M,Qin X M. Differential expression analysis of genes related to lipid synthesis through transcriptome sequencing during different developmental stages in peanut seed[J]. Journal of Henan Agricultural Sciences,2019,48(7):24-37.
[34] 王颖, 麦维军, 梁承邺,张明永. 高等植物启动子的研究进展[J]. 西北植物学报,2003,23(11):2040-2046. doi:10.3321/j.issn:1000-4025.2003.11.037.
Wang Y,Mai W J,Liang C Y,Zhang M Y. Advances on studies of plant promoters[J]. Acta Botanica Boreali-Occidentalia Sinica,2003,23(11):2040-2046.
[35] 伍静辉,谢楚萍,田长恩,周玉萍. 脱落酸调控种子休眠和萌发的分子机制[J]. 植物学报,2018,53(4):542-555. doi:10.11983/CBB18080.
Wu J H,Xie C P,Tian C E,Zhou Y P. Molecular mechanism of abscisic acid regulation during seed dormancy and germination[J]. Chinese Bulletin of Botany,2018,53(4):542-555.
[36] Nambara E,Naito S,McCourt P. A mutant of Arabidopsis which is defective in seed development and storage protein accumulation is a new abi3 allele[J]. The Plant Journal,1992,2(4):435-441. doi:10.1111/j.1365-313X.1992.00435.x.
[37] Finkelstein R R,Somerville C R. Three classes of abscisic acid (ABA)-insensitive mutations of Arabidopsis define genes that control overlapping subsets of ABA responses[J]. Plant Physiology,1990,94(3):1172-1179. doi:10.1104/pp.94.3.1172.
[38] 崔力勃, 朱乐, 蒋立希. ABA对于十字花科油籽脂肪酸组成及储藏蛋白的影响及机制[J]. 农业生物技术学报,2017,25(7):1059-1071. doi:10.3969/j.issn.1674-7968.2017.07.003.
Cui L B,Zhu L,Jiang L X. The effect of ABA on biosynthesis of fatty acids and storage proteins and the relevant mechanism in Cruciferae oilseed[J]. Journal of Agricultural Biotechnology,2017,25(7):1059-1071.
[39] Singh D P,Filardo F F,Storey R,Jermakow A M,Yamaguchi S,Swain S M. Overexpression of a gibberellin inactivation gene alters seed development,KNOX gene expression,and plant development in Arabidopsis[J]. Physiologia Plantarum,2010,138(1):74-90. doi:10.1111/j.1399-3054.2009.01289.x.
[40] Chen M X, Du X, Zhu Y, Wang Z, Hua S J, Li Z L, Guo W L, Zhang G P, Peng J R, Jiang L X. Seed fatty acid reducer acts downstream of gibberellin signalling pathway to lower seed fatty acid storage in Arabidopsis[J]. Plant Cell Environment,2012,35(12):2155-2169. doi:10.1111/j.1365-3040.2012.02546.x.
[41] 李志兰,华水金,蒋立希. 植物GDSL脂酶家族基因的研究进展[J]. 农业生物技术学报,2014,22(7):916-924. doi:10.3969/j.issn.1674-7968.2014.07.016.
Li Z L,Hua S J,Jiang L X. Advances in studying plant GDSL-type lipase genes[J]. Journal of Agricultural Biotechnology,2014,22(7):916-924.
[42] Rushton P J,Reinstädler A,Lipka V,Lippok B,Somssich I E. Synthetic plant promoters containing defined regulatory elements provide novel insights into pathogen-and wound-induced signaling[J]. The Plant Cell,2002,14(4):749-762. doi:10.1105/tpc.010412.
[43] Kroon J T M,Wei W X,Simon W J,Slabas A R. Identification and functional expression of a type 2 acyl-CoA:Diacylglycerol acyltransferase (DGAT2) in developing castor bean seeds which has high homology to the major triglyceride biosynthetic enzyme of fungi and animals[J]. Phytochemistry,2006,67(23):2541-2549. doi:10.1016/j.phytochem.2006.09.020.
[44] 曹仪植. 拟南芥[M]. 北京:高等教育出版社, 2004.
Cao Y Z. A. thaliana[M]. Beijing:Higher Education Press,2004.
