禽流感(Avian influenza,AI)是由禽流感病毒(Avian influenza virus,AIV)引起的一种以呼吸系统疾病为特征的传染病,1878年首次在意大利暴发流行,当时称之为“鸡瘟”,分为高致病性和低致病性禽流感[1-3]。H9N2亚型为低致病性禽流感,感染鸡群后尤其是产蛋鸡群,通常引起轻度呼吸道疾病,使蛋鸡产蛋率急剧下降或者与其他病原体共同感染进而出现高死亡率[4],不仅给养鸡业造成重大的经济损失,也给人类健康生活带来了极大隐患。哈兽研禽流感研究室在2016年对我国鸡场进行的禽流感病原学调查中发现,禽流感阳性鸡群中H9亚型阳性鸡群占总数的37.12%,这表明了H9N2亚型禽流感在我国广泛存在。
AIV属于正黏病毒科A型流感病毒属的单股负链RNA病毒,共编码10种蛋白,包括结构蛋白PB1、PB2、PA、HA、NA、NP、M1、M2及非结构蛋白NS1和NS2。其中HA蛋白是AIV粒子表面最主要囊膜糖蛋白,也是AIV最重要的保护性抗原,该蛋白产生的抗体不仅可以中和病毒,还可以刺激宿主产生细胞毒性淋巴细胞反应。
目前,预防H9N2亚型AIV主要以传统疫苗为主,即灭活苗和弱毒苗。灭活苗主要诱导机体产生体液免疫应答,不能抵抗异源毒株的感染,长期使用易导致不同亚型抗原间的重排和抗原变异,常出现免疫失败的现象。减毒活疫苗仍存在活病毒成分,有返毒风险,而且疫苗的保存、成本、运输条件较高。因此,随着生物技术的发展,研究者们陆续投入新型疫苗的研发以弥补传统疫苗的不足,如亚单位疫苗。HA是流感病毒亚单位疫苗研制的主要靶抗原,许多研究人员已在各种表达系统中表达HA蛋白,进行动物试验,并评估HA蛋白免疫效果。李春红等[5]、易华山等[6]分别在原核表达系统中表达HA蛋白,虽然能与抗体发生反应,但易以包涵体的形式存在,活性不高;何宏轩等[7]制备的DNA疫苗,可诱导鸡群产生免疫保护,但接种的DNA有可能与宿主的基因组整合;徐一鸣等[8]将H9的HA基因在酵母中成功表达,但酵母系统表达蛋白分泌效率低,不适合高密度培养;张民秀等[9]、Lin等[10]、石霖等[11]在杆状病毒(Baculovirus)-昆虫细胞中成功表达了HA蛋白,且具有良好的生物学活性;陈平等[12]将HA基因插入鸡痘病毒,制成的重组鸡痘病毒疫苗,能明显的抑制病毒排出;孙莹等[13]构建HA基因重组鸭肠炎病毒,免疫鸭能诱导产生AIV HI抗体效价,可阻止80%以上免疫鸭排毒;Liu等[14]重组火鸡疱疹病毒-HA,也可预防病毒攻击。
H9N2亚型禽流感亚单位疫苗的研究不计其数,但由于这些表达系统表达出的重组蛋白存在产量较低、生产和后期纯化成本较高以及存在重组蛋白的稳定性和安全性等问题,基本上都处在研究阶段,限制了这些表达系统在生产中的应用[15]。有研究表明,通过水稻胚乳细胞高效表达平台表达得到的狂犬病毒重组G蛋白、新城疫病毒重组HN蛋白和重组F蛋白具有成本较低、易于储存、免疫活性较高的特点[16-19]。鉴于此,为了在体外得到表达量高、易储存、易规模化、成本低且免疫活性高的禽流感H9N2亚型HA蛋白,选择水稻胚乳细胞高效表达平台表达HA蛋白,且通过杂交提高蛋白的表达量,旨在为新型、高效H9N2亚型禽流感亚单位疫苗的制备奠定基础。
1 材料和方法
1.1 试验材料
根据GenBank的HA基因序列,重组质粒pUC57-HA由南京金斯瑞公司合成。中间载体pMP3、植物表达载体pCAMBIA1300、根癌农杆菌(Agrobacterium tumefaciens)EHA105等均由武汉禾元生物技术有限公司提供。Fast Start Universal SYBR Green Master(Rox)购自瑞士Roche公司;10×Loading Buffer、DL10000 DNA Marker、Premix Taq、dNTPs等均购自TaKaRa公司;质粒提取试剂盒和DNA凝胶回收试剂盒均购自美国Axygen公司;NC膜、PVDF膜均购自美国Millipore公司;潮霉素B、卡那霉素(Kan)、特美汀等均购自美国Phyto Technology公司;所有限制性内切酶均购自NEB公司;乙酰丁香酮(AS)、植物激素6-苄氨基腺嘌呤(6-BA)、萘乙酸(NAA)、吲哚;3-乙酸(Indole-3-acetic acid,IAA)、6-糖基氨基嘌呤(KT)等均购自Biosharp公司。LB、农杆菌悬浮培养基、诱导培养基、共培养基、筛选培养基、分化培养基及生根培养基等均参照武汉禾元科技股份有限生物公司提供的方法配制。商品化杆状病毒-昆虫细胞表达的H9N2亚型禽流感HA蛋白和兔多抗血清等均购自北京义翘神州科技有限公司;辣根过氧化酶(Horseradish peroxidase,HRP)标记的羊抗兔二抗购自北京博奥森生物技术有限公司。
1.2 试验方法
1.2.1 HA基因序列优化及引物设计 从GenBank中获得HA氨基酸序列,根据水稻密码子偏爱性优化基因序列,由南京金斯瑞公司将HA基因序列合成到pUC57上,应用Primer 5.0软件设计1对特异性引物和2对qPCR引物和1对内参(RBE4)引物(表1)。引物由北京六合华大基因科技有限公司合成。
表1 合成的引物
Tab.1 Synthetic primer
1.2.2 中间载体和植物表达载体的构建 MlyⅠ和XhoⅠ双酶切重组质粒pUC57-HA,NaeⅠ和XhoⅠ双酶切中间载体pMP3;经胶回收、T4 DNA连接酶连接转化到大肠杆菌(Escherichia coli)DH5α,然后进行PCR和重组质粒酶切鉴定,最后送到公司测序鉴定HA基因序列;分别用限制性内切酶Hind Ⅲ和EcoRⅠ双酶切pMP3-HA和植物载体pCAMBIA1300,切胶回收、连接转化,并用PCR和双酶切鉴定将重组质粒送到公司进行测序鉴定。
1.2.3 HA基因的水稻遗传转化 通过电转化法,将重组质粒pCAMBIA1300-pMP3-HA转化到农杆菌EHA105中。农杆菌侵染培养8~9 d水稻愈伤组织30~40 min,其次将愈伤组织接种到共培养基上,25 ℃暗培养3 d 后用头孢水冲洗,置于无菌滤纸上晾干后转移至筛选培养基,26 ℃暗培养30~35 d,然后转移到分化培养基上培养约30 d,再转移至生根培养基中培养,待根系完全长出后,移栽至温室炼苗。
1.2.4 转基因水稻植株的PCR检测 采取炼苗期间水稻植株叶片,通过CTAB法提取水稻的总DNA。PCR反应体系(25 μL):Premix Taq 2.5 μL,HA-F(0.01 mol/L)1 μL,HA-R(0.01 mol/L)1 μL,水稻总DNA 1 μL,H2O 16.5 μL。反应条件:95 ℃预变性10 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min。最后用1%琼脂糖凝胶核酸电泳进行鉴定。
1.2.5 T1水稻种子HA蛋白的表达鉴定 将获得的转基因水稻种子进行切半粒研磨成粉,按1∶5加入HA蛋白提取液(20 mmol/L Tris-HCl,25 mmol/L NaCl,1 mmol/L EDTA,pH值8.5)。室温下搅拌1 h,然后12 000 r/min离心20 min,吸取上清液至新的离心管中,保存于4 ℃备用。分别用Dot Blot和Western Blot的方法检测HA蛋白的表达。Dot Blot检测:裁剪合适大小的NC膜,取提取好的蛋白点在NC膜上,每点1 μL,待其完全风干,经封闭、一抗孵育、二抗孵育及显色,鉴定HA蛋白的反应活性。Western Blot检测:取适量取提取好的蛋白,通过10% SDS-PAGE电泳,利用转印电泳将蛋白到合适大小的PVDF膜上,经封闭、一抗孵育、二抗孵育及显色,鉴定HA蛋白的反应活性。
1.2.6 纯合子植株的筛选 利用荧光定量PCR的方法[20-21],筛选转HA蛋白的纯合子株系。用水稻的内源基因水稻淀粉分支酶基因(Rice starch branching enzyme,RBE4)(单拷贝)作为内参,通过比较Ct(2-ΔΔCt)值进行筛选。纯合子的2-ΔΔCt值为杂合子的2倍,所以依据2-ΔΔCt值来判定纯合子植株。首先用qPCR筛选出引物,做出标准曲线和溶解曲线,然后用CTAB法提取T2水稻的新鲜叶片DNA,进行qPCR扩增。反应体系20 μL:DNA模板2 μL,2×SYBR Green mix 5 μL,QHA-F和QHA-R各0.5 μL。反应程序:95 ℃预变性10 min;95 ℃ 15 s,53 ℃ 20 s,35个循环;95 ℃ 15 s,53 ℃ 20 s。每个反应重复3次。
1.2.7 高表达杂交植株的筛选 利用温汤杀雄剪颖授粉法[22],将含有HA蛋白的TP309水稻与低谷蛋白杂交,经过T1和T2检测和种植,最终在T3获得纯合低谷蛋白水稻,通过观察杂交前后种子外观发生的变化、SDS-PAGE和Western Blot检测,判断杂交前种子和杂交后种子HA蛋白表达量。
1.2.8 HA蛋白活性检测 将提取的水稻源的HA蛋白和商品化的HA蛋白(杆状病毒-昆虫细胞表达)分别稀释6个组,即:0.062 5,0.125 0,0.250 0,0.500 0,1.000 0,2.000 0 mg/L。通过双抗夹心ELISA的方法对比检测2个蛋白的活性[23]。
2 结果与分析
2.1 重组质粒的鉴定与分析
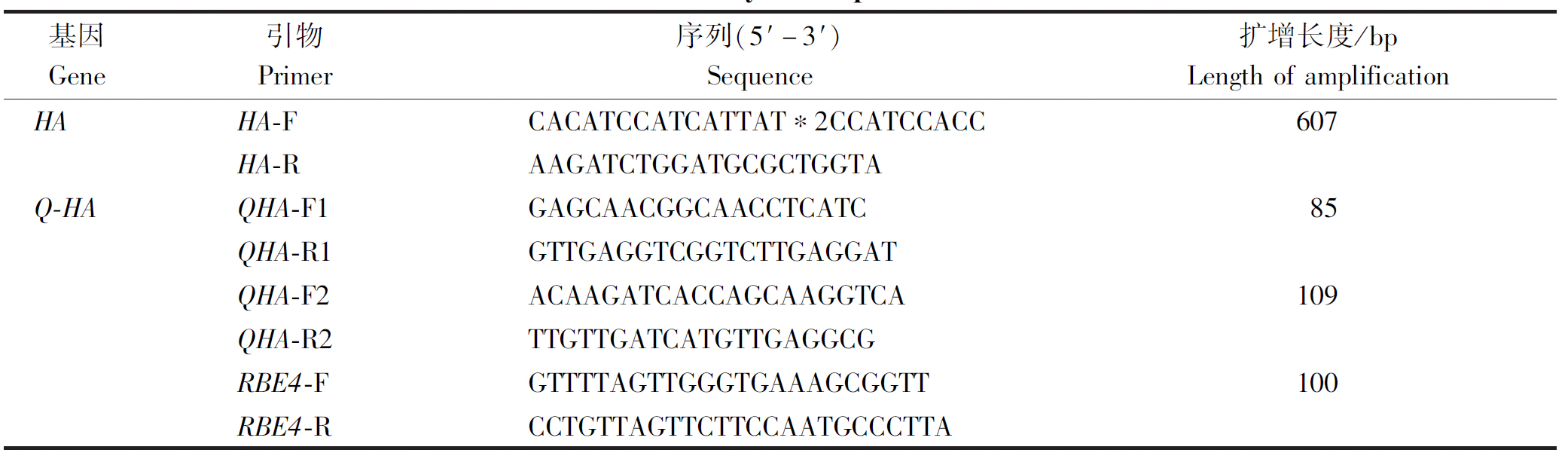
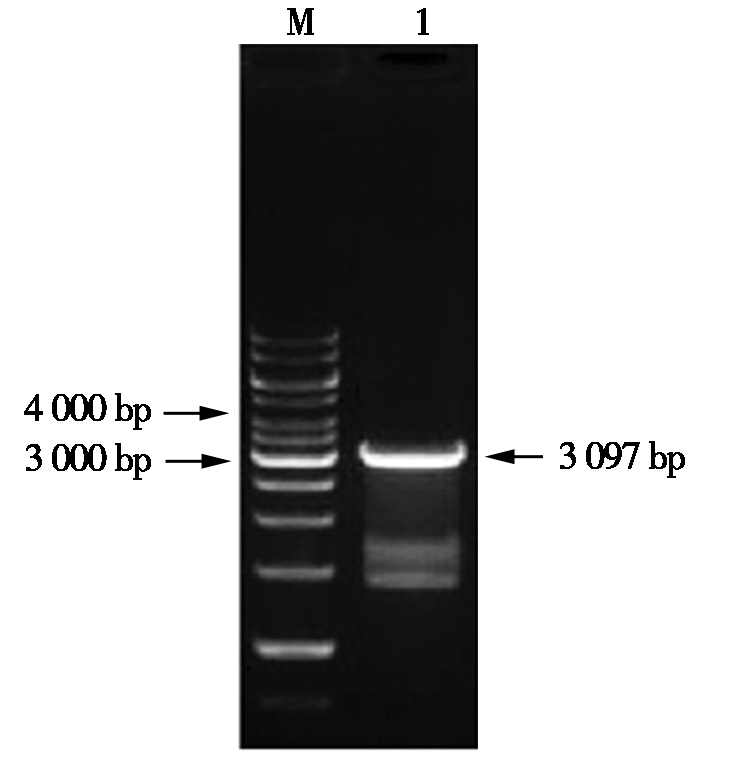
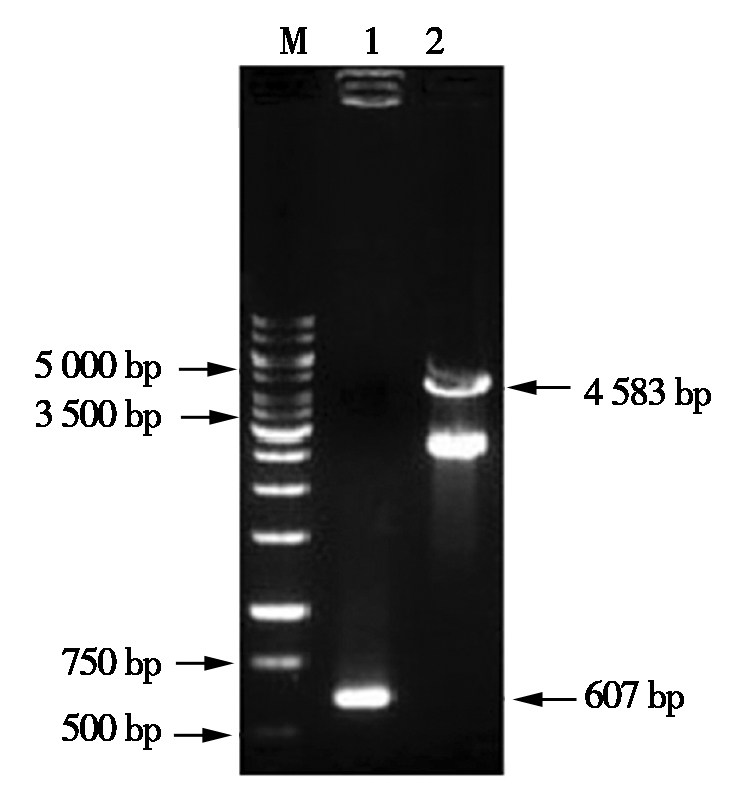
Mly Ⅰ和Xho Ⅰ双酶切pUC57-HA(图1)及Nae Ⅰ和XhoⅠ双酶切中间载体pMP3(图2),分别经胶回收、连接,转化到E.coli DH5α中,经PCR和双酶切鉴定pMP3-HA,并送到公司测序,结果正确。用Hind Ⅲ和EcoRⅠ分别酶切重组质粒pMP3-HA(图2)和植物载体pCAMBIA1300,分别经胶回收、连接,转化到E.coli DH5α菌中,经PCR和双酶切鉴定pCAMBIA1300-HA(图3),并送到公司测序,与预期结果相符。
M. DL10000 DNA Marker;
1.重组质粒pUC57-HA双酶切产物。
M. DL10000 DNA Marker;1.Recombinant plasmid pUC57-HA
double digestion product.
图1 重组质粒pUC57-HA的双酶切鉴定
Fig.1 Identification of recombinant plasmid pUC57-HA by double enzyme digestion
M. DL10000 DNA Marker;1.PCR扩增产物;
2.重组质粒pMP3-HA双酶切产物。
M. DL10000 DNA Marker;1.PCR amplification products;
2.Recombinant plasmid pMP3-HA double digestion product.
图2 重组质粒pMP3-HA的双酶切鉴定
Fig.2 Identification of recombinant plasmid
pMP3-HA by double enzyme digestion
M. DL10000 DNA Marker;1.PCR扩增产物;
2.重组质粒pCAMBIA1300-HA双酶切产物。
M. DL10000 DNA Marker;1.PCR amplification products;
2.Recombinant plasmid pCAMBIA1300-HA double digestion product.
图3 重组质粒pCAMBIA1300-HA的双酶切鉴定
Fig.3 Identification of recombinant plasmid pCAMBIA1300-HA by double enzyme digestion
2.2 HA阳性植株的筛选与分析
经农杆菌EHA105将重组质粒pCAMBIA1300导入到水稻愈伤组织中,经过暗培养、筛选、分化、生根移栽,提取叶片DNA,经PCR检测,共检测到66株为阳性植株(图4)。
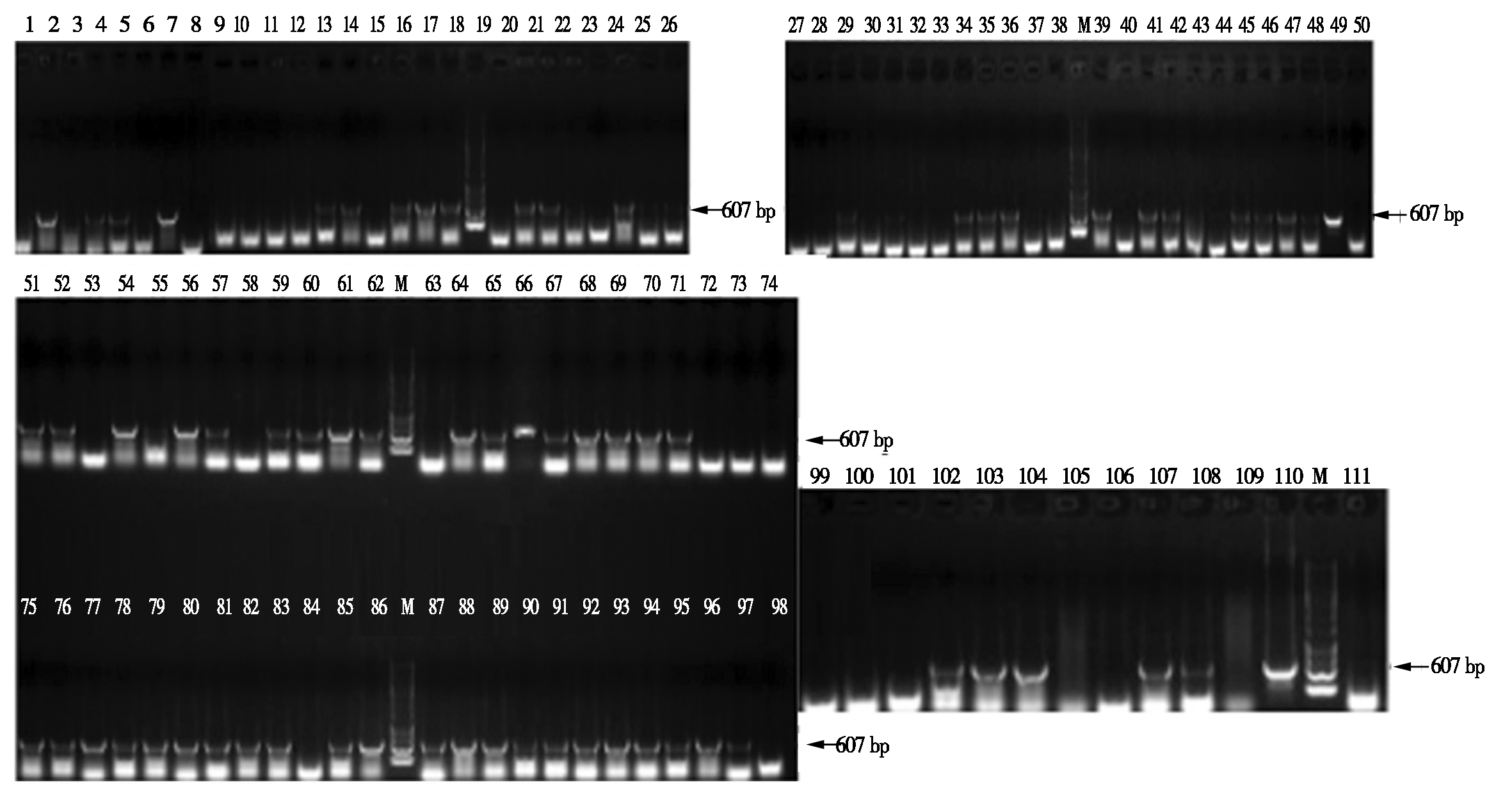
M. DL10000 DNA Marker;1-48,51-111.转基因植株的检测;49.阳性对照;50.阴性对照。
M. DL10000 DNA Marker;1-48,51-111.Detection of transgenic plants;49.Positive control;50.Negative control.
图4 HA转基因水稻总DNA的PCR检测
Fig.4 PCR detection of total DNA in HA transgenic rice
2.3 HA蛋白表达鉴定与分析
取检测为阳性的4株植株种子,研磨,加提取液,搅拌,离心,取上清,通过Dot Blot和Western Blot检测。结果显示,NC膜上出现特异性蛋白圆点(图5),PVDF膜上显示出一条大小约为130 ku的特异性蛋白质条带(图6)。说明HA蛋白已在水稻胚乳中表达,且具有良好的反应原性。
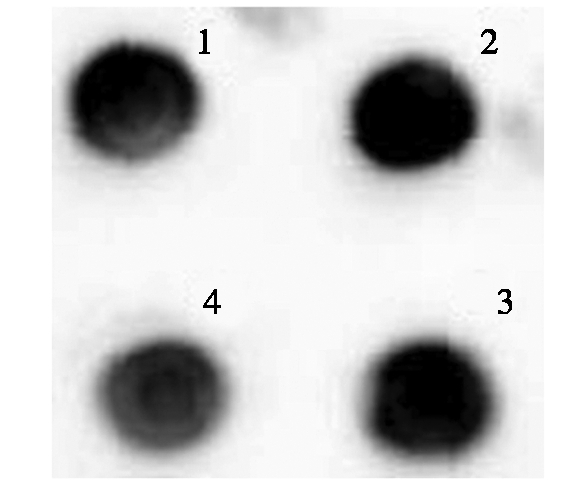
1-4.水稻源重组HA蛋白。图6同。
1-4.Rice-derived recombinant HA protein.The same as Fig.6.
图5 重组HA蛋白的Dot Blot鉴定
Fig.5 Dot Blot identification of recombinant HA protein
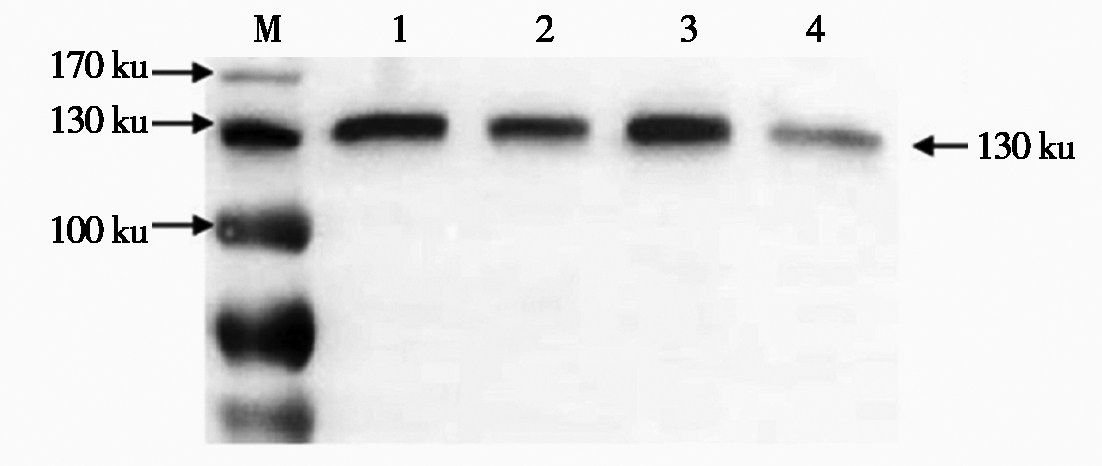
M.蛋白质Marker。
M.Protein Marker.
图6 重组HA蛋白的Western Blot鉴定
Fig.6 Western Blot identification of recombinant HA protein
2.4 T1HA纯合子植株的筛选与分析
设计2对qPCR引物,利用阳性质粒筛选2对引物的特异性,确定标准曲线(图7)和溶解曲线(图8),最终确定引物QHA-F2:5′-ACAAGATCACCAGCAAGGTCA-3′;QHA-R2:5′-TTGTTGATCATGTTGAGGCG-3′。应用RBE4作为内参,检测阳性植株HA基因的Ct值,每个样品重复3次,通过比较RBE4和HA基因的Ct值,根据公式2-ΔΔCt进行筛选纯合子。纯合子的2-ΔΔCt值约为杂合子的2倍,107株中筛选到31株纯合子植株,部分结果如表2所示。
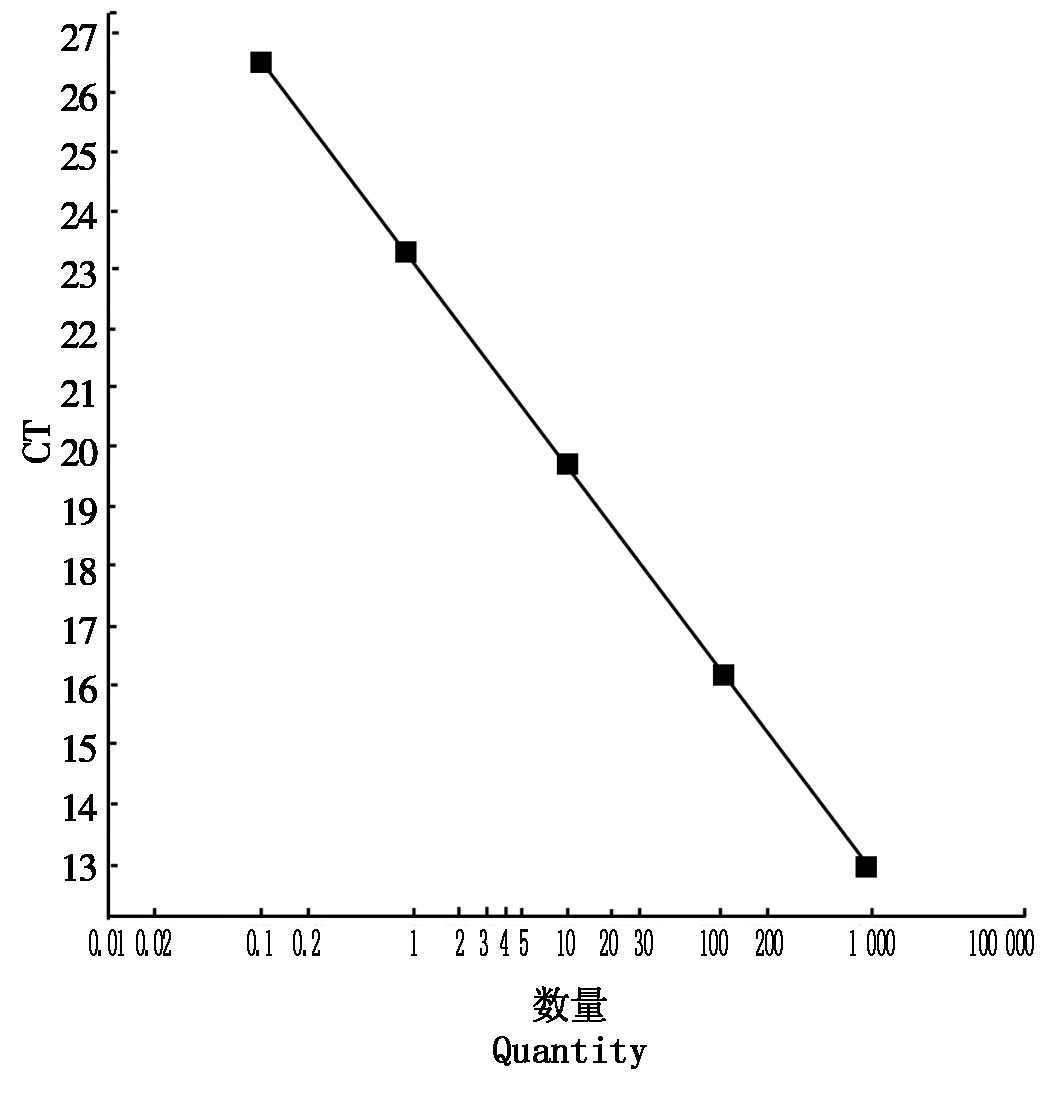
图7 QHA-F2/R2引物的标准曲线
Fig.7 Standard curve for QHA-F2/R2 primers
图8 QHA-F2/R2引物的熔解曲线
Fig.8 Melting curve of QHA-F2/R2 primer
表2 荧光定量PCR检测HA的T1植株的纯合子
Tab.2 Detection of homozygotes T1 generation of HA by fluorogenic quantitative PCR
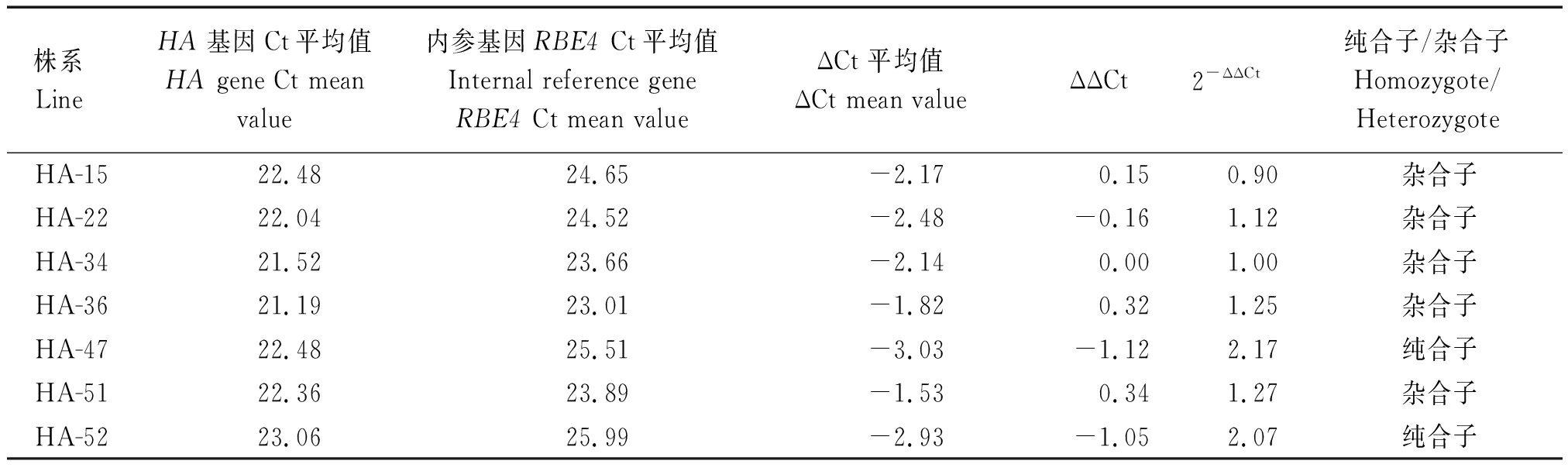
株系LineHA基因Ct平均值HA gene Ct meanvalue内参基因RBE4 Ct平均值Internal reference geneRBE4 Ct mean valueΔCt 平均值ΔCt mean valueΔΔCt2-ΔΔCt纯合子/杂合子Homozygote/HeterozygoteHA-1522.4824.65-2.170.150.90杂合子HA-2222.0424.52-2.48-0.161.12杂合子HA-3421.5223.66-2.140.001.00杂合子HA-3621.1923.01-1.820.321.25杂合子HA-4722.4825.51-3.03-1.122.17纯合子HA-5122.3623.89-1.530.341.27杂合子HA-5223.0625.99-2.93-1.052.07纯合子
2.5 高表达杂交植株的鉴定与分析
利用温汤杀雄剪颖授粉法,将含有HA蛋白的TP309水稻与低谷蛋白杂交,T1、T2经检测后种植,在T3筛选到含HA蛋白的纯合低谷蛋白水稻。通过Western Blot检测4株杂交后HA蛋白,结果在130 ku附近出现单一且很粗的条带(图9)。通过外观观察发现,杂交前种子多数呈土黄色;杂交后种子的颜色为白色,且颗粒饱满(图10)。通过Western Blot检测发现, HA蛋白表达量提高较多(图11)。
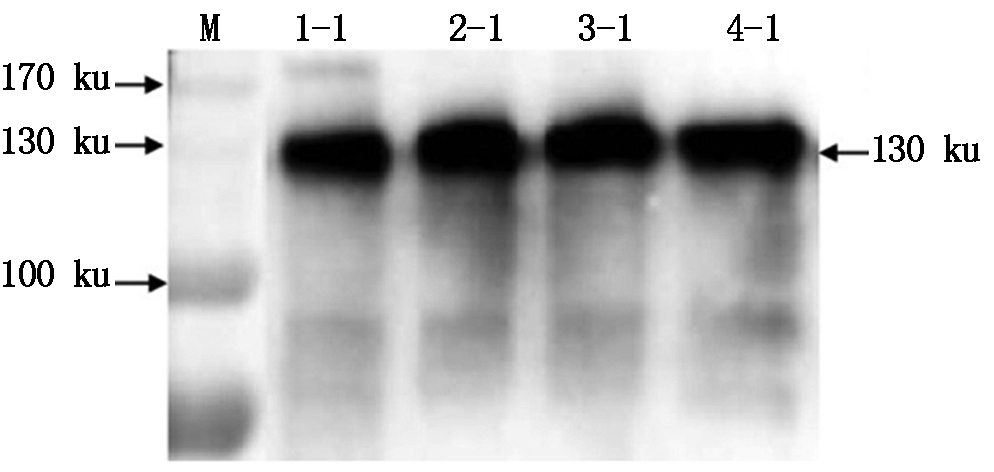
M.蛋白质Marker;1-1,2-1,3-1,4-1.杂交后的HA蛋白。
M.Protein Marker;1-1,2-1,3-1,4-1.Hybridized HA protein.
图9 Western Blot检测杂交后的HA蛋白
Fig.9 Western Blot detection of hybridized HA protein

图10 杂交前后种子外观变化
Fig.10 Seeds appearance changes before and after hybridization
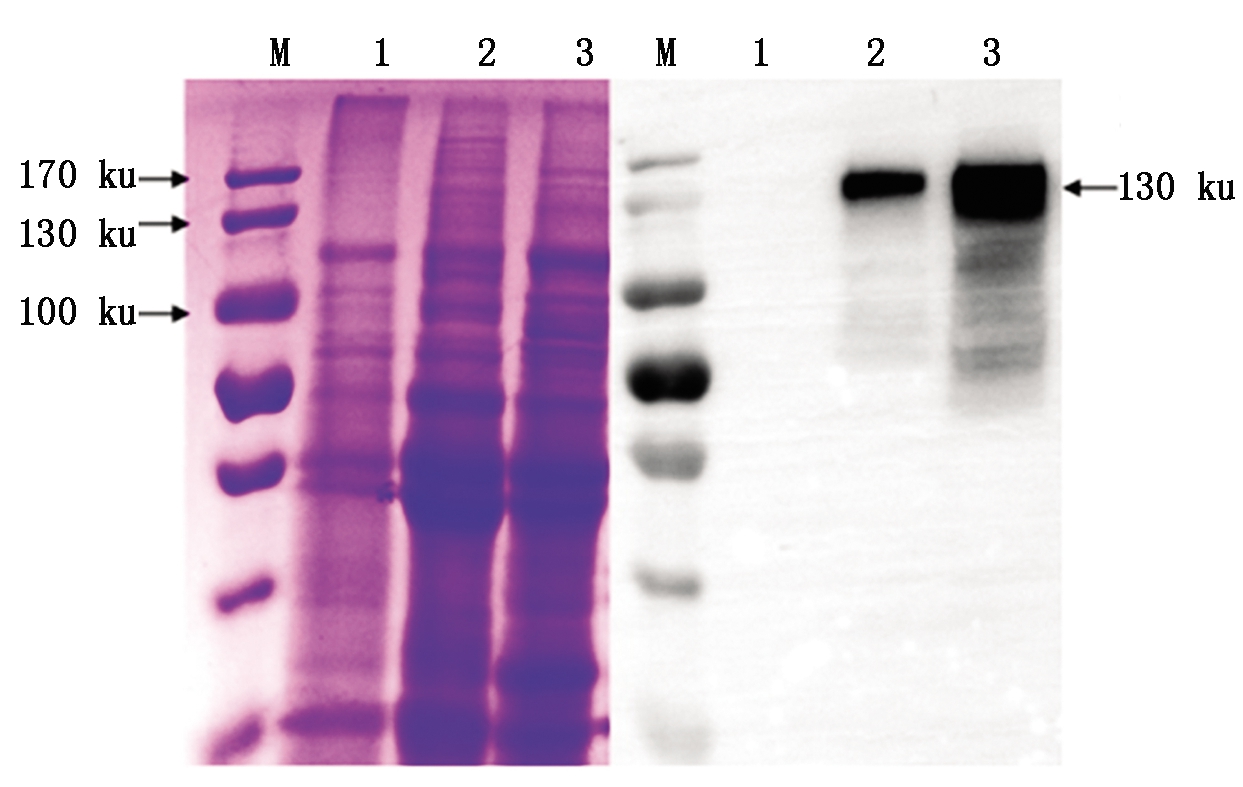
M.蛋白质Marker;1.阴性对照;
2.杂交前HA蛋白;3.杂交后HA蛋白。
M.Protein Marker;1.Negative control;2.HA protein
before hybridization;3.HA protein after hybridization.
图11 杂交前后HA蛋白的
SDS-PAGE和Western Blot结果
Fig.11 SDS-PAGE and Western Blot results of HA protein before and after hybridization
2.6 HA蛋白ELISA检测分析
将水稻源HA蛋白和商品化杆状病毒-昆虫细胞表达的HA蛋白分别稀释6组,即0.062 5,0.125 0,0.250 0,0.500 0,1.000 0,2.000 0 mg/L。通过双抗夹心ELISA法检测2个蛋白的活性。结果表明,水稻源重组HA蛋白活性高于昆虫源重组HA蛋白(图12)。
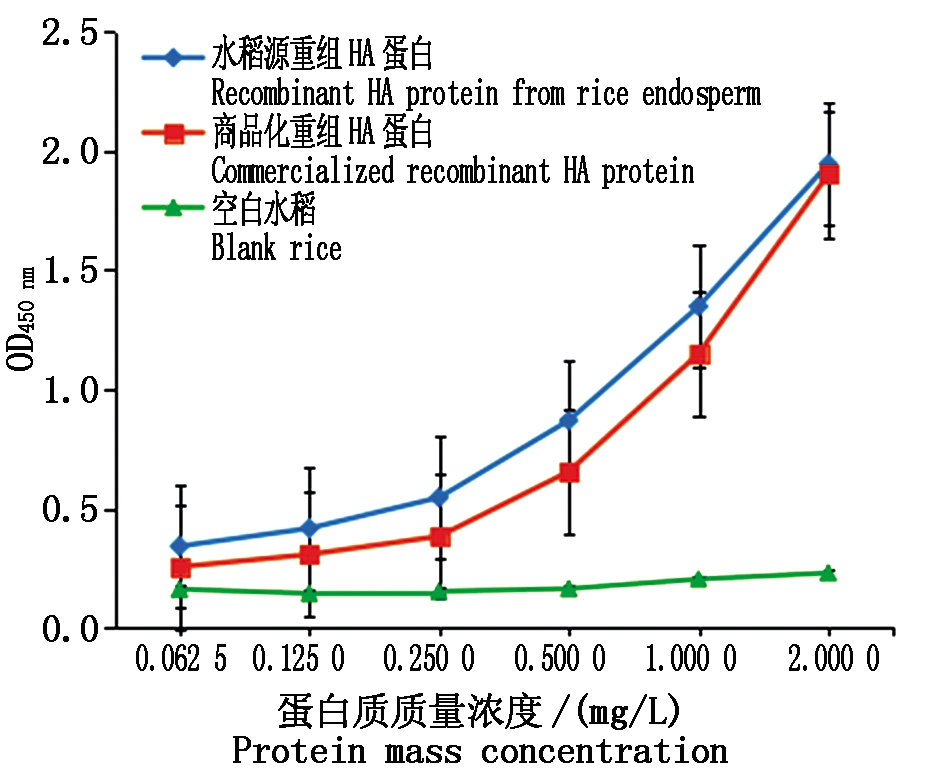
图12 ELISA方法检测水稻源和昆虫源HA蛋白活性
Fig.12 Detection activity of HA protein from rice and insect respectively by ELISA
3 结论与讨论
植物表达系统表达重组蛋白在生产成本、规模化和产品安全方面具有优势,与所有的生物反应器相比,植物是最廉价的“工厂”[24]。而水稻作为严格的自花授粉植物,很好地避免了田间污染的问题。水稻本身使用广泛、过敏性低,这一点不同于烟草,且已经被FDA公证过,对动物体没有任何的伤害;不携带任何的动物源性疾病,用水稻胚乳作为反应器更安全[25]。水稻作为单子叶真核植物,细胞内可以进行完整的蛋白修饰和加工,这也有利于对目的蛋白进行设计转入后的复制和扩增,可以很好地提高目的蛋白的表达量[26]。
HA蛋白是AIV疫苗研制的主要靶抗原,所以本研究选择HA基因作为靶基因,利用水稻胚乳表达系统表达H9N2亚型HA蛋白。将优化的HA基因成功构建到植物载体pCAMBIA1300上,使pCAMBIA1300-HA植物表达载体上不仅含有中间载体pMP3上利于外源基因在水稻中表达的GT13特有启动子、信号肽SP和终止子,还能够通过根癌农杆菌成功地将HA基因转入水稻的愈伤组织中。愈伤组织经过筛选、分化、生根和田间种植,经PCR结果显示,T0有66株水稻的HA基因已经整合到水稻基因组上。通过Dot Blot和Western Blot方法检测T0水稻种子,HA基因已在水稻胚乳中的成功表达。为了确保HA蛋白在水稻中能够稳定遗传,利用qPCR筛选了107株T1 成功表达HA的株系,获得了31株稳定遗传的HA蛋白水稻株系;为了提高HA蛋白在水稻胚乳中的表达量,采用温汤杀雄剪颖授粉法,将含有HA蛋白的TP309水稻与低谷蛋白水稻杂交,经过3代种植筛选后,用SDS-PAGE和Western Blot方法检测T3杂交种子,获得了HA表达量更高的杂交后水稻种子。利用夹心ELISA法比较水稻源和昆虫源HA蛋白的活性,结果表明,在水稻胚乳中表达的HA蛋白活性高于杆状病毒-昆虫细胞。
Qiu等[27]用致死小鼠的H9N2亚型AIV毒株表达的HA和NA基因的核酸疫苗免疫小鼠;Pushko等[28]将扩增的H9N2亚型AIV的HA、NA和M1基因,获得大量表达的HA﹑NA和M1蛋白,并自动组装成病毒样颗粒,该病毒样颗粒具有AIV的HA和NA活性,能有效阻止AIV在上呼吸道和肺部的复制,但是后续研究没有与实际应用直接相连,只是处于研究阶段。虽然本研究利用水稻胚乳表达系统得到的HA蛋白纯化的条件还需进一步摸索,以及动物试验还未开展,但已经在体外获得表达量高、储存容易、成本低、免疫活性高、安全性好、易规模化、生产工艺简单且绿色环保的禽流感H9N2亚型的HA蛋白。本研究为后续进行蛋白质纯化和动物试验提供了依据,也为后期新型H9N2亚型禽流感亚单位疫苗的研发提供了可能。
[1] 郭霄峰, 廖明, 辛朝安. H9N2亚型禽流感病毒的致病特性研究[J]. 华南农业大学学报,2001,22 (3) :70-72. doi:10.3969/j.issn.1001-411X.2001.03.021.
Guo X F,Liao M,Xin C A. Studies on the pathogenicity of H9N2 subtype influenza virus[J]. Journal of South China Agricultural University,2001,22(3):70-72.
[2] 顾敏, 彭大新, 刘秀梵. 我国H9N2亚型禽流感病毒的流行和进化特点[J]. 生命科学,2015,27(5):531-538.doi:10.13376/j.cbls/2015070.
Gu M,Peng D X,Liu X F. Features of the evolution and epidemiology of H9N2 subtype Avian influenza virus in China[J]. Chinese Bulletin of Life Sciences,2015,27(5):531-538.
[3] 孟芳, 徐怀英, 张伟, 黄迪海, 张再辉, 刘霞, 常维山, 秦卓明. 近20年中国部分地区鸡源H9N2亚型禽流感病毒HA基因遗传演化及其变异频率[J]. 微生物学报,2016,56(1):35-43.doi:10.13343/j.cnki.wsxb.20150217.
Meng F,Xu H Y,Zhang W,Huang D H,Zhang Z H,Liu X,Chang W S,Qin Z M. Genetic evolution and substitution frequency of Avian influenza virus HA gene in chicken H9N2 subtype in China in the last 20 years[J]. Acta Microbiologica Sinica,2016,56(1):35-43.
[4] Sun Y P,Liu J H. H9N2 influenza virus in China:A cause of concern[J]. Protein Cell,2015,6(1):18-25. doi:10.1007/s13238-014-0111-7.
[5] 李春红, 董玉龙. H9N2亚型禽流感病毒血凝素基因的克隆及原核表达[J].安徽农业科学,2009,37(18):8375-8376.doi:10.3969/j.issn.0517-6611.2009.18.030.
Li C H,Dong Y L. Clone and procaryotic expression of hemagglutinin gene of H9N2 Avian influenza virus[J]. Journal of Anhui Agricultural Sciences,2009,37(18):8375-8376.
[6] 易华山, 侯顺利, 独军政, 常惠芸, 丛国政, 胡永浩. H9N2亚型禽流感病毒HA基因的原核表达及其免疫反应性分析[J]. 中国人兽共患病学报,2007,23(12):1249-1251,1254.doi:10.3969/j.issn.1002-2694.2007.12.021.
Yi H S,Hou S L,Du J Z ,Chang H Y,Cong G Z,Hu Y H. Prokaryotic expression of Avian influenza virus HA gene (H9N2) and analysis of its immunoreactivity[J]. Chinese Journal of Zoonoses,2007,23(12):1249-1251,1254.
[7] 何宏轩, 秦曦明, 张强哲, 汤义, 刘丽艳, 郑昌学, 段明星. H9N2亚型禽流感病毒HA基因的克隆及其DNA疫苗的动物免疫试验[J]. 生物化学与生物物理进展,2004,31(2):163-166. doi:10.3321/j.issn:1000-3282.2004.02.012.
He H X,Qin X M,Zhang Q Z,Tang Y,Liu L Y,Zheng C X,Duan M X. Cloning of HA gene of H9N2 subtype Avian influenza virus and immune protection test of its DNA vaccine[J]. Progress in Biochemistry and Biophysics,2004,31(2):163-166.
[8] 徐一鸣, 金宁一, 夏志平, 马鸣潇, 鲁会军, 韩松, 金扩世, 梁国栋. 禽流感病毒H5HA、H7HA、H9HA亚型血凝素基因在毕赤酵母中的表达[J]. 生物工程学报,2006,22(2):231-236. doi:10.3321/j.issn:1000-3061.2006.02.011.
Xu Y M, Jin N Y, Xia Z P, Ma M X, Lu H J, Han S, Jin K S, Liang G D. Expression of AIV subtype H5HA, H7HA,H9HA hemagglutinin gene in Pichia pastoris[J]. Chinese Journal of Biotechnology,2006,22(2):231-236.
[9] 张民秀, 谢芝勋, 黄莉, 谢志勤, 刘加波, 谢丽基, 邓显文, 罗思思, 黄娇玲. H9N2亚型禽流感病毒HA基因在昆虫细胞中的表达[J]. 基因组学与应用生物学,2017,36(3):859-864.doi:10.13417/j.gab.036.000859.
Zhang M X,Xie Z X,Huang L,Xie Z Q,Liu J B,Xie L J,Deng X W,Luo S S,Huang J L. Expression of HA gene of H9N2 subtype Avian influenza virus in insect cells[J]. Genomics and Applied Biology,2017,36(3):859-864.
[10] Lin W Y, Fan H Y, Cheng X L, Ye Y, Chen X W, Ren T, Qi W B, Liao M. A baculovirus dual expression system-based vaccine confers complete protection against lethal challenge with H9N2 Avian influenza virus in mice[J]. Virology Journal,2011,8:273-281.
[11] 石霖, 熊永忠, 李晓楠, 赵晓彤, 顾贵波, 谷志大, 邓炜娜, 薛树山, 吴运谱, 王宏燕, 魏澍, 张雅为, 王竹, 曹东.重组杆状病毒表达H9亚型禽流感HA基因的研究[J]. 河南农业科学,2014,43(1):120-122. doi:10.15933/j.cnki.1004-3268.2014.01.003.
Shi L,Xiong Y Z,Li X N,Zhao X T,Gu G B,Gu Z D,Deng W N,Xue S S,Wu Y P,Wang H Y,Wei S,Zhang Y W,Wang Z,Cao D. Recombinant baculovirus expressing the HA gene of H9 subtype Avian influenza[J]. Journal of Henan Agricultural Sciences,2014,43(1):120-122.
[12] 陈平, 陈素娟, 彭大新, 刘秀梵. 高效表达H9亚型禽流感病毒HA基因的重组鸡痘病毒的构建及免疫效力试验[J].中国兽医学报,2004,24(3):216-218.doi:10.16303/j.cnki.1005-4545.2004.03.003.
Chen P,Chen S J,Peng D X,Liu X F. Recombinant fowlpox virus highly expressing HA from subtype H9N2 of Avian influenza virus and its protective efficacies against homologous challenge in chickens[J]. Chinese Journal of Veterinary Science,2004,24(3):216-218.
[13] 孙莹, 张兵, 李岭, 黄小洁, 侯力丹, 刘丹, 李启红, 李俊平, 王乐元, 李慧姣, 杨承槐. 表达H9亚型禽流感病毒HA基因重组鸭肠炎病毒的构建[J]. 中国农业科学,2019,52(23):4398-4405.doi:10. 3864/j.issn.0578-1752.2019.23.020.
Sun Y,Zhang B,Li L,Huang X J,Hou L D,Liu D,Li Q H,Li J P,Wang L Y,Li H J,Yang C H. Construction of a recombinant duck enteritis virus expressing hemagglutinin of H9N2 avian influenza virus[J]. Scientia Agricultura Sinica,2019,52(23):4398-4405.
[14] Liu L T, Wang T, Wang M Y, Tong Q, Sun Y P, Pu J, Sun H L, Liu J H. Recombinant turkey herpesvirus expressing H9 hemagglutinin providing protection against H9N2 avian influenza[J]. Virology,2019,529:7-15. doi:10.1016/j.virol.2019.01.004.
[15] Waheed M T,Ismail H,Gottschamel J,Mirza B,Lössl A G. Plastids:The green frontiers for vaccine production[J]. Front Plant Sci,2015,6:1005.doi:10.3389/fpls.2015.01005.
[16] He Y,Ning T T,Xie T T,Qiu Q C,Zhang L P,Sun Y F,Jiang D M,Fu K,Yin F,Zhang W J,Shen L,Wang H,Li J J,Lin Q S,Sun Y X,Li H Z,Zhu Y G,Yang D C. Large-scale production of functional human serum albumin from transgenic rice seeds[J]. Proc Natl Acad Sci USA,2011,108(47):19078-19083. doi:10.1073/pnas.1109736108.
[17] 许倩茹,张二芹,郭军庆,杨继飞,刘运超,王爱萍,王丽,万博,汪磊,蒋大伟,邓瑞广,张改平. 新城疫病毒F蛋白在水稻中的表达及检测[J]. 畜牧兽医学报,2017,48(6):1167-1172.doi:10.11843/j.issn.0366-6964.2017.06.022.
Xu Q R,Zhang E Q,Guo J Q,Yang J F,Liu Y C,Wang A P,Wang L,Wan B,Wang L,Jiang D W,Deng R G,Zhang G P. Expression and detection of NDV-F protein in rice endosperm[J]. Acta Veterinaria et Zootechnica Sinica,2017,48(6):1167-1172.
[18] 申雪静, 张二芹, 许倩茹,刘林科, 万博, 刘运超, 孙亚宁, 赵东, 牛香香, 邓瑞广, 张改平. 狂犬病病毒G蛋白在水稻中的表达及遗传稳定性鉴定[J]. 农业生物技术学报,2019,27(2):204-211. doi:10. 3969/j.issn.1674-7968.2019.02.002.
Shen X J,Zhang E Q,Xu Q R,Liu L K,Wan B,Liu Y C,Sun Y N,Zhao D,Niu X X,Deng R G,Zhang G P. Expression of rabies protein in rice and identification of its genetic stability[J]. Journal of Agricultural Biotechnology,2019,27(2):204-211.
[19] Ma F S,Zhang E Q,Li Q M,Xu Q R,Qu J Q,Yin H,Li K P,Wang L,Zhao X Y,Niu X X,Li X Y,Zhang S L,Wang Y N,Deng R G,Zhou E M,Zhang G P.A Plant-produced recombinant fusion protein-based newcastle disease subunit vaccine and rapid differential diagnosis platform[J]. Vaccines,2020,8(1):122. doi:10.3390/vaccines8010122.
[20] Wang X H,Jiang D M,Yang D C.Fast-tracking determination of homozygous tansgenic lines and transgene stacking using a reliable quantitative real-time PCR assay[J]. Appl Biochem Biotechnol,2015,175(2):996-1006. doi:10.1007/s12010-014-1322-3.
[21] Mieog J C,Howitt C A,Ral J P. Fast-tacking development of homozygous transgenic cereal lines using a simple and highly flexible real-time PCR assay[J]. BMC Plant Biol,2013,13(71):1-9.doi:10.1186/1471-2229-13-71.
[22] 陈启康, 陈博, 陆惠兰, 周慧, 梅治平. 海涂互花米草与水稻正反远缘杂交创新方法研究[J]. 农业科学与技术,2015,16(12):2604-2611.doi:10.16175/j.cnki.1009-4229.2015.12.005.
Chen Q K,Chen B,Lu H L,Zhou H,Mei Z P. An innovative strategy for reciprocal distant hybridization between spartina alterniflora and rice[J]. Agricultural Science &Technology,2015,16(12):2604-2611.
[23] Warzecha H,Mason H S. Benefits and risks of antibody and vaccine production in transgenic plants[J]. J Plant Physiol,2003,160(7):755-764. doi:10.1078/0176-1617-01125.
[24] 杨丽萍. 植物瞬时表达系统的研究进展[J]. 现代农业研究,2019(5):51-52.doi:10.3969/j.issn.1674-0653.2019.05.020.
Yang L P. Research progress of plant transient expression system[J]. Research of Modern Agriculture,2019(5):51-52.
[25] Yang L C,Li Y H,Yang X G,Piao J H. Study on the food safety of the marker gene expressed protein HPT[J]. Journal of Hygiene Research,2005,34(5):49-53. doi:10.1007/s11769-005-0030-x.
[26] Cox N J,Subbarao K. Global epidemiology of influenza:past and present[J].Annu Rev Med,2000,51:407-421.doi:10.1146/annurev.med.51.1.407.
[27] Qiu M Z,Fang F,Chen Y,Wang H L,Chen Q J,Chang H Y,Wang F Y,Wang H Z,Zhang R,Chen Z. Protection against avian influenza H9N2 virus challenge by immunization with hemagglutinin-or neuraminidase-expressing DNA in BALB/c mice[J]. Biochem Biophys Res Commun,2006,343(4):1124-1131. doi:10. 1016/j. bbrc. 2006. 03. 088.
[28] Pushko P,Tumpey T M,Bu F,Knell J,Robinson R,Smith G. Influenza virus-like particles comprised of the HA,NA,and M1 proteins of H9N2 influenza virus induce protective immune responses in BALB/c mice[J]. Vaccine,2005,23(50):5751-5759. doi:10.1016/j.vaccine.2005.07.098.
