人们对肉产品的质量要求随着生活水平的提高而越来越高,山羊肉因其低胆固醇,富含人体必需的各种氨基酸和脂肪酸等特点而深受消费者青睐[1]。肌肉pH值、肉色、系水力、肌肉嫩度等肉质性状直接受动物体内糖原的含量影响[2]。磷酸化酶激酶(Phosphorylase kinase,PHK)参与糖原分解,是催化分解的限速酶,其活性受到Ca2+的调节,Ca2+通过其内源性钙调蛋白亚基(δ)导致变构活化,而外源性钙调蛋白(δ′)依赖于Ca2+的结合进一步激活。磷酸化激活糖原磷酸化酶(Glycogen phosphorylase)将糖原降解,在肝脏中可以维持血糖,而在肌肉中维持肌肉收缩[3-4]。PHK是由α、β、γ、δ 4种亚基组成的全酶(αβγδ)4[5],其中α、β、δ为调控亚基,γ为催化亚基(包括γ1和γ2),γ1和γ2亚基分别由磷酸化酶激酶γ1(Phosphorylase kinase γ1,PHKG1)基因和磷酸化酶激酶γ2(Phosphorylase kinase γ2,PHKG2)基因编码[6-7]。
研究表明,PHKG1基因在糖原分解的级联激活中发挥调控作用[8],通过磷酸化激活糖原磷酸化酶,从而介导糖原分解的神经和激素调节。Winchester等[4]提出 PHKG1基因存在弱的多聚腺苷酸化和第 6 内含子切割位点,因此,将PHKG1的第6外显子鉴定为3′复合末端外显子。 Camus等[9]确定PHK为激酶抑制剂化合物的靶标,且发现PHKG1在人类肿瘤样品中上调,证实其参与血管生成和作为抗肿瘤治疗的潜在靶点的价值。Ma等[8]对猪PHKG1进行深度测序,发现其第9内含子剪接受体位点发生一个点突变(C> A),异常转录物导致动物体内蛋白质水平下降和酶活性减弱,且使猪肉持水量减少> 20%。Zappaterra等[10]表示PHKG1剪接突变(g.8283C>A)对大白猪的猪肉持水力呈累加效应且对肉色呈显性影响。Liu等[11]证明杜洛克×陆川杂交猪的PSE肉是由PHKG1的剪接突变引起的,该研究结果进一步支持了PHKG1致病突变对肉质的影响。Xue等[12]发现PHKG1在鸡生长发育3个阶段存在差异表达,可作为鸡生长差异的潜在候选基因。以上研究说明PHKG1参与机体内许多生物学过程,对动物肉质具有重要影响,但尚未见羊方面的报道。
因此,本研究以简州大耳羊为研究对象,拟通过克隆获得山羊PHKG1基因的序列并进行生物信息学分析,利用实时荧光定量PCR技术(Quantitative Real-time PCR,qPCR)检测该基因在不同组织及不同分化阶段脂肪细胞中的表达变化,为进一步研究该基因在脂肪沉积中发挥的生物学功能奠定基础。
1 材料和方法
1.1 试验材料
1.1.1 试验动物与样品采集 以成年(1周岁)健康简州大耳羊为试验动物(n=8,购自四川省简阳市大哥大牧业有限公司)。屠宰后收集羊的心、肝、脾、肾、肺、皮下脂肪、背最长肌等组织样品,使用DEPC水清洗样品后迅速装入RNase free冻存管中,置于液氮中保存。
1.1.2 试验试剂 TRIzol、SYBR® Premix Ex TaqTM(2×)试剂盒、pMD-19T Vector购自TaKaRa公司,DNA回收试剂盒、DNA聚合酶、大肠杆菌DH5α感受态细胞购自天根生化科技有限公司,反转录试剂盒购自Thermo公司。
1.2 试验方法
1.2.1 山羊PHKG1基因克隆 根据GenBank上山羊PHKG1基因预测序列(XM_018040602.1),使用Primer Premier 5.0软件设计PCR引物(表1)。
表1 PCR和荧光定量PCR(qPCR)引物信息
Tab.1 Primers information for PCR and quantitative real-time PCR(qPCR)
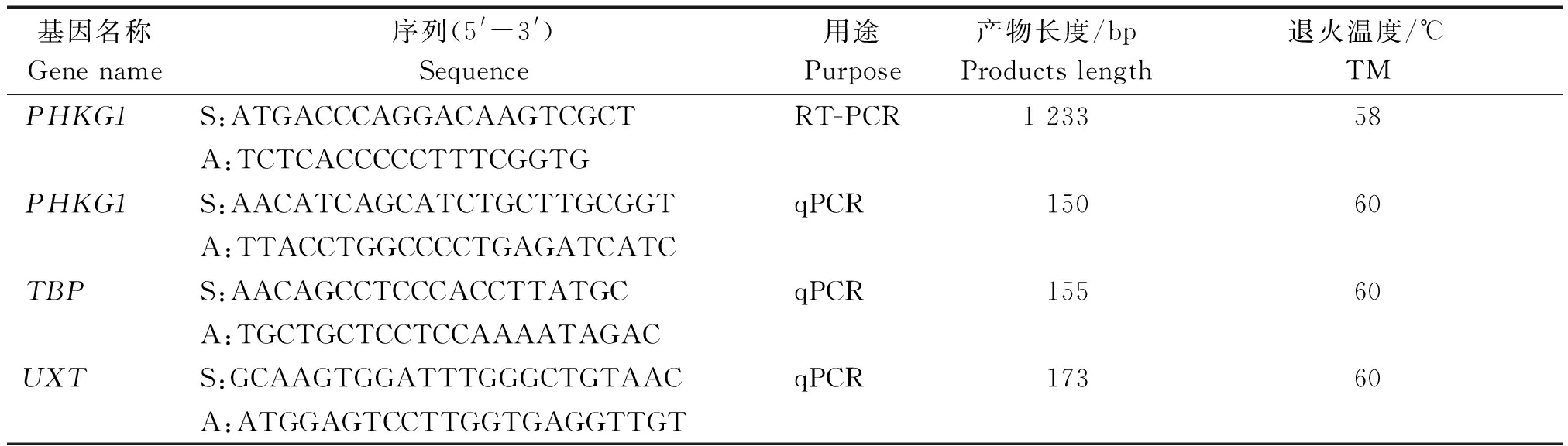
基因名称Gene name序列(5'-3')Sequence用途Purpose产物长度/bpProducts length退火温度/℃TMPHKG1S:ATGACCCAGGACAAGTCGCTRT-PCR1 23358A:TCTCACCCCCTTTCGGTGPHKG1S:AACATCAGCATCTGCTTGCGGTqPCR 15060A:TTACCTGGCCCCTGAGATCATCTBPS:AACAGCCTCCCACCTTATGCqPCR 15560A:TGCTGCTCCTCCAAAATAGACUXTS:GCAAGTGGATTTGGGCTGTAACqPCR 17360A:ATGGAGTCCTTGGTGAGGTTGT
注:S.正义链引物;A.反义链引物。
Note:S. Sense primer;A. Antisense primer.
PCR反应体系为:Taq酶12.5 μL,背最长肌cDNA 1 μL,10 μmol/L的上、下游引物各1 μL,ddH2O 9.5 μL,反应总体系为25 μL。PCR扩增程序:预变性(94 ℃,4 min);变性(94 ℃,30 s),退火(58 ℃,45 s),延伸(72 ℃,2 min),38个循环;延伸(72 ℃,10 min),4 ℃保温。用2%琼脂糖凝胶电泳检测PCR产物,使用DNA回收试剂盒对目的片段进行回收和纯化,将纯化产物连接至pMD-19T载体,转化至热激后的DH5α感受态细胞,随后接种到含有 Amp 的LB固体培养基上,37 ℃过夜培养,对阳性菌落进行菌落PCR鉴定后送至成都擎科生物技术有限公司测序。
1.2.2 山羊PHKG1基因生物学特性 山羊PHKG1基因生物学特性分析及方法参见表2。
表2 分析内容及相应分析工具
Tab.2 Analytical contents and the corresponding analysis tools

分析内容Analytical contents运用软件或在线工具Applied software or online tools开放阅读框预测、氨基酸序列翻译 Open reading frame prediction and amino acid sequence translationORF Finder蛋白质理化性质分析 Analysis of physicochemical properties of proteinExPASy ProtParam蛋白质二级结构预测 Prediction of protein secondary structureExPASy蛋白质三级结构预测 Prediction of protein tertiary structureSWISS-MODEL信号肽分析 Signal peptide analysisSignalP 4.1 Server蛋白质磷酸化、糖基化位点预测 Prediction of protein phosphorylation and glycosylation sitesNet Phos 3.1 、NetOGlyc 1.0、 NetNGly 3.1跨膜结构域预测 Prediction of transmembrane domainTMHMM亚细胞定位 Subcellular localizationPSORTII蛋白相互作用分析 Protein interaction analysisSTRING交互式数据库同源性比对分析 Homology comparison analysisBlast系统进化树构建 Construction of phylogenetic treeMEGA 5.0
1.2.3 山羊PHKG1基因组织表达差异分析 根据克隆获得的PHKG1基因设计qPCR引物(表1)。利用qPCR技术检测PHKG1在各个组织中表达的差异,TBP为内参基因以矫正基因的相对表达水平。qPCR反应体系:10 μmol/L上、下游引物各1 μL ,SYBR®Premix Ex TaqTM (2×)10 μL, cDNA 1 μL,ddH2O 7 μL,总体系为20 μL,每个组织样本设置3个重复。反应条件:预变性(95 ℃ 3 min);变性(95 ℃ 10 s),退火(60 ℃ 10 s),延伸(72 ℃ 15 s),共38个循环。
1.2.4 PHKG1基因在山羊不同部位前体脂肪细胞分化过程中的表达差异分析 复苏青藏高原动物遗传资源保护与利用教育部,四川省重点实验室前期保存的山羊肌内和皮下前体脂肪细胞,待长至F3 80%时进行诱导分化,分别收集不同阶段(0,12,24,36,48,60,96 h)的细胞提取RNA并反转录成cDNA,以UXT基因为内参基因,利用qPCR检测PHKG1基因在各个阶段的表达水平。反应体系和程序与1.2.3相同。
2 结果与分析
2.1 山羊PHKG1基因的克隆
以简州大耳羊背最长肌cDNA为模板,经PCR扩增获得与预期目的产物大小相符的片段(图1),测序得到PHKG1基因片段长度1 233 bp,其中CDS区1 164 bp,无5′UTR序列,3′UTR 69 bp,共编码387个氨基酸。
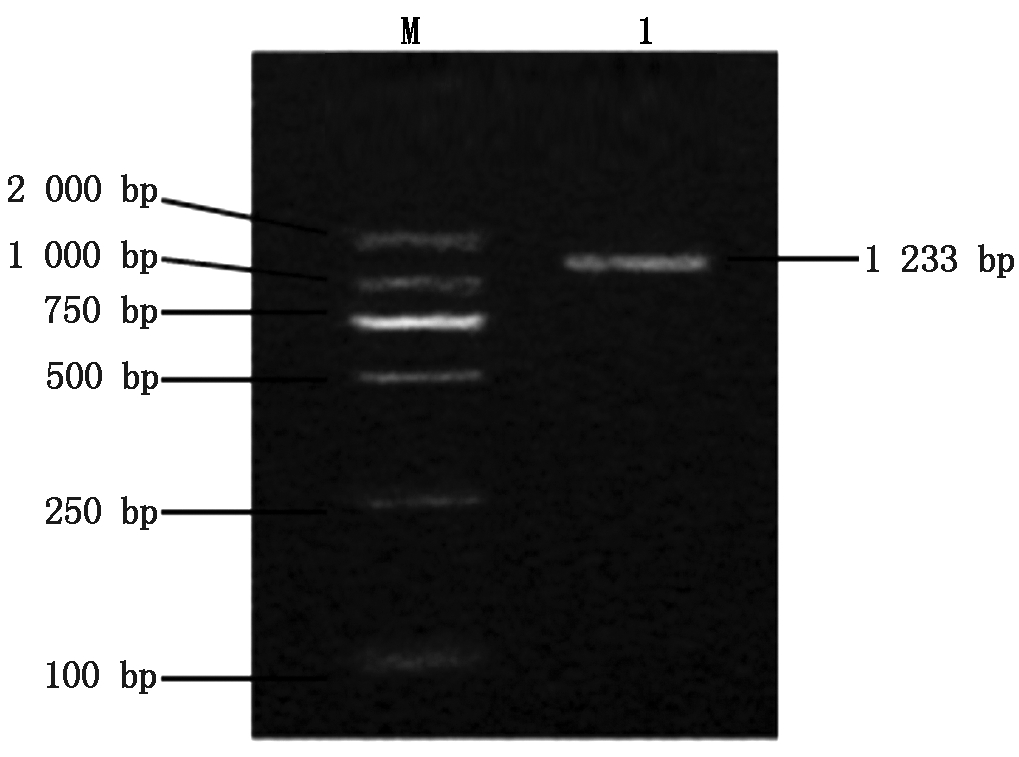
M.DL2000 DNA Marker;1.PHKG1目的条带。
M.DL2000 DNA Marker;1.PHKG1 target strip.
图1 山羊PHKG1基因扩增结果
Fig.1 Amplification of PHKG1 gene in goat
2.2 山羊PHKG1基因序列分析
2.2.1 氨基酸序列同源性 利用DNAMAN对不同物种PHKG1基因所编码的氨基酸序列进行比对,显示简州大耳羊与绵羊(XP_027817635.1)、牛(NP_001039951.1)、猪(NP_001280073.1)、马(XP_001493403.2)、人(AAH69655.1)的PHKG1氨基酸序列相似性依次为99%,98%,94%,96%和93%,说明该基因在不同的物种间具有较高的保守性(图2)。
2.2.2 蛋白理化性质分析 用ExPASy在线工具对山羊PHKG1氨基酸序列进行分析,其预测蛋白分子式为C2016H3156N544O580S18,分子质量为44.87 ku;在氨基酸组成中,亮氨酸(Leu)含量为9.6%,是占比最高的氨基酸残基;带正电荷(Arg+Lys)和带负电荷(Asp+Lys)的氨基酸残基总数分别为50和51,表明山羊PHKG1蛋白可能带负电荷;理论等电点(Protein isoelectric point,pI)为6.81,亲水性总平均值为-0.330,不稳定指数为45.83,因此,预测PHKG1蛋白属于酸性亲水不稳定蛋白。磷酸化位点预测显示,山羊PHKG1蛋白有31个磷酸化位点,其中包括丝氨酸(Ser)磷酸化位点18个,苏氨酸(Thr)磷酸化位点10个,酪氨酸(Tyr)磷酸化位点3个。糖基化位点预测显示,该蛋白有4个O糖基化位点,分别位于2,6,12和329位点;无N糖基化位点。山羊PHKG1蛋白没有跨膜结构域且无信号肽;亚细胞定位表明其主要存在于细胞质(73.9%)中,其次为细胞核(13.0%)和线粒体(13.0%)。

黑色.同源性=100%;粉色.同源性>75%;蓝色.同源性>50%;白色.同源性<50%。
Black.Homology=100%;Pink.Homology>75%;Blue.Homology>50%;White.Homology<50%.
图2 山羊和其他物种间PHKG1氨基酸序列比对
Fig.2 Alignment of amino acid sequence of PHKG1 between goat and other species
2.2.3 蛋白质二级结构及蛋白相互作用预测 用ExPASy预测蛋白二级结构,显示PHKG1蛋白有138个(35.66%)氨基酸可能形成α-螺旋(Alpha helix),167个(43.15%)氨基酸可能形成无规则卷曲(Random coil),82个(21.19%)氨基酸可能形成延伸链(Extended strand)(图3-A)。蛋白质三级结构的预测结果与二级结构预测结果基本一致(图3-B)。相互作用分析显示,PHKG1蛋白可能与CALM1、PHKA1、PYGM、PHKB、PHKG2、PHKA2和PYGL等蛋白存在相互作用(图3-C)。
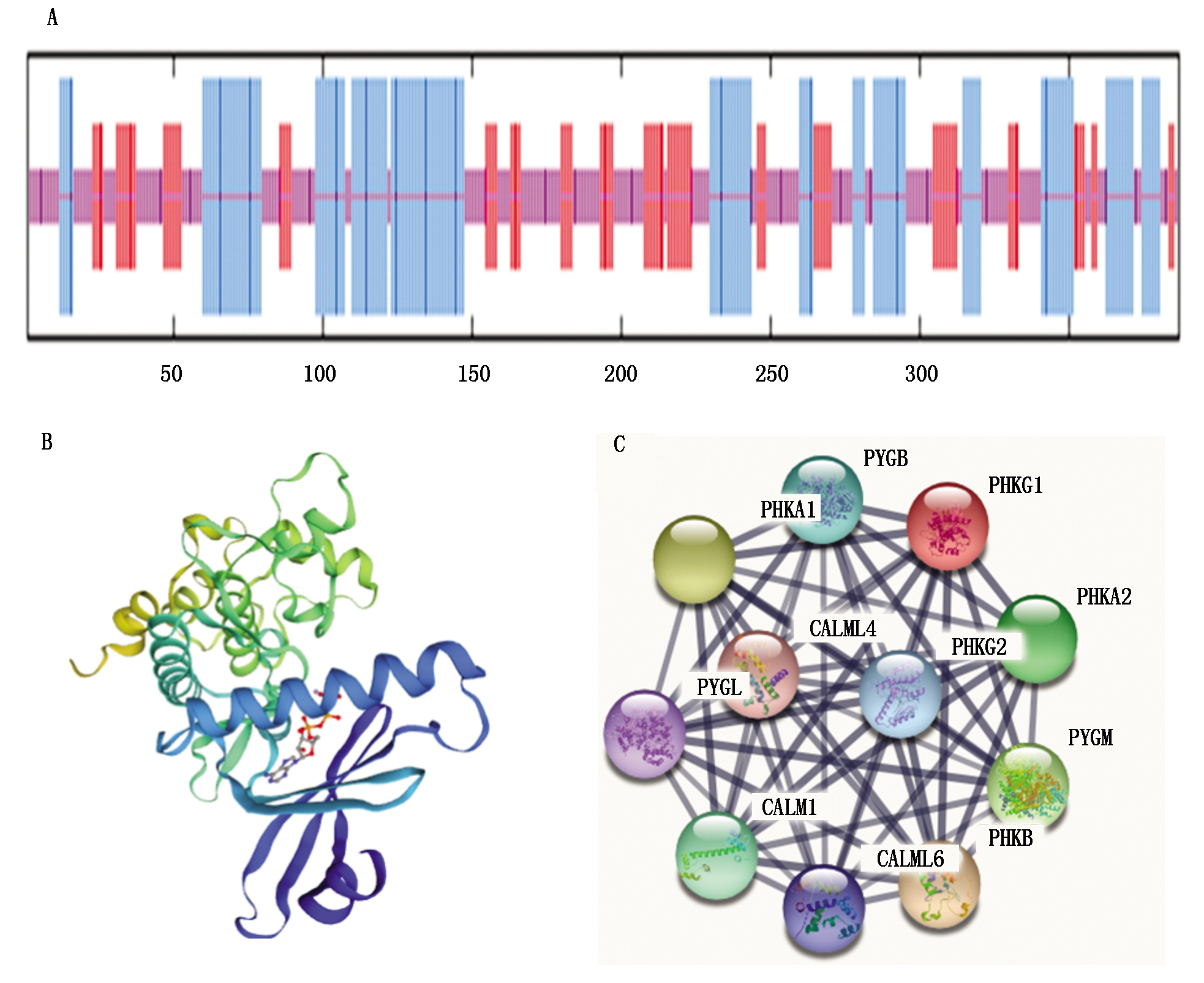
A.PHKG1蛋白质二级结构预测,其中蓝色竖线表示α螺旋,红色竖线表示延伸链,紫色竖线表示无规卷曲;
B.PHKG1蛋白质三级结构预测;C.PHKG1蛋白质互作网络。
A.The second-order structure prediction of PHKG1 protein, α-hehix indicated with the blue, extended strand indicated with the red,
random coil indicated with the purple;B.PHKG1 protein tertiary structure prediction;C.PHKG1 protein interaction network.
图3 山羊PHKG1蛋白质结构及相互作用预测
Fig.3 Prediction of protein structure and interaction of goat PHKG1
2.3 山羊PHKG1的系统进化树分析
为了研究山羊PHKG1蛋白的进化过程,用MEGA 5.0构建进化树。结果(图4)显示,山羊与绵羊首先聚为一类,亲缘关系最近,因与牛同属反刍动物聚类在同一分支,与原鸡的亲缘关系最远,符合物种的进化规律。
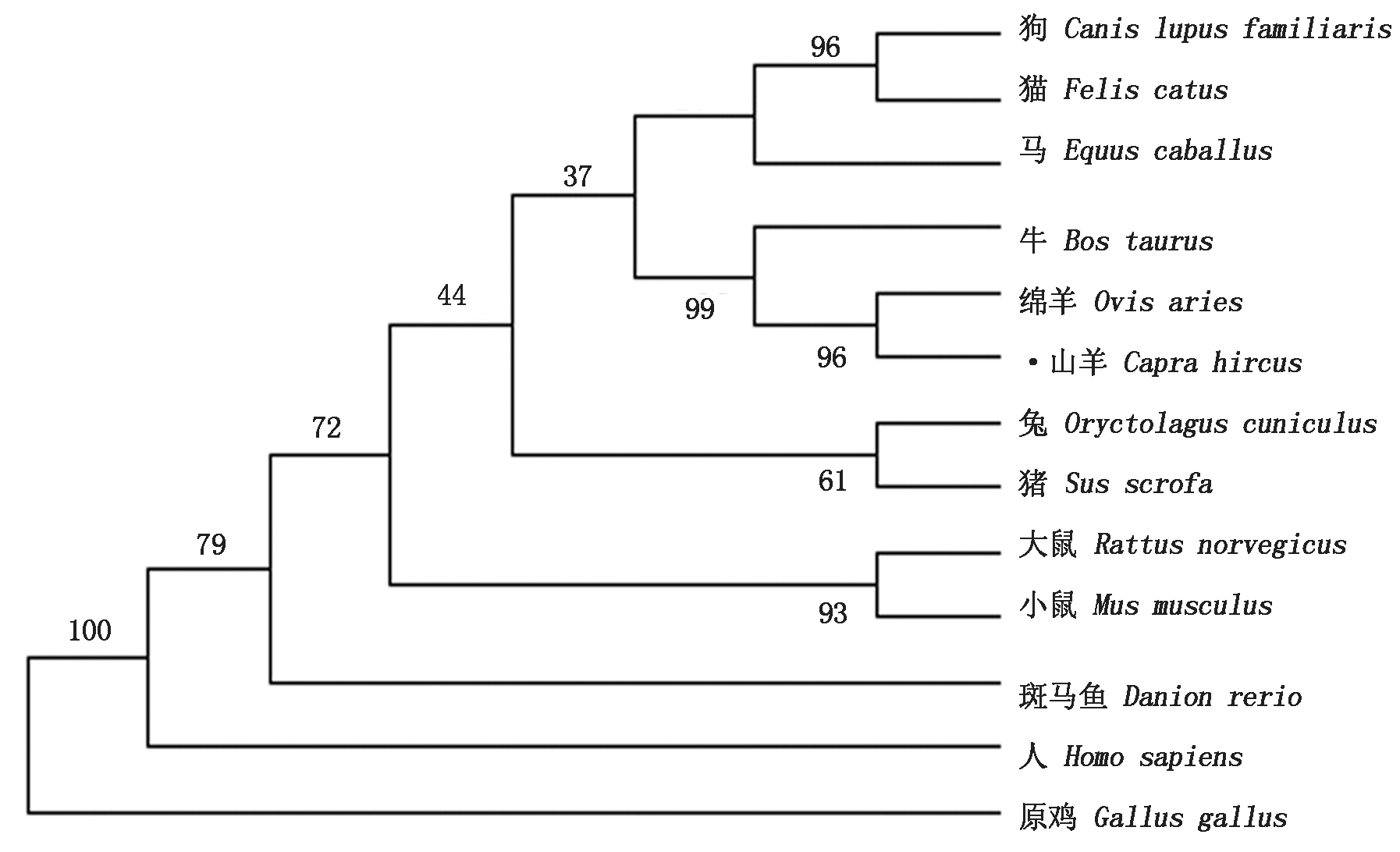
GenBank登录号:小鼠.NP_035209.1;大鼠.NP_113761.1;兔.NP_001095175.1;猪.NP_001280073.1;狗.XP_0222275227.1;猫.XP_023102031.1;牛.NP_001039951.1;山羊.XP_017896091.1;斑马鱼.NP_001018868.1;绵羊.XP_027817635.1;马. XP 001493403.2;人.AAH69655.1;原鸡.XP_015151218.1。
GenBank accession number:Mus musculus.NP_035209.1;Rattus norvegicus.NP_113761.1;Oryctolagus cuniculus.NP_001095175.1;Sus scrofa.NP_001280073.1;Canis lupus familiaris.XP_0222275227.1;Felis catus. XP_023102031.1;Bos taurus.NP_001039951.1;Capra hircus.XP_017896091.1;Danio rerio.NP_001018868.1;Ovis aries.XP_027817635.1;Equus caballus.XP 001493403.2;Homo sapiens.AAH69655;Gallus gallus. XP_015151218.1.
图4 PHKG1蛋白系统进化树
Fig.4 Phylogenetic tree of PHKG1 protein sequence
2.4 山羊PHKG1基因组织表达分析
利用qPCR方法检测PHKG1基因在山羊各个组织中的表达水平,结果表明,PHKG1基因在所检测的7个组织中均有表达,以背最长肌中的表达最高,极显著高于其他的组织(P<0.01),在皮下脂肪、肾、心、肝、肺和脾组织表达量相对较低,组织间差异不显著(图5)。
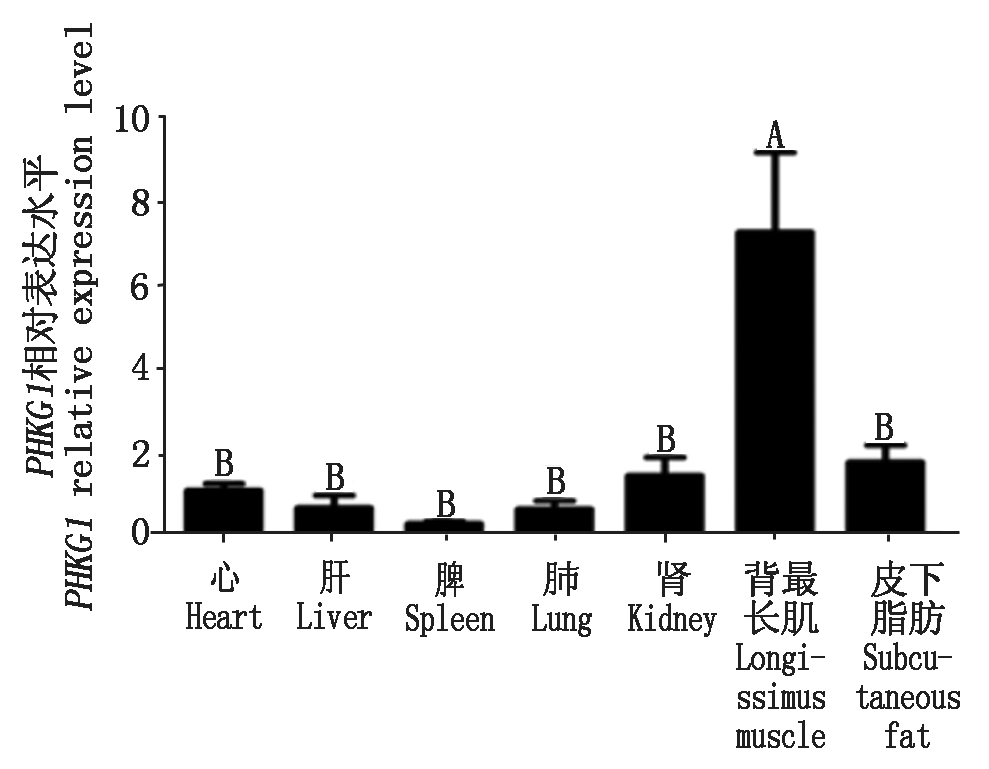
不同大写字母表示数据间差异极显著(P<0.01);不同小写字母表示差异显著(P<0.05)。图6同。
Different capital letters in the superscript indicate that the difference is extremely significant difference between the data (P<0.01);Different lowercase letters indicate significant difference (P<0.05).The same as Fig.6.
图5 PHKG1基因在山羊不同组织中的相对表达水平
Fig.5 Relative expression level of PHKG1 in different tissues of goat
2.5山羊PHKG1基因时序表达分析
qPCR检测PHKG1基因在山羊肌内和皮下前体脂肪细胞分化不同阶段的相对表达水平。结果表明,在肌内前体脂肪细胞分化过程中该基因的相对表达水平呈上升-下降-上升-下降的趋势,在60 h时达最高,显著高于0 h(P<0.05)(图6-A);在皮下前体脂肪细胞的时序表达中,该基因的相对表达水平先维持稳定且均处于较低水平,在48~96 h相对表达量升高,96 h时表达量极显著高于前期表达量(P<0.01)(图6-B)。
3 讨论与结论
研究发现与糖原分解有关的PHKG1基因功能丧失,导致糖原分解酶的缺乏,从而导致猪的糖原累积病(Glycogen storage disease,GSD),而消除该基因的不良突变将大大降低GSD的发病率并改善猪肉质量[13],因此,该基因在动物肉质研究中被引起重视。为了阐明山羊PHKG1基因特性,本研究克隆获得包括完整CDS的PHKG1基因序列,经蛋白质相互作用预测发现,其与CALM1、PHKA1、PYGM、PHKB、PHKG2、PHKA2和PYGL等蛋白可能存在相互作用。PHK的α亚基具有调控作用,其中磷酸化酶激酶α1(Phosphorylase kinase α1,PHKA1)基因编码肌肉组织特异表达的αM型,PHKA2基因编码肝脏特异表达的αL型;PHKB基因编码其β亚基;CALM1、CALM2和CALM3 3个基因共同编码的δ亚基为钙调节蛋白,可以在不同 Ca2+浓度的条件下调节酶活性[14-16]。Bali等[17]报道,由PHKA2、PHKB和PHKG2基因的突变引起的PHK缺乏是糖原贮积病(糖原贮积病Ⅸ型)最常见的原因之一。糖原磷酸化酶(PYGM)通常以去磷酸化状态存在而不具活性,在PHK和钙离子存在时,被磷酸化而获得活性[18-19]。而PYGM基因缺陷可引起人类Ⅹ型糖原贮积病[20]。对PHKG1超表达后,检测到PHKG2和磷酸甘油酸变位酶基因(PGAM2)表达量亦上调[21]。综上所述,本试验预测的蛋白质互作的结果辅证了PHKG1参与糖原代谢。
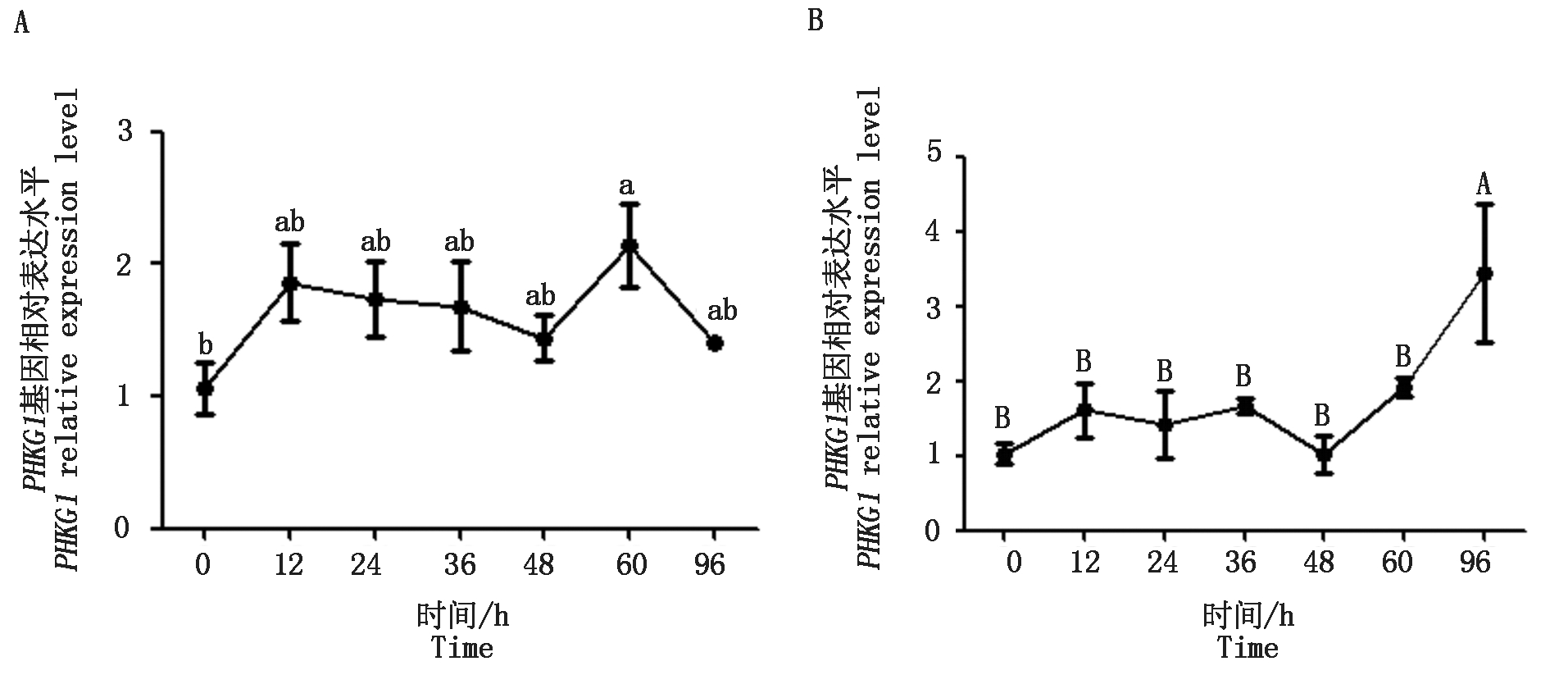
A.PHKG1在山羊肌内前体脂肪细胞分化过程中的相对表达量;B.PHKG1在山羊皮下前体脂肪细胞分化过程中的相对表达量。
A .The relative expression of PHKG1 during the differentiation of intramuscular preadipocytes in goat;
B. The relative expression of PHKG1 during the differentiation of subcutaneous preadipocytes in goat.
图6 PHKG1基因在山羊肌内和皮下脂肪细胞分化过程中的相对表达水平
Fig.6 Relative expression level of PHKG1 during the differentiation of intramuscular and subcutaneous preadipocytes in goat
前人对多个物种间PHK家族基因进行了研究,结果表明,其家族成员在多种动物以及人的组织中存在广泛表达[8,22]。为探究该基因是否在山羊各组织中广泛表达,本试验构建了山羊PHKG1基因组织表达图谱,结果表明,PHKG1在山羊的心、肝、脾、肾、肺、背最长肌、皮下脂肪组织中均有表达,并且在背最长肌中相对表达量最高,其次为皮下脂肪,说明PHKG1在山羊的各组织中广泛表达且具有组织特异性。糖原主要集中于肝脏和肌肉[23],肌肉对维持机体运动时的血糖平衡起着重要作用[24],运动时肌浆网释放的钙离子可变构激活PHK,使磷酸化酶b转变为有活性的磷酸化酶a[25-26]。王圆圆[21]发现,PHKG1在从江香猪和大白猪背最长肌组织中的表达量最高,在脂肪中的表达量较高,在其他组织中表达水平较低,与本研究结果类似。综合以上推测PHKG1基因在动物肌肉组织糖原代谢中发挥重要作用。同时本研究发现,PHKG1在肌内和皮下前体脂肪细胞分化过程中的表达模式有区别,可能是由于皮下脂肪位于真皮之下,肌内脂肪位于肌纤维之间,二者所处的部位和发育环境不同[27],且皮下脂肪为储能组织,而肌内脂肪多与肉质性状相关[28],属功能性组织,另外在猪中的研究证明,不同部位脂肪沉积具有明显的时序性和组织特异性,肌内脂肪的沉积晚于皮下脂肪[29]。本研究还发现,PHKG1基因在诱导分化后第60小时的肌内脂肪细胞和诱导分化后第96小时的皮下脂肪细胞内表达水平分别显著和极显著高于分化前表达水平,推测该基因可能具有促进分化的作用。随着前体脂肪细胞向成熟脂肪细胞分化,糖代谢水平也发生改变,细胞会摄取利用葡萄糖为维持正常生命活动提供能量,亦通过转化作用生成甘油三酯的合成底物[30]如丙酮酸、乙酰辅酶A(CoA)和3-磷酸甘油等。因此,PHKG1基因可能通过对糖原代谢的调控而在山羊脂肪细胞分化过程起重要作用,但如果要全面深入的阐明PHKG1基因对山羊脂肪细胞分化的调控作用则需要进一步进行功能研究。
本试验克隆得到山羊PHKG1基因CDS全长1 164 bp,编码387个氨基酸,无跨膜结构、无信号肽且主要在细胞质中发挥作用。PHKG1基因在山羊背最长肌中表达最高,在分化后的脂肪细胞中的表达水平显著高于未分化的前体脂肪细胞。
[1] 朱武政,林亚秋,江明锋,王永,廖红海,李倩,朱江江. 肉用山羊脂代谢相关基因与肌内脂肪含量的相关性分析[J]. 畜牧兽医学报,2016,47(7):1333-1341. doi:10.11843/j.issn.0366-6964. 2016.07.005.
Zhu W Z,Lin Y Q,Jiang M F,Wang Y,Liao H H,Li Q,Zhu J J. Association analysis of intramuscular fat content and the expression of genes related to lipid metabolism in meat goat[J]. Acta Veterinaria Zootechnica Sinica,2016,47(7):1333-1341.
[2] 王林杰. 猪糖原合成酶(GS)与糖原合成酶激酶(GSK3)基因的分离克隆、表达分析及其功能研究[D]. 武汉:华中农业大学,2010.
Wang L J. Molecular characterization,expression patterns and functional study of the porcine GS and GSK3 genes[D]. Wuhan:Huazhong Agricultural University,2010.
[3] Nadeau O W,Sacks D B,Carlson G M. The structural effects of endogenous and exogenous Ca2+/calmodulin on phosphorylase kinase[J]. Journal of Biological Chemistry,1997,272(42):26202-26209. doi:10.1074/jbc.272.42.26202.
[4] Winchester J S,Rouchka E C,Rowland N S,Rice N A. In Silico characterization of phosphorylase kinase:Evidence for an alternate intronic polyadenylation site in PHKG1[J]. Molecular Genetics and Metabolism,2007,92(3):234-242. doi:10.1016/j.ymgme.2007.06.015.
[5] Brushia R J,Walsh D A. Phosphorylase kinase:the complexity of its regulation is reflected in the complexity of its structure[J]. Frontiers in Bioscience A Journal & Virtual Library,1999,4(1-3):618-641. doi:10.2741/Brushia.
[6] Hancock J M,Rice N A. Characterization of the human PHKG2 promoter[J].FASEB Journal,1989,20:A957. doi:10.1096/fasebj.20.5.A957-a.
[7] Priddy T S,Price E S,Johnson C K,Carlson G M. Single molecule analyses of the conformational substates of calmodulin bound to the phosphorylase kinase complex[J]. Protein Science,2007,16(6):1017-1023. doi:10.1110/ps.062747407.
[8] Ma J W,Yang J,Zhou L S,Ren J,Liu X X,Zhang H,Yang B,Zhang Z Y,Ma H B,Xie X H,Xing Y Y,Guo Y M,Huang L S. A splice mutation in the PHKG1 gene causes high glycogen content and low meat quality in pig skeletal muscle[J]. PLoS Genetics,2014,10(10):e1004710. doi:10.1371/journal.pgen.1004710.
[9] Camus S,Quevedo C,Menéndez S,Paramonov I,Stouten P F W,Janssen R A J,Rueb S,He S,Snaar-Jagalska B E,Laricchia-Robbio L,Belmonte J C I. Identification of phosphorylase kinase as a novel therapeutic target through high-throughput screening for anti-angiogenesis compounds in zebrafish[J]. Oncogene,2012,31(39):4333-4342. doi:10.1038/onc.2011.594.
[10] Zappaterra M,Sami D,Davoli R. Association between the splice mutation g.8283C>A of the PHKG1 gene and meat quality traits in Large White pigs[J]. Meat Science,2019,148:38-40. doi:10.1016/j.meatsci.2018.10.003.
[11] Liu Y,Liu Y,Ma T,Long H,Niu L,Zhang X,Lei Y,Wang L,Chen Y,Wang Q,Zheng Z,Xu X W. A splicing mutation in PHKG1 decreased its expression in skeletal muscle and caused PSE meat in Duroc×Luchuan crossbred pigs[J]. Animal Genetics,2019,50(4):395-398. doi:10.1111/age.12807.
[12] Xue Q,Zhang G X,Li T T,Ling J J,Zhang X Q,Wang J Y. Transcriptomic profile of leg muscle during early growth in chicken[J]. PLoS One,2017,12(3):e0173824. doi:10.1371/journal.pone.0173824.
[13] Liu X X,Xiong X W,Yang J,Zhou L S,Yang B,Ai H S,Ma H B,Xie X H,Huang Y X,Fang S M,Xiao S J,Ren J,Ma J W,Huang L S. Genome-wide association analyses for meat quality traits in Chinese Erhualian pigs and a Western Duroc×(Landracex×Yorkshire) commercial population[J]. Genetics Selection Evolution,2015,47(1):44. doi:10.1186/s12711-015-0120-x.
[14] Wehner M,Kilimann M W. Human cDNA encoding the muscle isoform of the phosphorylase kinase gamma subunit(PHKG1)[J]. Human Genetics,1995,96(5):616-618. doi:10.1007/bf00197422.
[15] Wolfsdorf J I,Holm I A,Weinstein D A. Glycogen storage diseases. Phenotypic,genetic,and biochemical characteristics,and therapy[J]. Endocrinology and Metabolism Clinics of North America,1999,28(4):801-823. doi:10.1016/s0889-8529(05)70103-1.
[16] Burwinkel B,Hu B,Schroers A,Clemens P R,Moses S W,Shin Y S,Pongratz D,Vorgerd M,Kilimann M W. Muscle glycogenosis with low phosphorylase kinase activity:mutations in PHKA1,PHKG1 or six other candidate genes explain only a minority of cases[J]. European Journal of Human Genetics,2003,11(7):516-526. doi:10.1038/sj.ejhg.5200996.
[17] Bali D S,Goldstein J L,Fredrickson K,Rehder C,Boney A,Austin S,Weinstein D A,Lutz R,Boneh A,Kishnani P S. Variability of disease spectrum in children with liver phosphorylase kinase deficiency caused by mutations in the PHKG2 gene[J]. Molecular Genetics and Metabolism,2014,111(3):309-313. doi:10.1016/j.ymgme.2013.12.008.
[18] 杨军,张小莉,莫新民. 从蛋白质组学研究壮骨止痛方治疗骨质疏松症作用机理[J]. 辽宁中医药大学学报,2013,15(11) :35-37.
Yang J,Zhang X L,Mo X M. Study of proteomics mechanism of Zhuanggu Zhitong formula on osteoporosis[J]. Journal of Liaoning University of Traditional Chinese Medicine,2013,15(11) :35-37.
[19] Levitan B I. Modulation of ION channels by protein phosphorylation and dephosphorylation[J]. Annual Review of Physiology,1994,56(1):193-212. doi:10.1146/annurev.ph.56.030194.001205.
[20] Naini A,Toscano A,Musumeci O,Vissing J,Akman H O,DiMauro S. Muscle phosphoglycerate mutase deficiency revisited[J]. Archives of Neurology,2009,66(3):394-398. doi:10.1001/archneurol.2008.584.
[21] 王圆圆. 贵州从江香猪PHKG1、PHKG2基因的克隆表达及功能研究[D]. 贵阳:贵州大学,2018.
Wang Y Y. Cloning expression and function analysis of the PHKG1 and PHKG2 genes in Guizhou congjiang Pig[D]. Guiyang:Guizhou University,2018.
[22] 王圆圆,许厚强,陈伟,周迪,孙成娟,张青青,赵焕平,张鸣,杨洋. 从江香猪PHKG1和PHKG2基因克隆及其mRNA在组织中表达水平[J]. 农业生物技术学报,2017,25(10):1643-1652. doi:10.3969/j.issn.1674-7968.2017.10.010.
Wang Y Y,Xu H Q,Chen W,Zhou D,Sun C J,Zhang Q Q,Zhao H P,Zhang M,Yang Y. Cloning of PHKG1 and PHKG2 genes in Congjiang pigs (Sus scrofa) and their mRNA expression in tissue[J]. Journal of Agricultural Biotechnology,2017,25(10):1643-1652.
[23] 邓斌. 动物肝糖原分子结构及糖原分子生长中链终止机制初步研究[D]. 武汉:华中科技大学,2016.
Deng B. Studies on the molecular structure of animal liver glycogen and the chain stoppage mechanism in glycogen molecule growth[D].Wuhan:Huazhong University of Science and Technology,2016.
[24] Stanford K I,Goodyear L J. Exercise and type 2 diabetes:molecular mechanisms regulating glucose uptake in skeletal muscle[J]. Advances in Physiology Education,2014,38(4):308-314. doi:10.1152/advan.00080.2014.
[25] Hems D A,Whitton P D. Control of hepatic glycogenolysis[J]. Physiological Reviews,1980,60(1):1-50. doi:10.1152/physrev.1980.60.1.1.
[26] Chrisman T D,Jordan J E,Exton J H. Purification of rat liver phosphorylase kinase[J]. Journal of Biological Chemistry,1982,257(18):10798-10804.
[27] Fox K E,Fankell D M,Erickson P F,Majka S M,Crossno J T,Klemm D J. Depletion of cAMP-response element-binding protein/ATF1 inhibits adipogenic conversion of 3T3-L1 cells ectopically expressing CCAAT/enhancer-binding protein (C/EBP)alpha,C/EBP beta or PPAR gamma 2[J]. Journal of Biological Chemistry,2006,281(52):40341-40353. doi:10.1074/jbc.M605077200.
[28] Jeremiah L E,Dugan M E R,Aalhus J L,Gibson L L. Assessment of the relationship between chemical components and palatability of major beef muscles and muscle groups[J]. Meat Science,2003,65(3):1013-1019. doi:10.1016/S0309-1740(02)00309-1.
[29] Kouba M, Bonneau M, Noblet J. Relative development of subcutaneous, intermuscular, and kidney fat in growing pigs with different body compositions[J]. Journal of Animal Science,1999,77(3):622-629. doi:10.2527/1999.773622x.
[30] 姜藻航,贺丹丹,夏梦圆,李振,陈杰. AdipoR2介导C2C12肌管细胞促进3T3-L1前体脂肪细胞的糖代谢能力[J]. 南京农业大学学报,2018,41(5):911-916. doi:10.7685/jnau.201709012.
Jiang Z H,He D D,Xia M Y,Li Z,Chen J. Mediation of AdipoR2 in 3T3-L1 preadipocytes co-cultured with C2C12 myotubes for glucose absorption and consumption[J]. Journal of Nanjing Agricultural University,2018,41(5):911-916.
