嫁接是利用植物愈伤的机能和砧木的优异性状,通过靠接、劈接、插接及折叠T型芽接等方法将植物的枝或芽,嫁接到优良植物的茎或根上,从而提高植株抗病和耐低温、干旱、高盐能力等,在烟草和蔬菜等经济作物的品种改良方面有着广泛的应用。Liu等[1]利用耐干旱烟草品种农大202作为砧木,相比于自接苗(K326/K326),显著提升了接穗K326的耐旱能力;霍勇锦等[2]用耐干旱品种龙江851(LJ851)为砧木,也发现嫁接苗JX6007/LJ851的耐旱能力显著高于JX6007/JX6007,这是因为耐旱砧木能够提高接穗的抗氧化酶活性及耐旱基因的表达;![]()
 eri 等[3]利用烟草Samsun和 Hasankeyf作为砧木,显著提高接穗番茄(Elazig)对高盐胁迫的耐受性。嫁接在病害防治方面最早的应用是西瓜细菌性枯萎病的防治[4]。Inoue等[5]和Kunwar等[6]发现利用抗性番茄作为砧木能够显著提高嫁接苗对细菌性枯萎病和番茄青枯病的抗性;蔡健和等[7]和黎妍妍等[8]都报道了将烟草抗性品种作为砧木可有效提高烟草对青枯病抗性,这些研究表明,嫁接在防控瓜果、蔬菜和烟草等经济作物土传病害上也有较好的应用潜力[9]。
eri 等[3]利用烟草Samsun和 Hasankeyf作为砧木,显著提高接穗番茄(Elazig)对高盐胁迫的耐受性。嫁接在病害防治方面最早的应用是西瓜细菌性枯萎病的防治[4]。Inoue等[5]和Kunwar等[6]发现利用抗性番茄作为砧木能够显著提高嫁接苗对细菌性枯萎病和番茄青枯病的抗性;蔡健和等[7]和黎妍妍等[8]都报道了将烟草抗性品种作为砧木可有效提高烟草对青枯病抗性,这些研究表明,嫁接在防控瓜果、蔬菜和烟草等经济作物土传病害上也有较好的应用潜力[9]。
青枯病(Tobacco bacterial wilt)是世界上最具破坏性的土壤传播病害之一,对马铃薯、番茄和烟草等重要经济作物造成严重的经济损失[10-11]。目前,农业生产中主要采用农药(化学农药和生物制剂)灌根等方法防治青枯病。但是由于青枯病具有复杂的组成类群和基因多样性、存在着VBNC状态以及多样的传播方式,传统的化学防治很难达到理想的防控效果[12-13],而用抗病品种作为砧木是减少由青枯病造成损失的控制方法之一。为了揭示砧木Y87提高烟草接穗HD对青枯菌抗性的机制,本研究首先测定HD/Y87和HD/HD苯丙氨酸解氨酶(PAL)酶活性的变化,然后利用转录组对HD/Y87和HD/HD的基因表达规律进行分析。
1 材料和方法
1.1 试验地点
2015-2017年在宜宾烟草科技示范园、四川农业大学农学院进行不同嫁接组合及烤烟品种对烟草青枯病的抗性鉴定。
1.2 试验设计和试验材料
1.2.1 嫁接苗构建 试验嫁接苗为:红花大金元(易感青枯病,HD)作为接穗,云烟87(高抗青枯病,Y87)或HD作为砧木,接穗和砧木按湿润育苗技术规程育苗,接穗品种按正常的育苗时令播种,砧木比接穗早播种10 d;待砧木长至7叶、接穗长至6叶1心,采用劈接加生料带缠绕法,选取砧木,平切去顶芽,并在平切面中部向下垂直切开1.0~1.5 cm;同时选取接穗,从生长点向下3 cm左右处切去,从两边切长度1 cm左右的平滑楔形,插入砧木切口内,用生料带缠绕好后放回湿润盘内,及时遮阴保湿,嫁接苗长出1片新叶后即可移栽。
1.2.2 PAL活性的测定 分别取移栽返青后的嫁接苗第1,3,6,9天新鲜叶片,取约0.15 g叶片,切碎,放入预冷的研钵中,加适量的硼酸缓冲液(200 mmol/L pH值 8.8 含10%质量分数聚乙烯吡咯烷酮,1 mmol/L乙二胺四乙酸 和5 mmol/L β-巯基乙醇)在冰浴环境研磨成匀浆,以3 000 r/min的转速冷冻离心10 min,低温下保存备用,沉淀用1 mL 硼酸缓冲液提取2次,将全部上清液转入容量瓶,定容至5 mL。以L-苯丙氨酸为底物,反应条件为37 ℃,1 h,0.2 mol/L pH 值8.8 硼酸缓冲液为反应环境,酶活性以每小时内吸光值变化0.1 为1 个活性单位,PAL 酶活性表示为U/g,每样品重复测3次[14]。
1.2.3 转录组测序 取5株健康旺盛叶片,分别标记为HB (HD/Y87)和HH (HD/HD),每处理2个生物学重复。根据TRIzol®Reagent (InvitrogenTM) 试剂盒说明,提取样品总RNA,并用DNase Ⅰ消化基因组DNA,经质检合格后,用带有Oligo(dT)的磁珠富集真核生物mRNA;加入打断试剂,在Thermomixer中将mRNA打断成150~200 nt的短片段,以短片段mRNA为模板,用6碱基随机引物(Random hexamers)合成一链;然后配制二链合成反应体系合成二链cDNA,并利用试剂盒纯化双链cDNA;纯化后的cDNA先进行黏性末端修复,随后在cDNA的3′末端加上碱基A并连接接头,最后进行片段大小选择和PCR扩增;构建好的文库用Agilent 2100 Bioanalyzer和ABI StepOnePlus Real-Time PCR System质检合格后,使用Illumina HiSeqTM 4000测序。
1.2.4 转录组数据与参考基因组序列比对 通过去除含有接头的Reads及低质量的Reads(包括去除N的比例大于10%的Reads;去除质量值Q≤10的碱基数占整条Read的50%以上的Reads),得到高质量的Clean Reads,然后将高质量的Clean Reads上传NCBI SRA database。利用TopHat2[15]将Clean Reads与烟草参考基因组进行序列比对,获取在参考基因组或基因上的位置信息,以及测序样品特有的序列特征信息。
1.2.5 基因表达量分析 使用Cufflinks软件的Cuffquant和Cuffnorm组件,对样品中Mapped Reads的数目和转录本长度进行归一化,通过Mapped Reads在基因上的位置信息,对转录本和基因的表达水平进行定量,Cuffquant和Cuffnorm采用FPKM[16](Fragments Per Kilobase of transcript per Million fragments mapped)作为衡量转录本或基因表达水平的指标,FPKM计算公式如下:
公式中,总外显子读数表示比对到某一转录本上的片段数目,即双端Reads数目;定位的读数(百万)表示比对到转录本上的片段总数,以106为单位;外显子长度(kb)表示转录本长度,以103个碱基为单位。
1.2.6 差异表达分析 将Fold Change(差异倍数,两样品(组)间表达量的比值)≥2且FDR(错误发现率,通过对差异显著性P值(P-value)进行校正得到的)<0.01作为筛选标准。利用DESeq[17]进行样品组间的差异表达分析,获得2个生物学条件之间的差异表达基因集,利用Blast程序将差异表达基因富集到GO和KEEG数据库,从而注释差异表达基因。
2 结果与分析
2.1 不同嫁接方式对烤烟PAL的影响
由图1可以看出,在不同取样时间,Y87作为砧木的嫁接苗HD/Y87叶片的PAL活性(12.10~15.71 U/g)均高于HD作为砧木的嫁接苗HD/HD的(8.60~10.78 U/g),两者差异显著,随着取样时间的增加2种嫁接苗的PAL活性均呈现增加的趋势。
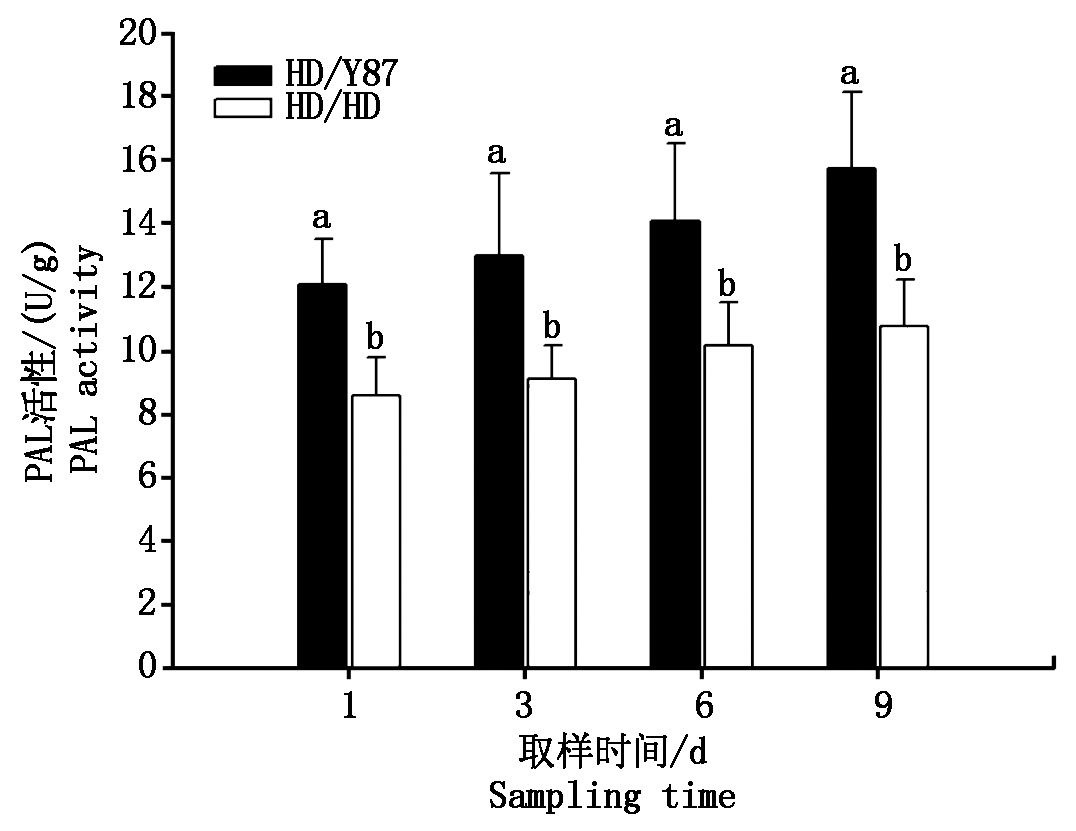
条形柱表示PAL活性(均值±标准误)。根据Duncan′s的多范围测
试,条形柱上方的不同字母(a、b)表示存在显著差异(P<0.05)。
Bars mean PAL enzyme activity (mean±s).Different letters (a, b)
above bars indicate significant differences (P<0.05) according to
Duncan′s multiple range test.
图1 嫁接苗HD/Y87和HD/HD在移栽返青后不同取样时间的PAL活性
Fig.1 PAL activity of grafted seedlings HD/Y87 and HD/HD at different sampling times after transplanting back to green
2.2 转录组分析不同嫁接方式基因表达规律
2.2.1 转录组数据 由表1可知,4个待测样品分别得到48 414 474~48 697 874条Clean Reads,Q20为97.43%~97.80%,Q30为93.46%~94.35%,GC含量在43.26%~44.23%,测序质量和重复性符合要求;将4个待测样品的Clean Reads分别比对到烟草基因组得到24 769 974~25 217 318 Mapped Reads,Mapped Reads数目和所占百分比差异不显著;
表1 RNA-seq数据统计
Tab.1 Summary of RNA-seq data
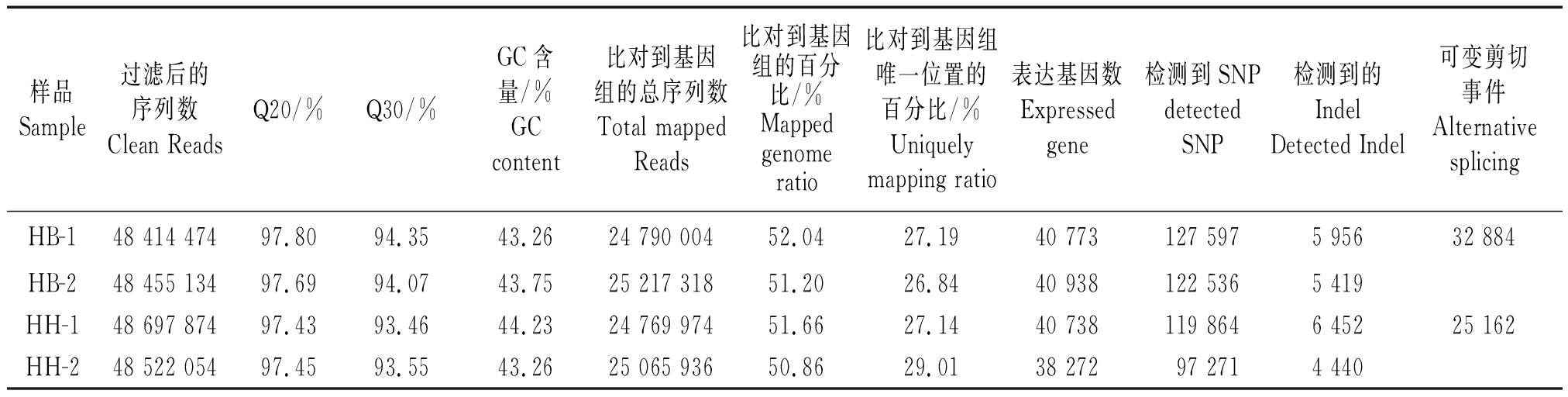
样品Sample过滤后的序列数Clean ReadsQ20/%Q30/%GC含量/%GCcontent比对到基因组的总序列数Total mappedReads比对到基因组的百分比/%Mappedgenomeratio比对到基因组唯一位置的百分比/%Uniquelymapping ratio表达基因数Expressedgene检测到SNPdetectedSNP检测到的IndelDetected Indel可变剪切事件AlternativesplicingHB-148 414 47497.8094.3543.2624 790 00452.0427.1940 773127 5975 95632 884HB-248 455 13497.6994.0743.7525 217 31851.2026.8440 938122 5365 419HH-148 697 87497.4393.4644.2324 769 97451.6627.1440 738119 8646 45225 162HH-248 522 05497.4593.5543.2625 065 93650.8629.0138 27297 2714 440
注:HB为HD/Y87;HH为HD/HD。表2同。
Note: HB is HD/Y87; HH is HD/HD.The same as Tab.2.
4个样品Mapped Reads在烟草基因基因组的分布大体一致(图2),但HB与HH表达的基因数目在38 272~40 938,检测到SNP和Indel位点数分别为97 271~127 597和4 440~6 452;HB发生的选择性剪切事件数(32 884)高于HH(25 162),且HB不同选择性剪切类型的事件数和发生基因上的选择性基因剪切事件数均高于HH(图3-4)。

图2 Reads在染色体上的分布统计
Fig.2 Distribution statistics of Reads on chromosomes
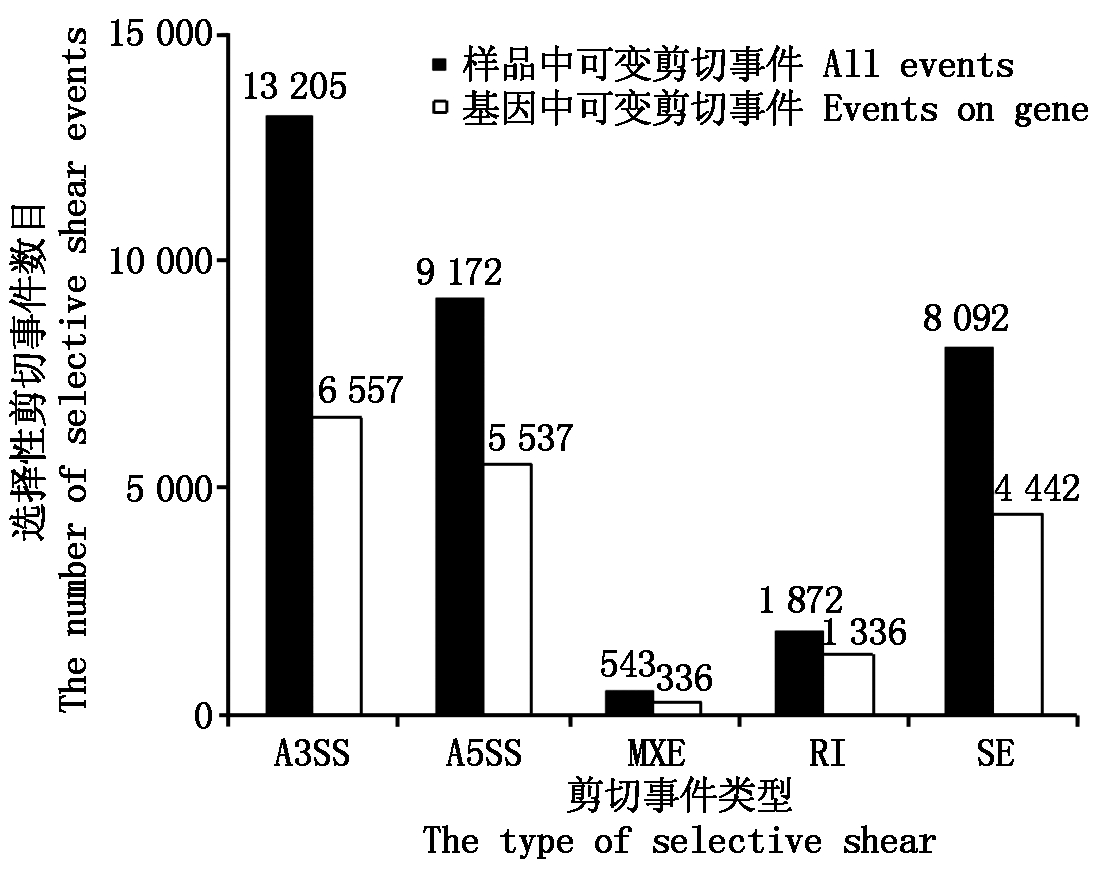
A3SS.可变转录终止位点;A5SS.可变转录起始位点;MXE.可变外显子;RI.内含子保留;SE.外显子跳跃。All events.样品中可变剪切事件。图4同。
A3SS.Alternative 3′ splice site; A5SS.Alternative 5′ splice site; MXE.Mutually exclusive exon; RI.Intron retention; SE.Exon skipping. The same as Fig.4.
图3 样品HB的选择性剪切数量统计
Fig.3 Selective shear quantity statistics of samples HB
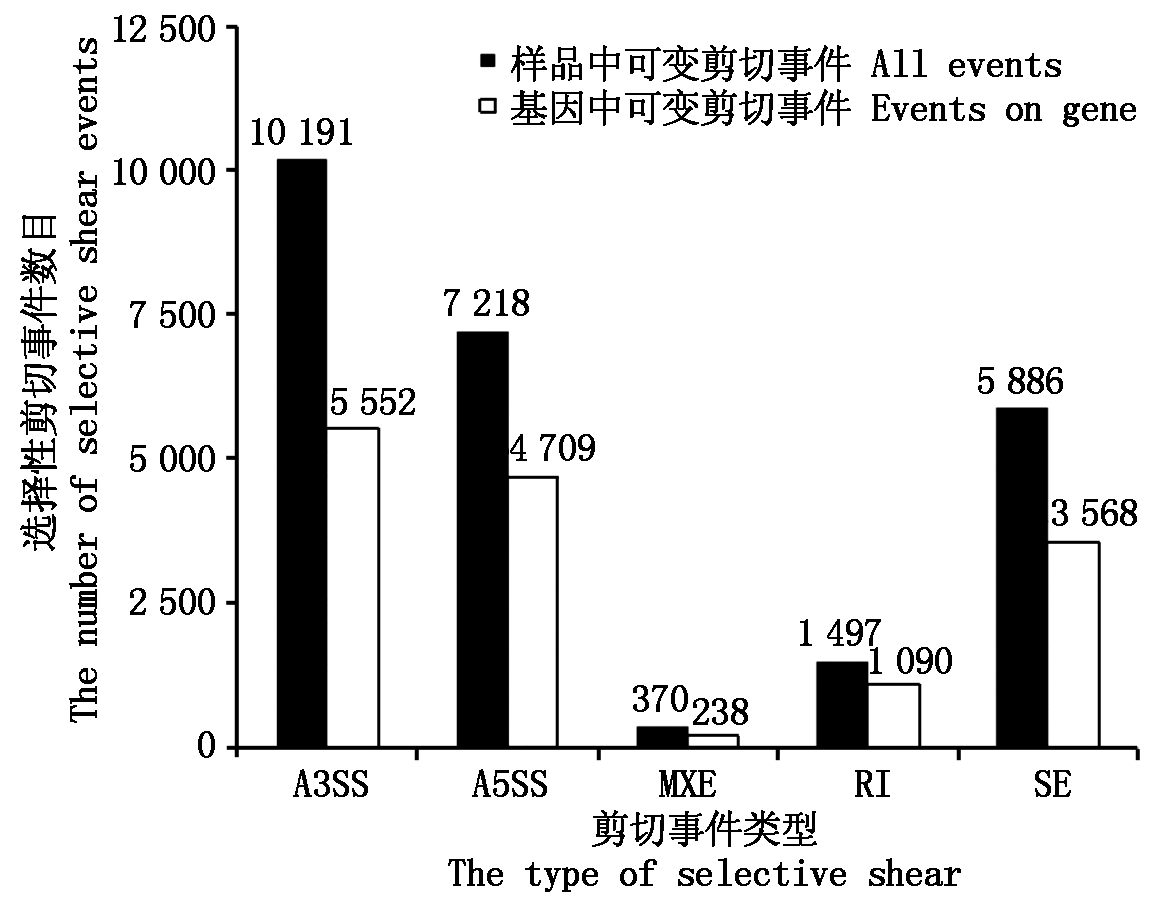
图4 样品HH的选择性剪切数量统计
Fig.4 Selective shear quantity statistics of samples HH
2.2.2 基因表达量PCA分析 2个HB嫁接苗品系(HB-1和HB-2)的基因表达水平(相关指数为0.898 2~0.971 9)明显高于HH品系(相关指数为0.731 7~0.789 3)(图5)。PCA主成分分析显示,未接种青枯菌嫁接苗品系HB-1、HB-2与接种青枯菌嫁接苗品系HH-1、HH-2的基因表达量分别在主成分PC1变量上呈现显著的聚类关系,PC1的贡献度(93.9%)远大于PC2的贡献度(5.6%),说明组内的聚类关系明显高于组间的聚类关系(图6)。
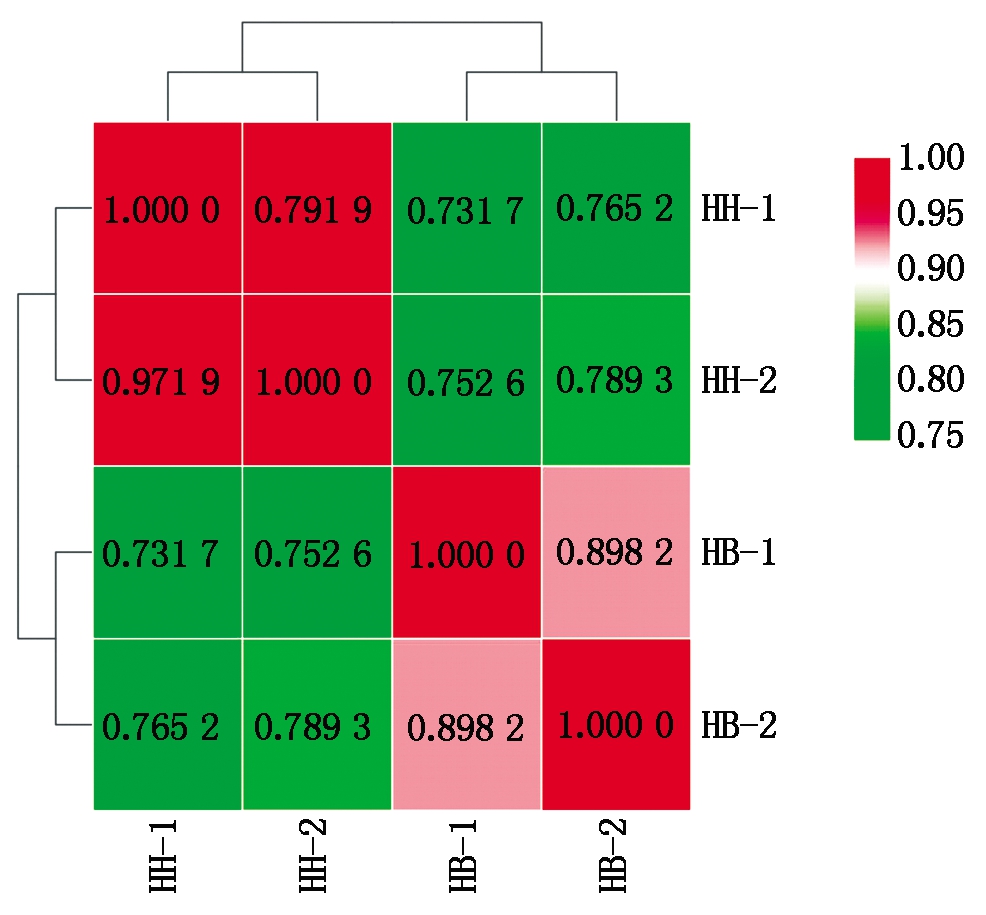
颜色越深,相关性就越大。
The darker the color is, the greater the correlation is.
图5 4个样本中基因表达量之间相关性的热图
Fig.5 Heat map of gene expression levels in the four samples
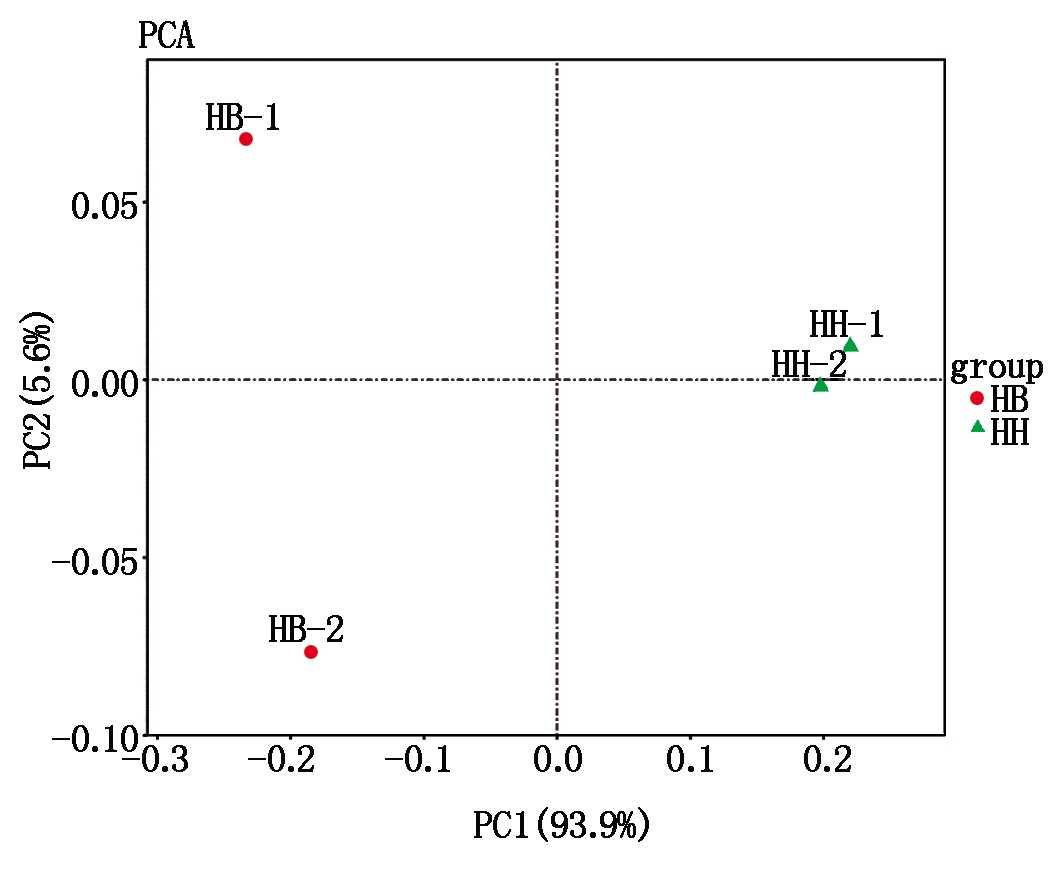
图6 4个样本间基因表达量的主成分分析图
Fig.6 Principal component analysis of gene expression amounts between four samples
2.2.3 差异表达基因统计 通过对HB和HH2组间基因表达量的比较,得到3 904条差异基因,其中3 096条基因上调,占所有差异基因的比例是79.3%;808条基因下调,占所有差异基因的比例20.7%。对4个样本的差异基因聚类分析得知,HB 2个样本之间相关性分别高于它们与HH 2个样本之间的相关性(图7)。
2.2.4 差异表达基因GO注释 差异表达基因在生物过程、细胞成分、分子功能等3种途径中均有富集。在生物过程中,差异表达基因在代谢过程、细胞转化、单一的生物过程、定位等途径均有富集,分别有1 358,1 195,750,276条;在分子功能中,差异表达基因在结合、酶催化反应、结构分子活性、细胞转运活性、核酸转录调控活性、分子功能调控等途径均有富集,分别有1 452,1 212,199,133,64,47条;在细胞成分中,差异表达基因在细胞、细胞组分、细胞器、细胞膜、高分子复合物等途径均有富集,分别有646,646,454,438,419条(图8)。
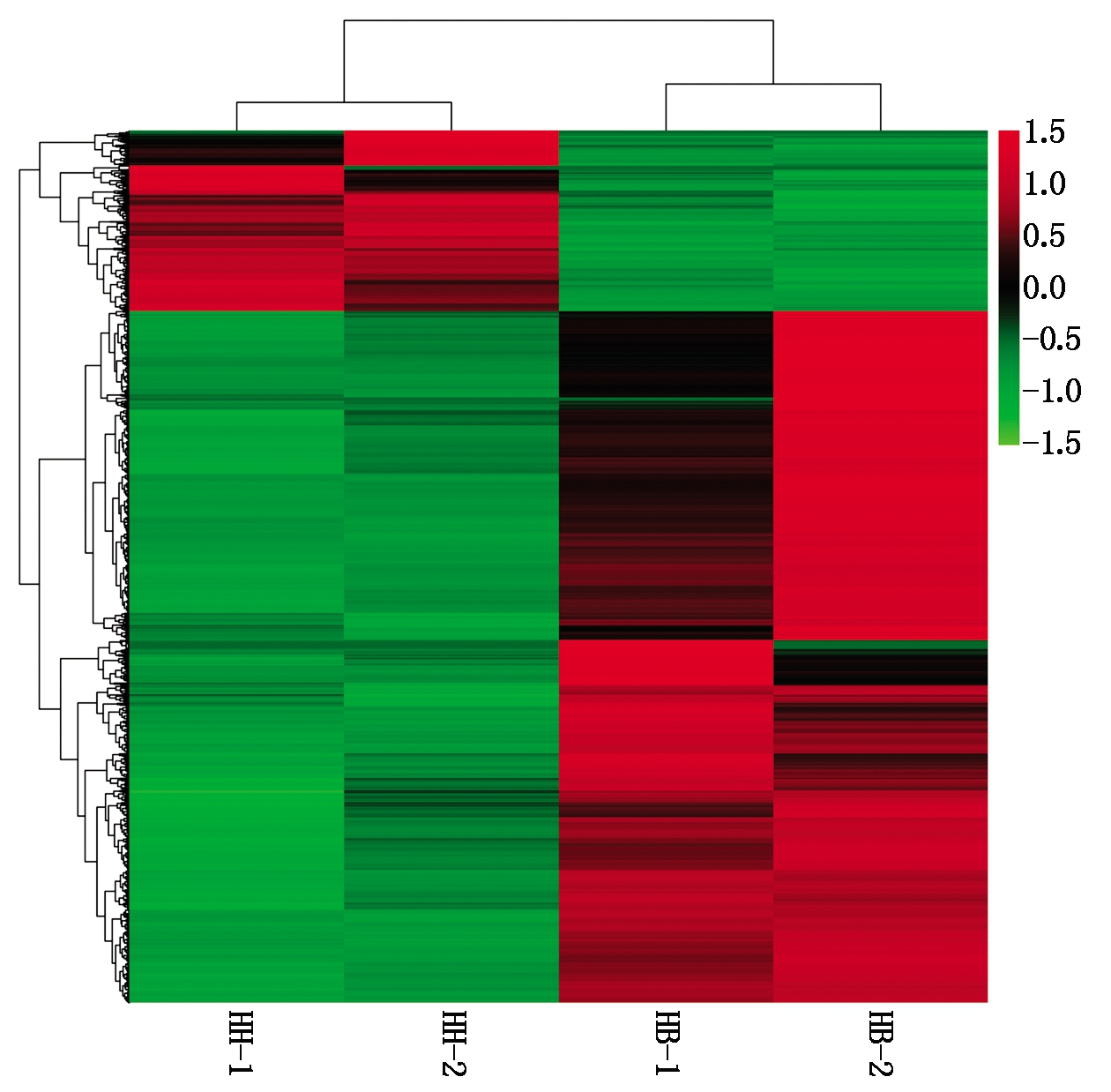
列表示样本,行表示基因;颜色越红,基因表达越高,反之,颜色越绿。
The column represents samples, and the row means genes; Color-scaled log2 (fold change) values for resistant lines, the redder the color is, the higher the gene expression is, and on the contrary, the more green the color is.
图7 4个样本间差异表达基因聚类热图
Fig.7 Clustering thermogram of differentially expressed genes among four samples
2.2.5 差异表达基因KEEG富集 在3 904条差异基因中,共有451条基因富集在KEGG数据库(图9),分别富集在碳水化合物代谢、能量代谢、核酸代谢、氨基酸代谢等途径;在这些途径中,富集在碳水化合物代谢数目最多,达92条。
2.3 抗病相关基因表达量分析
在差异表达基因中,3条编码苯丙氨酸解氨酶(Phenylalanine ammonia-lyase, PAL)基因、 5条多酚氧化酶(Polyphenoloxidase, PPO)基因、5条编码Myb 家族转录因子基因、2条编码病程相关蛋白(Pathogenesis-related protein, PR)基因、6条编码生长素应答因子(Auxin response factor,ARF)基因和3条编码乙烯-响应元件结合因子(Ethylene responsive transcription factor, ERF)基因的表达量均上调(表2)。
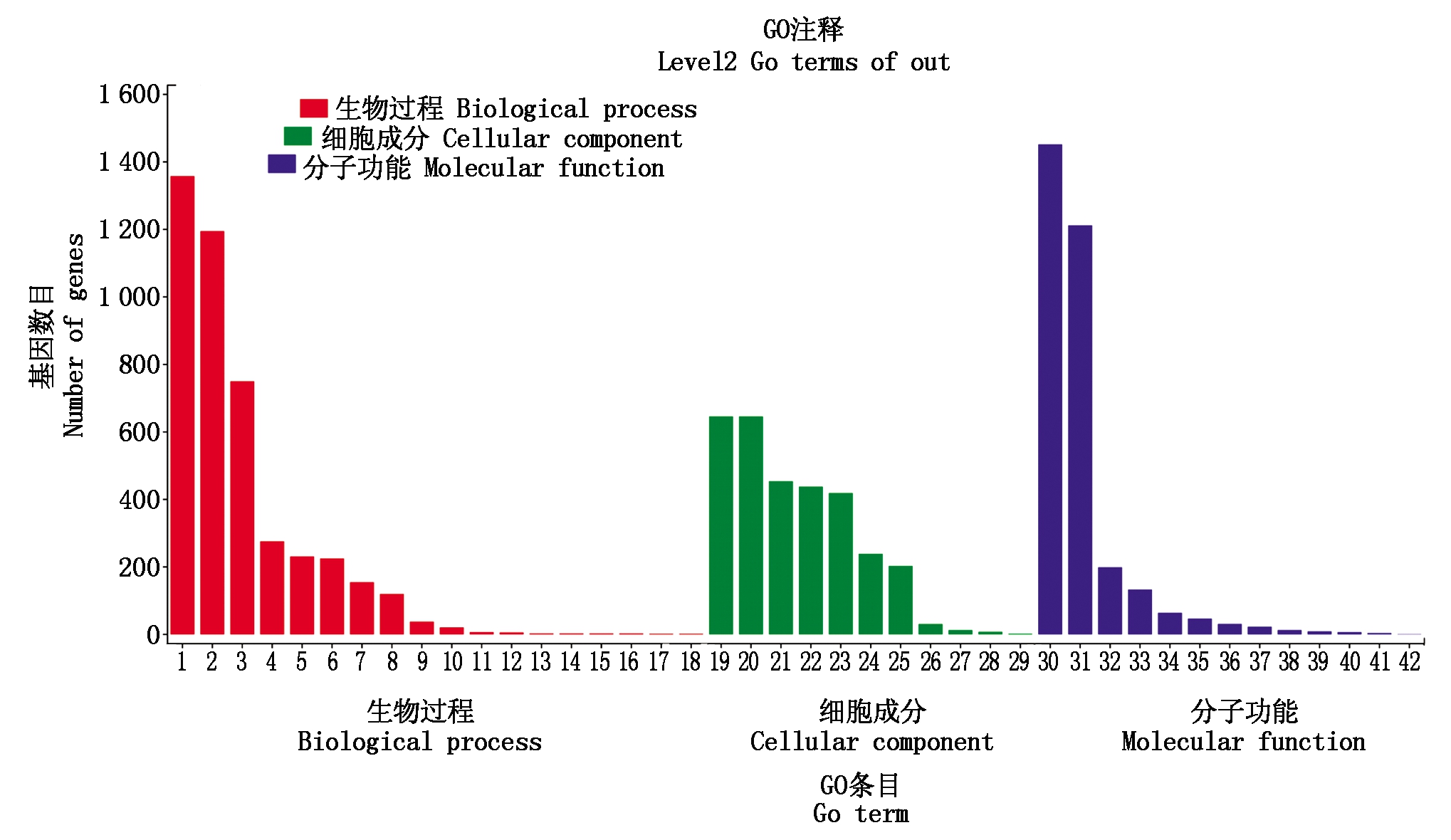
1.代谢过程;2.细胞转化;3.单一的生物过程;4.定位;5.生物调控;6.生物途径的调控;7.细胞组分的起源;8.相应外界刺激;9.信号传导;10.生物过程负调控;11.生物过程正调控;12.多种生物过程;13.生物附着;14.生长;15.繁殖;16.繁殖过程;17.发育过程;18.多细胞组分过程;19.细胞;20.细胞组分;21.细胞器;22.细胞膜;23.高分子复合物;24.细胞膜组分;25.细胞器组分;26.胞外区;27.超分子纤维;28.膜包围的空腔;29.膜外的基质;30.结合;31.酶催化反应;32.结构分子活性;33.细胞转运活性;34.核酸转录调控活性;35.分子功能调控器;36.电子传导活性;37.抗氧化活性;38.信号传感器活性;39.转录调控活性;40.储存营养物质;41.分子传感器;42.分子伴侣。
1.Metabolic processes; 2.Cellular process; 3.Single-organism processes; 4.Localization; 5.Biological regulation; 6.Regulation of biological pathways; 7.Cellular component organization or biogenesis; 8.Response to stimulus; 9.Signaling; 10.Negative regulation of biological processes; 11.Positive regulation of biological processes; 12.Multi-organism processes; 13.Biological adhesion; 14.Growth; 15.Reproduction; 16.Reproductive processes; 17.Development processes; 18.Multicellular organismal processes; 19.Cells; 20.Cell part; 21.Organelle; 22.Cell membrane; 23.Macromolecular complexes; 24.Membrane part; 25.Organelle part; 26.Extracellular regions; 27.Supramolecular fibers; 28.Membrane-enclosed lumen; 29.Extracellular matrix; 30.Binding; 31.Catalytic activity; 32.Structural molecular activity; 33.Transporter activity; 34.Nucleic acid binding transcription factor activity; 35.Molecular function regulator; 36.Electron carrier activity; 37.Antioxidant activity; 38.Signal transducer activity; 39.Transcription factor activity; 40.Nutrient reservoir activity; 41.Molecular transducer activity; 42.Metallochapenrone activity.
图8 4个样本间差异表达基因GO注释图
Fig.8 GO terms of differentially expressed genes among four samples
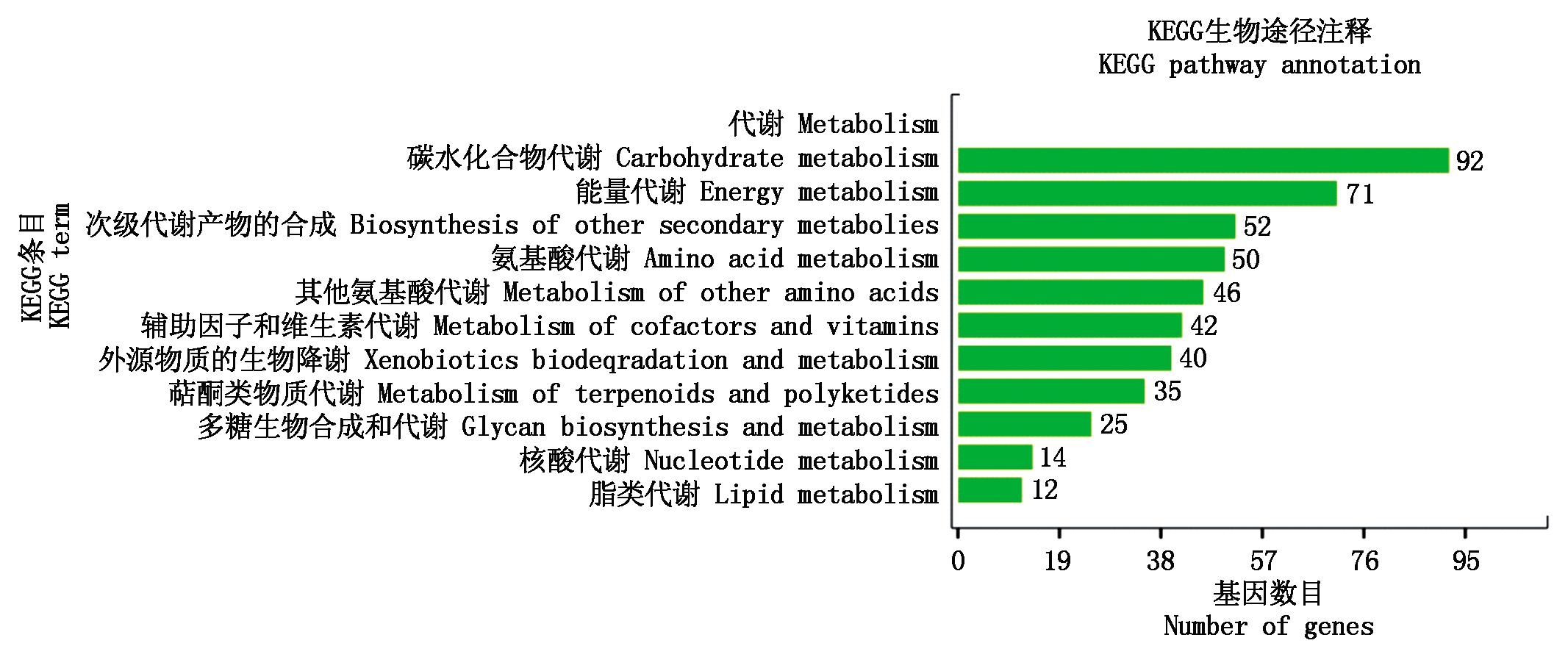
图9 4个样本间差异表达基因KEGG注释图
Fig.9 KEGG terms of differentially expressed genes among four samples
表2 抗病相关基因表达量及注释表
Tab.2 Candidate gene expression and annotation
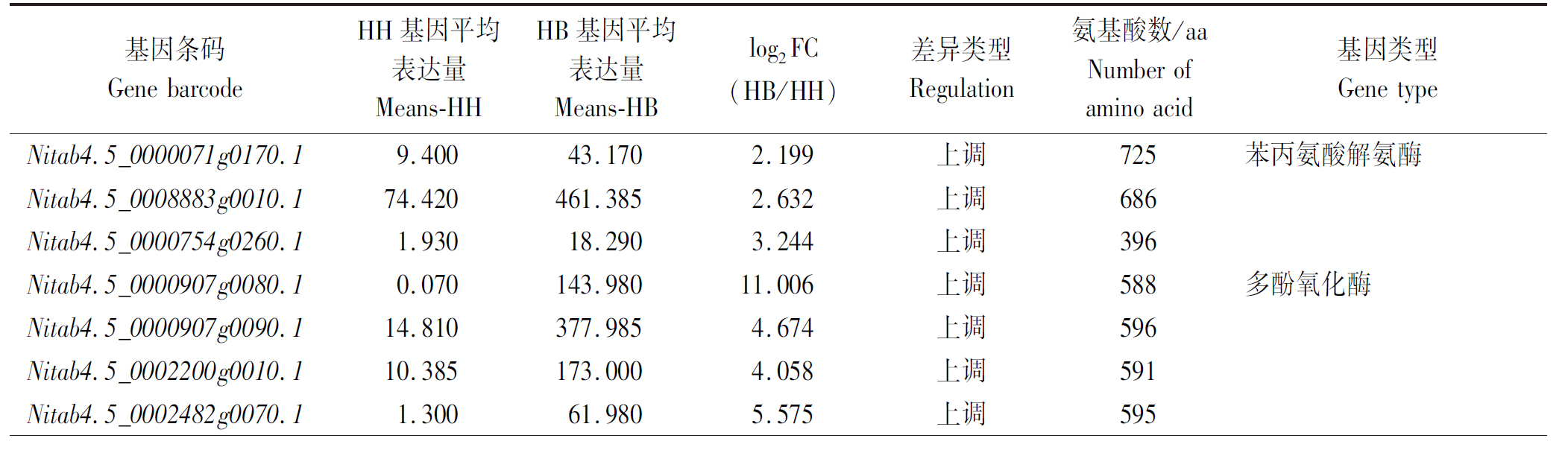
表2(续)

3 结论与讨论
Kunwar等[6]将抗青枯病番茄砧木,嫁接到敏感接穗,显著减少了根感染青枯病的概率,这些研究表明,利用抗性材料作为砧木可以显著提高接穗的抗病性;这是因为抗性品种作为砧木能够提高接穗的多种保护酶(如PPO、PAL)酶活[18]。本研究也发现HD/Y87 PAL酶活性显著高于自接苗HD/HD;冯壮志[19]在研究番茄抗青枯病生理机制发现PAL与番茄对青枯病的抗性存在显著的关联,通过喷施40 mg/L壳聚糖克显著提升PAL和PPO酶活显著提升,减轻青枯病病情;严泽生[20]也发现相比苦瓜自根苗,嫁接苗的PAL和PPO酶活显著增加;这些研究表明,PAL、PPO在嫁接苗抵抗青枯病菌侵染的防卫反应中发挥重要作用[18]。
通过HD/Y87和HD/HD之间的高通量比较转录组发现,相比于自接苗HD/HD,HD/Y87中Nitab4.5_0008883g0010.1、Nitab4.5_0000754g0260.1及Nitab4.5_0000071g0170.1等PAL基因,以及Nitab4.5_0000907g0080.1、Nitab4.5_0000907g0090.1、Nitab4.5_0002200g0010.1、Nitab4.5_0002482g0070.1及Nitab4.5_0003171g0010.1等PPO基因均上调,类似的基因在接种青枯菌后HD/Y87和HD/HD之间的比较转录组也有发现,类似的结果同样被Ishihara等[21]报道;许多研究已经证实多酚氧化酶基因、木质素合成关键基因的上调在抗病反应中起重要作用,形成较多的酚酸类物质和木质素,加固机械屏障,增强抵御能力,减轻病菌对组织细胞的伤害[22]。PAL是木质素的关键酶,被逆境诱导上调表达后,相应的酶活性明显增强,提高木质素含量,从而使作物获得病害抗性[18, 23-24];而嫁接等处理促使酚类物质、木质素的积累,如接种青枯病菌后嫁接辣椒的苯丙氨酸解氨酶(PAL)、多酚氧化酶(PPO)活性均高于对照组,通过增强次生代谢相关酶活性加速辣椒根系的次生代谢,从而形成较多的酚酸类物质和木质素,增强作物病菌对抵御能力[25]。同时一些MYB家族转录因子成员可以通过调控靶基因的表达来调控植物体内次生代谢物质的合成,保护作物抵御生物和非生物胁迫,如ATMYB12和ATMYB11调控番茄和烟草中黄酮类化合物和咖啡酰奎宁酸的生物合成,ATMYB11的组成表达增强了苯丙醇生物合成途径中基因的表达,导致烟草和番茄植株中类黄酮和绿原酸的积累[26-27];MYB转录因子AtMYB58和AtMYB63在水稻次生壁形成过程中能够激活木质素生物合成关键基因[28]。本研究也发现Nitab4.5_0004118g0080.1、Nitab4.5_0007287g0010.1、Nitab4.5_0007139g0020.1、Nitab4.5_0003845g0050.1及Nitab4.5_0000008g0850.1等多种MYB转录因子显著上调。
在HD/Y87叶片中不仅木质素合成关键酶PAL和酚类合成关键酶PPO等基因表达量增加,同时乙烯-响应元件结合因子(ERF)Nitab4.5_0002236g0020.1、Nitab4.5_0002211g0030.1、Nitab4.5_0004161g0090.1和病程相关蛋白(PR)Nitab4.5_0000090g0160.1和Nitab4.5_0002022g0020.1等基因表达量增加,李秀钰等[29]在研究病程相关蛋白与马铃薯抗病的相关性时发现StPR1在马铃薯的抗病过程中发挥着重要的作用,病程相关蛋白作为作物抵御生物胁迫重要的抗性基因,在细胞壁松弛时或者在受到机械损害的组织中抵御细菌和真菌等病原物的侵害,它可以被多种因素诱导,例如病原菌侵染和机械损伤[30]。Nisha等[31]发现荆条的水和甲醇提取物能够诱导病程相关蛋白等的产生,从而有效防控水稻白叶枯病;王艳艳等[32]以对根结线虫抗性黄瓜作为嫁接砧木,接种后苯丙烷类代谢和病程相关蛋白活性均升高。在很多PR基因的启动子中检测出GCC盒、W盒以及AS反应元件如As-1等重要的顺式作用元件,这些元件被ERF(乙烯-响应元件结合因子AP2/EREBP)蛋白质结合,它是新的植物转录因子,共享一个保守的58~59个酸性结构域即ERF结构域,AP2/EREBP蛋白在植物生长、发育以及生物(包括病原菌侵染)和非生物胁迫响应中发挥关键作用[33]。
姜夕雷[34]在通过转录组研究不同砧木(八棱海棠和M9)对接穗(烟富3)苹果组织发育的影响时发现不同嫁接组合茎顶端叶片中IAA 含量显著发生变化,进而导致多种生长素应答因子基因表达量发生变化;同时本研究也发现HD/Y87叶片中Nitab4.5_0011529g0020.1、Nitab4.5_0001988g0030.1、Nitab4.5_0007665g0050.1、Nitab4.5_0000650g0030.1、Nitab4.5_0001535g0030.1、Nitab4.5_0000315g0090.1等多种生长素响应因子显著上调。研究发现嫁接可以促进植物内源激素运输,从而诱导嫁接苗的基因表达模式发生变化[35-36];嫁接可通过改变嫁接苗内源激素含量而增强其对逆境胁迫的耐受性[37],阳燕娟等[38]和谭明明等[39]发现逆境胁迫下,嫁接苗通过改变根系、茎及叶片中吲哚-3-乙酸IAA、赤霉素GA3和脱落酸ABA等内源激素的含量,从而提升了嫁接苗对逆境的耐受能力;刘业霞[40]发现接种青枯菌后辣椒嫁接苗叶片中的内源激素含量显著增高;而MYB转录因子(TF)家族的成员通过MYB应答元件(MRE)参与生长素相关基因的转录控制[41];Li等[42]研究发现,R2R3-MYB 转录因子和TCP3相互作用,参与对生长素的负响应。基于此,MYB家族转录因子和ERF转录因子上调表达可能是由于在嫁接苗促进内源激素的传递,而这些转录因子参与对PAL、PPO和病程相关蛋白(PR)等抗性基因的调控。因此,青枯菌抗性品种Y87作为砧木能够提高接穗HD PAL活性和多种抗性基因(包含木质素、多酚及病程相关蛋白)表达量,从而提高接穗红大金元对青枯菌等病害抗性,为研究嫁接提升烤烟青枯菌抗性的机制奠定了基础。
[1] Liu J J, Li J Q, Su X H, Xia Z L. Grafting improves drought tolerance by regulating antioxidant enzyme activities and stress-responsive gene expression in tobacco[J]. Environmental and Experimental Botany, 2014, 107:173-179. doi:10.1016/j.envexpbot.2014.06.012.
[2] 霍勇锦, 徐紫薇, 王燃, 王欢颜, 刘剑君, 苏新宏, 张威, 杨铁钊, 夏宗良. 干旱胁迫下嫁接对烟草抗氧化酶活性、膜脂过氧化及胁迫响应基因表达的影响[J]. 烟草科技, 2016, 49(8):14-20. doi:10.16135/j.issn1002-0861.2015.0528.
Huo Y J, Xu Z W, Wang R, Wang H Y, Liu J J, Su X H, Zhang W, Yang T Z, Xia Z L. Effects of grafting on antioxidant enzyme activities, membrane lipid peroxidation and stress-responsive gene expression in tobacco under drought stress[J]. Tobacco Science & Technology, 2016, 49(8):14-20.
[3] ![]() Ö D, Körpe D A, Sahin F I, Haberal M. High salt induced oxidative damage and antioxidant response in tomato grafted on tobacco[J]. Chilean Journal of Agricultural Research, 2015, 75(2):192-201. doi:10.4067/S0718-58392015000200008.
Ö D, Körpe D A, Sahin F I, Haberal M. High salt induced oxidative damage and antioxidant response in tomato grafted on tobacco[J]. Chilean Journal of Agricultural Research, 2015, 75(2):192-201. doi:10.4067/S0718-58392015000200008.
[4] Zhang M, Xu J H, Liu G, Yang X P. Antifungal properties of a thaumatin-like protein from watermelon[J]. Acta Physiologiae Plantarum, 2018, 40(11): 5881. doi:10.1007/s11738-018-2759-8.
[5] Inoue Y, Kawaguchi A, Nakaho K. Bacterial wilt-resistant tomato rootstock suppresses migration of Ralstonia solanacearum into soil[J]. Journal of General Plant Pathology, 2018, 84(2):118-123. doi:10.1007/s10327-018-0771-x.
[6] Kunwar S, Paret M L, Olson S M, Ritchie L, Rich J R, Freeman J, McAvoy T. Grafting using rootstocks with resistance to Ralstonia solanacearum against Meloidogyne incognita in tomato production[J]. Plant Disease, 2015, 99(1):119-124. doi:10.1094/PDIS-09-13-0936-RE.
[7] 蔡健和, 黄福新, 石保峰, 李波, 朱桂宁, 秦碧霞, 周兴华, 李元科. 利用嫁接技术防治烟草青枯病试验研究[J]. 广西农业科学, 2010, 41(6):558-561. doi:10.3969/j.issn.2095-1191.2010.06.013.
Cai J H, Huang F X, Shi B F, Li B, Zhu G N, Qin B X, Zhou X H, Li Y K. Control effects of tobacco bacterial wilt by grafting technique[J]. Guangxi Agricultural Sciences, 2010, 41(6):558-561.
[8] 黎妍妍, 王林, 彭五星, 孙玉晓, 许汝冰, 黄俊斌, 李锡宏. 嫁接对烟草青枯病抗性及产质量的影响[J]. 中国烟草学报, 2016, 22(5):63-69. doi:10.16472/j.chinatobacco.2016.174.
Li Y Y, Wang L, Peng W X, Sun Y X, Xu R B, Huang J B, Li X H. Effects of grafting on bacterial wilt resistance, yield and quality in tobacco[J]. Acta Tabacaria Sinica, 2016, 22(5):63-69.
[9] King S R, Davis A R, Liu W G, Levi A. Grafting for disease resistance[J]. Hortscience, 2008, 43(6):1673-1676. doi:10.21273/HORTSCI.43.6.1673.
[10] 黄雯. 青枯菌LAMP检测方法的建立及植物精油抑菌活性评价[D]. 重庆:西南大学, 2017.
Huang W. Development of LAMP assays for detection of Ralstonia solanacearum and the antibacterial effects of essential oils on Ralstonia solanacearum[D]. Chongqing: Southwest University, 2017.
[11] Nishi T, Tajima T, Noguchi S, Ajisaka H, Negishi H. Identification of DNA markers of tobacco linked to bacterial wilt resistance[J]. Theoretical and Applied Genetics, 2003, 106:765-770. doi:10.1007/s00122-002-1096-9.
[12] 黎妍妍, 王林, 孙光伟, 李锡宏, 彭五星, 王昌军. 清江流域烟区烟草青枯病流行时间动态及气象因素分析[J]. 中国烟草学报, 2017,23(4):77-83. doi:10.16472/j.chinatobacco.2017.089.
Li Y Y, Wang L, Sun G W, Li X H, Peng W X, Wang C J. Jemporal epidemic dynamics and climatic factors of transmission of tobacco bacterial wilt in Qingjiang river basin[J]. Acta Tabacaria Sinica, 2017,23(4):77-83.
[13] Grey B E, Steck T R. The viable but nonculturable state of Ralstonia solanacearum may be involved in long-term survival and plant infection[J]. Applied and Environmental Microbiology, 2001, 67(9):3866-3872. doi:10.1128/AEM.67.9.3866-3872.2001.
[14] Zucker M. Induction of phenylalanine deaminase by light and its relation to chlorogenic acid synthesis in potato tuber tissue[J]. Plant Physiology, 1965, 40(5):779-784. doi:10.1104/pp.40.5.779.
[15] Liao Y, Smyth G K, Shi W. The R package rsubread is easier, faster, cheaper and better for alignment and quantification of RNA sequencing reads[J].Nucleic Acids Research, 2019, 47(8):e47. doi:10.1093/nar/gkz114.
[16] 雷阳, 成妍, 乔宁, 焦彦生, 苗如意, 杨玉花. 辣椒苗期抗感疫病比较转录组学分析[J]. 华北农学报, 2019, 34(3):194-202. doi:10.7668/hbnxb.201751450.
Lei Y, Cheng Y, Qiao N, Jiao Y S, Miao R Y, Yang Y H. Comparative transcriptome analysis of Phytophthora blight resistance of pepper at seedling stage[J]. Acta Agriculturae Boreali-Sinica, 2019, 34(3):194-202.
[17] Varešlija D, Priedigkeit N, Fagan A, Purcell S, Cosgrove N, O′Halloran P J, Ward E, Cocchiglia S, Hartmaier R, Castro C A, Zhu L, Tseng G C, Lucas P C, Puhalla S L, Brufsky A M, Hamilton R L, Mathew A, Leone J P, Basudan A, Hudson L, Dwyer R, Das S, O′Connor D P, Buckley P G, Farrell M, Hill A D K, Oesterreich S, Lee A V, Young L S. Transcriptome characterization of matched primary breast and brain metastatic tumors to detect novel actionable targets[J]. Journal of the National Cancer Institute, 2019, 111(4):388-398. doi:10.1093/jnci/djy110.
[18] 刘业霞, 付玲, 艾希珍, 王洪涛, 姬德刚. 嫁接对辣椒次生代谢的影响及其与青枯病抗性的关系[J]. 中国农业科学, 2013, 46(14):2963-2969. doi:10.3864/j.issn.0578-1752.2013.14.012.
Liu Y X, Fu L, Ai X Z, Wang H T, Ji D G. Effect of grafting on secondary metabolism and its relationship with bacterial wilt resistance in pepper[J]. Scientia Agricultura Sinica, 2013, 46(14):2963-2969.
[19] 冯壮志. 番茄抗青枯病生理机制及分子标记的研究[D]. 杭州:浙江大学, 2005.
Feng Z Z. Studies on the physiological mechanism and molecular markers of tomato resistance to bacterial wilt [D]. Hangzhou:Zhejiang University, 2005.
[20] 严泽生. 苦瓜嫁接苗酶变化及抗性和栽培效果研究[D]. 雅安:四川农业大学, 2007.
Yan Z S. Study on enzyme changes, resistance and cultivation effect of grafted balsam pear seedlings[D]. Yaan: Sichuan Agricultural University, 2007.
[21] Ishihara T, Mitsuhara I, Takahashi H, Nakaho K. Transcriptome analysis of quantitative resistance-specific response upon Ralstonia solanacearum infection in tomato[J]. PLoS One, 2012, 7(10)e46763. doi:10.1371/journal.pone.0046763.
[22] Ma Q H, Zhu H H, Qiao M Y. Contribution of both lignin content and sinapyl monomer to disease resistance in tobacco[J]. Plant Pathology, 2018, 67(3):642-650.doi:10.1111/ppa.12767.
[23] Olsen K M, Lea U S, Slimestad R, Verheul M, Lillo C.Differential expression of four Arabidopsis PAL genes; PAL1 and PAL2 have functional specialization in abiotic environmental-triggered flavonoid synthesis[J]. Journal of Plant Physiology, 2008, 165(14):1491-1499. doi:10.1016/j.jplph.2007.11.005.
[24] Wang G F, Balint-Kurti P J. Maize homologs of CCoAOMT and HCT, two key enzymes in lignin biosynthesis, form complexes with the NLR Rp1 protein to modulate the defense response[J]. Plant Physiology, 2016,171(3):2166-2177. doi:10.1104/pp.16.00224.
[25] 段曦. 嫁接提高辣椒根腐病和青枯病抗性的机理研究[D]. 泰安:山东农业大学, 2016.
Duan X. Study on the mechanism of grafting improving disease resistant of root rot and bacterial wilt in pepper [D]. Taian: Shandong Agricultural University, 2016.
[26] Li Y, Chen M, Wang S L, Ning J, Ding X H, Chu Z H. AtMYB11 regulates caffeoylquinic acid and flavonol synthesis in tomato and tobacco[J]. Plant Cell, Tissue and Organ Culture, 2015, 122(2):309-319. doi:10.1007/s11240-015-0767-6.
[27] 李洋. 转录因子AtMYB11和AtMYB12在茄科作物上调控多酚类物质合成的研究[D]. 泰安:山东农业大学, 2016.doi:10.7666/d.Y3031782.
Li Y. Effect of transcription factor AtMYB11 and AtMYB12 on production of polyphenols in solanaceae crops [D]. Taian:Shandong Agricultural University, 2016.
[28] Noda S, Koshiba T, Hattori T, Yamaguchi M, Suzuki S,Umezawa T.The expression of a rice secondary wall-specific cellulose synthase gene, OsCesA7, is directly regulated by a rice transcription factor, OsMYB58/63[J]. Planta, 2015, 242(3):589-600. doi:10.1007/s00425-015-2343-z.
[29] 李秀钰, 贺付蒙, 韩瑛琪, 赵潇璨, 武佳文, 朱元芳, 周磊, 石奇海, 冯哲, 李凤兰. 马铃薯StPR1基因克隆及表达特异性分析[J]. 华北农学报, 2019, 34(2):66-71. doi:10.7668/hbnxb.201751433.
Li X Y, He F M, Han Y Q, Zhao X C, Wu J W, Zhu Y F, Zhou L, Shi Q H, Feng Z, Li F L. Cloning and expression characteristics of Solanum tuberosum StPR1 gene[J]. Acta Agriculturae Boreali-Sinica, 2019, 34(2):66-71.
[30] van Loon L C, Rep M, Pieterse C M J. Significance of inducible defense-related proteins in infected plants[J]. Annual Review of Phytopathology, 2006, 44(1):135-162. doi:10.1146/annurev.phyto.44.070505.143425.
[31] Nisha S, Revathi K, Chandrasekaran R, Kirubakaran S A, Sathish-Narayanan S,Stout M J,Senthil-Nathan S. Effect of plant compounds on induced activities of defense-related enzymes and pathogenesis related protein in bacterial blight disease susceptible rice plant[J]. Physiological and Molecular Plant Pathology, 2012,80:1-9. doi:10.1016/j.pmpp.2012.07.001.
[32] 王艳艳, 魏珉, 沈琼, 李岩, 史庆华. 不同抗性黄瓜砧木对南方根结线虫侵染的生理生化反应[J]. 山东农业大学学报(自然科学版), 2014,45(4):522-528. doi:10.3969/j.issn.1000-2324.2014.04.008.
Wang Y Y, Wei M, Shen Q, Li Y, Shi Q H. The physiological and biochemical response of cucumber rootstocks with different resistance against Meloidogyne incognita[J]. Journal of Shandong Agricultural University(Natural Science Edition), 2014,45(4):522-528.
[33] Liu C X, Zhang T Z.Expansion and stress responses of the AP2/EREBP superfamily in cotton[J].BMC Genomics, 2017, 18(1):118.doi:10.1186/s12864-017-3517-9.
[34] 姜夕雷. 不同砧木对“烟富3”苹果接穗发育影响的分子机理研究[D].烟台:烟台大学, 2019.
Jiang X L. Molecular mechanism of different rootstocks on the development of scion of ″Yanfu 3″ apple[D]. Yantai: Yantai University, 2019.
[35] Goldschmidt E E. Plant grafting:new mechanisms, evolutionary implications[J]. Frontiers in Plant Science, 2014, 5:727. doi:10.3389/fpls.2014.00727.
[36] Wang J, Jiang L B, Wu R L. Plant grafting: how genetic exchange promotes vascular reconnection[J]. New Phytologist, 2017, 214(1):56-65. doi:10.1111/nph.14383.
[37] 郝婕, 王献革, 李学营, 鄢新民, 冯建忠. 苹果实生苗不同嫁接方法下内源激素含量变化分析[J]. 华北农学报, 2013, 28(S1):259-264. doi:10.7668/hbnxb.2013.S1.048.
Hao J, Wang X G, Li X Y, Yan X M, Feng J Z. Analysis on the changes of endogenous hormones in apple seedlings by different grafting methods[J]. Acta Agriculturae Boreali-Sinica, 2013, 28(S1):259-264.
[38] 阳燕娟, 郭世荣, 于文进. 嫁接对盐胁迫下西瓜幼苗体内离子和内源激素含量与分布的影响[J]. 西北植物学报, 2015, 35(3):500-507. doi:10.7606/j.issn.1000-4025.2015.03.0500.
Yang Y J, Guo S R, Yu W J. Effect of rootstock-grafting on the contents and distributions of ions and endogenous hormones in watermelon seedlings under NaCl stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2015, 35(3):500-507.
[39] 谭明明, 唐剑, 贺忠群, 鞠丽萍. 嫁接对铜胁迫下甜瓜幼苗生长及内源激素水平的影响[J]. 西北农林科技大学学报(自然科学版), 2016, 44(2):113-120. doi:10.13207/j.cnki.jnwafu.2016.02.016.
Tan M M, Tang J, He Z Q, Ju L P. Effects of grafting on growth and endogenous hormones of melon (Cucumis melo L.) seedlings under copper stress[J]. Journal of Northwest A&F University (Natural Science Edition), 2016, 44(2):113-120.
[40] 刘业霞. 嫁接提高辣椒青枯病抗性的生理生化机制[D]. 泰安:山东农业大学, 2011.doi:10.7666/d.d143691.
Liu Y X. The physiological and biochemical mechanism of grafted pepper in improvement of bacterial wilt resistance[D]. Taian: Shandong Agricultural University, 2011.
[41] Berendzen K W, Weiste C, Wanke D, Kilian J, Harter K, Dröge-Laser W. Bioinformatic cis-element analyses performed in Arabidopsis and rice disclose bZIP-and MYB-related binding sites as potential AuxRE-coupling elements in auxin-mediated transcription[J].BMC Plant Biology, 2012, 12:125. doi:10.1186/1471-2229-12-125.
[42] Li S T, Zachgo S. TCP3 interacts with R2R3-MYB proteins, promotes flavonoid biosynthesis and negatively regulates the auxin response in Arabidopsis thaliana [J]. The Plant Journal,2013, 76(6):901-913. doi:10.1111/tpj.12348.
