N-酰基高丝氨酸内酯(N-acyl-homoserine lactones, AHLs)是由革兰氏阴性菌产生的,作为一种通讯信号分子参与细胞间信息交流,由其介导的细菌群体感应(Quorum sensing, QS)参与细菌多种生物学功能的调控[1-2]。近年来,越来越多的证据表明,AHLs不仅可以被细菌感知调控细菌的群体行为,而且会对植物细胞产生影响[3-4]。AHLs被认为是引发诱导物,使植物宿主具有更快和更强的抵抗力,抵抗环境的胁迫[5]。植物可以通过感受AHLs,进而感知环境中细菌的存在,并做出主动和适宜的响应,调控其生长发育过程和抗病抗逆反应[6-7]。
番茄(Solanum lycopersicum)是一种重要的经济作物,其食用方法多种多样而且营养价值非常丰富。从20世纪初开始,番茄在我国就成了一种重要的蔬菜品种被人们广泛种植,是我国不可缺少的经济作物之一。灰霉病(Botrytis cinerea) 作为一种全球性分布广、发病率高且减产严重的植物真菌病害,在我国的番茄生产中灰霉病的危害极为突出,它常通过侵染植物的衰老或受损组织,从而在番茄上引起病斑或果实变软。灰霉菌能通过植物表面伤口渗透到植物的内部组织,而且能从一开始的坏死部位传染至植物的健康部位[8]。灰霉菌侵染植物时,植物能产生一系列的生理生化反应,比如植物系统内部的超敏反应、抗性相关路径、抗性相关基因表达、植物蛋白酶系统、气孔关闭等来抵御灰霉的侵染[9-16],而其中最主要的方式为茉莉酸(JA)信号路径,JA可作为信号物质诱导植物产生抗性,甲基化的JA可运输到植物未被侵染的部分并通过COI1调控PI1、PI2等抗性相关基因的表达[17],但植物仅仅依靠自身的抗性不能完全有效的抵御病害的发生。番茄灰霉病可以侵染叶、茎、花、果实等各个部位,邹庆道等[18]利用26份番茄材料,对番茄叶片、茎以及果实接种灰霉孢子后进行部位抗病性相关性分析,结果表明,番茄抗灰霉病叶部、茎部和果实的相关性不明显,需根据试验目的选取适当部位进行接种。叶片是最易操作也是最能直观体现抗性的部位,故番茄对灰霉抗性试验大多利用番茄叶片进行。到目前,生产上对此病害的控制仍是药物控制,使病原菌产生抗药性且对环境保护带来巨大压力。在此情况下,一种环境友好型且对植物生长发育有促进作用的植物新型诱抗剂的发现及研究将有重大意义。
已有研究表明,植物根际环境中由有益的革兰氏阴性菌产生的脂类物质 AHLs 可以提高植物对真菌病害的抗病性。生物工程实验室前期研究发现,短链的 AHLs 中的 N-3-羰基己酰基高丝氨酸内酯(N-3-oxo-hexanoyl-homoserinelactone,3OC6-HSL) 和 N-3-羰基辛酰基高丝氨酸内酯(N-3-oxo-octanoyl-homoserine lactone,3OC8-HSL)可以诱导 G 蛋白信号系统的变化从而诱导植物根系的伸长、促进植物的生长发育;另外 3OC8-HSL 可以激发植物的免疫状态从而诱导植物对病原菌丁香假单胞PstDC3000 和胡 萝 卜 软 腐 果 胶 杆 菌(Pectobacterium carotovoram)的抗性。基于以上研究结果,推测植物能感应不同长度脂肪酸侧链的AHLs,并且做出不同的响应。AHLs 酰基链长度的不同会影响其对植物天然免疫能力的调节,长链 AHLs 似乎更有利于增强植物的抗病性。因此,本试验以番茄为对象,以灰霉为指示菌,探索AHLs信号分子诱导植物抵抗真菌病害的效果及其抗性相关的信号通路。
1 材料和方法
1.1 试验材料
1.1.1 植物材料 供试番茄品种为杂交种1097,采购自天津市宏程芹菜研究所,为普通番茄杂交种。室温下浸泡番茄种子6 h后,置于28 ℃培养箱催芽3~4 d,将发芽的种子种在营养土与蛭石比例为1∶2混合拌匀的基质中,室温下培养,待番茄长到5~6轮叶片时,选取长势大小一致的叶片进行试验。病原菌:供试灰霉菌由田间分离所得,分离得到的灰霉菌转接到PDA培养基上,20 ℃培养箱放置。
1.1.2 试剂 试验用到的信号分子购买自Sigma公司,用丙酮作溶剂溶解信号分子,试验用的终浓度为10 μmol/L。TaqTM DNA 聚合酶、Marker DL2000、SYBR Premix Ex TaqTM (Perfect Real Time)试剂盒购自TaKaRa公司(大连)。过氧化物酶(POD)、超氧化物歧化酶(SOD)活性检测试剂盒购自索莱宝生物公司(北京)。
1.2 试验方法
1.2.1 灰霉孢子菌悬液的配制 田间分离得到的灰霉菌20 ℃培养10 d左右,用无菌水从PDA平板上洗脱孢子,纱布过滤菌丝,用血球计数板调整细胞浓度为2×105个/mL。
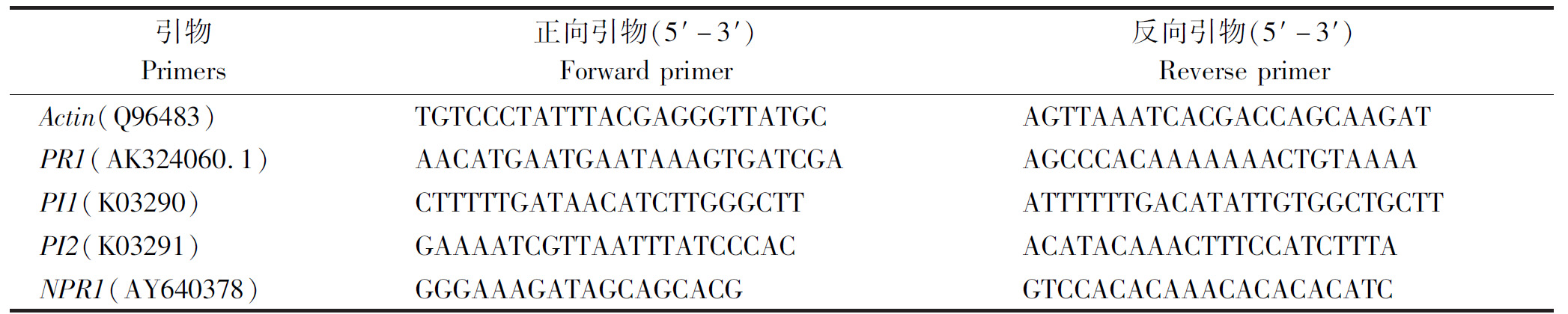
1.2.2 AHLs诱导番茄对灰霉病抗性离体试验 当番茄长至5~6轮叶片时,采集长势大小一致的番茄叶片,每组为3片平行叶片。在10 μmol/L浓度的信号分子N-癸酰基高丝氨酸内酯(C10-HSL)、N-十二酰基高丝氨酸内酯(C12-HSL)、N-十四酰基高丝氨酸内酯(C14-HSL)、N-3-羰基辛酰基高丝氨酸内酯(3OC8-HSL)、N-3-羰基十二酰基高丝氨酸内酯(3OC12-HSL)和3OC14-HSL中浸泡48 h后接灰霉菌块,放在20 ℃培养箱,5 d后观察叶片发病情况。试验重复3次。
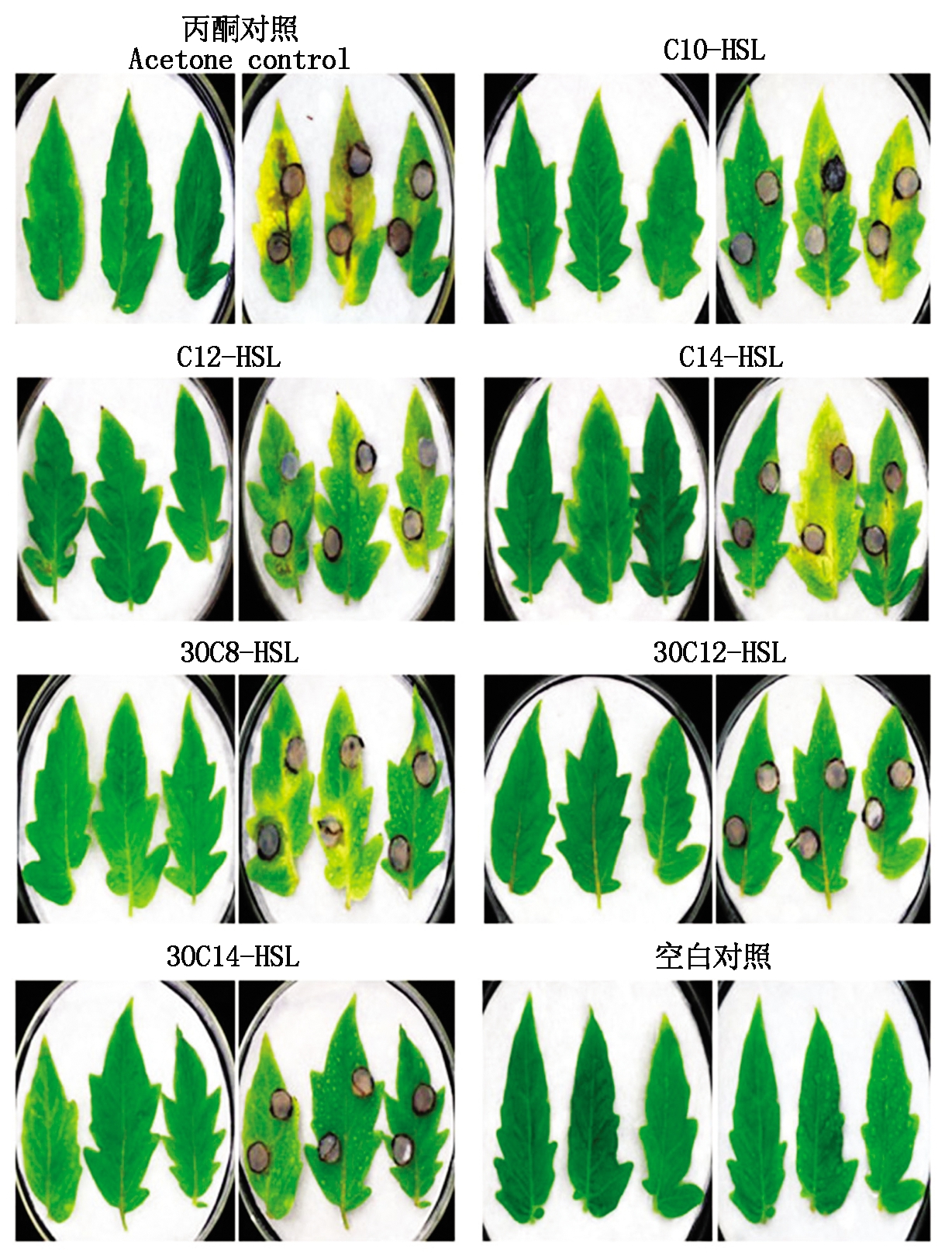
1.2.3 AHLs诱导番茄对灰霉病抗性活体试验 当番茄长到5~6轮叶片时,分别用不同AHLs信号分子C10-HSL、C12-HSL、C14-HSL、3OC8-HSL、3OC12-HSL 和3OC14-HSL(10 μmol/L)均匀喷湿整株植物的所有叶片表面,直到滴水为止,预处理48 h后再用灰霉孢子菌悬液(2×105个/mL)均匀喷湿植株所有叶片,温湿度为25 ℃/80%,丙酮作对照,接菌5 d后观察叶片发病情况,统计番茄叶片发病病情指数。试验设3次重复,每次同一处理设定2盆植株。
1.2.4 病情指数的计算 参照田龙等[19]的方法,番茄灰霉病发病程度分级标准:0级 无病斑;1 级 病斑面积占整个叶面积的 5%以下;3 级 病斑面积占整个叶面积的 6%~15%;5 级 病斑面积占整个叶面积的 16%~25%;7 级 病斑面积占整个叶面积的 26%~50%;9 级 病斑面积占整个叶面积的 50%及以上。采用分级计数法计算病情指数。
病情指数=∑(各级株数×各级级值)/(调查总株数×最高级值)×100%。
在病情指数统计时,包括每次同一处理2盆植株的所有叶片。
1.2.5 总RNA的提取、纯化、cDNA的合成 分别在信号分子3OC14-HSL处理番茄叶片接种灰霉孢子菌悬液的0,1,2,4 d取样,提取植物组织的RNA,进行反转录、PCR、实时荧光定量PCR测定抗病相关基因的表达量。TRIzol法提取总RNA, 提取的RNA进行纯化以及反转录。
基因组去除反应体系:2.0 μL 5×gDNA Eraser Buffer,1.0 μL gDNA Eraser,1.0 μg Total RNA,6.0 μL RNase Free ddH2O;反应条件:42 ℃,2 min。反转录反应体系:10.0 μL 步骤1的反应液,1.0 μL PrimeScript RT Enzyme Mix 1,1.0 μL RT Primer Mix,4.0 μL 5×PrimeScript Buffer 2,4.0 μL RNase Free ddH2O,37 ℃ 15 min,85 ℃ 5 s。
1.2.6 实时荧光定量PCR 实时荧光定量PCR反应体系:反转录得到的cDNA 模板,根据其浓度进行 10~15 倍的稀释。10 μL SYBR Premix Ex Taq,0.8 μL PCR 正向引物,0.8 μL PCR 反向引物,0.4 μL ROX Reference DyeⅡ,5 μL cDNA模板,3 μL ddH2O;反应体系:95 ℃ 10 s;95 ℃ 5 s,60 ℃ 31 s,95 ℃ 15 s,40个循环 。引物如表1所示。
表1 实时荧光定量PCR所用引物
Tab.1 Primers used for Real-time PCR
1.2.7 番茄DAB染色 参考Thordal-Christensen 等[20] 的方法来检测番茄叶片中H2O2 积累情况。在有过氧化物酶存在时,DAB与H2O2反应,会迅速变成红褐色。蛋白质定量后,结合过敏性反应,选择一最适浓度,均匀地轻轻地喷洒于植物叶片表面;剪取叶柄基部,轻轻地浸入DAB染色液(2.5 g/mL)中,避免碰伤叶片的其他部位,于28 ℃下,光照染色8~12 h;将DAB染色液倒干净,加入95%乙醇脱色,直至组织透明;组织透明后,整体拍照;水悬浮叶片,局部镜检,观察死亡细胞。取样3片作为平行处理,试验重复3次。
1.2.8 过氧化氢(H2O2)含量的测定 过氧化氢含量的测定用Solarbio试剂盒测定。取样3片作为平行处理,试验重复3次。
1.2.9 抗病相关酶活性 过氧化物酶(POD)和超氧化物歧化酶(SOD)酶活用Solarbio试剂盒测定。取样3片作为平行处理,试验重复3次。
2 结果与分析
2.1 不同信号分子预处理番茄后对灰霉病抗性效果分析
如图1所示,在AHLs诱导番茄对灰霉病抗性离体试验中,番茄离体叶片在接灰霉菌块5 d后,番茄叶片出现了不同程度的坏死,叶片枯萎、变黄,与菌块交接处有菌丝长出。不同信号分子预处理后的叶片相对于溶剂处理对照表现出了不同的抗性效果,其中用C10-HSL、3OC8-HSL、C12-HSL和C14-HSL预处理后,叶片坏死程度高,与对照叶片发病情况类似,没有明显的抗病效果;而用3OC12-HSL和3OC14-HSL预处理后,与对照组相比,坏死叶片减少,发黄腐烂程度减轻,未看见明显的菌丝繁殖,表现出了明显且稳定的抗性效果。
丙酮对照.丙酮预处理叶片后接菌;C10-HSL、C12-HSL、C14-HSL、3OC8-HSL、3OC12-HSL、3OC14-HSL.相应的信号分子预处理后接菌;空白对照.不进行任何处理,不接菌。
Acetone control. Pre-treating the leaves with acetone before inoculation; C10-HSL, C12-HSL, C14-HSL, 3OC8-HSL, 3OC12-HSL, 3OC14-HSL. Pretreatment with corresponding signal molecules before inoculation; Blank control. No treatment or inoculation.
图1 不同信号分子处理番茄离体叶片接菌5 d后发病情况
Fig.1 The incidence of the disease after 5 days of inoculation of tomato leaves with different signal molecules
在盆栽番茄中,用灰霉孢子悬液喷洒番茄叶片5 d后,不同信号分子处理后的叶片表现出了不同的抗性效果。按照叶片发病程度的轻重划分了0~9级,按照图2-A的发病等级图来统计番茄发病的病情指数。
从图2-B可以看出,番茄叶片在接种灰霉孢子5 d后,用信号分子3OC12-HSL和3OC14-HSL处理的盆栽番茄植株,叶片发病程度与其他处理组差异显著,病情指数显著低于其他处理组,这表明了3OC12-HSL和3OC14-HSL的处理对番茄灰霉菌有显著的抗性效果,但二者差异不显著。结合图1试验结果,信号分子3OC12-HSL 和3OC14-HSL无论是番茄叶片对灰霉抗性的离体试验还是盆栽试验,都表现出了显著且稳定的抗性,二者差异虽不显著,但后者处理组病情指数更低。因此,选用信号分子3OC14-HSL来进行后续的研究。
A.0~9级发病等级图;B.盆栽番茄植株的病情指数。不同小写字母表示处理间差异显著(P<0.05)。图3-5同。
A. Grade chart of grade 0-9; B. Disease index of potted tomato plants. Different lowercase letters indicate significant differences between treatments (P<0.05).The same as Fig.3-5.
图2 不同信号分子处理活体番茄接灰霉菌5 d后的病情指数
Fig.2 Disease index of live tomato treated with different signal molecules for 5 days
2.2 信号分子诱导番茄对灰霉产生抗性依赖于JA信号途径
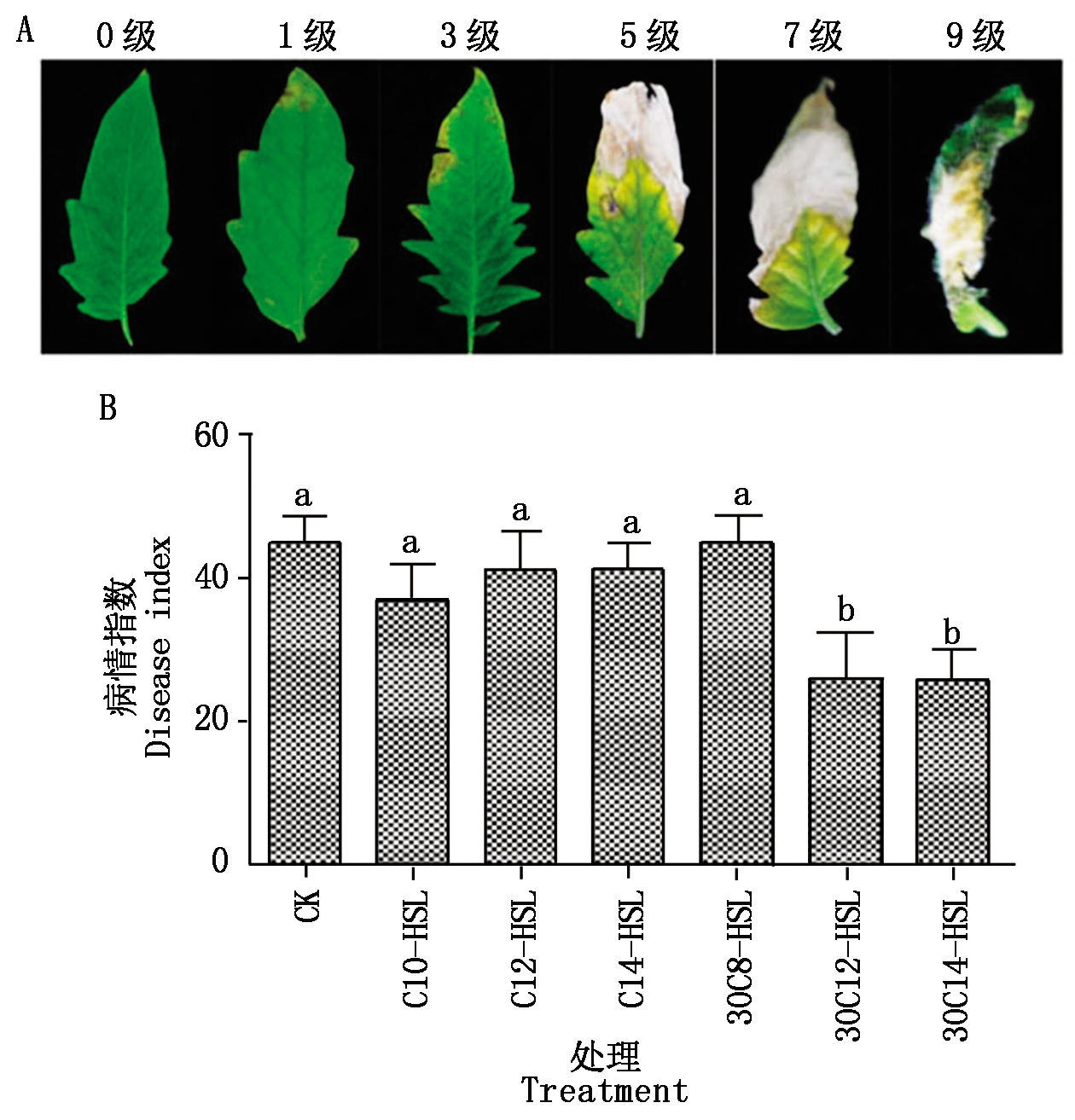
茉莉酸信号通路在植物对灰霉病的抗病信号传导中起重要作用,因此,选用抗性效果最佳的3OC14-HSL预处理盆栽番茄,进行实时荧光定量PCR,检测抗病相关基因的表达变化。从图3可以看出,与空白对照组相比,番茄叶片在接种灰霉孢子1 d后基因NPR1显著上调,PR1、PI2和PI1变化不显著;用3OC14-HSL处理番茄叶片再接灰霉之后,JA信号路径关键基因PI2 和PI1较空白对照、丙酮对照及3OC14-HSL对照均显著上调,而与SA信号路径相关的基因NPR1基因较空白对照显著下调,PR1基因较空白对照变化不显著,但较丙酮对照则显著下调。
选用3OC14-HSL处理番茄再接种灰霉,JA信号通路关键基因PI1、 PI2显著上调,说明JA信号通路参与了番茄和灰霉的互作,3OC14-HSL有可能通过刺激JA信号路径来提高番茄对真菌性病害灰霉的抗性。
CK.不作任何处理,不接菌;3OC14-HSL.3OC14-HSL预处理,不接菌;B.cinerea.丙酮预处理,接灰霉菌;
3OC14-HSL+B.cinerea.3OC14-HSL预处理,接灰霉菌。图4-5同。
CK.No treatment, no inoculation; 3OC14-HSL.3OC14-HSL pretreatment, no inoculation; B. cinerea.Acetone
pretreatment, inoculation; 3OC14-HSL+B.cinerea.3OC14-HSL pretreatment, inoculation.The same as Fig.4-5.
图3 3OC14-HSL处理的番茄在接种灰霉1 d后抗病相关基因表达量的变化
Fig.3 Fold changes in expression of disease resistance-related genes in tomato pretreated
with 3OC14-HSL molecules 1 day after inoculation with Botrytis cinerea
2.3 信号分子处理对活性氧积累的影响
近年来的研究表明,植物和病原菌的相互识别会诱导活性氧(ROS)的产生。活性氧作为新的信号传递激活防卫反应, 氧爆发被认为是抗病过程反应的特征性反应,也是植物对病原物应答的最早期的反应之一[21-22],在植物的抗病性中具有很重要的作用。
在信号分子3OC14-HSL预处理番茄叶片48 h再接种灰霉0,2,4 d后,对其进行了DAB染色及H2O2含量的测定,观察番茄叶片在接种真菌灰霉孢子菌悬液之后活性氧积累的情况。
从图4-A中可以看出,随着接种灰霉孢子时间的增加,叶片活性氧积累能力也在增强。丙酮对照组和测定组与空白对照相比,通过DAB染色检测到有大量的深棕色物质在植物叶肉组织积累,而空白对照没有此现象。而且,用信号分子3OC14-HSL处理过的叶片比对照组有更多的棕色物质积累。
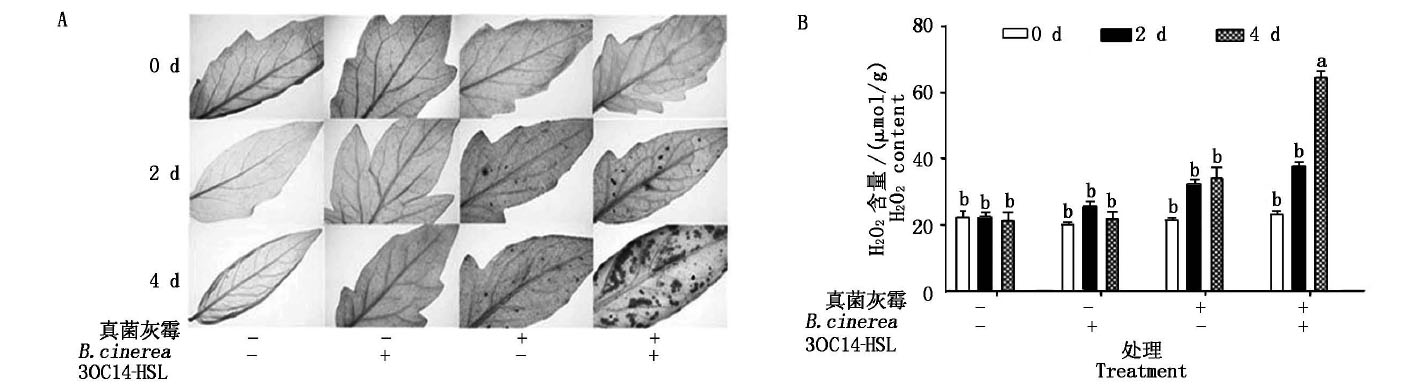
A.番茄叶片DAB染色后在显微镜下观察
拍摄的图片,比例为1∶200PX。
A.The picture taken under the microscope after DAB staining
of tomato leaves, the ratio is 1∶200PX.
图4 3OC14-HSL处理番茄叶片后H2O2积累
Fig.4 H2O2 accumulation in tomato leaves after 3OC14-HSL treatment
从图4-B中可以看出,H2O2含量的变化趋势与DAB染色结果一致。随着接种灰霉孢子时间的增加,叶片中活性氧含量也在增加,丙酮对照组和测定组与空白对照相比,H2O2含量在2 d后有了较大幅度的增加,接菌4 d后测定组H2O2含量可以达到对照组的2~3倍,而空白对照含量没有显著变化。这个结果说明,信号分子3OC14-HSL的处理加速了植物活性氧爆发,加速了对病原菌的抗性应激,这可能对下游抗病信号的传递及植物抗病起到了积极的效果。
2.4 信号分子处理对番茄抗病相关酶活性的影响
植物在逆境下会诱导植物体内活性氧的爆发, 激发植物的抗病反应[23], 但是活性氧的积累会导致细胞膜系统受损伤, 引起植物体内发生一系列的生理生化反应, 造成植物组织受损害。植物的保护反应是植物体内新陈代谢的结果, 其生理反应是通过抗性相关酶催化来实现的。SOD和POD是植物体内重要的防御酶, 能清除活性氧,抵御活性氧及氧自由基对细胞膜系统的损伤, 还能增强植物对病害的抵抗力。SOD和POD活性高低能反映出植物体内抗氧化能力的强弱, 常作为检测植物抗逆性的指标。
如图5所示,番茄叶片内的POD和SOD活性在灰霉菌侵染过程中趋势相似,都是先升高后逐渐降低,其中空白对照和3OC14-HSL对照组的POD和SOD活性随着时间增加都没有显著的变化,丙酮对照和3OC14-HSL处理组都是在接菌2 d后达到峰值,POD和SOD的活性最高,与对照组相比有了显著的提高,且在接菌2 d时这2个处理差异显著;信号分子3OC14-HSL接灰霉菌处理的POD和SOD活性一直高于丙酮对照、空白对照和3OC14-HSL对照。这些结果说明信号分子3OC14-HSL的处理可使番茄在接菌后保持较高的POD和SOD活性。
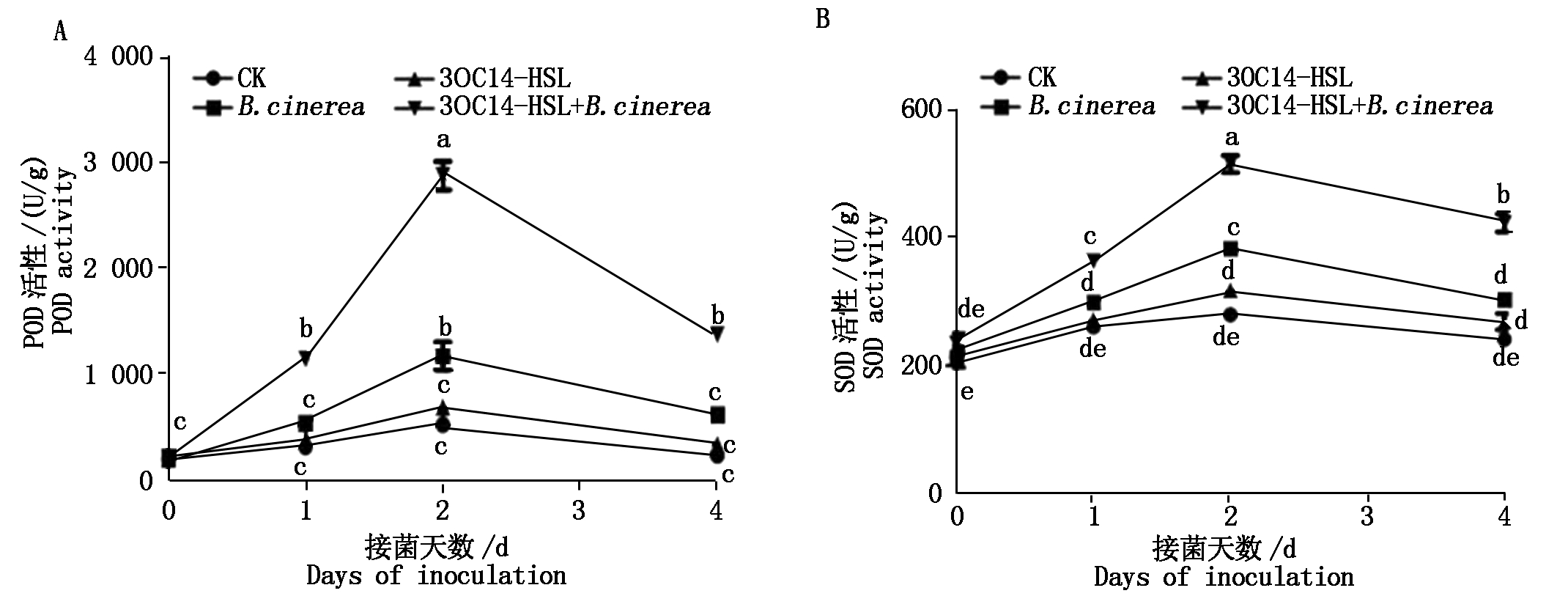
图5 3OC14-HSL处理对酶活性的影响
Fig.5 Effect of 3OC14-HSL treatment on enzyme activity
3 讨论与结论
在植物根际存在着很多产AHLs的革兰氏阴性菌,它们通过合成并释放AHLs作为信号分子来协调群体行为。AHLs具有一个保守的高丝氨酸内酯环和一个长度在4~18个碳原子的酰基侧链。侧链含4~8个碳原子的是短链AHLs,含10~18个碳原子的是长链AHLs。AHLs由其酰基侧链的长度(4~18个碳原子)、酰基侧链的饱和水平及C3位取代基(羰基或羟基)的不同而有不同的功能[24]。
据报道,细菌产生的AHLs在植物系统抗性诱导中发挥重要作用。当植物遭受病原体感染时,3OC14-HSL可以诱导拟南芥和大麦植物对活体营养型和半活体营养型病原菌的抗性[25]。在番茄根际施加产N-丁酰基高丝氨酸内酯(N-butyl-homoserine lactone,C4-HSL)和N-己酰基高丝氨酸内酯(N-hexanoyl-homoserine lactone,C6-HSL)的沙雷氏菌(Serratia liquefaciens)MG1可提高番茄对病原真菌链格孢霉(Alternaria alternata)的系统抗性,而突变株(失去合成AHLs能力)的MG44诱导番茄抗病性的能力明显降低[26]。expR编码草木樨中华根瘤菌(Sinorhizobium meliloti)中AHL受体蛋白。过表达expR的菌株S.meliloti expR+可以产生比其亲本菌S.meliloti Rm 2011更多的3OC14-HSL。用S. meliloti expR+接种拟南芥可以诱导对丁香假单胞菌(Pseudomones syringae DC3000)产生抗性。同样,用S. meliloti expR+处理大麦、小麦和番茄也能诱导对小麦白粉病(Blumeria graminis)、秆锈病(Puccinia graminis)和疫霉(Phytophthora infestans)的抗性[27]。还有研究发现,C10-HSL在对真菌灰霉(B.cinerea)的系统抗性中有积极作用,而且不同的植物受体感知不同的AHLs会触发不同的植物免疫信号通路[28]。最新数据表明,3OC8-HSL可以引发拟南芥细菌感染后的防御反应,而且3OC8-HSL引发的抗病性取决于水杨酸信号通路[29]。在本研究中,通过设置不同酰基侧链长度和不同修饰的信号分子预处理番茄植物叶片,然后接种灰霉,观察在信号分子预处理下,植物叶片的发病情况。通过观察番茄叶片离体表型试验以及统计盆栽试验病情指数,发现不同酰基侧链长度和修饰不同的信号分子对灰霉病抗性效果差异显著。从抗病表型试验结果可以看出,用信号分子3OC12-HSL和3OC14-HSL预处理番茄叶片后,与对照组相比,发黄腐烂程度明显减轻,未看见明显的菌丝繁殖,表现出了明显且稳定的抗性效果,但是这2个信号分子效果差异不显著,相较而言,3OC14-HSL处理组病情指数低于3OC12-HSL处理组,所以选择了3OC14-HSL进行后续的试验探索,而且推测植物能感应不同长度脂肪酸侧链的AHLs,并做出不同的响应,长链的AHLs似乎更有利于增强植物的抗病性。
茉莉酸是一种公认的植物激素,参与植物对病原体的防御机制,植物在感染病原菌后,JA的含量会显著增加[30-33]。在拟南芥上,JA生物合成突变体aos或者JA 转导突变体coi1和pad3大幅度降低了植物对灰霉的抗性[34-35]。用C10-HSL处理番茄后可以提高植物对灰霉的抗性,提高了植物的防御能力,而且这主要是取决于植物JA信号转导途径[27]。PI类基因是用于增强植物对昆虫和病原微生物的防御能力的JA信号标记基因[36]。通过荧光定量PCR分析番茄抗病相关基因的表达,研究在信号分子处理下番茄抵抗灰霉的分子作用机制。从qRT-PCR结果可以看出,3O14-HSL预处理番茄再接种灰霉可以显著上调茉莉酸信号通路中的抗病关键基因PI1、PI2的表达,而响应水杨酸的基因PR1的表达较对照变化不显著,而NPR1则显著下调,这些结果表明,JA信号通路参与了番茄和灰霉的互作,3OC14-HSL有可能通过刺激JA信号路径来提高番茄对真菌病害灰霉的抗性。
有研究表明,接种S.meliloti expR+激发的植物抗病性依赖于植物体内活性氧的过量产生[27]。AHLs预处理的大麦接种白粉病后活性氧爆发,导致过敏反应(Hypersensitive response,HR)水平提高,囊泡形成增多,过氧化物酶HVPRX7基因转录水平提高[37]。本试验中用信号分子3OC14-HSL处理番茄再接种灰霉后发现,3OC14-HSL不仅促进了茉莉酸诱导的活性氧爆发,同时也使番茄叶片接菌后保持较高的POD、SOD活水平,这对植物抗病起到了积极的作用。
综上所述,信号分子3OC14-HSL可以诱导番茄对真菌灰霉的抗性,使得番茄可以抵御灰霉的伤害,而且能诱导植物产生大量的活性氧,使得植物体内保持较高的POD、SOD活性,而且该抗性效果可能与茉莉酸信号路径相关。本研究结果为开发3OC14-HSL作为植物免疫诱抗剂防治农作物重要真菌病害奠定了理论基础。
[1] Bassler B L,Wright M,Showalter R E,Silverman M R.Intercellular signalling in Vibrio harveyi:sequence and function of genes regulating expression of luminescence[J].Mol Microbiol,1993, 9(4):773-786.doi:10.1111/j.1365-2958.1993.tb01737.x.
[2] Fuqua W C, Winans S C, Greenberg E P. Quorum sensing in bacteria: the LuxR-LuxI family of cell density-responsive transcriptional regulators[J]. J Bacteriol, 1994,176(2):269-275.doi:10.1128/jb.176.2.269-275.1994.
[3] Zhao Q, Zhang C, Jia Z H, Huang Y L, Li H L, Song S S. Involvement of calmodulin in regulation of primary root elongation by N-3-oxo-hexanoyl homoserine lactone in Arabidopsis thaliana[J]. Front Plant Sci,2015, 5:807.doi:10.3389/fpls.2014.00807.
[4] Zhao Q, Li M, Jia Z H, Liu F, Ma H, Huang Y L, Song S S.AtMYB44 positively regulates the enhanced elongation of primary roots induced by N-3-oxo-hexanoyl homoserine lactone in Arabidopsis thaliana[J]. Mol Plant Microbe Interact,2016, 29(10):774-785.doi:10.1094/MPMI-03-16-0063-R.
[5] Shenk S T, Schikora A. AHL-priming functions via oxylipin and salicylic acid[J]. Front Plant Sci,2015, 5:784.doi:10.3389/fpls.2014.00784.
[6] 赵芊, 宋水山. N-酰基高丝氨酸内酯调控植物生长发育的研究进展[J]. 植物生理学通讯,2010, 46(10): 980-984.doi:10.13592/j.cnki.ppj.2010.10.005.
Zhao Q,Song S S. Advances in the regulation of plant growth and development by N-acyl-homoserine lactones[J].Plant Physiology Newsletter,2010,46(10): 980-984.
[7] 赵芊, 贾振华, 宋水山. 细菌信号分子N-酰基高丝氨酸内酯调控植物抗性的研究进展[J]. 植物生理学报, 2014,50(2):143-149.doi:10.13592/j.cnki.ppj.2014.02.003.
Zhao Q,Jia Z H,Song S S. Advances in regulation of plant resistance by N-acyl-homoserine lactones,the bacterial quorum-sensing signals[J].Plant Physiology Journal, 2014,50(2):143-149.
[8] Oridi M E,Bouarab K. Plant signalling components EDS1 and SGT1 enhance disease caused by the necrotrophic pathogen Botrytis cinerea[J].New Phytologist,2007,175(1):131-139.doi:10.1111/j.1469-8137.2007.02086.x.
[9] Abramovitch R B,Martin G B. AvrPtoB:a bacterial type Ⅲ effector that both elicits and suppresses programmed cell death associated with plant immunity[J].Fems Microbiology Letters,2005,245(1):1-8.doi:10.1016/j.femsle.2005.02.025.
[10] Bouarab K,Melton R,Peart J,Baulcombe D,Osboutn A.A saponin-detoxifying enzyme mediates suppression of plant defences[J].Nature, 2002,418(6900):889-892.doi:10.1038/nature00950.
[11] Chisholm S T,Coaker G,Day B,Staskawicz B J. Host-microbe interactions:shaping the evolution of the plant immune response[J].Cell, 2006,124(4):803-814.doi:10.1016/j.cell.2006.02.008.
[12] Hann D R,Gimenez-Ibanez S,Rathjen J P.Bacterial virulence effectors and their activities[J].Current Option in Plant Biology,2010,13(4):388-393.doi:10.1016/j.pbi.2010.04.003.
[13] Janjusevic R,Abramovitch R B,Martin G B,Stebbins C E.A bacterial inhibitor of host programmed cell death defenses is an E3 ubiquitin ligase[J].Science,2006,311(5758):222-226.doi:10.1126/science.1120131.
[14] Nomura K, DebRoy S, Lee Y H, Pumplin N, Jones J, He S Y.A bacterial virulence protein supresses host innate immunity to cause plant disease[J].Science,2006,313(5784):220-223.doi:10.1126/science.1129523.
[15] Rigano L A, Payette C, Brouillard G, Marano M R, Abramowicz L,Torres P S,Yun M, Castagnaro A P, Oirdi E M, Dufour V, Malamud F, Dow J M, Bouarab K,Vojnov A A.Bacterial cyclic β-(1,2)-glucan acts in systemic suppression of plant immune responses[J].The Plant Cell, 2007,19(6):2077-2089.doi:10.1105/tpc.106.047944.
[16] Yun M H,Torres P S, Oirdi M E, Rigano L A,Gonzalez-Lamothe R, Marano M R,Castagnaro A P,Dankert M A,Bouarab K,Vojnov A A. Xanthan induces plant susceptibility by suppressing callose deposition[J].Plant Physiology,2006,141(1):178-187.doi:10.1104/pp.105.074542.
[17] Mou Z L, Fan W H, Dong X N. Inducers of plant systemic acquired resistance regulate NPR1 function through redox changes[J].Cell,2003,113(7):935-944.doi:10.1016/s0092-8674(03)00429-x.
[18] 邹庆道,张子君,徐明,李海涛.番茄抗灰霉病材料叶、茎和果实抗性的相关性研究[J].园艺学报,2009,36(S1):1972.
Zou Q D, Zhang Z J, Xu M, Li H T. Studies on the correlation of leaf, stem and fruit resistance of tomato to gray mold resistance materials[J]. Acta Horticulturae Sinica, 2009, 36 (S1):1972.
[19] 田龙,淡昭菊,关迎池.大棚番茄灰霉病流行规律观察试验[J].湖北植保,2017(2):9-11.doi:10.3969/j.issn.1005-6114.2017.02.005.
Tian L, Dan Z J, Guan Y C. Observation and experiment on the epidemic law of tomato gray mold in greenhouses[J]. Hubei Plant Protection, 2017(2):9-11.
[20] Thordal-Christensen H, Zhang Z G, Wei Y D, Collinge D B. Subcellular localization of H2O2 in plants. H2O2 accumulation in papillae and hypersensitive response during the barley-powdery mildew interaction[J]. The Plant Journal,1997,11(6):1187-1194.doi:10.1046/j.1365-313X.1997.11061187.x.
[21] Lamb C, Dixon R A. The oxidative burst in plant disease resistance[J].Annu Rev Plant Mol Biol,1997,48:251-275.doi:10.1146/annurev.arplant.48.1.251.
[22] Wojtaszek P.Oxidative burst:an early plant response to pathogen infection[J].Biochem,1997,322(3):681-692.doi:10.1042/bj3220681.
[23] Thoma I, Loeffler C, Sinha A K, Gupta M, Krischke M, Steffan B,Roitsch T, Mueller M J. Cyclopentenone isoprostanes induced by reactive oxygen species trigger defense gene activation and phytoalexin accumulation in plants[J].The Plant Journal,2003,34(3):363-375.doi:10.1046/j.1365-313x.2003.01730.x.
[24] Hartmann A, Schenk S T, Riedel T, Schröder P, Schikora A.The response of plants toward N-acyl homoserine lactones of quorum-sensing-active bacteria in the rhizosphere[J].Molecular Microbial Ecology of the Rizosphere 1 & 2,2013,73:77-783.doi:10.1002/9781118297674.ch73.
[25] Schikora A, Schenk S T, Stein E, Molitor A, Zuccaro A, Kogel K H.N-acyl-homoserine lactone confers resistance towards biotrophic and hemibiotrophic pathogens via altered activation of AtMPK6[J].Plant Physiol, 2011,157(3):1407-1418.doi:10.1104/pp.111.180604.
[26] Schuhegger R, Ihring A, Gantner S, Bahnweg G, Knappe C,Vogg G, Hutzler P, Schmid M, Breusegem F V, Eberl L, Hartmann A, Langebartels C.Induction of systemic resistance in tomato by N-acyl-L-homoserine lactone-producing rhizosphere bacteria[J].Plant Cell Environ, 2006, 29(5): 909-918.doi:10.1111/j.1365-3040.2005.01471.x.
[27] Zarkani A A, Stein E, Röhrich C R, Schikora M, Evguenieva-Hackenberg E,Degenkolb T, Vilcinskas A, Klug G, Kogel K H, Schikora A. Homoserine lactones influence the reaction of plants to rhizobia[J]. Int J Mol Sci, 2013,14(8):17122-17146.doi:10.3390/ijms140817122.
[28] Hernández-Reyes C, Schenk S T, Neumann C, Kogel K H,Schikora A.N-acyl-homoserine lactones-producing bacteria protect plants against plant and human pathogens[J].Microb Biotechnol, 2014,7(6): 580-588.doi:10.1111/1751-7915.12177.
[29] Hu Z J,Shao S J,Zheng C F,Sun Z H,Shi J Y,Yu J Q,Qi Z Y,Shi K.Induction of systemic resistance in tomato against Botrytis cinerea by N-decanoyl-homoserine lactone via jasmonic acid signaling[J].Planta,2018, 247(5):1217-1227.doi:10.1007/s00425-018-2860-7.
[30] Liu F, Zhao Q, Jia Z H, Song C, Huang Y L, Ma H, Song S S.N-3-oxo-octanoyl-homoserine lactone-mediated priming of resistance to Pseudomonas syringae requires the salicylic acid signaling pathway in Arabidopsis thaliana[J].BMC Plant Biology,2020,20:38.doi:10.1186/s12870-019-2228-6.
[31] Birkennbihl R P, Diezel C, Somssich I E.Arabidopsis WRKY33 is a key transcriptional regulator of hormonal and metabolic responses toward Botrytis cinerea infection[J].Plant Physiol,2012,159(1):266-285.doi:10.1104/pp.111.192641.
[32] Zabala M D T, Zhai B, Jayaraman S, Eleftheriadou G, Winsbury R,Yang R,Truman W,Tang S J, Smirnoff N,Grant M.Novel JAZ co-operativity and unexpected JA dynamics underpin Arabidopsis defence responses to Pseudomonas syringae infection[J].New Phytol,2016,209(3):1120-1134.doi:10.1111/nph.13683.
[33] Zhu Z Q, An F Y, Feng Y, Li P P, Xue L, A M, Jiang Z Q, Kim J M, To T K, Li W, Zhang X Y, Yu Q, Dong Z,Chen W Q, Seki M, Zhou J M, Guo H W. Derepression of ethylene-stabilized transcription factors(EIN3/EIL1) mediates jasmonate and ethylene signaling synergy in Arabidopsis[J]. Proc Natl Acad Sci,2011,108(30):12539-12544. doi:10.1073/pnas.1103959108.
[34] Zhang S, Li X, Sun Z H, Sun S J, Hu L F,Ye M, Zhou Y H, Xia X J, Yu J Q, Shi K.Antagonism between phytohormone signaling underlies the variation in disease susceptibility of tomato plants under elevated CO2[J].Journal of Experimental Botany,2015,66(7):1951-1963.doi:10.1093/jxb/eru538.
[35] Ferrari S, Galletti R, Denoux C, De Lorenzo G, Ausubel F M, Dewdney J.Resistance to Botrytis cinerea induced in Arabidopsis by elicitors is independent of salicylic acid,ethylene,or jasmonate signaling but requires PHYTOALEXIN DEFICIENT3[J].Plant Physiol,2007,144(1):367-379.doi:10.1104/pp.107.095596.
[36] Rowe H C, Walley J W, Corwin J, Chan E K F, Dehesh K, Kliebenstein D J.Deficiencies in jasmonate-mediated plant defense reveal quantitative variation in Botrytis cinerea pathogenesis[J].PLoS Pathog,2010,6(4):e1000861.doi:10.1371/journal.ppat.1000861.
[37] Rehman S,Aziz E,Akhtar W,Ilyas M,Mahmood T.Structural and functional characteristics of plant protecinase inhibitor-Ⅱ(PI-Ⅱ)familiy[J].Biotechnol Lett,2017,39(5):647-666.doi:10.1007/s10529-017-2298-1.
