植物不能主动避害,而自然环境是多变的。为了能够在一定的环境中存活下来,植物在长期的生物进化过程中建立了一定的机制来抵御不良环境,这种机制与胁迫诱导的一系列基因表达改变所引起的生理效应密切相关[1]。首先,非生物胁迫能够引起新蛋白在植物营养组织中积累,该类蛋白被称为逆境胁迫诱导蛋白[2];其次,甘氨酸甜菜碱、脯氨酸、糖醇等低分子量的渗透调节物在胁迫条件下积累,这些改变能够显著提高植物对干旱、高盐和渗透胁迫的适应和耐受能力[3-4]。
晚期胚胎富集蛋白(Late embryogenesis abundant protein,LEA蛋白)被认为是一类与植物抵御非生物胁迫密切相关的蛋白。在胚胎发育晚期的棉花子叶中,Dure等[5]首次分离得到一组mRNA,并且将其命名为lea mRNA,同时还分离得到其翻译产物,即LEA蛋白。随后的研究结果表明该类蛋白在生物体内广泛存在,包括高等植物(大麦、玉米、大豆、水稻等)[6]、苔藓[7]、藻类[8]、蕨类植物、细菌和无脊椎动物[9]。有大量的试验研究结果证实,能够被低温、干旱等非生物胁迫诱导表达的LEA蛋白可以通过结合金属离子、清除活性氧自由基以及保护酶活性和膜系统等方式保护植物的新陈代谢[10],从而增强植物的抗逆性。Battaglia等[11]根据蛋白的亲水性系数和保守结构域等,将LEA蛋白分为7组。然而,随着更多的LEA蛋白被发现,其分类也愈发复杂。基于Dure′s group分类标准,根据LEA基因推导出的氨基酸的相似性至少可以将其分为6组。其中,第3组LEA蛋白具有特征性的11氨基酸基序(FF[E/Q]XFK[E/Q]KFX[E/D/Q]),其第1,2,5和9位为疏水性残基(F),第3,7和11位为带负电荷或氨基的残基(E、D、Q),第6和8位为正电荷残基(K),第4和10位为任何残基(X)。基序拷贝数量和其中残基的多样性决定了第3组蛋白的分子量和序列是多样的。
日本结缕草(Zoysia japonica)是禾本科画眉亚科多年生的暖季型C4草本植物,具有对高温、干旱等多种非生物胁迫耐受能力强的特征,极耐践踏,被广泛建植于运动场、园林、高尔夫球场、庭院和机场中,是较好的固土护坡植物和较为理想的运动场草坪草。揭示结缕草抵御非生物胁迫的分子机制不仅可以指导结缕草的育种工作,而且对其他植物的育种工作也有参考价值。本研究报道结缕草LEA蛋白家族中的一个基因Zjlea3,分析其生物信息学,检测了其在不同逆境胁迫下的表达模式,并且在酵母细胞中对其抗逆功能进行了初步评价,为抗逆研究提供了新的候选基因资源。
1 材料和方法
1.1 试验材料
试验所用材料为日本结缕草Meyer。植物总RNA提取试剂盒、质粒提取试剂盒、琼脂糖凝胶DNA快速回收试剂盒和T-载体(pUM-T)均购自北京百泰克有限公司。T4 DNA连接酶和M-MLV逆转录酶均购自Promega公司。质粒载体pDEST32、酵母AH109菌株和大肠杆菌感受态细胞DH5α由中央民族大学植物分子生物学实验室提供。试验所用引物由上海生工合成及测序,引物序列及用途见表1所示。
表1 引物序列及用途
Tab.1 Sequence and usage of primers

引物名称Primer name引物序列(5'-3')Primer sequences(5'-3')用途UsageP1-FATGGCGTCCAACCAGGACAAGZjlea3基因CDS扩增P1-RGATAGGGCAAGATCGACG-GAACP2-FGCCACTGAGCAGGTGAAGAZjlea3基因荧光定量PCR P2-RTATTGATCCCTGGTGGTGGTactin1-FGATATGCACTTCCCCATGCT内参基因actin1荧光定量PCR actin1-RCGAGCTTCTCCTTGATGTCC
1.2 材料培养及试验处理
在植物培养室内培养试验材料,基质为蛭石∶珍珠岩∶营养土=1∶1∶2的混合物,室内温度为25 ℃/20 ℃(L/D),光强为200 μmol/(m2·s),光周期14 h。对植物材料分别进行低温、干旱和高盐胁迫处理,处理方法参见冯婉倩等[12]的方案。在逆境处理时间分别为2,12,24,72 h时取各处理植株顶端的第1~2片展开叶,于液氮中速冻后保存于-80 ℃冰箱中备用。
1.3 总RNA提取、cDNA合成及Zjlea3基因的克隆
在液氮中将冻存的叶片研磨成粉末状,利用试剂盒提取总RNA。提取的RNA产物分别用1.0%琼脂糖凝胶电泳检测其完整性和NanoDrop 2000超微量分光光度计(美国Thermo公司)检测其浓度。用M-MLV逆转录酶将mRNA反转录为cDNA。试验的具体操作按照试剂盒提供的说明书进行。
以4 ℃处理72 h的cDNA为模板,使用引物对P1来扩增目的基因的编码区序列,扩增产物经1.0%琼脂糖凝胶电泳,用胶回收试剂盒回收PCR扩增产物。Zjlea3基因的克隆方法参见李京等[13]的方案。
1.4 Zjlea3基因生物信息学分析
采用表2中的生物信息学相关软件推测Zjlea3基因编码的氨基酸序列及其理化性质,预测蛋白质的二级结构,进行跨膜区分析和构建系统发育树。
表2 生物信息学分析使用的相关软件及网址
Tab.2 The bioinformatics analysis softwares and website
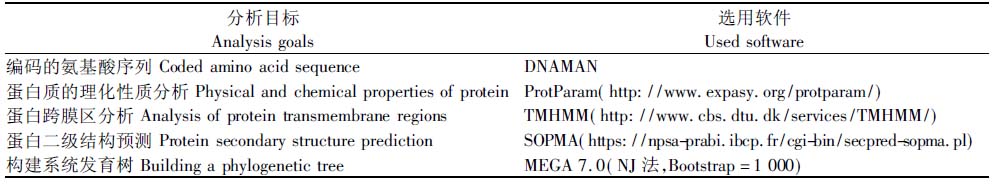
分析目标Analysis goals选用软件Used software编码的氨基酸序列 Coded amino acid sequenceDNAMAN蛋白质的理化性质分析 Physical and chemical properties of pro-teinProtParam(http://www.expasy.org/protparam/)蛋白跨膜区分析 Analysis of protein transmembrane regionsTMHMM(http://www.cbs.dtu.dk/services/TMHMM/)蛋白二级结构预测 Protein secondary structure predictionSOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/secpred-sopma.pl)构建系统发育树 Building a phylogenetic treeMEGA 7.0(NJ法,Bootstrap=1 000)
1.5 逆境胁迫下Zjlea3基因的表达模式
以不同胁迫处理的cDNA为模板,以actin1(NCBI accession No.:GU290545)为内参基因,使用特异性引物对P2、actin1进行荧光定量PCR,检测不同逆境胁迫处理下叶组织Zjlea3基因的相对表达量。反应体系和程序参见Feng等[14]的方案。设定对照组的基因表达量为1,用2-ΔΔCt来表示不同胁迫处理组中目的基因的相对表达量。
1.6 Zjlea3基因转化酵母细胞
改造酵母表达载体pDEST32(图1-A),保留其BD结构域,得到pyeast质粒载体(图1-B),将Zjlea3取代pyeast载体中的BD结构域,得到Zjlea3表达载体pyeastZjlea3(图1-C)。将pyeast(阴性对照)和pyeastZjlea3重组质粒分别转入酵母AH109菌株感受态细胞中,在30 ℃ SD/Leu-(亮氨酸缺陷型培养基)培养基上培养以筛选转化子。
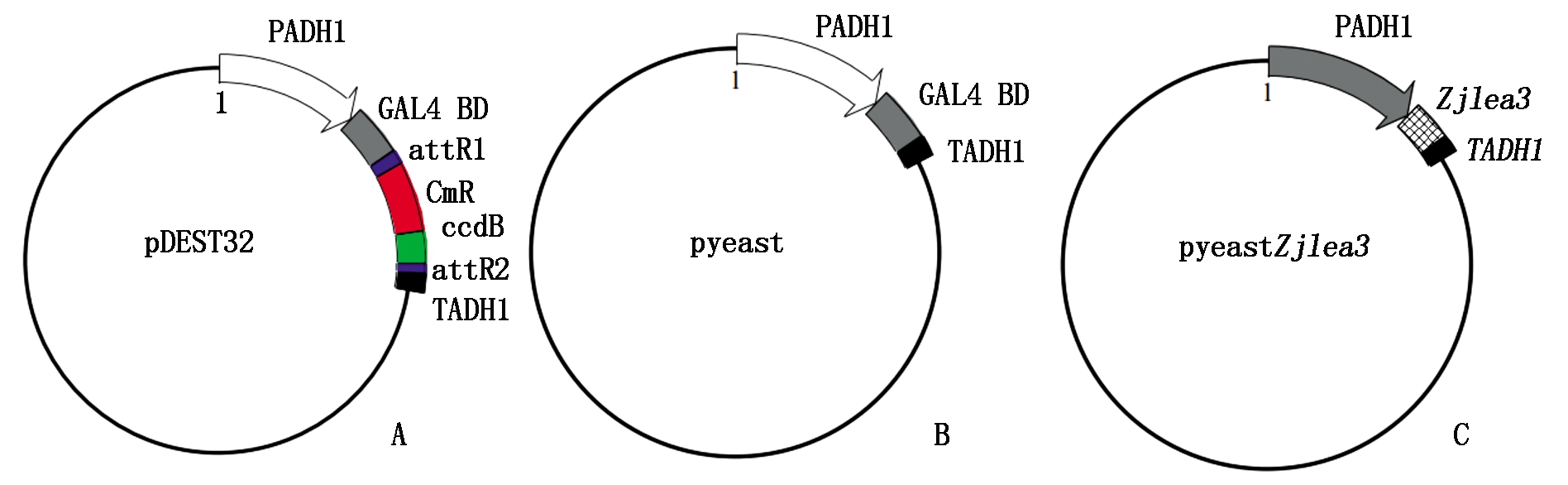
A. 酵母表达载体pDEST32;B. 阴性对照载体pyeast;C. Zjlea3表达载体。PADH1和TADH1分别为酵母乙醇脱氢酶1启动子和终止子,GAL4 BD为酵母GAL4转录因子的DNA结合结构域。
A. Yeast expression vector pDEST32; B. Negative control vector pyeast; C. Zjlea3 expression vector.PADH1 and TADH1 are promoters and terminators of yeast alcohol dehydrogenase 1, respectively,GAL4 BD is the DNA binding domain of yeast GAL4 transcription factor.
图1 酵母表达载体
Fig.1 Yeast expression vectors
1.7 酵母细胞抗逆能力评价
抗冻能力评价是用无菌水制备酵母细胞悬浊液并稀释到合适的浓度,于-20 ℃的低温中分别冷冻处理0(对照),24,48,72 h后,取100 μL涂布在Leu-的固体培养基上,于30 ℃培养,2 d后计菌落数。以未经低温处理(0 h)组的存活率(100%)为参照,计算存活率[1]。抗高盐能力评价是在NaCl浓度分别为0,0.4,0.8,1.2 mol/L的SD/Leu-液体培养基(3 mL)中加入OD600为0.2的酵母菌悬液40 μL,培养24 h后测定OD600的值,根据浑浊度差异评价酵母细胞的耐盐能力。耐高渗能力评价是在培养基中添加浓度分别为0,0.4,0.8,1.2,1.6 mol/L的山梨醇,其他与耐盐评价方法相同。以上试验中的每个处理均设置3个重复。
2 结果与分析
2.1 Zjlea3基因的序列特征
根据前期的转录组数据设计引物对P1,对4 ℃处理72 h的cDNA进行PCR扩增,获得了一条约500 bp的高亮度特异带。经克隆、测序后获得其核酸序列,在NCBI上进行BlastX分析结果显示,该序列与多种植物LEA蛋白家族中的第3组基因高度相似,因而命名为Zjlea3。
Zjlea3基因能够编码177个氨基酸,且其中含有9个拷贝的由11氨基酸组成的基元序列(图2)。Zjlea3蛋白的预测分子质量为18.3 ku,理论等电点(pI)为5.63,且其主要氨基酸组成为丙氨酸(Ala)18.1%、苏氨酸(Thr)13.6%、赖氨酸(Lys)12.4%、谷氨酰胺(Gln)9.0%、甘氨酸(Gly)9.0%、谷氨酸(Glu)8.5%、丝氨酸(Ser)7.3%、天冬氨酸(Asp)7.3%,无半胱氨酸和色氨酸,氨基酸平均亲水性指数(GRAVY)为-1.134,这些结果表明,Zjlea3基因能够编码一个亲水性强的小分子蛋白质。蛋白二级结构预测结果显示,该蛋白的二级结构主要是α-螺旋(Hh)、无规则卷曲(Cc),所占比例分别为78.53%,16.38%,另外2种结构为延伸链(Ee)2.82%、β-折叠(Tt)2.26%(图3)。蛋白跨膜区分析结果表明,Zjlea3蛋白的第1-177位氨基酸均位于细胞膜表面,暗示该蛋白不含有跨膜区,属于非跨膜蛋白(图4)。

阴影部分为Zjlea3基因编码氨基酸序列中的11氨基酸基元序列。
The shaded part is the 11 amino acid motif sequence in the amino acid sequence encoded by Zjlea3 gene.
图2 Zjlea3基因序列特征
Fig.2 Sequence characters of Zjlea3

Hh. α-螺旋;Ee. 延伸链;Tt. β-折叠;Cc. 无规则卷曲;数值代表氨基酸位点。
Hh.α-helix; Ee.Extended strand; Tt.β-turn; Cc.Random coil; The number represents the amino acid position.
图3 Zjlea3蛋白的二级结构预测
Fig.3 Secondary structure prediction of Zjlea3 protein
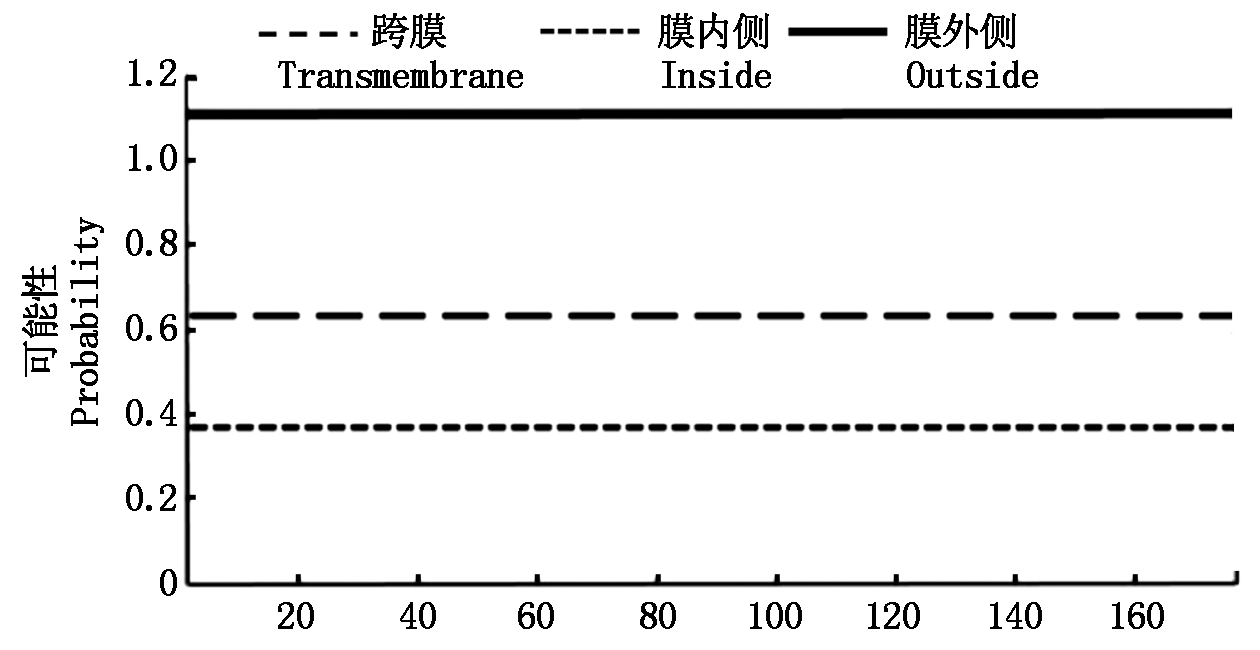
图4 Zjlea3蛋白氨基酸序列跨膜分析
Fig.4 Transmembrane analysis of Zjlea3 protein
2.2 Zjlea3蛋白的系统发育树
在NCBI网站上对Zjlea3基因编码的氨基酸序列进行在线Blast分析,结果显示,与Zjlea3蛋白氨基酸序列相似度最高的前40个蛋白序列来自22个物种,其中数量最多的前2个物种同属于高粱族,为金发草(Pogonatherum paniceum)和高粱(Sorghum bicolor),分别有6,5个同源蛋白。使用Mega 7.0软件对Zjlea3和这40个蛋白质氨基酸序列进行聚类分析,结果表明,Zjlea3蛋白主要与高粱族和小麦族植物聚在一起形成一个分支,在这个分支中还包含能够在冻土中生长的南极发草(Deschampsia antarctica)和能够在干燥环境中生长的冰草(Agropyron cristatum)。Zjlea3蛋白与高粱属(S.Moench)中的3个物种高粱(S.bicolor)、芦苇状高粱(S.arundinaceum)、石茅(S.halepense)的同源蛋白亲缘关系最近,4个蛋白形成一个小分支(图5)。
2.3 Zjlea3基因表达的逆境响应模式
如图6所示,在正常生长条件下,Zjlea3基因仅有少量表达。经4 ℃低温处理2 h后,其表达量呈现上调趋势,在12 h时其表达量进一步积累,随后出现下降,而在72 h时表达量达最大值。在PEG-6000模拟的干旱胁迫处理下,Zjlea3基因的相对表达量出现下降后上调又下降的趋势,且在胁迫处理24 h时表现出显著的上调。在高盐胁迫下,Zjlea3基因的相对表达量则呈现出先降低后上调的趋势,且在处理72 h时达到最高水平。以上结果显示,低温、干旱以及高盐3种非生物胁迫对Zjlea3基因的表达均有不同程度的诱导效应,暗示结缕草Zjlea3基因参与多种逆境胁迫应答,但是对不同逆境胁迫的敏感性有差异。

图5 Zjlea3蛋白的系统进化树分析
Fig.5 Phylogenetic tree analysis of Zjlea3 protein
2.4 Zjlea3基因的抗逆功能
为了解Zjlea3基因在抵御非生物胁迫中的作用,构建了Zjlea3的酵母表达载体pyeastZjlea3并转化到酵母AH109菌株感受态细胞中,在酵母细胞中评价其抗冻、抗高盐以及抗高渗透功能。
对转化了pyeastZjlea3和pyeast(阴性对照)的酵母细胞进行-20 ℃低温处理24,48,72 h后,涂板,统计菌落数,细胞存活情况如图7所示。在低温处理24 h时,含pyeastZjlea3和pyeast的酵母细胞存活率分别为42.25%,17.29%,在低温处理48 h时的存活率分别为25.31%,6.46%。说明2种酵母细胞的存活率随着低温处理时间的延长而逐渐降低,但是在相同处理时间内,转pyeastZjlea3的酵母细胞的存活率均高于转pyeast的酵母细胞,Zjlea3基因具有增强细胞耐受冷冻低温的能力。
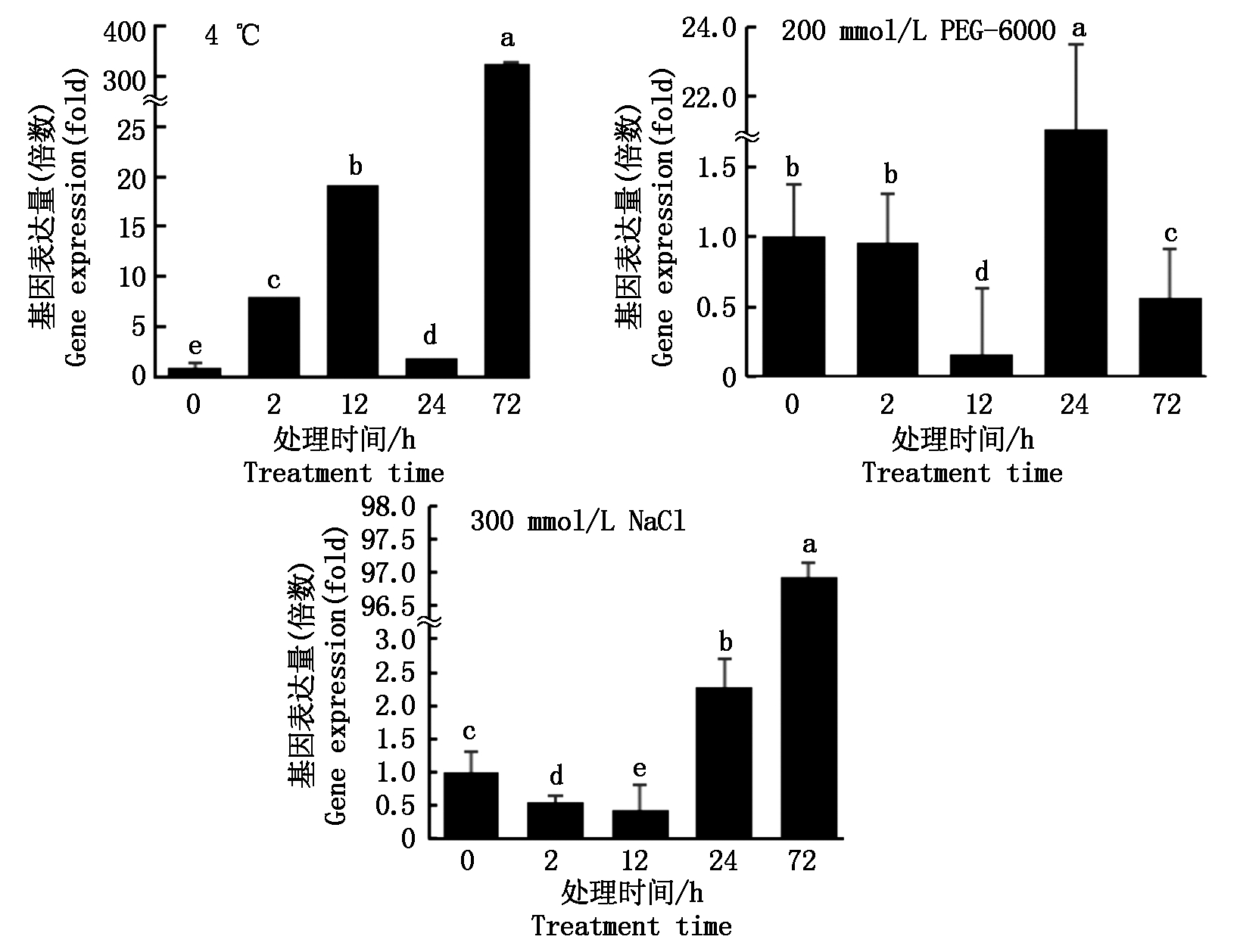
不同小写字母表示0.05水平差异显著(P<0.05)。
Different small letters mean significant difference (P<0.05).
图6 不同逆境胁迫下的结缕草中Zjlea3基因的相对表达量
Fig.6 Relative expression of Zjlea3 gene in Z.japonica under different stresses
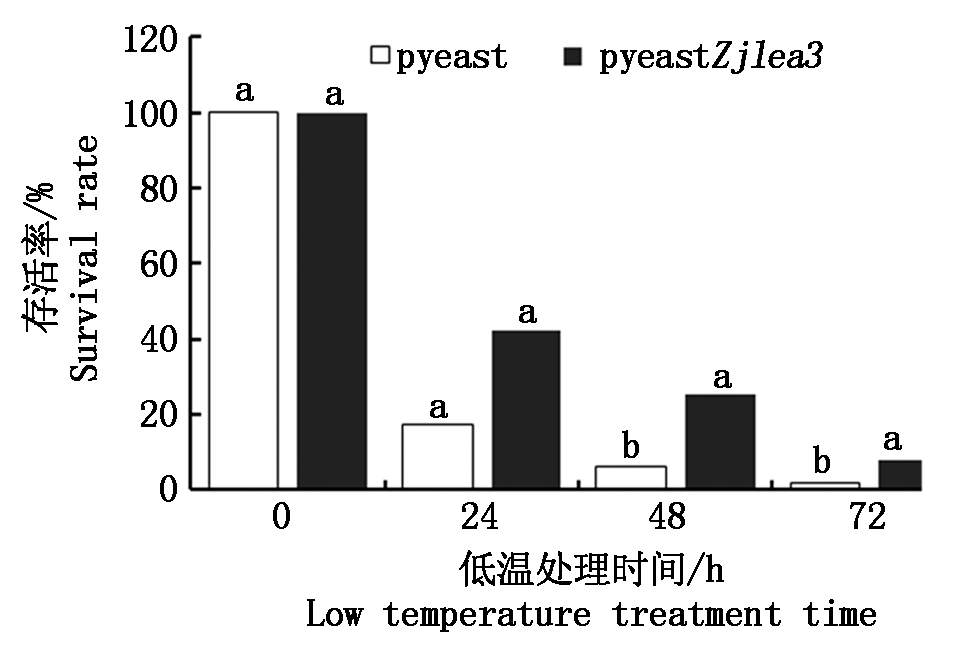
不同小写字母表示pyeast和pyeastZjlea3差异显著(P<0.05)。图8同。
Different small letters indicate significant difference between pyeast and pyeastZjlea3 (P<0.05). The same as Fig.8.
图7 冷冻胁迫后酵母细胞的存活能力
Fig.7 The survival of yeast cells exposed to freezing stress
在含有不同盐浓度的培养基中接种同量的种子菌,培养24 h后测定菌悬液的OD600,结果如图8所示。在盐浓度不超过0.4 mol/L时,2种细胞悬浊液的浊度与对照组差异不显著,说明该条件下酵母细胞均未受到显著胁迫。当NaCl浓度为0.8~1.2 mol/L时,2种细胞悬浊液的浊度均下降,但是相同胁迫条件下含pyeastZjlea3重组质粒的酵母细胞OD600值显著高于载有pyeast质粒细胞的OD600值。说明该条件下2种细胞均受到的胁迫,生长量下降,但是转化Zjlea3基因后增强了对高盐的耐受性,细胞受到的影响小。
在含有不同浓度山梨醇的培养基中振荡培养分别转化了pyeast和pyeastZjlea3的酵母细胞,24 h后测定OD600,结果如图8所示。在不同山梨醇浓度的处理条件下,转化pyeastZjlea3重组质粒的酵母细胞OD600值显著高于转化pyeast的酵母细胞OD600值,且随着山梨醇浓度的增加,2种酵母细胞的OD600值均呈现先上升后降低的趋势。该试验结果表明,Zjlea3基因在抗高渗胁迫过程中也起一定的作用。
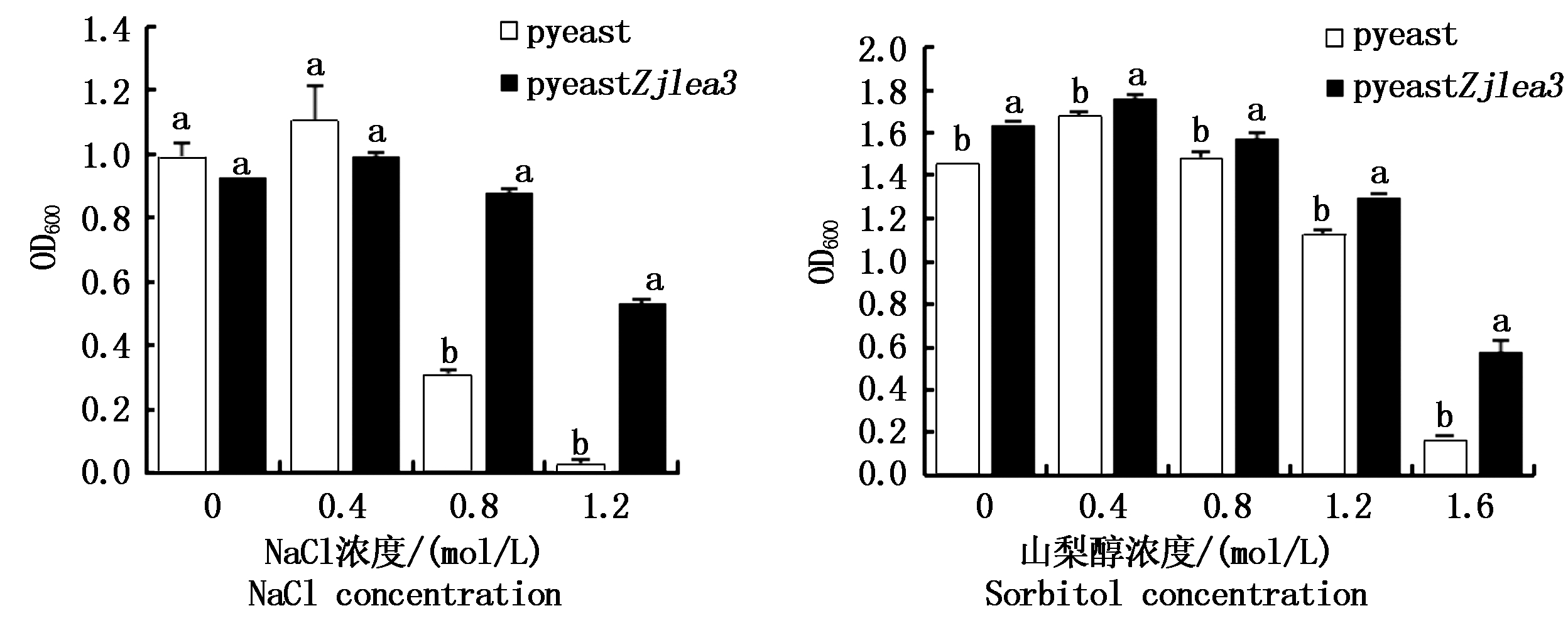
图8 盐、高渗胁迫下酵母细胞的生长量
Fig.8 The growth of yeast cells under salt stress and hypertonic stress
3 结论与讨论
LEA蛋白在抵御干旱、高盐、高渗、冷冻等非生物胁迫中起着关键的作用。结缕草具有较强的逆境耐受性特征,其lea基因的抗逆功能值得研究。本研究报道了结缕草LEA蛋白第3组中的一个基因,命名为Zjlea3。
多数LEA蛋白的相对分子质量较小,为10~30 ku[15],在结构体系上有一定的共性,Cys和Trp残基比率低,而Arg、Lys、Gly、Ala、Thr和Gly比率高,亲水指数大于1,Gly比率大于6%[11]。结缕草Zjlea3基因编码177个氨基酸,Ala、Thr和Lys的含量均大于10%,Gly含量为9.0%,不含Cys和Trp,平均亲水性指数为-1.134,预测分子质量为18.3 ku,属于亲水性强的小分子蛋白质,符合lea3蛋白的特征。
LEA蛋白第3组成员的共同特征是含有多拷贝的11氨基酸基元序列,少则5个,多则可达几十个[16]。本研究报道的Zjlea3蛋白含有9个拷贝的11氨基酸基元序列,这种串联基元序列的重复次数与植物抗逆性的关系尚不清楚。蛋白的二级结构分析显示Zjlea3蛋白的组成结构大部分为α-螺旋(Hh)和无规则卷曲(Cc),该结构特征可能与其抗逆功能相关。高比例的α-螺旋(Hh)结构使蛋白具有一定的流动性和柔性,从而在分子内形成氢键,使蛋白质分子具有无规则卷曲结构,能够在各个方向伸展、拉长和弯曲[6],同时无规则卷曲(Cc)结构有助于与水分子结合,可以作为水分结合蛋白防止细胞内水分的丧失和高浓度的Na+和Cl-对细胞的毒害[17-18],从而能够在细胞受到非生物胁迫时起到保护功能,提高植物的抗逆能力。在Zjlea3蛋白的系统进化树中,Zjlea3蛋白与具有耐高温、抗旱、耐盐碱的高粱、石茅的同源蛋白的亲缘关系最近。结缕草耐高温、干旱和贫瘠,石茅生命力强,生长在山谷、河边或荒野中,高粱具有耐高温、抗旱、抗涝、耐盐碱、耐贫瘠的特点,三者的抗逆特征相似,LEA蛋白基因相似度也最高,推测其同源LEA蛋白与抗逆境胁迫密切相关。
LEA蛋白在非生物胁迫条件下具有保护膜系统、结合金属离子、清除活性氧自由基和保护酶活性的功能[19]。有研究表明,当细胞中水分缺失时,LEA蛋白能够捕捉足够的水分到细胞内,保护细胞免受水分胁迫的伤害,从而降低细胞死亡率[20]。大量的试验结果表明,在逆境胁迫下lea基因转录的mRNA和翻译产生的蛋白可以被大量诱导。例如Liu等[21]发现水分胁迫可诱导玉米中Zmlea3基因表达量上调。转基因研究结果表明,lea3基因表达后可显著增强植株的抗逆能力。Xu等[22]将大麦lea基因HVA1转入水稻后得到转基因水稻植株,该植株的抗旱和抗高盐能力大大提高,转入该基因的转基因烟草和桑树的抗旱和抗盐能力也得到显著增强[23-24]。张妍等[25]研究发现导入大麦lea3基因后获得的转基因水稻植株具有较强的抗旱以及耐盐能力。王瑛等[26]利用基因枪法将大麦的lea3基因导入苜蓿愈伤组织中,获得的转基因植株的耐盐能力得到显著提高。本研究结果显示,结缕草Zjlea3基因表达受低温、高盐和高渗胁迫诱导,这与前人的研究结果一致。与干旱(PEG-6000)和高盐(NaCl)胁迫相比,低温胁迫对Zjlea3基因表达的诱导强度最大,这可能与结缕草对低温敏感相关。在低温胁迫试验中观察到结缕草叶片内卷明显,说明此条件下叶片缺水严重。酵母细胞抗逆试验的研究结果显示,Zjlea3可以增强细胞在冷冻低温条件下的存活率,增强细胞在高渗和高盐(NaCl浓度≥0.8 mol/L)胁迫下的活性,说明该基因具有抗逆功能,可能在结缕草抗逆过程中发挥重要作用。
综上所述,结缕草Zjlea3基因是LEA蛋白家族第3组成员之一,具有抗逆功能。在低温、高盐和干旱逆境胁迫下,结缕草叶组织中Zjlea3基因表达量显著上调,推测该基因与抗逆活动相关。本研究为进一步研究结缕草LEA蛋白与抗逆境胁迫的关系奠定了基础。
[1] 邰付菊. 棉花抗逆相关基因的克隆与功能研究及低温胁迫下棉花蛋白质差异表达分析[D]. 武汉: 华中师范大学,2007.
Tai F J. Cloning and characterization of stress-tolerant genes from cotton and analysis of differential expression of proteins in cotton under cold-stress[D]. Wuhan:Central China Normal University,2007.
[2] 杨天旭,汪耀富,宋世旭,蔡寒玉,高华军. 逆境胁迫下植物LEA蛋白的研究进展[J]. 干旱地区农业研究,2006,24(6):120-124. doi:10.3321/j.issn:1000-7601.2006.06.027.
Yang T X, Wang Y F, Song S X, Cai H Y, Gao H J. A review of plant LEA proteins in adversity stress[J]. Agricultural Research in the Arid Areas,2006,24(6):120-124.
[3] Cushman J C, Bohnert H J. Genomic approaches to plant stress tolerance[J]. Current Opinion in Plant Biology,2000,3(2):117-124. doi:10.1016/S1369-5266(99)00052-7.
[4] Yancey P H, Clark M E, Hand S C, Bowlus R D, Somero G N. Living with water stress: evolution of osmolyte systems[J]. Science,1982,217(4566):1214-1222. doi:10.1126/science.7112124.
[5] Dure L,Chlan C. Developmental biochemistry of cottonseed embryogenesis and germination: XII. purification and properties of principal storage proteins[J].Plant Physiology,1981,68(1):180-186. doi:10.1104/pp.68.1.180.
[6] 刘亚玲, 王俊杰, 云锦凤, 赵彦, 侯永霞. 黄花苜蓿LEA3基因片段克隆与生物信息学分析[J]. 生物技术通报,2011(7):82-87. doi:10.13560/j.cnki.biotech.bull.1985.2011.07.006.
Liu Y L, Wang J J, Yun J F, Zhao Y, Hou Y X. Cloning and bioinformatics analysis of LEA3 gene from wild Medicago falcata[J]. Biotechnology Bulletin,2011(7):82-87.
[7] Saavedra L, Svensson J, Carballo V, Izmendi D, Welin B, Vidal S. A dehydrin gene in Physcomitrella patens is required for salt and osmotic stress tolerance[J]. The Plant Journal,2006,45(2):237-249. doi:10.1111/j.1365-313X.2005.02603.x.
[8] 王梦飞, 滑璐玢. LEA蛋白及其在作物抗逆过程中的作用[J]. 北方农业学报,2018,46(4):70-76. doi:10.3969/j.issn.2096-1197.2018.04.12.
Wang M F, Hua L F. LEA protein and its role in the process of crop resistance[J]. Journal of Northern Agriculture,2018,46(4):70-76.
[9] 王艳蓉, 张治国, 吴金霞. LEA蛋白及其在植物抗逆改良中的应用[J]. 生物技术通报,2015,31(3):1-9. doi:10.13560/j.cnki.biotech.bull.1985.2015.04.001.
Wang Y R, Zhang Z G, Wu J X. LEA protein and its application in improvement of stress tolerance in plants[J]. Biotechnology Bulletin,2015,31(3):1-9.
[10] Hundertmark M, Hincha D K. LEA (Late Embryogenesis Abundant) proteins and their encoding genes in Arabidopsis thaliana[J]. BMC Genomics,2008,9(1):118. doi:10.1186/1471-2164-9-118.
[11] Battaglia M, Olvera-Carrillo Y, Garciarrubio A, Campos F, Covarrubias A A.The enigmatic LEA proteins and other hydrophilins[J]. Plant Physiology,2008,148(1):6-24. doi:10.1104/pp.108.120725.
[12] 冯婉倩, 马礼鹏, 蒋笑笑, 张红, 李玥, 韦善君. 结缕草转录因子基因ZjDREB1.2的克隆及胁迫下的表达分析[J]. 北方园艺,2018(18):75-85. doi:10.11937/bfyy.20180246.
Feng W Q, Ma L P, Jiang X X, Zhang H, Li Y, Wei S J. Cloning and expression analysis of a transcription factor gene ZjDREB1.2 from Zoysia[J]. Northern Horticulture,2018(18):75-85.
[13] 李京, 吴奇, 张琳婕, 李旭婷, 周敏琪, 韦善君. 结缕草转录因子基因ZjDREB4.1克隆和逆境表达模式[J]. 生物技术通报,2017,33(2):80-88. doi:10.13560/j.cnki.biotech.bull.1985.2017.02.012.
Li J, Wu Q, Zhang L J, Li X T, Zhou M Q, Wei S J. Cloning and expression profiles of a transcription factor gene ZjDREB4.1 in Zoysia japonica under adversity[J]. Biotechnology Bulletin,2017,33(2):80-88.
[14] Feng W Q, Li J, Long S X, Wei S J. A DREB1 gene from zoysiagrass enhances Arabidopsis tolerance to temperature stresses without growth inhibition[J]. Plant Science,2019,278:20-31. doi:10.1016/j.plantsci.2018.10.009.
[15] Dure L, Crouch M, Harada J, Ho T H D, Mundy J, Quatrano R, Thomas T, Sung Z R. Common amino acid sequence domains among the LEA proteins of higher plants[J]. Plant Molecular Biology,1989,12(5):475-486. doi:10.1007/BF00036962.
[16] Liu Y, Zheng Y Z. PM2, a group 3 LEA protein from soybean, and its 22-mer repeating region confer salt tolerance in Escherichia coli[J]. Biochemical and Biophysical Research Communications,2005,331(1):325-332. doi:10.1016/j.bbrc.2005.03.165.
[17] Hollung K, Espelund M, Jakobsen K S. Another Lea B19 gene (Group1 Lea) from barley containing a single 20 amino acid hydrophilic motif[J]. Plant Molecular Biology,1994,25(3):559-564. doi:10.1007/BF00043884.
[18] Stacy R A D, Aalen R B. Identification of sequence homology between the internal hydrophilic repeated motifs of Group 1 late-embryogenesis-abundant proteins in plants and hydrophilic repeats of the general stress protein GsiB of Bacillus subtilis[J]. Planta,1998,206(3):476-478. doi:10.1007/s004250050424.
[19] Baker J, Van Dennsteele C, Dure L. Sequence and characterization of 6 Lea proteins and their genes from cotton[J]. Plant Molecular Biology,1988,11(3):277-291. doi:10.1007/BF00027385.
[20] Hitzeman R A, Hagie F E, Levine H L, Goeddel D V, Ammerer G, Hall B D. Expression of a human gene for interferon in yeast[J]. Nature,1981,293(5835):717-722. doi:10.1038/293717a0.
[21] Liu Y, Liang J N, Sun L P, Yang X H, Li D Q. Group 3 LEA protein, ZmLEA3, is involved in protection from low temperature stress[J]. Frontiers in Plant Science,2016,7:1011. doi:10.3389/fpls.2016.01011.
[22] Xu D P, Duan X L, Wang B Y, Hong B M, Ho T H D, Wu R. Expression of a late embryogenesis abundant protein gene, HVA1, from barley confers tolerance to water deficit and salt stress in transgenic rice[J]. Plant Physiol,1996, 110(1):249-257. doi:10.1104/pp.110.1.249.
[23] 李楠, 赵琦, 黄静, 赵玉锦, 张世煌. 六棱大麦HVA1基因在烟草中遗传转化的研究[J]. 生物技术通报,2007(3):139-144. doi:10.13560/j.cnki.biotech.bull.1985.2007.03.031.
Li N, Zhao Q, Huang J, Zhao Y J, Zhang S H. Research on the transformation and expression of HVA1 gene from sixrow barley in tobacco[J]. Biotechnology Bulleyin,2007(3):139-144.
[24] Lal S, Gulyani V, Khurana P.Overexpression of HVA1 gene from barley generates tolerance to salinity and water stress in transgenic mulberry (Morus indica)[J]. Transgenic Research,2008,17(4):651-663. doi:10.1007/s11248-007-9145-4.
[25] 张妍, 王瑛, 梁玉玲, 朱宝成. 转LEA3基因水稻的抗性分析[J]. 河北农业大学学报,2005,28(5):33-36. doi:10.3969/j.issn.1000-1573.2005.05.007.
Zhang Y, Wang Y, Liang Y L, Zhu B C. Analysis of resistance to salt and drought stress of transgenic rice with LEA3 gene[J]. Journal of Agricultural University of Hebei,2005,28(5):33-36.
[26] 王瑛, 朱宝成, 孙毅, 张琳宇, 罗建平. 外源lea3基因转化紫花苜蓿的研究[J]. 核农学报,2007,21(3):249-252,260. doi:10.3969/j.issn.1000-8551.2007.03.011.
Wang Y, Zhu B C, Sun Y, Zhang L Y, Luo J P. Transformation of barely lea3 gene into Alfalfa(Medicago sativa L.)[J]. Journal of Nuclear Agricultural Sciences, 2007,21(3):249-252,260.
