蛋白磷酸酶(Protein phosphatase,PP)是蛋白质可逆磷酸化的关键酶,在植物生长发育和非生物胁迫响应中起着重要的调节作用[1]。2C型蛋白磷酸酶(Protein phosphatase 2C type)是一类单体丝氨酸/苏氨酸残基蛋白磷酸酶,参与生物体多种信号途径[2]。从古菌到高等植物,PP2C在进化上是相对保守的。高等植物中的PP2C较其他生物更具多样性,其蛋白C端具有保守的催化结构域,N端为功能各异的延伸区,广泛参与ABA信号调控、植物生长发育及逆境胁迫应答等信号途径[3-7]。
Xue等[8]对拟南芥和水稻中的PP2C成员进行了全基因组鉴定,分别找到80,78个PP2C成员,并将其分别划分成了13,11个亚组。拟南芥A组的PP2C蛋白(如ABI1和ABI2)主要参与ABA信号转导,通过与ABA受体蛋白结合来调控ABA响应,而B组蛋白能刺激丝裂原活化蛋白磷酸激酶(MAPK)信号,C组蛋白则参与花发育的调控,这表明PP2C是通过不同信号通路调节转录因子的表达来参与植物生长发育和逆境响应的[9-10]。ABA是重要的植物内源激素,在低温、干旱、盐碱等非生物胁迫中具有重要作用。拟南芥中的研究表明,PP2C是ABA信号途径中关键的负调节因子[11-12]。山毛榉中有2个PP2C成员被分离鉴定,其中FsPP2C1在ABA信号途径中为负调控[13],而FsPP2C2基因的拟南芥过表达植株中表现出对ABA信号敏感上升,说明其是ABA信号途径中的正调控因子[14]。
Shazadee等[15]对亚洲棉、雷蒙德氏棉、海岛棉和陆地棉的PP2C家族成员进行了全基因组鉴定,找到的PP2C基因数量分别为87,99,147,181个。qRT-PCR分析其中30个陆地棉GhPP2C基因在非生物胁迫下的表达发现,大部分基因的转录受到高温、低温、干旱和高盐胁迫的诱导,暗示着PP2C基因在棉花非生物胁迫响应中发挥着关键作用。到目前为止,大多数PP2C基因的功能还未得到深入的研究,棉花干旱响应的PP2C基因的研究也少见报道。
本研究依据亚洲棉干旱转录组测序结果,以石系亚1号为材料,克隆到GaPP2C24基因,对其进行了生物信息学特征分析,研究基因的组织表达特性和干旱胁迫下的表达模式,为揭示其干旱响应的分子机制以及棉花抗旱分子育种奠定了理论基础。
1 材料和方法
1.1 试验材料干旱胁迫处理和取样
亚洲棉石系亚1号由河北省农林科学院棉花研究所棉花分子育种研究室种植保存。种子经硫酸脱绒后,直接播种于湿润沙子中,子叶展开后转移到1/2 Hogland营养液中进行水培。培养条件为白天28 ℃,夜晚26 ℃,湿度70%。当植株第2片真叶完全展开时进行17%PEG6000模拟干旱胁迫处理,处理时间为0,1,2,3,5 h。处理后迅速剪取其真叶,液氮速冻,-80 ℃保存。
1.2 GaPP2C24基因克隆
根据本研究室石系亚1号干旱转录组测序获得的PP2C基因序列片段(Cotton_A_12895),利用Primer Premier 5.0设计引物(表1)。以干旱处理2 h的石系亚1号叶片cDNA为模板扩增目的基因。PCR扩增采用TaKaRa公司的PrimeSTAR HS高保真酶,反应体系为50 μL,反应条件参照说明书中三步法进行。PCR扩增产物连接到pEASY-T3克隆载体,转入大肠杆菌Trans1-T1,筛选阳性克隆测序。本研究中引物合成和测序由苏州金唯智生物科技有限公司完成,RNA提取试剂盒购自天根生化科技有限公司,高保真DNA聚合酶、反转录以及荧光定量PCR试剂购自TaKaRa,克隆载体、大肠杆菌感受态细胞购自北京全式金生物技术有限公司。
1.3 GaPP2C24生物信息学分析
多序列比对采用Clustalx 1.83和DNAMAN 8.0软件。系统进化树构建采用MEGA 5.2软件。利用ProtParam tool (https://web.expasy.org/protparam/)分析基因编码蛋白的理化性质;蛋白潜在的磷酸化位点和跨膜域分别采用NetPhos 3.1 Server (http://www.cbs.dtu.dk/services/NetPhos/)软件和TMHMM Server v.2.0 (http://www.cbs.dtu.dk/services/TMHMM/)软件进行在线预测。利用CELLO v.2.5(http://cello.life.nctu.edu.tw/)预测蛋白亚细胞定位情况。分别利用SOPM(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopm.html)和SWISS-MODEL(https://www.swissmodel.expasy.org/interactive)软件在线预测蛋白质序列的二级结构和三级结构。
1.4 GaPP2C24基因表达分析
提取石系亚1号子叶、胚根、下胚轴,3周龄的叶、根、茎等组织以及模拟干旱胁迫处理0,1,2,3,5 h的叶片总RNA,反转录合成第一链cDNA,以第一链cDNA为模板进行qRT-PCR分析。设计GaPP2C24特异引物GaPP2C24-qRT-F和GaPP2C24-qRT-R(表1),以Histone3为内参基因,按照CFX96定量PCR仪(Bio-Rad,USA)说明书进行实时荧光定量PCR(qRT-PCR),3次生物学重复,采用2-ΔΔCT法分析基因相对表达量。
表1 本研究所用引物
Tab.1 Primers used in this study

引物Primer序列(5'-3')Sequence 用途FunctionGaPP2C24-F1TTCACATACCCAAACCTTCT基因克隆GaPP2C24-R1ACTACCAAGTCCCGACCAACGaPP2C24-qRT-FTATGATGGTCACGGTT-GCTCT实时荧光定量PCRGaPP2C24-qRT-RTCCTCCTCACTGGCTA-ACTCTTHistone3-FTCAAGACTGATTT-GCGTTTCCA实时荧光定量PCRHistone3-RGCGCAAAGGTTGGTGTCTTC
2 结果与分析
2.1 GaPP2C24基因全长cDNA的克隆及其编码蛋白的理化性质分析
根据本研究室石系亚1号干旱转录组测序获得的差异表达基因Cotton_A_12895设计PCR特异引物,以石系亚1号叶片cDNA为模板进行PCR扩增,回收目的条带(图1),克隆到pEASY-T3载体上,进行测序分析,测序结果与NCBI上公布的亚洲棉(G. arboreum)PP2C24基因序列(XM_017793991.1)一致,其全长CDS序列大小为1 251 bp,编码416个氨基酸,将其命名为GaPP2C24。
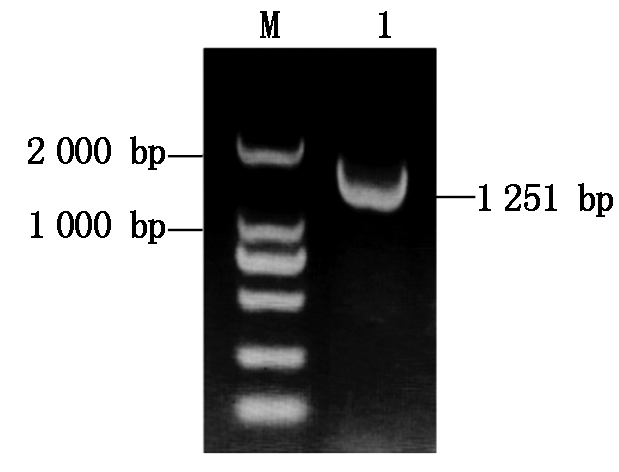
M. DL2000 Marker; 1. GaPP2C24基因。
M.DL2000 Marker;1. GaPP2C24 gene.
图1 GaPP2C24基因的克隆
Fig.1 Cloning of GaPP2C24 gene from Gossypiumarboreum L.
利用ProtParam在线工具分析显示,GaPP2C24基因编码蛋白长度为416个氨基酸残基,蛋白分子量为45.380 54 ku,等电点pI为6.07。平均疏水指数(GRAVY)为-0.332,是亲水性蛋白,不稳定系数46.66,属于不稳定蛋白。Netphos分析蛋白磷酸化位点,发现肽链中Serine磷酸化位点最多。SignalP 4.1 Server检测发现其不含信号肽。TMHMM预测结果表明,该蛋白没有跨膜结构域,为非跨膜蛋白。利用CELLO v.2.5进行亚细胞定位预测,结果显示,该蛋白可能定位于细胞质中。
2.2 GaPP2C24基因编码蛋白的结构预测
SOPM蛋白二级结构分析结果表明,编码该蛋白的139个氨基酸可能形成α螺旋(33.41%),107个氨基酸可能形成延伸带(25.72%),43个氨基酸可能形成β转角(10.34%),127个氨基酸可能形成无规则卷曲(30.53%)(图2)。利用SWISS-MODEL工具进行三维结构预测的结果与二级结构预测结果一致(图3)。
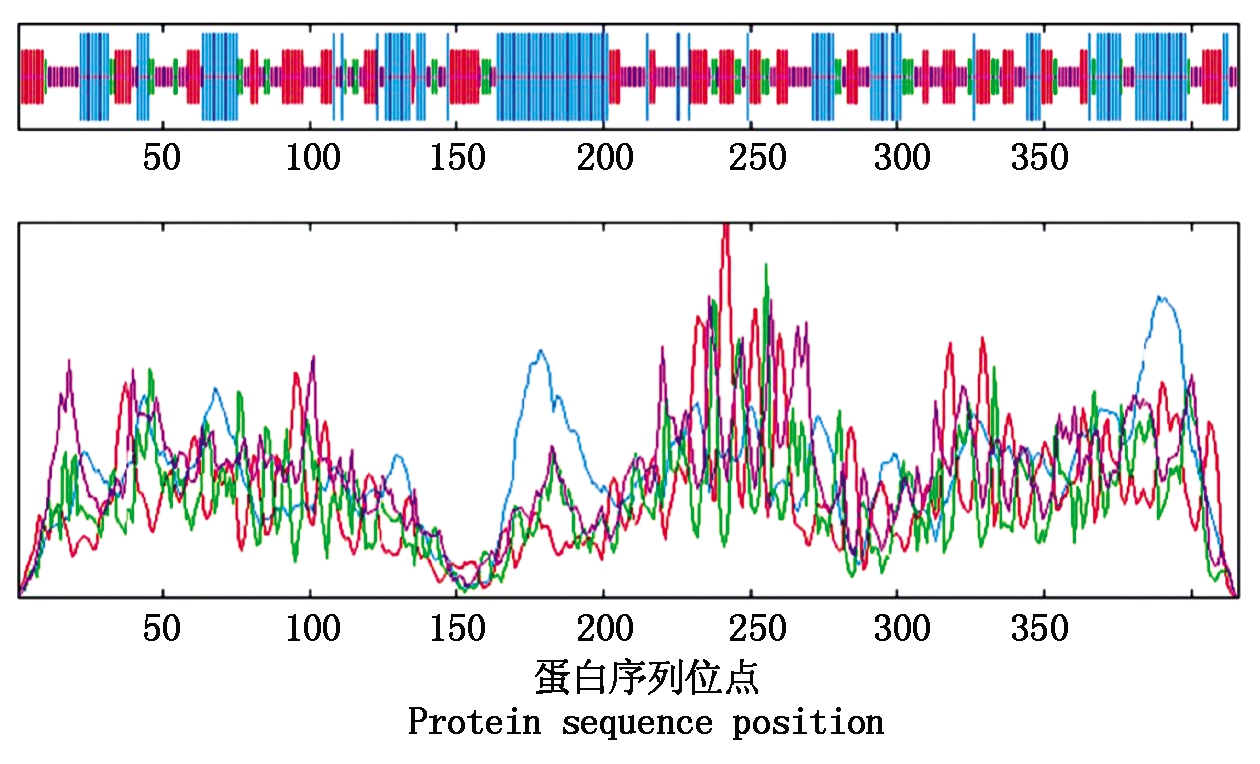
蓝色.α螺旋;红色.延伸带;绿色.β转角;紫色.无规则卷曲。
Alpha helix, extended strand, beta turn and random coil are represented by blue, red, green and purple,respectively.
图2 GaPP2C24蛋白的二级结构
Fig.2 Secondary structure of GaPP2C24 protein
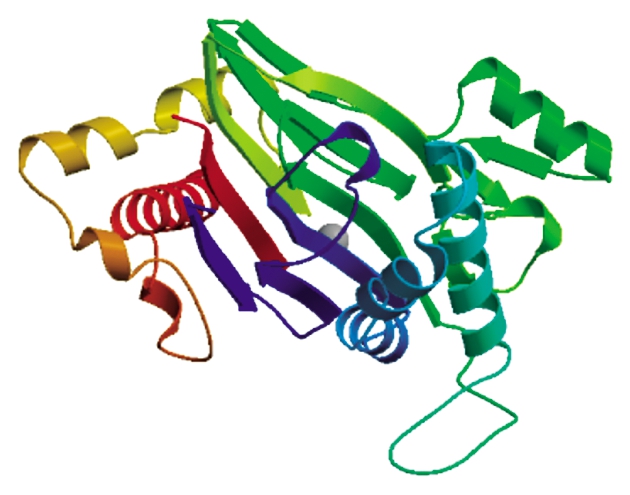
图3 预测的GaPP2C24蛋白的三级结构
Fig.3 The predicted tertiary structure of GaPP2C24 protein
2.3 GaPP2C24蛋白同源性和系统进化分析
将GaPP2C24氨基酸序列提交到NCBI进行BlastP比对,结果表明,GaPP2C24与可可树(EOY33930.1)、黄麻(OMO91132.1)的PP2C蛋白的相似性较高,分别为85%和84%,与拟南芥(NP_172223.1)的相似性为56%。选取可可树(EOY33930.1)、黄麻(OMO91132.1)、枣(XP_015873860.1)、桑树(XP_010106553.1)、甜橙(XP_006488392.1)、葡萄(XP_002282608.1)、胡杨(XP_011032242.1)、麻风树(XP_012066955.1)、烟草(XP_009599862.1)和拟南芥(NP_172223.1)10个代表性物种的PP2C氨基酸序列,与本研究克隆的GaPP2C24进行了氨基酸序列多重比对。结果表明,不同物种来源的PP2C在氨基酸序列上保守性较高(图4)。进化分析表明,本研究克隆的PP2C编码蛋白与黄麻(OMO91132.1)和可可树(EOY33930.1)聚在一支,其中与黄麻(OMO91132.1)的进化距离最近,与拟南芥(NP_172223.1)进化上的亲缘关系最远(图5)。

GaPP2C24.亚洲棉Cotton_A_12895;TcPP2C.可可树EOY33930.1;CoPP2C. 黄麻OMO91132.1;ZjPP2C.枣XP_015873860.1;MnPP2C.桑树XP_010106553.1;CsPP2C. 甜橙XP_006488392.1;VvPP2C. 葡萄XP_002282608.1;PePP2C. 胡杨XP_011032242.1;JcPP2C. 麻风树XP_012066955.1;NtPP2C. 烟草XP_009599862.1;AtPP2C.拟南芥NP_172223.1。
GaPP2C24. Gossypium arboreum Cotton_A_12895;TcPP2C. Theobroma cacao EOY33930.1;CoPP2C. Corchorus olitorius OMO91132.1;ZjPP2C.Ziziphus jujube XP_015873860.1;MnPP2C. Morus notabilis XP_010106553.1;CsPP2C. Citrus sinensis XP_006488392.1;VvPP2C. Vitis vinifera XP_002282608.1;PePP2C. Populus euphratica XP_011032242.1;JcPP2C. Jatropha curcas XP_012066955.1;NtPP2C. Nicotiana tomentosiformis XP_009599862.1;AtPP2C.Arabidopsis thaliana NP_172223.1.
图4 GaPP2C24与不同植物的PP2C氨基酸序列多重比对
Fig.4 Alignment of amino acid sequences of GaPP2C24 and PP2Cs from different plant species

图5 GaPP2C24与其他物种PP2C氨基酸序列的进化树
Fig.5 Phylogenetic tree of GaPP2C24 and PP2Cs from other species
2.4 GaPP2C24基因表达分析
为了解GaPP2C24基因的组织表达特性,以石系亚1号为材料,分析了不同组织中基因的表达变化情况。如图6所示,GaPP2C24在幼苗期的茎和根中表达量较高,分别是萌发期子叶中的3.2,3.0倍。在所有检测的组织中,GaPP2C24在幼苗期叶片中的表达量最低,与其他部位的表达量差异均达到显著水平。
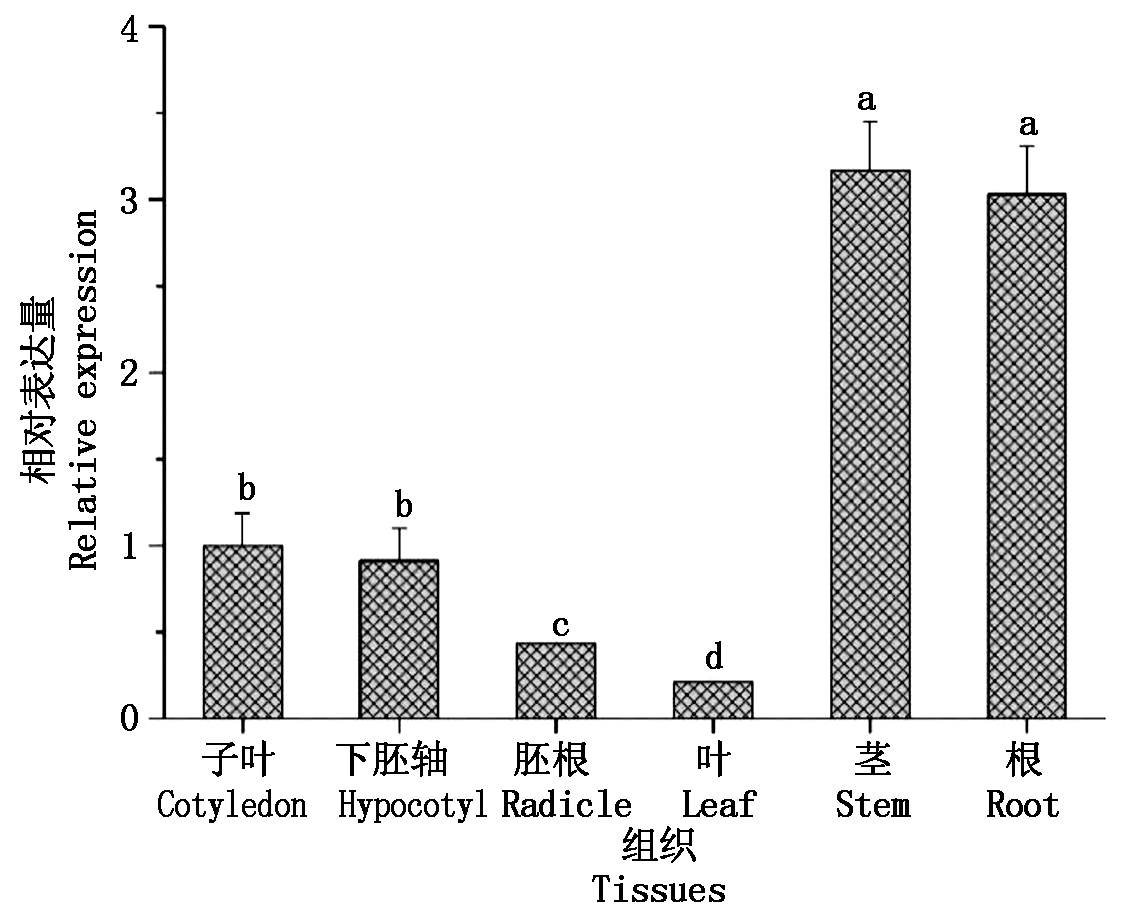
小写字母a、b、c、d表示不同样本之间存在显著差异(P<0.05)。图7同。
a, b, c and d showed significant difference between different samples (P<0.05).The same as Fig.7.
图6 GaPP2C24基因组织表达特性分析
Fig.6 Expression pattern of GaPP2C24 gene in different tissues
以石系亚1号幼苗期干旱胁迫处理不同时间的根、茎和叶为材料,分析GaPP2C24基因在干旱响应中的表达变化情况(图7)。干旱处理后,根和叶中GaPP2C24基因与对照相比均显著上调表达。在干旱处理1 h时,叶和根中GaPP2C24的表达量就达到了最大值,分别为对照的6.9,53.9倍。在干旱胁迫1,2,3 h的根中,该基因的表达量显著增强,分别为对照的53.9,51.6,48.3倍。在干旱胁迫处理1,2,3 h的茎中,该基因的表达也显著上调,且在处理3 h达到最大值,为对照的5.9倍。
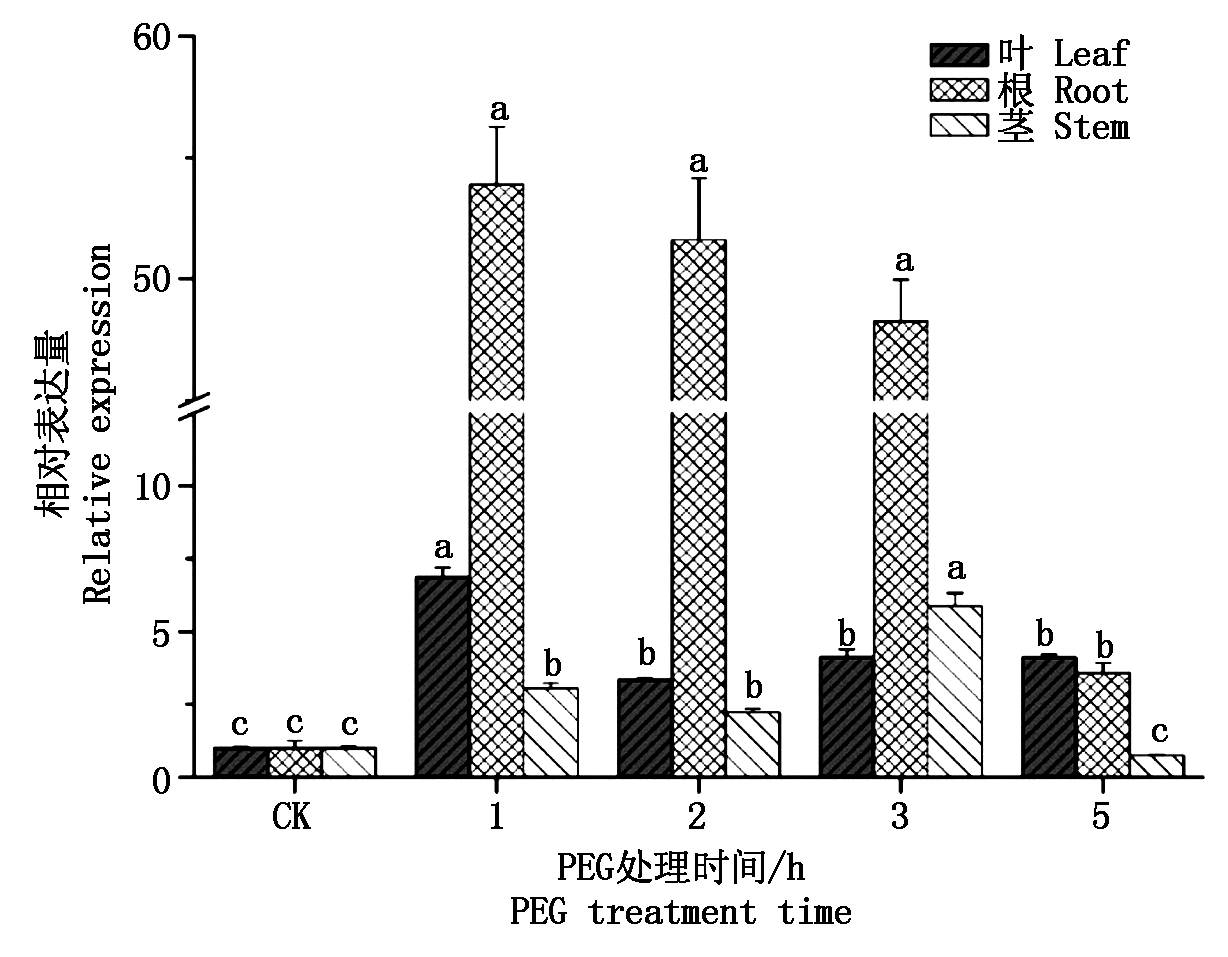
图7 干旱胁迫下石系亚1号叶片中GaPP2C24基因的表达分析
Fig.7 Expression pattern of GaPP2C24 gene in Shixiya-1 leaves under drought stresses
3 讨论
干旱严重影响棉花的产量和纤维品质。目前,与抗旱相关蛋白磷酸酶的研究主要集中在拟南芥、水稻等植物上,与棉花抗旱性有关的蛋白磷酸酶的研究较少。PP2C是一个多基因家族[16-19],在植物中数量众多,具有相对保守的结构特征。在拟南芥中已分离到80个PP2C基因[1,8]。Xue等[8]根据遗传进化关系和功能将拟南芥PP2C基因家族划分为13个亚组(A、B、C、D、E、G、H、I、J、K、L、F1和F2),而水稻PP2C家族基因可以划分成11个亚组(A、B、C、D、E、G、H、I、K、F1和F2)。Shazadee等[15]将鉴定的87个亚洲棉PP2C基因与拟南芥PP2C基因进行了系统进化分析,将亚洲棉PP2C基因分成了11个亚组(A-K)。本研究所克隆的GaPP2C24(Cotton_A_12895)基因属于A亚组。
GaPP2C24基因编码蛋白长度为416个氨基酸残基,分子量为45.380 54 ku,等电点pI为6.07。该蛋白没有跨膜结构域,为非跨膜蛋白,亚细胞定位预测显示,该蛋白定位于细胞质中。通过系统进化分析发现,GaPP2C24蛋白和同是锦葵科的黄麻、可可亲缘关系最近,与拟南芥中的NP_172223.1相似性56%,表明PP2C在进化中相对保守。
大多数的拟南芥A组的PP2C基因表达受到ABA、低温、干旱等多种逆境胁迫的诱导,说明它们在非生物胁迫响应中发挥着重要作用。研究表明,水稻、谷子、花生中A组的PP2C成员也能不同程度地响应ABA、干旱、高盐、低温等非生物逆境胁迫[8,20-21]。本研究对克隆得到的亚洲棉GaPP2C24基因进行了干旱胁迫下的表达分析,发现该基因的表达受干旱胁迫的诱导,这暗示了该基因可能在干旱应答中发挥着重要的作用。
本研究克隆得到一个亚洲棉干旱响应的PP2C基因GaPP2C24,对其进行了组织表达特性和干旱胁迫表达模式分析,这将为后续开展基因功能研究、阐明干旱响应下分子调控机制奠定基础。
[1] Schweighofer A, Hirt H, Meskiene I. Plant PP2C phosphatases: emerging functions in stress signaling [J]. Trends in Plant Science, 2004,9(5): 236-243. doi:10.1016/j.tplants.2004.03.007.
[2] 陈金焕,夏新莉,尹伟伦.植物2C类蛋白磷酸酶及其在逆境信号转导中的作用[J].北京林业大学学报, 2010, 32(5):168-171. doi:10.13332/j.1000-1522.2010.05.004.
Chen J H, Xia X L, Yin W L. PP2C-type protein phosphatases and their functions in stress signaling [J]. Journal of Beijing Forestry University, 2010, 32(5):168-171.
[3] 张继红, 陶能国. 植物PP2C蛋白磷酸酶ABA信号转导及逆境胁迫调控机制研究进展[J].广西植物, 2015, 35(6):935-941. doi:10.11931/guihaia.gxzw201307007.
Zhang J H, Tao N G. Research progress of plant PP2C-type protein phosphatase in ABA signal transduction and adversity stress regulation mechanism [J]. Guihaia, 2015, 35(6):935-941.
[4] 胡晓丽, 李德全. 植物蛋白磷酸酶2C(PP2C)及其在信号转导中的作用[J].植物生理学通讯, 2007, 43(3):407-412.
Hu X L, Li D Q. Protein phosphatase 2C in plants and its functions of signal transduction [J]. Plant Physiology Communications, 2007, 43(3):407-412.
[5] Akimoto-Tomiyama C, Tanabe S, Kajiwara H, Minami E, Ochiai H. Loss of chloroplast-localized protein phosphatase 2Cs in Arabidopsis thaliana leads to enhancement of plant immunity and resistance to Xanthomonas campestris pv. campestris infection [J]. Molecular Plant Pathology, 2018, 19(5):1184-1195. doi:10.1111/mpp.12596.
[6] Ren H, Park M Y, Spartz A K, Wong J H, Gray W M. A subset of plasma membrane-localized PP2C.D phosphatases negatively regulate SAUR-mediated cell expansion in Arabidopsis[J].PLoS Genetics,2018,14(6): e1007455. doi:10.1371/journal.pgen.1007455.
[7] Fuchs S, Grill E, Meskiene I, Schweighofer A. Type 2C protein phosphatases in plants [J]. The FEBS Journal, 2013,280(2):681-693. doi:10.1111/j.1742-4658.2012.08670.x.
[8] Xue T T, Wang D, Zhang S Z, Ehlting J, Ni F, Jakab S, Zheng C C, Zhong Y. Genome-wide and expression analysis of protein phosphatase 2C in rice and Arabidopsis[J]. BMC Genomics, 2008, 9:550. doi:10.1186/1471-2164-9-550.
[9] 杜驰, 张富春.植物蛋白磷酸酶2C在非生物胁迫信号通路中的调控作用[J]. 生物技术通报, 2014, 30(8):16-22. doi:10.13560/j.cnki.biotech.bull.1985.2014.08.003.
Du C, Zhang F C. Protein phosphatases Ⅱ C in plants are involved in abiotic stress tolerance of several signaling pathways [J]. Biotechnology Bulletin, 2014, 30(8):16-22.
[10] Merlot S, Gosti F, Guerrier D, Vavasseur A, Giraudat J. The ABI1 and ABI2 protein phosphatases 2C act in a negative feedback regulatory loop of the abscisic acid signalling pathway [J]. The Plant Journal, 2001, 25(3):295-303. doi:10.1046/j.1365-313x.2001.00965.x.
[11] Tähtiharju S, Palva T. Antisense inhibition of protein phosphatase 2C accelerates cold acclimation in Arabidopsis thaliana[J]. The Plant Journal, 2001, 26(4):461-470. doi:10.1046/j.1365-313x.2001.2641048.x.
[12] Santiago J, Rodrigues A, Saez A, Rubio S, Antoni R, Dupeux F, Park S Y, Márquez J A, Cutler S R, Rodriguez P L. Modulation of drought resistance by the abscisic acid receptor PYL5 through inhibition of clade A PP2Cs[J]. The Plant Journal, 2009, 60(4):575-588. doi:10.1111/j.1365-313x.2009.03981.x.
[13] Gonz lez-García M P, Rodríguez D, Nicolasá C, Rodríguez P L, Nicolás G, Lorenzo O. Negative regulation of abscisic acid signaling bythe Fagus sylvatica FsPP2C1 plays a role in seed dormancy regulation and promotion of seed germination [J]. Plant Physiology,2003, 133(1):135-144. doi:10.1104/pp.103.025569.
lez-García M P, Rodríguez D, Nicolasá C, Rodríguez P L, Nicolás G, Lorenzo O. Negative regulation of abscisic acid signaling bythe Fagus sylvatica FsPP2C1 plays a role in seed dormancy regulation and promotion of seed germination [J]. Plant Physiology,2003, 133(1):135-144. doi:10.1104/pp.103.025569.
[14] Reyes D, Rodríguez D, González-García M P, Lorenzo O, Nicolás G,García-Martínez J L, Nicolás C. Overexpression of a protein phosphatase 2C from beech seeds in Arabidopsis shows phenotypes related to abscisic acid responses and gibberellin biosynthesis [J]. Plant Physiology, 2006, 141(4):1414-1424. doi:10.1104/pp.106.084681.
[15] Shazadee H, Khan N, Wang J J, Wang C C, Zeng J G, Huang Z Y, Wang X Y. Identification and expression profiling of protein phosphatases (PP2C) gene family in Gossypium hirsutum L.[J]. International Journal of Molecular Sciences, 2019,20(6):1395. doi:10.3390/ijms20061395.
[16] Wei K F, Pan S. Maize protein phosphatase gene family: identification and molecular characterization [J]. BMC Genomics, 2014, 15:773. doi:10.1186/1471-2164-15-773.
[17] Cao J M, Jiang M, Li P, Chu Z Q. Genome-wide identification and evolutionary analyses of the PP2C gene family with their expression profiling in response to multiple stresses in Brachypodium distachyon [J]. BMC Genomics, 2016, 17:175. doi:10.1186/s12864-016-2526-4.
[18] Yang Q, Liu K, Niu X C, Wang Q, Wan Y Q, Yang F Y, Li G J, Wang Y F, Wang R G. Genome-wide identification of PP2C genes and their expression profiling in response to drought and cold stresses in Medicago truncatula[J]. Scientific Repprts, 2018, 8:12841. doi:10.1038/s41598-018-29627-9.
[19] Yu X F, Han J P, Wang E F, Xiao J, Hu R, Yang G X, He G Y. Genome-wide identification and homoeologous expression analysis of PP2C genes in wheat (Triticum aestivum L.) [J]. Frontiers in Genetics, 2019, 10:561. doi:10.3389/fgene.2019.00561.
[20] 闵东红, 薛飞洋, 马亚男, 陈明, 徐兆师, 李连城, 刁现民, 贾冠清, 马有志. 谷子PP2C基因家族的特性[J]. 作物学报, 2013, 39(12):2135-2144. doi:10.3724/SP.J.1006.2013.02135.
Min D H, Xue F Y, Ma Y N, Chen M, Xu Z S, Li L C, Diao X M, Jia G Q, Ma Y Z. Characteristics of PP2C gene family in foxtail millet (Setaria italica) [J]. Acta Agronomica Sinica, 2013, 39(12):2135-2144.
[21] 陈冠旭, 秦贵龙, 李恩广, 赵春梅, 乔利仙, 王晶珊, 隋烔明. 花生蛋白磷酸酶2C家族基因的鉴定和盐胁迫响应分析[J].华北农学报, 2018, 33(3): 71-77. doi:10.7668/hbnxb.2018.03.012.
Chen G X, Qin G L, Li E G, Zhao C M, Qiao L X, Wang J S, Sui J M. Identification and salinity stress-responsive analysis of PP2C genes in peanut [J]. Acta Agriculturae Boreali-Sinica, 2018, 33(3): 71-77.
