据报道2017年我国羊肉的产量已达到471.1万t,同2007年的羊肉产量相比已上涨22.1%[1-2]。随着羊肉在我国受欢迎程度不断提高,提高羊肉肉质的口感、鲜度等影响其食用的特征就迫在眉睫。目前,已知肌内脂肪(Intramuscular fat, IMF)沉积对肉质有重要的影响,而IMF沉积又受多种脂肪分化相关基因和信号通路等调控[3]。青藏高原动物遗传资源保护与利用教育部重点实验室山羊脂代谢课题组在前期研究中通过转录组测序发现,Krüppel样因子(Krüppel-like factors, KLFs)家族成员可能在山羊肌内脂肪细胞分化前后存在差异表达,推测其可能发挥重要的调控作用。
KLFs是一个能募集多种调控蛋白来发挥其作用的功能蛋白质家族,目前已发现18个KLFs家族成员[4-6]。在结构组成方面,KLFs家族成员既有高度的保守性,又有高度的可变性。所有的KLFs家族成员在其羧基末端均有3个高度保守的锌指结构域,但研究发现不同的KLFs家族成员的功能结合域则有所差异[5]。KLF1、KLF2、KLF5和KLF7等有与乙酰基转移酶结合的功能结合域;KLF3和KLF12等可能有与CtBP结合的功能结合域;KLF9、KLF10、KLF13 和KLF16等可能有与Sin3A结合的功能结合域[5]。因结构的特异性,KLFs家族蛋白在细胞分化、增殖、凋亡和发育等生命活动过程中也发挥特异的生物学效应[5]。KLF1能够刺激红细胞的生成,KLF2、KLF4、KLF5、KLF7和KLF15等则参与脂肪细胞的分化[5,7]。在细胞凋亡方面,KLF4和KLF6被普遍认为是肿瘤抑制因子[8-9],KLF5则是凋亡抑制因子等[5]。
Krüppel样因子5(Krüppel-like factors 5, KLF5)作为KLFs家族中的一员,目前已发现了多种生物学功能。在细胞增殖方面,KLF5既可通过加速细胞周期中的G1/S和G2/M期,又可通过参与RAS/MAPK、PI3K和Kinase C蛋白等多种生长因子信号通道来促进细胞增殖[5,10]。此外,KLF5还可通过诱导胆管上皮细胞增殖在胆管反应和胆管上皮组织扩展和重建中发挥关键作用,以致使肝脏再生[11]。在治疗疾病方面,KLF5可作为多种疾病的潜在靶向治疗基因。KLF5的沉默表达可通过阻断NF-kB通路抑制人喉表皮样癌细胞的增殖和迁移等来治疗咽喉癌[12]。而KLF5的过表达则可通过PAN抑制足细胞中的ERK/p38 MAP kinase通路来治疗糖尿病、肾病[13]。基于本课题组前期研究,更关注其在脂肪细胞分化中的作用,且有研究者证实 KLF5在3T3-L1分化早期可经C/EBPs β和δ诱导后促进PPARγ2的表达进而促进脂肪细胞分化[14-15]。另一方面,PPARδ激动剂又促进了KLF5的去SUMO化,去SUMO化的KLF5紧接着与转录激活复合体相联系,随后激活复合体激发了脂质氧化基因的表达来促进脂肪细胞分化[16]。但目前为止关于KLF5在山羊脂肪细胞分化中的作用尚未见报道,因此,克隆获得山羊KLF5基因的序列,并明确其组织和细胞表达模式是为了最终阐明其在山羊肌内脂肪细胞分化中的调控作用所必需的基础。
因此,本研究根据GenBank上山羊KLF5基因的预测序列设计引物,通过降落PCR克隆包含完整ORF的山羊KLF5基因序列,通过生物信息学分析获得山羊KLF5基因的生物学特性,通过qPCR等方法构建山羊KLF5基因的组织和细胞时序表达谱。本研究结果将为进一步通过超表达和干扰手段研究功能基因KLF5在山羊肌内脂肪沉积中的具体作用提供重要的基础数据和科学依据。
1 材料和方法
1.1 试验材料
1.1.1 试验材料及取材 4头24月龄的简州大耳羊试验动物由四川省简阳大哥大牧业有限公司提供。经合理屠宰后,采取简州大耳羊的心、肝、脾、肺、肾、背最长肌、皮下脂肪和腹间脂肪等组织用DEPC水清洗后放置于液氮罐中带回实验室使用。山羊肌内前体脂肪细胞由本实验室保存在液氮罐中。
1.1.2 主要试剂 购买于TaKaRa公司的TB GreenTM Premix Ex TaqTMⅡ和TRIzol试剂,购买于ThermoFisher Scientific公司的RevertAid First Strand cDNA Synthesis Kit,购买于天根生化科技有限公司的2×GC-rich PCR Master Mix和琼脂糖凝胶DNA回收试剂盒,购买于擎科生物技术有限公司的pClone007 Versatile Simple Vector Kit和Trelief TM 5α Chemically Competent Cell,购买于美国Sigma公司的DEPC、胎牛血清、DMEM培养基和油酸等。
1.2 试验方法
1.2.1 山羊KLF5基因克隆 以GenBank中山羊KLF5基因预测序列(XM_018056510.1)为模板,利用Primer Premier 5.0软件设计克隆引物(表1)。以山羊肌内脂肪细胞反转录cDNA为模板,通过降落PCR扩增山羊KLF5基因序列。扩增体系:ddH2O 9.5 μL,cDNA模板1 μL,上、下游引物各1 μL,2×GC-rich酶12.5 μL。PCR程序:94 ℃预变性30 s;94 ℃变性30 s,70 ℃退火30 s,72 ℃延伸3 min,10个循环,每1次循环退火温度降低1 ℃;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸3 min,30个循环;72 ℃延伸5 min。将PCR产物用凝胶电泳法验证其大小后切割符合预期大小的凝胶提纯,再取5 μL纯化PCR产物验证提纯效率。将纯化的目的片段与pClone007 VS载体连接,再转化到超级感受态细胞中过夜培养。将菌落PCR阳性结果对应的菌液送往生物技术公司进行测序。测序结果序列用Blast进行对比,检验其是否为目的基因序列。
表1引物信息
Tab.1 The information of primers
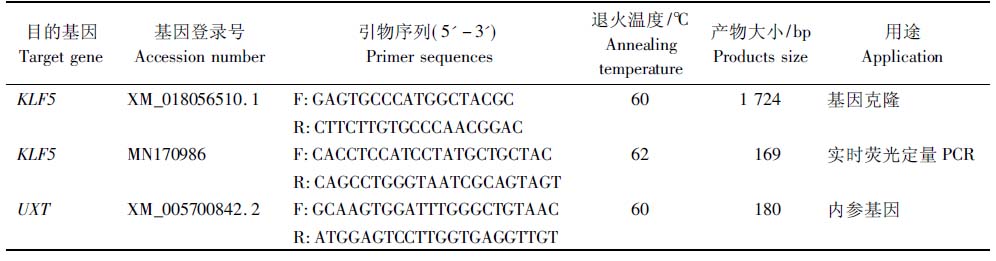
目的基因Target gene基因登录号Accession number引物序列(5'-3')Primer sequences退火温度/℃Annealing temperature产物大小/bpProducts size用途ApplicationKLF5XM_018056510.1F:GAGTGCCCATGGCTACGC601 724基因克隆R:CTTCTTGTGCCCAACGGACKLF5MN170986F:CACCTCCATCCTATGCTGC-TAC62169实时荧光定量PCRR:CAGCCTGGGTAATCGCAG-TAGTUXTXM_005700842.2F:GCAAGTGGATTTGGGCTG-TAAC60180内参基因R:ATGGAGTCCTTGGTGAG-GTTGT
1.2.2 山羊KLF5氨基酸序列分析 用ProtParam分析山羊KLF5蛋白质的理化性质;用NetPhos 3.1 Server和NetNGlyc 1.0 Server等预测山羊KLF5蛋白质的修饰位点;利用SignalP 4.1在线工具预测山羊KLF5蛋白质有无信号肽;用TMHMM对山羊KLF5蛋白质的跨膜域结构进行分析;用PSORT Ⅱ对山羊KLF5蛋白质进行亚细胞定位;利用GOR IV在线工具预测山羊KLF5蛋白质的二级结构;利用SMATR分析山羊KLF5蛋白质的功能结构域;利用SWISS-MODEL在线工具和VMD 1.9.3构建山羊KLF5蛋白质的三级结构;利用STRING交互式数据库分析山羊KLF5蛋白质的互作蛋白;将测序得到的山羊KLF5蛋白质的氨基酸序列在NCBI上同其他物种进行同源性分析;利用MEGA软件以邻接(Neighbor-joining, NJ)法构建KLF5的系统进化树。
1.2.3 构建山羊KLF5基因的组织表达谱 以克隆所得的山羊KLF5基因序列(登录号:MN170986)为模板,利用Primer Premier 5.0软件设计特异性定量引物(表1)。提取山羊心、肝、脾、肺、肾、背最长肌、皮下脂肪和腹间脂肪等组织总RNA,并将其反转录为cDNA作为qPCR模板。利用梯度PCR确定山羊KLF5基因的qPCR引物最适退火温度(表1),使用qPCR技术分别检测山羊KLF5基因和UXT内参基因在上述简州大耳羊组织中的表达量[17]。qPCR体系:ddH2O 7 μL,TB GreenTM Premix Ex TaqTMⅡ 10 μL,上、下游引物各1 μL,组织cDNA 1 μL。qPCR反应程序:预变性95 ℃ 3 min;变性95 ℃ 10 s,退火(KLF5基因:62 ℃; UXT内参基因:60 ℃)10 s,延伸72 ℃ 15 s,38个循环。
1.2.4 山羊肌内前体脂肪细胞的复苏及诱导分化 将本实验室保存的山羊肌内前体脂肪细胞进行复苏,并将其培养传代到F3。当F3细胞融合程度达到80%时,用50 μmol/L的油酸完全培养基进行诱导分化。收取诱导0,1,3,5,6 d的山羊肌内脂肪细胞,提取其总RNA并反转录为cDNA用以后续试验。
1.2.5 构建山羊KLF5基因的时序表达谱 以0,1,3,5,6 d的反转录cDNA为模板,通过qPCR技术用特异性定量引物(表1)来检测山羊KLF5基因在不同诱导分化阶段的肌内脂肪细胞中的表达量。qPCR体系及反应程序如1.2.3所述。
1.3 数据处理及统计
用山羊UXT内参基因的CT值均一化KLF5基因的CT值,并用2-ΔΔCt法对其CT值进行分析。不同山羊组织中KLF5基因的表达显著性通过SPSS 17软件中One-way ANOVA分析的Games-Howell 法检验。KLF5基因在不同诱导分化阶段山羊肌内脂肪细胞中的表达显著性通过SPSS 17软件中LSD法检验。上述检验结果均用GraphPad Prism 8.0绘制其表达谱。
2 结果与分析
2.1 山羊KLF5基因克隆
以山羊肌内脂肪细胞cDNA为模板,通过降落PCR扩增获得山羊KLF5基因序列,获得符合预期大小的凝胶电泳图(图1)。经测序后Blast比对确定该基因为山羊KLF5基因。经分析可知,克隆所得山羊KLF5基因序列为1 735 bp,其中完整的ORF序列1 365 bp(图2),5′UTR序列8 bp和3′UTR序列362 bp。将测序序列上传到GenBank,获得登录号MN170986。
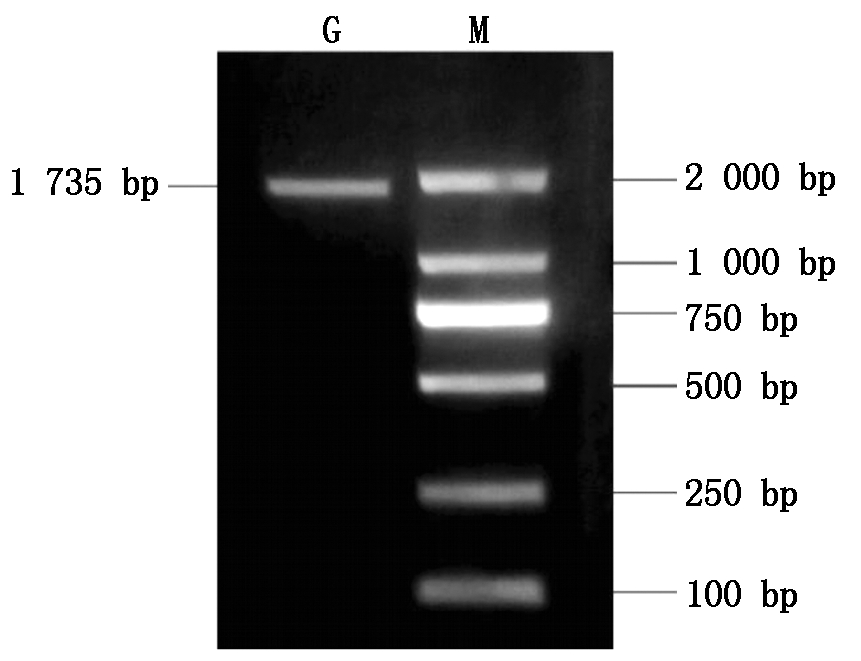
M.DL2000 Marker; G.KLF5基因。
M. DL2000 Marker; G.KLF5 gene.
图1 山羊KLF5基因的降落PCR产物电泳
Fig.1 The electrophoresis diagrams of Touchdown PCR product of goat KLF5
2.2 山羊KLF5氨基酸序列分析
2.2.1 山羊KLF5理化性质分析 山羊KLF5蛋白由454个氨基酸组成,可知其带正电荷的赖氨酸和精氨酸残基较多,有42个,而带负电荷的谷氨酸和天冬氨酸残基只有36个。由于带正电荷的氨基酸多于带负电的氨基酸,因此,山羊KLF5蛋白带正电。此外,山羊KLF5蛋白质分子式为C2236H3476N634O658S22,分子量大小是50.473 ku,理论等电点为8.76,不稳定指数为71.12,平均亲水系数为-0.611,所以山羊KLF5是不稳定亲水性蛋白质。

六边形.丝氨酸磷酸化位点;星形.苏氨酸磷酸化位点;圆形.酪氨酸磷酸化位点;实线框.低复杂结构域;阴影框.C2H2锌指结构域。
Hexagons.Serine phosphorylation sites;Stars.Threonine phosphorylation sites ;Circles.Tyrosine phosphorylation sites; The solid line boxes.Low complexity domains;Shadow boxes.C2H2 zinc finger domains.
图2 山羊KLF5基因的ORF序列及推断的氨基酸序列
Fig.2 The sequences of ORF and deduced amino acid of KLF5 in goat
2.2.2 山羊KLF5蛋白的修饰位点 山羊KLF5蛋白经分析可知其含有丰富的磷酸化位点(图2),并且还有34个O-糖基化位点和2个可能存在的N-糖基化位点。
2.2.3 山羊KLF5蛋白信号肽、跨膜结构域和亚细胞定位分析 经分析可知,山羊KLF5蛋白无信号肽和跨膜结构域,预测结果说明,山羊KLF5蛋白主要在细胞核(78.3%)内发挥功能(图3-A)。
2.2.4 山羊KLF5蛋白的结构特征与互作蛋白预测 分析山羊KLF5蛋白的二级结构组成可知较多的氨基酸组成无规卷曲,其余氨基酸分别组成α螺旋和延伸链(图3-B)。在结构域方面,山羊KLF5蛋白在其氨基酸第370-394位,第400-424位,第430-452位上分别具有1个高度保守的C2H2锌指结构域(图2)。此外,山羊KLF5蛋白质还有4个可能存在的低复杂度结构域(图2)。山羊KLF5蛋白的羧基端三级结构由3个α螺旋等组成(图3-C)。在蛋白互作方面,可知CCAAT增强子结合蛋白α(CCAAT/enhancer binding protein alpha,C/EBPα)和CCAAT增强子结合蛋白β(CCAAT/enhancer binding protein beta,C/EBPβ)可能对山羊KLF5蛋白起正调节作用(图3-D)。
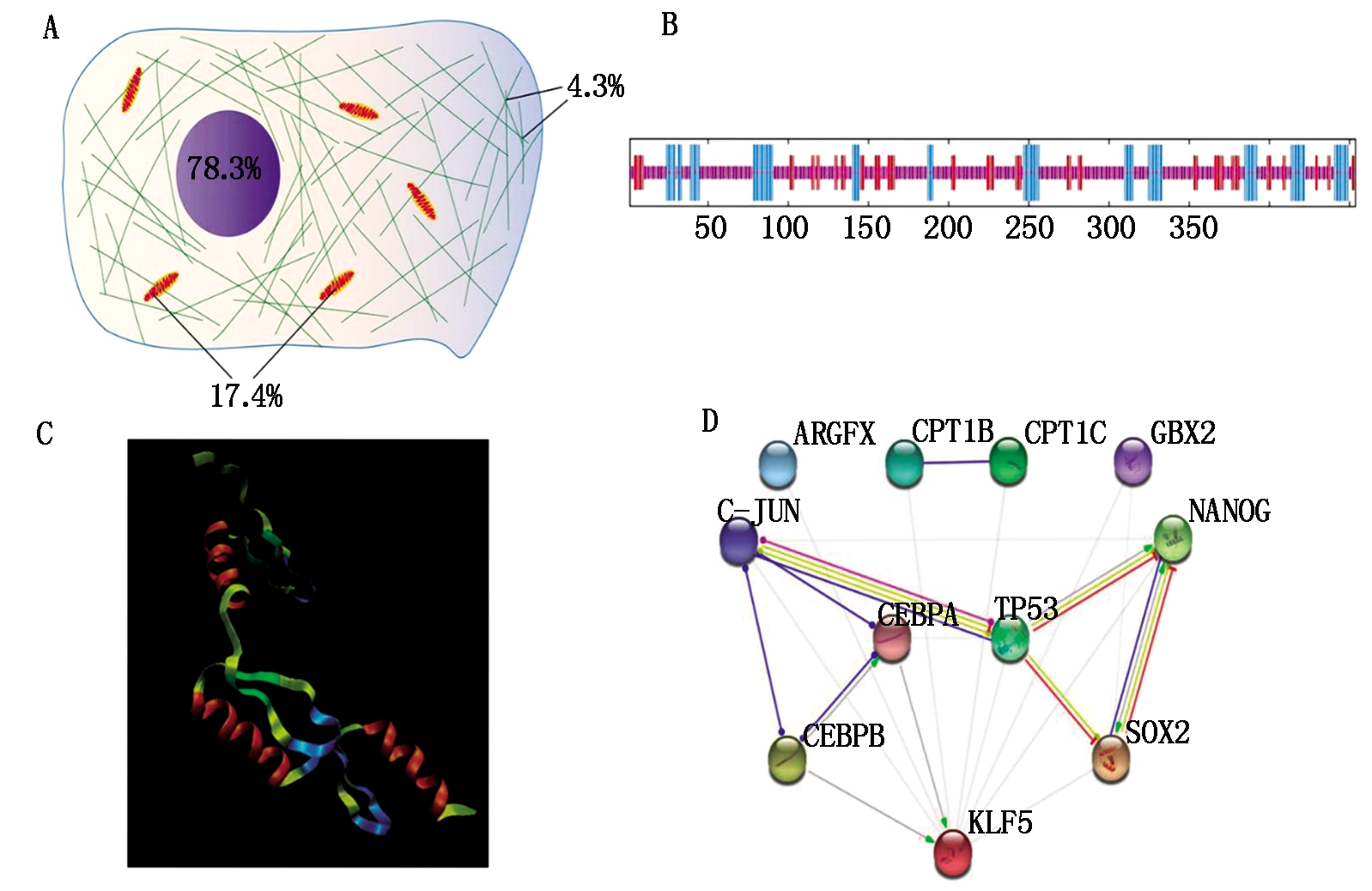
A.山羊KLF5蛋白的亚细胞定位预测:细胞核78.3%;线粒体17.4%;细胞骨架4.3%;B.山羊KLF5蛋白的二级结构预测:垂直线由长到短分别为α螺旋、延伸链和无规卷曲;C.山羊KLF5蛋白羧基端三级结构预测:由第362-454 位氨基酸预测所得;D. 山羊KLF5蛋白相互作用分析:绿色箭头.正向活化反应;蓝色圆形.未知结合;红色矩形.负向抑制作用。
A. The predicted subcellular localization of KLF5 protein in goat: Nuclear 78.3%; Mitochondrial 17.4%; Cytoskeletal 4.3%; B.The predicted secondary structure of goat KLF5 protein: The vertical lines from the longest to the shortest in order indicated that the α-helices, extended strands and random coils, respectively; C. The predicted tertiary structure of goat KLF5 protein: Base on 362th-454th amino acid; D. Interaction analysis in KLF5 protein of goat: Green arrows.Positive activation; Blue rotundities.Unspecified binding; Red rectangles. Negative inhibition.
图3 山羊KLF5蛋白的亚细胞定位、结构特征和互作蛋白预测
Fig.3 The predicted subcellular localization, structural features and interaction proteins in KLF5 protein of goat
2.3 山羊KLF5基因组织表达谱的构建
组织表达谱检测结果显示,山羊KLF5基因在被检测的组织中均有表达,但在肺中相对表达量最高,显著高于检测的除腹间脂肪外的其他组织(P<0.05)(图4)。
2.4 山羊KLF5氨基酸的同源性及系统进化树分析
经Blast比对可知山羊KLF5氨基酸序列与绵羊的同源性最高(图5-A)。以NJ法构建系统进化树,结果也证明山羊和绵羊的KLF5氨基酸序列的亲缘关系最近(图5-B)。
2.5 山羊KLF5基因时序表达谱的构建
通过时序表达谱可知,山羊KLF5基因在肌内脂肪细胞诱导分化第3天和第5天中的表达量均与第0天和第1天的表达量差异显著(P<0.05),且其表达量在诱导分化第5天时达到峰值(图6)。
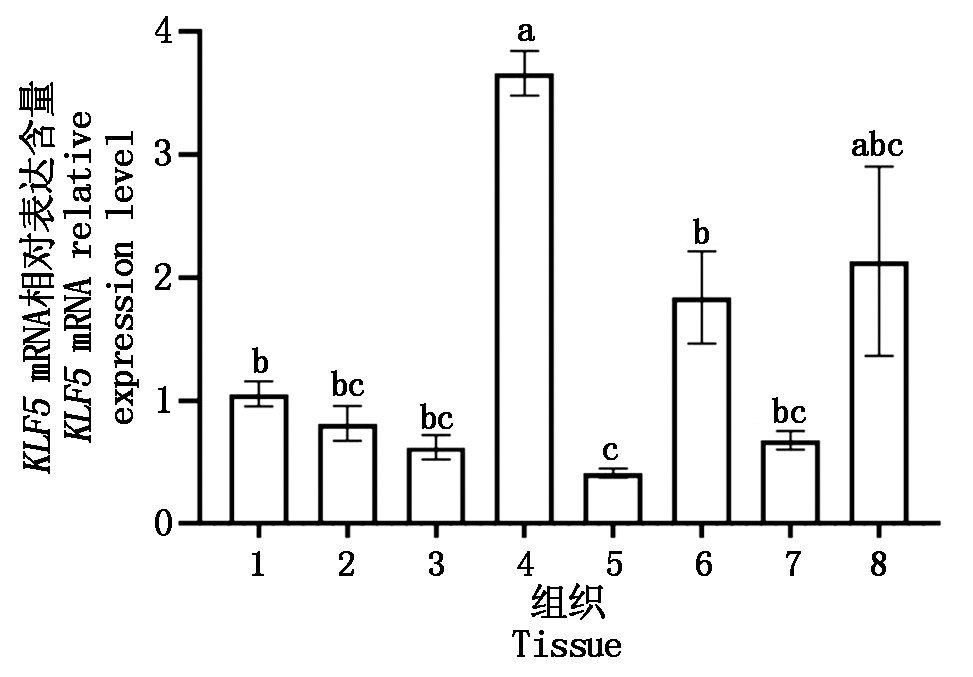
1.心;2.肝;3.脾;4.肺;5.肾;6.背最长肌;7.皮下脂肪;8.腹间脂肪。不同小写字母表示差异显著(P<0.05);相同字母表示差异不显著(P>0.05);n=4。图6同。
1.Heart;2.Liver;3.Spleen; 4.Lung; 5.Kidney; 6.Longissimus dorsi; 7.Subcutaneous fat ; 8.Abdominal fat. Different lowercase letters showed significant difference (P<0.05);No obvious difference is indicated by the same letters (P>0.05); n=4.The same as Fig.6.
图4 山羊KLF5基因的组织表达谱
Fig.4 Tissue expression profile of KLF5 in goat
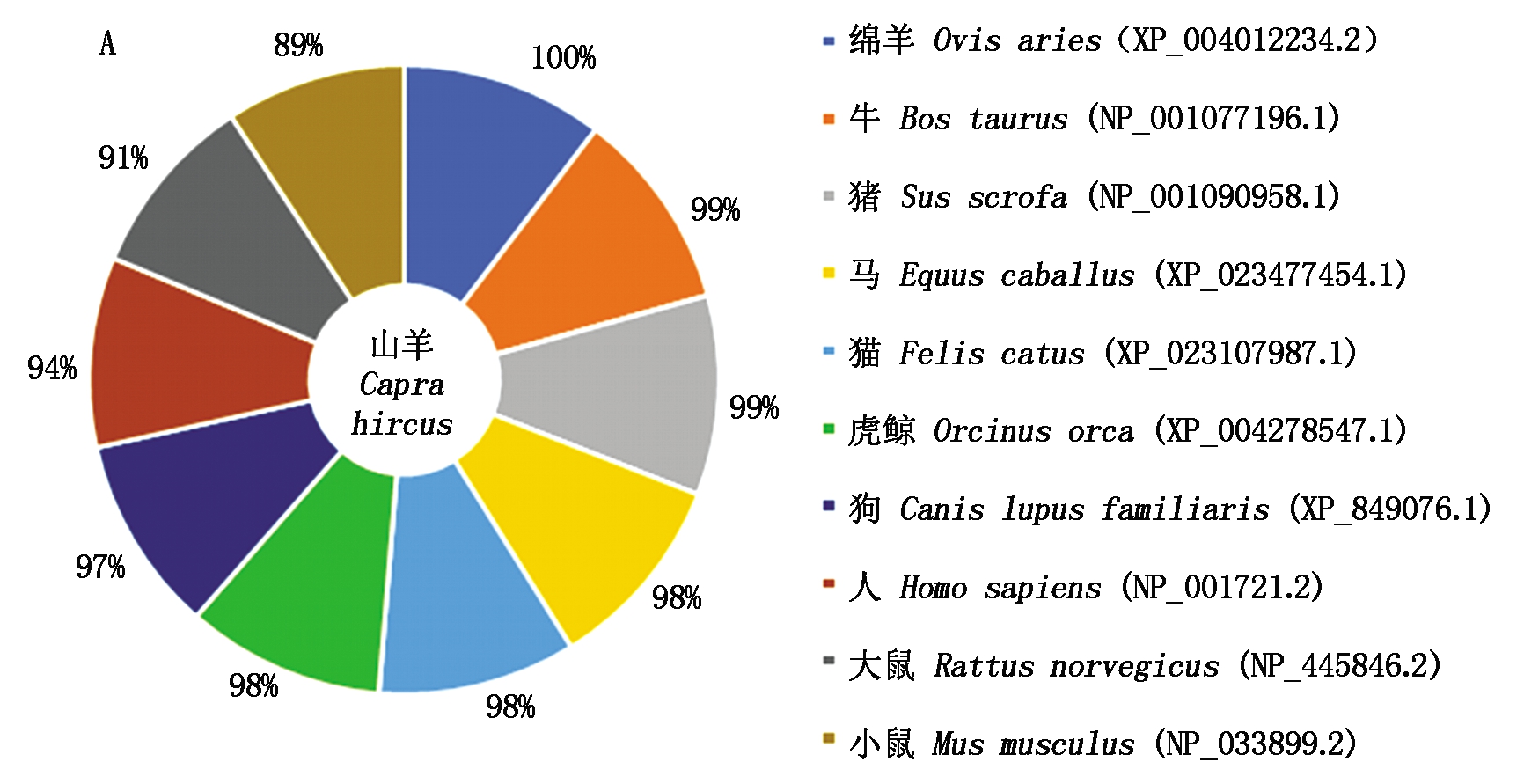
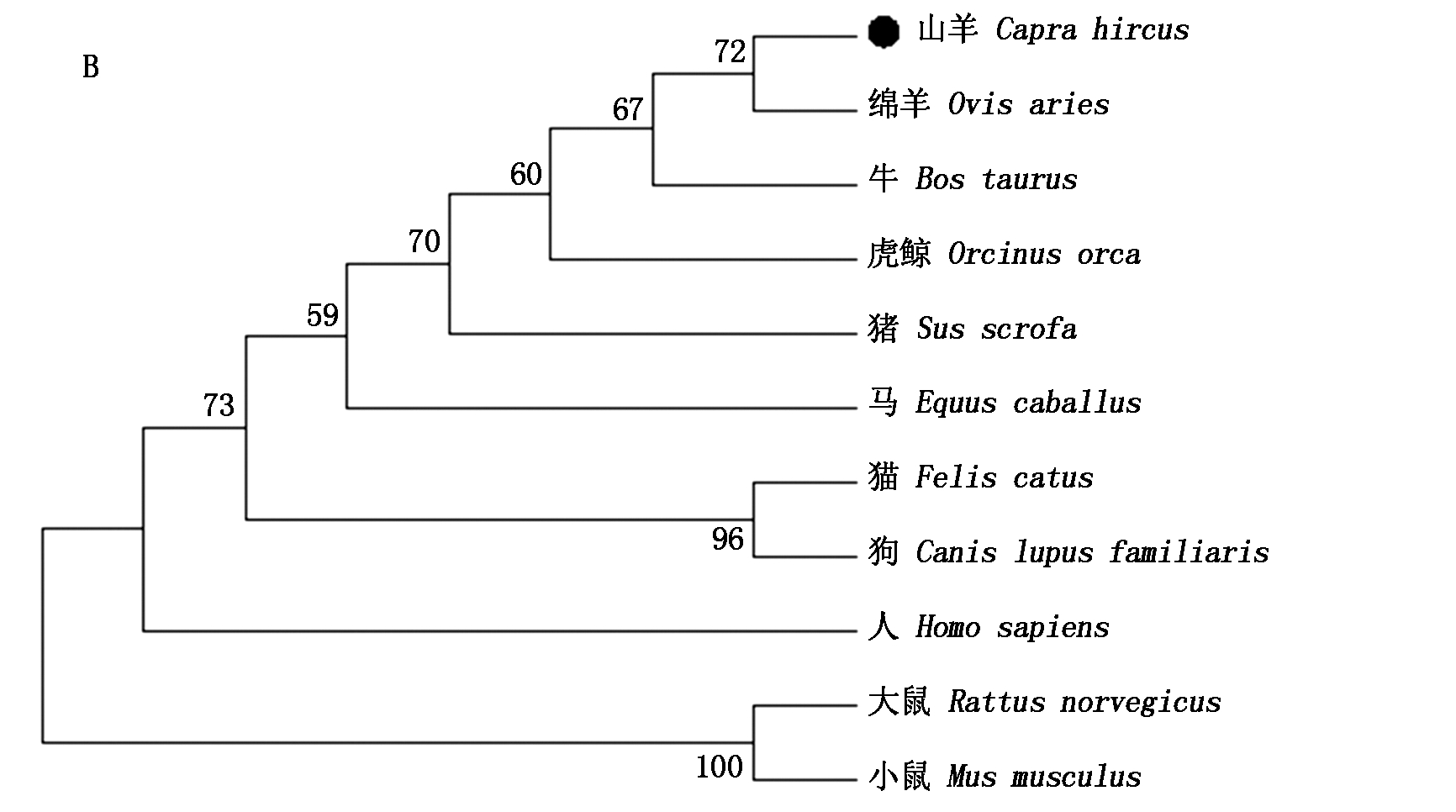
A.KLF5氨基酸同源性对比;B.NJ法构建KLF5氨基酸系统进化树。
A.Comparison of amino acid homology of goat KLF5; B.Phylogenetic tree constructed based on KLF5 amino acid with Neighbor-joining method.
图5 KLF5氨基酸同源性对比及其系统进化树
Fig.5 Comparison of amino acid homology of goat KLF5 and its phylogenetic trees
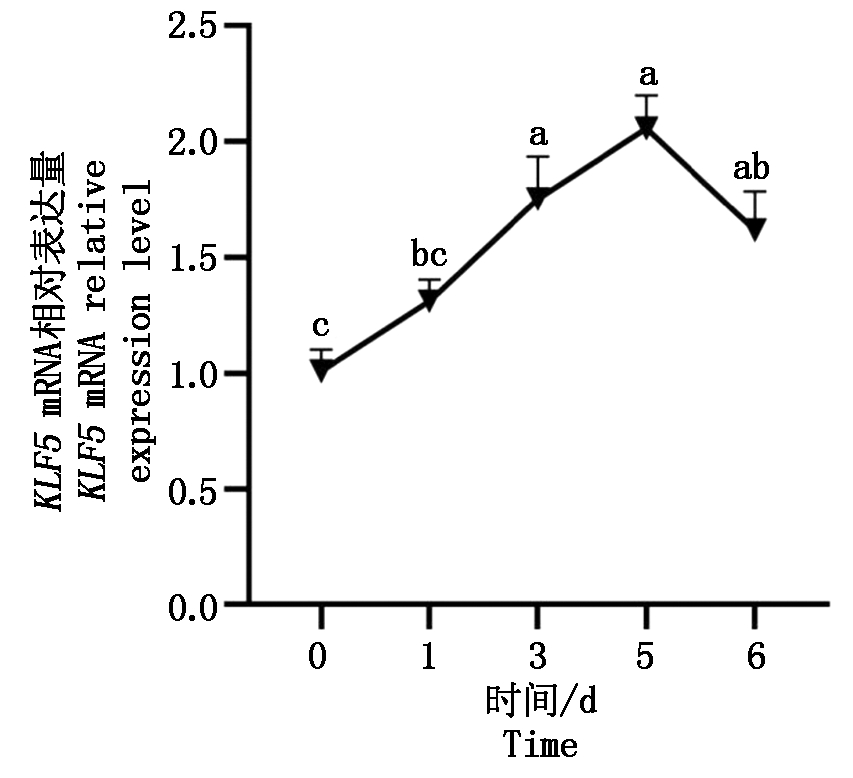
图6 山羊KLF5基因的时序表达谱
Fig.6 Time-series expression profile of KLF5 in goat
3 讨论与结论
作为一种锌指蛋白转录因子,KLF5已被发现可调控细胞增殖、分化和凋亡等多种生命活动过程。Oishi等[14]在2005年发现的KLF5能促进3T3-L1分化形成成熟脂肪细胞引起了畜牧工作者的关注,因为成熟脂肪细胞的快速形成有利于动物脂肪沉积,因此,在家畜动物上对其进行研究具有重要的理论与实际意义,但在山羊中尚未见相关报道。本研究首先通过降落PCR克隆获得山羊KLF5基因的完整ORF及部分UTR序列,并通过各种在线工具对山羊KLF5基因序列的理化性质等进行了分析。通过分析修饰位点可知山羊KLF5蛋白具有的丰富磷酸化位点有助于其活性的表达[18]。此外,山羊KLF5蛋白的34个O-糖基化位点也为其在细胞核及细胞骨架中发挥生物学作用奠定了基础[19]。由于山羊KLF5蛋白缺乏信号肽结构,因此,其预测得到的2个N-糖基化位点也很有可能不存在[20]。结构域方面,山羊KLF5蛋白可凭借其3个锌指结构域来识别不同长度的核酸序列进而调控不同基因的表达[21]。蛋白互作分析发现山羊KLF5蛋白可能与C/EBPα和C/EBPβ具有相互作用,Oishi等[14]和Zhu等[15]研究发现KLF5基因经C/EBPβ和C/EBPδ诱导后可促进PPARγ2的表达从而促进3T3-L1的分化,为本研究的蛋白质预测提供支持证据。另一方面,不同物种KLF5氨基酸的高度保守性也为不同物种KLF5蛋白发挥相似的生物学功能奠定了基础。
为进一步明确山羊KLF5基因的组织表达特性,本研究构建了山羊KLF5基因的组织表达谱。结果显示,山羊KLF5基因在被检测的各组织中均存在表达,但在肺组织中的表达量相对较高。Wan等[22]也发现KLF5在小鼠肺成熟阶段必不可少,缺乏KLF5基因的转基因小鼠在出生后立即死于呼吸窘迫。这说明KLF5基因在肺的形成和成熟阶段发挥巨大的生物学功能。但是Zhang等[23]发现KLF5基因在4日龄鸡的胸肌和腿肌中表达量相对较高,在肺中的表达量相对较少,这与本研究的结果存在差异,推测该基因在不同物种中具有组织表达特异性。本研究同时发现KLF5基因在腹间脂肪组织中亦存在相对较高的表达,结合前期转录组测序结果推测其可能参与山羊脂肪沉积。
明确KLF5在山羊肌内脂肪细胞分化过程中的表达模式是阐明其调控作用的重要基础。因此,本研究利用qPCR方法检测了KLF5基因在分化0~6 d山羊肌内脂肪细胞中的表达模式,明确了KLF5基因在脂肪细胞分化前后的表达差异。即在山羊肌内前体脂肪细胞诱导分化前后,KLF5基因的表达量增加,且在诱导分化第5天时达到最大值,推测该基因在山羊肌内脂肪细胞分化中具有正调控作用。在Oishi等[14]的研究中,它们发现3T3-L1经诱导分化1 h后KLF5基因的表达量增加并且在3 h内达到最高值,此后表达量逐渐降低。这与本研究存在相似及不同之处,可能因为选取的检测时间及诱导液成分不同有关。本研究仅仅明确了KLF5基因在山羊肌内脂肪细胞分化前后的表达差异,为了最终阐明 KLF5对山羊肌内脂肪细胞分化的调控作用及机制,本实验室则拟用过表达载体构建、超表达、RNA干扰及West Blotting等手段进行进一步研究。
本研究成功克隆了山羊KLF5基因序列(登录号:MN170986),其ORF全长为1 365 bp,编码454个氨基酸。山羊KLF5具有的各种蛋白质修饰位点和结构域等均有助于其活性的表达。组织表达谱表明KLF5基因在山羊肺中存在较高水平的表达。时序表达谱显示,山羊KLF5基因在肌内前体脂肪细胞经诱导分化后表达量均升高,并且在诱导分化第5天时表达量最高。本研究将为进一步研究KLF5基因对山羊肌内脂肪沉积的调控作用提供科学依据。
[1] 谢伏瞻. 中国统计年鉴-2008[M]. 北京: 中国统计出版社, 2008.
Xie F Z. China statistical yearbook-2008[M]. Beijing: China Statistics Press, 2008.
[2] 宁吉喆. 中国统计年鉴-2018[M]. 北京: 中国统计出版社, 2018.
Ning J Z. China statistical yearbook-2018[M]. Beijing: China Statistics Press, 2018.
[3] Hocquette J F, Gondret F, Baéza E, Médale F, Jurie C, Pethick D W. Intramuscular fat content in meat-producing animals: development, genetic and nutritional control, and identification of putative markers[J]. Animal, 2010, 4(2): 303-319. doi: 10.1017/S1751731109991091.
[4] Pearson R, Fleetwood J, Eaton S, Crossley M, Bao S S. Krüppel-like transcription factors: A functional family[J]. The International Journal of Biochemistry & Cell Biology, 2008, 40(10): 1996-2001. doi: 10.1016/j.biocel.2007.07.018.
[5] McConnell B B, Yang V W. Mammalian Krüppel-like factors in health and diseases[J]. Physiological Reviews, 2010, 90(4): 1337-1381. doi: 10.1152/physrev.00058.2009.
[6] Pei J M, Grishin N V. A new family of predicted Krüppel-Like factor genes and pseudogenes in placental mammals[J]. PLoS One, 2013, 8(11): e81109. doi: 10.1371/journal.pone.0081109.
[7] Yang C T, Ma R, Axton R A, Jackson M, Taylor A H, Fidanza A, Marenah L, Frayne J, Mountford J C, Forrester L M. Activation of KLF1 enhances the differentiation and maturation of red blood cells from human pluripotent stem cells[J]. Stem Cells, 2017, 35(4): 886-897. doi: 10.1002/stem.2562.
[8] Ghaleb A M, Elkarim E A, Bialkowska A B, Yang V W. KLF4 suppresses tumor formation in genetic and pharmacological mouse models of colonic tumorigenesis[J]. Molecular Cancer Research, 2016, 14(4): 385-396. doi:10.1158/1541-7786.MCR-15-0410.
[9] Gao Y, Li H Z, Ma X, Fan Y,Ni D, Zhang Y, Huang Q B, Liu K, Li X T, Wang L, Gu L Y, Yao Y X, Ai Q, Du Q S, Song E L, Zhang X. KLF6 suppresses metastasis of clear cell renal cell carcinoma via transcriptional repression of E2F1[J]. Cancer Research, 2017, 77(2): 330-342. doi: 10.1158/0008-5472.CAN-16-0348.
[10] Dong J T, Chen C S. Essential role of KLF5 transcription factor in cell proliferation and differentiation and its implications for human diseases[J]. Cellular and Molecular Life Sciences, 2009, 66(16): 2691-2706. doi: 10.1007/s00018-009-0045-z.
[11] Okada H, Yamada M, Kamimoto K, Kok C Y, Kaneko K, Ema M, Miyajima A, Itoh T. The transcription factor Klf5 is essential for intrahepatic biliary epithelial tissue remodeling after cholestatic liver injury[J]. Journal of Biological Chemistry, 2018, 293(17): 6214-6229. doi: 10.1074/jbc.RA118.002372.
[12] Liu F F, Dong L, Yang X, Li D J, Shen Y Y, Liu Z L. KLF5 silence attenuates proliferation and epithelial-mesenchymal transition induction in Hep-2 cells through NF-κB signaling pathway[J]. European Review for Medical and Pharmacological Sciences, 2019, 23(9): 3867-3875. doi: 10.26355/eurrev_201905_17814.
[13] Li Y, Sui X N, Hu X Q, Hu Z. Overexpression of KLF5 inhibits puromycin-induced apoptosis of podocytes[J]. Molecular Medicine Reports, 2018,18(4):3843-3849. doi: 10.3892/mmr.2018.9366.
[14] Oishi Y, Manabe I, Tobe K, Tsushima K, Shindo T, Fujiu K, Nishimura G, Maemura K, Yamauchi T, Kubota N, Suzuki R, Kitamura T, Akira S, Kadowaki T, Nagai R. Krüppel-like transcription factor KLF5 is a key regulator of adipocyte differentiation[J]. Cell Metabolism, 2005, 1(1): 27-39. doi:10.1016/j.cmet.2004.11.005.
[15] Zhu S M, Cheng G, Zhu H L, Guan G C. A study of genes involved in adipocyte differentiation[J]. Journal of Pediatric Endocrinology and Metabolism, 2015, 28(1-2):93-99. doi: 10.1515/jpem-2014-0002.
[16] Oishi Y, Manabe I, Tobe K, Ohsugi M, Kubota T, Fujiu K, Maemura K, Kubota N, Kadowaki T, Nagai R. SUMOylation of Krüppel-like transcription factor 5 acts as a molecular switch in transcriptional programs of lipid metabolism involving PPAR-δ[J]. Nature Medicine, 2008, 14(6): 656-666. doi: 10.1038/nm1756.
[17] Bonnet M, Bernard L, Bes S, Leroux C. Selection of reference genes for quantitative Real-time PCR normalisation in adipose tissue, muscle, liver and mammary gland from ruminants[J]. Animal, 2013, 7(8): 1344-1353. doi: 10.1017/S1751731113000475.
[18] Ardito F, Giuliani M, Perrone D, Troiano G, Muzio L L. The crucial role of protein phosphorylation in cell signaling and its use as targeted therapy (Review)[J]. International Journal of Molecular Medicine, 2017, 40(2): 271-280. doi:10.3892/ijmm.2017.3036.
[19] 赵新元, 沈丙权, 秦伟捷, 钱小红. 基于生物质谱的蛋白质O-GalNAc糖基化修饰研究进展[J]. 中国科学, 2018, 48(2): 113-123. doi: 10.1360/N052017-00137.
Zhao X Y, Shen B Q, Qin W J, Qian X H. Advances in O-GalNAc glycosylation research based on biological mass spectrometry[J]. Scientia Sinica Vitae, 2018, 48(2): 113-123.
[20] Spiro R G. Protein glycosylation: nature, distribution, enzymatic formation, and disease implications of glycopeptide bonds[J]. Glycobiology, 2002, 12(4): 43-56. doi: 10.1093/glycob/12.4.43R.
[21] Garton M, Najafabadi H S, Schmitges F W, Radovani E, Hughes T R, Kim P M. A structural approach reveals how neighbouring C2H2 zinc fingers influence DNA binding specificity[J]. Nucleic Acids Research, 2015, 43(19): 9147-9157. doi:10.1093/nar/gkv919.
[22] Wan H J, Luo F M, Wert S E, Zhang L Q, Xu Y, Ikegami M, Maeda Y, Bell S M, Whitsett J A. Kruppel-like factor 5 is required for perinatal lung morphogenesis and function[J]. Development, 2008, 135(15): 2563-2572. doi: 10.1242/dev.021964.
[23] Zhang X X, Lian T, Ran J S, Li Z Q, Han S S, Liu Y P. KLF5 functions in proliferation, differentiation, and apoptosis of chicken satellite cells[J]. 3 Biotech, 2019, 9(6): 222. doi: 10.1007/s13205-019-1752-2.
