由灰葡萄孢菌(Botrytis cinerea)引起的灰霉病能够侵染包括黄瓜、番茄、草莓等蔬菜水果在内的200多种植物,该病害在植物生长期和采后均可发生,每年给世界农业造成数十亿的经济损失[1-3]。目前,灰霉病依然以化学防治为主,长期重复用药导致灰霉病菌对苯并咪唑类、二甲酰亚胺类和氨基甲酸酯类三类常用杀菌剂的抗药性增强,农药防效降低、用量增大,也加剧了对生态环境的威胁[4-6]。因此,寻找一种生态安全、效果稳定的灰霉菌防治方法至关重要。
生物防治是目前最具潜力并具有良好农药替代效果的植物病害安全防治技术[4],灰霉病的生物防治已经成为研究者关注的焦点。从多种生境中筛选出对灰葡萄孢菌具有抑制作用的芽孢杆菌(Bacillus spp.)[7]、木霉(Trichoderma spp.)[8]、链霉菌(Streptomyces spp.)[9]等生防菌株。芽孢杆菌由于其性能稳定、易于贮存是灰霉病害防治中应用最多的生防微生物。小麦内生枯草芽孢杆菌(B. subtilis)Em7对葡萄灰霉病菌的生长具有抑制作用,离体果实相对防治效果为78.92%[10]。张新刚等[11]研究表明,贝莱斯芽孢杆菌SFJ1发酵液对盆栽黄瓜接种灰霉病4,7 d后的防效分别为86.48%,84.09%。这些研究为生防微生物菌剂的开发和田间应用积累了菌株资源和应用基础。目前,已经登记了包括枯草芽孢杆菌、哈茨木霉在内的多种灰霉病防治微生物菌剂。然而,生防菌剂的应用效果由于活体微生物定殖受诸多因素的影响,导致防治效果不稳定[12]。特别是对于灰霉病这种叶部病害来说,由于拮抗菌株的叶面定殖受紫外线、温度、水分等环境因素影响导致防治效果更为不稳,成为限制灰霉病生物防治的技术瓶颈[13]。利用微生物产生的活性抑菌物质进行灰霉菌的生物防治能够有效克服活菌制剂防效不稳定的缺点。
本研究以从多个省采集的蔬菜种植土壤样品为筛选基础,采用平板对峙法筛选获得一株具有较强拮抗活性的灰霉菌拮抗菌株,通过形态学、生理生化特征以及16S rRNA和gyrB序列分析将该菌株鉴定为解淀粉芽孢杆菌(B. amyloliquefaciens),并且该菌能够分泌抑菌效果良好、稳定性较高的胞外抑菌活性物质。该研究为黄瓜灰霉病的生物防治提供新的生物材料和生物防治方式,对灰霉病的有效防治和化学农药的减量具有重要的意义。
1 材料和方法
1.1 试验材料
1.1.1 试剂与培养基 细菌基因组提取试剂盒EE161、多重PCR扩增试剂盒购自北京全式金生物科技有限公司;革兰氏染色试剂盒购自北京索莱宝科技有限公司;PDA培养基:去皮马铃薯200.0 g/L,葡萄糖20.0 g/L,琼脂15 g/L,pH值自然,1×105 Pa灭菌20 min;PB液体培养基:牛肉膏5.0 g/L,蛋白胨10.0 g/L,NaCl 5.0 g/L,pH值7.0,1×105 Pa灭菌20 min;PB固体培养基为液体培养基中加入琼脂15 g/L。
1.1.2 样品来源 共采集云南、黑龙江、新疆、河北等地蔬菜种植土壤耕层样品129个;供试病原菌灰葡萄孢菌,由本单位从罹病黄瓜上分离获得;供试黄瓜品种为津优1号,购于河北省农林科学院种子市场。
1.1.3 仪器 Beckman Coulter Allegra 64R冷冻离心机购自美国Beckman公司;Scientz-IID超声波细胞粉碎机购自宁波新芝生物科技股份有限公司;Eppendorf Mastercycler X50梯度PCR仪购自德国Eppendorf公司;Panasonic高压蒸汽灭菌器购自日本Panasonic公司。
1.2 拮抗菌的分离筛选与纯化
采用稀释涂平板方法进行细菌分离,土壤经80 ℃水浴10 min逐级稀释后涂布于PB培养基中,28 ℃培养3 d,挑取形态各异的单菌落连续划线纯化直至得到菌落形态一致,长势较快的菌株。将得到的菌株进行编号,用30%的甘油于-80 ℃冷冻保存。以灰葡萄孢菌为靶标菌,采用平板对峙法测定保存菌株的拮抗性能。打孔器打取直径为5 mm的灰葡萄孢菌菌块并接种于PDA平板中央,挑取细菌单菌落均匀接在距离指示菌3 cm的位置,22 ℃恒温培养5 d,测量对照组病原菌菌落半径(R0)和处理组病原菌抑制区半径(R1),并按公式①计算抑制率。
抑制率=(1-R1/R0)×100%
①
1.3 拮抗菌BA-KA4的鉴定
拮抗菌菌落形态:将待测菌划线接种于PB培养基上,28 ℃恒温培养48 h,观察菌落的大小、形态、颜色、透明度等特征。拮抗菌菌体形态:将待测菌接种于PB液体培养基,180 r/min、28 ℃恒温培养48 h,采用革兰氏染色试剂盒进行革兰氏染色、采用美兰试剂进行芽孢染色,在光学显微镜下观察菌体形态。拮抗菌生理生化鉴定:参考《常见细菌系统鉴定手册》[14]和《伯杰细菌鉴定手册》[15]的方法,对拮抗菌株的明胶液化、硝酸盐、柠檬酸盐利用试验、吲哚试验、V-P试验、纤维素等生理生化指标进行测定。拮抗菌株的分子鉴定:采用细菌基因组提取试剂盒提取待测菌株的基因组DNA,以此为模板,以27F(5′-AGAGTTTGATCMTGGCTCAG-3′)和1 492R(5′-GGYTACCTTGTTACGACTT-3′)为引物,进行菌株16S rDNA的扩增。PCR扩增条件为: 95 ℃ 5 min;94 ℃ 1 min,50 ℃ 1 min,72 ℃ 2 min,35个循环;72 ℃ 10 min[16]。以UP-1 (5′-GAAGTCATCAT GACCGTTCTGCAYGCNGGNGGNAARTTYGA-3′)和UP-2r(5′-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3′)对gyrB基因序列进行扩增。PCR扩增条件为:95 ℃ 4 min;98 ℃ 10 s,62 ℃ 1 min,72 ℃ 2 min,30个循环;72 ℃ 8 min[17]。将16S rDNA和gyrB 基因序列扩增产物送金唯智生物科技有限公司进行测序,所得序列在GenBank数据库进行Blast比对,采用Mega 7.0软件与Neighbor-Joining法进行系统发育分析并构建系统发育树[18]。
1.4 拮抗菌BA-KA4无菌发酵液的抑菌活性和不同浓度无菌发酵液的抑菌效果
拮抗菌无菌发酵液抑菌活性的确定:挑取BA-KA4菌株单菌落接种于PB液体培养基中,28 ℃、180 r/min恒温培养48 h,经8 000 r/min离心15 min,收集上清液并过孔径0.22 μm的滤膜得到无菌发酵液。收集离心获得的菌体,超声波破碎3 min,用PB培养基稀释到原体积,经8 000 r/min离心15 min,收集上清液为菌体破碎液。分别吸取1 mL无菌发酵液和菌体破碎液至培养皿中,倒入25 mL PDA培养基,待培养基凝固后,在中央接入直径5 mm的灰葡萄孢菌菌块,22 ℃恒温培养至对照平板菌丝刚长满平板时(R0),测量不同处理中灰葡萄孢菌的菌落直径(R1)。采用公式①计算抑菌率。
利用50 ℃的PDA培养基进行无菌发酵液的稀释,分别稀释至10,20,40,80,160倍并倒平板,以添加同体积无菌水的PDA平板为对照。用直径5 mm的打孔器打取活化3 d 的灰葡萄孢菌菌落边缘的菌块并接种于含不同浓度无菌发酵液PDA平板和对照平板的中央,22 ℃恒温培养至对照平板菌丝刚长满平板时(R0),测量不同处理中灰葡萄孢菌的菌落直径(R1)。采用公式①计算抑菌率。
1.5 拮抗菌BA-KA4无菌发酵液的稳定性分析
测定温度、pH值、紫外线3个变量对发酵液稳定性的影响:将无菌发酵液经10,20,30,40,50,60,70,80,90,100 ℃水浴处理30 min以及在121 ℃高压灭菌15 min;采用浓度0.1 mol/L的HCl和NaOH溶液调节无菌发酵液的pH值至3,4,5,6,7,8,9,并处理30 min;采用功率为15 W的紫外线灯,距离无菌发酵液20 cm的高度照射1,7,11,16 h。按照1.2的方法测定不同处理无菌发酵液20倍稀释、22 ℃恒温培养5 d灰葡萄孢菌菌落直径(R1),以不经处理的无菌发酵液为对照(R0),按照公式②计算相对抑菌率。
相对抑菌率=R1/R0×100%
②
1.6 数据处理
每组试验均重复3次,数据用均数±标准差![]() 表示,试验结果采用Microsoft Excel 2007、SPSS 17.0统计软件进行分析,采用LSD法进行差异显著性检验。菌株系统发育树采用Mega 7.0软件构建。
表示,试验结果采用Microsoft Excel 2007、SPSS 17.0统计软件进行分析,采用LSD法进行差异显著性检验。菌株系统发育树采用Mega 7.0软件构建。
2 结果与分析
2.1 灰霉病拮抗芽孢杆菌菌株的筛选
根据芽孢杆菌的芽孢的耐热特性,将采集的土样用80 ℃水浴处理10 min后,通过PB培养基从129个土壤样品中共分离获得4 200株细菌。采用平板对峙方法,从中筛选出具有灰霉病菌拮抗作用的菌株191株。对191株拮抗菌进行复筛并比较菌株的拮抗性能,共获得10株抑菌率超过50%的菌株,其中一株细菌平板对峙试验72 h对灰霉病菌的抑菌率为65.34%,经方差分析与其他几株存在显著性差异(表1、图1),命名为KA4。
2.2 灰霉病拮抗芽孢杆菌菌株的鉴定
菌株KA4在PB平板中,呈扁平或圆形、乳白色不透明、边缘整齐、表面有褶皱、中央略凹的菌落(图2-A)。显微镜观察(图2-B)为杆状、单个排列、两端平滑,大小为(1.1~4.1) μm×(0.2~0.5) μm,革兰氏染色呈阳性。明胶液化、硝酸盐、柠檬酸盐利用试验、吲哚试验、V-P试验、纤维素、淀粉水解、H2S产生试验均呈阳性,甲基红、丙二酸盐、酪氨酸试验均呈阴性(表2)。
表1 不同菌株对灰葡萄孢菌的抑菌效果
Tab.1 Antibacterial effect of rescreening antagonistic strains on B.cinerea
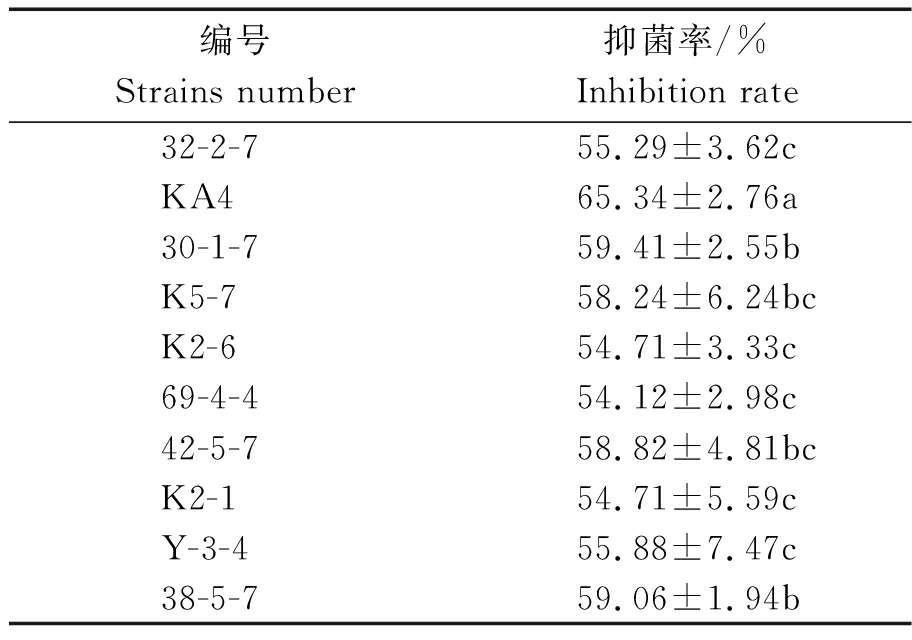
编号Strains number抑菌率/%Inhibition rate 32-2-755.29±3.62cKA465.34±2.76a30-1-759.41±2.55bK5-758.24±6.24bcK2-654.71±3.33c69-4-454.12±2.98c42-5-758.82±4.81bcK2-154.71±5.59cY-3-455.88±7.47c38-5-759.06±1.94b
注:同列数据后不同小写字母表示差异显著(P<0.05)。
Note:Different letters after the same column of data indicate significant difference(P<0.05).
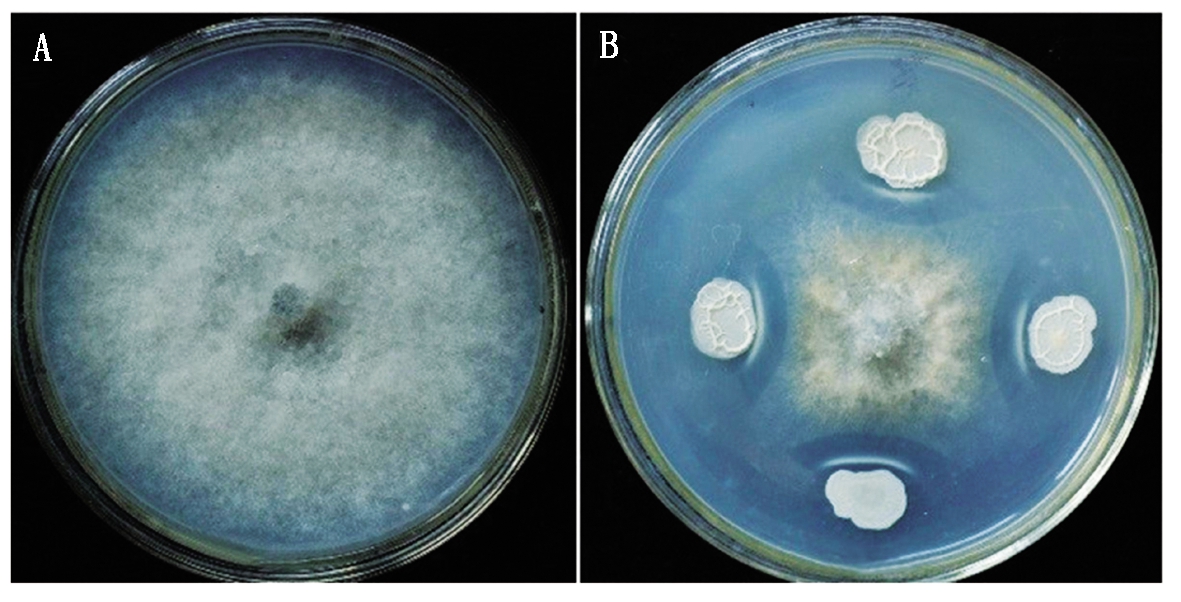
图1 KA4对黄瓜灰霉病菌的拮抗效果
Fig.1 Antagonistic effect of strain KA4 on B.cinerea
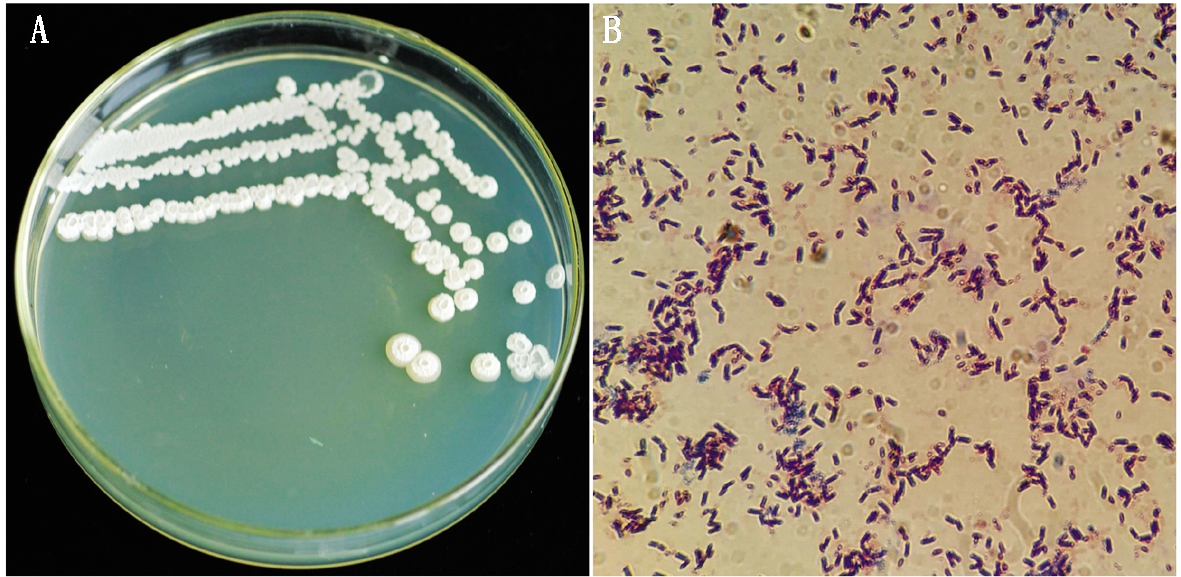
图2 拮抗菌KA4菌落和菌体形态
Fig.2 Colony and morphology of strain KA4
表2 拮抗菌KA4的生理生化鉴定结果
Tab.2 Result of physiological and biochemistry experiments of strain KA4
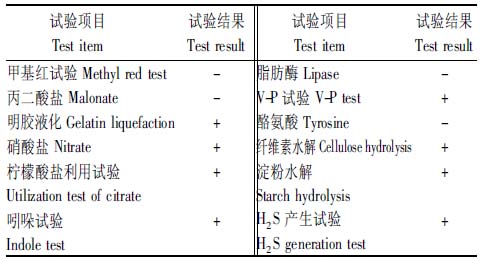
试验项目 Test item 试验结果Test result试验项目 Test item 试验结果Test result甲基红试验 Methyl red test-脂肪酶 Lipase-丙二酸盐 Malonate-V-P试验 V-P test+明胶液化 Gelatin liquefaction+酪氨酸 Tyrosine-硝酸盐 Nitrate+纤维素水解 Cellulose hydroly-sis+柠檬酸盐利用试验+淀粉水解+ Utilization test of citrate Starch hydrolysis吲哚试验+H2S产生试验 + Indole testH2S generation test
将菌株KA4的16S rRNA扩增产物测序获得1 394 bp的片段(图3),序列提交至GenBank (序列号: MK336717)进行同源性分析,发现菌株KA4与解淀粉芽孢杆菌D6 (序列号: KJ123707)、解淀粉芽孢杆菌R-1 (序列号: AB847954)、解淀粉芽孢杆菌13(序列号: HM107806)、枯草芽孢杆菌B4 (序列号: JX123316)、枯草芽孢杆菌 L4 (序列号: GQ421472)等菌株的同源性均>99%,可以初步推测菌株KA4为芽孢杆菌属细菌,与解淀粉芽孢杆菌和枯草芽孢杆菌的相似性较高。为进一步确定菌株KA4的分类学地位,利用Mega 7.0软件及其Neighbor-Joining法构建系统发育树(图4),发现菌株KA4与解淀粉芽孢杆菌D6 (序列号: KJ123707)、解淀粉芽孢杆菌R-1 (序列号: AB847954)、解淀粉芽孢杆菌13(序列号: HM107806)等菌株均处于同一分支,与枯草芽孢杆菌B4 (序列号: JX123316)、枯草芽孢杆菌L4 (序列号: GQ421472)等菌株也处于临近分支。由于解淀粉芽孢杆菌和枯草芽孢杆菌的亲缘关系比较近,以16S rDNA序列构建的系统发育树不能确定该菌株的种,因此,选用芽孢杆菌专用的指示基因gyrB对菌株KA4进行了进一步的鉴定。经PCR扩增获得长度为1 006 bp的片段,提交至GenBank (序列号: MK3434447)并与NCBI中已知的gyrB基因序列进行比对分析,发现菌株KA4与解淀粉芽孢杆菌 GM-1 (序列号: JQ658430)、解淀粉芽孢杆菌FQS38 (序列号: KC439667)、解淀粉芽孢杆菌DM09 (序列号: JX014631)等菌株的同源性均>98%,利用Mega 7.0软件及其Neighbor-Joining法构建基于gyrB的系统发育树(图5),菌株KA4与解淀粉芽孢杆菌的系列菌株聚成一簇。综合形态学、生理生化特征、16S rRNA、gyrB基因序列和系统发育分析,可以确定菌株KA4为解淀粉芽孢杆菌,命名为BA-KA4。
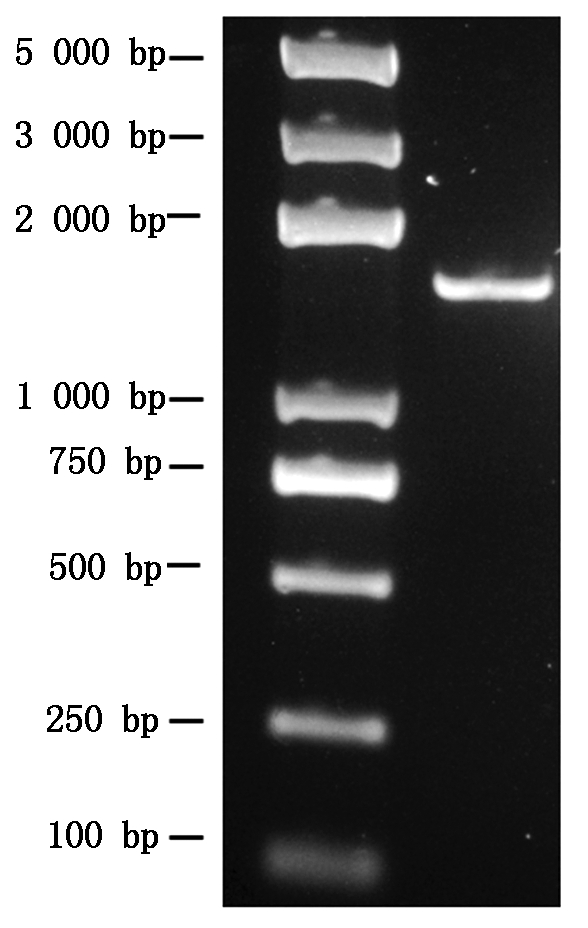
图3 菌株KA4的16S rRNA扩增产物片段
Fig.3 16S rRNA amplification product fragment of strain KA4
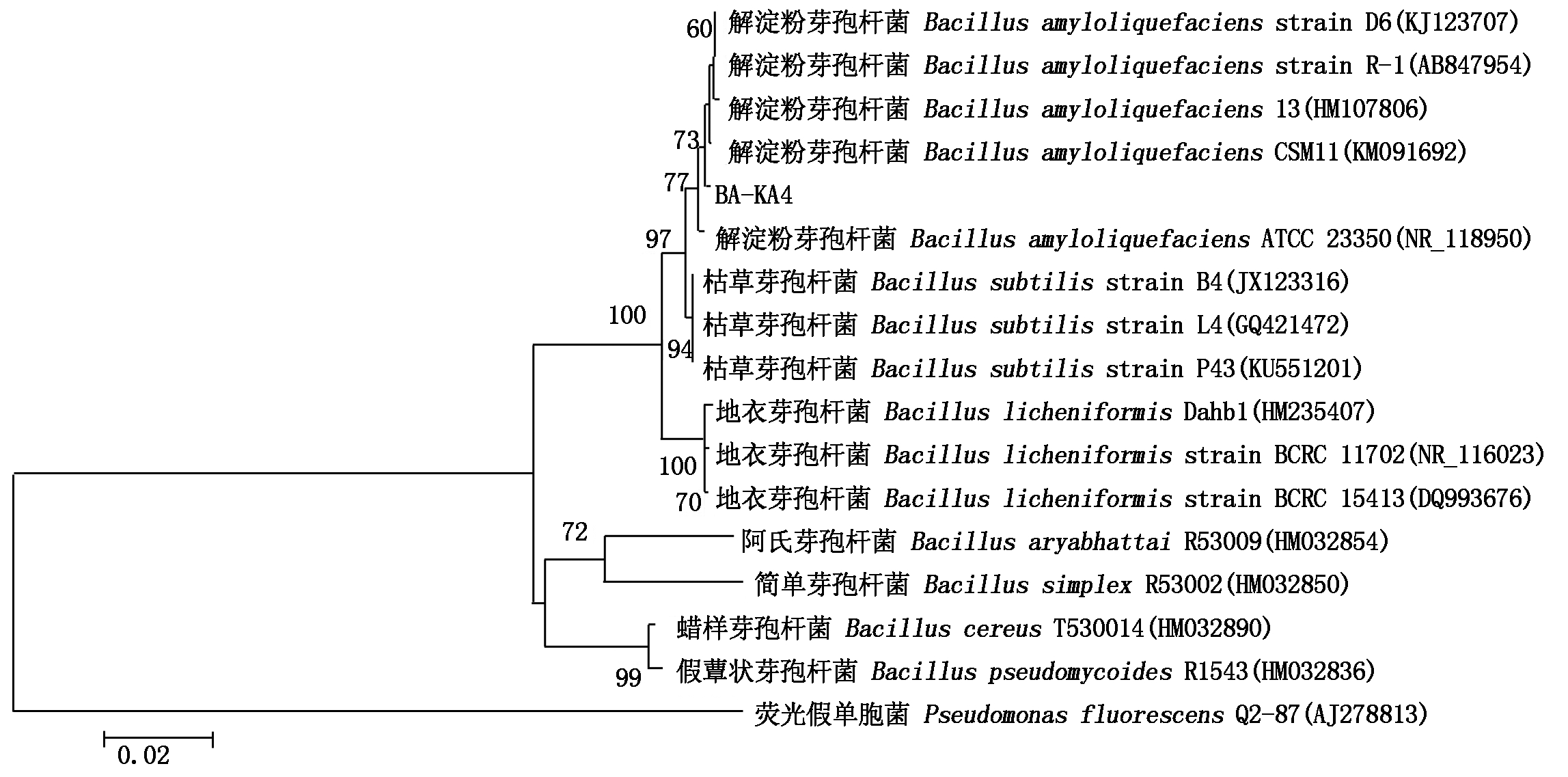
图4 拮抗菌BA-KA4 依据16S rDNA基因序列的系统发育树
Fig.4 Phylogenetic tree of strain BA-KA4 and related strains based on 16S rDNA sequence
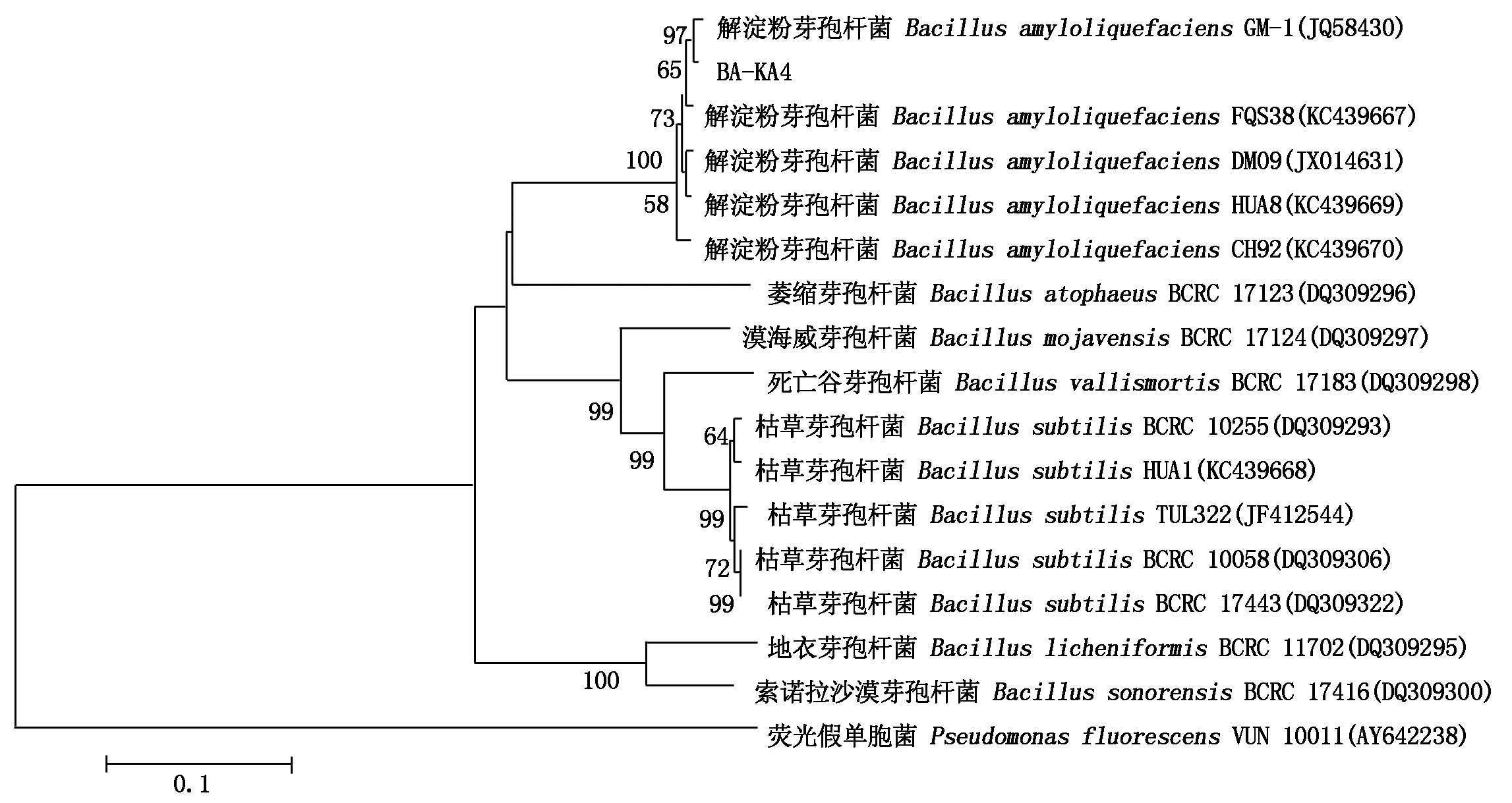
图5 拮抗菌BA-KA4 依据gyrB基因序列的系统发育树
Fig.5 Phylogenetic tree of strain BA-KA4 and related strains based on gyrB sequence
2.3 拮抗菌BA-KA4无菌发酵液抑菌活性的分析
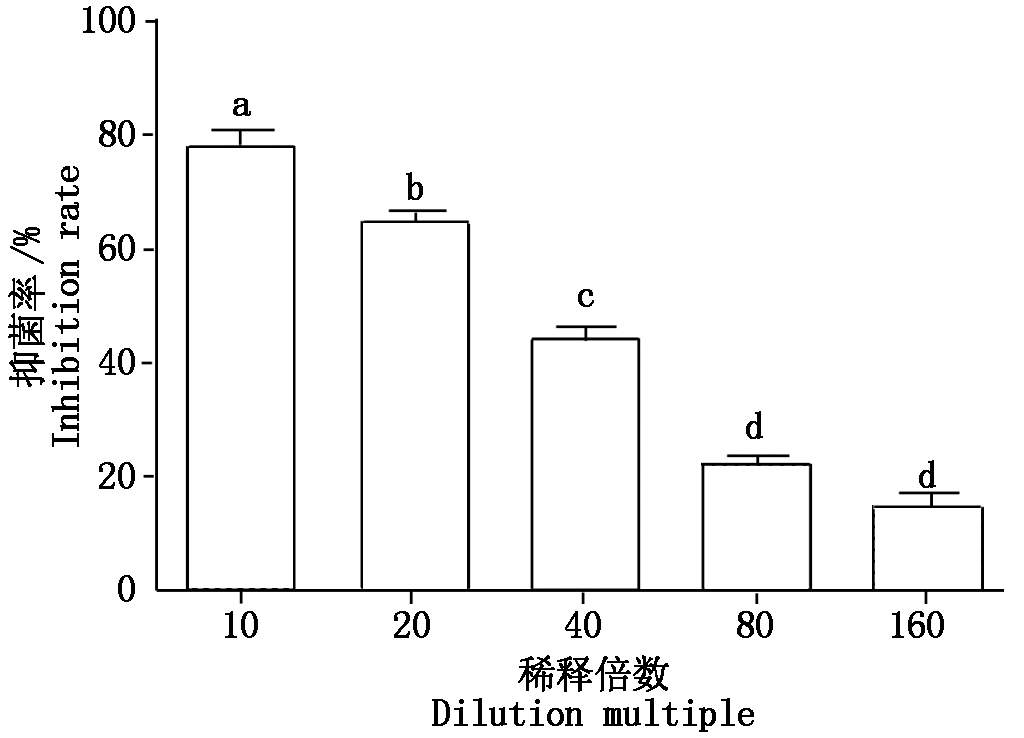
测定BA-KA4无菌发酵液与细胞破碎液的抑菌活性(图6),不加无菌发酵液的为对照(图6-A),结果表明,无菌发酵液对灰葡萄孢菌抑菌率为63.87%(图6-B),细胞破碎液对灰葡萄孢菌的抑菌率为41.17%(图6-C),说明BA-KA4主要以胞外分泌物为抑制活性成分。图7为不同稀释倍数无菌发酵液对灰葡萄孢菌的抑菌效果,结果显示,10,20,40,80,160倍无菌发酵液对灰葡萄孢菌的生长均有一定的抑制作用,其中以稀释10倍抑菌作用最强为78.83%,20,40,80,160倍的无菌发酵液的抑菌率依次为65.19%,45.38%,22.89%,15.97%,随着稀释倍数的增大,抑制效果依次减弱。
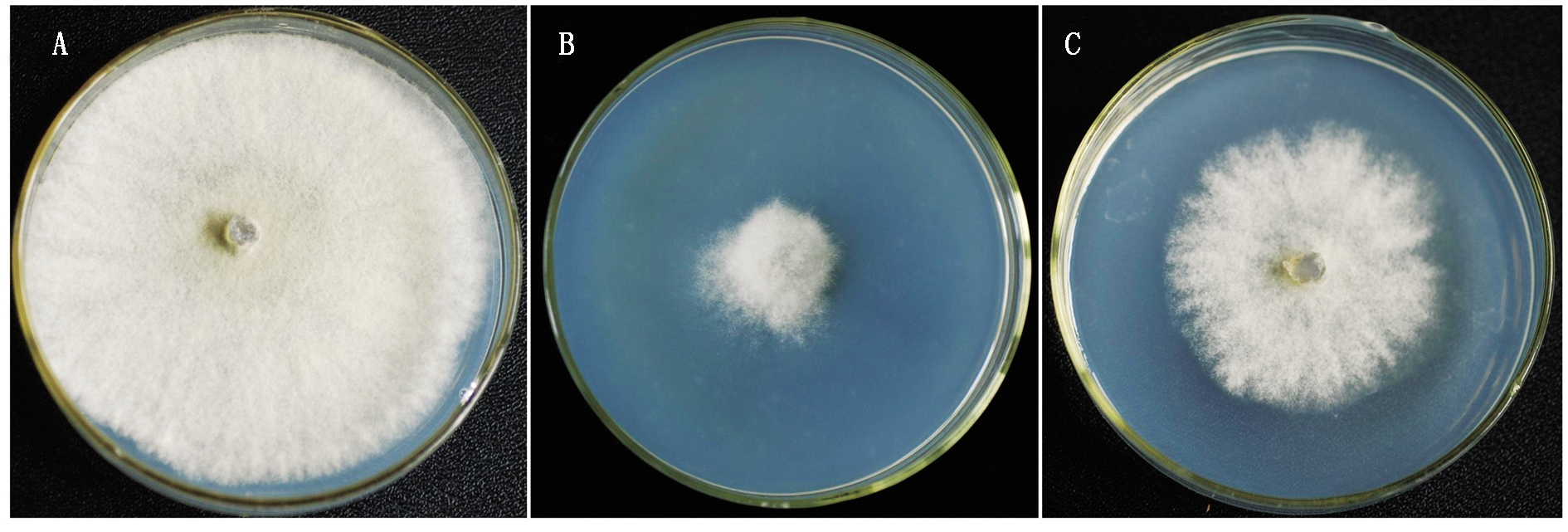
图6 BA-KA4无菌发酵液和细胞破碎液对黄瓜灰霉病菌的抑制效果
Fig.6 Inhibition effect of BA-KA4 sterile filtrate and cell disrupting solution on B.cinerea
不同小写字母表示处理间差异显著(P<0.05)。图8同。
Different letters represent significant difference(P<0.05)among treatments.The same as Fig.8.
图7 BA-KA4不同浓度无菌发酵液的对黄瓜灰霉病菌的抑制效果
Fig.7 Antagonistic effect of different concentration BA-KA4 sterile filtrate against B.cinereal
2.4 拮抗菌BA-KA4无菌发酵液的稳定性分析
测定不同温度处理的无菌发酵液的抑菌效果表明(如图8-A),其中10,20,40,60,80,100,121 ℃处理后BA-KA4的相对抑菌率分别为82.59%,92.50%,87.27%,86.55%,86.55%,86.33%,71.58%,其中20 ℃处理显著高于除40 ℃外的其他温度处理,121 ℃处理显著低于其他处理。BA-KA4无菌发酵液分别在pH值3,4,5,6,7,8,9时处理30 min,各pH处理相对抑菌活性依次为55.50%,76.47%,84.75%,90.91%,93.73%,87.92%,85.27%(图8-B),其中pH值7处理显著高于除pH值6处理外的其他处理,pH值3处理显著低于其他处理。紫外线照射无菌发酵液1,7,11,16 h的抑菌活性如图8-C所示,抑菌活性依次为89.48%,76.28%,66.98%,64.10%,其中紫外线照射1 h处理显著高于紫外线照射11,16 h处理。综合而言,无论是温度、酸碱还是紫外线照射处理,BA-KA4无菌发酵液的相对抑菌活性最低仍可达到55.50%,说明BA-KA4代谢产物具有良好的温度、pH和紫外线稳定性。
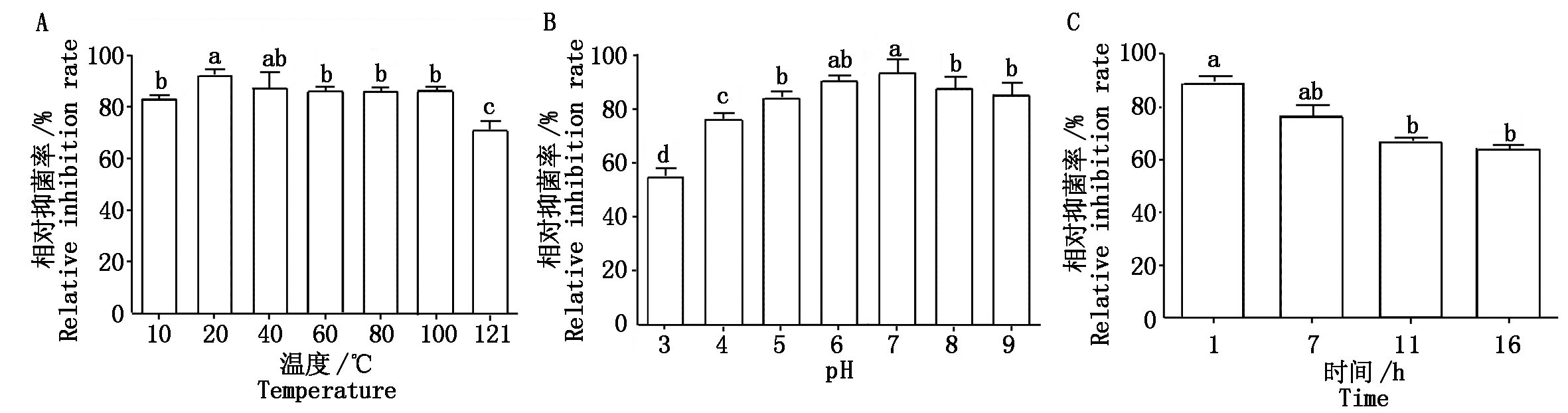
图8 温度、pH、紫外照射时间对BA-KA4无菌发酵液抑菌活性的影响
Fig.8 Antagonistic effect of BA-KA4 sterile filtrate under different temperatures, pH and UV on B.cinereal
3 讨论
化学药剂的长期大量使用造成病原菌耐药性增强和环境污染,使得生物防治成为植物灰霉病防控的重要组成部分。为了使灰霉病害的生物防控更为有效,研究者不断地从不同生境样品中进行灰霉病生防菌株的挖掘。从土壤、海洋、植物内部以及极端环境中分离筛选出多种的灰葡萄孢菌拮抗菌株,为灰霉病菌的生物防治奠定了菌株基础。其中,芽孢杆菌由于其生存能力强、分布范围广、产生抑菌物质多样成为灰霉病防治的主要微生物[19]。郑喜清等[20]从植物根际土壤中分离到对番茄灰葡萄孢菌具有拮抗作用的地衣芽孢杆菌、短芽孢杆菌、蜡状芽孢杆菌。Kefi等[7]从番茄植株中分离到内生莫海威芽孢杆菌BL1、耐盐短杆菌BT5、枯草芽孢杆菌BR8、解淀粉芽孢杆菌BF11对灰霉病菌具有拮抗效果。本研究从全国不同地区采集土壤样品,以黄瓜灰霉病菌为指示菌,进行了灰葡萄孢菌拮抗芽孢杆菌菌株的筛选,其中以解淀粉芽孢杆菌BA-KA4对灰葡萄孢菌的拮抗作用最强。解淀粉芽孢杆菌因其生存能力强、抑菌范围广以及对人和环境的安全等特点,被认为是最具生防潜力的菌株之一[21]。本研究进一步丰富了灰霉病菌生物防治的菌株资源。
微生物制剂的效果与微生物的定殖能力相关,受温度、紫外线、微生物区系以及施用药剂等环境因素的影响。以微生物代谢产物作为生防药剂进行病害防治可以减少由于微生物活性造成的田间防效不稳的缺点,因此,研究者对芽孢杆菌胞外分泌物进行了大量研究。De 等[22]筛选到5株解淀粉芽孢杆菌对番茄灰霉病的抑制率为52%~61%,其抑菌活性物质主要为表面活性素。夏京津等[23]从解淀粉芽孢杆菌HE中鉴定出ituA、fenB、sfP、mycB的脂肽合成相关基因和Surfactin、Iturin和Fengycin这3类脂肽类抗生素,且产生的抑菌活性物质对高温、酸、碱和蛋白酶具有一定的耐受性。魏新燕等[24]从海水中分离到了一株甲基营养型芽孢杆菌BH21,该菌株含有ituA、ituB、ituC、ituD、fenD、srfAB 和yndJ等7种脂肽物质的合成基因,推测该菌株的抑菌活性物质是这几种物质的混合物。总之,大量研究表明芽孢杆菌具有丰富的次级代谢产物,且代谢产物的抑菌活性具有较好的稳定性。Zhang等[25]从番茄根际分离到解淀粉芽孢杆菌W10,该菌株产生的新型小抗菌肽5240在100 °C条件下处理20 min仍保持稳定的抑菌活性,pH值4~10范围内可以保持抑菌活性。本研究测定了解淀粉芽孢杆菌BA-KA4代谢产物对黄瓜灰霉病的抑制作用,结果表明,该菌株的无菌发酵液具有较强的抑菌活性,而细胞破碎液的抑菌活性较低,说明该菌主要通过胞外分泌物起到拮抗病原菌的作用;该菌株的无菌发酵液稀释10,20,40,80,160倍对灰葡萄孢菌的生长均有一定的抑制作用,其中以稀释10倍抑菌作用最强为78.83%,20,40,80,160倍的无菌发酵液也具有一定的抑菌效果,为该菌株代谢产物的田间应用提供参考;该菌株的胞外抑菌物质具有良好的温度、紫外线和pH稳定性,在121 ℃高温高压灭菌15 min的相对抑菌率仍为71.58%,紫外线照射16 h的相对抑菌率仍高达64.10%,该菌株的胞外抑菌物质在pH值3~9处理的情况下相对抑菌率在55.50%~93.73%。这些研究表明,解淀粉芽孢杆菌BA-KA4的代谢产物具有良好的环境稳定性,从而赋予了菌株较好的加工、储存、药剂复配性能,适宜进行大规模的生产和田间应用。
[1] 张艳杰,沈凤英,许换平,李亚宁,刘大群. 灰葡萄孢菌多样性研究进展[J]. 农业生物技术学报,2017,25(6):954-968. doi:10.3969/j.issn.1674-7968.2017.06.010.
Zhang Y J, Shen F Y, Xu H P, Li Y N, Liu D Q. Research advances in the diversity of Botrytis cinerea [J]. Journal of Agricultural Biotechnology, 2017,25(6):954-968.
[2] Weber R W S, Hahn M. Grey mould disease of strawberry in northern Germany: causal agents, fungicide resistance and management strategies[J]. Applied Microbiology and Biotechnology, 2019,103:1589-1597. doi:10.1007/s00253-018-09590-1.
[3] Swartzberg D, Kirshner B, Rav-David D, Elad Y, Granot D. Botrytis cinerea induces senescence and is inhibited by autoregulated expression of the IPT gene[J]. European Journal of Plant Pathology, 2007, 120:289-297. doi:10.1007/s10658-007-9217-6.
[4] Fernández-Ortu o D, Grabke A, Bryson P K, Amiri A, Peres N A,Schnabel G.Fungicide resistance profiles in Botrytis cinerea from strawberry fields of seven Southern U. S. States[J]. Plant Dis, 2014, 98(6): 825-833. doi:10.1094/PDIS-09-13-0970-RE.
o D, Grabke A, Bryson P K, Amiri A, Peres N A,Schnabel G.Fungicide resistance profiles in Botrytis cinerea from strawberry fields of seven Southern U. S. States[J]. Plant Dis, 2014, 98(6): 825-833. doi:10.1094/PDIS-09-13-0970-RE.
[5] 宋晰,肖露,林东,王艳辉,李波涛,刘西莉. 番茄灰霉病菌对腐霉利的抗药性检测及生物学性状研究[J]. 农药学学报,2013,15(4):398-404. doi:10.3969/j.issn.1008-7303.2013.04.06.
Song X, Xiao L, Lin D, Wang Y H, Li B T, Liu X L. Detection of procymidone resistance and investigation of biological characteristics in Botrytis cinerea [J]. Chinese Journal of Pesticide Science, 2013, 15(4): 398-404.
[6] 李兴红,乔广行,黄金宝,林雪,刘建华. 北京地区番茄灰霉病菌对嘧霉胺的抗药性检测[J]. 植物保护,2012,38(4):141-143. doi:10.3969/j.issn.0529-1542.2012.04.031.
Li H X, Qiao G X, Huang J B, Lin X, Liu J H. Detection of the resistance of Botrytis cinerea to pyrimethanil from tomato in Beijing[J]. Plant Protection, 2012, 38(4): 141-143.
[7] Kefi A, Slimene I B,Karkouch I, Rihouey C, Azaeiz S, Bejaoui M,Belaid R, Cosette P, Jouenne T, Limam F. Characterization of endophytic Bacillus strains from tomato plants (Lycopersicon esculentum) displaying antifungal activity against Botrytis cinerea Pers[J]. World Journal of Microbiology and Biotechnology, 2015, 31(12):1967-1976. doi:10.1007/s11274-015-1943-x.
[8] 徐文,黄媛媛,贾振华,黄亚丽,宋水山. 木霉防治灰霉病的研究进展[J]. 微生物学通报,2017,44(9):2184-2191. doi:10.13344/j.microbiol.china.170018.
Xu W, Huang Y Y, Jia Z H, Huang Y L, Song S S. Advances in biocontrol of Botrytis cinerea by Trichoderma spp. [J]. Microbiology China, 2017, 44(9): 2184-2191.
[9] 赵娟,刘霆,刘伟成,刘德文,张殿朋,卢彩鸽. 番茄灰霉病生防链霉菌筛选及鉴定[J]. 微生物学通报,2019,46(10):2548-2558. doi:10.13344/j.microbiol.china.180788.
Zhao J, Liu T, Liu W C, Liu D W, Zhang D P, Lu C G. Screening and identification of the biocontrol Streptomyces against tomato Botrytis cinerea[J]. Microbiology China, 2019, 46(10):2548-2558.
[10] 伏波,姚娟妮,高小宁,黄丽丽,康振生,韩青梅. 植物内生枯草芽孢杆菌Em7菌株对葡萄灰霉病菌的抑菌活性[J]. 农药学学报,2016,18(4):465-471. doi:10.16801/j.issn.1008-7303.2016.0065.
Fu B, Yao J N, Gao X N, Huang L L, Kang Z S, Han Q M. Antifungal activity of plant endophytic Bacillus subtilis strain Em7 against Botrytis cinerea[J]. Chinese Journal of Pesticide Science, 2016, 18(4): 465-471.
[11] 张新刚,王海利,张晓慷. 防治蔬菜灰霉病的生防菌SFJ1的鉴定及抑菌活性[J]. 农药,2018,57 (3):181-183. doi:10.16820/j.cnki.1006-0413.2018.03.008.
Zhang X G, Wang H L, Zhang X K. Identification of Bio-control bacteria SFJ1 against vegetable Botrytis cinerea and its antimicrobial characteristics[J]. Agrochemicals, 2018, 57(3): 181-183.
[12] 张炳欣,张平,陈晓斌.影响引入微生物根部定殖的因素[J].应用生态学报,2000,11(6):951-953. doi:10.13287/j.1001-9332.2000.0226.
Zhang B X, Zhang P, Chen X B. Factors affecting colonization of introduced microorganisms on plant roots[J]. Chinese Journal of Applied Ecology,2000,11(6):951-953.
[13] Elad Y. Reasons for the delay in development of biological control of foliar pathogen [J]. Phytoparasitica, 1990, 18(2): 99-104. doi:10.1007/BF02981226.
[14] 东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001:349-387.
Dong X Z, Cai M Y. Manual for systematic identification of common bacteria[M]. Beijing: Science Press, 2001:349-387.
[15] Krieg N R, Staley J T, Brown D R, Hedlund B P, Paster B J, Ward N L, Ludwig W, Whitman W B. Bergey′s manual® of systematic bacteriology[M]. USA:The Williams &Wilkins Co, 1986. doi:10.1007/978-0-387-68572-4.
[16] Bavykin S G, Lysov Y P, Zakhariev V, Kelly J J, Jackman J, Stahl D A, Cherni A. Use of 16S rRNA, 23S rRNA, and gyrB gene sequence analysis to determine phylogenetic relationships of Bacillus cereus group microorganisms[J]. Journal of Clinical Microbiology, 2004, 42(8):3711-3730. doi:10.1128/JCM.42.8.3711-3730. 2004.
[17] 谢永丽,Renato D′Ovidio,Stefania Masci,范晶,李云龙.几株解纤维素生防芽孢杆菌的分子鉴定及其抗逆促生特性分析[J].微生物学通报,2017,44(2):348-357. doi:10.13344/j.microbiol.china.160099.
Xie Y L, D′Ovidio R, Masci S, Fan J, Li Y L. Molecular identification of cellulose-degrading bio-control Bacillus strains and their stress-resistance and growth-promoting characteristics[J]. Microbiology China,2017,44(2):348-357.
[18] Kumar S, Stecher G, Tamura K. MEGA7: Molecular evolutionary genetics analysis Version 7.0 for Bigger Datasets.[J]. Molecular Biology and Evolution, 2016, 33(7):1870-1874. doi:10.1093/molbev/msw054.
[19] Salvatierra-Martinez R, Arancibia W, Araya M, Aguilera S, Olalde V, Bravo J, Stoll A. Colonization ability as an indicator of enhanced biocontrol capacity-An example using two Bacillus amyloliquefaciens strains and Botrytis cinereal infection of tomatoes[J]. Journal of Phytopathology, 2018, 166(9): 601-612. doi:10.1111/jph.12718.
[20] 郑喜清,郭振华,邸娜,李旭红,王靖.番茄灰霉病拮抗细菌的分离筛选及鉴定[J]. 北方园艺,2017,41(6): 122-126. doi:10.11937/bfyy.201706028.
Zheng X Q, Guo Z H, Di N, Li X H, Wang J. Isolation and screening of antagonistic bacterium against Botrytis cinerea[J]. Northern Horticulture, 2017,41 (6): 122-126.
[21] Chen X H, Koumoutsi A, Scholz R, Schneider K, Vater J, Süssmuthb R, Piel J, Borriss R. Genome analysis of Bacillus amyloliquefaciens FZB42 reveals its potential for biocontrol of plant pathogens[J]. Journal of Biotechnology, 2009, 140(1-2):27-37. doi:10.1016/j.jbiotec.2008.10.011.
[22] De Senna A, Lathrop A. Antifungal screening of bioprotective isolates against Botrytis cinerea, Fusarium pallidoroseum and Fusarium moniliforme[J]. Fermentation, 2017, 3(4):53. doi:10.3390/fermentation3040053.
[23] 夏京津,陈建武,宋怿,刘永涛,董靖,吴峪楠,艾晓辉. 解淀粉芽孢杆菌HE活性成分鉴定及抗菌特性分析[J]. 南方水产科学,2019,15(3):41-49. doi:10.12131/20190054.
Xia J J, Chen J W, Song Y, Liu Y T, Dong J, Wu Y N, Ai X H. Identification of antibacterial substances from Bacillus amyloliquefaciens HE and analysis of antibacterial characteristics[J]. South China Fisheries Science, 2019,15(3):41-49.
[24] 魏新燕,黄媛媛,黄亚丽,杜克久. 拮抗灰霉菌的海洋细菌甲基营养型芽胞杆菌的筛选、鉴定及其抑菌活性物质的研究[J]. 中国生物防治学报,2017,35(5):667-674. doi:10.16409/j.cnki.2095-039x.2017.05.013.
Wei X Y, Huang Y Y, Huang Y L, Du K J. Screening, identification of antagonistic ocean bacteria Bacillus methylotrophicus and its antimicrobial substances to Botrytis cinerea pres. [J]. Chinese Journal of Biological Control, 2017,35(5):667-674.
[25] Zhang Q X, Zhang Y, Shan H H, Tong Y H, Chen X J, Liu F Q. Isolation and identification of antifungal peptides from Bacillus amyloliquefaciens W10[J]. Environmental Science and Pollution Research, 2017, 24(32):25000-25009. doi:10.1007/s11356-017-0179-8.
